
ných liekov. Dávka sa musí predpísať v mg d-alfa- tokoferolu vo forme tokofersolanu. Hladiny vitamínu E v plazme sa musia kontrolovať kaţdý mesiac po dobu najmenej niekoľkých prvých mesiacov po liečbe, potom v pravidelných intervaloch a dávka sa má podľa toho upraviť, ak je to potrebné.
DávkovanieOdporúčaná celková denná dávka je u pediatrických pacientov trpiacich vrodenou chronickou cholestázou
alebo dedičnou chronickou cholestázou 0,34 ml/kg/deň (17 mg/kg d-alfa-tokoferolu vo forme tokofersolanu).
Dávka sa má upraviť podľa hladiny vitamínu E v plazme.
Na výpočet dávky Vedropu, ktorá sa má podať, vydeľte predpísanú dávku d-alfa-tokoferolu (v mg) číslom
50. Výsledok je objem Vedropu v ml:
Dávka Vedropu (v ml) =
dávka d-alfa-tokoferolu (v mg)
50
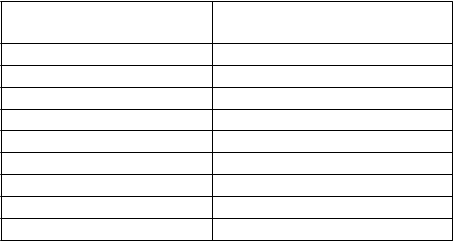
U pacientov s vrodenou chronickou alebo dedičnou chronickou cholestázou je dávkovanie 17 mg/kg/deň d- alfa-tokoferolu vo forme tokofersolanu. Nasledujúca tabuľka uvádza objemy Vedropu v závislosti na hmotnosti pacienta.
Hmotnosť (kg) Objem Vedropu (ml)3 1,0
4 1,4
5 1,7
6 2,0
7 2,4
8 2,7
9 3,1
10 3,4
15 5,1
Spôsob podaniaVedrop sa podáva perorálne s vodou alebo bez nej. Perorálna striekačka s objemom 1 ml alebo 2 ml
priloţená v balení je uspôsobená na pomoc pri meraní presnej dávky v súlade s predpísaným dávkovaním.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok. Vedrop sa nesmie pouţívať u predčasne narodených detí.
4.4 Osobitné upozornenia a opatrenia pri pouţívaníKeďţe bolo hlásené, ţe vysoké dávky vitamínu E zvyšujú sklon ku krvácaniu u pacientov s nedostatkom vitamínu K alebo tých pacientov, ktorí uţívajú perorálnu liečbu antivitamínov K, odporúča sa preto monitorovať protrombínový čas a medzinárodný normalizovaný pomer (international normalised ratio, INR). Počas alebo po ukončení liečby Vedropom môţe byť potrebná moţná úprava dávky perorálneho antikoagulantu.
Kvôli potenciálnej obličkovej toxicite glykolov polyetylénu, Vedrop sa má pacientom s obličkovou nedostatočnosťou, napr. pacientom s dehydratáciou podať opatrne a za dôkladného monitorovania funkcií obličiek.
Keďţe sú údaje od pacientov s pečeňovou nedostatočnosťou obmedzené, Vedrop sa má takýmto pacientom podať opatrne a za dôkladného monitorovania funkcií pečene.
Počas liečby Vedropom sa má zhodnotiť a monitorovať funkcia obličiek a osmolarita séra.
Vedrop obsahuje metyl-para-hydroxybenzoát sodný (E219) a propyl-para-hydroxybenzoát sodný (E217),
ktoré môţu spôsobovať alergické reakcie (môţu byť oneskorené).
Tento liek obsahuje menej neţ 1 mmol (23 mg) sodíka v jednej dávke, t.j. v podstate zanedbateľné mnoţstvo
sodíka.
Obsahuje tieţ draslík; menej ako 1 mmol (39 mg) v jednej dávke, t.j. v podstate zanedbateľné mnoţstvo
draslíka.
4.5 Liekové a iné interakcieVzhľadom na inhibíciu transportéra P-glykoproteínu môţe tokofersolan tieţ zvyšovať intestinálnu absorpciu
iných súbeţne uţitých vitamínov rozpustných v tukoch (A, D, E, K) alebo vysoko lipofilných liekov (ako sú
napr. steroidy, antibiotiká, antihistaminiká, cyklosporín, takrolimus). Preto sa musí uskutočniť
monitorovanie, a ak je to potrebné, musia sa upraviť dávky.
4.6 Gravidita a laktácia
Nie sú k dispozícii ţiadne klinické údaje o gravidných ţenách vystavených účinku tokofersolanu. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývoj, pôrod alebo postnatálny vývoj (pozri 5.3). Pri predpisovaní lieku gravidným ţenám je potrebná opatrnosť.
Nie je známe, či sa tokofersolan vylučuje v ľudskom materskom mlieku. Vylučovanie tokofersolanu v mlieku sa u zvierat neskúmalo. Rozhodnutie o tom, či pokračovať alebo ukončiť dojčenie alebo či pokračovať alebo ukončiť liečbu Vedropom sa má urobiť berúc do úvahy prospech dojčenia pre dieťa a prospech liečby tokofersolanom pre ţenu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa ţiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Neţiaduce účinky
Dolu uvedené hlásené neţiaduce účinky sú usporiadané podľa triedy orgánových systémov a frekvencie.
Frekvencie sú definované ako: veľmi časté (≥ 1/10), časté (≥ 1/100 aţ < 1/10), menej časté (≥ 1/1000 aţ
< 1/100), zriedkavé (≥ 1/10 000 aţ < 1/1000), veľmi zriedkavé (< 1/10 000).
V rámci jednotlivých skupín frekvencií sú neţiaduce účinky usporiadané v poradí klesajúcej závaţnosti.
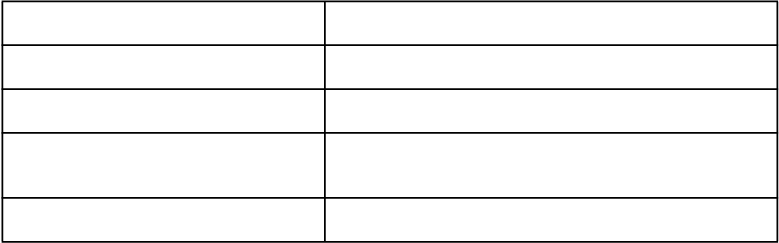
Trieda orgánového systému Neţiaduce liekové reakcie
Poruchy gastrointestinálneho traktu Časté: hnačka
Poruchy koţe a podkoţného tkaniva Menej časté: alopécia, svrbenie, vyráţky
Celkové poruchy a reakcie v mieste
podania
Menej časté: asténia, bolesť hlavy
Laboratórne a funkčné vyšetrenia
Menej časté: anomálne hladiny sodíka v sére, anomálne
hladiny draslíka v sére, zvýšené hladiny transamináz
4.9 PredávkovanieVysoké dávky vitamínu E môţu spôsobovať hnačku, bolesti brucha a iné gastrointestinálne poruchy.
Nebol hlásený ţiadny prípad predávkovania tokofersolanom.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné vitamínové prípravky, samotné: ATC kód: A11HA08
Vitamín E je hlavný v tukoch rozpustný antioxidant v tele. Účinkuje ako molekula narúšajúca reťazec voľných radikálov a zastavujúc peroxidáciu polynenasýtených mastných kyselín. Podieľa sa na udrţiavaní stability a integrity bunkových membrán.
Tento liek bol registrovaný za takzvaných „mimoriadnych okolností“.
To znamená, ţe v dôsledku zriedkavosti ochorenia nebolo moţné získať kompletné informácie o prínosoch
a rizikách tohto lieku.
Európska lieková agentúra (EMEA) bude kaţdý rok posudzovať nové informácie o lieku, ktoré budú dostupné a tento súhrn charakteristických vlastností bude podľa potreby aktualizovaný.
5.2 Farmakokinetické vlastnosti
Liečivo d-alfa-tokoferol-polyetylén glykol 1000 sukcinát (tokofersolan) je prodrug (prekurzor); aktívny metabolit je d-alfa-tokoferol. V nízkych koncentráciách vytvára tokofersolan micely, ktoré zlepšujú absorpciu nepolárnych tukov, ako sú vitamíny rozpustné v tukoch. Jeho kritická micelárna koncentrácia je nízka (0,04 aţ 0,06 mmol/l).
Hydrolýza tokofersolanu sa deje v lúmeni čreva. Po prieniku do buniek sa zloţka alfa-tokoferolu objavuje
v chylomikrónoch v lymfe rovnakým spôsobom, ako sa vitamín E absorbuje z potravy. Prienik do buniek si
nevyţaduje receptory, väzbové proteíny alebo metabolické procesy a neuskutočňuje sa pinocytózou. Absorpcia tokofersolanu označeného deutériom ukázala v lipoproteínoch normálnu charakteristiku: alfa- tokoferol dosahuje maximum najprv v chylomikrónoch, potom v lipoproteínoch s veľmi nízkou hustotou (very low density lipoproteins, VLDL) a nakoniec v lipoproteínoch s nízkou hustotou (low density lipoproteins, LDL) a lioproteínoch s vysokou hustotou (high density lipoproteins, HDL). Eliminačné časti kriviek sú paralelné s príslušnými časťami kriviek u jedincov v kontrolnej skupine.'
Vitamín E je rozmiestnený všade na bunkových membránach, v mitochondriách a mikrozómoch (červené krvinky, mozog, svaly, pečeň, krvné doštičky) a tukové tkanivá sú jeho najhlavnejším rezervoárom.
Štúdia s 12 zdravými dobrovoľníkmi porovnala tokofersolan s referenčným, s vodou miešateľným vitamínom E po podaní jednej nárazovej perorálnej dávky 1200 IU. Relatívna biodostupnosť tokofersolanu mala tendenciu byť vyššia (Frel 1,01 ± 1,74) s AUC0-t 0,383 ± 0,203µM.hod/mg, Cmax 0,013 ± 0,006, tmax 6,0 hod (6,0 – 24,0) a t1/2 29,7 hod (16,0 – 59,5).
V podobnej štúdii ukázal tokofersolan vyššiu biodostupnosť ako referenčný, s vodou miešateľný vitamín E u pediatrických pacientov s chronickou cholestázou (n=6). Absorpcia bola významne vyššia u oboch, zvýšenia maximálnej koncentrácie v plazme (p=0,008) a AUC (p=0,0026).
Vitamín E sa eliminuje hlavne ţlčou (75%) a stolicou, buď ako voľný tokoferol alebo ako jeho oxidované
formy. Moč reprezentuje malú eliminačnú cestu vitamínu E (vo forme glukuronidového konjugátu).
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje v literatúre na základe obvyklých štúdií toxicity po opakovanom podávaní, genotoxicity a
reprodukčnej toxicity neodhalili ţiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Sorbát draselný
Metyl-para-hydroxybenzoát sodný (E219) Propyl-para-hydroxybenzoát sodný (E217)
Glycerol
Dodekahydrát hydrogénfosforečnanu sodného Koncentrovaná kyselina chlorovodíková Čistená voda
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas pouţiteľnosti
2 roky.
Po prvom otvorení fľaše: 1 mesiac.
6.4 Špeciálne upozornenia na uchovávanieFlašu udrţiavajte dôkladne uzatvorenú.
6.5 Druh obalu a obsah baleniaFľaša z hnedého skla typu III s uzáverom so závitom z HDPE a viečkom z LDPE. Perorálna striekačka
z LDPE a piest z polystyrolu. Kaţdá fľaša obsahuje 10 ml, 20 ml alebo 60 ml perorálneho roztoku.
Škatule s obsahom:
§ jedna fľaša s objemom 10 ml a jedna perorálna striekačka s objemom 1 ml
§ jedna fľaša s objemom 20 ml a jedna perorálna striekačka s objemom 1 ml
§ jedna fľaša s objemom 60 ml a jedna perorálna striekačka s objemom 2 ml
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomDávky na podanie sa musia z fľaše odobrať pomocou perorálnych striekačiek priloţených v balení. Perorálna striekačka s objemom 1 ml je ciachovaná od 0,05 do 1 ml po 0,05 ml a perorálna striekačka s objemom 2 ml od 0,1 do 2 ml po 0,1 ml.
Keďţe Vedrop obsahuje 50 mg/ml, jedna jednotka perorálnej striekačky s objemom 1 ml zodpovedá 2,5 mg d-alfa-tokoferolu vo forme tokofersolanu a jedna jednotka perorálnej striekačky s objemom 2 ml zodpovedá
5 mg d-alfa-tokoferolu vo forme tokofersolanu.
7. DRŢITEĽ ROZHODNUTIA O REGISTRÁCIIOrphan Europe S.A.R.L.
Immeuble “Le Wilson”
70 avenue du Général de Gaulle
92800 Puteaux
Francúzsko
8. REGISTRAČNÉ ČÍSLO9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŢENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry (EMEA)
http://www.emea.europa.eu.