
ek (pozri časť 6.6).
Pred aplikáciou VeraSeal je potrebné vysušiť povrch rany štandardnými technikami (napr. striedavou aplikáciou obkladov, tampónov, použitím odsávacích zariadení).
Aby sa predišlo potenciálne život ohrozujúcej embólii vzduchom alebo plynom, odporúča sa
pri aplikácii VeraSeal nástrekom použiť CO2 pod tlakom.
Informácie o aplikácii nástrekom pozri časti 4.4 a 6.6, kde sú podrobné odporučenia na požadovaný
tlak a vzdialenosť od tkaniva pri chirurgickom výkone.
4.3 Kontraindikácie
VeraSeal sa nesmie aplikovať intravaskulárne.
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. VeraSeal sa nesmie použiť na liečbu vážneho alebo prudkého arteriálneho krvácania. Aplikácia VeraSeal nástrekom sa nesmie použiť pri endoskopických výkonoch. Informácie
o laparoskopii pozri časť 4.4.
4.4 Osobitné upozornenia a opatrenia pri používaní
Opatrenia pri používaní
Len na epiléziové použitie. Neaplikujte intravaskulárne.
V prípade neúmyselnej intravaskulárnej aplikácie prípravku sa môžu objaviť život ohrozujúce
tromboembolické komplikácie (pozri časť 4.8).
Pri použití pomôcok na aplikáciu nástrekom s regulátorom tlaku pri podaní fibrínových lepiacich prípravkov sa vyskytla život ohrozujúca embólia vzduchom alebo plynom. Zdá sa, že táto udalosť súvisí s použitím pomôcky na aplikáciu nástrekom pri vyššom tlaku, ako sa odporúča a/alebo v tesnej blízkosti povrchu tkaniva, ako sa odporúča.
Zdá sa, že riziko je vyššie, keď sa fibrínové lepidlá aplikujú nástrekom pri použití vzduchu, než pri použití CO2 a preto ho nie je možné vylúčiť ani pri použití VeraSeal. Aby sa toto riziko minimalizovalo, pomôcka na aplikáciu nástrekom sa má používať podľa inštrukcií v časti 6.6.
Aplikácia VeraSeal nástrekom sa má použiť len vtedy, ak je možné presne posúdiť aplikačnú vzdialenosť, najmä pri laparoskopii. Vzdialenosť od tkaniva a tlak pri aplikácii nástrekom majú byť v rozmedzí, ktoré odporúča držiteľ rozhodnutia o registrácii VeraSeal (informácie o tlaku
a vzdialenosti pozri v časti 6.6).
Kvôli možnosti výskytu vzduchovej alebo plynovej embólie sa pri aplikácii VeraSeal nástrekom majú
sledovať krvný tlak, pulz, saturácia kyslíkom a hladiny CO2 na konci výdychu.
Pri použití prídavných špičiek je potrebné dodržiavať pokyny na použitie špičiek.
Pred podaním VeraSeal je potrebné dbať na to, aby časti tela mimo požadovanej oblasti aplikácie boli
dostatočne chránené (zakryté), aby sa zabránilo adhézii tkaniva na nežiaducich miestach.
VeraSeal sa má aplikovať ako tenká vrstva. Nadmerná hrúbka zrazeniny môže negatívne interferovať s účinnosťou lieku a procesom hojenia rany.
Nie sú k dispozícii adekvátne údaje, ktoré by podporili použitie tohto lieku na lepenie tkanív, v neurochirurgii, pri aplikácii pomocou flexibilného endoskopu na liečbu krvácania alebo pri gastrointestinálnych anastomózach.
Reakcie precitlivenosti
Tak ako aj pri iných proteínových liekoch sú možné reakcie precitlivenosti alergického typu. Príznaky
reakcií precitlivenosti zahŕňajú žihľavku, generalizovanú urtikáriu, tlak na hrudníku, sipot, hypotenziu a anafylaxiu. Ak sa objavia tieto príznaky, podávanie sa musí okamžite prerušiť. V prípade šoku sa
majú vykonať štandardné lekárske postupy pre liečbu šoku.
Prenosné infekčné látky
Štandardné opatrenia na prevenciu infekcií spôsobených používaním liekov vyrobených z ľudskej krvi
alebo plazmy zahŕňajú výber darcov, skríning jednotlivých odberov a plazmatických poolov na špecifické markery infekcie a zaradenie efektívnych výrobných postupov na inaktiváciu/odstránenie
vírusov. Napriek tomu pri podávaní liekov vyrobených z ľudskej krvi alebo plazmy, nie je možné
úplne vylúčiť možnosť prenosu infekčných látok. Platí to aj pre neznáme alebo novoobjavené vírusy
a iné patogény.
Prijaté opatrenia sú považované za účinné proti obaleným vírusom, ako je vírus ľudskej imunodeficiencie (HIV), vírus hepatitídy typu B a vírus hepatitídy typu C, a proti neobalenému vírusu hepatitídy typu A. Prijaté opatrenia môžu mať obmedzenú účinnosť proti neobaleným vírusom ako je parvovírus B19. Infekcia parvovírusom môže byť závažná pre tehotné ženy (infekcia plodu) a pre osoby s imunodeficienciou alebo zvýšenou erytropoézou (napr. hemolytická anémia).
Sledovateľnosť
Dôrazne sa odporúča, aby pri každom podaní VeraSeal pacientovi boli zaznamenané meno a číslo
šarže lieku, aby sa zachovala spojitosť medzi pacientom a šaržou lieku.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne formálne interakčné štúdie. Podobne ako u porovnateľných prípravkoch alebo roztokoch trombínu, tento liek sa môže denaturovať po expozícii roztokmi s obsahom alkoholu, jódu alebo ťažkých kovov (napr. antiseptické roztoky). Takéto látky majú byť v maximálnej možnej miere pred podávaním lieku odstránené.
4.6 Fertilita, gravidita a laktácia
Gravidita a dojčenie
Bezpečnosť použitia fibrínových lepidiel/hemostatických prípravkov počas gravidity alebo počas
dojčenia u človeka nebola v kontrolovaných klinických štúdiách stanovená. Experimentálne štúdie na
zvieratách nepostačujú na hodnotenie bezpečnosti, čo sa týka reprodukcie, vývoja embrya alebo plodu,
priebehu gravidity a perinatálneho a postnatálneho vývoja. Preto sa má liek podávať gravidným
a dojčiacim ženám len, ak je to nevyhnutne potrebné.
Fertilita
Štúdie fertility sa nevykonali.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Netýka sa.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
U pacientov liečených fibrínovými lepidlami/hemostatickými prípravkami sa môžu v zriedkavých
prípadoch objaviť precitlivenosť alebo alergické reakcie (ktoré môžu zahŕňať angioedém, pálenie
a štípanie v mieste aplikácie, bronchospazmus, zimnicu, návaly tepla, generalizovanú urtikáriu, bolesť hlavy, žihľavku, hypotenziu, letargiu, nauzeu, nepokoj, tachykardiu, tlak na hrudníku, mravenčenie,
vracanie, sipot). V ojedinelých prípadoch tieto reakcie progredovali až do ťažkej anafylaxie. Takéto
reakcie je možné pozorovať predovšetkým pri opakovanej aplikácii prípravku alebo pri podávaní pacientom so známou precitlivenosťou na zložky lieku.
V zriedkavých prípadoch sa môžu objaviť protilátky proti zložkám fibrínového tkanivového lepidla/hemostatických liekov.
Neúmyselná intravaskulárna injekčná aplikácia môže viesť k tromboembolickej príhode
a diseminovanej intravaskulárnej koagulácii (disseminated intravascular coagulation, DIC), a existuje tiež riziko vzniku anafylaktickej reakcie (pozri časť 4.4).
Pri použití pomôcok na aplikáciu nástrekom s regulátorom tlaku pri podaní fibrínových lepidiel/hemostatických prípravkov sa vyskytla život ohrozujúca embólia vzduchom alebo plynom. Zdá sa, že táto udalosť súvisí s použitím pomôcky na aplikáciu nástrekom pri vyššom tlaku ako sa odporúča a/alebo v tesnej blízkosti povrchu tkaniva.
Informácie o bezpečnosti s ohľadom na prenosné agensy, pozri časť 4.4. Tabuľkovýzoznamnežiaducichreakcií
Tabuľka uvedená nižšie je podľa klasifikácie organových systémov MedDRA (trieda orgánových
systémov a úroveň preferovaného termínu).
Frekvencie výskytu boli hodnotené podľa nasledujúcej konvencie:
- veľmi časté (≥ 1/10)
- časté (≥ 1/100 až < 1/10)
- menej časté (≥ 1/1 000 až < 1/100)
- zriedkavé (≥ 1/10 000 až <1/1 000)
- veľmi zriedkavé (<1/10 000)
- neznáme (z dostupných údajov).
V každej skupine frekvencií sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Frekvencia výskytu nežiaducich reakcií v klinických štúdiách s VeraSeal:
Trieda orgánových systémov
MedDRA (SOC) Nežiaduce reakcie Frekvencia
Infekcie a nákazy Abdominálny absces, celulitída (flegmóna), pečeňový absces, peritonitída, pooperačná infekcia rany, infekcia rany, infekcia miesta incízie, infekcia po zákroku
Menej časté
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
Plazmocytárny myelóm Menej časté
Poruchy krvi a lymfatického systému
Anémia, hemoragická anémia, leukocytóza, leukopénia
Menej časté
Poruchy imunitného systému Hypersenzitivita* Neznáme
Poruchy metabolizmu a výživy Hyperglykémia, hyperkaliémia, hypokalcémia, hypoglykémia, hypokaliémia, hypomagneziémia, hyponatrémia, hypoproteinémia
Menej časté
Psychické poruchy Úzkosť, nespavosť Menej časté Poruchy nervového systému Bolesť hlavy, somnolencia Menej časté Poruchy oka Podráždenie spojoviek Menej časté

Poruchy srdca a srdcovej
činnosti
Fibrilácia predsiení, komorová tachykardia
Menej časté
Poruchy ciev Hlboká venózna trombóza, hypertenzia hypotenzia
Menej časté
Poruchy dýchacej sústavy, hrudníka a mediastína
Pľúcna embólia, dyspnoe, hypoxia, pleurálny výpotok, pleuritída, pľúcny edém, chrapot, sipot
Menej časté
Poruchy gastrointestinálneho
Nauzea Časté
traktu
Zápcha, nafukovanie, ileus, retroperitoneálny hematóm, vracanie
Menej časté
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Pruritus Časté Ekchymóza, erytém Menej časté Bolesť chrbta, bolesť končatín Menej časté
Poruchy obličiek a močových ciest
Celkové poruchy a reakcie v mieste podania
Spazmus močového mechúra, ťažkosti
s močením, retencia moču
Zimnica, hypertermia, periférny edém, bolesť, pyrexia, hematóm v mieste vpichu injekcie
Menej časté
Menej časté
T
rieda orgánových systémov
MedDRA (SOC)
N
ežiaduce reakcie Frekvencia
Laboratórne a funkčné
vyšetrenia
Pozitivita testu na parvovírus B19, predĺženie aktivovaného parciálneho tromboplastínového času, zvýšenie alanínaminotransferázy, zvýšenie aspartátaminotransferázy, zvýšenie bilirubinu v krvi, zvýšenie glukózy
v krvi, zvýšenie medzinárodného normalizovaného pomeru (
INR,international normalised ratio),
predĺženie protrombínového času,
zvýšenie transamináz, zníženie objemu
vylúčeného moču
Prítomnosť špecifických protilátok proti
lieku*
Menej časté
Neznáme
Úrazy, otravy a komplikácie
Bolesť pri výkone Časté
liečebného postupu
Dehiscencia abdominálnej rany, únik
žlče po výkone, pomliaždenie, erytém
v mieste incízie, bolesť v mieste incízie, krvácanie po výkone, hypotenzia
pri výkone, komplikácie spojené
s cievnym štepom, trombóza cievneho štepu, sekrécia z rany
Menej časté
* Všetky tieto reakcie sú reakcie celej skupiny liekov. Žiadna nebola hlásená v klinickej štúdii,
preto nie je možné stanoviť frekvenciu.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV prípade predávkovania sa musia u pacientov pozorne sledovať znaky alebo príznaky nežiaducich reakcií a musí sa začať s vhodnou symptomatickou liečbou a podpornými opatreniami.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká, lokálne hemostatiká, ATC kód:B02BC.
Mechanizmus účinkuSystém adhézie fibrínu spúšťa poslednú fázu fyziologického zrážania krvi. Premena fibrinogénu na
fibrín prebieha štiepením fibrinogénu na monoméry fibrínu a fibrinopeptidy. Monoméry fibrínu sa zhlukujú a tvoria fibrínovú zrazeninu. Faktor XIIIa, ktorý je aktivovaný z faktora XIII trombínom,
vytvára fibrínové siete. Ióny vápnika sú potrebné pre oba procesy, konverziu fibrinogénu
aj zosieťovanie fibrínu.
S postupujúcim hojením rany sa vplyvom plazmínu zvyšuje fibrinolytická aktivita a spúšťa sa rozklad fibrínu na jeho degradačné produkty.
K
l
i
n
i
cká účinnosť abezpečnosť
Randomizované, jednoducho zaslepené klinické štúdie s VeraSeal sa uskutočnili u pacientov, ktorí
podstúpili cievne chirurgické výkony a operácie na parenchýmovom a mäkkom tkanive, kde sa demonštrovala hemostáza a podpora hojenia sutúr v cievnej chirurgii.
Do štúdie cievnych chirurgických výkonov bolo zahrnutých 225 subjektov, ktorí podstúpili cievny chirurgický výkon s použitím štepu z polytetrafluoroetylénového materiálu na artériovú anastomózu end-to-side alebo na arteriálnu anastomózu pre cievny prístup na hornej končatine. Priemerný vek štúdijnej populácie a jeho štandardná odchýlka boli 63,2 (9,5) rokov. Najčastejší typ chirurgického výkonu bol bypass s použitím femoro-popliteálneho štepu, cievny prístup na hornej končatine
pre hemodialýzu a bypass s použitím ileo-femorálneho cievneho štepu. U VeroSeal sa preukázala superiorita nad kontrolnou skupinou (manuálna kompresia) na dosiahnutie hemostázy za 4 minúty.
Miera hemostázy v cieľovom mieste krvácania za 4 minúty bola 76,1 % v skupine s VeraSeal a 22,8 %
v kontrolnej skupine.
Do štúdie chirurgických výkonov na parenchymatóznom tkanive bolo zaradených 325 subjektov, ktorí podstúpili resekciu pečene. Priemerný vek štúdijnej populácie a jeho štandardná odchýlka boli 57,9 (14,5) rokov. U VeroSeal sa preukázala superiorita nad kontrolnou skupinou (oxidovaná regenerovaná celulóza) v dosiahnutí hemostázy za 4 minúty. Miera hemostázy v cieľovom mieste krvácania
za 4 minúty bola 92,8 % v skupine s VeraSeal a 80,5 % v kontrolnej skupine.
Do štúdie chirurgických výkonov na mäkkom tkanive bolo zaradených 327 subjektov,
ktorí podstúpili chirurgický výkon v panve, v retroperitoneu a abdominoplastiku a mastopexiu. Priemerný vek študijnej populácie a jeho štandardná odchýlka boli 47,2 (18,4) rokov. Najčastejší typ chirurgckého výkonu boli jednoduché alebo radikálne hysterektómie, abdominoplastiky a radikálne cystektómie. U VeroSeal sa nepreukázala inferiorita oproti kontrolnej skupine (oxidovaná regenerovaná celulóza) v dosiahnutí hemostázy za 4 minúty. Miera hemostázy v cieľovom mieste krvácania za 4 minúty bola 82,8 % v skupine s VeraSeal a 77,8 % v kontrolnej skupine.
Pediatrická populácia
VeraSeal sa v uvedených klinických štúdiách použil pri liečbe jedenástich detských pacientov vo veku
16 rokov alebo mladších.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s VeraSeal v jednej alebo vo viacerých podskupinách pediatrickej populácie pri liečbe krvácania v dôsledku chirurgického zákroku v súlade so schváleným výskumným pediatrickým plánom (PIP) pre schválenú indikáciu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
VeraSeal je určený len na epiléziové použitie. Intravaskulárne podávanie je kontraindikované. Preto neboli u ľudí vykonané žiadne intravaskulárne farmakokinetické štúdie.
Fibrínové tkanivové lepidlá/hemostatiká sú metabolizované rovnakým spôsobom ako endogénny fibrín fibrinolýzou a fagocytózou.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti a akútnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
I
njekčná striekačka s ľudskýmfibrinogénom:
'
Dihydrát citronanu sodného
Chlorid sodný
Arginín
IzoleucínKyselina glutámová, monosodná soľ
Voda na injekcie
Injekčná striekačka s ľudskýmtrombínom:
Chlorid vápenatý
Ľudský albumín Chlorid sodný Glycín
Voda na injekcie
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky.
Po rozmrazení sa pred použitím môže uchovávať najviac 48 hodín pri teplote 2 ºC – 8 ºC alebo
24 hodín pri izbovej teplote (20 ºC – 25 ºC), ak zostane neotvorený v originálnom balení.
Čas použiteľnosti: Po otvorení vonkajšieho váčika sa má VeraSeal použiť okamžite.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v mrazničke (pri teplote -18º C alebo nižšej). Uskladnenie v chlade (pri teplote -18º C alebo nižšej) nesmie byť až do použitia prerušené. Uchovávajte váčik obsahujúci sterilné pretlačovacie balenie vo vonkajšej škatuli na ochranu pred svetlom.
Po rozmrazení, znovu nezmrazujte. Podmienky na uchovávanie po rozmrazení a prvom otvorení lieku,
pozri časť 6.3.
6.5 Druh obalu a obsah balenia
VeraSeal sa dodáva ako jednorazový set obsahujúci dve naplnené injekčné striekačky (sklo typu I)
s gumovými zátkami, každá so sterilným zmrazeným roztokom, namontované na držiaku striekačiek. S liekom sa dodáva jedna aplikačná kanyla.
VeraSeal sa môže podávať pomocou pomôcky na aplikáciu nástrekom, ktorá sa dodáva oddelene.
VeraSeal je dostupný v nasledujúcich veľkostiach balenia:
- VeraSeal 2 ml (obsahujúci 1 ml ľudského fibrinogénu a 1 ml ľudského trombínu)
- VeraSeal 4 ml (obsahujúci 2 ml ľudského fibrinogénu a 2 ml ľudského trombínu)
- VeraSeal 6 ml (obsahujúci 3 ml ľudského fibrinogénu a 3 ml ľudského trombínu)
- VeraSeal 10 ml (obsahujúci 5 ml ľudského fibrinogénu a 5 ml ľudského trombínu)
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pokyny na použitie sú popísané tiež v časti písomnej informácie určenej pre zdravotníckych
pracovníkov.
• Rozmrazovanie
Rozmrazovanie pri izbovej teplote
VeraSeal sa má rozmrazovať pri izbovej teplote (20 ºC – 25 ºC) približne osemdesiat (80) minút
v prípade 2 ml a 4 ml prípravku a stodvadsať (120) minút v prípade 6 ml a 10 ml prípravku. Kroky potrebné pre rozmrazenie sú:
- Otvorte kartónový obal a vyberte vnútorný obsah.
- Umiestnite toto balenie na povrch pri izbovej teplote.
Po rozmrazení nie je nevyhnutné zohriať liek pred jeho použitím.
Vodný kúpeľ
V prípade, že čas rozmrazovania je potrebné skrátiť, sa môže použiť termostatický vodný kúpeľ,
ale stále pri teplote neprevyšujúcej 37 ºC. Pri teplote 37 ºC je potrebný čas približne dvadsať (20) minút v prípade 2 ml a 4 ml prípravku a tridsať (30) minút v prípade 6 ml a 10 ml prípravku. Kroky potrebné pre rozmrazenie sú:
- Otvorte kartónový obal a vyberte vnútorný obsah.
- Umiestnite toto balenie do vodného kúpeľa.
- Zabezpečte, aby toto balenie ostalo ponorené počas rozmrazovania.
Teplota nesmie prevýšiť 37 ºC.
• Príprava
Po rozmrazení musia byť roztoky číre až ľahko opalescentné a bezfarebné až slabožlté.
Roztoky, ktoré sú zakalené alebo obsahujú častice, nesmú byť použité.
Prenos zahŕňa:
- Po rozmrazení vyberte balenie z povrchu pri izbovej teplote, z chladničky pri
teplote 2 °C – 8 ºC alebo z vodného kúpeľa (a vysušte vonkajší váčik).
- Otvorte vonkajší váčik a vyberte sterilné vnútorné pretlačovacie balenie.
- Otvorte vnútorné pretlačovacie balenie a sprístupnite držiak injekčných striekačiek
VeraSeal druhej osobe na prenos do sterilného poľa. Vonkajšia časť pretlačovacieho balenia nesmie prísť do kontaktu so sterilným poľom.
Pripojenie zahŕňa:
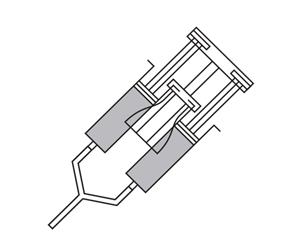
- Držte držiak injekčných striekačiek VeraSeal naklonený mierne nahor.
- Odskrutkujte a odstráňte viečka injekčných striekačiek fibrinogénu a trombínu.
- Na odstránenie vzduchových bublín jemne poklepte po strane injekčných striekačiek raz alebo dvakrát, kým držíte držiak injekčných striekačiek vo zvislej polohe a vytlačte
vzduch.
- Na pripojenie konca aplikátora, priskrutkujte obe injekčné striekačky za sebou, otočením o štvrtinu (90 stupňov) pre každú.
 • Aplikácia kvapkaním
• Aplikácia kvapkaním
VeraSeal sa musí aplikovať s dodaným držiakom injekčných striekačiek.
VeraSeal sa musí aplikovať kanylou poskytovanou s produktom alebo ekvivalentnou kanylou, označenou znakom CE, určenou na také použitie (vrátane pomôcok na použitie pre otvorenú alebo laparoskopickú chirurgiu). Pri použití poskytnutej kanyly je potrebné dodržiavať inštrukcie na pripojenie uvedené vyššie. V prípade použitia iných špičiek aplikátora je potrebné dodržiavať inštrukcie na použitie daných špičiek.
Na aplikáciu kvapkaním je potrebné držať špičku aplikátora čo najbližšie k povrchu tkaniva, ale bez dotyku tkaniva počas aplikácie. Jednotlivé kvapky sa majú aplikovať na liečenú plochu.
Na zabránenie nekontrolovanému zrážaniu je potrebné oddeliť kvapky od seba navzájom a od
špičky aplikátora.
•
Aplikácia nástrekomVeraSeal sa musí aplikovať s dodaným držiakom injekčných striekačiek. VeraSeal sa má aplikovať nástrekom len v prípade, že je možné presne posúdiť vzdialenosť pri aplikácii (pozri tiež časť 4.4).
VeraSeal sa musí aplikovať pomôckou na aplikáciu nástrekom, ktorá sa dodáva oddelene alebo ekvivalentnou pomôckou na aplikáciu nástrekom označenou znakom CE, určenou na také použitie (vrátane pomôcok na použitie pre otvorenú a laparoskopickú chirurgiu). Vždy je potrebné riadiť sa podrobnými inštrukciami poskytnutými v balení.
Aby sa predišlo potenciálne život ohrozujúcej embólii vzduchom alebo plynom, odporúča sa
na aplikáciu VeraSeal nástrekom použiť CO2 pod tlakom (pozri tabuľku nižšie).
Ku koncu filtračnej hadičky s luer-zátkou aplikačnej pomôcky pripojte krátku plynovú hadicu.
Potom pripojte luer zátku plynovej hadice na regulátor tlaku, ktorý je schopný poskytnúť
15 - 25 psi (1,0 - 1,7 barov) tlaku plynu. Regulátor tlaku sa má používať v súlade s pokynmi výrobcu.
Pri aplikácii VeraSeal pomôckou na aplikáciu nástrekom je nutné zaistiť, aby tlak a vzdialenosť od tkaniva boli v rozmedzí odporúčanom držiteľom rozhodnutia o registrácii VeraSeal tak, ako sa uvádza v nasledujúcej tabuľke:
C
hirurgický výkon
Otvorený
Súprava na aplikáciu nástrekom, ktorá sa má použiť Dodaná súprava na
aplikáciu
Použitie regulátora tlaku
Odporúčaná vzdialenosť od cieľového tkaniva
Odporúčaný tlak pri striekaní
chirurgický výkon
nástrekom alebo ekvivalentná súprava
Zlučiteľné 10 cm

(3,9 palca)
15 – 25 psi
(1,0 – 1,7 barov)
Liek sa má potom nastriekať na povrch tkaniva v krátkych strekoch (0,1 – 0,2 ml) tak, aby sa
vytvorila tenká, rovnomerná vrstva.
Kvôli možnosti výskytu vzduchovej alebo plynovej embólie sa pri aplikácii VeraSeal nástrekom
majú sledovať krvný tlak, pulz, saturácia kyslíkom a hladiny CO2 na konci výdychu.
• LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIInstituto Grifols, S.A.
Can Guasc, 2 - Parets del Vallès
E-08150 Barcelona - Španielsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/17/1239/001-004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu