
ia,
úzkosť, nočné mory, paranoja, závrat, zmätenosť, tras, halucinácie, depresia a samovražedné myšlienky alebo správanie. Tieto nežiaduce rekcie sa môžu objaviť po podaní prvej dávky. Ak sa tieto
reakcie vyskytnú u pacientov dostávajúcich delafloxacín, podávanie delafloxacínu sa má ihneď ukončiť a majú sa zaviesť primerané opatrenia. Delafloxacín sa má používať v prípade, ak prínosy
liečby prevažujú nad rizikami u pacientov so známymi poruchami CNS alebo s podozrením na tieto poruchy (napr. závažná cerebrálna arterioskleróza, epilepsia) alebo v prítomnosti iných rizikových faktorov, ktoré môžu predpovedať vznik záchvatov alebo znižovať prach záchvatov.
Zhoršenie myasthenie gravis
Fluorochinolóny majú neuromuskulárny blokujúci účinok a môžu zhoršiť svalovú slabosť u ľudí
s ochorením myasthenia gravis. Závažné nežiaduce reakcie po uvedení lieku na trh vrátane úmrtí a požiadaviek na podporu ventilácie sa spájali s použitím fluorochinolónov u ľudí s ochorením
myasthenia gravis. Použitie delafloxacinu sa neodporúča u pacientov so známou anamnézou ochorenia
myasthenia gravis.
Ochorenie súvisiace s Clostridioides difficile
Ochorenie súvisiace s Clostridioides difficile sa zaznamenalo u používateľov takmer všetkých
systémových antibakteriálnych liečiv so závažnosťou v rozsahu od miernej hnačky po kolitídu s fatálnymi následkami. Ochorenie súvisiace s Clostridioides difficile sa musí zvážiť u všetkých pacientov s hnačkou. V prípade podozrenia na ochorenie súvisiace s Clostridioides difficile alebo potvrdenia tohto ochorenia sa má liečba delafloxacínom ukončiť a má sa zvážiť použitie náležitých podporných opatrení spolu so špecifickou antibakteriálnou liečbou C. difficile.
Lieky inhibujúce peristaltiku sú kontraindikované v prípade podozrenia na výskyt ochorenia súvisiaceho s Clostridioides difficile.
Reakcie zprecitlivenosti
Pacienti so známou precitlivenosťou na delafloxacín alebo iné fluorochinolóny nesmú používať
Quofenix (pozri časť 4.3). Závažné a príležitostne smrteľné reakcie z precitlivenosti (anafylaktické) sa zaznamenali u pacientov užívajúcich fluorochinolónové antibakteriálne liečivá. Pred začiatkom liečby
Quofenixom sa má vykonať dôkladné vyšetrenie týkajúce sa výskytu predchádzajúcich reakcií z precitlivenosti na iné chinolóny alebo fluorochinolónové antibakteriálne lieky. V prípade výskytu
anafylaktickej reakcie na Quofenix sa má používanie lieku ihneď ukončiť a má sa začať náležitá liečba.
Pacienti s poruchoufunkcieobličiek
Úprava dávkovania je potrebná u pacientov so závažnou poruchou funkcie obličiek (pozri časť 4.2).
Bezpečnosť a účinnosť pokynov na úpravu dávkovania u pacientov so závažnou poruchou funkcie obličiek nebola klinicky hodnotená a vychádza z údajov farmakokinetických modelov. Delafloxacín sa má používať len u tých pacientov, kde očakávaný klinický prínos prevažuje nad potenciálnym
rizikom. U týchto pacientov sa má starostlivo sledovať klinická odpoveď na liečbu a funkcia obličiek. Hromadenie intravenóznej pomocnej látky, sodnej soli sulfobutylbetadexu, sa vyskytuje u pacientov
so stredne ťažkou až ťažkou poruchou funkcie obličiek; preto sa majú u týchto pacientov starostlivo
sledovať hladiny kreatinínu v sére, a ak dôjde k nárastu, má sa zvážiť prechod na Quofenix 450 mg tablety podávané každých 12 hodín.
Quofenix sa neodporúča u pacientov s ochorením obličiek v terminálnom štádiu (ESRD).
Obmedzenie klinickýchúdajov
V dvoch hlavných skúšaniach pri ABSSSI sa liečené typy infekcií týkali len celulitídy/eryzipelu,
abscesov a infekcií rán. Iné typy kožných infekcií sa neskúmali. Pacienti s toxickým šokom, neutropéniou (počet neutrofilov < 500 buniek/mm3) alebo závažne oslabeným imunitným systémom neboli zaradení do štúdií. U pacientov vo veku > 75 rokov sú obmedzené skúsenosti.
Dlhodobé a potenciálne ireverzibilné závažné nežiaducereakciespôsobujúcepostihnutie
Veľmi zriedkavé prípady dlhodobých (trvajúcich mesiace alebo roky) a potenciálne ireverzibilých
závažných nežiaducich reakcií spôsobujúcich postihnutie zasahujúcich rozličné, niekedy početné, orgánové systémy (muskuloskeletálne, nervové, psychické a zmyslové) sa zaznamenali u pacientov
užívajúcich chinolóny a fluorochinolóny bez ohľadu na vek a už existujúce rizikové faktory. Podávanie delafloxacínu sa má ihneď ukončiť pri prvých prejavoch alebo príznakoch akejkoľvek
závažnej nežiaducej reakcie a pacientom je potrebné odporučiť, aby sa poradili so svojím predpisujúcim lekárom.
Superinfekcia
Mikroorganizmy rezistentné voči fluorochinolónom môžu pri používaní delafloxacínu spôsobiť
superinfekciu. Ak sa superinfekcia objaví počas liečby, majú sa prijať primerané opatrenia.
Dysglykémia
Tak ako pri všetkých chinolónoch sa zaznamenali poruchy glykémie vrátane hypoglykémie a
hyperglykémie (pozri časť 4.8) zvyčajne u diabetických pacientov užívajúcich súbežnú liečbu perorálnymi antidiabetikami (napr. glibenklamid) alebo inzulínom. Zaznamenali sa prípady
hypoglykemickej kómy. U diabetických pacientov sa odporúča starostlivé sledovanie glykémie.
Nie sú k dispozícii údaje týkajúce sa závažných prípadov hypoglykémie, ktoré vedú ku kóme alebo úmrtiu po použití delafloxacínu.
Závažné pľuzgierovité kožnéreakcie
Prípady pľuzgierovitých kožných reakcií ako Stevensov-Johnsonov syndróm alebo toxická
epidermálna nekrolýza sa zaznamenali s inými fluorochinolónmi. Pacientom sa má odporučiť, aby ihneď kontaktovali svojho lekára predtým, ako budú pokračovať v liečbe, ak sa objavia reakcie na koži a/alebo slizniciach.
Pacientisnedostatkomglukózo-6-fosfátdehydrogenázy
Pacienti s rodinnou anamnézou alebo s aktuálnym nedostatkom glukózo-6-fosfát dehydrogenázy sú náchylní na hemolytické reakcie, ak sú liečení inými chinolónmi. Preto sa má delafloxacín u týchto pacientov používať s opatrnosťou.
Pomocnélátky
Tento liek obsahuje sodnú soľ sulfobutylbetadexu. U pacientov so stredne ťažkou až ťažkou renálnou dysfunkciou sa vyskytuje akumulácia cyklodextrínov.
Tento liek obsahuje 175 mg sodíka v jednej injekčnej liekovke, čo zodpovedá 8,8 % WHO
odporúčaného maximálneho denného príjmu 2 g sodíka pre dospelú osobu.
4.5 Liekové a iné interakcie
Účinok iných liečivnadelafloxacín
Nie sú k dispozícii údaje týkajúce sa špecifických účinkov iných liečiv na delafloxacín. Je potrebné
vziať do úvahy známe možné interakcie spojené s fluorochinolónmi.
Účinok delafloxacínu na inéliečivá
Chelatotvorné liečivá: antacidá, sukralfát, katióny kovov, multivitamíny
Nie sú k dispozícii údaje týkajúce interakcie intravenózne podávaného delafloxacínu s multivitamínmi, didanozínom alebo katiónmi kovov. Delafloxacín sa však nemá súbežne podávať
s akýmkoľvek roztokom obsahujúcim multivalentné katióny, napr. horčík, v tej istej intravenóznej súprave (pozri časť 4.2 a 6.2).
Na základe in vitro údajov o metabolizujúcich enzýmoch a transportéroch má delafloxacín nízky potenciál meniť dispozíciu iných liekov (pozri časť 5.2).
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomveku
Ženy vo fertilnom veku musia používať účinnú antikoncepciu počas liečby delafloxacínom.
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití delafloxacínu u gravidných
žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Kvôli nedostatku údajov a zistení v predklinických štúdiách pri terapeutických expozíciách u ľudí je delafloxacín
kontraindikovaný počas gravidity a u žien vo fertilnom veku, ktoré nepoužívajú antikoncepciu (pozri časti 4.3 a 4.4).
Dojčenie
Nie je známe, či sa delafloxacín/metabolity vylučujú do ľudského mlieka.
Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie delafloxacínu/metabolitov do mlieka (pozri časť 5.3). Riziko u novorodencov/dojčiat nemôže byť
vylúčené. Dojčenie je počas liečby delafloxacínom kontraindikované.
Fertilita
Účinky delafloxacínu na fertilitu u ľudí sa neskúmali. Predklinické štúdie s delafloxacínom
vykonávané na potkanoch nenaznačujú škodlivé účinky s ohľadom na fertilitu alebo reprodukčné správanie (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Quofenix má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Niektoré nežiaduce
reakcie na liek (napr. závraty, bolesť hlavy, poruchy zraku) môžu zhoršiť schopnosť pacienta sústrediť sa a reagovať, a preto môžu predstavovať riziko v situáciách, keď pacient vedie vozidlo alebo obsluhuje stroje alebo vykonáva iné činnosti vyžadujúce si mentálnu ostražitosť a koordináciu.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie nežiaduce reakcie hlásené v štúdiách fázy 2 a 3 pri ABSSSI zahŕňajúcich 868 pacientov
vystavených účinkom delafloxacínu v intravenóznej alebo perorálnej forme boli hnačka (6,91 %)
a nauzea (7,83 %), ktoré boli miernej až stredne závažnej intenzity.
Tabuľkový zoznamnežiaducichreakcií
Nasledujúce nežiaduce reakcie boli identifikované v štyroch porovnávacích štúdiách fázy 2 a 3
pri ABSSSI klasifikované podľa preferovanej terminológie a tried orgánových systémov a podľa frekvencie. Frekvencie sú definované ako: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000).
T
rieda orgánových
systémov
Č
asté Menej časté
Infekcie a nákazy Mykotické infekcie Infekcia spôsobená Clostridioides difficile (pozri časť 4.4),
Infekcia močových ciest
Sinusitída
P
oruchy krvi
a lymfatického systému
P
oruchy imunitného systému
P
oruchy metabolizmu a výživy
Trombocytopénia
Zníženie hodnoty hematokritu Zníženie počtu bielych krviniek Zníženie hladiny hemoglobínu Zníženie počtu červených krviniek Precitlivenosť (pozri časť 4.4) Sezónna alergia
Hypoglykémia (pozri časť 4.4) Hyperglykémia (see časť 4.4) Znížená chuť do jedla
P
sychické poruchy* Halucinácie, sluchové
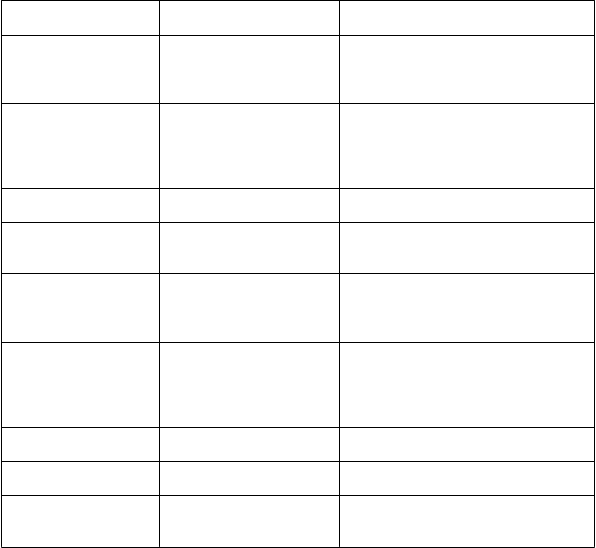
Úzkosť
Nespavosť
Nezvyčajné sny
P
oruchy nervového systému*
Bolesť hlavy Periferálna neuropatia (vrátane parestézie a hypestézie) (pozri časť 4.4) Závraty
Presynkopa
Dysgeuzia
P
oruchy oka* Rozmazané videnie
Suché oko
P
oruchy ucha a labyrintu Poruchy srdca a
srdcovej činnosti*
Vertigo
Tinitus
Sínusová tachykardia Palpitácie Bradykardia
T
rieda orgánových systémov
Č
asté Menej časté
P
oruchy ciev Hypertenzia Hypotenzia Začervenanie Flebitída
P
oruchy dýchacej sústavy, hrudníka a mediastína Poruchy
gastrointestinálneho
t
raktu
Hnačka Vracanie Nauzea
Dyspnoe
Kašeľ
Sucho v hrdle
Erozívna gastritída
Stomatitída
Bolesť brucha
Dyspepsia
Gastroezofageálna refluxová choroba
Orálna parestézia Orálna hypestézia Glosodýnia
Sucho v ústach
Flatulencia
Zápcha
Sfarbenie stolice
P
oruchy pečene a žlčových ciest
P
oruchy kože
a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva*
P
oruchy obličiek a močových ciest
Hypertransaminázémia Zvýšenie hladiny alkalickej fosfatázy v krvi
Zníženie hladiny albumínu v krvi
Pruritus Alergická dermatitída

Urtikária Vyrážka Alopécia Hyperhidróza Studený pot Nočné potenie
Reaktívna artritída Bolesť kĺbov Myalgia, Myozitída
Zápal šliach (pozri 4.4) Muskuloskeletálna bolesť (napr. bolesť
končatín, bolesť chrbta, bolesť v krku), svalová slabost
Kŕče svalov
Zvýšenie hladiny kreatínfosfokinázy v krvi
Porucha funkcie obličiek
Hematúria
Prítomnosť kryštálikov v moči
C
elkové poruchy a reakcie v mieste podania*
Ú
razy, otravy a komplikácie liečebného postupu
Reakcie v mieste podania injekcie/infúzie
Pyrexia Periférny edém Miestny opuch Únava
Zimnica
Komplikácie zdravotníckej pomôcky
Komplikácie v mieste rany
O
pis
vybraných
nežiaducich
účinkov
Veľmi zriedkavé prípady dlhodobých (trvajúcich mesiace alebo roky) a potenciálne ireverzibilých závažných nežiaducich reakcií spôsobujúcich postihnutie zasahujúcich rozličné, niekedy početné, triedy orgánových systémov (muskuloskeletálne, nervové, psychické a zmyslové) a zmyslov (vrátane reakcií ako napríklad tendinitída, ruptúra šľachy, artralgia, bolesť v končatinách, poruchy chôdze, neuropatie spojené s parestéziou, depresia, únava, poruchy pamäti, poruchy spánku a poruchy sluchu, zraku, chuti a čuchu) sa zaznamenali u pacientov užívajúcich chinolóny a fluorochinolóny
v niektorých prípadoch bez ohľadu na existujúce rizikové faktory (pozri časť 4.4).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNajvyššia denná intravenózna dávka podávaná v klinických štúdiách bola 1 200 mg. Pacienti, ktorí dostávali túto dávku, nemali žiadne nežiaduce reakcie alebo významné zistenia vo výsledkoch laboratórnych vyšetrení počas štúdie. Liečba predávkovania delafloxacínom má pozostávať
z pozorovania a celkových podporných opatrení.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antibiotiká na systémové použitie, fluorochinolóny, ATC kód: J01MA23.
Mechanizmus účinkuDelafloxacín inhibuje bakteriálnu topoizomerázu IV a DNA gyrázu (topoizomeráza II), enzýmy
potrebné na replikáciu, transkripciu, obnovu a rekombináciu bakteriálnej DNA.
RezistenciaRezistencia na fluorochinolóny vrátane delafloxacínu sa môže objaviť kvôli mutácii v definovaných
oblastiach cieľových bakteriálnych enzýmov topoizomerázy IV a DNA gyrázy považovaných
za oblasti určujúce rezistenciu na chinolóny (Quinolone-Resistance Determining Regions, QRDRs)
alebo prostredníctvom iných mechanizmov rezistencie ako napríklad efluxný mechanizmus.
Môže sa pozorovať skrížená rezistencia medzi delafloxacínom a inými fluorochinolómni, hoci niektoré izoláty rezistentné na iné fluorochinolóny si môžu zachovať citlivosť na delafloxacín.
Hraničné hodnoty testovania citlivostiHraničné hodnoty minimálnej inhibičnej koncentrácie (MIC) stanovené Európskou komisiou pre
testovanie antimikrobiálnej citlivosti (European Committee on Antimicrobial Susceptibility Testing, EUCAST) pre delafloxacín sú nasledovné:
Mikroorganizmus
H
raničné hodnoty MIC
(m
g
/
l
)
C
it
l
i
vé (S ≤) Rezistentné (R >)
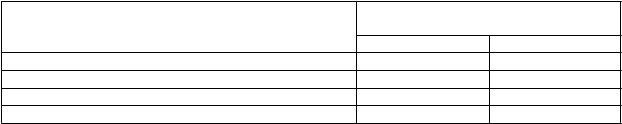 Staphylococcus aureus
Staphylococcus aureus 0,25 0,25
Streptococcus pyogenes 0,03 0,03
Streptococcus dysgalactiae 0,03 0,03
Streptococcus agalactiae 0,03 0,03

Skupina
Streptococcus anginosus 0,03 0,03
Escherichia coli 0,125 0,125
Farmakokinetický/farmakodynamickývzťahTak ako pri iných chinolónových antibiotikách spôsobil pomer fAUC24/MIC farmakokinetický/
farmakodynamický parameter najviac súvisiaci s účinnosťou delafloxacínu.
Klinická účinnosťvočišpecifickýmpatogénomÚčinnosť sa preukázala v klinických štúdiách voči nasledujúcim patogénom, ktoré boli citlivé
na delafloxacín
in vitro.
Grampozitívne mikroorganizmy:
·
Staphylococcus aureus (vrátane meticilín-rezistentného [MRSA])
·
Staphylococcus haemolyticus·
Staphylococcus hominis·
Staphylococcus lugdunensis·
Streptococcus agalactiae· Skupina
Streptococcus anginosus (vrátane
Streptococcus anginosus, Streptococcus intermedius a Streptococcus constellatus)·
Streptococcus dysgalactiae· Skupina
Streptococcus mitis (vrátane
Streptococcus cristatus, Streptococcus gordonii, Streptococcus oralis, Streptococcus mitis a Streptococcus sanguinis)·
Streptococcus pyogenes·
Enterococcus faecalisGramnegatívne mikroorganizmy:
·
Escherichia coli·
Enterobacter cloacae·
Klebsiella oxytoca·
Klebsiella pneumoniae·
Proteus mirabilis·
Pseudomonas aeruginosaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Quofenixom vo všetkých podskupinách pediatrickej populácie pri liečbe lokálnych infekcií kože a podkožného tkaniva (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiPo intravenóznom použití 300 mg delafloxacínu každých 12 hodín sa
rovnovážne koncentrácie dosahujú po približne 3-5 dňoch s približne 10 % kumuláciou po viacnásobnom podaní. Biologický polčas intravenózne podávaného delafloxacínu je približne 10 hodín. Farmakokinetika delafloxacínu je u pacientov s ABSSSI a zdravých dobrovoľníkov porovnateľná.
AbsorpciaMaximálne plazmatické koncentrácie delafloxacínu sa dosahujú na konci 1-hodinovej intravenóznej
infúzie. Vo vzťahu k celkovej expozícii (AUC) je dávka 300 mg v intravenóznej forme a 450 mg vo forme tablety bioekvivaletná.
DistribúciaDistribučný objem delafloxacínu v rovnovážnom stave je asi 40 l, čo sa približuje celkovému obsahu
vody v tele. Väzba na plazmatické bielkoviny delafloxacínu je približne 84 %. Primárne sa viaže na
albumín. Väzba na plazmatické bielkoviny delafloxacínu nie je významne ovplyvnená stupňom poruchy funkcie obličiek.
BiotransformáciaGlukuronidácia delafloxacínu je primárnou metabolickou cestou s oxidatívnym metabolizmom
predstavujúcim <1 % podanej dávky. Glukuronidácia delafloxacínu je sprostredkovaná prevažne
UGT1A1,UGT1A3 a UGT2B15. V plazme prevláda pôvodné liečivo v nezmenej forme. U ľudí nie sú prítomné žiadne významné cirkulujúce metabolity (priemer = 9,6 %).
Údaje
in vitro naznačujú, že delafloxacín v klinicky významných koncentráciách neinhibuje
cytochróm P450 CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 a CYP3A4/5 ani izoformy UGT1A1 a UGT2B7 UDP glukuronozyltransferázy. Delafloxacín neindukuje CYP1A2, CYP2B6, CYP2C9, CYP2C8, CYP2C19 alebo CYP3A4/5.
Rovnako pri klinicky významných koncentráciách delafloxacín neinhibuje transportéry MDR1, BCRP, OAT1, OAT3, OCT1, OCT2, OATP1B1, OATP1B3, MATE1, MATE2K a BSEP.
Delafloxacín je pravdepodobne substrátom BCRP.
ElimináciaPo jednorazovej intravenóznej dávke 14C-značeného delafloxacínu sa 65 % rádioaktívne značeného liečiva vylučuje v moči a 28 % sa vylučuje v stolici. Delafloxacín sa vylučuje v nezmenej forme
a vo forme glukuronidových metabolitov v moči. Rádioaktívne značené liečivo, ktoré sa opätovne získa zo stolice, je nezmenený delafloxacín.

Obézni pacienti (≥ 30 kg/m2 BMI)

Farmakokinetické parametre nie sú u obéznych ľudí zmenené (BMI ≥ 30 kg/m2).
PoruchafunkciepečenePo podaní jednorazovej 300 mg intravenóznej dávky delafloxacínu pacientom s miernou, stredne
závažnou alebo závažnou poruchou funkcie pečene (trieda A, B a C podľa Childa-Pugha) sa
nepozorovali žiadne klinicky významné zmeny v hodnote Cmax a AUC¥ v porovnaní so zodpovedajúcimi zdravými jedincami v kontrolnej skupine.
Porucha funkcieobličiekPo podaní jednorazovej intravenóznej dávky (300 mg) pacientom s miernou poruchou funkcie obličiek
bola priemerná celková expozícia (AUCt) asi 1,3-násobne vyššia; u pacientov so stredne závažnou poruchou funkcie obličiek bola hodnota AUCt asi 1,7-násobne vyššia; u pacientov so závažnou poruchou funkcie obličiek bola hodnota AUCt asi 2,1-násobne vyššia; u hemodialyzovaných pacientov s ochorením obličiek v terminálnom štádiu s hemodialýzou po dávkovaní bola hodnota AUCt asi 3,5- násobne vyššia a u hemodialyzovaných pacientov s ochorením obličiek v terminálnom štádiu bez hemodialýzy po dávkovaní bola hodnota AUCt asi 4,1-násobne vyššia ako hodnoty v zodpovedajúcich kontrolných skupinách.
Maximálne koncentrácie u pacientov s miernou a stredne závažnou poruchou funkcie obličiek boli podobné ako maximálne koncentrácie u zdravých jedincov, zatiaľ čo maximálne koncentrácie boli 2,1- násobne vyššie u pacientov so závažnou poruchou funkcie obličiek; 5,9-násobne vyššie u hemodialyzovaných pacientov s ochorením obličiek v terminálnom štádiu s hemodialýzou po dávkovaní a 6,4-násobne vyššie u pacientov u hemodialyzovaných pacientov s ochorením obličiek v terminálnom štádiu bez hemodialýzy po dávkovaní.
U pacientov so stredne závažnou alebo závažnou poruchou funkcie obličiek alebo hemodialyzovaných pacientov s ochorením obličiek v terminálnom štádiu sa objavuje kumulácia intravenóznej pomocnej
látky, sodnej soli sulfobutyl betacyklodextrínu. Priemerná systémová expozícia (AUC) sa zvyšuje 2,2-
násobne u pacientov so stredne závažnou poruchou funkcie obličiek; 5,3-násobne u pacientov so závažnou poruchou funkcie obličiek, 8,5- násobne u pacientov s ochorením obličiek v terminálnom
štádiu s hemodialýzou po dávkovaní a 29,8-násobne u pacientov s ochorením obličiek v terminálnom
štádiu bez hemodialýzy po dávkovaní v porovnaní s normálnou kontrolnou skupinou. Priemerná maximálna expozícia (Cmax) sa zvyšuje asi 2-násobne u pacientov so závažnou poruchou funkcie obličiek, 5-násobne u pacientov s ochorením obličiek v terminálnom štádiu s hemodialýzou po dávkovaní a 7-násobne u pacientov s ochorením obličiek v terminálnom štádiu bez hemodialýzy po dávkovaní v porovnaní s normálnou kontrolnou skupinou.
Pokyny pre dávkovanie osobám s poruchou funkcie obličiek sú uvedené v časti 4.2.
Starší pacienti
Keďže sa farmakokinetika delafloxacínu s vekom významne nemení, úprava dávkovania nie je na
základe veku potrebná.
Pediatrická populácia
Nevykonali sa žiadne klinické skúšania s delafloxacínom u pediatrických pacientov.
Pohlavie
Klinicky významné zmeny vo farmakokinetike delafloxacínu súvisiace s pohlavím sa nepozorovali
u zdravých jedincov alebo pacientov s ABSSSI. Nie je potrebná úprava dávkovania na základe pohlavia.
5.3 Predklinické údaje o bezpečnosti
Gastrointestinálne účinky patrili v štúdiách toxicity po opakovanom podávaní u potkanov a psov k najdôležitejším zisteniam: zahŕňali rozšírené slepé črevo (len po perorálnom podaní), abnormálnu stolicu a znížený príjem jedla a/alebo telesnej hmotnosti u potkanov a vracanie, slinenie a abnormálnu stolicu/hnačku u psov. Okrem toho sa zaznamenalo zvýšenie hodnôt ALT a ALP v sére a zníženie hladín celkových bielkovín a globulínu na konci liečebného obdobia v pivotnej 4-týždňovej intravenóznej štúdii so psami s podaním vysokej dávky (75 mg/kg) u jednotlivých psoch. Čo je však dôležité, gastrointestinálne účinky a mierne zvýšené hladiny pečeňových enzýmov u psov nesúviseli
s histopatologickými zmenami v tkanive gastrointestinálneho traktu a súvisiacich orgánoch (pankreas, pečeň). Žiadne nežiaduce účinky sa nepozorovali u potkanov pri expozíciách asi 2-násobne vyšších
ako u ľudí alebo u psov pri expozíciách približne rovnakých ako u ľudí.
V štúdiách embyo-fetálneho vývinu uskutočnených na potkanoch a králikoch nemal delafloxacín teratogénny účinok, ale indukoval retardáciu rastu plodu a oneskorenie osifikácie pri hladinách
spôsobujúcich toxicitu u matiek. U potkanov sa účinky na plod objavili pri hladinách expozície
presahujúcich asi 2-násobok hladiny, ktorá sa pozorovala u ľudí na základe hodnoty AUC, ale u králikov, druhov známych ako extrémne citlivých na maternálnu toxicitu vyvolanú antibakteriálnymi liečivami, boli účinky na plod zaznamenané pri hladinách expozície oveľa nižších ako sa pozorovali u ľudí. Keďže sa delafloxacín vylučuje do mlieka, závažná toxicita sa pozorovala u novorodencov
potkanov počas laktácie, keď boli matky liečené počas gravidity a laktácie delafloxacínom pri dávkach spôsobujúcich systémovú expozíciu asi 5-násobne vyššiu ako expozícia u ľudí. Žiadne také účinky
a žiadne iné vývojové abnormality sa však neobjavili v potomstve matiek s expozíciou hladín asi 2-
násobne vyšších ako sú hladiny u ľudí. Žiadne účinky na fertilitu samcov a samíc potkanov sa nezaznamenali pri hladinách expozície asi 5-násobne vyšších ako sú hladiny pozorované u ľudí.
Nevykonali sa dlhodobé štúdie karcinogenicity s delafloxacínom.
Neidentifikovalo sa žiadne riziko genotoxicity in vitro a in vivo bolo negatívne pri najvyššej možnej dávke ≥ 15-násobne vyššej ako je odhadovaná plazmatická expozícia u ľudí vychádzajúca z hodnoty AUC.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
meglumín
sulfobutylbetadex, sodná soľ edetát disodný
hydroxid sodný (na úpravu pH)
kyselina chlorovodíková, koncentrovaná (na úpravu pH)
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
4 roky.
Preukázalo sa, že chemická a fyzikálna stabilita pri používaní je 24 hodín pri teplote 20 °C až 25 °C
alebo na 24 hodín pri teplote 2 °C až 8 °C.
Z mikrobiologického hľadiska sa má liek po rekonštitúcii a zriedení použiť ihneď. Ak sa nepoužije ihneď, za čas použiteľnosti a podmienky pred použitím je zodpovedný používateľ a nemali by byť za normálnych okolností dlhšie ako 24 hodín pri teplote 2 °C až 8 °C, pokiaľ sa rekonštitúcia a riedenie neuskutočnilo v kontrolovaných a validovaných aseptických podmienkach.
Neuchovávajte v mrazničke.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie. Podmienky na uchovávanie po zriedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
20 ml injekčné liekovky z číreho skla typu I s 20 mm gumenými zátkami typu I a 20 mm obrubou s vyklápacími viečkami.
Veľkosť balenia: 10 injekčných liekoviek.
6.6 Špeciálne opatrenia na likvidáciu
Každá 300 mg injekčná liekovka Quofenix sa musí rekonštituovať za aseptických podmienok použitím 10,5 ml injekčného roztoku dextrózy 50 mg/ml (5 %, D5W) alebo injekčného roztoku chloridu sodného 9 mg/ml (0,9 %).
· Injekčná liekovka sa má dôkladne pretrepávať až dovtedy, kým sa jej obsah úplne nerozpustí.
Injekčná liekovka s rekonštituovaným roztokom obsahuje 300 mg delafloxacínu v 12 ml vo forme číro žltého až oranžovožltého roztoku.
· Následne pred podaním sa musí rekonštituovaný roztok riediť v 250 ml intravenóznom vaku
(buď injekčný roztok chloridu sodného 0,9 % alebo D5W).
· Požadovanú dávku intravenóznej infúzie priprav odobraním objemu 12 ml pre Quofenix
300 mg alebo 8 ml pre Quofenix 200 mg z injekčnej liekovky s rekonštituovaným roztokom.
· Požadovaná dávka rekonštituovaného roztoku Quofenixu sa má asepticky premiestniť z injekčnej liekovky do 250 ml intravenózneho vaku. (Akákoľvek nepoužitá časť rekonštituovaného roztoku sa má vyhodiť).
· Po rekonštitúcii a zriedení sa má Quofenix podať intravenóznou infúziou s celkovým časom podania infúzie 60 minút.
Quofenix sa nesmie infúziou podávať súbežne s inými liekmi. Ak sa použije spoločná intravenózna súprava na podanie iných liekov spolu s Quofenixom, súprava sa má prepláchnuť pred a po každej infúzii Quofenixu s injekčným roztokom chloridu sodného 9 mg/ml (0,9 %) alebo D5W.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIA. Menarini – Industrie Farmaceutiche Riunite – s.r.l. Via Sette Santi 3, 50131 Florencia, Taliansko
8. REGISTRAČNÉ ČÍSLOEU/1/19/1393/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií
o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUQuofenix 450 mg tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEJedna tableta obsahuje delafloxacínium-meglumín,čo zodpovedá 450 mg delafloxacínu.
PomocnálátkasoznámymúčinkomJedna tableta obsahuje 39 mg sodíka.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATableta.
Béžové až škvrnito bežové, podlhovasté bikonvexné tablety so šírkou približne 10 mm x 21 mm dĺžkou, s označením RX3341 na jednej strane.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieQuofenix je indikovaný na liečbu akútnych bakteriálnych infekcií kože a kožných štruktúr (acute bacterial skin and skin structure infections, ABSSSI) u dospelých, ak sa použitie iných antibakteriálnych látok, ktoré sa zvyčajne odporúčajú na začatie liečby týchto infekcií, považuje za nevhodné (pozri časti 4.4 a 5.1).
Je potrebné vziať do úvahy oficiálne pokyny pre správne používanie antibakteriálnych látok.
4.2 Dávkovanie a spôsob podávaniaDávkovanieOdporúčaná schéma podávania delafloxacínu je 450 mg podávaných perorálne každých 12 hodín
celkovo počas 5 až 14 dní podľa uváženia lekára. Tablety delafloxacínu sa môžu užívať s jedlom alebo bez jedla.
Osobitné populácieStarší pacientiNie je potrebná úprava dávkovania. V prípade fluorochinolónov sú pacienti starší ako 60 rokov vystavení zvýšenému riziku vzniku závažných porúch šliach vrátane ruptúry šľachy (pozri časti 4.4 a
5.2).
Porucha funkcie obličiek
U pacientov s miernou až závažnou poruchou funkcie obličiek nie je potrebná úprava dávkovania (pozri časť 4.4. a 5.2). Quofenix sa neodporúča u pacientov s ochorením obličiek v terminálnom štádiu (End Stage Renal Disease, ESRD).
Porucha funkcie pečene
Nie je potrebná úprava dávkovania (pozri časť 5.2).
Pediatrická populácia
Quofenix je kontraindikovaný u detí a dospievajúcich (pozri časť 4.3).
Spôsob podávania
Perorálne použitie.
Tablety sa majú prehltnúť a môžu sa užívať s jedlom alebo bez jedla. Pacient má pri užítí Quofenixu vypiť dostatočné množstvo tekutín.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Precitlivenosť na ktorékoľvek fluorochinolónové alebo chinolónové antibiotikum. Poruchy šliach súvisiace s podávaním fluorochinolónov v anamnéze.
Gravidita, ženy vo fertilnom veku neužívajúce antikoncepciu a dojčenie (pozri časť 4.6). Deti alebo dospievajúci mladší ako 18 rokov (pozri časť 4.2).
4.4 Osobitné upozornenia a opatrenia pri používaní
U pacientov, u ktorých sa v minulosti objavili pri užívaní liekov s obsahom chinolónov alebo fluorochinolónov závažné nežiaduce reakcie, je potrebné sa vyhnúť užívaniu delafloxacínu (pozri časť
4.8). Liečba týchto pacientov delafloxacínom sa má začať len v prípade, ak neexistujú alternatívne
možnosti liečby a po starostlivom zhodnotení prínosu/rizika (pozri tiež časť 4.3).
Antikoncepcia
V prípade liečby žien vo fertilnom veku sa musí počas liečby používať účinná forma antikoncepcie
(pozri časť 4.6).
Disekcia a aneuryzmaaorty
V epidemiologických štúdiách bolo zistené zvýšené riziko aneuryzmy aorty a disekcie aorty po použití
fluorochinolónov, najmä u starších osôb.
Preto sa majú fluorochinolóny používať len po starostlivom zhodnotení prínosu a rizika a po zvážení iných terapeutických možností u pacientov s pozitívnou rodinnou anamnézou ochorenia aneuryzmy alebo u pacientov s diagnostikovanou už existujúcou aneuryzmou aorty a/alebo disekciou aorty, alebo v prípade výskytu iných rizikových faktorov alebo stavov, ktoré sú predispozíciou k vzniku aneuryzmy aorty a/alebo disekcie aorty (napr. Marfanov syndróm, vaskulárny Ehlersov-Danlosov
syndróm, Takayasuova arteritída, obrovskobunková arteritída, Behcetova choroba, hypertenzia, známa ateroskleróza).
V prípade náhlej bolesti brucha, hrudníka alebo chrbta je potrebné pacientom odporučiť, aby sa bezodkladne obrátili na lekársku pohotovosť.
Tendinitída a ruptúra šľachy
Tendinitída a ruptúra šľachy (najmä Achillovej šľachy, avšak nielen tej), niekedy bilaterálne, sa môže
vyskytnúť už počas 48 hodín po začatí liečby chinolónmi a fluorochinolónmi a ich výskyt sa dokonca zaznamenal až do niekoľkých mesiacov po ukončení liečby. Riziko tendinitídy a ruptúry šľachy je
zvýšené u starších pacientov, pacientov s poruchou funkcie obličiek, pacientov po transplantácii
solídnych orgánov a pacientov, ktorí sú súbežne liečení kortikosteroidmi. Preto je potrebné predísť súbežnému užívaniu kortikosteroidov. Pri prvých prejavoch tendinitídy (napr. bolestivého opuchu, zápalu) sa má liečba delafloxacínom ukončiť a má sa zvážiť alternatívna liečba. Postihnutá končatina (končatiny) sa má primerane liečiť (napr. imobilizáciou). Kortikosteroidy sa nemajú užívať, ak sa vyskytnú príznaky tendinopatie.
Periférna neuropatia
Prípady senzorickej alebo senzorimotorickej polyneuropatie spôsobujúce parestéziu, hypestéziu,
dyzestéziu alebo slabosť sa zaznamenali u pacientov užívajúcich chinolóny a fluorochinolóny. Pacientom liečených delafloxacínom sa má odporučiť, aby informovali svojho lekára predtým, ako
budú pokračovať v liečbe, ak u nich dôjde k výskytu príznakov neuropatie, ako je bolesť, pálenie,
mravčenie, znecitlivenie alebo slabosť, aby sa zabránilo výskytu potenciálne ireverzibilných stavov
(pozri časť 4.8).
Účinky na centrálnynervovýsystém
Fluorochinolóny sa spájali so zvýšeným rizikom účinkov na centrálny nervový system (CNS), vrátane
konvulzií a zvýšeného intrakraniálneho tlaku (vrátane pseudotumoru cerebri) a toxickej psychózy. Fluorochinolóny môžu tiež spôsobiť účinky na CNS ako nervozita, agitácia, insomnia, úzkosť, nočné
mory, paranoja, závrat, zmätenosť, tras, halucinácie, depresia a samovražedné myšlienky alebo
správanie. Tieto nežiaduce rekcie sa môžu objaviť po podaní prvej dávky. Ak sa tieto reakcie vyskytnú u pacientov užívajúcich delafloxacín, podávanie delafloxacínu sa má ihneď ukončiť a majú sa zaviesť
primerané opatrenia. Delafloxacín sa má používať v prípade, ak prínosy liečby prevažujú riziká u
pacientov so známymi poruchami CNS alebo s podozrením na tieto poruchy (napr. závažná cerebrálna arterioskleróza, epilepsia) alebo v prítomnosti iných rizikových faktorov, ktoré môžu predpovedať vznik záchvatov alebo znižovať prach záchvatov.
Zhoršenie myasthenie gravis
Fluorochinolóny majú neuromuskulárny blokujúci účinok a môžu zhoršiť svalovú slabosť u ľudí
s ochorením myasthenia gravis. Závažné nežiaduce reakcie po uvedení lieku na trh vrátane úmrtí a požiadaviek na podporu ventilácie sa spájali s použitím fluorochinolónov u ľudí s ochorením myasthenia gravis. Použitie delafloxacinu sa neodporúča u pacientov so známou anamnézou ochorenia myasthenia gravis.
Ochorenie súvisiace s Clostridioides difficile
Ochorenie súvisiace s Clostridioides difficile sa zaznamenalo u používateľov takmer všetkých
systémových antibakteriálnych liečiv so závažnosťou v rozsahu od miernej hnačky po kolitídu s fatálnymi následkami. Ochorenie súvisiace s Clostridioides difficile sa musí zvážiť u všetkých pacientov s hnačkou. V prípade podozrenia na ochorenie súvisiace s Clostridioides difficile alebo potvrdenia tohto ochorenia sa má liečba delafloxacínom ukončiť a má sa zvážiť použitie náležitých podporných opatrení spolu so špecifickou antibakteriálnou liečbou C. difficile.
Lieky inhibujúce peristaltiku sú kontraindikované v prípade podozrenia na výskyt ochorenia súvisiaceho s Clostridioides difficile.
Reakcie zprecitlivenosti
Pacienti so známou precitlivenosťou na delafloxacín alebo iné fluorochinolóny nesmú užívať
Quofenix (pozri časť 4.3). Závažné a príležitostne fatálne reakcie z precitlivenosti (anafylaktické) sa zaznamenali u pacientov užívajúcich fluorochinolónové antibakteriálne liečivá. Pred začiatkom liečby
Quofenixom sa má vykonať dôkladné vyšetrenie týkajúce sa výskytu predchádzajúcich reakcií z
precitlivenosti na iné chinolóny alebo fluorochinolónové antibakteriálne lieky. V prípade výskytu anafylaktickej reakcie na Quofenix sa má užívanie lieku ihneď ukončiť a má sa začať náležitá liečba.
Pacienti sporuchou funkcieobličiek
Bezpečnosť a účinnosť pokynov na úpravu dávkovania u pacientov so závažnou poruchou funkcie
obličiek nebola klinicky hodnotená a vychádza z údajov farmakokinetických modelov. Delafloxacín sa má používať len u tých pacientov, kde očakávaný klinický prínos prevažuje nad potenciálnym
rizikom. U týchto pacientov sa má starostlivo sledovať klinická odpoveď na liečbu a funkcia obličiek. Perorálne podávanie delafloxacínu u pacientov so závažnou poruchou funkcie obličiek a s nízkou telesnou hmotnosťou môže viesť k zvýšeniu systémovej expozície. Quofenix sa neodporúča u
pacientov s ochorením obličiek v terminálnom štádiu (ESRD).
Obmedzenie klinickýchúdajov
V dvoch hlavných skúšaniach pri ABSSSI sa liečené typy infekcií týkali len celulitídy/eryzipelu,
abscesov a infekcií rán. Iné typy kožných infekcií sa neskúmali. Pacienti s toxickým šokom, neutropéniou (počet neutrofilov < 500 buniek/mm3) alebo závažne oslabeným imunitným systémom neboli zaradení do štúdií. U pacientov vo veku > 75 rokov sú obmedzené skúsenosti.
Dlhodobé a potenciálne ireverzibilné závažné nežiaducereakciespôsobujúcepostihnutie
Veľmi zriedkavé prípady dlhodobých (trvajúcich mesiace alebo roky) a potenciálne ireverzibilých
závažných nežiaducich reakcií spôsobujúcich postihnutie zasahujúcich rozličné, niekedy početné, orgánové systémy (muskuloskeletálne, nervové, psychické a zmyslové) sa zaznamenali u pacientov užívajúcich chinolóny a fluorochinolóny bez ohľadu na vek a už existujúce rizikové faktory. Podávanie delafloxacínu sa má ihneď ukončiť pri prvých prejavoch alebo príznakoch akejkoľvek závažnej nežiaducej reakcie a pacientom je potrebné odporučiť, aby sa poradili so svojím predpisujúcim lekárom.
Superinfekcia
Mikroorganizmy rezistentné voči fluorochinolónom môžu pri užívaní delafloxacínu spôsobiť
superinfekciu. Ak sa superinfekcia objaví počas liečby, majú sa prijať primerané opatrenia.
Dysglykémia
Tak ako pri všetkých chinolónoch sa zaznamenali poruchy glykémie vrátane hypoglykémie a
hyperglykémie (pozri časť 4.8) zvyčajne u diabetických pacientov užívajúcich súbežnú liečbu perorálnymi antidiabetikami (napr. glibenklamid) alebo inzulínom. Zaznamenali sa prípady hypoglykemickej kómy. U diabetických pacientov sa odporúča starostlivé sledovanie glykémie.
Nie sú k dispozícii údaje týkajúce sa závažných prípadov hypoglykémie, ktoré vedú ku kóme alebo úmrtiu po užití delafloxacínu.
Závažné pľuzgierovité kožnéreakcie
Prípady pľuzgierovitých kožných reakcií ako Stevensov-Johnsonov syndróm alebo toxická'
epidermálna nekrolýza sa zaznamenali s inými fluorochinolónmi. Pacientom sa má odporučiť, aby ihneď kontaktovali svojho lekára predtým, ako budú pokračovať v liečbe, ak sa objavia reakcie na
koži a/alebo slizniciach.
Pacienti s nedostatkom glukózo-6-fosfát dehydrogenázy
Pacienti s rodinnou anamnézou alebo s aktuálnym nedostatkom glukózo-6-fosfát dehydrogenázy sú
náchylní na hemolytické reakcie, ak sú liečení inými chinolónmi. Preto sa má delafloxacín u týchto pacientov používať s opatrnosťou.
Pomocnélátky
Tento liek obsahuje 39 mg sodíka v jednej tablete, čo zodpovedá 2 % WHO odporúčaného maximálneho denného príjmu 2 g sodíka pre dospelú osobu.
4.5 Liekové a iné interakcie
Ú
činok iných liečivnadelafloxacín
Chelatotvorné liečivá: antacidá, sukralfát, katióny kovov, multivitamíny
Fluorochinolóny tvoria cheláty s katiónmi kovov alkalických zemín a prechodných kovov. Perorálne podávanie delafloxacínu s antacidami obsahujúcimi hliník alebo horčík, so sukralfátom, s katiónmi
kovov ako napríklad železo alebo s multivitamínmi obsahujúcimi železo alebo zinok alebo s liekovými formami s obsahom dvojvalentných a trojvalentných katiónov ako napríklad didanozín vo
forme pufrovaných tabliet na perorálnu suspenziu alebo prášku na perorálny roztok pre deti môže výrazne interferovať s absorpciou delafloxacínu, čo vedie k systémovým koncentráciám oveľa nižším, ako je požadované. Preto sa má delafloxacín užívať najmenej 2 hodiny pred alebo 6 hodín po užití
týchto liečiv.
Účinok delafloxacínu na inéliečivá
Na základe in vitro údajov o metabolizujúcich enzýmoch a transportéroch má delafloxacín nízky
potenciál meniť dispozíciu iných liekov (pozri časť 5.2).
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomveku
Ženy vo fertilnom veku musia používať účinnú antikoncepciu počas liečby delafloxacínom.
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití delafloxacínu u gravidných
žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Kvôli nedostatku údajov a zistení v predklinických štúdiách pri terapeutických expozíciách u ľudí je delafloxacín
kontraindikovaný počas gravidity a u žien vo fertilnom veku, ktoré neužívajú antikoncepciu (pozri
časti 4.3 a 4.4).
Dojčenie
Nie je známe, či sa delafloxacín/metabolity vylučujú do ľudského mlieka.
Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie delafloxacínu/metabolitov do mlieka (pozri časť 5.3). Riziko u novorodencov/dojčiat nemôže byť vylúčené. Dojčenie je počas liečby delafloxacínom kontraindikované.
Fertilita
Účinky delafloxacínu na fertilitu u ľudí sa neskúmali. Predklinické štúdie s delafloxacínom
vykonávané na potkanoch nenaznačujú škodlivé účinky s ohľadom na fertilitu alebo reprodukčné správanie (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Quofenix má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Niektoré nežiaduce
reakcie na liek (napr. závraty, bolesť hlavy, poruchy zraku) môžu zhoršiť schopnosť pacienta sústrediť sa a reagovať, a preto môžu predstavovať riziko v situáciách, keď pacient vedie vozidlo alebo obsluhuje stroje alebo vykonáva iné činnosti vyžadujúce si mentálnu ostražitosť a koordináciu.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie nežiaduce reakcie hlásené v štúdiách fázy 2 a 3 pri ABSSSI zahŕňajúcich 868 pacientov
vystavených účinkom delafloxacínu v intravenóznej alebo perorálnej forme boli hnačka (6,91 %)
a nauzea (7,83 %), ktoré boli miernej až stredne závažnej intenzity.
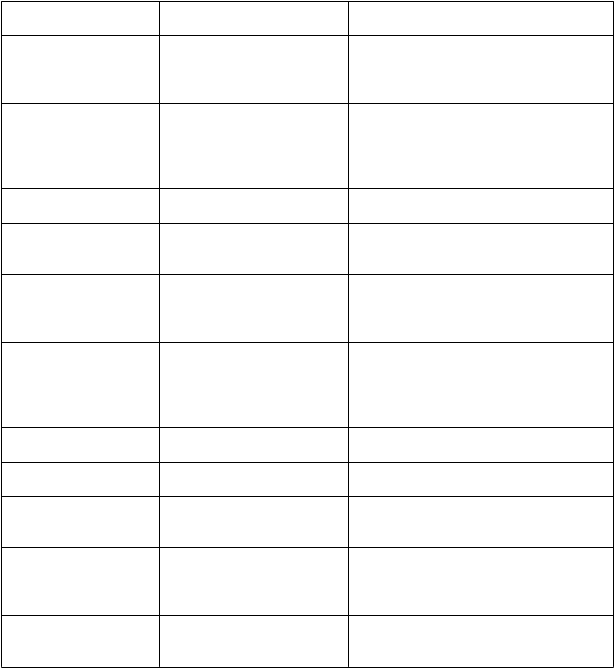
Tabuľkový zoznamnežiaducichreakcií
Nasledujúce nežiaduce reakcie boli identifikované v štyroch porovnávacích štúdiách fázy 2 a 3 pri
ABSSSI klasifikované podľa preferovanej terminológie a tried orgánových systémov a podľa frekvencie. Frekvencie sú definované ako: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté
(≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000).
T
rieda orgánových
systémov
Č
asté Menej časté
Infekcie a nákazy Mykotické infekcie Infekcia spôsobená Clostridioides difficile
(pozri časť 4.4)
Infekcia močových ciest
Sinusitída
P
oruchy krvi
a lymfatického systému
P
oruchy imunitného systému
P
oruchy metabolizmu a výživy
Trombocytopénia
Zníženie hodnoty hematokritu
Zníženie počtu bielych krviniek
Zníženie hladiny hemoglobínu Zníženie počtu červených krviniek Precitlivenosť (pozri časť 4.4) Sezónna alergia
Hypoglykémia (pozri časť 4.4) Hyperglykémia (see časť 4.4) Znížená chuť do jedla
P
sychické poruchy Halucinácie, sluchové
Úzkosť Nespavosť Nezvyčajné sny
P
oruchy nervového systému*
Bolesť hlavy Periferálna neuropatia (vrátane parestézie a hypestézie) (pozri časť 4.4)
Závraty
Presynkopa
Dysgeuzia
P
oruchy oka* Rozmazané videnie
Suché oko
P
oruchy ucha a labyrintu Poruchy srdca a
srdcovej činnosti*
Vertigo
Tinitus
Sínusová tachykardia Palpitácie Bradykardia
P
oruchy ciev Hypertenzia Hypotenzia Začervenanie Flebitída
P
oruchy dýchacej sústavy, hrudníka a mediastína
Dyspnoe
Kašeľ
Sucho v hrdle
T
rieda orgánových systémov
Č
asté Menej časté
P
oruchy gastrointestinálneho traktu
Hnačka Vracanie Nauzea
Erozívna gastritída
Stomatitída
Bolesť brucha
Dyspepsia
Gastroezofageálna refluxová choroba
Orálna parestézia Orálna hypestézia Glosodýnia
Sucho v ústach
Flatulencia
Zápcha
Sfarbenie stolice
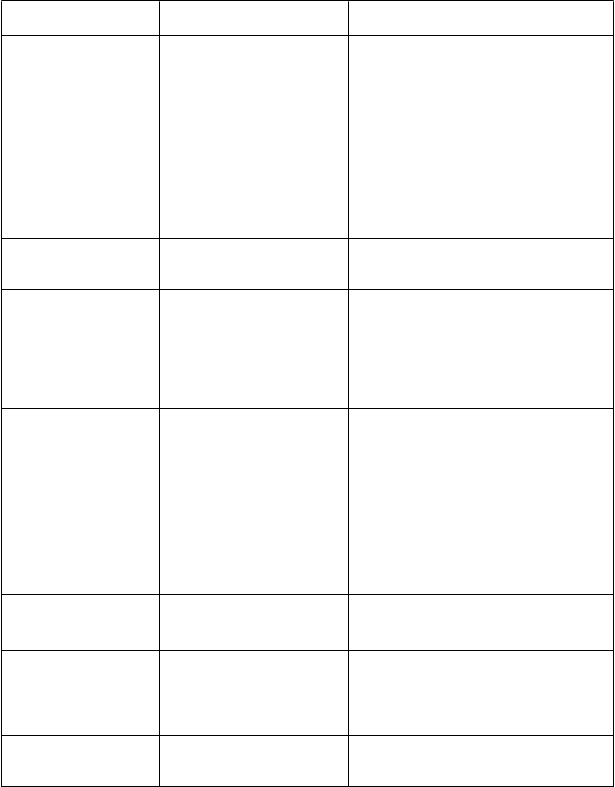
P
oruchy pečene a žlčových ciest
P
oruchy kože
a podkožného tkaniva
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva*
P
oruchy obličiek a močových ciest
C
elkové poruchy a reakcie v mieste podania*
Ú
razy, otravy a komplikácie liečebného postupu
Hypertransaminázémia Zvýšenie hladiny alkalickej fosfatázy v krvi
Zníženie hladiny albumínu v krvi
Pruritus Alergická dermatitída
Urtikária Vyrážka Alopécia Hyperhidróza Studený pot Nočné potenie
Reaktívna artritída Bolesť kĺbov Myalgia, Myozitída
Zápal šliach (pozri 4.4) Muskuloskeletálna bolesť (napr. bolesť končatín, bolesť chrbta, bolesť v krku), svalová slabost
Kŕče svalov
Zvýšenie hladiny kreatínfosfokinázy v krvi
Poruchy funkcie obličiek
Hematúria
Prítomnosť kryštálikov v moči
Pyrexia Periférny edém Miestny opuch Únava
Zimnica
Komplikácie v mieste rany
 O
pis
vybraných
nežiaducich
účinkov
O
pis
vybraných
nežiaducich
účinkov
Veľmi zriedkavé prípady dlhodobých (trvajúcich mesiace alebo roky) a potenciálne ireverzibilých závažných nežiaducich reakcií spôsobujúcich postihnutie zasahujúcich rozličné, niekedy početné,
triedy orgánových systémov (muskuloskeletálne, nervové, psychické a zmyslové) a zmyslov (vrátane reakcií ako napríklad tendinitída, ruptúra šľachy, artralgia, bolesť v končatinách, poruchy chôdze,
neuropatie spojené s parestéziou, depresia, únava, poruchy pamäti, poruchy spánku a poruchy sluchu, zraku, chuti a čuchu) sa zaznamenali u pacientov užívajúcich chinolóny a fluorochinolóny
v niektorých prípadoch bez ohľadu na existujúce rizikové faktory (pozri časť 4.4).
H
l
ásenie
podozrení
na
nežiaduce
r
eakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNajvyššia denná perorálna dávka podávaná v klinických štúdiách bola 1 600 mg. Pacienti, ktorí užívali túto dávku, nemali žiadne nežiaduce reakcie alebo významné zistenia vo výsledkoch laboratórnych vyšetrení počas štúdie. Liečba predávkovania delafloxacínom má pozostávať z pozorovania
a celkových podporných opatrení.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antibiotiká na systémové použitie, fluórochinolóny, ATC kód: J01MA23.
Mechanizmus účinkuDelafloxacín inhibuje bakteriálnu topoizomerázu IV a DNA gyrázu (topoizomeráza II), enzýmy
potrebné na replikáciu, transkripciu, obnovu a rekombináciu bakteriálnej DNA.
RezistenciaRezistencia na fluorochinolóny vrátane delafloxacínu sa môže objaviť kvôli mutácii v definovaných
oblastiach cieľových bakteriálnych enzýmov topoizomerázy IV a DNA gyrázy považovaných za oblasti určujúce rezistenciu na chinolóny (Quinolone-Resistance Determining Regions, QRDRs) alebo
prostredníctvom iných mechanizmov rezistencie ako napríklad efluxný mechanizmus.
Môže sa pozorovať skrížená rezistencia medzi delafloxacínom a inými fluorochinolómni, hoci niektoré izoláty rezistentné na iné fluorochinolóny si môžu zachovať citlivosť na delafloxacín.
Hraničné hodnoty testovania citlivostiHraničné hodnoty minimálnej inhibičnej koncentrácie (MIC) stanovené Európskou komisiou pre
testovanie antimikrobiálnej citlivosti (European Committee on Antimicrobial Susceptibility Testing, EUCAST) pre delafloxacín sú nasledovné:
Mikroorganizmus
H
raničné hodnoty MIC
(m
g
/
l
)
C
it
l
i
vé (S ≤) Rezistentné (R >)
 Staphylococcus aureus
Staphylococcus aureus 0,25 0,25
Streptococcus pyogenes 0,03 0,03
Streptococcus dysgalactiae 0,03 0,03
Streptococcus agalactiae 0,03 0,03
Skupina
Streptococcus anginosus 0,03 0,03
Escherichia coli 0,125 0,125
Farmakokinetický/farmakodynamickývzťahTak ako pri iných chinolónových antibiotiká spôsobil pomer fAUC24/MIC farmakokinetický/
farmakodynamickým parameter najviac súvisiaci s účinnosťou delafloxacínu.
K
l
i
n
i
cká účinnosťprotišpecifickýmpatogénom
Účinnosť sa preukázala v klinických štúdiách voči nasledujúcim patogénom, ktoré boli citlivé na
delafloxacín in vitro.
Grampozitívne mikroorganizmy:
· Staphylococcus aureus (vrátane meticilín-rezistentného [MRSA])
· Staphylococcus haemolyticus
· Staphylococcus hominis
· Staphylococcus lugdunensis
· Streptococcus agalactiae
· Skupina Streptococcus anginosus (vrátane Streptococcus anginosus, Streptococcus intermedius a Streptococcus constellatus)
· Streptococcus dysgalactiae
· Skupina Streptococcus mitis (vrátane Streptococcus cristatus, Streptococcus gordonii, Streptococcus oralis, Streptococcus mitis a Streptococcus sanguinis)
· Streptococcus pyogenes
· Enterococcus faecalis
Gramnegatívne mikroorganizmy:
· Escherichia coli
· Enterobacter cloacae
· Klebsiella oxytoca
· Klebsiella pneumoniae
· Proteus mirabilis
· Pseudomonas aeruginosa
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Quofenixom vo všetkých podskupinách pediatrickej populácie pri liečbe lokálnych infekcií kože a podkožného tkaniva (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Po perorálnom podaní 450 mg delafloxacínu každých 12 hodín sa rovnovážne koncentrácie dosahujú po približne 5 dňoch s približne 36 % kumuláciou po viacnásobnom podaní. Biologický polčas perorálne podávaného delafloxacínu je približne 14 hodín. Farmakokinetika delafloxacínu je
u pacientov s ABSSSI a zdravých dobrovoľníkov porovnateľná.
Absorpcia
Maximálne plazmatické koncentrácie delafloxacínu sa dosahujú približne počas 1 hodiny po
perorálnom podaní nalačno. 450 mg tableta a 300 mg intravenózna forma sú bioekvivalentné vo vzťahu k celkovej expozícii (AUC). Delafloxacín sa môže podávať s jedlom alebo bez jedla, keďže
celková systémová expozícia (AUC∞) sa nemení v stave nalačno a po jedle (vysoko tuková, vysoko kalorická potrava).
Distribúcia
Distribučný objem delafloxacínu v rovnovážnom stave je asi 40 l, čo sa približuje celkovému obsahu
vody v tele. Väzba na plazmatické bielkoviny delafloxacínu je približne 84 %. Primárne sa viaže na albumín. Väzba na plazmatické bielkoviny delafloxacínu nie je významne ovplyvnená stupňom poruchy funkcie obličiek.
Biotransformácia
Glukuronidácia delafloxacínu je primárnou metabolickou cestou s oxidatívnym metabolizmom predstavujúcim <1 % podanej dávky. Glukuronidácia delafloxacínu je sprostredkovaná prevažne UGT1A1,UGT1A3 a UGT2B15. V plazme prevláda pôvodné liečivo v nezmenej forme. U ľudí nie sú prítomné žiadne významné cirkulujúce metabolity (priemer = 9,6 %).
Údaje
in vitro naznačujú, že delafloxacín v klinicky významných koncentráciách neinhibuje cytochróm P450 CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 a
CYP3A4/5 ani izoformy UGT1A1 a UGT2B7 UDP glukuronozyltransferázy. Delafloxacín neindukuje
CYP1A2, CYP2B6, CYP2C9, CYP2C8, CYP2C19 alebo CYP3A4/5.
Rovnako pri klinicky významných koncentráciách delafloxacín neinhibuje transportéry MDR1, BCRP, OAT1, OAT3, OCT1, OCT2, OATP1B1, OATP1B3, MATE1, MATE2K a BSEP. Delafloxacín je pravdepodobne substrátom BCRP.
ElimináciaPo jednorazovej perorálnej dávke 14C-značeného delafloxacínu sa 50 % rádioaktívne značeného liečiva vylučuje v moči ako nezmenený delafloxacín a vo forme glukuronidových metabolitov a 48 % sa vylučuje v nezmenenej forme v stolici.

Obézni pacienti (≥ 30 kg/m2 BMI)

Farmakokinetické parametre nie sú u obéznych ľudí zmenené (BMI ≥ 30 kg/m2).
PoruchafunkciepečenePo podaní delafloxacínu sa nepozorovali žiadne klinicky významné zmeny vo farmakokinetike
delafloxacínu u pacientov s miernou, stredne závažnou alebo závažnou poruchou funkcie pečene (trieda A, B a C podľa Childa-Pugha) v porovnaní so zodpovedajúcimi zdravými jedincami v kontrolnej skupine. Preto nie je potrebná úprava dávkovania.
Porucha funkcieobličiekPo podaní jednorazovej perorálnej dávky (400 mg) pacientom s miernou, stredne závažnou alebo
závažnou poruchou funkcie obličiek bola priemerná celková expozícia (AUCt) asi 1,5-násobne vyššia u jedincov so stredne závažnou alebo závažnou poruchou funkcie obličiek v porovnaní so zdravými jedincami, zatiaľ čo celková systémová expozícia bola porovnateľná s jedincami s miernou poruchou funkcie obličiek. Medzi jedincami s poruchou funkcie obličiek a zdravými jedincami nebol štatisticky významný rozdiel rozdiel v maximálnej expozícii (Cmax).
Pokyny pre dávkovanie osobám s poruchou funkcie obličiek sú uvedené v časti 4.2.
Starší pacientiKeďže sa farmakokinetika delafloxacínu s vekom významne nemení, úprava dávkovania nie je na
základe veku potrebná.
Pediatrická populáciaNevykonali sa žiadne klinické skúšania s delafloxacínom u pediatrických pacientov.
PohlavieKlinicky významné zmeny vo farmakokinetike delafloxacínu súvisiace s pohlavím sa nepozorovali
u zdravých jedincov alebo pacientov s ABSSSI. Nie je potrebná úprava dávkovania na základe pohlavia.
5.3 Predklinické údaje o bezpečnosti
Gastrointestinálne účinky patrili v štúdiách toxicity po opakovanom podávaní u potkanov a psov k najdôležitejším zisteniam: zahŕňali rozšírené slepé črevo (len po perorálnom podaní), abnormálnu stolicu a znížený príjem jedla a/alebo telesnej hmotnosti u potkanov a vracanie, slinenie a abnormálnu stolicu/hnačku u psov. Okrem toho sa zaznamenalo zvýšenie hodnôt ALT a ALP v sére a zníženie hladín celkových bielkovín a globulínu na konci liečebného obdobia v pivotnej 4-týždňovej intravenóznej štúdii so psami s podaním vysokej dávky (75 mg/kg) u jednotlivých psoch. Čo je však dôležité, gastrointestinálne účinky a mierne zvýšené hladiny pečeňových enzýmov u psov nesúviseli
s histopatologickými zmenami v tkanive gastrointestinálneho traktu a súvisiacich orgánoch (pankreas, pečeň). Žiadne nežiaduce účinnky sa nepozorovali u potkanov pri expozíciách asi 2-násobne vyšších
ako u ľudí alebo u psov pri expozíciách približne rovnakých ako u ľudí.
V štúdiách embyo-fetálneho vývinu uskutočnených na potkanoch a králikoch nemal delafloxacín teratogénny účinok, ale indukoval retardáciu rastu plodu a oneskorenie osifikácie pri hladinách
spôsobujúcich toxicitu u matiek. U potkanov sa účinky na plod objavili pri hladinách expozície
presahujúcich asi 2-násobok hladiny, ktorá sa pozorovala u ľudí na základe hodnoty AUC, ale u králikov, druhov známych ako extrémne citlivých na maternálnu toxicitu vyvolanú antibakteriálnymi liečivami, boli účinky na plod zaznamenané pri hladinách expozície oveľa nižších ako sa pozorovali u ľudí. Keďže sa delafloxacín vylučuje do mlieka, závažná toxicita sa pozorovala u novorodencov
potkanov počas laktácie, keď boli matky liečené počas gravidity a laktácie delafloxacínom pri dávkach spôsobujúcich systémovú expozíciu asi 5-násobne vyššiu ako expozícia u ľudí. Žiadne také účinky
a žiadne iné vývojové abnormality sa však neobjavili v potomstve matiek s expozíciou hladín asi 2-
násobne vyšších ako sú hladiny u ľudí. Žiadne účinky na fertilitu samcov a samíc potkanov sa nezaznamenali pri hladinách expozície asi 5-násobne vyšších ako sú hladiny pozorované u ľudí.
Nevykonali sa dlhodobé štúdie karcinogenicity s delafloxacínom.
Neidentifikovalo sa žiadne riziko genotoxicity in vitro a bolo in vivo negatívne pri najvyššej možnej dávke ≥ 15-násobne vyššej ako je odhadovaná plazmatická expozícia u ľudí vychádzajúca z hodnoty AUC.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Mikrokryštalická celulóza
Povidón Krospovidón Hydrogenuhličitan sodný
Dihydrogenfosforečnan sodný, monohydrát
Kyselina citrónová
Stearan horečnatý
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie. Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Viacvrstvové hliník/hliníková fólia blistre s jednotlivými dávkami. Veľkosti balenia: 10 x1, 20 x1, 30 x1, 50 x1, 60 x1 or 100 x1 tabliet. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIA. Menarini – Industrie Farmaceutiche Riunite
Via Sette Santi 3, 50131 Florencia, Taliansko
8. REGISTRAČNÉ ČÍSLOEU/1/19/1393/002-007
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.