d width="123"> 4 – 6 rokov
0,3 – 0,8
| 150 – 400
| 1,2 – 3,2
| 600 – 1 600
| 24 – 30
| 7 – 9 rokov
| 0,4 – 1,0
| 200 – 500
| 1,6 – 4,0
| 800 – 2 000
|
31 – 45
| 10 – 12 rokov
| 0,5 – 1,4
| 250 – 700
| 2,0 – 5,6
| 1 000 – 2 800
|
46 – 53
| 13 – 14 rokov
| 0,8 – 1,8
| 400 – 900
| 3,2 – 7,2
| 1 600 – 3 600
|
> 53
| ≥ 15 rokov
| 1,0 – 2,0*
| 500 – 1 000*
| 4,0 – 8,0*
| 2 000 – 4 000*
|
*
) V prípade potreby môže byť jednorazová dávka zvýšená na 5 ml (čo zodpovedá 2 500 mg metamizolu) a denná dávka na 10 ml (čo zodpovedá 5 000 mg metamizolu).
Metamizol Krka injekčný/ infúzny roztok sa neodporúča pre dojčatá mladšie ako 3 mesiace. Dostupné sú aj iné liekové formy, ktoré je možné vhodne dávkovať u detí mladších ako 3 mesiace.
Trvanie liečbyTrvanie liečby závisí od typu a závažnosti ochorenia. Počas dlhodobej liečby Metamizolom Krka sa majú vykonávať pravidelné krvné testy vrátane diferenciálneho krvného obrazu.
Osobitné skupiny pacientovStarší pacienti, pacienti so zlým celkovým zdravotným stavom a pacienti so zníženým klírensom kreatinínuU starších pacientov, pacientov so zlým celkovým zdravotným stavom a pacientov so zníženým klírensom kreatinínu, má byť dávka znížená, pretože eliminácia metabolitov metamizolu môže byť predĺžená.
Pacienti s poruchou funkcie pečene a obličiekKeďže rýchlosť eliminácie je pri poruche funkcie obličiek alebo pečene znížená, je potrebné sa vyhnúť viacnásobným vysokým dávkam. Pri krátkodobom používaní nie je potrebná redukcia dávky. V súčasnosti nie sú dostatočné skúsenosti s dlhodobým používaním metamizolu u pacientov so závažnou poruchou funkcie pečene a obličiek.
Spôsob podávaniaMetamizol Krka sa podáva intravenózne alebo intramuskulárne.
Na intramuskulárne injekcie sa má vždy používať roztok telesnej teploty.
Bezpečnostné opatrenia, ktoré sa majú prijať pri podávaní liekuAk sa podáva jednorazová dávka viac ako 2 ml Metamizolu Krka (čo zodpovedá 1 000 mg monohydrátu sodnej soli metamizolu), je potrebná prísna indikácia a osobitná starostlivosť, pretože existuje podozrenie, že kritický pokles krvného tlaku nealergického pôvodu je závislý od dávky.
Pri parenterálnom podaní Metamizolu Krka musí pacient ležať a musí byť pod prísnym lekárskym dohľadom.
Aby sa minimalizovalo riziko hypotenznej reakcie a aby sa zabezpečilo, že injekcia sa môže prerušiť pri prvých príznakoch anafylaktickej/ anafylaktoidnej reakcie, má sa intravenózna injekcia podať veľmi pomaly, t.j. nie rýchlejšie ako 1 ml (500 mg monohydrátu sodnej soli metamizolu) za minútu.
4.3 Kontraindikácie- Precitlivenosť na liečivo alebo iné pyrazolóny alebo pyrazolidíny (zahŕňa aj pacientov, ktorí mali, napr. agranulocytózu po podaní niektorej z týchto látok) alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1,
- Pacienti so známym syndrómom analgetickej astmy alebo so známou analgetickou intoleranciou typu urtikária-angioedém, t.j. pacienti so známym výskytom bronchospazmu alebo iných anafylaktoidných reakcií (napr. urtikáriou, rinitídou, angioedémom) po podaní salicylátov, paracetamolu alebo iných nenarkotických analgetík, napr. diklofenaku, ibuprofénu, indometacínu alebo naproxénu,
- zhoršená funkcia kostnej drene (napr. po liečbe cytostatikami) alebo porucha hematopoézy,
- vrodený deficit glukózo-6-fosfátdehydrogenázy (riziko hemolýzy),
- akútna intermitentná hepatálna porfýria (riziko spustenia atakov porfýrie),
- tretí trimester tehotenstva (pozri časť 4.6),
- existujúca hypotenzia a nestabilná hemodynamika.
4.4 Osobitné upozornenia a opatrenia pri používaníMetamizol Krka obsahuje derivát metamizolu pyrazolón a je spojený so zriedkavým, ale život ohrozujúcim rizikom šoku a agranulocytózy (pozri časť 4.8).
Pacienti, u ktorých sa vyskytnú anafylaktoidné reakcie s Metamizolom Krka, sú tiež vystavení osobitnému riziku výskytu podobných reakcií s inými nenarkotickými analgetikami.
Pacienti, u ktorých sa vyskytne anafylaktická reakcia alebo iná imunologicky sprostredkovaná reakcia (napr. agranulocytóza) s Metamizolom Krka, sú tiež vystavení osobitnému riziku výskytu podobných reakcií s inými pyrazolónmi a pyrazolidínmi.
U pacientov, u ktorých sa vyskytne anafylaktická reakcia alebo iná imunologicky sprostredkovaná reakcia s inými pyrazolónmi, pyrazolidínmi alebo inými nenarkotickými analgetikami, je tiež vysoké riziko výskytu podobných reakcií s Metamizolom Krka.
AgranulocytózaV prípade neutropénie (< 1 500 neutrofilov/mm
3) sa liečba musí okamžite ukončiť a urgentne skontrolovať celkový krvný obraz a monitorovať, kým sa hodnoty nevrátia do normálu.
Každému pacientovi musí byť odporučené ukončenie liečby a okamžite sa poradiť s lekárom, ak sa prejaví u neho niektorý z týchto prejavov alebo príznakov: neočakávané zhoršenie celkového stavu (ako horúčka, zimnica, bolesť hrdla, problémy s prehĺtaním), pretrvávajúce alebo opakujúce sa horúčky a bolestivé zmeny slizníc, najmä v ústach, nose a hrdle alebo v oblasti genitálií alebo análneho otvoru.
Použitie Metamizolu Krka sa musí okamžite prerušiť a musí sa monitorovať krvný obraz (vrátane diferenciálneho krvného obrazu). Liečba sa musí ukončiť ešte predtým, ako budú k dispozícii výsledky laboratórnych testov (pozri časť 4.8).
TrombocytopéniaAk sa vyskytnú prejavy trombocytopénie, ako je zvýšená tendencia ku krvácaniu a petechie na koži a slizniciach (pozri časť 4.8), musí sa použitie Metamizolu Krka okamžite zastaviť a musí sa monitorovať krvný obraz (vrátane diferenciálneho krvného obrazu). Liečba sa musí ukončiť ešte predtým, ako budú k dispozícii výsledky laboratórnych testov.
PancytopéniaV prípade výskytu pancytopénie sa liečba musí ihneď prerušiť a musí sa sledovať kompletný krvný obraz, pokiaľ sa neupraví na normálne hodnoty (pozri časť 4.8).
Pacienti musia byť upozornení, aby okamžite vyhľadali lekársku pomoc, ak sa u nich počas liečby objavia znaky alebo prejavy naznačujúce poruchy krvotvorby (napr. malátnosť, infekcie, pretrvávajúca horúčka, tvorba modrín, krvácanie, bledosť).
Anafylaktické/ anafylaktoidné reakciePri výbere spôsobu podania treba vziať do úvahy, že parenterálne podanie Metamizolu Krka sa spája s vyšším rizikom anafylaktických a anafylaktoidných reakcií (pozri časť 4.2, „Bezpečnostné opatrenia, ktoré sa majú prijať pri podávaní lieku”).
Riziko výskytu možných ťažkých anafylaktoidných reakcií na Metamizol Krka je výrazne zvýšené u pacientov s:
- astmou indukovanou analgetikami alebo s intoleranciou analgetík typu urtikária-angioedém (pozri časť 4.3)
- bronchiálnou astmou, najmä so sprievodnou rinosinusitídou a nosovými polypmi
- chronickou urtikáriou
- intoleranciou farbív (napr. tartrazín) alebo konzervačných prostriedkov (napr. benzoátov)
- intoleranciou alkoholu. Títo pacienti reagujú aj na malé množstvá alkoholických nápojov kýchaním, slzením a výrazným sčervenaním tváre. Intolerancia alkoholu môže byť ukazovateľom syndrómu predtým nediagnostikovanej alergickej analgetickej astmy (pozri časť 4.3).
Anafylaktický šok sa môže vyskytnúť predovšetkým u citlivých pacientov. Preto je potrebná osobitná opatrnosť pri použití u pacientov s astmou alebo atopiou.
Pred podaním Metamizolu Krka treba urobiť anamnézu pacienta. Pacientom so zvýšeným rizikom anafylaktoidných reakcií, možno podať Metamizol Krka len po starostlivom zvážení pomeru možného rizika a očakávaného účinku (pozri časť 4.3). Ak sa v takýchto prípadoch podá Metamizol Krka, vyžaduje sa prísny lekársky dohľad a musia byť zabezpečené prostriedky na poskytnutie okamžitej pomoci v prípade ohrozenia pacienta.
Závažné kožné reakcieV súvislosti s používaním metamizolu boli hlásené život ohrozujúce kožné reakcie – Stevensov-Johnsonov syndróm (SJS) a toxická epidermálna nekrolýza (TEN). Ak sa objavia prejavy alebo príznaky SJS alebo TEN (napr. progresívna kožná vyrážka často s pľuzgiermi alebo léziami na slizniciach), liečba metamizolom sa musí ihneď prerušiť a nesmie sa v nej opätovne pokračovať. Pacienti musia byť poučení o prejavoch a príznakoch a musia byť pozorne sledované ich kožné reakcie, obzvlášť počas prvých týždňov liečby.
Ojedinelé hypotenzívne reakciePodanie metamizolu môže spôsobiť ojedinelé hypotenzívne reakcie (pozri tiež časť 4.8). Tieto reakcie pravdepodobne závisia od dávky. Častejšie sa vyskytujú pri parenterálnom podaní, ako pri enterálnom podaní.
Riziko takýchto reakcií je zvýšené aj:
- ak sa intravenózna injekcia podáva príliš rýchlo (pozri časť 4.2),
- u pacientov s predchádzajúcou hypotenziou, s objemovou stratou alebo dehydratáciou, s nestabilným obehom alebo so začiatočným zlyhávaním obehu (napr. u pacientov s infarktom myokardu alebo polytraumou),
- u pacientov s vysokou horúčkou.
U týchto pacientov treba zvlášť opatrne stanoviť indikáciu a vyžaduje sa prísny lekársky dohľad. Preventívne opatrenia (napr. stabilizácia obehu) môžu byť potrebné na zníženie rizika hypotenzívnych reakcií.
Metamizol Krka sa môže podávať, iba ak sú hemodynamické parametre starostlivo monitorované u pacientov, u ktorých je potrebné sa vyhnúť zníženiu krvného tlaku, napr. pacientov so závažným koronárnym ochorením srdca alebo so súvisiacou cerebrovaskulárnou stenózou.
Metamizol Krka sa má používať iba po starostlivom zvážení pomeru prínosu a rizika a iba vtedy, ak sa u pacientov s poruchou funkcioe obličiek alebo pečene prijmú vhodné opatrenia (pozri časť 4.2).
Tento liek obsahuje 32,7 mg sodíka v jednom ml injekčného/ infúzneho roztoku, čo zodpovedá 1,635 % WHO odporúčaného maximálneho denného príjmu 2 g sodíka pre dospelú osobu.
Účinky na laboratórne testyU pacientov liečených metamizolom boli hlásené interferencie s diagnostickými laboratórnymi testami, ktoré používajú Trinderovu reakciu alebo reakcie podobné Trinderovej (napr. testy na kreatinín, triglyceridy, HDL-cholesterol alebo kyselinu močovú v sére).
4.5 Liekové a iné interakcieMetamizol môže spôsobiť pokles sérovej hladiny cyklosporínu. Pri súbežnom podávaní s metamizolom treba tieto hladiny sledovať.
Súbežné podávanie metamizolu a chlórpromazínu môže viesť k ťažkej hypotermii.
Súbežná liečba metamizolu s metotrexátom môže zvýšiť hematotoxicitu metotrexátu, najmä u starších pacientov. Preto je potrebné sa tejto kombinácii vyhnúť.
Ak je metamizol užívaný súbežne s kyselinou acetylsalicylovou, môže znížiť jej účinok na agregáciu krvných doštičiek. Pacientom, ktorí užívajú na ochranu srdca nízke dávky kyseliny acetylsalicylovej, musí byť preto metamizol podávaný s opatrnosťou.
Metamizol môže znížiť koncentráciu bupropiónu v krvi. Preto je pri súbežnom podávaní metamizolu a bupropiónu potrebná opatrnosť.
Je známe, že liečivá z triedy pyrazolónov spôsobujú interakcie s perorálnymi antikoagulanciami, kaptoprilom, lítiom a triamterénom a majú vplyv na účinnosť antihypertenzív a diuretík. Nebolo dokázané, do akej miery tieto interakcie spôsobuje aj metamizol.
4.6 Fertilita, gravidita a laktáciaGraviditaDostupné sú len obmedzené údaje o použití metamizolu u gravidných žien.
Na základe publikovaných údajov o gravidných ženách vystavených metamizolu počas prvého trimestra (n=568) nebol zistený žiaden dôkaz teratogénnych alebo embryotoxických účinkov. Vo vybraných prípadoch môžu byť jednorazové dávky metamizolu počas prvého a druhého trimestra prípustné, ak neexistujú žiadne ďalšie možnosti liečby. Avšak, vo všeobecnosti sa použitie metamizolu počas prvého a druhého trimestra neodporúča. Použitie počas tretieho trimestra je spojené s fetotoxicitou (porucha funkcie obličiek a predčasné uzavretie
ductus arteriosus) a preto je použitie metamizolu počas tretieho trimestra tehotenstva kontraindikované (pozri časť 4.3). V prípade neúmyselného použitia metamizolu počas tretieho trimestra má byť plodová tekutina a
ductus arteriosus kontrolovaný ultrazvukom a echokardiografiou.
Hoci metamizol je iba slabým inhibítorom syntézy prostaglandínov, nie je možné vylúčiť možnosť perinatálnych komplikácií v dôsledku zníženia agregácie krvných doštičiek u matky a dieťaťa.
Metamizol prechádza plancentárnou bariérou.
U zvierat metamizol indukoval reprodukčnú toxicitu ale nie teratogenitu (pozri časť 5.3).
Dojčenie
Produkty rozkladu metamizolu prechádzajú do materského mlieka vo veľkom množstve a riziko pre dojčené dieťa nie je možné vylúčiť. Zvlášť je potrebné zabrániť opakovanému použitiu metamizolu počas dojčenia. V prípade jednorazového podania metamizolu sa odporúča matkám, aby zbierali materské mlieko 48 hodín po podaní dávky a zlikvidovali ho.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeV odporúčanom dávkovacom rozsahu nie je známe žiadne ovplyvnenie koncentrácie a reakčnej schopnosti. Avšak pri vyššom dávkovaní treba pre istotu zobrať do úvahy možnosť takého ovplyvnenia a vyhnúť sa obsluhovaniu strojov, vedeniu vozidiel alebo iným rizikovým činnostiam. Platí to najmä po požití alkoholu.
4.8 Nežiaduce účinkyFrekvencie uvedené nižšie boli stanovené podľa nasledujúcej konvencie:
- Veľmi časté (³ 1/10)
- Časté (³ 1/100 až < 1/10)
- Menej časté (³ 1/1 000 až < 1/100)
- Zriedkavé (³ 1/10 000 až < 1/1 000)
- Veľmi zriedkavé (< 1/10 000)
- Neznáme (nedá sa odhadnúť z dostupných údajov)
| Menej časté
| Zriedkavé
| Veľmi zriedkavé
| Neznáme
|
Poruchy krvi a lymfatického systému *1
|
| Leukopénia.
| Agranulocytóza, vrátane fatálnych prípadov, trombocytopénia.
| Aplastická anémia, pancytopénia, vrátane fatálnych prípadov.
|
Poruchy imunitného systému *3
|
| Anafylaktoidné alebo anafylaktické reakcie*.
| Analgetikami vyvolaný astmatický syndróm.
U pacientov s analgetickým astmatickým syndrómom majú zvyčajne reakcie intolerancie formu astmatických záchvatov.
| Anafylaktický šok*2
|
Poruchy srdca a srdcovej činnosti
|
|
|
| Kounisov syndróm
|
Poruchy ciev
| Hypotenzívne reakcie počas alebo po podaní, ktoré môžu mať farmakologický pôvod a nie sú sprevádzané inými prejavmi anafylaktoidnej alebo anafylaktickej reakcie. Taká reakcia môže viesť k výraznému poklesu krvného tlaku. Rýchla intravenózna injekcia zvyšuje riziko hypotenzívnej reakcie.*4
|
|
|
|
Poruchy gastrointestinálneho traktu
|
|
|
| Boli hlásené prípady gastrointestinálneho krvácania.
|
Poruchy kože a podkožného tkaniva
| Fixný liekový exantém.
| Vyrážka (napr. makulopapulárny exantém).
| Stevensov-Johnsonov syndróm alebo toxická epidermálna nekrolýza (liečba sa musí prerušiť, pozri časť 4.4).
|
|
Poruchy obličiek a močových ciest
|
|
| Akútne zhoršenie funkcie obličiek (proteinúria, oligúria, anúria alebo akútne zlyhanie obličiek sa môže vyskytnúť veľmi zriedkavo), akútna intersticiálna nefritída.
|
|
Celkové poruchy a reakcie v mieste aplikácie
|
|
| Bolesť a lokálne reakcie sa môžu vyskytnúť v mieste podania, veľmi zriedkavo vo forme flebitídy. Môže sa vyskytnúť červené sfarbenie moču, čo môže spôsobiť neškodný metabolit metamizolu kyselina rubazónová, ktorá je prítomná v nízkych koncentráciách.
|
|
*
1 Tieto reakcie sa môžu vyskytnúť aj vtedy, keď predchádzajúce podávanie metamizolu bolo bez komplikácií. Existujú izolované indikácie, že riziko agranulocytózy sa môže zvýšiť, ak sa metamizol podáva dlhšie ako jeden týždeň. Táto reakcia nie je závislá od dávky a môže sa vyskytnúť kedykoľvek počas liečby. Vyznačuje sa vysokou horúčkou, zimnicou, bolesťou hrdla, ťažkosťami pri prehĺtaní a zápalom v oblasti ústnej dutiny, nosovej dutiny, hltana alebo análneho otvoru. U pacientov liečených antibiotikami môžu byť tieto prejavy minimálne. Existuje len malý alebo žiadny opuch lymfatických uzlín alebo sleziny. Rýchlosť sedimentácie sa výrazne zrýchli, granulocyty sa značne znížia alebo úplne chýbajú. Množstvo hemoglobínu, erytrocytov a krvných doštičiek je vo všeobecnosti, nie však vždy, normálne (pozri časť 4.4). Okamžité prerušenie podávania je nevyhnutné na zotavenie. Preto sa dôrazne odporúča okamžite prerušiť podávanie Metamizolu Krka bez čakania na výsledky laboratórnych diagnostických testov, ak dôjde k neočakávanému zhoršeniu celkového stavu, horúčka nezmizne alebo sa znovu objaví, alebo sa objavia bolestivé lézie na sliznici, najmä v oblasti ústnej dutiny, nosovej dutiny a hltanu. Ak sa objaví pancytopénia, liečba sa musí okamžite prerušiť a má sa sledovať celkový krvný obraz, až kým sa normalizuje (pozri časť 4.4).
*
2 Takéto reakcie na lieky sa môžu vyskytnúť počas injekcie, okamžite po podaní alebo sa môžu objaviť aj niekoľko hodín po podaní. Vo väčšine prípadov sa však vyskytujú počas prvej hodiny po podaní. Miernejšie reakcie majú zvyčajne formu kožných a mukozálnych reakcií (napríklad svrbenie, pocit pálenia, sčervenanie, žihľavka, opuch), dýchavice a zriedkavo gastrointestinálnych ťažkostí. Takéto mierne reakcie sa môžu zhoršiť pri generalizovanej urtikárii, ťažkom angioedéme (vrátane edému hrtanu), ťažkom bronchospazme, srdcových arytmiách, poklese krvného tlaku (niekedy tiež s predchádzajúcim zvýšením krvného tlaku) a obehovom šoku. Ak sa vyskytnú kožné reakcie, používanie Metamizolu Krka sa musí okamžite ukončiť.
*
3 Tieto reakcie môžu byť závažné a život ohrozujúce, najmä po parenterálnom podaní a niekedy až smrteľné. Môžu sa vyskytnúť aj vtedy, keď predchádzajúce podávanie metamizolu bolo bez komplikácií.
*
4 Pri hyperpyrexii sa môže vyskytnúť kritický pokles krvného tlaku závislý od dávky, bez ďalších ukazovateľov reakcie z precitlivenosti.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.'
4.9 PredávkovaniePríznakyNauzea, vracanie, bolesť brucha, poškodenie obličiek / akútne zlyhávanie obličiek (napr. vo forme intersticiálnej nefritídy) a zriedkavejšie príznaky centrálneho nervového systému (závrat, somnolencia, kóma, kŕče) a pokles krvného tlaku, ktorý môže postupovať v súvislosti s akútnym predávkovaním a vedie k šoku a tachykardii.
Po veľmi vysokých dávkach môže vylučovanie kyseliny rubazónovej spôsobiť červené sfarbenie moču.
LiečbaPre metamizol nie je známe žiadne špecifické antidotum. Ak bol príjem metamizolu nedávno, môžu sa vyskúšať primárne detoxikačné opatrenia (napr. výplach žalúdka) na zníženie absorpcie do tela alebo opatrenia na zníženie jeho absorpcie (podávanie aktívneho uhlia). Hlavný metabolit (4-N-metylaminoantipyrín) sa môže eliminovať hemodialýzou, hemofiltráciou, hemoperfúziou alebo plazmovou filtráciou.
Liečba intoxikácie a prevencia závažných komplikácií si môže vyžadovať všeobecné a špecifické intenzívne monitorovanie a liečbu.
Okamžité opatrenia, ak sa vyskytnú závažné reakcie z precitlivenosti (šok)Pri prvých prejavoch precitlivenosti (napr. kožné reakcie, ako je žihľavka a návaly horúčavy, nepokoj, bolesť hlavy, potenie, nevoľnosť) sa musí injekcia zastaviť. Kanyla sa má ponechať v žile alebo sa má vytvoriť prístup do žily. Okrem bežných núdzových opatrení, ako je napríklad Trendelenburgova poloha, udržiavanie priechodnosti dýchacích ciest, podávanie kyslíka, môže byť potrebné podať sympatomimetiká, objem alebo glukokortikoidy.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Analgetiká, iné analgetiká a antipyretiká, pyrazolóny
ATC kód: N02BB02.
Metamizol je pyrazolónový derivát s analgetickými, antipyretickými a spazmolytickými vlastnosťami. Mechanizmus účinku nie je úplne objasnený. Niektoré výsledky štúdií ukazujú, že metamizol a jeho hlavný metabolit (4-N-metylaminoantipyrín) môžu mať kombinovaný centrálny a periférny spôsob účinku.
5.2 Farmakokinetické vlastnostiPo perorálnom podaní sa metamizol úplne hydrolyzuje na farmakologicky aktívny 4-N-metylaminoantipyrín (MAA). Biologická dostupnosť MAA je okolo 90% a po perorálnom podaní je o niečo vyššia ako po parenterálnom podaní. Súbežné požitie potravy nemá významný vplyv na kinetiku metamizolu.
Hlavný metabolit metamizolu, MAA, je ďalej metabolizovaný v pečeni oxidáciou a demetyláciou, po ktorej nasleduje acetylácia.
Najmä MAA, a do určitej miery aj 4-aminoantipyrín (AA), prispievajú ku klinickému účinku. Hodnoty AUC pre AA tvoria asi 25 % AUC pre MAA. Metabolity 4-N-acetylaminoantipyrín (AAA) a N-4-formylaminoantipyrín (FAA) nemajú žiadny klinický účinok.
Farmakokinetika všetkých metabolitov je nelineárna. Na zhodnotenie klinického významu tohto zistenia sú potrebné ďalšie štúdie. Akumulácia metabolitov pri krátkodobej liečbe nie je významná.
Metamizol prechádza placentárnou bariérou. Metabolity metamizolu prechádzajú do materského mlieka.
Stupeň väzby na proteíny je 58 % pre MAA, 48 % pre AA, 18 % pre FAA a 14 % pre AAA.
Po intravenóznom podaní je polčas metamizolu okolo 14 minút. Približne 96 % intravenóznej dávky označenej rádioizotopom sa vylúčilo v moči a asi 6 % v stolici.
Po jednorazovej perorálnej dávke bolo identifikovaných 85% metabolitov vylúčených močom. Z toho MAA predstavovala 3 ± 1%, AA 6 + 3%, AAA 26 ± 8% a FAA 23 ± 4%. Renálny klírens po jednorazovej perorálnej dávke 1 g metamizolu bol 5 ± 2 ml / min pre MAA, 38 ± 13 ml / min pre AA, 61 ± 8 ml / min pre AAA a 49 ± 5 ml / min pre FAA. Súvisiace plazmatické polčasy boli 2,7 ± 0,5 hodiny pre MAA, 3,7 ± 1,3 hodiny pre AA, 9,5 ± 1,5 hodiny pre AAA a 11,2 ± 1,5 hodiny pre FAA.
Starší pacienti a pacienti s poruchou funkcie pečene U starších pacientov sa expozícia (AUC) zvýšila na dvoj- až trojnásobok. U pacientov s cirhózou pečene sa polčas MAA a FAA po jednorazovej perorálnej dávke zvýšil 3-krát, zatiaľ čo u AA a AAA nebol nárast zaznamenaný. U týchto pacientov sa treba vyhnúť vysokým dávkam.
Porucha funkcie obličiekDostupné údaje o pacientoch s poruchou funkcie obličiek naznačujú zníženie eliminácie niektorých metabolitov (AAA a FAA). U týchto pacientov sa treba vyhnúť vysokým dávkam.
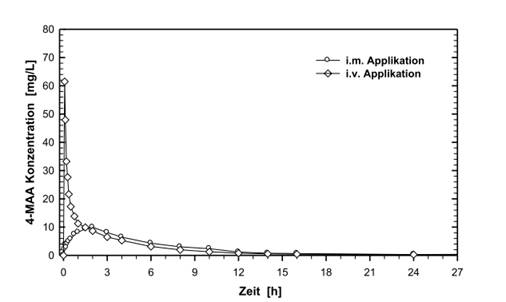
BiodostupnosťVýsledky 4-MAA zo štúdie biologickej dostupnosti uskutočnenej v roku 1989 u 12 subjektov s roztokom i.m. v porovnaní s referenčným produktom (intravenózne podanie v priebehu 2 minút) boli nasledujúce:
| IM podanie
(1 g)
| IV podanie
(1 g)
|
Maximálna plazmatická koncentrácia (Cmax) [mg/l]
Čas na dosiahnutie maximálnej plazmatickej koncentrácie (tmax) [h]
Plocha pod krivkou závislosti koncentrácie od času (AUC) [mg x h/l]
(hodnoty uvedené ako stredná a smerodajná odchýlka)
| 11,4 ± 3,12
1,67 ± 0,69
64,1 ± 14,8
| 62,1 ± 15,9
0,009 ± 0,02
67,8 ± 16,1
|
Absolútna biologická dostupnosť roztoku IM meraná ako AUC 4-MAA v plazme je 87%.
Priemerné profily hladín v plazme v porovnaní s referenčným produktom na grafe závislosti koncentrácie od času:
![Text Box: Koncentrácia 4-MAA [mg/l]](PublicData/Liekinfo/Spc/13838_files/image001.png)
 Pediatrická populácia
Pediatrická populáciaDeti vykazujú rýchlejšiu elimináciu metabolitov ako dospelí.
5.3 Predklinické údaje o bezpečnostiSubchronická/chronická toxicitaŠtúdie subchronickej a chronickej toxicity sa uskutočnili na rôznych druhoch. Potkanom sa perorálne podávalo 100 až 900 mg metamizolu na kg telesnej hmotnosti počas 6 mesiacov. Pri najvyššej dávke (900 mg na kg telesnej hmotnosti) sa po 13 týždňoch pozorovalo zvýšenie počtu retikulocytov a Heinzových teliesok.
Psi dostávali metamizol v denných dávkach 30 až 600 mg na kg telesnej hmotnosti po dobu 6 mesiacov. Hemolytická anémia a funkčné obličkové a pečeňové zmeny sa pozorovali v závislosti od dávky pri dávkach 300 mg na kg telesnej hmotnosti a viac.
Mutagénny a karcinogénny potenciálProtichodné výsledky sa získali pri metamizole pri
in vitro a
in vivo skúškach mutagenity.
V dlhodobých štúdiách na potkanoch sa nepreukázal tumorogénny potenciál. V dvoch z troch dlhodobých štúdií na myšiach sa pozoroval zvýšený výskyt hepatocelulárnych adenómov pri vysokých dávkach.
Reprodukčná toxicitaŠtúdie na potkanoch a králikoch nepreukázali žiadny teratogénny potenciál.
Embryoletálne účinky sa pozorovali u králikov pri dennej dávke 100 mg na kg telesnej hmotnosti, ktorá ešte nebola toxická pre matku. U potkanov sa embryoletálne účinky vyskytli pri dávkach toxických pre matku. Denné dávky nad 100 mg na kg telesnej hmotnosti u potkanov viedli k predĺženiu gravidných a pôrodných komplikácií so zvýšenou úmrtnosťou matiek a potomkov.
Testy plodnosti ukázali mierne zníženú rýchlosť tehotenstva u rodičovskej generácie pri dennej dávke nad 250 mg na kg telesnej hmotnosti. Plodnosť generácie F1 nebola ovplyvnená.
Metabolity metamizolu sa vylučujú do materského mlieka. Nie sú žiadne skúsenosti týkajúce sa účinkov na dojčatá.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokVoda na injekcie
6.2 InkompatibilityTento liek sa nesmie miešať s inými liekmi, okrem liekov uvedených v časti 6.6.
6.3 Čas použiteľnosti2 roky
Po prvom otvorení a/alebo rozriedení sa liek musí použiť okamžite.
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne špeciálne teplotné podmienky na uchovávanie.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pre podmienky na uchovávanie po prvom otvorení a/alebo rozriedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaAmpulka označená s bielym bodom, žltým a červeným kruhom (jantárové sklo, Ph. Eur. typ I): 5, 10, 20, 25, 50 alebo 100 ampuliek s 2 ml injekčného/ infúzneho roztoku, zabalených do blistra (PVC//Al) v škatuľke.
Ampulka označená s bielym bodom a žltým kruhom (jantárové sklo, Ph. Eur. typ I): 5, 10, 20, 25, 50 alebo 100 ampuliek s 5 ml injekčného/ infúzneho roztoku, zabalených do blistra (PVC//Al) v škatuľke.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomMetamizol Krka sa môže miešať alebo riediť s roztokom glukózy 50 mg/ml (5%), roztokom NaCl 9 mg/ml (0,9%), Ringerovým laktátom alebo Ringerovým roztokom.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. Držiteľ rozhodnutia o registráciiKRKA, d.d., Novo mesto
Šmarješka cesta 6
8501 Novo mesto
Slovinsko
8. Registračné čísloReg.č.: 07/0030/20-S
9. Dátum PRVEJ registrácie/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. Dátum revízie textu02/2020