
ónu obsiahnutých v kombinovanej perorálnej antikoncepcii (pozri časť 5.2). Na základe
tejto farmakokinetickej štúdie sa neočakáva, že by ambrisentan významne ovplyvnil expozíciu
antikoncepcii založenej na estrogénoch alebo progestagéne.
Warfarín
V štúdii u zdravých dobrovoľníkov nemal ambrisentan žiadny vplyv na rovnovážne farmakokinetické
parametre a antikoagulačný účinok warfarínu (pozri časť 5.2). Warfarín taktiež nemal klinicky
významný vplyv na farmakokinetiku ambrisentanu. Ambrisentan okrem toho nemal u pacientov žiadny celkový vplyv na týždennú dávku antikoagulancia warfarínového typu, na protrombínový čas (Pothrombin Time, PT) a medzinárodný normalizovaný pomer (International Normalized Ratio, INR).
Ketokonazol
Podávanie ketokonazolu (silný inhibítor CYP3A4) v rovnovážnom stave neviedlo ku klinicky
významnému zvýšeniu expozície ambrisentanu (pozri časť 5.2).
Vplyv ambrisentanu na transportéry xenobiotík
Ambrisentan v klinicky významných koncentráciách nemá in vitro inhibičný vplyv na ľudské
transportéry vrátane P•glykoproteínu (Pgp), proteínu zodpovedného za rezistenciu pri rakovine prsníka
(breast cancer resistance protein, BCRP), proteínu 2 súvisiaceho s mnohopočetnou liekovou
rezistenciou (multi-drug resistance related protein 2, MRP2), transportnej pumpy solí žlčových kyselín (bile salt export pump, BSEP), transportných polypeptidov organických aniónov (organic anion transporting polypeptides, OATP1B1 a OATP1B3) a kontransportného polypeptidu sodíka
a taurocholátu (sodium-dependent taurocholate co-transporting polypeptide, NTCP).
Ambrisentan je substrát pre Pgp-sprostredkovaný eflux.
Štúdie in vitro na potkaních hepatocytoch taktiež ukázali, že ambrisentan neindukoval expresiu
proteínov Pgp, BSEP alebo MRP2.
Ambrisentan v rovnovážnom stave podávaný zdravým dobrovoľníkom nemal klinicky významný vplyv na farmakokinetiku jednorazovej dávky digoxínu, substrátu pre Pgp (pozri časť 5.2).
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnom veku
Liečba ambrisentanom sa nesmie začať u žien vo fertilnom veku, pokiaľ výsledok tehotenského testu
pred začiatkom liečby nie je negatívny a pokiaľ nepoužívajú spoľahlivú antikoncepciu. Počas liečby ambrisentanom sa odporúča vykonávať tehotenské testy v mesačných intervaloch.
Gravidita
Ambrisentan je kontraindikovaný počas gravidity (pozri časť 4.3). Štúdie na zvieratách preukázali, že
ambrisentan je teratogénny. Nie sú k dispozícii skúsenosti s použitím u ľudí.
Ženy liečené ambrisentanom musia byť informované o riziku poškodenia plodu a ak dôjde k otehotneniu, má sa začať alternatívna liečba (pozri časti 4.3, 4.4 a 5.3).
Dojčenie
Nie je známe, či sa ambrisentan vylučuje do ľudského materského mlieka. Vylučovanie ambrisentanu
do mlieka sa u zvierat neskúmalo. Z tohto dôvodu je dojčenie kontraindikáciou u pacientok
užívajúcich ambrisentan(pozri časť 4.3).
Fertilita
Dlhodobé podávanie ERA, vrátane ambrisentanu, bolo u samcov spojené so vznikom atrofie
semenníkových tubulov (pozri časť 5.3). Hoci sa v štúdii ARIESE nezistili jasné dôkazy o škodlivom účinku dlhodobej expozície ambrisentanu na počet spermií, dlhodobé podávanie ambrisentanu sa spájalo so zmenami v markeroch spermatogenézy. Pozoroval sa pokles plazmatickej koncentrácie inhibínu B a zvýšenie plazmatickej koncentrácie FSH. Vplyv na mužskú fertilitu nie je známy, ale nie je možné vylúčiť zhoršenie spermatogenézy. V klinických štúdiách nebolo dlhodobé podávanie ambrisentanu spojené so zmenou plazmatických hladín testosterónu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Ambrisentan má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pri posudzovaní pacientovej schopnosti vykonávať činnosti, ktoré vyžadujú úsudok, motorické alebo kognitívne zručnosti, treba mať na pamäti klinický stav pacienta a profil nežiaducich reakcií
na ambrisentan (akými sú hypotenzia, závraty, slabosť, únava) (pozri časť 4.8). Pred vedením vozidiel
alebo obsluhou strojov majú pacienti vedieť, ako by ich ambrisentan mohol ovplyvniť.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofiluBezpečnosť ambrisentanu v monoterapii a/alebo v kombinovanej liečbe bola hodnotená v klinických
skúšaniach u viac ako 1 200 pacientov s PAH (pozri časť 5.1). Nežiaduce reakcie zistené z údajov z 12týždňových placebom kontrolovaných klinických skúšaní sú zahrnuté nižšie podľa triedy
orgánových systémov a frekvencie.
Nižšie sú zahrnuté aj informácie z dlhodobejších štúdií, ktoré neboli kontrolované placebom
(ARIES-E a AMBITION (kombinácia s tadalafilom)). Pri dlhodobej liečbe alebo pri podávaní ambrisentanu v kombinácii s tadalafilom sa nezistili žiadne predtým neznáme nežiaduce reakcie. Počas dlhodobejšieho pozorovania v nekontrolovaných štúdiách (priemerná doba pozorovania bola
79 týždňov) bol bezpečnostný profil podobný ako bezpečnostný profil pozorovaný v krátkodobých
štúdiách. Uvedené sú aj údaje získané v rámci rutinného dohľadu nad liekmi.
Najčastejšie nežiaduce reakcie pozorované pri liečbe ambrisentanom boli periférny edém, retencia tekutín a bolesť hlavy (vrátane bolesti hlavy v dôsledku sinusitídy, migrény). V krátkodobých klinických štúdiách sa liečba vyššou dávkou (10 mg) spájala s vyšším výskytom týchto nežiaducich reakcií a periférny edém bol zvyčajne závažnejší u pacientov ≥ 65 rokov (pozri časť 4.4).
Zoznam nežiaducich reakcií uvedený vtabuľkeFrekvencie sú definované ako: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000
až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) a neznáme
(z dostupných údajov). U nežiaducich reakcií súvisiacich s dávkou sa kategória frekvencie vzťahuje na vyššiu dávku ambrisentanu. Kategórie frekvencie nezohľadňujú ďalšie faktory zahŕňajúce rôznu dĺžku
štúdie, už existujúce ochorenia a východiskové charakteristiky pacientov. Kategórie frekvencie
nežiaducich reakcií priradené na základe skúseností z klinických skúšaní nemusia zobrazovať frekvenciu nežiaducich udalostí vyskytujúcu sa počas bežnej klinickej praxe. V rámci jednotlivých
skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
| Ambrisentan
(ARIES•C
a obdobie po uvedení lieku na trh)
| Ambrisentan (AMBITION a ARIES•E)
| Kombinácia
s tadalafilom
(AMBITION)
|
Poruchy krvi a lymfatického systému
|
Anémia (znížená hladina hemoglobínu, znížená hladina hematokritu)
| Časté1
| Veľmi časté
| Veľmi časté
|
|
Poruchy imunitného systému
|
Reakcie z precitlivenosti (napr.
angioedém, vyrážka, pruritus)
| Menej časté
| Časté
| Časté
|
|
Poruchy nervového systému
|
Bolesť hlavy (vrátane bolesti hlavy
v dôsledku sinusitídy, migréna)
| Veľmi časté2
| Veľmi časté
| Veľmi časté
|
Závrat
| Časté3
| Veľmi časté
| Veľmi časté
|
|
Poruchy oka
|
Rozmazané videnie, porucha zraku
| Neznáme4
| Časté
| Časté
|
|
|
A
m
brisentan
(
AR
IES•C
a obdobie po uvedení lieku
na trh)
|
A
m
brisentan (AMBITION a ARIES•E)
|
K
ombinácia
s tadalafilom
(
A
MBITION)
|
Poruchy ucha a labyrintu
|
Tinnitus
|
NR
|
NR
|
Časté
|
Náhla strata sluchu
|
NR
|
NR
|
Menej časté
|
|
Poruchy srdca a srdcovej činnosti
|
Srdcové zlyhanie
|
Časté5
|
Časté
|
Časté
|
Palpitácie
|
Časté
|
Veľmi časté
|
Veľmi časté
|
|
Poruchy ciev
|
Hypotenzia
|
Časté3
|
Časté
|
Časté
|
Návaly tepla
|
Časté
|
Časté
|
Veľmi časté
|
Synkopa
|
Menej časté3
|
Časté
|
Časté
|
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Epistaxa
|
Časté3
|
Časté
|
Časté
|
Dyspnoe
|
Časté3,6
|
Veľmi časté
|
Veľmi časté
|
Kongescia v oblasti horných dýchacích ciest (napr. kongescia nosovej sliznice, kongescia sliznice prinosových dutín), sinusitída, nazofaryngitída, rinitída
|
Časté7
|
|
|
Nazofaryngitída
|
|
Veľmi časté
|
Veľmi časté
|
Sinusitída, rinitída
|
|
Časté
|
Časté
|
Kongescia nosovej sliznice
|
|
Veľmi časté
|
Veľmi časté
|
|
Poruchy gastrointestinálneho traktu
|
Nauzea, vracanie, hnačka
|
Časté3
|
|
|
Nauzea
|
|
Veľmi časté
|
Veľmi časté
|
Vracanie
|
|
Časté
|
Veľmi časté
|
Hnačka
|
|
Veľmi časté
|
Veľmi časté
|
Bolesť brucha
|
Časté
|
Časté
|
Časté
|
Zápcha
|
Časté
|
Časté
|
Časté
|
|
Poruchy pečene a žlčových ciest
|
Poškodenie pečene (pozri časť 4.4)
|
Menej časté3,8
|
NR
|
NR
|
Autoimunitná hepatitída (pozri
časť 4.4)
|
Menej časté3,8
|
NR
|
NR
|
Zvýšené hladiny pečeňových
transamináz
|
Časté3
|
NR
|
NR
|
|
Poruchy kože a podkožného tkaniva
|
Vyrážka
|
NR
|
Časté9
|
Časté9
|
|
|
A
m
brisentan
(
AR
IES•C
a obdobie po uvedení lieku
na trh)
|
A
m
brisentan (AMBITION a ARIES•E)
|
K
ombinácia
s tadalafilom
(
A
MBITION)
|
C
elkové poruchy a reakcie v mieste podania
|
Periférny edém, retencia tekutín
|
Veľmi časté
|
Veľmi časté
|
Veľmi časté
|
Bolesť/nepríjemný pocit na hrudníku
|
Časté
|
Časté
|
Veľmi časté
|
Slabosť
|
Časté3
|
Časté
|
Časté
|
Únava
|
Časté3
|
Veľmi časté
|
Veľmi časté
|
NR – nehlásené
1 Pozri časť
„Popis vybraných nežiaducich reakcií“.
2 Frekvencia bolesti hlavy bola zvyčajne vyššia pri liečbe 10 mg dávkou ambrisentanu.
3 Údaje sa získali z obdobia sledovania počas rutinného dohľadu nad liekmi a frekvencie sú založené
na skúsenostiach z placebom kontrolovaných klinických skúšaní.
4 Údaje sa získali z obdobia sledovania počas rutinného dohľadu nad liekmi.
5 Väčšina hlásených prípadov srdcového zlyhania bola spojená s retenciou tekutín. Údaje sa získali z obdobia sledovania počas rutinného dohľadu nad liekmi, frekvencie sú založené na štatistickom
modelovaní údajov z placebom kontrolovaných klinických skúšaní.
6 Prípady zhoršujúceho sa dyspnoe nejasnej etiológie boli hlásené v krátkom čase po začatí liečby
ambrisentanom.
7 Počas liečby ambrisentanom súvisel výskyt kongescie nosovej sliznice s dávkou.
8 Počas liečby ambrisentanom boli hlásené prípady autoimunitnej hepatitídy, vrátane prípadov
exacerbácie autoimunitnej hepatitídy a poškodenia pečene.
9 Vyrážka zahŕňa erytematóznu vyrážku, generalizovanú vyrážku, papulóznu vyrážku a pruritickú
vyrážku.
Popis vybraných nežiaducich reakciíZníženákoncentráciahemoglobínuV období po uvedení lieku na trh boli hlásené prípady anémie vyžadujúcej si transfúziu krvi (pozri
časť 4.4). Frekvencia zníženej koncentrácie hemoglobínu (anémia) bola vyššia pri liečbe 10 mg
dávkou ambrisentanu. Vo všetkých 12týždňových placebom kontrolovaných klinických štúdiách
fázy 3 došlo u pacientov v skupine s ambrisentanom k zníženiu priemernej koncentrácie hemoglobínu,
ktoré bolo zistené už v 4. týždni (zníženie o 0,83 g/dl); priemerné zmeny oproti východiskovej koncentrácii sa zvyčajne stabilizovali počas nasledujúcich 8 týždňov. U celkovo 17 pacientov (6,5 %) v skupine s ambrisentanom sa koncentrácia hemoglobínu znížila o ≥ 15 % oproti východiskovej koncentrácii a klesla pod dolnú hranicu referenčného rozpätia.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieU pacientov s PAH nie sú skúsenosti s podávaním ambrisentanu v denných dávkach vyšších ako
10 mg. U zdravých dobrovoľníkov bolo podanie jednorazovej dávky 50 a 100 mg (5 až 10násobok
maximálnej odporúčanej dávky) spojené s bolesťou hlavy, návalmi tepla, závratmi, nauzeou
a kongesciou nosovej sliznice.
Vzhľadom na mechanizmus účinku by predávkovanie ambrisentanom mohlo potenciálne spôsobiť hypotenziu (pozri časť 5.3). V prípade výraznej hypotenzie môže byť potrebná aktívna kardiovaskulárna podpora. Nie je k dispozícii špecifické antidotum.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antihypertenzíva, iné antihypertenzíva, ATC kód: C02KX02
Mechanizmus účinku
Ambrisentan je perorálne účinný derivát kyseliny propiónovej a ERA so selektivitou pre receptor pre
endotelín A (ETA). Endotelín má významnú úlohu v patofyziológii PAH.
Ambrisentan je účinný (Ki 0,016 nM) a vysoko selektívny antagonista ETA (približne 4 000•násobne
selektívnejší pre ETA ako pre ETB).
Ambrisentan blokuje ETA receptorový podtyp, ktorý sa nachádza predovšetkým na bunkách hladkého
svalstva ciev a srdcových myocytoch. To zabraňuje endotelínom sprostredkovanej aktivácii sekundárnych signálnych systémov, čo má za následok vazokonstrikciu a proliferáciu buniek hladkého svalstva.
Očakáva sa, že vďaka selektivite ambrisentanu pre ETA receptor a nie pre ETB receptor sa zachová
ETB receptorom sprostredkovaná tvorba vazodilatačných látok, oxidu dusnatého a prostacyklínu.
Klinická účinnosť abezpečnosť
Boli vykonané dve randomizované, dvojito zaslepené, multicentrické, placebom kontrolované pivotné
štúdie fázy 3 (ARIES•1 a 2). Štúdia ARIES1 zahŕňala 201 pacientov a porovnala 5 mg a 10 mg dávku ambrisentanu s placebom. Štúdia ARIES2 zahŕňala 192 pacientov a porovnala 2,5 mg a 5 mg dávku
ambrisentanu s placebom. V oboch štúdiách bol ambrisentan pridaný k podpornému/základnému lieku
pacientov, čo mohlo zahŕňať podávanie v kombinácii s digoxínom, antikoagulanciami, diuretikami, kyslíkom a vazodilatanciami (blokátory kalciových kanálov, ACE inhibítory). Zaradení pacienti mali IPAH alebo PAH spojenú s ochorením spojivového tkaniva (PAH-CTD). Väčšina pacientov mala príznaky funkčnej triedy II (38,4 %) alebo III (55,0 %) podľa SZO. Pacienti s už existujúcim ochorením pečene (s cirhózou alebo s klinicky významne zvýšenými hodnotami aminotransferáz)
a pacienti používajúci inú cielenú liečbu PAH (napr. prostanoidy) boli vylúčení. Hemodynamické
parametre neboli v týchto štúdiách hodnotené.
Primárnym cieľovým ukazovateľom definovaným pre štúdie fázy 3 bolo zlepšenie záťažovej kapacity hodnotené prostredníctvom zmeny oproti východiskovej hodnote v 6•minútovom teste chôdzou (6•minute walk distance, 6MWD) v 12. týždni. V oboch štúdiách viedla liečba ambrisentanom
k významnému zlepšeniu v 6MWD pri každej dávke ambrisentanu.
Na placebo korigované zlepšenie priemernej hodnoty v 6MWD v 12. týždni oproti východiskovej hodnote v skupine s 5 mg dávkou bolo 30,6 m (95 % IS: 2,9 až 58,3; p = 0,008) v štúdii ARIES1 a 59,4 m (95 % IS: 29,6 až 89,3; p < 0,001) v štúdii ARIES2. Na placebo korigované zlepšenie
priemernej hodnoty v 6MWD v 12. týždni u pacientov v skupine s 10 mg dávkou v štúdii ARIES1
bolo 51,4 m (95 % IS: 26,6 až 76,2; p < 0,001).
Uskutočnila sa vopred špecifikovaná kombinovaná analýza štúdií fázy 3 (ARIES•C). Na placebo korigované priemerné zlepšenie v 6MWD bolo 44,6 m (95 % IS: 24,3 až 64,9; p < 0,001) pri 5 mg dávke a 52,5 m (95 % IS: 28,8 až 76,2; p < 0,001) pri 10 mg dávke.
V štúdii ARIES2 ambrisentan (skupina s kombinovanou dávkou) významne spomalil čas do klinického zhoršenia PAH v porovnaní s placebom (p < 0,001), hazard ratio preukázalo 80 % zníženie (95 % IS: 47 % až 92 %). Hodnotené premenné zahŕňali: úmrtie, transplantáciu pľúc, hospitalizáciu kvôli PAH, septostómiu predsiení, pridanie ďalších látok na liečbu PAH a kritériá pre predčasné ukončenie liečby. V skupine s kombinovanou dávkou sa pozorovalo štatisticky významné zvýšenie (3,41 ± 6,96) skóre škály hodnotiacej fyzické fungovanie v rámci dotazníka o zdraví SF-36
v porovnaní s placebom (−0,20 ± 8,14, p = 0,005). Liečba ambrisentanom viedla k štatisticky významnému zlepšeniu skóre Borgovej škály hodnotiacej dýchavičnosť (Borg Dyspnea Index, BDI) v 12. týždni (na placebo korigované skóre BDI v hodnote −1,1 (95 % IS: −1,8 až −0,4; p = 0,019; skupina s kombinovanou dávkou)).
Dlhodobé údaje
Pacienti, ktorí sa zúčastnili štúdie ARIES1 a ARIES2, mohli byť zaradení do dlhodobej otvorenej
predĺženej štúdie ARIESE (n = 383). Kombinovaná priemerná expozícia bola približne
145 ± 80 týždňov a maximálna expozícia bola približne 259 týždňov. Hlavné primárne cieľové ukazovatele tejto štúdie boli výskyt a závažnosť nežiaducich udalostí súvisiacich s dlhodobou expozíciou ambrisentanu, vrátane sérových LFT (funkčných vyšetrení pečene). Zistenia ohľadom bezpečnosti pozorované pri dlhodobej expozícii ambrisentanu v tejto štúdii boli zvyčajne zhodné s tými, ktoré sa pozorovali v 12týždňových placebom kontrolovaných štúdiách.
Pravdepodobnosť prežitia zistená u jedincov užívajúcich ambrisentan (skupina s kombinovanou dávkou ambrisentanu) bola po 1 roku 93 %, po 2 rokoch 85 % a po 3 rokoch 79 %.
V otvorenej štúdii (AMB222) bol ambrisentan skúmaný u 36 pacientov za účelom zhodnotenia výskytu zvýšených sérových koncentrácií aminotransferáz u pacientov, ktorí prerušili predchádzajúcu liečbu iným ERA kvôli abnormalitám aminotransferáz. Počas priemerne 53 týždňov liečby ambrisentanom sa u žiadneho zo zaradených pacientov nepotvrdila hodnota sérovej ALT > 3× ULN, ktorá by vyžadovala trvalé ukončenie liečby. Počas tejto doby bola u päťdesiatich percent pacientov dávka ambrisentanu zvýšená z 5 mg na 10 mg.
Kumulatívny výskyt abnormalít sérových aminotransferáz > 3× ULN vo všetkých štúdiách fázy 2 a 3 (vrátane príslušných otvorených predĺžených štúdií) bol 17 zo 483 jedincov počas priemernej doby expozície 79,5 týždňa. To pri ambrisentane zodpovedá miere výskytu 2,3 udalosti na
100 pacientorokov expozície. V otvorenej dlhodobej predĺženej štúdii ARIESE sa zistilo, že po
2 rokoch liečby je riziko vzniku vzostupov koncentrácií aminotransferáz na > 3× ULN u pacientov
liečených ambrisentanom 3,9 %.
Ďalšie klinickéinformácie
Zlepšenie hemodynamických parametrov sa pozorovalo u pacientov s PAH po 12 týždňoch (n = 29)
v štúdii fázy 2 (AMB220). Liečba ambrisentanom viedla k zvýšeniu priemerného srdcového indexu, zníženiu priemerného tlaku v pľúcnych artériách a zníženiu priemernej pľúcnej cievnej rezistencie.
Pri liečbe ambrisentanom bol hlásený pokles systolického a diastolického krvného tlaku. V placebom kontrolovaných klinických skúšaniach trvajúcich 12 týždňov sa zistil priemerný pokles systolického krvného tlaku o 3 mmHg a diastolického krvného tlaku o 4,2 mmHg, keď sa porovnali hodnoty namerané na začiatku a na konci liečby. Priemerný pokles systolického a diastolického krvného tlaku pretrvával počas až 4 rokov liečby ambrisentanom v dlhodobej otvorenej predĺženej štúdii ARIESE.
Počas štúdie liekových interakcií u zdravých dobrovoľníkov nebol pozorovaný klinicky významný vplyv na farmakokinetiku ambrisentanu alebo sildenafilu a táto kombinácia bola dobre znášaná. Počet pacientov, ktorí boli súbežne liečení ambrisentanom a sildenafilom, bol 22 pacientov (5,7 %) v štúdii ARIES•E a 17 pacientov (47 %) v štúdii AMB222. U týchto pacientov sa nezistili žiadne ďalšie bezpečnostné obavy.
Klinická účinnosť vkombinácii s tadalafilom
Uskutočnila sa multicentrická, dvojito zaslepená, aktívnymi komparátormi kontrolovaná štúdia fázy 3
typu „event-driven“
(dosiahnutie cieľa štúdie bolo podmienené výskytom vopred definovanej príhody), ktorá sledovala efekt liečby (AMB112565/AMBITION) s cieľom zhodnotiť účinnosť začiatočnej liečby kombináciou
ambrisentanu a tadalafilu v porovnaní s monoterapiou buď ambrisentanom, alebo tadalafilom,
u 500 pacientov s PAH bez predchádzajúcej liečby, ktorí boli na uvedené liečby randomizovaní v pomere 2:1:1. Žiadni pacienti neužívali samotné placebo. Primárna analýza porovnala skupinu s kombinovanou liečbou so súhrnne hodnotenými skupinami s monoterapiami. Uskutočnili sa aj
podporné porovnania skupiny s kombinovanou liečbou s jednotlivými skupinami s monoterapiami. Pacienti s významnou anémiou, s retenciou tekutín alebo so zriedkavými ochoreniami sietnice boli
z účasti na štúdii vylúčení na základe kritérií stanovených skúšajúcimi lekármi. Z účasti na štúdii boli
vylúčení aj pacienti, ktorí mali východiskové hodnoty ALT a AST > 2 × ULN.
Pri vstupe do štúdie bolo 96 % pacientov bez predchádzajúcej špecifickej liečby PAH a medián času od stanovenia diagnózy do zaradenia do štúdie bol 22 dní. Pacienti začali liečbu 5 mg ambrisentanu
a 20 mg tadalafilu a v 4. týždni mali dávku tadalafilu titrovanú na 40 mg a v 8. týždni mali dávku
ambrisentanu titrovanú na 10 mg, pokiaľ nemali žiadne problémy so znášanlivosťou liečby. Medián trvania dvojito zaslepenej liečby bol pri kombinovanej liečbe dlhší ako 1,5 roku.
Primárnym cieľovým ukazovateľom bol čas do prvého výskytu príhody, ktorou bolo klinické zlyhanie
liečby definované ako:
– smrť alebo
– hospitalizácia z dôvodu zhoršujúcej sa PAH,
– progresia ochorenia,
– neuspokojivá dlhodobá klinická odpoveď na liečbu.
Priemerný vek všetkých pacientov bol 54 rokov (SD 15; vekové rozmedzie 18 – 75 rokov). Pri vstupe do štúdie boli pacienti vo FT II (31 %) a FT III (69 %) podľa SZO. Najčastejšou etiológiou v populácii tejto štúdie bola idiopatická alebo dedičná PAH (56 %), po nej nasledovala PAH zapríčinená poruchami spojivového tkaniva (37 %), PAH súvisiaca s liekmi a toxínmi (3 %), s korigovanou jednoduchou vrodenou srdcovou chybou (2 %) a s HIV (2 %). Pacienti vo FT II a III podľa SZO mali priemernú východiskovú hodnotu v 6MWD rovnú 353 metrom.
Cieľové ukazovateleefektuliečby
Kombinovaná liečba viedla v porovnaní so súhrnne hodnotenými skupinami s monoterapiami
k 50 % zníženiu rizika (hazard ratio [HR] 0,502; 95 % IS: 0,348 až 0,724; p = 0,0002) výskytu združeného cieľového ukazovateľa, ktorým bolo klinické zlyhanie liečby, a to až do hodnotenia na záverečnej návšteve [graf 1 a tabuľka 1]. Efekt liečby bol založený na 63 % znížení počtu hospitalizácií pri kombinovanej liečbe, dosiahol sa v krátkom čase a zostal zachovaný. Účinnosť kombinovanej liečby z hľadiska primárneho cieľového ukazovateľa sa preukázala aj v porovnaní s jednotlivými monoterapiami a naprieč podskupinami vytvorenými na základe veku, etnického pôvodu, geografickej oblasti, etiológie (iPAH/hPAH a PAH-CTD). Efekt liečby bol významný
u pacientov vo FC II aj u pacientov vo FC III.
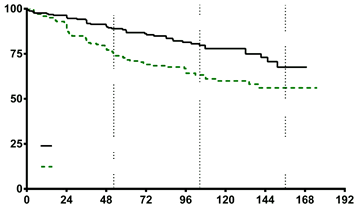
Graf 1
| Čas do klinického zlyhania liečby
|
Pacienti bez príhody (%)
| 1 rok 88,9 %
2 roky 79,7 %
3 roky 67,6 %
1 rok 75,5 %
2 roky 63,2 %
3 roky 56,1 %
Kombinovaná liečba HR: 0,502
95 % IS (0,348; 0,724)
Monoterapie – súhrnne p = 0,0002
|
|
Čas (týždne)
|
Počet pacientov v riziku:
Kombinácia:
| 253
| 229
| 186
| 145
| 106
| 71
| 36
| 4
|
Monoterapie – súhrnne:
| 247
| 209
| 155
| 108
| 77
| 49
| 25
| 5
|
Tabuľka 1
| Ambrisentan +
tadalafil
(N = 253)
| Monoterapie –
súhrnne
(N = 247)
| Ambrisentan
v monoterapii
(N = 126)
| Tadalafil
v monoterapii
(N = 121)
|
Čas do prvej príhody klinického zlyhania liečby (formálne posúdenej)
|
Klinické zlyhanie
liečby, počet (%)
|
46 (18 %)
|
77 (31 %)
|
43 (34)
|
34 (28)
|
Hazard ratio (95 % IS)
|
| 0,502
(0,348; 0,724)
| 0,477
(0,314; 0,723)
| 0,528
(0,338; 0,827)
|
p•hodnota, log-rank test
|
| 0,0002
| 0,0004
| 0,0045
|
Zložky tvoriace prvú príhodu klinického zlyhania liečby (formálne posúdené)
|
Smrť (z akýchkoľvek príčin)
|
9 (4 %)
|
8 (3 %)
|
2 (2)
|
6 (5)
|
Hospitalizácia z dôvodu
zhoršujúcej sa PAH
|
10 (4 %)
|
30 (12 %)
|
18 (14)
|
12 (10)
|
Progresia ochorenia
| 10 (4 %)
| 16 (6 %)
| 12 (10)
| 4 (3)
|
Neuspokojivá dlhodobá klinická odpoveď na liečbu
|
17 (7 %)
|
23 (9 %)
|
11 (9)
|
12 (10)
|
Čas do prvej hospitalizácie z dôvodu zhoršujúcej sa PAH (formálne posúdenej)
|
Prvá hospitalizácia,
počet (%)
|
19 (8 %)
|
44 (18 %)
|
27 (21 %)
|
17 (14 %)
|
Hazard ratio (95 % IS)
|
| 0,372
| 0,323
| 0,442
|
p•hodnota, log-rank test
|
| 0,0002
| < 0,0001
| 0,0124
|
Sekundárna cieľové ukazovateleHodnotené boli sekundárne cieľové ukazovatele:
Tabuľka 2
Sekundárna cieľové ukazovatele (zmena v 24. týždni
v porovnaní
s východiskovým stavom)
|
Ambrisentan +
tadalafil
|
Monoterapie –
súhrnne
|
Rozdiel
a interval
spoľahlivosti
|
p•hodnota
|
NT-proBNP (% zníženie)
|
−67,2
|
−50,4
| % rozdiel:
−33,8;
95 % IS: −44,8;
−20,7
|
p < 0,0001
|
% osôb, ktoré
v 24. týždni dosiahli
uspokojivú klinickú
odpoveď na liečbu
|
39
|
29
| Pomer šancí:
1,56;
95 % IS: 1,05;
2,32
|
p = 0,026
|
6MWD (metre, medián zmeny)
|
49,0
|
23,8
| 22,75 m;
95 % IS: 12,00;
33,50
|
p < 0,0001
|
IdiopatickápľúcnafibrózaUskutočnila sa štúdia so 492 pacientmi (ambrisentan N = 329, placebo N = 163) s idiopatickou
pľúcnou fibrózou (IPF), z ktorých 11 % malo sekundárnu pľúcnu hypertenziu (skupiny 3 podľa SZO), ktorá však bola predčasne ukončená, keď sa zistilo, že nie je možné splniť primárny cieľový ukazovateľ účinnosti (štúdia ARTEMIS-IPF). V skupine s ambrisentanom sa pozorovalo 90 prípadov (27 %) progresie IPF (vrátane hospitalizácie
z dôvodu respiračných ťažkostí) alebo úmrtia v porovnaní s 28 prípadmi (17 %) v skupine s placebom. Ambrisentan je preto kontraindikovaný u pacientov s IPF so sekundárnou pľúcnou hypertenziou alebo
bez nej (pozri časť 4.3).
5.2 Farmakokinetické vlastnostiAbsorpciaAmbrisentan sa u ľudí rýchlo absorbuje. Po perorálnom podaní sa maximálne plazmatické
koncentrácie (Cmax) ambrisentanu zvyčajne dosiahnu v priebehu približne 1,5 hodiny po podaní dávky spolu s jedlom ako aj nalačno. Cmax a plocha pod krivkou závislosti plazmatickej koncentrácie od času
(AUC) sa zvyšujú úmerne dávke v rozmedzí terapeutických dávok. Rovnovážny stav sa zvyčajne
dosiahne po 4 dňoch opakovaného podávania.
Štúdia skúmajúca vplyv jedla, v ktorej bol ambrisentan podávaný zdravým dobrovoľníkom nalačno a s jedlom s vysokým obsahom tuku poukázala na to, že hodnota Cmax sa znížila o 12 %, zatiaľ čo hodnota AUC zostala nezmenená. Tento pokles maximálnej koncentrácie nie je klinicky významný, a preto sa ambrisentan môže užívať s jedlom alebo bez jedla.
D
i
stribúcia
Ambrisentan sa vo veľkej miere viaže na plazmatické bielkoviny. Väzba ambrisentanu na plazmatické
bielkoviny in•vitro bola v priemere 98,8 % a nezávislá od koncentrácie v rozmedzí 0,2 –
20 mikrogramov/ml.
Ambrisentan sa viaže predovšetkým na albumín (96,5 %) a v menšej miere na alfa1-kyslý glykoproteín.
Distribúcia ambrisentanu do červených krviniek je nízka a priemerný pomer krv: plazma je 0,57 u žien
a 0,61 u mužov.
Biotransformácia
Ambrisentan je nesulfónamidový ERA (je to derivát kyseliny propiónovej).
Ambrisentan je glukuronidovaný niekoľkými izoenzýmami UGT (UGT1A9S, UGT2B7S
a UGT1A3S) na glukuronid ambrisentanu (13 %). Ambrisentan podlieha aj oxidačnému metabolizmu
sprostredkovanému hlavne CYP3A4 a v menšej miere CYP3A5 a CYP2C19, pri ktorom vzniká
4•hydroxymetylambrisentan (21 %), ktorý je ďalej glukuronidovaný na glukuronid
4•hydroxymetylambrisentanu (5 %). Väzbová afinita 4•hydroxymetylambrisentanu k ľudskému receptoru pre endotelín je 65násobne nižšia ako u ambrisentanu. Z tohto dôvodu sa pri koncentráciách
pozorovaných v plazme (približne 4 % oproti pôvodnému ambrisentanu) neočakáva, že sa
4hydroxymetylambrisentan bude podieľať na farmakologickom účinku ambrisentanu.
Údaje in vitro ukazujú, že ambrisentan v koncentrácii 300 μmol/l spôsobil menej ako 50 % inhibíciu
UGT1A1,
UGT1A6, UGT1A9, UGT2B7 (do 30 %) alebo enzýmov 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1
a 3A4 cytochrómu P450 (do 25 %). Ambrisentan v klinicky významných koncentráciách nemá in vitro
žiaden inhibičný vplyv na ľudské transportéry vrátane Pgp, BCRP, MRP2, BSEP, OATP1B1, OATP1B3 a NTCP. Okrem toho ambrisentan neindukoval expresiu proteínov MRP2, Pgp alebo BSEP v potkaních hepatocytoch. Celkovo vzaté, údaje in vitro naznačujú, že sa nepredpokladá, že by ambrisentan v klinicky
významných koncentráciách (plazmatická Cmax do 3,2 μmol/l) mal vplyv na UGT1A1, UGT1A6,
UGT1A9, UGT2B7 alebo enzýmy 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, 3A4 cytochrómu P450
alebo na transport sprostredkovaný BSEP, BCRP, Pgp, MRP2, OATP1B1/3 alebo NTCP.
Vplyv ambrisentanu v rovnovážnom stave (10 mg jedenkrát denne) na farmakokinetiku
a farmakodynamiku jednorazovej dávky warfarínu (25 mg), hodnotený pomocou PT a INR, bol skúmaný u 20 zdravých dobrovoľníkov. Ambrisentan nemal žiadny klinicky významný vplyv na
farmakokinetiku alebo farmakodynamiku warfarínu. Podobne ani súbežné podávanie warfarínu
nemalo vplyv na farmakokinetiku ambrisentanu (pozri časť 4.5).
Vplyv 7dňového podávania sildenafilu (20 mg trikrát denne) na farmakokinetiku jednorazovej dávky ambrisentanu a vplyv 7dňového podávania ambrisentanu (10 mg jedenkrát denne) na farmakokinetiku jednorazovej dávky sildenafilu bol skúmaný u 19 zdravých dobrovoľníkov. Po súbežnom podávaní ambrisentanu sa hodnota Cmax sildenafilu zvýšila o 13 %, avšak okrem toho sa nezistili žiadne ďalšie zmeny farmakokinetických parametrov sildenafilu, N•desmetylsildenafilu a ambrisentanu. Toto
mierne zvýšenie hodnoty Cmax sildenafilu sa nepovažuje za klinicky významné (pozri časť 4.5).
Vplyv ambrisentanu v rovnovážnom stave (10 mg jedenkrát denne) na farmakokinetiku jednorazovej dávky tadalafilu a vplyv tadalafilu v rovnovážnom stave (40 mg jedenkrát denne) na farmakokinetiku jednorazovej dávky ambrisentanu bol skúmaný u 23 zdravých dobrovoľníkov. Ambrisentan nemal žiadny klinicky významný vplyv na farmakokinetiku tadalafilu. Podobne ani súbežné podávanie tadalafilu nemalo vplyv na farmakokinetiku ambrisentanu (pozri časť 4.5).
Vplyv opakovaného podávania ketokonazolu (400 mg jedenkrát denne) na farmakokinetiku jednorazovej 10 mg dávky ambrisentanu bol skúmaný u 16 zdravých dobrovoľníkov. Expozícia
ambrisentanu sa zvýšila o 35 % pri hodnotení pomocou AUC(0–inf) a o 20 % pri hodnotení pomocou Cmax. Táto zmena expozície pravdepodobne nie je klinicky významná, a preto sa ambrisentan môže podávať súbežne s ketokonazolom.
Vplyv opakovaného podávania cyklosporínu A (100 – 150 mg dvakrát denne) na farmakokinetiku ambrisentanu (5 mg jedenkrát denne) v rovnovážnom stave a vplyv opakovaného podávania ambrisentanu (5 mg jedenkrát denne) na farmakokinetiku cyklosporínu A (100 – 150 mg dvakrát denne) v rovnovážnom stave bol skúmaný u zdravých dobrovoľníkov. Pri podávaní opakovaných dávok cyklosporínu A došlo k zvýšeniu hodnoty Cmax a AUC(0–τ) ambrisentanu (48 % a 121 %, v tomto poradí). Na základe týchto zmien sa má pri súbežnom podávaní cyklosporínu A dávka ambrisentanu obmedziť na 5 mg jedenkrát denne (pozri časť 4.2). Podávanie opakovaných dávok ambrisentanu však nemalo klinicky významný vplyv na expozíciu cyklosporínu A a úprava dávky cyklosporínu A nie je potrebná.
Vplyv akútneho a opakovaného podávania rifampicínu (600 mg jedenkrát denne) na farmakokinetiku ambrisentanu (10 mg jedenkrát denne) v rovnovážnom stave bol sledovaný u zdravých dobrovoľníkov. Po podaní úvodných dávok rifampicínu sa pozorovalo prechodné zvýšenie hodnôt AUC(0–τ) ambrisentanu (o 121 % po prvej dávke a o 116 % po druhej dávke rifampicínu), pravdepodobne kvôli inhibícii OATP spôsobenej rifampicínom. Po podávaní opakovaných dávok rifampicínu sa však na
8. deň nezistil klinicky významný vplyv na expozíciu ambrisentanu. Pacienti užívajúci ambrisentan majú byť starostlivo sledovaní pri začatí liečby rifampicínom (pozri časti 4.4 a 4.5).
Vplyv opakovaného podávania ambrisentanu (10 mg) na farmakokinetiku jednorazovej dávky digoxínu bol skúmaný u 15 zdravých dobrovoľníkov. Podávanie opakovaných dávok ambrisentanu spôsobilo mierne zvýšenie AUC0–last a minimálnych (trough) koncentrácií digoxínu a zvýšenie Cmax digoxínu o 29 %. Zvýšenie expozície digoxínu pozorované po podávaní opakovaných dávok ambrisentanu sa nepovažovalo za klinicky významné a úprava dávky digoxínu nie je potrebná (pozri časť 4.5).
Vplyv 12dňového podávania ambrisentanu (10 mg jedenkrát denne) na farmakokinetiku jednorazovej dávky perorálneho kontraceptíva obsahujúceho etinylestradiol (35 μg) a noretindrón (1 mg) bol skúmaný u zdravých dobrovoľníkov. Cmax a AUC(0–∞) boli mierne znížené pri etinylestradiole (o 8 %
a 4 %) a mierne zvýšené pri noretindróne (o 13 % a 14 %). Tieto zmeny v expozícii etinylestradiolom
alebo noretindrónom boli malé a pravdepodobne nie sú klinicky významné (pozri časť 4.5).
Eliminácia
Ambrisentan a jeho metabolity sa vylučujú predovšetkým žlčou po hepatálnom a/alebo
extrahepatálnom metabolizme. Po perorálnom podaní sa približne 22 % podanej dávky zistilo v moči, pričom 3,3 % tvoril ambrisentan v nezmenenej forme. Plazmatický eliminačný polčas u ľudí je
v rozmedzí od 13,6 do 16,5 hodín.
Osobitné skupiny pacientov
Na základe výsledkov populačnej farmakokinetickej analýzy u zdravých dobrovoľníkov a pacientov
s PAH nebola farmakokinetika ambrisentanu významne ovplyvnená pohlavím alebo vekom (pozri
časť 4.2).
Porucha funkcieobličiek
Ambrisentan nepodlieha významnému renálnemu metabolizmu alebo renálnemu klírensu (exkrécii).
V populačnej farmakokinetickej analýze sa zistilo, že klírens kreatinínu je štatisticky významný kovariant ovplyvňujúci perorálny klírens ambrisentanu. U pacientov so stredne ťažkou poruchou
funkcie obličiek je rozsah poklesu perorálneho klírensu mierny (20 – 40 %), a preto pravdepodobne nie je klinicky významný. U pacientov s ťažkou poruchou funkcie obličiek je však potrebná opatrnosť
(pozri časť 4.2).
Porucha funkciepečene
Hlavné cesty metabolizmu ambrisentanu sú glukuronidácia a oxidácia, po ktorých nasleduje
vylučovanie žlčou, a preto je možné očakávať, že porucha funkcie pečene zvýši expozíciu (Cmax
a AUC) ambrisentanu. V populačnej farmakokinetickej analýze sa zistilo, že perorálny klírens je znížený v dôsledku zvýšených hladín bilirubínu. Vplyv bilirubínu je však len mierne závažný
(u pacienta s hladinou bilirubínu zvýšenou na 4,5 mg/dl by bol perorálny klírens ambrisentanu znížený o približne 30 % v porovnaní s typickým pacientom s hladinou bilirubínu 0,6 mg/dl). Farmakokinetika ambrisentanu nebola skúmaná u pacientov s poruchou funkcie pečene (s cirhózou alebo bez nej).
Z tohto dôvodu sa liečba ambrisentanom nemá začať u pacientov s ťažkou poruchou funkcie pečene
alebo s klinicky významne zvýšenými hodnotami pečeňových aminotransferáz (> 3× ULN) (pozri
časti 4.3 a 4.4).
5.3 Predklinické údaje o bezpečnosti
Vzhľadom na hlavný skupinový farmakologický účinok by podanie veľkej jednorazovej dávky ambrisentanu (t. j. predávkovanie) mohlo znížiť artériový tlak a mohlo by spôsobiť hypotenziu a príznaky súvisiace s vazodilatáciou.
Preukázalo sa, že ambrisentan nie je inhibítor transportu žlčových kyselín ani nevyvoláva zjavnú
hepatotoxicitu.
Po dlhodobom podávaní boli u hlodavcov pozorované zápal a zmeny epitelu nosovej dutiny pri expozíciách nižších ako sú terapeutické hladiny u ľudí. Po dlhodobom podávaní vysokých dávok ambrisentanu boli u psov pozorované mierne zápalové reakcie pri expozíciách viac ako 20•násobne prevyšujúcich expozície zistené u pacientov.
U potkanov liečených ambrisentanom bola v nosovej dutine pozorovaná hyperplázia tkaniva nosovej kosti v oblasti nosových mušlí pri expozičných hladinách 3násobne prevyšujúcich klinickú hodnotu AUC. Hyperplázia tkaniva nosovej kosti nebola pozorovaná pri podávaní ambrisentanu myšiam alebo psom. U potkanov je hyperplázia nosovej mušle známou reakciou na zápal nosovej sliznice, a to na základe skúseností s inými látkami.
Ambrisentan bol klastogénny, keď sa testoval vo vysokých koncentráciách v cicavčích bunkách
in vitro. V bakteriálnych testoch a v dvoch štúdiách in vivo na hlodavcoch sa nepreukázali mutagénne
ani genotoxické účinky ambrisentanu.
V 2ročných štúdiách s perorálnym podávaním vykonaných na potkanoch a myšiach sa nepreukázal
karcinogénny potenciál. U samcov potkanov došlo k malému zvýšeniu výskytu fibroadenómov
prsníka, benígneho nádoru, iba pri podávaní najvyššej dávky. Pri tejto dávke bola systémová expozícia
ambrisentanu u samcov potkanov (na základe hodnoty AUC v rovnovážnom stave) 6násobne vyššia
ako systémová expozícia dosiahnutá pri klinickej dávke 10 mg/deň.
Atrofia semenníkových tubulov, ktorá bola ojedinelo spojená s aspermiou, bola pozorovaná v štúdiách toxicity po opakovanom podávaní perorálnej dávky a v štúdiách fertility na samcoch potkanov a myší, a to bez stanovenia bezpečnostného rozpätia. Zmeny na semenníkoch neboli plne reverzibilné počas hodnotených období bez podávania dávky. Zmeny na semenníkoch však neboli pozorované v štúdiách na psoch, ktoré trvali až 39 týždňov, a to pri expozícii 35násobne prevyšujúcej hodnotu AUC dosiahnutú u ľudí. U samcov potkanov nemal ambrisentan žiadne účinky na pohyblivosť spermií
pri všetkých skúšaných dávkach (až do 300 mg/kg/deň). Zaznamenal sa mierny (< 10 %) pokles percenta morfologicky normálnych spermií pri dávke 300 mg/kg/deň, ale nie pri dávke 100 mg/kg/deň
(> 9•násobok klinickej expozície dosiahnutej pri dávke 10 mg/deň). Vplyv ambrisentanu na mužskú
fertilitu nie je známy.
Zistilo sa, že ambrisentan mal teratogénne účinky u potkanov a králikov. Abnormality dolnej čeľuste, jazyka a/alebo podnebia boli pozorované pri všetkých skúšaných dávkach. V štúdii na potkanoch sa okrem toho preukázal zvýšený výskyt defektov interventrikulárneho septa, defektov v oblasti ciev
trupu, abnormalít štítnej žľazy a týmu, osifikácie spodinovoklinovej kosti a výskyt umbilikálnej artérie lokalizovanej na ľavej strane močového mechúra namiesto na pravej strane. Teratogenita je suspektným skupinovým účinkom ERA.
Podávanie ambrisentanu samiciam potkanov v neskorom štádiu brezivosti a počas obdobia laktácie viedlo k nežiaducim účinkom na správanie samíc, k zníženému prežívaniu mláďat a k poruche reprodukčnej schopnosti potomkov (pri pitve sa zistili malé semenníky), a to pri expozícii 3•násobne prevyšujúcej hodnotu AUC dosiahnutú u ľudí po podaní maximálnej odporúčanej dávky.
U juvenilných potkanov, ktorým bol ambrisentan podávaný perorálne jedenkrát denne v postnatálnom období od 7. do 26., 36. alebo 62. dňa, sa vyskytlo zníženie hmotnosti mozgu (−3 % až −8 %)
bez morfologických alebo neurobehaviorálnych zmien po tom, ako boli pozorované abnormálne zvuky pri dýchaní, apnoe a hypoxia. Tieto účinky sa vyskytli pri expozíciách približne 1,8 až 7•násobne vyšších ako je expozícia dosiahnutá pri 10 mg dávke u pediatrických pacientov (vo veku
9 až 15 rokov), na základe hodnoty AUC. Klinický význam tohto zistenia pre pediatrickú populáciu nie je úplne objasnený.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
Laktóza
Mikrokryštalická celulóza (E460i) Sodná soľ kroskarmelózy
Magnéziumstearát (E570)
Filmový obal
Polyvinylalkohol (čiastočne hydrolyzovaný) Oxid titaničitý (E171)
Makrogol
Mastenec (E553b)
Hlinitý lak červene Allura AC (E129)
Hlinitý lak indigokarmínu (E132).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
PVC/PVdC blistre.
Veľkosti balenia obsahujúce 30 filmom obalených tabliet a blistre s jednotlivou dávkou po 30 x 1
alebo 60 x 1 filmom obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMylan S.A.S.
117 Allée des Parcs
69800 Saint Priest
Francúzsko
8. REGISTRAČNÉ ČÍSLAEU/1/19/1368/001
EU/1/19/1368/002
EU/1/19/1368/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. júna 2019
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Ambrisentan Mylan 10 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tableta obsahuje 10 mg ambrisentanu.
Pomocné látkysoznámymúčinkom
Každá tableta obsahuje približne 52 mg laktózy a 20 mikrogramov hlinitého laku červene Allura AC.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta (tableta)
Ružová, bikonvexná, filmom obalená tableta v tvare kapsule s označením „M“ na jednej strane
a „AN1“ na druhej strane, dlhá približne 9,9 mm a široká približne 4,8 mm.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Ambrisentan Mylan je indikovaný na liečbu pľúcnej artériovej hypertenzie (PAH) u dospelých pacientov vo funkčnej triede (FT) II až III podľa SZO, vrátane použitia v kombinovanej liečbe (pozri časť 5.1). Účinnosť bola preukázaná pri idiopatickej PAH (IPAH) a pri PAH spojenej s ochorením spojivového tkaniva.
4.2 Dávkovanie a spôsob podávania
Liečbu musí začať lekár so skúsenosťami v liečení PAH.
Dávkovanie
Ambrisentan v monoterapii
Ambrisentan Mylan sa má začať užívať perorálne v dávke 5 mg jedenkrát denne a môže sa zvýšiť na
10 mg denne v závislosti od klinickej odpovede na liečbu a znášanlivosti liečby.
Ambrisentan v kombinácii s tadalafilom
Pri používaní v kombinácii s tadalafilom sa má dávka Ambrisentanu Mylanu titrovať na 10 mg
jedenkrát denne.
V štúdii AMBITION pacienti užívali 5 mg ambrisentanu denne počas prvých 8 týždňov pred
vytitrovaním dávky na 10 mg, a to v závislosti od znášanlivosti liečby (pozri časť 5.1). Pri používaní
v kombinácii s tadalafilom pacienti začali liečbu 5 mg ambrisentanu a 20 mg tadalafilu. V závislosti od
znášanlivosti liečby sa dávka tadalafilu zvýšila na 40 mg po 4 týždňoch a dávka ambrisentanu sa
zvýšila na 10 mg po 8 týždňoch. Takéto dávkovanie sa dosiahlo u viac ako 90 % pacientov. Dávky sa
tiež mohli znižovať v závislosti od znášanlivosti liečby.
Obmedzené údaje svedčia o tom, že náhle ukončenie liečby ambrisentanom nie je spojené
so zhoršením príznakov PAH (s „rebound“ fenoménom).
Pri súbežnom podávaní cyklosporínu A sa má dávka ambrisentanu obmedziť na 5 mg jedenkrát denne a pacienti majú byť starostlivo sledovaní (pozri časti 4.5 a 5.2).
Osobitné skupiny pacientov
Staršípacienti
U pacientov starších ako 65 rokov nie je potrebná úprava dávky (pozri časť 5.2).
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek nie je potrebná úprava dávky (pozri časť 5.2). Skúsenosti
s použitím ambrisentanu u jedincov s ťažkou poruchou funkcie obličiek (klírens kreatinínu
< 30 ml/min) sú obmedzené; v tejto podskupine pacientov sa má liečba začať opatrne a pri zvýšení
dávky na 10 mg ambrisentanu je potrebná osobitná opatrnosť.
Porucha funkciepečene
Ambrisentan nebol skúmaný u jedincov s poruchou funkcie pečene (s cirhózou alebo bez nej).
Vzhľadom na to, že hlavné cesty metabolizmu ambrisentanu sú glukuronidácia a oxidácia s následným
vylučovaním do žlče, je možné očakávať, že porucha funkcie pečene zvýši expozíciu (Cmax a AUC) ambrisentanu. Z tohto dôvodu sa liečba ambrisentanom nesmie začať u pacientov s ťažkou poruchou funkcie pečene alebo s klinicky významne zvýšenými hodnotami pečeňových aminotransferáz
(nad 3násobok hornej hranice referenčného rozpätia (> 3× ULN); pozri časti 4.3 a 4.4).
Pediatrická populácia
Bezpečnosť a účinnosť ambrisentanu u detí a dospievajúcich mladších ako 18 rokov neboli stanovené.
K dispozícii nie sú žiadne údaje (dostupné údaje týkajúce sa juvenilných zvierat, pozri časť 5.3).
Spôsob podávania
Odporúča sa, aby sa tableta prehltla vcelku a môže sa užívať s jedlom alebo bez jedla. Odporúča sa
tabletu nedeliť, nedrviť ani nežuť.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Gravidita (pozri časť 4.6).
Ženy vo fertilnom veku, ktoré nepoužívajú spoľahlivú antikoncepciu (pozri časti 4.4 a 4.6).
Dojčenie (pozri časť 4.6).
Ťažká porucha funkcie pečene (s cirhózou alebo bez nej) (pozri časť 4.2).
Východiskové hodnoty pečeňových aminotransferáz (aspartátaminotransferázy (AST) a/alebo
alanínaminotransferázy (ALT)) > 3× ULN (pozri časti 4.2 a 4.4).
Idiopatická pľúcna fibróza (IPF) so sekundárnou pľúcnou artériovou hypertenziou alebo bez nej (pozri časť 5.1).
4.4 Osobitné upozornenia a opatrenia pri používaní
Ambrisentan nebol skúmaný u dostatočného počtu pacientov, aby bolo možné stanoviť rovnováhu
medzi prínosom a rizikom pri PAH funkčnej triedy I podľa SZO.
Účinnosť ambrisentanu v monoterapii nebola stanovená u pacientov s PAH funkčnej triedy IV podľa SZO. Ak dôjde k zhoršeniu klinického stavu, má sa zvážiť liečba, ktorá je odporúčaná pre ťažké štádium ochorenia (napr. epoprostenol).
Funkcia pečene
PAH je spojená s abnormalitami funkcie pečene. Pri používaní ambrisentanu boli pozorované prípady
zodpovedajúce autoimunitnej hepatitíde, vrátane možnej exacerbácie už existujúcej autoimunitnej
hepatitídy, poškodenia pečene a zvýšenia hodnôt pečeňových enzýmov potenciálne súvisiaceho
s liečbou (pozri časti 4.8 a 5.1). Pred začiatkom liečby ambrisentanom sa preto majú stanoviť hodnoty pečeňových aminotransferáz (ALT a AST) a liečba sa nemá začať u pacientov s východiskovými hodnotami ALT a/alebo AST > 3× ULN (pozri časť 4.3).
Pacienti majú byť sledovaní kvôli prejavom poškodenia pečene a odporúča sa kontrolovať hodnoty ALT a AST raz za mesiac. Ak u pacienta dôjde k trvalému, neobjasnenému, klinicky významnému zvýšeniu hodnôt ALT a/alebo AST, alebo ak je zvýšenie hodnôt ALT a/alebo AST sprevádzané znakmi alebo príznakmi poškodenia pečene (napr. žltačka), liečba ambrisentanom sa má ukončiť.
U pacientov bez klinických príznakov poškodenia pečene alebo bez žltačky sa opätovné začatie liečby ambrisentanom môže zvážiť po normalizácii hodnôt pečeňových enzýmov. Odporúča sa vyšetrenie
u hepatológa.
Koncentrácia hemoglobínu
Používanie antagonistov endotelínových receptorov (ERA) vrátane ambrisentanu je spojené
so znížením koncentrácií hemoglobínu a hematokritu. Znížené koncentrácie boli väčšinou zistené počas prvých 4 týždňov liečby a potom sa hemoglobín zvyčajne stabilizoval. Priemerné poklesy
(v rozmedzí od 0,9 do 1,2 g/dl) koncentrácií hemoglobínu, v porovnaní s východiskovými
koncentráciami, pretrvávali počas až 4 rokov liečby ambrisentanom v dlhodobom otvorenom predĺžení pivotných klinických štúdií fázy 3. V období po uvedení lieku na trh boli hlásené prípady anémie vyžadujúcej si transfúziu krvi (pozri časť 4.8).
Neodporúča sa začať liečbu ambrisentanom u pacientov s klinicky významnou anémiou. Počas liečby ambrisentanom sa odporúča kontrolovať hladiny hemoglobínu a/alebo hematokritu, napríklad
po 1 mesiaci, 3 mesiacoch a potom v pravidelných intervaloch v súlade s klinickou praxou. Ak sa zistí
klinicky významné zníženie hladín hemoglobínu alebo hematokritu a vylúčia sa iné príčiny, má sa zvážiť zníženie dávky alebo ukončenie liečby. Výskyt anémie bol zvýšený, keď sa ambrisentan
podával v kombinácii s tadalafilom (15 % frekvencia výskytu tejto nežiaducej udalosti), v porovnaní
s výskytom anémie, keď sa ambrisentan a tadalafil podávali v monoterapii (7 % a 11 %, v uvedenom poradí).
Retencia tekutín
Pri používaní ERA vrátane ambrisentanu sa pozoroval periférny edém. Väčšina prípadov periférneho
edému v klinických štúdiách s ambrisentanom bola ľahkej až stredne ťažkej závažnosti, aj keď sa môže vyskytnúť s väčšou frekvenciou a závažnosťou u pacientov ≥ 65 rokov. V krátkodobých
klinických štúdiách bol periférny edém hlásený častejšie pri podávaní 10 mg ambrisentanu (pozri
časť 4.8).
Po uvedení lieku na trh boli hlásené prípady retencie tekutín vyskytujúcej sa v priebehu niekoľkých týždňov po začatí liečby ambrisentanom a v niektorých prípadoch liečba retencie tekutín alebo dekompenzovaného srdcového zlyhania vyžadovala podanie diuretika alebo hospitalizáciu. Ak
pacienti trpia už existujúcim preťažením tekutinami, treba ho zvládnuť klinicky vhodným spôsobom pred začatím liečby ambrisentanom.
Ak počas liečby ambrisentanom vznikne klinicky významná retencia tekutín, ktorá je alebo nie je spojená s prírastkom telesnej hmotnosti, majú sa vykonať ďalšie vyšetrenia, aby sa určila príčina, napr. liečba ambrisentanom alebo už existujúce srdcové zlyhanie, a možná potreba špecifickej liečby alebo ukončenia liečby ambrisentanom. Výskyt periférneho edému bol zvýšený, keď sa ambrisentan podával v kombinácii s tadalafilom (45 % frekvencia výskytu tejto nežiaducej udalosti), v porovnaní
s výskytom periférneho edému, keď sa ambrisentan a tadalafil podávali v monoterapii (38 % a 28 %, v uvedenom poradí). Výskyt periférneho edému bol najvyšší v priebehu prvého mesiaca po začatí
liečby.
Ženy vofertilnomveku
Liečba Ambrisentanom Mylanom sa nesmie začať u žien vo fertilnom veku, pokiaľ výsledok
tehotenského testu pred začiatkom liečby nie je negatívny a pokiaľ nepoužívajú spoľahlivú
antikoncepciu. V prípade akýchkoľvek pochybností ohľadom toho, aká antikoncepcia sa má odporučiť konkrétnej pacientke, sa má zvážiť konzultácia s gynekológom. Počas liečby ambrisentanom sa odporúča vykonávať tehotenské testy v mesačných intervaloch (pozri časti 4.3 a 4.6).
Pľúcna venookluzívna choroba
Pri používaní vazodilatačných liekov, ako sú ERA, u pacientov s pľúcnou venookluzívnou chorobou
boli zaznamenané prípady pľúcneho edému. V dôsledku toho, ak u pacientov s PAH vznikne akútny pľúcny edém počas liečby ambrisentanom, je potrebné zvážiť možnosť pľúcnej venookluzívnej choroby.
Súbežné podávanie sinými liekmi
Pacienti užívajúci ambrisentan majú byť starostlivo sledovaní pri začatí liečby rifampicínom (pozri
časti 4.5 a 5.2).
Pomocné látky
Filmom obalené tablety Ambrisentanu Mylanu 10 mg obsahujú laktózu. Pacienti so zriedkavými
dedičnými problémami galaktózovej intolerancie, celkovým deficitom laktázy alebo glukózo- galaktózovou malabsorpciou nesmú užívať tento liek.
Filmom obalené tablety Ambrisentanu Mylanu 10 mg obsahujú azofarbivo hlinitý lak červene Allura
AC (E129), ktoré môže vyvolať alergické reakcie.
Filmom obalené tablety Ambrisentanu Mylanu 10 mg obsahujú menej ako 1 mmol sodíka (23 mg), t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
V predklinických štúdiách in vitro a in vivo ambrisentan v klinicky významných koncentráciách neinhiboval ani neindukoval enzýmy I. alebo II. fázy metabolizácie liečiv, čo svedčí o nízkej schopnosti ambrisentanu zmeniť profil liekov metabolizovaných týmito cestami.
Schopnosť ambrisentanu indukovať aktivitu CYP3A4 bola skúmaná u zdravých dobrovoľníkov
a výsledky svedčia o nedostatočnom vplyve ambrisentanu na indukciu izoenzýmu CYP3A4.
Cyklosporín A
Súbežné podávanie ambrisentanu a cyklosporínu A v rovnovážnom stave viedlo u zdravých
dobrovoľníkov k 2násobnému zvýšeniu expozície ambrisentanu. Toto môže byť spôsobené inhibíciou
transportérov a metabolických enzýmov podieľajúcich sa na farmakokinetike ambrisentanu cyklosporínom A. Z toho dôvodu sa má dávka ambrisentanu obmedziť na 5 mg jedenkrát denne pri súbežnom podávaní s cyklosporínom A (pozri časť 4.2). Podávanie opakovaných dávok ambrisentanu nemalo vplyv na expozíciu cyklosporínu A a úprava dávky cyklosporínu A nie je potrebná.
Rifampicín
Súbežné podávanie rifampicínu (inhibítor transportného polypeptidu organických aniónov [OATP],
silný induktor CYP3A a 2C19 a induktor P•gp a uridíndifosfát glukuronozyltransferáz [UGTs]) bolo spojené s prechodným (približne 2násobným) zvýšením expozície ambrisentanu po podaní úvodných dávok zdravým dobrovoľníkom. Podávanie rifampicínu v rovnovážnom stave však na 8. deň nemalo klinicky významný vplyv na expozíciu ambrisentanu. Pacienti užívajúci ambrisentan majú byť starostlivo sledovaní pri začatí liečby rifampicínom (pozri časti 4.4 a 5.2).
Inhibítory fosfodiesterázy
Súbežné podávanie ambrisentanu s inhibítorom fosfodiesterázy, buď so sildenafilom alebo tadalafilom
(oba sú substráty pre CYP3A4), zdravým dobrovoľníkom významne neovplyvnilo farmakokinetiku
inhibítora fosfodiesterázy alebo ambrisentanu (pozri časť 5.2).
Iné cielenéliečbyPAH
Účinnosť a bezpečnosť ambrisentanu, keď sa podával súbežne s inými liekmi na PAH
(napr. s prostanoidmi a so stimulátormi rozpustnej guanylátcyklázy), sa špecificky nesledovali
v kontrolovaných klinických skúšaniach u pacientov s PAH (pozri časť 5.1). Na základe známych údajov o biotransformácii sa nepredpokladajú žiadne špecifické liekové interakcie so stimulátormi
rozpustnej guanylátcyklázy ani s prostanoidmi (pozri časť 5.2). S týmito liečivami sa však
neuskutočnili žiadne štúdie špecifických liekových interakcií. V prípade ich súbežného podávania sa preto odporúča obozretnosť.
Perorálna antikoncepcia
V klinickej štúdii u zdravých dobrovoľníkov podávanie ambrisentanu v rovnovážnom stave v dávke
10 mg jedenkrát denne významne nezmenilo farmakokinetiku jednorazovej dávky etinylestradiolu a noretindrónu obsiahnutých v kombinovanej perorálnej antikoncepcii (pozri časť 5.2). Na základe
tejto farmakokinetickej štúdie sa neočakáva, že by ambrisentan významne ovplyvnil expozíciu
antikoncepcii založenej na estrogénoch alebo progestagéne.
Warfarín
V štúdii u zdravých dobrovoľníkov nemal ambrisentan žiadny vplyv na rovnovážne farmakokinetické
parametre a antikoagulačný účinok warfarínu (pozri časť 5.2). Warfarín taktiež nemal klinicky
významný vplyv na farmakokinetiku ambrisentanu. Ambrisentan okrem toho nemal u pacientov žiadny celkový vplyv na týždennú dávku antikoagulancia warfarínového typu, na protrombínový čas (Pothrombin Time, PT) a medzinárodný normalizovaný pomer (International Normalized Ratio, INR).
Ketokonazol
Podávanie ketokonazolu (silný inhibítor CYP3A4) v rovnovážnom stave neviedlo ku klinicky
významnému zvýšeniu expozície ambrisentanu (pozri časť 5.2).
Vplyv ambrisentanu na transportéry xenobiotík
Ambrisentan v klinicky významných koncentráciách nemá in vitro inhibičný vplyv na ľudské
transportéry vrátane P•glykoproteínu (Pgp), proteínu zodpovedného za rezistenciu pri rakovine prsníka
(breast cancer resistance protein, BCRP), proteínu 2 súvisiaceho s mnohopočetnou liekovou
rezistenciou (multi-drug resistance related protein 2, MRP2), transportnej pumpy solí žlčových kyselín (bile salt export pump, BSEP), transportných polypeptidov organických aniónov (organic anion transporting polypeptides, OATP1B1 a OATP1B3) a kontransportného polypeptidu sodíka
a taurocholátu (sodium-dependent taurocholate co-transporting polypeptide, NTCP).
Ambrisentan je substrát pre Pgp-sprostredkovaný eflux.
Štúdie in vitro na potkaních hepatocytoch taktiež ukázali, že ambrisentan neindukoval expresiu proteínov Pgp, BSEP alebo MRP2.
Ambrisentan v rovnovážnom stave podávaný zdravým dobrovoľníkom nemal klinicky významný vplyv na farmakokinetiku jednorazovej dávky digoxínu, substrátu pre Pgp (pozri časť 5.2).
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomveku
Liečba ambrisentanom sa nesmie začať u žien vo fertilnom veku, pokiaľ výsledok tehotenského testu
pred začiatkom liečby nie je negatívny a pokiaľ nepoužívajú spoľahlivú antikoncepciu. Počas liečby
ambrisentanom sa odporúča vykonávať tehotenské testy v mesačných intervaloch.
Gravidita
Ambrisentan je kontraindikovaný počas gravidity (pozri časť 4.3). Štúdie na zvieratách preukázali, že
ambrisentan je teratogénny. Nie sú k dispozícii skúsenosti s použitím u ľudí.
Ženy liečené ambrisentanom musia byť informované o riziku poškodenia plodu a ak dôjde k otehotneniu, má sa začať alternatívna liečba (pozri časti 4.3, 4.4 a 5.3).
Dojčenie
Nie je známe, či sa ambrisentan vylučuje do ľudského materského mlieka. Vylučovanie ambrisentanu
do mlieka sa u zvierat neskúmalo. Z tohto dôvodu je dojčenie kontraindikáciou u pacientok
užívajúcich ambrisentan(pozri časť 4.3).
Fertilita
Dlhodobé podávanie ERA, vrátane ambrisentanu, bolo u samcov spojené so vznikom atrofie
semenníkových tubulov (pozri časť 5.3). Hoci sa v štúdii ARIESE nezistili jasné dôkazy o škodlivom účinku dlhodobej expozície ambrisentanu na počet spermií, dlhodobé podávanie ambrisentanu sa spájalo so zmenami v markeroch spermatogenézy. Pozoroval sa pokles plazmatickej koncentrácie inhibínu B a zvýšenie plazmatickej koncentrácie FSH. Vplyv na mužskú fertilitu nie je známy, ale nie je možné vylúčiť zhoršenie spermatogenézy. V klinických štúdiách nebolo dlhodobé podávanie ambrisentanu spojené so zmenou plazmatických hladín testosterónu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Ambrisentan má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pri posudzovaní pacientovej schopnosti vykonávať činnosti, ktoré vyžadujú úsudok, motorické alebo kognitívne zručnosti, treba mať na pamäti klinický stav pacienta a profil nežiaducich reakcií
na ambrisentan (akými sú hypotenzia, závraty, slabosť, únava) (pozri časť 4.8). Pred vedením vozidiel alebo obsluhou strojov majú pacienti vedieť, ako by ich ambrisentan mohol ovplyvniť.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofiluBezpečnosť ambrisentanu v monoterapii a/alebo v kombinovanej liečbe bola hodnotená v klinických
skúšaniach u viac ako 1 200 pacientov s PAH (pozri časť 5.1). Nežiaduce reakcie zistené z údajov z 12týždňových placebom kontrolovaných klinických skúšaní sú zahrnuté nižšie podľa triedy
orgánových systémov a frekvencie.
Nižšie sú zahrnuté aj informácie z dlhodobejších štúdií, ktoré neboli kontrolované placebom
(ARIES-E a AMBITION (kombinácia s tadalafilom)). Pri dlhodobej liečbe alebo pri podávaní ambrisentanu v kombinácii s tadalafilom sa nezistili žiadne predtým neznáme nežiaduce reakcie. Počas dlhodobejšieho pozorovania v nekontrolovaných štúdiách (priemerná doba pozorovania bola
79 týždňov) bol bezpečnostný profil podobný ako bezpečnostný profil pozorovaný v krátkodobých
štúdiách. Uvedené sú aj údaje získané v rámci rutinného dohľadu nad liekmi.
Najčastejšie nežiaduce reakcie pozorované pri liečbe ambrisentanom boli periférny edém, retencia tekutín a bolesť hlavy (vrátane bolesti hlavy v dôsledku sinusitídy, migrény). V krátkodobých klinických štúdiách sa liečba vyššou dávkou (10 mg) spájala s vyšším výskytom týchto nežiaducich reakcií a periférny edém bol zvyčajne závažnejší u pacientov ≥ 65 rokov (pozri časť 4.4).
Zoznam nežiaducich reakcií uvedený vtabuľkeFrekvencie sú definované ako: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000
až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) a neznáme
(z dostupných údajov). U nežiaducich reakcií súvisiacich s dávkou sa kategória frekvencie vzťahuje na vyššiu dávku ambrisentanu. Kategórie frekvencie nezohľadňujú ďalšie faktory zahŕňajúce rôznu dĺžku
štúdie, už existujúce ochorenia a východiskové charakteristiky pacientov. Kategórie frekvencie
nežiaducich reakcií priradené na základe skúseností z klinických skúšaní nemusia zobrazovať frekvenciu nežiaducich udalostí vyskytujúcu sa počas bežnej klinickej praxe. V rámci jednotlivých
skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
| Ambrisentan
(ARIES•C
a obdobie po uvedení lieku na trh)
| Ambrisentan (AMBITION a ARIES•E)
| Kombinácia
s tadalafilom
(AMBITION)
|
Poruchy krvi a lymfatického systému
|
Anémia (znížená hladina hemoglobínu, znížená hladina hematokritu)
| Časté1
| Veľmi časté
| Veľmi časté
|
|
Poruchy imunitného systému
|
Reakcie z precitlivenosti (napr.
angioedém, vyrážka, pruritus)
| Menej časté
| Časté
| Časté
|
|
Poruchy nervového systému
|
Bolesť hlavy (vrátane bolesti hlavy
v dôsledku sinusitídy, migréna)
| Veľmi časté2
| Veľmi časté
| Veľmi časté
|
Závrat
| Časté3
| Veľmi časté
| Veľmi časté
|
|
Poruchy oka
|
Rozmazané videnie, porucha zraku
| Neznáme4
| Časté
| Časté
|
|
|
A
m
brisentan
(
AR
IES•C
a obdobie po uvedení lieku
na trh)
|
A
m
brisentan (AMBITION a ARIES•E)
|
K
ombinácia
s tadalafilom
(
A
MBITION)
|
Poruchy ucha a labyrintu
|
Tinnitus
|
NR
|
NR
|
Časté
|
Náhla strata sluchu
|
NR
|
NR
|
Menej časté
|
|
Poruchy srdca a srdcovej činnosti
|
Srdcové zlyhanie
|
Časté5
|
Časté
|
Časté
|
Palpitácie
|
Časté
|
Veľmi časté
|
Veľmi časté
|
|
Poruchy ciev
|
Hypotenzia
|
Časté3
|
Časté
|
Časté
|
Návaly tepla
|
Časté
|
Časté
|
Veľmi časté
|
Synkopa
|
Menej časté3
|
Časté
|
Časté
|
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Epistaxa
|
Časté3
|
Časté
|
Časté
|
Dyspnoe
|
Časté3,6
|
Veľmi časté
|
Veľmi časté
|
Kongescia v oblasti horných dýchacích ciest (napr. kongescia nosovej sliznice, kongescia sliznice prinosových dutín), sinusitída, nazofaryngitída, rinitída
|
Časté7
|
|
|
Nazofaryngitída
|
|
Veľmi časté
|
Veľmi časté
|
Sinusitída, rinitída
|
|
Časté
|
Časté
|
Kongescia nosovej sliznice
|
|
Veľmi časté
|
Veľmi časté
|
|
Poruchy gastrointestinálneho traktu
|
Nauzea, vracanie, hnačka
|
Časté3'
|
|
|
Nauzea
|
|
Veľmi časté
|
Veľmi časté
|
Vracanie
|
|
Časté
|
Veľmi časté
|
Hnačka
|
|
Veľmi časté
|
Veľmi časté
|
Bolesť brucha
|
Časté
|
Časté
|
Časté
|
Zápcha
|
Časté
|
Časté
|
Časté
|
|
Poruchy pečene a žlčových ciest
|
Poškodenie pečene (pozri časť 4.4)
|
Menej časté3,8
|
NR
|
NR
|
Autoimunitná hepatitída (pozri
časť 4.4)
|
Menej časté3,8
|
NR
|
NR
|
Zvýšené hladiny pečeňových
transamináz
|
Časté3
|
NR
|
NR
|
|
Poruchy kože a podkožného tkaniva
|
Vyrážka
|
NR
|
Časté9
|
Časté9
|
|
|
A
m
brisentan
(
AR
IES•C
a obdobie po uvedení lieku
na trh)
|
A
m
brisentan (AMBITION a ARIES•E)
|
K
ombinácia
s tadalafilom
(
A
MBITION)
|
C
elkové poruchy a reakcie v mieste podania
|
Periférny edém, retencia tekutín
|
Veľmi časté
|
Veľmi časté
|
Veľmi časté
|
Bolesť/nepríjemný pocit na hrudníku
|
Časté
|
Časté
|
Veľmi časté
|
Slabosť
|
Časté3
|
Časté
|
Časté
|
Únava
|
Časté3
|
Veľmi časté
|
Veľmi časté
|
NR – nehlásené
1 Pozri časť
„Popis vybraných nežiaducich reakcií“.
2 Frekvencia bolesti hlavy bola zvyčajne vyššia pri liečbe 10 mg dávkou ambrisentanu.
3 Údaje sa získali z obdobia sledovania počas rutinného dohľadu nad liekmi a frekvencie sú založené
na skúsenostiach z placebom kontrolovaných klinických skúšaní.
4 Údaje sa získali z obdobia sledovania počas rutinného dohľadu nad liekmi.
5 Väčšina hlásených prípadov srdcového zlyhania bola spojená s retenciou tekutín. Údaje sa získali z obdobia sledovania počas rutinného dohľadu nad liekmi, frekvencie sú založené na štatistickom
modelovaní údajov z placebom kontrolovaných klinických skúšaní.
6 Prípady zhoršujúceho sa dyspnoe nejasnej etiológie boli hlásené v krátkom čase po začatí liečby
ambrisentanom.
7 Počas liečby ambrisentanom súvisel výskyt kongescie nosovej sliznice s dávkou.
8 Počas liečby ambrisentanom boli hlásené prípady autoimunitnej hepatitídy, vrátane prípadov
exacerbácie autoimunitnej hepatitídy a poškodenia pečene.
9 Vyrážka zahŕňa erytematóznu vyrážku, generalizovanú vyrážku, papulóznu vyrážku a pruritickú
vyrážku.
Popis vybraných nežiaducich reakciíZníženákoncentráciahemoglobínuV období po uvedení lieku na trh boli hlásené prípady anémie vyžadujúcej si transfúziu krvi (pozri
časť 4.4). Frekvencia zníženej koncentrácie hemoglobínu (anémia) bola vyššia pri liečbe 10 mg
dávkou ambrisentanu. Vo všetkých 12týždňových placebom kontrolovaných klinických štúdiách
fázy 3 došlo u pacientov v skupine s ambrisentanom k zníženiu priemernej koncentrácie hemoglobínu,
ktoré bolo zistené už v 4. týždni (zníženie o 0,83 g/dl); priemerné zmeny oproti východiskovej koncentrácii sa zvyčajne stabilizovali počas nasledujúcich 8 týždňov. U celkovo 17 pacientov (6,5 %) v skupine s ambrisentanom sa koncentrácia hemoglobínu znížila o ≥ 15 % oproti východiskovej koncentrácii a klesla pod dolnú hranicu referenčného rozpätia.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieU pacientov s PAH nie sú skúsenosti s podávaním ambrisentanu v denných dávkach vyšších ako
10 mg. U zdravých dobrovoľníkov bolo podanie jednorazovej dávky 50 a 100 mg (5 až 10násobok maximálnej odporúčanej dávky) spojené s bolesťou hlavy, návalmi tepla, závratmi, nauzeou
a kongesciou nosovej sliznice.
Vzhľadom na mechanizmus účinku by predávkovanie ambrisentanom mohlo potenciálne spôsobiť hypotenziu (pozri časť 5.3). V prípade výraznej hypotenzie môže byť potrebná aktívna kardiovaskulárna podpora. Nie je k dispozícii špecifické antidotum.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antihypertenzíva, iné antihypertenzíva, ATC kód: C02KX02
Mechanizmus účinku
Ambrisentan je perorálne účinný derivát kyseliny propiónovej a ERA so selektivitou pre receptor pre
endotelín A (ETA). Endotelín má významnú úlohu v patofyziológii PAH.
Ambrisentan je účinný (Ki 0,016 nM) a vysoko selektívny antagonista ETA (približne 4 000•násobne
selektívnejší pre ETA ako pre ETB).
Ambrisentan blokuje ETA receptorový podtyp, ktorý sa nachádza predovšetkým na bunkách hladkého
svalstva ciev a srdcových myocytoch. To zabraňuje endotelínom sprostredkovanej aktivácii sekundárnych signálnych systémov, čo má za následok vazokonstrikciu a proliferáciu buniek hladkého svalstva.
Očakáva sa, že vďaka selektivite ambrisentanu pre ETA receptor a nie pre ETB receptor sa zachová
ETB receptorom sprostredkovaná tvorba vazodilatačných látok, oxidu dusnatého a prostacyklínu.
Klinická účinnosť abezpečnosť
Boli vykonané dve randomizované, dvojito zaslepené, multicentrické, placebom kontrolované pivotné
štúdie fázy 3 (ARIES•1 a 2). Štúdia ARIES1 zahŕňala 201 pacientov a porovnala 5 mg a 10 mg dávku ambrisentanu s placebom. Štúdia ARIES2 zahŕňala 192 pacientov a porovnala 2,5 mg a 5 mg dávku
ambrisentanu s placebom. V oboch štúdiách bol ambrisentan pridaný k podpornému/základnému lieku
pacientov, čo mohlo zahŕňať podávanie v kombinácii s digoxínom, antikoagulanciami, diuretikami, kyslíkom a vazodilatanciami (blokátory kalciových kanálov, ACE inhibítory). Zaradení pacienti mali IPAH alebo PAH spojenú s ochorením spojivového tkaniva (PAH-CTD). Väčšina pacientov mala príznaky funkčnej triedy II (38,4 %) alebo III (55,0 %) podľa SZO. Pacienti s už existujúcim ochorením pečene (s cirhózou alebo s klinicky významne zvýšenými hodnotami aminotransferáz)
a pacienti používajúci inú cielenú liečbu PAH (napr. prostanoidy) boli vylúčení. Hemodynamické
parametre neboli v týchto štúdiách hodnotené.
Primárnym cieľovým ukazovateľom definovaným pre štúdie fázy 3 bolo zlepšenie záťažovej kapacity hodnotené prostredníctvom zmeny oproti východiskovej hodnote v 6•minútovom teste chôdzou (6•minute walk distance, 6MWD) v 12. týždni. V oboch štúdiách viedla liečba ambrisentanom
k významnému zlepšeniu v 6MWD pri každej dávke ambrisentanu.
Na placebo korigované zlepšenie priemernej hodnoty v 6MWD v 12. týždni oproti východiskovej hodnote v skupine s 5 mg dávkou bolo 30,6 m (95 % IS: 2,9 až 58,3; p = 0,008) v štúdii ARIES1 a 59,4 m (95 % IS: 29,6 až 89,3; p < 0,001) v štúdii ARIES2. Na placebo korigované zlepšenie
priemernej hodnoty v 6MWD v 12. týždni u pacientov v skupine s 10 mg dávkou v štúdii ARIES•1
bolo 51,4 m (95 % IS: 26,6 až 76,2; p < 0,001).
Uskutočnila sa vopred špecifikovaná kombinovaná analýza štúdií fázy 3 (ARIES•C). Na placebo korigované priemerné zlepšenie v 6MWD bolo 44,6 m (95 % IS: 24,3 až 64,9; p < 0,001) pri 5 mg dávke a 52,5 m (95 % IS: 28,8 až 76,2; p < 0,001) pri 10 mg dávke.
V štúdii ARIES2 ambrisentan (skupina s kombinovanou dávkou) významne spomalil čas do klinického zhoršenia PAH v porovnaní s placebom (p < 0,001), hazard ratio preukázalo 80 % zníženie (95 % IS: 47 % až 92 %). Hodnotené premenné zahŕňali: úmrtie, transplantáciu pľúc, hospitalizáciu kvôli PAH, septostómiu predsiení, pridanie ďalších látok na liečbu PAH a kritériá pre predčasné ukončenie liečby. V skupine s kombinovanou dávkou sa pozorovalo štatisticky významné zvýšenie (3,41 ± 6,96) skóre škály hodnotiacej fyzické fungovanie v rámci dotazníka o zdraví SF-36
v porovnaní s placebom (−0,20 ± 8,14, p = 0,005). Liečba ambrisentanom viedla k štatisticky významnému zlepšeniu skóre Borgovej škály hodnotiacej dýchavičnosť (Borg Dyspnea Index, BDI) v 12. týždni (na placebo korigované skóre BDI v hodnote −1,1 (95 % IS: −1,8 až −0,4; p = 0,019; skupina s kombinovanou dávkou)).
Dlhodobé údaje
Pacienti, ktorí sa zúčastnili štúdie ARIES1 a ARIES2, mohli byť zaradení do dlhodobej otvorenej
predĺženej štúdie ARIESE (n = 383). Kombinovaná priemerná expozícia bola približne
145 ± 80 týždňov a maximálna expozícia bola približne 259 týždňov. Hlavné primárne cieľové ukazovatele tejto štúdie boli výskyt a závažnosť nežiaducich udalostí súvisiacich s dlhodobou expozíciou ambrisentanu, vrátane sérových LFT (funkčných vyšetrení pečene). Zistenia ohľadom bezpečnosti pozorované pri dlhodobej expozícii ambrisentanu v tejto štúdii boli zvyčajne zhodné s tými, ktoré sa pozorovali v 12týždňových placebom kontrolovaných štúdiách.
Pravdepodobnosť prežitia zistená u jedincov užívajúcich ambrisentan (skupina s kombinovanou dávkou ambrisentanu) bola po 1 roku 93 %, po 2 rokoch 85 % a po 3 rokoch 79 %.
V otvorenej štúdii (AMB222) bol ambrisentan skúmaný u 36 pacientov za účelom zhodnotenia výskytu zvýšených sérových koncentrácií aminotransferáz u pacientov, ktorí prerušili predchádzajúcu liečbu iným ERA kvôli abnormalitám aminotransferáz. Počas priemerne 53 týždňov liečby ambrisentanom sa u žiadneho zo zaradených pacientov nepotvrdila hodnota sérovej ALT > 3× ULN, ktorá by vyžadovala trvalé ukončenie liečby. Počas tejto doby bola u päťdesiatich percent pacientov dávka ambrisentanu zvýšená z 5 mg na 10 mg.
Kumulatívny výskyt abnormalít sérových aminotransferáz > 3× ULN vo všetkých štúdiách fázy 2 a 3 (vrátane príslušných otvorených predĺžených štúdií) bol 17 zo 483 jedincov počas priemernej doby expozície 79,5 týždňa. To pri ambrisentane zodpovedá miere výskytu 2,3 udalosti na
100 pacientorokov expozície. V otvorenej dlhodobej predĺženej štúdii ARIESE sa zistilo, že po
2 rokoch liečby je riziko vzniku vzostupov koncentrácií aminotransferáz na > 3× ULN u pacientov
liečených ambrisentanom 3,9 %.
Ďalšie klinickéinformácie
Zlepšenie hemodynamických parametrov sa pozorovalo u pacientov s PAH po 12 týždňoch (n = 29)
v štúdii fázy 2 (AMB220). Liečba ambrisentanom viedla k zvýšeniu priemerného srdcového indexu, zníženiu priemerného tlaku v pľúcnych artériách a zníženiu priemernej pľúcnej cievnej rezistencie.
Pri liečbe ambrisentanom bol hlásený pokles systolického a diastolického krvného tlaku. V placebom kontrolovaných klinických skúšaniach trvajúcich 12 týždňov sa zistil priemerný pokles systolického krvného tlaku o 3 mmHg a diastolického krvného tlaku o 4,2 mmHg, keď sa porovnali hodnoty namerané na začiatku a na konci liečby. Priemerný pokles systolického a diastolického krvného tlaku pretrvával počas až 4 rokov liečby ambrisentanom v dlhodobej otvorenej predĺženej štúdii ARIESE.
Počas štúdie liekových interakcií u zdravých dobrovoľníkov nebol pozorovaný klinicky významný vplyv na farmakokinetiku ambrisentanu alebo sildenafilu a táto kombinácia bola dobre znášaná. Počet pacientov, ktorí boli súbežne liečení ambrisentanom a sildenafilom, bol 22 pacientov (5,7 %) v štúdii ARIES•E a 17 pacientov (47 %) v štúdii AMB222. U týchto pacientov sa nezistili žiadne ďalšie bezpečnostné obavy.
Klinická účinnosť vkombinácii s tadalafilom
Uskutočnila sa multicentrická, dvojito zaslepená, aktívnymi komparátormi kontrolovaná štúdia fázy 3
typu „event-driven“
(dosiahnutie cieľa štúdie bolo podmienené výskytom vopred definovanej príhody), ktorá sledovala efekt liečby (AMB112565/AMBITION) s cieľom zhodnotiť účinnosť začiatočnej liečby kombináciou
ambrisentanu a tadalafilu v porovnaní s monoterapiou buď ambrisentanom, alebo tadalafilom,
u 500 pacientov s PAH bez predchádzajúcej liečby, ktorí boli na uvedené liečby randomizovaní v pomere 2:1:1. Žiadni pacienti neužívali samotné placebo. Primárna analýza porovnala skupinu s kombinovanou liečbou so súhrnne hodnotenými skupinami s monoterapiami. Uskutočnili sa aj
podporné porovnania skupiny s kombinovanou liečbou s jednotlivými skupinami s monoterapiami. Pacienti s významnou anémiou, s retenciou tekutín alebo so zriedkavými ochoreniami sietnice boli
z účasti na štúdii vylúčení na základe kritérií stanovených skúšajúcimi lekármi. Z účasti na štúdii boli
vylúčení aj pacienti, ktorí mali východiskové hodnoty ALT a AST > 2 × ULN.
Pri vstupe do štúdie bolo 96 % pacientov bez predchádzajúcej špecifickej liečby PAH a medián času od stanovenia diagnózy do zaradenia do štúdie bol 22 dní. Pacienti začali liečbu 5 mg ambrisentanu
a 20 mg tadalafilu a v 4. týždni mali dávku tadalafilu titrovanú na 40 mg a v 8. týždni mali dávku
ambrisentanu titrovanú na 10 mg, pokiaľ nemali žiadne problémy so znášanlivosťou liečby. Medián trvania dvojito zaslepenej liečby bol pri kombinovanej liečbe dlhší ako 1,5 roku.
Primárnym cieľovým ukazovateľom bol čas do prvého výskytu príhody, ktorou bolo klinické zlyhanie
liečby definované ako:
– smrť alebo
– hospitalizácia z dôvodu zhoršujúcej sa PAH,
– progresia ochorenia,
– neuspokojivá dlhodobá klinická odpoveď na liečbu.
Priemerný vek všetkých pacientov bol 54 rokov (SD 15; vekové rozmedzie 18 – 75 rokov). Pri vstupe do štúdie boli pacienti vo FT II (31 %) a FT III (69 %) podľa SZO. Najčastejšou etiológiou v populácii tejto štúdie bola idiopatická alebo dedičná PAH (56 %), po nej nasledovala PAH zapríčinená poruchami spojivového tkaniva (37 %), PAH súvisiaca s liekmi a toxínmi (3 %), s korigovanou jednoduchou vrodenou srdcovou chybou (2 %) a s HIV (2 %). Pacienti vo FT II a III podľa SZO mali priemernú východiskovú hodnotu v 6MWD rovnú 353 metrom.
Cieľové ukazovateleefektuliečby
Kombinovaná liečba viedla v porovnaní so súhrnne hodnotenými skupinami s monoterapiami
k 50 % zníženiu rizika (hazard ratio [HR] 0,502; 95 % IS: 0,348 až 0,724; p = 0,0002) výskytu združeného cieľového ukazovateľa, ktorým bolo klinické zlyhanie liečby, a to až do hodnotenia na záverečnej návšteve [graf 1 a tabuľka 1]. Efekt liečby bol založený na 63 % znížení počtu hospitalizácií pri kombinovanej liečbe, dosiahol sa v krátkom čase a zostal zachovaný. Účinnosť kombinovanej liečby z hľadiska primárneho cieľového ukazovateľa sa preukázala aj v porovnaní s jednotlivými monoterapiami a naprieč podskupinami vytvorenými na základe veku, etnického pôvodu, geografickej oblasti, etiológie (iPAH/hPAH a PAH-CTD). Efekt liečby bol významný
u pacientov vo FC II aj u pacientov vo FC III.

Graf 1
| Čas do klinického zlyhania liečby
|
Pacienti bez príhody (%)
| 1 rok 88,9 %
2 roky 79,7 %
3 roky 67,6 %
1 rok 75,5 %
2 roky 63,2 %
3 roky 56,1 %
Kombinovaná liečba HR: 0,502
95 % IS (0,348; 0,724)
Monoterapie – súhrnne p = 0,0002
|
|
Čas (týždne)
|
Počet pacientov v riziku:
Kombinácia:
| 253
| 229
| 186
| 145
| 106
| 71
| 36
| 4
|
Monoterapie – súhrnne:
| 247
| 209
| 155
| 108
| 77
| 49
| 25
| 5
|
Tabuľka 1
| Ambrisentan +
tadalafil
(N = 253)
| Monoterapie –
súhrnne
(N = 247)
| Ambrisentan
v monoterapii
(N = 126)
| Tadalafil
v monoterapii
(N = 121)
|
Čas do prvej príhody klinického zlyhania liečby (formálne posúdenej)
|
Klinické zlyhanie
liečby, počet (%)
|
46 (18 %)
|
77 (31 %)
|
43 (34)
|
34 (28)
|
Hazard ratio (95 % IS)
|
| 0,502
(0,348; 0,724)
| 0,477
(0,314; 0,723)
| 0,528
(0,338; 0,827)
|
p•hodnota, log-rank test
|
| 0,0002
| 0,0004
| 0,0045
|
Zložky tvoriace prvú príhodu klinického zlyhania liečby (formálne posúdené)
|
Smrť (z akýchkoľvek príčin)
|
9 (4 %)
|
8 (3 %)
|
2 (2)
|
6 (5)
|
Hospitalizácia z dôvodu
zhoršujúcej sa PAH
|
10 (4 %)
|
30 (12 %)
|
18 (14)
|
12 (10)
|
Progresia ochorenia
| 10 (4 %)
| 16 (6 %)
| 12 (10)
| 4 (3)
|
Neuspokojivá dlhodobá klinická odpoveď na liečbu
|
17 (7 %)
|
23 (9 %)
|
11 (9)
|
12 (10)
|
Čas do prvej hospitalizácie z dôvodu zhoršujúcej sa PAH (formálne posúdenej)
|
Prvá hospitalizácia,
počet (%)
|
19 (8 %)
|
44 (18 %)
|
27 (21 %)
|
17 (14 %)
|
Hazard ratio (95 % IS)
|
| 0,372
| 0,323
| 0,442
|
p•hodnota, log-rank test
|
| 0,0002
| < 0,0001
| 0,0124
|
Sekundárna cieľové ukazovateleHodnotené boli sekundárne cieľové ukazovatele:
Tabuľka 2
Sekundárna cieľové ukazovatele (zmena v 24. týždni
v porovnaní
s východiskovým stavom)
|
Ambrisentan +
tadalafil
|
Monoterapie –
súhrnne
|
Rozdiel
a interval
spoľahlivosti
|
p•hodnota
|
NT-proBNP (% zníženie)
|
−67,2
|
−50,4
| % rozdiel:
−33,8;
95 % IS: −44,8;
−20,7
|
p < 0,0001
|
% osôb, ktoré
v 24. týždni dosiahli
uspokojivú klinickú
odpoveď na liečbu
|
39
|
29
| Pomer šancí:
1,56;
95 % IS: 1,05;
2,32
|
p = 0,026
|
6MWD (metre, medián zmeny)
|
49,0
|
23,8
| 22,75 m;
95 % IS: 12,00;
33,50
|
p < 0,0001
|
IdiopatickápľúcnafibrózaUskutočnila sa štúdia so 492 pacientmi (ambrisentan N = 329, placebo N = 163) s idiopatickou
pľúcnou fibrózou (IPF), z ktorých 11 % malo sekundárnu pľúcnu hypertenziu (skupiny 3 podľa SZO), ktorá však bola predčasne ukončená, keď sa zistilo, že nie je možné splniť primárny cieľový ukazovateľ účinnosti (štúdia ARTEMIS-IPF). V skupine s ambrisentanom sa pozorovalo 90 prípadov (27 %) progresie IPF (vrátane hospitalizácie
z dôvodu respiračných ťažkostí) alebo úmrtia v porovnaní s 28 prípadmi (17 %) v skupine s placebom. Ambrisentan je preto kontraindikovaný u pacientov s IPF so sekundárnou pľúcnou hypertenziou alebo
bez nej (pozri časť 4.3).
5.2 Farmakokinetické vlastnostiAbsorpciaAmbrisentan sa u ľudí rýchlo absorbuje. Po perorálnom podaní sa maximálne plazmatické
koncentrácie (Cmax) ambrisentanu zvyčajne dosiahnu v priebehu približne 1,5 hodiny po podaní dávky spolu s jedlom ako aj nalačno. Cmax a plocha pod krivkou závislosti plazmatickej koncentrácie od času
(AUC) sa zvyšujú úmerne dávke v rozmedzí terapeutických dávok. Rovnovážny stav sa zvyčajne
dosiahne po 4 dňoch opakovaného podávania.
Štúdia skúmajúca vplyv jedla, v ktorej bol ambrisentan podávaný zdravým dobrovoľníkom nalačno a s jedlom s vysokým obsahom tuku poukázala na to, že hodnota Cmax sa znížila o 12 %, zatiaľ čo hodnota AUC zostala nezmenená. Tento pokles maximálnej koncentrácie nie je klinicky významný, a preto sa ambrisentan môže užívať s jedlom alebo bez jedla.
D
i
stribúcia
Ambrisentan sa vo veľkej miere viaže na plazmatické bielkoviny. Väzba ambrisentanu na plazmatické
bielkoviny in•vitro bola v priemere 98,8 % a nezávislá od koncentrácie v rozmedzí 0,2 –
20 mikrogramov/ml.
Ambrisentan sa viaže predovšetkým na albumín (96,5 %) a v menšej miere na alfa1-kyslý glykoproteín.
Distribúcia ambrisentanu do červených krviniek je nízka a priemerný pomer krv: plazma je 0,57 u žien
a 0,61 u mužov.
Biotransformácia
Ambrisentan je nesulfónamidový ERA (je to derivát kyseliny propiónovej).
Ambrisentan je glukuronidovaný niekoľkými izoenzýmami UGT (UGT1A9S, UGT2B7S
a UGT1A3S) na glukuronid ambrisentanu (13 %). Ambrisentan podlieha aj oxidačnému metabolizmu
sprostredkovanému hlavne CYP3A4 a v menšej miere CYP3A5 a CYP2C19, pri ktorom vzniká
4•hydroxymetylambrisentan (21 %), ktorý je ďalej glukuronidovaný na glukuronid
4•hydroxymetylambrisentanu (5 %). Väzbová afinita 4•hydroxymetylambrisentanu k ľudskému receptoru pre endotelín je 65násobne nižšia ako u ambrisentanu. Z tohto dôvodu sa pri koncentráciách
pozorovaných v plazme (približne 4 % oproti pôvodnému ambrisentanu) neočakáva, že sa
4hydroxymetylambrisentan bude podieľať na farmakologickom účinku ambrisentanu.
Údaje in vitro ukazujú, že ambrisentan v koncentrácii 300 μmol/l spôsobil menej ako 50 % inhibíciu
UGT1A1,
UGT1A6, UGT1A9, UGT2B7 (do 30 %) alebo enzýmov 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1
a 3A4 cytochrómu P450 (do 25 %). Ambrisentan v klinicky významných koncentráciách nemá in vitro
žiaden inhibičný vplyv na ľudské transportéry vrátane Pgp, BCRP, MRP2, BSEP, OATP1B1, OATP1B3 a NTCP. Okrem toho ambrisentan neindukoval expresiu proteínov MRP2, Pgp alebo BSEP v potkaních hepatocytoch. Celkovo vzaté, údaje in vitro naznačujú, že sa nepredpokladá, že by ambrisentan v klinicky
významných koncentráciách (plazmatická Cmax do 3,2 μmol/l) mal vplyv na UGT1A1, UGT1A6,
UGT1A9, UGT2B7 alebo enzýmy 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, 3A4 cytochrómu P450
alebo na transport sprostredkovaný BSEP, BCRP, Pgp, MRP2, OATP1B1/3 alebo NTCP.
Vplyv ambrisentanu v rovnovážnom stave (10 mg jedenkrát denne) na farmakokinetiku
a farmakodynamiku jednorazovej dávky warfarínu (25 mg), hodnotený pomocou PT a INR, bol skúmaný u 20 zdravých dobrovoľníkov. Ambrisentan nemal žiadny klinicky významný vplyv na
farmakokinetiku alebo farmakodynamiku warfarínu. Podobne ani súbežné podávanie warfarínu
nemalo vplyv na farmakokinetiku ambrisentanu (pozri časť 4.5).
Vplyv 7dňového podávania sildenafilu (20 mg trikrát denne) na farmakokinetiku jednorazovej dávky ambrisentanu a vplyv 7dňového podávania ambrisentanu (10 mg jedenkrát denne) na farmakokinetiku jednorazovej dávky sildenafilu bol skúmaný u 19 zdravých dobrovoľníkov. Po súbežnom podávaní ambrisentanu sa hodnota Cmax sildenafilu zvýšila o 13 %, avšak okrem toho sa nezistili žiadne ďalšie zmeny farmakokinetických parametrov sildenafilu, N•desmetylsildenafilu a ambrisentanu. Toto
mierne zvýšenie hodnoty Cmax sildenafilu sa nepovažuje za klinicky významné (pozri časť 4.5).
Vplyv ambrisentanu v rovnovážnom stave (10 mg jedenkrát denne) na farmakokinetiku jednorazovej dávky tadalafilu a vplyv tadalafilu v rovnovážnom stave (40 mg jedenkrát denne) na farmakokinetiku jednorazovej dávky ambrisentanu bol skúmaný u 23 zdravých dobrovoľníkov. Ambrisentan nemal žiadny klinicky významný vplyv na farmakokinetiku tadalafilu. Podobne ani súbežné podávanie tadalafilu nemalo vplyv na farmakokinetiku ambrisentanu (pozri časť 4.5).
Vplyv opakovaného podávania ketokonazolu (400 mg jedenkrát denne) na farmakokinetiku jednorazovej 10 mg dávky ambrisentanu bol skúmaný u 16 zdravých dobrovoľníkov. Expozícia
ambrisentanu sa zvýšila o 35 % pri hodnotení pomocou AUC(0–inf) a o 20 % pri hodnotení pomocou Cmax. Táto zmena expozície pravdepodobne nie je klinicky významná, a preto sa ambrisentan môže podávať súbežne s ketokonazolom.
Vplyv opakovaného podávania cyklosporínu A (100 – 150 mg dvakrát denne) na farmakokinetiku ambrisentanu (5 mg jedenkrát denne) v rovnovážnom stave a vplyv opakovaného podávania ambrisentanu (5 mg jedenkrát denne) na farmakokinetiku cyklosporínu A (100 – 150 mg dvakrát denne) v rovnovážnom stave bol skúmaný u zdravých dobrovoľníkov. Pri podávaní opakovaných dávok cyklosporínu A došlo k zvýšeniu hodnoty Cmax a AUC(0–τ) ambrisentanu (48 % a 121 %, v tomto poradí). Na základe týchto zmien sa má pri súbežnom podávaní cyklosporínu A dávka ambrisentanu obmedziť na 5 mg jedenkrát denne (pozri časť 4.2). Podávanie opakovaných dávok ambrisentanu však nemalo klinicky významný vplyv na expozíciu cyklosporínu A a úprava dávky cyklosporínu A nie je potrebná.
Vplyv akútneho a opakovaného podávania rifampicínu (600 mg jedenkrát denne) na farmakokinetiku ambrisentanu (10 mg jedenkrát denne) v rovnovážnom stave bol sledovaný u zdravých dobrovoľníkov. Po podaní úvodných dávok rifampicínu sa pozorovalo prechodné zvýšenie hodnôt AUC(0–τ) ambrisentanu (o 121 % po prvej dávke a o 116 % po druhej dávke rifampicínu), pravdepodobne kvôli inhibícii OATP spôsobenej rifampicínom. Po podávaní opakovaných dávok rifampicínu sa však na
8. deň nezistil klinicky významný vplyv na expozíciu ambrisentanu. Pacienti užívajúci ambrisentan majú byť starostlivo sledovaní pri začatí liečby rifampicínom (pozri časti 4.4 a 4.5).
Vplyv opakovaného podávania ambrisentanu (10 mg) na farmakokinetiku jednorazovej dávky digoxínu bol skúmaný u 15 zdravých dobrovoľníkov. Podávanie opakovaných dávok ambrisentanu spôsobilo mierne zvýšenie AUC0–last a minimálnych (trough) koncentrácií digoxínu a zvýšenie Cmax digoxínu o 29 %. Zvýšenie expozície digoxínu pozorované po podávaní opakovaných dávok ambrisentanu sa nepovažovalo za klinicky významné a úprava dávky digoxínu nie je potrebná (pozri časť 4.5).
Vplyv 12dňového podávania ambrisentanu (10 mg jedenkrát denne) na farmakokinetiku jednorazovej dávky perorálneho kontraceptíva obsahujúceho etinylestradiol (35 μg) a noretindrón (1 mg) bol skúmaný u zdravých dobrovoľníkov. Cmax a AUC(0–∞) boli mierne znížené pri etinylestradiole (o 8 %
a 4 %) a mierne zvýšené pri noretindróne (o 13 % a 14 %). Tieto zmeny v expozícii etinylestradiolom
alebo noretindrónom boli malé a pravdepodobne nie sú klinicky významné (pozri časť 4.5).
Eliminácia
Ambrisentan a jeho metabolity sa vylučujú predovšetkým žlčou po hepatálnom a/alebo
extrahepatálnom metabolizme. Po perorálnom podaní sa približne 22 % podanej dávky zistilo v moči, pričom 3,3 % tvoril ambrisentan v nezmenenej forme. Plazmatický eliminačný polčas u ľudí je
v rozmedzí od 13,6 do 16,5 hodín.
Osobitné skupiny pacientov
Na základe výsledkov populačnej farmakokinetickej analýzy u zdravých dobrovoľníkov a pacientov
s PAH nebola farmakokinetika ambrisentanu významne ovplyvnená pohlavím alebo vekom (pozri
časť 4.2).
Porucha funkcieobličiek
Ambrisentan nepodlieha významnému renálnemu metabolizmu alebo renálnemu klírensu (exkrécii).
V populačnej farmakokinetickej analýze sa zistilo, že klírens kreatinínu je štatisticky významný kovariant ovplyvňujúci perorálny klírens ambrisentanu. U pacientov so stredne ťažkou poruchou
funkcie obličiek je rozsah poklesu perorálneho klírensu mierny (20 – 40 %), a preto pravdepodobne nie je klinicky významný. U pacientov s ťažkou poruchou funkcie obličiek je však potrebná opatrnosť
(pozri časť 4.2).
Porucha funkcie pečene
Hlavné cesty metabolizmu ambrisentanu sú glukuronidácia a oxidácia, po ktorých nasleduje
vylučovanie žlčou, a preto je možné očakávať, že porucha funkcie pečene zvýši expozíciu (Cmax
a AUC) ambrisentanu. V populačnej farmakokinetickej analýze sa zistilo, že perorálny klírens je znížený v dôsledku zvýšených hladín bilirubínu. Vplyv bilirubínu je však len mierne závažný
(u pacienta s hladinou bilirubínu zvýšenou na 4,5 mg/dl by bol perorálny klírens ambrisentanu znížený o približne 30 % v porovnaní s typickým pacientom s hladinou bilirubínu 0,6 mg/dl). Farmakokinetika ambrisentanu nebola skúmaná u pacientov s poruchou funkcie pečene (s cirhózou alebo bez nej).
Z tohto dôvodu sa liečba ambrisentanom nemá začať u pacientov s ťažkou poruchou funkcie pečene
alebo s klinicky významne zvýšenými hodnotami pečeňových aminotransferáz (> 3× ULN) (pozri
časti 4.3 a 4.4).
5.3 Predklinické údaje o bezpečnosti
Vzhľadom na hlavný skupinový farmakologický účinok by podanie veľkej jednorazovej dávky ambrisentanu (t. j. predávkovanie) mohlo znížiť artériový tlak a mohlo by spôsobiť hypotenziu a príznaky súvisiace s vazodilatáciou.
Preukázalo sa, že ambrisentan nie je inhibítor transportu žlčových kyselín ani nevyvoláva zjavnú hepatotoxicitu.
Po dlhodobom podávaní boli u hlodavcov pozorované zápal a zmeny epitelu nosovej dutiny pri expozíciách nižších ako sú terapeutické hladiny u ľudí. Po dlhodobom podávaní vysokých dávok ambrisentanu boli u psov pozorované mierne zápalové reakcie pri expozíciách viac ako 20•násobne prevyšujúcich expozície zistené u pacientov.
U potkanov liečených ambrisentanom bola v nosovej dutine pozorovaná hyperplázia tkaniva nosovej kosti v oblasti nosových mušlí pri expozičných hladinách 3násobne prevyšujúcich klinickú hodnotu AUC. Hyperplázia tkaniva nosovej kosti nebola pozorovaná pri podávaní ambrisentanu myšiam alebo psom. U potkanov je hyperplázia nosovej mušle známou reakciou na zápal nosovej sliznice, a to na základe skúseností s inými látkami.
Ambrisentan bol klastogénny, keď sa testoval vo vysokých koncentráciách v cicavčích bunkách
in vitro. V bakteriálnych testoch a v dvoch štúdiách in vivo na hlodavcoch sa nepreukázali mutagénne
ani genotoxické účinky ambrisentanu.
V 2ročných štúdiách s perorálnym podávaním vykonaných na potkanoch a myšiach sa nepreukázal
karcinogénny potenciál. U samcov potkanov došlo k malému zvýšeniu výskytu fibroadenómov
prsníka, benígneho nádoru, iba pri podávaní najvyššej dávky. Pri tejto dávke bola systémová expozícia ambrisentanu u samcov potkanov (na základe hodnoty AUC v rovnovážnom stave) 6násobne vyššia
ako systémová expozícia dosiahnutá pri klinickej dávke 10 mg/deň.
Atrofia semenníkových tubulov, ktorá bola ojedinelo spojená s aspermiou, bola pozorovaná v štúdiách toxicity po opakovanom podávaní perorálnej dávky a v štúdiách fertility na samcoch potkanov a myší, a to bez stanovenia bezpečnostného rozpätia. Zmeny na semenníkoch neboli plne reverzibilné počas hodnotených období bez podávania dávky. Zmeny na semenníkoch však neboli pozorované v štúdiách na psoch, ktoré trvali až 39 týždňov, a to pri expozícii 35násobne prevyšujúcej hodnotu AUC dosiahnutú u ľudí. U samcov potkanov nemal ambrisentan žiadne účinky na pohyblivosť spermií
pri všetkých skúšaných dávkach (až do 300 mg/kg/deň). Zaznamenal sa mierny (< 10 %) pokles percenta morfologicky normálnych spermií pri dávke 300 mg/kg/deň, ale nie pri dávke 100 mg/kg/deň
(> 9•násobok klinickej expozície dosiahnutej pri dávke 10 mg/deň). Vplyv ambrisentanu na mužskú
fertilitu nie je známy.
Zistilo sa, že ambrisentan mal teratogénne účinky u potkanov a králikov. Abnormality dolnej čeľuste, jazyka a/alebo podnebia boli pozorované pri všetkých skúšaných dávkach. V štúdii na potkanoch sa okrem toho preukázal zvýšený výskyt defektov interventrikulárneho septa, defektov v oblasti ciev
trupu, abnormalít štítnej žľazy a týmu, osifikácie spodinovoklinovej kosti a výskyt umbilikálnej artérie lokalizovanej na ľavej strane močového mechúra namiesto na pravej strane. Teratogenita je suspektným skupinovým účinkom ERA.
Podávanie ambrisentanu samiciam potkanov v neskorom štádiu brezivosti a počas obdobia laktácie viedlo k nežiaducim účinkom na správanie samíc, k zníženému prežívaniu mláďat a k poruche reprodukčnej schopnosti potomkov (pri pitve sa zistili malé semenníky), a to pri expozícii 3•násobne prevyšujúcej hodnotu AUC dosiahnutú u ľudí po podaní maximálnej odporúčanej dávky.
U juvenilných potkanov, ktorým bol ambrisentan podávaný perorálne jedenkrát denne v postnatálnom období od 7. do 26., 36. alebo 62. dňa, sa vyskytlo zníženie hmotnosti mozgu (−3 % až −8 %)
bez morfologických alebo neurobehaviorálnych zmien po tom, ako boli pozorované abnormálne zvuky pri dýchaní, apnoe a hypoxia. Tieto účinky sa vyskytli pri expozíciách približne 1,8 až 7•násobne vyšších ako je expozícia dosiahnutá pri 10 mg dávke u pediatrických pacientov (vo veku
9 až 15 rokov), na základe hodnoty AUC. Klinický význam tohto zistenia pre pediatrickú populáciu nie je úplne objasnený.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety laktóza
mikrokryštalická celulóza (E460i)
sodná soľ kroskarmelózy
magnéziumstearát (E570)
Filmový obal
polyvinylalkohol (čiastočne hydrolyzovaný)
oxid titaničitý (E171)
makrogol mastenec (E553b)
hlinitý lak červene Allura AC (E129)
hlinitý lak indigokarmínu (E132)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
PVC/PVdC blistre.
Veľkosti balenia obsahujúce 30 filmom obalených tabliet a blistre s jednotlivou dávkou po 30 x 1
alebo 60 x 1 filmom obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMylan S.A.S.
117 Allée des Parcs
69800 Saint Priest
Francúzsko
8. REGISTRAČNÉ ČÍSLAEU/1/19/1368/003
EU/1/19/1368/004
EU/1/19/1368/006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. júna 2019
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.