ykonať odhad klírensu kreatinínu pacienta (CL
cr) v ml/min. Hodnotu CL
cr (ml/min) možno odhadnúť zo stanoveného sérového kreatinínu (mg/dl) pomocou nasledovného vzorca:
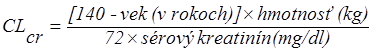
| (x 0,85 pre ženy)
|
Prispôsobenie dávkovania dospelým pacientom s poškodenou funkciou obličiek
Skupina
| Klírens kreatinínu (ml/min)
| Dávkovanie a frekvencia
|
Normálna
| ≥ 80
| 10 mg 1x denne
|
Mierna porucha
| 50 - 79
| 10 mg 1x denne
|
Stredná porucha
| 30 - 49
| 5 mg 1x denne
|
Závažná porucha
| < 30
| 5 mg 1x za 2 dni
|
Konečné štádium ochorenia obličiek - pacienti podstupujúci dialýzu
| < 10
| kontraindikované
|
U detských pacientov trpiacich na poruchu funkcie obličiek je nutné upraviť dávkovanie individuálne s prihliadnutím na hodnotu renálneho klírensu každého pacienta, vek a jeho telesnú hmotnosť.
Pacienti s poškodením funkcie pečeneU pacientov trpiacich len na poškodenie funkcie pečene nie je nutná úprava dávkovania.
Pacienti s poškodením funkcie pečene a poruchou funkcie obličiekOdporúča sa prispôsobenie dávkovania (pozri vyššie Pacienti so stredným až závažným stupňom poruchy funkcie obličiek).
Spôsob podaniaKvapky sa majú nakvapkať na lyžičku alebo rozpustiť vo vode a podávať perorálne.
V prípade, že sa kvapky rozpustia vo vode, je potrebné, obzvlášť pri podávaní deťom, prispôsobiť množstvo vody, v ktorom sa kvapky rozpustia, schopnosti pacienta prehĺtať. Pripravený roztok je potrebné okamžite užiť.
4.3 KontraindikáciePrecitlivenosť na liečivo, na ktorúkoľvek z pomocných látok uvedených v časti 6.1, na hydroxyzín alebo ktorýkoľvek derivát piperazínu.
Pacienti so závažnou poruchou funkcie obličiek s klírensom kreatinínu menším než 10 ml/min.
4.4 Osobitné upozornenia a opatrenia pri používaníPri liečebných dávkach sa nedokázali žiadne klinicky významné interakcie s alkoholom (pri hladine alkoholu v krvi 0,5 g/l). Ak však pacient súbežne užíva alkohol, odporúča sa opatrnosť.
Opatrnosť je potrebná u pacientov s predispozičnými faktormi retencie moču (napr. poškodenie miechy, hyperplázia prostaty), pretože cetirizín môže zvýšiť riziko retencie moču.
Opatrnosť sa odporúča u pacientov s epilepsiou a u pacientov s rizikom výskytu kŕčov.
Metylparabén a propylparabén môžu spôsobiť alergické reakcie (s možnosťou oneskoreného nástupu).
Antihistaminiká inhibujú testy kožnej alergie a preto je potrebné neužívať liek 3 dni pred ich uskutočnením.
Deti a dospievajúciPoužitie lieku sa neodporúča u dojčiat a batoliat mladších ako 2 roky.
4.5 Liekové a iné interakcieVzhľadom na farmakokinetický, farmakodynamický profil a profil znášanlivosti cetirizínu sa neočakávajú žiadne interakcie s týmto antihistaminikom. V uskutočnených štúdiách liekových interakcií neboli aktuálne popísané farmakodynamické ani významné farmakokinetické interakcie, obzvlášť s pseudoefedrínom alebo teofylínom (400 mg/deň).
Príjem potravy neznižuje mieru absorpcie cetirizínu, ale dochádza k zníženiu rýchlosti absorpcie.
4.6 Fertilita, gravidita a laktáciaGravidita
K dispozícii sú veľmi obmedzené poznatky o užívaní cetirizínu v gravidite. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývoj, pôrod alebo postnatálny vývoj. Opatrnosť je potrebná pri predpisovaní lieku tehotným ženám.
Laktácia
Cetirizín sa vylučuje do ľudského mlieka v koncentráciách predstavujúcich 25 % až 90 % koncentrácií, ktoré boli namerané v plazme v závislosti od času odberu vzoriek po podaní. Preto je potrebná opatrnosť pri predpisovaní cetirizínu dojčiacim ženám.
4.7 Ovplyvnenie schopnosti viesť motorové vozidlá a obsluhovať strojeObjektívne meranie schopnosti viesť vozidlá, latencie spánku a výkonnosti pri montážnej linke pri odporúčanej dávke 10 mg nepreukázalo žiadne klinicky významné účinky.
Pacienti, ktorí sa pripravujú viesť vozidlá, zúčastňovať sa na potenciálne nebezpečných činnostiach alebo obsluhovať stroje, by nemali prekračovať odporúčanú dávku a mali by zohľadniť reakcie svojho organizmu na daný liek.
U citlivých pacientov môže súbežné požívanie alkoholu alebo užívanie iných látok tlmiacich CNS vyvolať ďalšie zníženie bdelosti a zníženie výkonnosti.
4.8 Nežiaduce účinkyKlinické štúdie ukázali, že pri odporúčanom dávkovaní má cetirizín mierne nežiaduce účinky na CNS, vrátane ospalosti, únavy, závratu a bolesti hlavy. V niektorých prípadoch sa hlásila paradoxná stimulácia CNS.
Napriek tomu, že cetirizín je selektívny antagonista periférnych H
1 receptorov a nevykazuje relatívne anticholinergné pôsobenie, hlásili sa ojedinelé prípady ťažkostí s močením, poruchy akomodácie oka a pocit sucha v ústach.
Ďalej sa hlásili prípady abnormálnej funkcie pečene so zvýšenou hladinou pečeňových enzýmov, sprevádzané zvýšenou hladinou bilirubínu. Tieto príznaky po ukončení liečby cetirizín dihydrochloridom zväčša odzneli.
Klinické štúdieDvojito-zaslepené kontrolované klinické štúdie porovnávajúce cetirizín s placebom alebo inými antihistaminikami v odporúčanej dávke (10 mg denne u cetirizínu), z ktorých sú k dispozícii kvantifikované údaje o bezpečnosti, zahŕňali vyše 3 200 pacientov, ktorým podávali cetirizín.
Z tohto súboru sa pri dávke cetirizínu 10 mg v štúdiách kontrolovaných placebom hlásili tieto nežiaduce reakcie s mierou výskytu 1,0 % alebo viac:
Nežiaduce reakcie
(WHO-ART)
| Cetirizín 10 mg
(n = 3 260)
| Placebo
(n = 3 061)
|
Telo ako celok - celkové poruchy
Únava
|
1,63 %
|
0,95 %
|
Poruchy centrálnej a periférnej nervovej sústavy
Závraty
Bolesť hlavy
|
1,10 %
7,42 %
|
0,98 %
8,07 %
|
Poruchy gastrointestinálneho traktu
Bolesť brucha
Sucho v ústach
Nevoľnosť
|
0,98 %
2,09 %
1,07 %
|
1,08 %
0,82 %
1,14 %
|
Psychické poruchy
Ospalosť
|
9,63 %
|
5,00 %
|
Poruchy dýchacej sústavy
Zápal hltanu
|
1,29 %
|
1,34 %
|
Napriek tomu, že ospalosť bola štatisticky častejšia než v skupine s placebom, zväčša išlo o prípady miernej až strednej ospalosti. Objektívne testy dokázané inými štúdiami ukázali, že zvyčajné každodenné činnosti pri odporúčanej dennej dávke u zdravých mladých dobrovoľníkov nie sú ovplyvnené.
Nežiaduce reakcie s mierou výskytu 1 % alebo viac u detí vo veku od 6 mesiacov do 12 rokov, vrátane klinických štúdií kontrolovaných placebom, sú:
Nežiaduce reakcie
(WHO-ART)
| Cetirizín 10 mg
(n = 1 656)
| Placebo
(n = 1 294)
|
Poruchy gastrointestinálneho traktu
Hnačka
|
1,0 %
|
0,6 %
|
Psychické poruchy
Ospalosť
|
1,8 %
|
1,4 %
|
Poruchy dýchacej sústavy
Nádcha
|
1,4 %
|
1,1 %
|
Telo ako celok - celkové poruchy
Únava
|
1,0 %
|
0,3 %
|
Skúsenosti po uvedení lieku na trhPopri nežiaducich reakciách hlásených počas klinických štúdií a uvedených vyššie sa v rámci skúseností po uvedení lieku na trh hlásili nasledovné nežiaduce účinky.
Nežiaduce účinky sú popísané podľa tried orgánových systémov MedDRA a podľa odhadovanej frekvencie na základe skúseností po uvedení lieku na trh.
Frekvencie sú definované nasledovne: Veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov).
Poruchy krvi a lymfatického systému:Veľmi zriedkavé: trombocytopénia
Poruchy imunitného systému:Zriedkavé: hypersenzitivita
Veľmi zriedkavé: anafylaktický šok
Poruchy metabolizmu a výživy:Neznáme: zvýšená chuť do jedla
Psychické poruchy:Menej časté: agitovanosť
Zriedkavé: agresivita, zmätenosť, depresia, halucinácie, nespavosť
Veľmi zriedkavé: tiky
Neznáme: myšlienky na samovraždu
Poruchy nervového systému:Menej časté: parestézia
Zriedkavé: kŕče
Veľmi zriedkavé: porucha chuti, synkopa, tras, dystónia, dyskinéza
Neznáme: amnézia, poruchy pamäti
Poruchy oka:Veľmi zriedkavé: porucha akomodácie, neostré/rozmazané videnie, okulogyrácia
Poruchy ucha a labyrintu:Neznáme: vertigo
Poruchy srdca a srdcovej činnosti:Zriedkavé: tachykardia
Poruchy gastrointestinálneho traktu:Menej časté: hnačka
Poruchy pečene a žlčových ciest:Zriedkavé: abnormálna funkcia pečene (zvýšené transaminázy, alkalická fosfatáza, γ-GT a bilirubín)
Poruchy kože a podkožného tkaniva:Menej časté: pruritus, vyrážka
Zriedkavé: urtikária
Veľmi zriedkavé: angioneurotický edém, lokalizované kožné erupcie
Poruchy obličiek a močových ciest:Veľmi zriedkavé: dyzúria, enuréza
Neznáme: retencia moču
Celkové poruchy a reakcie v mieste podania:Menej časté: asténia, celková nevoľnosť;
Zriedkavé: edém.
Laboratórne a funkčné vyšetrenia:Zriedkavé: prírastok telesnej hmotnosti
4.9 PredávkovanieSymptómySymptómy pozorované po predávkovaní cetirizínom sú spojené predovšetkým s účinkami CNS alebo s javmi, ktoré by mohli naznačovať anticholinergný účinok.
Nežiaduce udalosti hlásené po požití minimálne 5‑násobku odporúčanej dennej dávky sú: zmätenosť, hnačka, závraty, únava, bolesť hlavy, celková nevoľnosť, rozšírenie zreničky, svrbenie, nepokoj, sedácia, ospalosť, stupor, tachykardia, tras a zadržiavanie moču.
OpatreniaNie je známe žiadne špecifické antidotum cetirizínu.
Pokiaľ dôjde k predávkovaniu, odporúča sa symptomatická alebo podporná liečba. Odporúča sa zvážiť výplach žalúdka čo najskôr po užití lieku.
Cetirizín nie je účinne odstránený dialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina:Deriváty piperazínu, ATC kód: R06AE07
Cetirizín, ľudský metabolit hydroxyzínu, je účinný a selektívny antagonista periférnych H
1 receptorov. Štúdie viazania receptorov
in vitro nedokázali žiadnu inú merateľnú afinitu pre iné ako H
1 receptory.'
Okrem jeho anti-H
1 účinkov sa u cetirizínu tiež dokázalo antialergické pôsobenie: pri dávke 10 mg jedenkrát alebo dvakrát denne inhibuje neskorú fázu prieniku eozinofilov do pokožky a spojovky atopických pacientov vystavených pôsobeniu antigénov.
Štúdie na zdravých dobrovoľníkoch ukazujú, že cetirizín v dávkach 5 a 10 mg silne inhibuje „wheal and flare“ reakcie vyvolané veľmi vysokými koncentráciami histamínu v pokožke, avšak vzťah k účinnosti nebol stanovený.
Štúdia s deťmi vo veku od 5 do 12 rokov, trvajúca 35 dní, nezistila žiadnu toleranciu na antihistamínový účinok cetirizínu (supresia „wheal and flare“). Po ukončení liečby s opakovaným podávaním cetirizínu pokožka obnoví svoju normálnu reaktivitu na histamín v priebehu 3 dní.
Počas šesťtýždňovej štúdie kontrolovanej placebom, ktorej sa zúčastnilo 186 pacientov s alergickou nádchou a súčasne s miernou až stredne závažnou astmou, dávka 10 mg cetirizínu jedenkrát denne viedla k zlepšeniu symptómov nádchy a neovplyvnila pľúcne funkcie. Táto štúdia podporuje bezpečnosť podávania cetirizínu alergickým pacientom s miernou až stredne závažnou astmou.
V placebom kontrolovanej štúdii cetirizín podávaný vo vysokej dennej dávke 60 mg počas siedmych dní nespôsobil žiadne štatisticky významné predĺženie QT intervalu.
Pri odporúčanom dávkovaní cetirizín preukázal zlepšenie kvality života pacientov s celoročnou alebo sezónnou alergickou rinitídou.
5.2 Farmakokinetické vlastnostiMaximálna plazmatická koncentrácia v rovnovážnom stave je približne 300 ng/ml a dosahuje sa v priebehu 1,0 ± 0,5 h. U cetirizínu sa po denných dávkach 10 mg počas 10 dní nepozorovala kumulácia. Rozloženie farmakokinetických parametrov, ako je maximálna plazmatická koncentrácia (C
max) a plocha pod krivkou (AUC) je u ľudských dobrovoľníkov unimodálne.
Príjmom potravy sa neznižuje miera absorpcie cetirizínu, ale dochádza k zníženiu rýchlosti absorpcie. Biologická dostupnosť cetirizínu je porovnateľná ako v prípade podania cetirizínu vo forme roztoku, kapsúl alebo tabliet.
Zdanlivý distribučný objem je 0,50 l/kg. Väzba na plazmatické bielkoviny je 93 ± 0,3 %. Cetirizín neovplyvňuje väzbu warfarínu na bielkoviny.
Cetirizín nepodlieha extenzívnemu metabolizmu prvého prechodu pečeňou. Približne dve tretiny dávky sa vylučujú močom v nezmenenej forme. Terminálny polčas je približne 10 hodín.
Cetirizín vykazuje v rozsahu 5 až 60 mg lineárnu kinetiku.
Osobitné skupiny pacientov:Starší pacienti: Po podaní jedinej dávky 10 mg perorálne u 16 starších pacientov v porovnaní s normálnymi pacientmi došlo k zvýšeniu polčasu približne o 50 % a klírens klesol o 40 %. Zdá sa, že pokles klírensu cetirizínu u týchto dobrovoľníkov vyššieho veku súvisel s ich zníženou funkciou obličiek.
Deti, dojčatá a batoľatá: U detí vo veku od 6 do 12 rokov bol polčas cetirizínu asi 6 hodín a u detí vo veku od 2 do 6 rokov 5 hodín. U dojčiat a batoliat vo veku od 6 do 24 mesiacov je znížený na 3,1 hodiny.
Pacienti s poškodenou funkciou obličiek: Farmakokinetika liečiva u pacientov s miernou poruchou funkcie obličiek (klírens kreatinínu vyšší než 40 ml/min) bola podobná ako u zdravých dobrovoľníkov. U pacientov so stredne závažnou poruchou funkcie obličiek v porovnaní so zdravými dobrovoľníkmi došlo k trojnásobnému zvýšeniu polčasu a k 70 % zníženiu klírensu.
Pacienti na hemodialýze (klírens kreatinínu nižší ako 7 ml/min), ktorým sa perorálne podala jednorazová dávka 10 mg cetirizínu, mali v porovnaní so zdravými dobrovoľníkmi trojnásobné predĺženie polčasu a 70 % zníženie klírensu. Stupeň odstránenia cetirizínu hemodialýzou bol nízky. U pacientov so stredne závažným alebo závažným poškodením funkcie obličiek je nutné upraviť dávkovanie (pozri časť 4.2).
Pacienti s poškodením funkcie pečene: U pacientov s chronickými chorobami pečene (hepatocelulárna, cholestatická a biliárna cirhóza), ktorým sa podalo 10 alebo 20 mg cetirizínu jednorazovo, v porovnaní so zdravými jedincami došlo k 50 % predĺženiu polčasu a k 40 % zníženiu klírensu.
Úprava dávkovania je nevyhnutná iba u pacientov s poškodením funkcie pečene, ktorí majú súčasne aj poruchu funkcie obličiek.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látok- glycerol
- propylénglykol
- sodná soľ sacharínu
- metylparabén (E218)
- propylparabén (E216)
- octan sodný
- kyselina octová ľadová
- čistená voda
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnostiNeotvorený liek: 5 rokov.
Po prvom otvorení: 3 mesiace
6.4 Špeciálne upozornenia na uchovávanie Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaSklenená fľaša jantárovej farby (typ III) s objemom 10, 15 alebo 20 ml s nízkodenzitným polyetylénovým kvapkadlom a bielym PE uzáverom chráneným pred deťmi.
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomŽiadne zvláštne požiadavky.
7. Držiteľ rozhodnutia o registráciiUCB s.r.o., Thámova 11 – 13, 186 00 Praha 8, Česká republika
8. Registračné číslo24/1030/92-S
9. Dátum registrácie / Dátum predĺženia registrácieDátum prvej registrácie: 30. decembra 1992
Dátum posledného predĺženia: bez obmedzenia
10. Dátum poslednej revízie textuNovember 2012