ť, treba vykonať odhad klírensu kreatinínu pacienta (CL
cr) v ml/min. Hodnotu CL
cr (ml/min) možno odhadnúť zo stanoveného sérového kreatinínu (mg/dl) s pomocou nasledovného vzorca:
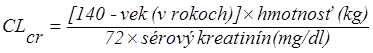
| (x 0,85 pre ženy)
|
Prispôsobenie dávkovania dospelým pacientom s poškodenou funkciou obličiek
Skupina
| Klírens kreatinínu (ml/min)
| Dávkovanie a frekvencia
|
Normálna
| ≥ 80
| 10 mg 1-krát denne
|
Mierna porucha
| 50 - 79
| 10 mg 1-krát denne
|
Stredná porucha
| 30 - 49
| 5 mg 1-krát denne
|
Závažná porucha
| < 30
| 5 mg 1-krát za 2 dni
|
Konečné štádium ochorenia obličiek - pacienti podstupujúci dialýzu
| < 10
| kontraindikované
|
U detských pacientov trpiacich na poruchu obličiek je nutné upraviť dávkovanie individuálne s prihliadnutím na hodnotu renálneho klírensu každého pacienta, vek a jeho hmotnosť.
Pacienti s poškodením pečene: u pacientov trpiacich len na poškodenie pečene nie je nutná úprava dávkovania.
Pacienti s poškodením pečene a poruchou obličiek: odporúča sa prispôsobenie dávkovania (pozri vyššie Pacienti so stredným až závažným stupňom poruchy funkcie obličiek).
4.3 KontraindikáciePrecitlivenosť na liečivo, ktorúkoľvek z pomocných látok, na hydroxyzín alebo akýkoľvek derivát piperazínu.
Pacienti so závažnou poruchou funkcie obličiek s klírensom kreatinínu menším než 10 ml/min.
Pacienti so zriedkavými dedičnými problémami intolerancie fruktózy nemajú užívať cetirizín 1 mg/ml perorálny roztok.
4.4 Osobitné upozornenia a opatrenia pri používaníPri liečebných dávkach sa nedokázali žiadne klinicky významné interakcie s alkoholom (pri hladine alkoholu v krvi 0,5 g/l). Ak však pacient súbežne užíva alkohol, odporúča sa opatrnosť.
Opatrnosť sa odporúča u pacientov s epilepsiou a u pacientov s rizikom výskytu kŕčov.
Použitie lieku sa neodporúča u detí mladších ako 2 roky.
Metylparabén a propylparabén môžu spôsobiť alergické reakcie (s možnosťou oneskoreného nástupu).
4.5 Liekové a iné interakcieVzhľadom na farmakokinetický a farmakodynamický profil a profil znášanlivosti cetirizínu sa neočakávajú interakcie s týmto antihistaminikom. V uskutočnených štúdiách liekových interakcií neboli aktuálne popísané farmakodynamické ani významné farmakokinetické interakcie, obzvlášť s pseudoefedrínom alebo teofylínom (400 mg/deň).
Príjem potravy neznižuje mieru absorpcie cetirizínu, ale dochádza k zníženiu rýchlosti absorpcie.
4.6 Gravidita a laktáciaK dispozícii sú veľmi obmedzené poznatky o užívaní cetirizínu v gravidite. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývoj, pôrod alebo postnatálny vývoj. Opatrnosť je potrebná pri predpisovaní lieku tehotným alebo dojčiacim ženám, pretože cetirizín prechádza do materského mlieka.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeObjektívne meranie schopnosti viesť vozidlá, latencie spánku a výkonnosti pri montážnej linke pri odporúčanej dávke 10 mg nepreukázalo žiadne klinicky relevantné účinky.
Pacienti, ktorí sa pripravujú viesť vozidlá, zúčastňovať sa na potenciálne nebezpečných činnostiach alebo obsluhovať stroje, by nemali prekračovať odporúčanú dávku a mali by zohľadniť reakcie svojho organizmu na daný liek. U týchto citlivých pacientov môže súbežné požívanie alkoholu alebo užívanie iných látok tlmiacich CNS vyvolať ďalšie zníženie bdelosti a zníženie výkonnosti.
4.8 Nežiaduce účinkyKlinické štúdie ukázali, že pri odporúčanom dávkovaní má cetirizín mierne nežiaduce účinky na CNS, vrátane ospalosti, únavy, závratu a bolesti hlavy. V niektorých prípadoch sa hlásila paradoxná stimulácia CNS.
Napriek tomu, že cetirizín je selektívny antagonista periférnych H
1 receptorov a nevykazuje relatívne anticholinergné pôsobenie, hlásili sa ojedinelé prípady ťažkostí s močením, poruchy akomodácie oka a pocit sucha v ústach.
Ďalej sa hlásili prípady abnormálnej funkcie pečene so zvýšenou hladinou pečeňových enzýmov, sprevádzané zvýšenou hladinou bilirubínu. Tieto príznaky po ukončení liečby cetirizínom zväčša odzneli.
Klinické štúdieDvojito-zaslepené kontrolované klinické alebo farmakoklinické štúdie porovnávajúce cetirizín
s placebom alebo inými antihistaminikami v odporúčanej dávke (10 mg denne u cetirizínu), z ktorých
sú k dispozícii kvantifikované údaje o bezpečnosti, zahŕňali vyše 3 200 pacientov, ktorým podávali
cetirizín.
Z tohto súboru sa pri dávke cetirizínu 10 mg v štúdiách kontrolovaných placebom hlásili tieto nežiaduce účinky s mierou výskytu 1,0 % a viac:
Nežiaduci účinok
(WHO-ART)
| Cetirizín 10 mg
(n = 3 260)
| Placebo
(n = 3 061)
|
Telo ako celok - celkové ochorenia
Únava
|
1,63 %
|
0,95 %
|
Poruchy centrálnej a periférnej nervovej sústavy
Závraty
Bolesť hlavy
|
1,10 %
7,42 %
|
0,98 %
8,07 %
|
Poruchya ochorenia gastrointestinálneho traktu
Bolesť brucha
Sucho v ústach
Nevoľnosť
|
0,98 %
2,09 %
1,07 %
|
1,08 %
0,82 %
1,14 %
|
Psychiatrické poruchy a ochorenia
Ospalosť
|
9,63 %
|
5,00 %
|
Ochorenia dýchacej sústavy
Zápal hltanu
|
1,29 %
|
1,34 %
|
Napriek tomu, že ospalosť bola štatisticky častejšia než v skupine s placebom, zväčša išlo o prípady miernej až strednej ospalosti. Objektívne testy dokázané inými štúdiami ukázali, že zvyčajné každodenné činnosti pri odporúčanej dávke u zdravých mladých dobrovoľníkov nie sú ovplyvnené.
Nežiaduce účinky s mierou výskytu 1 % alebo viac u detí vo veku od 6 mesiacov do 12 rokov, vrátane klinických alebo farmakoklinických štúdií kontrolovaných placebom, sú:
Nežiaduca reakcia na liek
(WHO-ART)
| Cetirizín 10 mg
(n = 1 656)
| Placebo
(n = 1 294)
|
Poruchy a ochorenia gastrointestinálneho traktu
Hnačka
|
1,0 %
|
0,6 %
|
Psychiatrické poruchy a ochorenia
Ospalosť
|
1,8 %
|
1,4 %
|
Ochorenia dýchacej sústavy
Nádcha
|
1,4 %
|
1,1 %
|
Telo ako celok - celkové ochorenia
Únava
|
1,0 %
|
0,3 %
|
Post-marketingové skúsenostiPopri nežiaducich účinkoch hlásených počas klinických štúdií a uvedených vyššie sa v rámci post- marketingových skúseností (po uvedení lieku na trh) hlásili nasledovné ojedinelé nežiaduce reakcie. Pre tieto menej často hlásené nežiaduce účinky je ich odhadovaný výskyt (menej časté: ≥ 1/1 000 až < 1/100, zriedkavé: ≥ 1/10 000 až < 1/1 000, veľmi zriedkavé: < 1/10 000) založený na post- marketingovej skúsenosti.
Ochorenia krvi a lymfatického systému:veľmi zriedkavé: trombocytopénia.
Poruchy imunitného systému:zriedkavé: hypersenzitivita;
veľmi zriedkavé: anafylaktický šok.
Psychiatrické poruchy a ochorenia:menej časté: agitovanosť;
zriedkavé: agresivita, zmätenosť, depresia, halucinácie, nespavosť;
veľmi zriedkavé: tiky.
Poruchy nervového systému:menej časté: parestézia;
zriedkavé: kŕče, poruchy pohybu;
veľmi zriedkavé: porucha chuti, synkopa, tras, dystónia, dyskinézia.
Ochorenia oka:veľmi zriedkavé: poruchy akomodácie šošovky, neostré/rozmazané videnie, mimovoľné cirkulárne pohyby očnej gule.
Ochorenia srdca a poruchy srdcovej činnosti:zriedkavé: tachykardia.
Poruchy a ochorenia gastrointestinálneho traktu:menej časté: hnačka.
Ochorenia pečene a žlčových ciest:zriedkavé: abnormálna funkcia pečene (zvýšené transaminázy, alkalická fosfatáza, γ-GT a bilirubín).
Poruchy kože a podkožného tkaniva:menej časté: pruritus, vyrážka;
zriedkavé: urtikária;
veľmi zriedkavé: angioneurotický edém, lokalizované kožné erupcie.
Poruchy obličiek a močových ciest:veľmi zriedkavé: ťažkosti s močením, enuréza.
Celkové poruchy a reakcie v mieste podania:menej časté: asténia, nevoľnosť;
zriedkavé: edém.
Abnormálne laboratórne a funkčné vyšetrenia:zriedkavé: prírastok hmotnosti.
4.9 PredávkovanieSymptómySymptómy pozorované po predávkovaní cetirizínom sú spojené predovšetkým s účinkami CNS alebo s javmi, ktoré by mohli naznačovať anticholinergný účinok.
Nežiaduce udalosti hlásené po požití minimálne 5 odporúčaných denných dávok sú: zmätenosť, hnačka, závraty, únava, bolesť hlavy, nevoľnosť, rozšírenie zreničky, svrbenie, nepokoj, sedácia, ospalosť, stupor, tachykardia, tras a zadržiavanie moču.
OpatreniaNie je známe žiadne špecifické antidotum cetirizínu.
Pokiaľ dôjde k predávkovaniu, odporúča sa symptomatická alebo podporná liečba. Odporúča sa zvážiť výplach žalúdka čo najskôr po užití lieku.
Cetirizín nie je účinne odstránený dialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina:Deriváty piperazínu
ATC kód: R06AE07
Cetirizín, ľudský metabolit hydroxyzínu, je účinný a selektívny antagonista periférnych H
1 receptorov. Štúdie viazania receptorov
in vitro nedokázali žiadnu inú merateľnú afinitu pre iné ako H
1 receptory.
Okrem jeho anti-H
1 účinkov sa u cetirizínu tiež dokázalo antialergické pôsobenie: pri dávke 10 mg jedenkrát alebo dvakrát denne inhibuje neskorú fázu prieniku eozinofilov do pokožky a spojovky atopických pacientov vystavených pôsobeniu antigénov.
Štúdie na zdravých dobrovoľníkoch ukazujú, že cetirizín v dávkach 5 a 10 mg silne inhibuje „wheal and flare“ reakciu vyvolanú veľmi vysokými koncentráciami histamínu v pokožke, avšak vzťah k účinnosti nebol stanovený.
Štúdia s deťmi vo veku od 5 do 12 rokov, trvajúca 35 dní, nezistila žiadnu toleranciu na antihistamínový účinok cetirizínu (inhibícia „wheal and flare“). Po ukončení liečby s opakovaným podávaním cetirizínu pokožka obnoví svoju normálnu reaktivitu na histamín v priebehu 3 dní.'
Počas šesťtýždňovej štúdie kontrolovanej placebom, na ktorej sa zúčastnilo 186 pacientov s alergickou nádchou a súčasne s miernou až stredne závažnou astmou, dávka 10 mg cetirizínu jedenkrát denne viedla k zlepšeniu symptómov nádchy a neovplyvnila pľúcne funkcie. Táto štúdia podporuje bezpečnosť podávania cetirizínu alergickým pacientom s miernou až stredne závažnou astmou.
V placebom kontrolovanej štúdii cetirizín podávaný vo vysokých denných dávkach 60 mg počas 7 dní nespôsobil žiadne štatisticky významné predĺženie QT intervalu.
Pri odporúčanom dávkovaní cetirizín preukázal zlepšenie kvality života pacientov s celoročnou alebo sezónnou alergickou rinitídou.
5.2 Farmakokinetické vlastnostiMaximálna plazmatická koncentrácia v rovnovážnom stave je približne 300 ng/ml a dosiahne sa za 1,0 ± 0,5 h. U cetirizínu sa po denných dávkach 10 mg počas 10 dní nepozorovala akumulácia. Rozloženie farmakokinetických parametrov, ako je maximálna plazmatická koncentrácia (C
max) a plocha pod krivkou (AUC) je u ľudských dobrovoľníkov unimodálne.
Príjmom potravy sa neznižuje miera absorpcie cetirizínu, ale dochádza k zníženiu rýchlosti absorpcie. Biologická dostupnosť cetirizínu je porovnateľná ako v prípade podania cetirizínu vo forme roztoku, kapsúl alebo tabliet.
Zdanlivý distribučný objem je 0,50 l/kg. Väzba na plazmatické bielkoviny je 93 ± 0,3 %. Cetirizín neovplyvňuje väzbu warfarínu na plazmatické bielkoviny.
Pri prvom prechode („first-pass“) pečeňou cetirizín neprechádza extenzívnym metabolizmom. Približne dve tretiny dávky sa bez zmeny vylučujú močom. Biologický polčas je približne 10 hodín.
Cetirizín vykazuje v rozsahu 5 až 60 mg lineárnu kinetiku.
Osobitné skupiny populácieStarší pacienti: Po podaní jedinej dávky 10 mg perorálne u 16 starších pacientov v porovnaní s normálnymi pacientmi došlo k zvýšeniu polčasu približne o 50 % a klírens klesol o 40 %. Zdá sa, že pokles klírensu cetirizínu u týchto dobrovoľníkov vyššieho veku súvisel s ich zníženou funkciou obličiek.
Deti, dojčatá a batoľatá: U detí vo veku od 6 do 12 rokov bol biologický polčas cetirizínu asi 6 hodín a u detí vo veku od 2 do 6 rokov 5 hodín. U dojčiat a batoliat vo veku od 6 do 24 mesiacov je znížený na 3,1 hodiny.
Pacienti s poškodenou funkciou obličiek: Farmakokinetika lieku u pacientov s miernou poruchou obličiek (klírens kreatinínu vyšší než 40 ml/min) bola podobná ako u zdravých dobrovoľníkov. U pacientov so stredne závažnou poruchou obličiek v porovnaní so zdravými dobrovoľníkmi došlo k trojnásobnému zvýšeniu biologického polčasu a k 70 % zníženiu klírensu.
Pacienti na hemodialýze (klírens kreatinínu nižší ako 7 ml/min), ktorým sa perorálne podala jednorazová dávka 10 mg, mali v porovnaní so zdravými dobrovoľníkmi trojnásobné predĺženie biologického polčasu a 70 % zníženie klírensu. Stupeň odstránenia cetirizínu hemodialýzou bol nízky. U pacientov so stredne závažným alebo závažným poškodením obličiek je nutné upraviť dávkovanie (pozri časť 4.2).
Pacienti s poškodením pečene: U pacientov s chronickými chorobami pečene (hepatocelulárna, cholestatická a biliárna cirhóza), ktorým sa podalo 10 alebo 20 mg cetirizínu jednorazovo, v porovnaní so zdravými jedincami došlo k 50 % predĺženiu biologického polčasu a k 40 % zníženiu klírensu.
Úprava dávkovania je nevyhnutná iba u pacientov s poškodením pečene, ktorí majú súčasne aj poruchu funkcie obličiek.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látok Methylparabenum, propylparabenum, glycerolum 85 %, propylenglycolum, sorbitolum 70 % non cristallisabile, saccharinum natricum dihydricum, natrii acetas trihydricus, acidum aceticum 99 %, aroma musae, aqua purificata.
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti3 roky
6.4 Špeciálne upozornenia na uchovávanieUchovávanie nevyžaduje žiadne zvláštne podmienky.
6.5 Druh obalu a obsah baleniaObal: hnedá sklenená fľaštička so závitovým uzáverom s detskou poistkou z PE/PP, dávkovacia pipeta, písomná informácia pre používateľov, papierová škatuľka.
Veľkosť balenia: 100 ml
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom Návod na odmeranie presnej dávky sirupu:1. Obsah uzatvorenej fľaše dôkladne pretrepte (asi 5 sekúnd).
2. Liekovka je opatrená detským bezpečnostným uzáverom.
Ak chcete otvoriť: stlačte uzáver pevne nadol a odskrutkujte proti smeru hodinových ručičiek.
3. Zatlačte dávkovaciu trubičku cez hrdlo fľaše do sirupu. Fľaša sa neobracia hore dnom.
4. Pomocou piestu dávkovacej trubičky natiahnite požadovanú dávku sirupu (podľa značenia na trubičke - ml).
5. Vyberte trubičku z hrdla fľaše.
6. Podajte sirup dieťaťu buď vložením konca trubičky do úst a jemným tlakom na piest, alebo vystreknutím sirupu na lyžičku a podaním lyžičkou.
7. Po použití uzáver na fľaši opäť starostlivo zatvorte. Trubičku umyte teplou vodou a nechajte vyschnúť.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIZentiva k.s., Praha, Česká republika
8. REGISTRAČNÉ ČÍSLO24/0376/00-S
9. DÁTUM REGISTRÁCIE/DÁTUM PREDĹŽENIA REGISTRÁCIE 29.11.2000/ bez časového obmedzenia
10. DÁTUM POSLEDNEJ REVÍZIE TEXTUSeptember 2012