orágie pri chirurgickom zákroku alebo ťažkej traume:
Prevencia krvácania pri chirurgickom zákroku: Wilate sa má podávať 1-2 hodiny pred začiatkom chirurgického výkonu. Je potrebné dosiahnuť hladiny VWF:RCo ³ 60 IU/dl (³ 60%) a FVIII:C ³ 40 IU/dl (³ 40%).
Primeranú dávku treba opäť podať každých 12-24 hodín liečby. Dávka a dĺžka liečby závisia od klinického stavu pacienta, od typu a závažnosti krvácania, ako aj od hladín FVIII:C a VWF:RCo .
U pacientov, ktorí dostávajú VWF lieky s obsahom FVIII, treba monitorovať hladiny
FVIII:C v plazme, aby sa zistili pretrvávajúce zvýšené hladiny FVIII:C v plazme, ktoré môžu zvýšiť riziko vzniku trombotických príhod, najmä u pacientov so známymi klinickými alebo laboratórnymi rizikovými faktormi. Ak sa zistia nadmerné hladiny FVIII:C v plazme, je potrebné zvážiť zníženie dávok a/alebo predĺženie dávkovacieho intervalu alebo použitie VWF lieku s obsahom nízkej hladiny FVIII.
Profylaxia:
Pri dlhodobej profylaxii proti krvácaniu sa pacientom s VWD majú podávať dávky 20-40 IU/kg telesnej hmotnosti dva alebo trikrát týždenne. V niektorých prípadoch, ako napr. u pacientov s gastrointestinálnym krvácaním, môžu byť potrebné vyššie dávky.
Hemofília ADávkovanie a dĺžka substitučnej terapie závisí od závažnosti nedostatku FVIII, miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet podaných jednotiek FVIII sa vyjadruje v medzinárodných jednotkách (IU), ktoré sú stanovené oproti súčasnému štandardu WHO pre lieky s FVIII. Aktivita FVIII v plazme sa vyjadruje buď percentuálne (vzhľadom k normálnej ľudskej plazme) alebo v medzinárodných jednotkách (vzhľadom k medzinárodnému štandardu pre FVIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity FVIII zodpovedá množstvu FVIII v 1 ml normálnej ľudskej plazmy.
Výpočet požadovanej dávky FVIII vychádza z empirického predpokladu, že 1 IU FVIII:C/kg telesnej hmotnosti zvýši aktivitu FVIII v plazme približne o 1,5-2 % normálnej aktivity.
Požadovaná dávka sa stanoví podľa nasledujúceho vzorca:
Požadované jednotky (IU)= telesná hmotnosť(kg) x požadovaný vzostup FVIII (%) (IU/dl) x 0.5 IU/kgMnožstvo, ktoré sa má podať a frekvencia podávania má vždy smerovať ku klinickej účinnosti v jednotlivých prípadoch. Ako návod na dávkovanie pri krvácaní a chirurgických výkonoch u dospelých pacientov a u detí starších ako 6 rokov možno použiť nasledujúcu tabuľku:
V prípade nasledujúcich krvácavých príhod FVIII:C nemá počas zodpovedajúceho obdobia klesnúť pod danú hladinu aktivity v plazme.
Liečebná schéma pri hemorágiách a chirurgických výkonochStupeň krvácania/
Typ chirurgického výkonu
| Požadovaná hladina faktora VIII
(% normálu) (IU/dl)
| Frekvencia dávkovania (hodiny)/ Dĺžka trvania terapie (dni)
|
Krvácanie
|
|
|
stredne závažná krvácanie:
Začínajúca hemartróza, krvácanie do svalstva, krvácanie z nosa, krvácanie do ústnej dutiny a iné malé
zranenia
| 20 – 40
| Infúziu opakovať každých 12 až 24 hodín. Najmenej 1 deň, kým nedôjde k ústupu bolesti spôsobenej krvácaním alebo k zahojeniu.
|
Rozsiahlejšia hemartróza, krvácanie do svalstva alebo hematóm
| 30 – 60
| Infúziu opakovať každých 12 až 24 hodín počas 3 – 4 alebo viacerých dní, pokiaľ nedôjde k ústupu bolesti a neobnoví sa funkčnosť.
|
Život ohrozujúce krvácanie:
cerebrálne hemorágie, otvorená rana bez bez viditeľného miesta krvácania, ťažké abdominálne resp. vnútorné krvácanie, krvácanie z hrdla
| 60 – 100
| Infúziu opakovať každých 8 až 24 hodín, pokiaľ nepominie ohrozenie života.
|
Chirurgické výkony
|
|
|
Malé
Vrátane extrakcie zubu
| 30 – 60
| Každých 24 hodín, najmenej 1 deň až do zahojenia.
|
Veľké
| 80 – 100
(pred a po operácii)
| Infúziu opakovať každých 8 –24 hodín, pokiaľ nedôjde k uspokojivému zahojeniu rany, potom po dobu najmenej 7 dní udržiavať aktivitu faktora VIII medzi 30 % až 60 % (IU/dl).
|
V priebehu liečby sa odporúča vhodné sledovanie hladín FVIII:C, aby bolo možné upravovať dávku, ktorá sa má podať a frekvenciu opakovaných infúzii.
Predovšetkým v prípadoch rozsiahlych chirurgických zákrokov je nevyhnutné presné monitorovanie priebehu substitučnej terapie prostredníctvom koagulačnej analýzy (FVIII:C).
Jednotliví pacienti sa môžu líšiť odozvou na podávanie FVIII z hľadiska dosahovanej hladiny obnovenia “
in vivo” a polčasu faktora v ich organizme.
Profylaxia:
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sa majú podávať dávky 20 až 40 IU Wilate/kg telesnej hmotnosti v intervaloch 2 až 3 dni. V niektorých prípadoch, obzvlášť u mladších pacientov, môžu byť potrebné kratšie intervaly dávkovania alebo vyššie dávky.
Kontinuálna infúzia:
Pred chirurgickým zákrokom treba vykonať farmakokinetickú analýzu, aby sa zistil klírens. Počiatočnú rýchlosť inúzie je možné vypočítať nasledovne:
Rýchlosť infúzie (IU/kg/h) = klírens (mL/kg/h) x požadovaná hladina rovnovážneho stavu (IU/mL)Po prvých 24 hodinách kontinuálnej infúzie sa má klírens opäť prepočítavať každý deň za použitia rovnice rovnovnovážneho stavu s nameranou hladinou a známou rýchlosťou infúzie.
Pacienti s hemofíliou A s inhibítormi proti FVIII:
Pacientov treba sledovať na vývin neutralizačných protilátok (inhibítorov) proti FVIII. Ak sa nedosiahne očakávaná aktivita FVIII v plazme alebo sa nepodarí zastaviť krvácanie zodpovedajúcou dávkou, má sa vykonať test na prítomnosť inhibítora FVIII. U pacientov s vysokými hladinami inhibítora nemusí byť liečba FVIII účinná a majú sa zvážiť iné terapeutické možnosti. Liečbu takýchto pacientov majú viesť lekári so skúsenosťami v liečbe pacientov s hemostatickými poruchami. Pozri tiež časť 4.4.
Skúsenosti s liečbou Wilate u detí mladších ako 6 rokov sú obmedzené.
Spôsob podávania
Na intravenóznu injekciu po rekonštitúcii s priloženým rozpúšťadlom. Pozri 6.6.
Rýchlosť injekcie alebo infúzie nesmie presiahnuť 2-3 ml za minútu.4.3 Kontraindikácie
Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok.
4.4 Osobitné upozornenia a opatrenia pri používaní
Tak ako pri infúziach iných intravenóznych prípravkov obsahujúcich deriváty plazmatických bielkovín sú možné reakcie z precitlivenosti alergického typu. Pacienti musia byť starostlivo sledovaní a pozorovaní na prítomnosť akýchkoľvek symptómov počas celej infúzie.
Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti, ako je žihľavka, generalizovaná urtikária, pocit tiesne na hrudníku, dýchavičnosť (sipot), hypotenzia a anafylaxia. Ak sa vyskytnú alergické symptómy, podávanie lieku pacientom sa musí okamžite zastaviť a spojiť sa so svojím lekárom. V prípade šoku sa majú dodržiavať všeobecné medicínske postupy na liečbu šoku.
Štandardné opatrenia na predchádzanie infekciám, ktoré sú následkom používania liekov pripravených z ľudskej krvi alebo plazmy, zahŕňajú výber darcov, kontrolu jednotlivých odberov darovanej krvi a zmesných jednotiek plazmy zameranú na špecifické markery infekcie a vykonanie efektívnych výrobných krokov na inaktiváciu/odstránenie vírusov. Napriek tomu nie je možné úplne vylúčiť možnosť prenosu infekčných agensov, ak sú podávané lieky pripravené z ľudskej krvi alebo plazmy. Platí to aj pre neznáme alebo nové vírusy a iné patogény.
Vykonané opatrenia sa považujú za efektívne pre obalené vírusy, ako sú vírusy HIV, HBV a HCV a pre neobalený vírus HAV. Vykonané opatrenia môžu mať obmedzený význam pre neobalené vírusy, ako je parvovírus B19. Infekcia spôsobená parvovírusom B19 môže vážne ohroziť gravidné ženy (infekcia plodu) a jedincov s oslabeným imunitným systémom alebo tých, ktorí trpia zvýšenou erytropoézou (napr. hemolytickou anémiou).
Pri každom podaní Wilate pacientovi sa dôrazne odporúča zaznamenať názov a číslo šarže lieku, aby sa udržiavali záznamy o prepojení medzi pacientom a šaržou lieku.
U pacientov s pravidelným/opakovaným príjmom koncentrátov FVIII/VWF vyrobených z ľudskej plazmy sa musí zvážiť vhodné očkovanie (hepatitída A a B).
Von Willebrandova choroba (VWD)Pri používaní VWF prípravku obsahujúceho FVIII si ošetrujúci lekár má byť vedomý toho, že pokračujúca liečba môže spôsobiť nadmerné zvýšenie FVIII:C. U pacientov, ktorí sú liečení VWF prípravkami obsahujúcimi FVIII, je potrebné monitorovať hladinu FVIII:C, aby sa zabránilo nadmerným hladinám FVIII:C v plazme, ktoré môžu zvýšiť riziko trombotických príhod.
Pri použití VWF prípravkov s obsahom FVIII, predovšetkým u pacientov so známymi klinickými alebo laboratórnymi rizikovými faktormi, existuje riziko výskytu trombotických príhod. Z tohto dôvodu musia byť títo pacienti sledovaní na zistenie prvotných príznakov trombózy. Má byť zahájená profylaxia proti žilovej tromboembólie podľa aktuálnych odporúčaní.
U pacientov s von Willebrandovou chorobou, hlavne u pacientov s typom 3, sa môžu vytvoriť neutralizujúce protilátky (inhibítory) proti VWF. Ak sa nedosiahnu očakávané hladiny aktivity VWF:RCo v plazme, alebo ak sa nedarí podávaním zvolených dávok krvácanie zastaviť, je nutné uskutočniť príslušnú analýzu na zistenie, či nie je prítomný inhibítor VWF. U pacientov s vysokými hladinami inhibítorov, liečba podávaním VWF nemusí byť účinná a je potrebné zvážiť iné terapeutické možnosti. Liečba týchto pacientov má byť vedená pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov s hemostatickými poruchami.
Hemofília ATvorba neutralizačných protilátok (inhibítorov) proti FVIII je známou komplikáciou pri liečbe jedincov s hemofíliou A. Tieto inhibítory predstavujú zvyčajne IgG imunoglobulíny, ktoré pôsobia proti koagulačnej aktivite FVIII a sú kvantifikované v Bethesdových jednotkách (BU) na 1 ml plazmy a zisťované použitím modifikovanej metódy.
Riziko vzniku inhibítorov koreluje s expozíciou organizmu anti-hemofilickému FVIII, pričom riziko je najvyššie v prvých 20 dňoch expozície. Zriedkavo sa inhibítory môžu vytvoriť až po prvých 100 dňoch expozície. Pacienti liečení koagulačným FVIII musia byť starostlivo sledovaní z hľadiska vytvárania inhibítorov prostredníctvom primeraného klinického pozorovania a laboratórnych testov. Pozri tiež časť 4.8. Nežiaduce účinky.
Tento liek obsahuje až do 2,55 mmol (58,7 mg) sodíka v jednej liekovke 450 IU FVIII a 400 IU VWF/liekovku a až do 5,1 mmol (117,3 mg) sodíka v jednej liekovke 900 IU FVIII a 800 IU VWF. Toto je potrebné zvážiť u pacientov na kontrolovanej sodíkovej diéte.
4.5 Liekové a iné interakcie
Nie sú známe žiadne interakcie s inými liekmi.
4.6 Gravidita a laktácia
Nevykonali sa reprodukčné štúdie u zvierat s FVIII/VWF.
Von Willebrandova choroba (VWD)Skúsenosti v liečbe tehotných a dojčiacich žien nie sú dostupné.
Wilate sa má podávať tehotným alebo dojčiacim ženám s nedostatkom VWF, ak je to jednoznačne indikované, pričom treba vziať do úvahy, že pôrod u týchto pacientiek zvyšujú riziko hemoragických príhod.
Hemofília ANie sú k dispozícii skúsenosti týkajúce sa liečby počas gravidity a laktácie vzhľadom na zriedkavý výskyt hemofílie A u žien. Preto sa Wilate má používať počas gravidity a laktácie iba v prípade, ak je to jednoznačne indikované.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Nepozorovali sa žiadne účinky na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Precitlivenosť alebo alergické reakcie (ktoré môžu zahŕňať angioedém, pálenie a bodanie v mieste podania infúzie, triašku, začervenanie, generalizovanú urtikáriu, bolesť hlavy, žihľavku, hypotenziu, letargiu, nauzeu, nepokoj, tachykardiu, pocit tiesne na hrudníku, mravenčenie, dávenie a dýchavičnosť (sipot) boli pozorované menej často a môžu v niektorých prípadoch progredovať do ťažkej anafylaxie (vrátane šoku). V zriedkavých prípadoch sa pozorovala horúčka.
Trieda orgánových systémov
| Menej časté
| Zriedkavé
| Veľmi zriedkavé
|
Poruchy imunitného systému
| reakcie z precitlivenosti
|
| anafylaktický šok
|
Celkové poruchy a reakcie a reakcie v mieste podania
|
| horúčka
|
|
Laboratórne a funkčné vyšetrenia
|
| inhibítory FVIII
| Inhibítory VWF
|
menej časté (> 1/1000, < 1/100)
zriedkavé (>1/10 000, <1/1000)
veľmi zriedkavé (<1/10 000), vrátane jednotlivých hlásení
Von Willebrandova choroba (VWD)U pacienti s VWD, predovšetkým u pacientov s typom 3, sa môžu veľmi zriedkavo vytvoriť neutralizačné protilátky proti VWF. Ak sa vytvoria takéto inhibítory, takýto stav sám o sebe sa prejavuje nedostatočnou klinickou odpoveďou. Tieto protilátky môžu precipitovať a môžu sa objaviť v súvislosti s anafylaktickými reakciami. Preto sa u pacientov prekonávajúcich anafylaktické reakcie má vyhodnocovať prítomnosť inhibítorov.
Vo všetkých takýchto prípadoch sa odporúča kontaktovať špecializované centrum na liečbu hemofílie.
U pacientov so známymi klinickými alebo laboratórnymi rizikovými faktormi existuje riziko výskytu trombotických príhod. Preto rizikoví pacienti musia byť monitorovaní na včasné príznaky trombózy. Preto má byť zahájená profylaxia proti venóznemu tromboembolizmu podľa aktuálnych odporúčaní.
U pacientov liečených VWF prípravkami s obsahom FVIII môžu trvalo nadmerné hladiny FVIII:C zvýšiť riziko trombotických príhod.
Hemofília AU pacientov s hemofíliou A sa môžu vytvoriť neutralizačné protilátky (inhibítory) proti FVIII.
Ak vzniknú takéto inhibítory, stav sa prejaví ako nedostatočná klinická odpoveď na liečbu.
V takýchto prípadoch sa odporúča kontaktovať špecializované centrum pre liečbu hemofílie.
Pre nízky počet pacientov liečených Wilate nemohla byť vypracovaná záverečná správa o
vývoji inhibítorov u predtým liečených pacientov. Údaje o výskytu inhibítorov u predtým liečených nie sú k dispozícii.
Nie sú k dispozícii dostatočné údaje na odporúčanie používania lieku Wilate u predtým neliečených pacientov.
Informácie o bezpečnosti s ohľadom na prenosné agens, pozri časť 4.4.
4.9 Predávkovanie
Neboli hlásené žiadne prípady predávkovania s FVIII alebo VWF.
V prípade veľkého predávkovania sa môžu vyskytnúť tromboembolické príhody.
5 FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina:
Antihemoragiká: krvné koagulačné faktory:Kombinácia von Willebrandovho faktora a koagulačného faktora VIII
ATC kód: B02BD06
Von Willebrandova choroba (VWD)VWF (z koncentrátu) je normálnou zložkou ľudskej plazmy a chová sa rovnako ako endogénny VWF.
Podanie VWF umožňuje korekciu hemostatických abnormalít prejavujúcich sa u pacientov, ktorí trpia deficitom VWF (VWD) na dvoch úrovniach:
- - VWF obnovuje adhéziu krvných doštičiek k vaskulárnemu sub-endotelu v mieste poškodenia cievy (pretože sa viaže tak k sub-endotelu cievy ako i k membráne krvnej doštičky), čo zaisťuje primárnu hemostázu, čo sa odráža v skrátení doby krvácania. K tomuto účinku dochádza okamžite a je známe, že do značnej miery závisí od úrovne polymerizácie proteínu;
- - VWF vyvoláva oneskorenú korekciu súvisiaceho deficitu FVIII. Po intravenóznom podaní sa von VWF viaže na endogénny FVIII (ktorý je normálne vytváraný pacientom), stabilizáciou tohto faktora zabraňuje jeho rýchlej degradácii. Z tohto dôvodu podanie čistého VWF (VWF prípravok s nízkou hladinou FVIII) obnovuje hladinu FVIII:C na normál, a to ako sekundárny účinok
po prvej infúzii. Podaním VWF prípravku obsahujúceho FVIII sa obnovuje hladina FVIII:C na normál bezprostredne
po prvej infúzii.
Spolu so svojou úlohou ochranného proteínu FVIII, sprostredkováva von Willebrandov faktor adhéziu doštičiek na miestach cievneho poranenia a hrá hlavnú úlohu v agregácii doštičiek.
Hemofília AKomplex FVIII/VWF sa skladá z dvoch molekúl (FVIII a VWF) s rôznymi fyziologickými funkciami. Po podaní pacientovi s hemofíliou sa FVIII viaže na VWF v krvnom obehu pacienta. Aktivovaný FVIII (FVIIIa) se chová ako kofaktor pre aktivovaný faktor IX (FIXa) a urýchľuje konverziu faktora X na aktivovaný faktor X (FXa). FXa premieňa protrombín na trombín. Trombín potom premieňa fibrinogén na fibrín a vytvorí se krvná zrazenina.
Hemofília A je na pohlavie viazanou dedičnou poruchou krvnej zrážanlivosti v dôsledku znížených hladín FVIII:C, jej dôsledkom dochádza k profúznemu krvácaniu do kĺbov, svalov alebo vnútorných orgánov, a to buď samovoľne alebo v dôsledku náhodných či chirurgicky vzniknutých poranení. Substitučnou liečbou sa hladiny FVIII v plazme zvyšujú, čím sa dosahuje dočasná náprava nedostatku koagulačného faktora a korekcia uvedených sklonov ku krvácaniu.
5.2 Farmakokinetické vlastnosti
Von Willebrandova choroba (VWD)VWF (z koncentrátu) je normálnou zložkou ľudskej plazmy a chová sa rovnako ako endogénny VWF.
U pacientov s VWD 3 typu bolo pre VWF:RCo počítané stredné recovery 68% a pre VWF:Ag 99%. Tieto hodnoty zodpovedajú strednému prírastku v plazme 1,5% a 2,1% na podanú IU/kg telesnej hmotnosti. V klinickej štúdii s 8 pacientmi s VWD 3 typu boli zistené nasledovné hodnoty:
Parameter
| Stredná hodnota
| Medián
| Rozmedzie
|
Recovery
%/IU/kg
| VWF:RCo: 1,5
| 1,5
| 1,2 – 2,2
|
AUC0-¥
(IU/mL * h)'
| VWF:RCo: 13,6
| 15,3
| 5,9 – 19,1
|
Polčas (h)
| VWF:RCo: 17,5
| 16,6
| 7,4 – 30,6
|
MRT (h)
| VWF:RCo: 23,2
| 23,3
| 10,2 – 37,1
|
Klírens
mL/h/kg
| VWF:RCo: 3,9
| 3,4
| 2,5 – 7,4
|
Kľúč: AUC = plocha pod krivkou; MRT = stredná doba zdržania
Hemofília AFVIII (z koncentrátu) je normálnou zložkou ľudskej plazmy a chová sa rovnako ako endogénny faktor. Po podaní prípravku približne dve tretiny až tri štvrtiny FVIII ostáva v krvnom riečišti. Hladina FVIII:C v plazme by mala dosiahnuť 80-120% predpokladanej aktivity FVIII:C.
FVIII:C sa znižuje dvojfázovým exponenciálnym rozpadom. V počiatočnej fáze distribúcia medzi intravaskulárnymi
V počiatočnej fáze distribúcia mezi intravaskulárnymi a ostatnými kompartmentmi (telesné tekutiny) prebieha s polčasom rozpadu z plazmy od 3 do 6 hodín. V nasledujúcej pomalšej faze sa polčas pohybuje medzi 8 až 18 hodinami s priemerom 15 hodín. Toto zodpovedá skutočnému biologickému polčasu.
V klinickej štúdii s 12 pacientmi (jednostupňový koagulačný test, jedno meranie) boli zistené nasledujúce hodnoty:
Parameter
| Stredná
hodnota
| Štandardná
odchýlka
|
Recovery
%/IU/kg
| FVIII:C 2,04
| 1,15
|
AUCnorm
% * h/IU/kg
| FVIII:C 37,8
| 10,0
|
Polčas (h)
| FVIII:C 14,8
| 3,1
|
MRT (h)
| FVIII:C 20,4
| 4,5
|
Klírens
mL/h/kg
| FVIII:C
2,9
| 1,0
|
Kľúč: AUC = plocha pod krivkou; MRT = stredná doba zdržania; SD = štandardná odchýlka
5.3 Predklinické údaje o bezpečnosti
FVIII a VWF obsiahnuté vo Wilate sú normálnymi zložkami ľudskej plazmy a pôsobia ako
endogénne FVIII/VWF.
Testovanie toxicity na zvieratách podaním opakovanej dávky sa nemôže uskutočniť vzhľadom k vzniku protilátok na heterológny ľudský proteín.
Klinické skúsenosti nevykazujú žiadne stopy po tumorogénnych a mutagénnych účinkoch ľudského FVIII/VWF.
Wilate obsahuje stopové množstvo chemických látok tri(n-butyl)fosát a Octoxynol (Triton X-100), ktoré sa používajú pre solvent/detergent (S/D) vírusovú inaktiváciu počas výroby. Predklinické údaje získané na základe obvyklých štúdii toxicity po opakovanom podávaní, genotoxicity a embryofetálneho vývinu neodhalili žiadne osobitné riziko pre ľudí.
6 FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok: chlorid sodný, glycín, sacharóza, citrónan sodný a chlorid vápenatý
Rozpúšťadlo: voda na injekciu s 0.1 % polysorbátom 80
6.2 Inkompatibility
Wilate sa nesmie miešať s inými liekmi alebo podávať súbežne s iným intravenóznym prípravkom v jednom infúznom sete. Môže sa použiť iba priložená injekčná/infúzna súprava, pretože v dôsledku adsorbcie FVIII/VWF na vnútorné povrchy niektorých iných infúznych zariadení môže dôjsť k zlyhaniu liečby.
6.3 Čas použiteľnosti
36 mesiacov.
Stabilita rekonštituovaného roztoku sa preukázala na 12 hodín pri izbovej teplote (max. +25°C). Napriek tomu, na zabránenie mikrobiálnej kontaminácii, rekonštituovaný roztok treba použiť ihneď.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte prášok a liekovku s rozpúšťadlom v chladničke pri teplote (+2-8°C).
Uchovávajte liekovky vo vonkajšom obale na ochranu pred svetlom. Neuchovávajte v mrazničke.
Liek sa môže uchovávať pri izbovej teplote (max. +25°C) po dobu 2 mesiacov. V tomto prípade je doba použiteľnosti 2 mesiace od chvíle, keď bol liek po prvýkrát vybratý z chladničky. Nový čas použiteľnosti musí pacient označiť na krabičke. Rekonštituovaný roztok sa má použiť v priebehu jedného podania. Akékoľvek nespotrebované množstvo sa musí zlikvidovať.
6.5 Druh obalu a obsah balenia
Veľkosti balenia:
Wilate 450, 450 IU FVIII a 400 IU VWF
1 balenie obsahuje:
1 liekovku s práškom, sklo typu I, uzatvorenú zátkou (brómbutylová guma) a uzatvorená vyklápacím viečkom,
1 liekovka s rozpúšťadlom (5 ml vody na injekciu s 0.1% polysorbátom 80), sklo typu I, uzatvorená zátkou (chlórbutylová guma) a uzatvorená vyklápacím viečkom.
1 balenie s príslušenstvom (1 jednorázová striekačka, 1 prepúšťací set [1 injekčná ihla s dvoma hrotmi a 1 filter s hrotom], 1 infúzny set)
2 alkoholové tampóny
Wilate 900, 900 IU FVIII a 800 IU VWF
1 balenie obsahuje:
1 liekovku s práškom, sklo typu I, uzatvorenú zátkou (brómbutylová guma) a uzatvorená vyklápacím viečkom,
1 liekovka s rozpúšťadlom (10 ml vody na injekciu s 0.1% polysorbátom 80), sklo typu I, uzatvorená zátkou (chlórbutylová guma) a uzatvorená vyklápacím viečkom.
1 balenie s príslušenstvom (1 jednorázová striekačka, 1 prepúšťací set [1 injekčná ihla s dvoma hrotmi a 1 filter s hrotom], 1 infúzny set)
2 alkoholové tampóny
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
1. Zohrejte rozpúšťadlo a prášok v uzatvorených liekovkách na izbovú teplotu. Ak sa na zahriatenie používa vodný kúpeľ, treba dbať na to, aby voda neprišla do kontaktu s gumennými zátkami (neobsahujú latex) alebo s viečkami liekoviek. Teplota vodného kúpeľa nemá presiahnuť +37°C.
2. Odstráňte viečka z liekovky s práškom a z liekovky s rozpúšťadlom (obr. A) a vydezinfikujte gumové zátky alkoholovým tampónom

3. Umiestnite liekovku s rozpúšťadlom na rovný povrch. Pripojte ihlu s dvoma hrotmi
zvlneným koncom k liekovke s rozpúšťadlom (“Wave to Water”) a tlačte dole tak ďaleko, ako to len pôjde (obr. B).

4. Umiestnite liekovku s koncentrátom na rovný povrch. Odstráňte ochranný kryt z ihly z dvoma hrotmi,dbjate na to, aby ste sa nedotkli hrotu ihly. Podržte liekovku s rozpúšťadlom s nasadenou ihlou s dvoma hrotmi dnom nahor a rýchlo prepichnite stred gumennej zátky liekovky s koncentrátom ihlou a tlačte nadol čo najviac, ako to len pôjde (obr. C). Vákuum vo vnútri liekovky s koncentrátom nasaje rozpúšťadlo.

5. Vyberte liekovku s rozpúšťadlom spolu s ihlou s dvoma hrotmi z liekovky s koncentrátom (obr. D). Wilate sa rozpúšťa rýchlo, preto len pomaly otáčajte liekovkou.

Roztok je číry až slabo opalescentný. Zakalené roztoky alebo roztoky so zhlukmi sa nesmú používať.
Injekcia: 1. Odstráňte ochranný obal z filtra s hrotom a prepichnite gumovú zátku liekovky s koncentrátom (Fig. E).
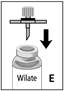
2. Vytiahnite piest na striekačke, aby sa dovnútra nasal vzduch.
3. Odstráňte kryt z filtra s hrotom a nasaďte naň injekčnú striekačku. (obr. Fa).
4. Vstrieknite vzduch do liekovky (obr. Fb).

5. Otočte liekovku s nasadenou striekačkou dnom nahor a natiahnite roztok do striekačky (obr. G).

6. Odstráňte zo striekačky filter.
7. Vydezinfikujte zamýšlané miesto vpichu alkoholovým tampónom.
8. Nasaďte infúznu ihlu s motýlikom na striekačku(obr. H) a okamžite aplikujte intravenózne prípravok. Rýchlosť injekcie má byť 2-3 ml za minútu.
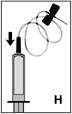
R
9. Ak pacient dostane viac ako jednu liekovku koncentrátu, môže sa použit rovnaký set s motýlikom. Striekačka sa tiež môže použiť pre viaceré liekovky s koncentrátom. Pri nasávaní roztoku však vždy používajte nový filter.
Akýkoľvek nepoužitý prípravok alebo odpadový materiál sa má zlikvidovať v súlade s miestnymi požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIOctapharma (IP) Ltd.
The Zenith Building
26 Spring Gardens
Manchester M2 1AB
Veľká Británia
8. REGISTRAČNÉ ČÍSLAWilate 450: 16/0546/09-S
Wilate 900: 16/0547/09-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTU