ku až do 10 mg/ml. Použitie takých vysokých koncentrácií môže zvýšiť riziko nežiaducich účinkov súvisiacich s infúziou (pozri časť 6.6).
Infúzie sa majú podávať počas aspoň 60 minút. U dospelých, ak dávky prekračujú 500 mg, sa odporúča rýchlosť infúzie do 10 mg/min. Nežiaduce účinky súvisiace s infúziou sa vzťahujú ku koncentrácii aj ku rýchlosti podávania vankomycínu.
Trvanie liečby sa riadi závažnosťou infekcie a jej klinickým a bakteriologickým vývojom.
Pacienti s normálnou funkciou obličiek a pečeneDospelí a dospievajúci pacienti starší ako 12 rokov:Odporúčaná denná intravenózna dávka je 2 000 mg (2 g), rozdelená na 500 mg dávky každých 6 hodín alebo 1 000 mg každých 12 hodín.
Pri bakteriálnej endokarditíde je všeobecne akceptovaný dávkovací režim 1 000 mg vankomycínu intravenózne každých 12 hodín počas 4 týždňov buď samostatne alebo v kombinácii s inými antibiotikami (gentamycín s rifampicínom, gentamycín, streptomycín). Endokarditída spôsobená enterokokmi sa lieči počas 6 týždňov pomocou vankomycínu v kombinácii s aminoglykozidovým antibiotikom – v súlade s národnými odporúčaniami.
Perioperatívna profylaxia: Dospelým sa podáva 1 000 mg vankomycínu (pred začiatkom anestézie) a v závislosti od trvania a typu chirurgického zákroku sa 12 hodín po chirurgickom zákroku môže podať i.v. dávka 1 000 mg vankomycínu.
Profylaxia antibiotikami má byť krátkodobá a limitovaná na perioperatívne obdobie, 24 hodín, ale nie viac ako 48 hodín.
Deti vo veku od 1 mesiaca do 12 rokov:Odporúčaná intravenózna dávka je 10 mg/kg každých 6 hodín alebo 20 mg/kg každých 12 hodín.
Dojčatá a novorodenci:Odporúčaná úvodná dávka je 15 mg/kg, následne 10 mg/kg každých 12 hodín počas prvého týždňa života a potom každých 8 hodín do konca prvého mesiaca života. Odporúča sa pozorné sledovanie koncentrácií vankomycínu v sére (pozri nižšie).
Starší pacienti:V dôsledku zníženej funkcie obličiek zapríčinenej vekom sa môžu vyžadovať nižšie udržiavacie dávky.
Obézni pacienti:Môže byť potrebná úprava zvyčajných denných dávok.
Pacienti s poškodenou funkciou pečeneNeexistuje dôkaz o tom, že u pacientov s poškodenou funkciou pečene sa musí dávka znížiť.
Pacienti s poškodenou funkciou obličiekU pacientov s poškodenou funkciou obličiek sa musí dávka upraviť – ako návod môže poslúžiť nasledujúci nomogram. Odporúča sa dôkladné sledovanie koncentrácie vankomycínu v sére (pozri nižšie).
Klírens kreatinínu (ml/s)
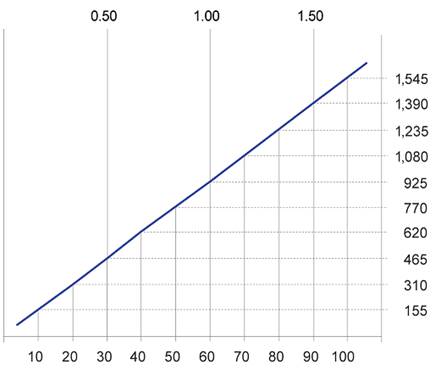
Denná dávka vankomycínu (mg)
|
Klírens kreatinínu (ml/min)
Dávkovací nomogram pre dospelých s poškodenou funkciou obličiekAk nie je dostupná hodnota klírensu kreatinínu, môže sa použiť na jej výpočet nasledujúci vzorec na základe pacientovho veku, pohlavia a hodnoty sérového kreatinínu:
Muži:
Telesná hmotnosť [kg] x (140-vek [roky])72 x sérový kreatinín [mg/100 ml]
Ženy: 0,85 x hodnota vypočítaná vyššie uvedeným vzorcom
Keď je to možné, klírens kreatinínu sa má vždy stanoviť.
Úvodná dávka u pacientov s miernym až stredne závažným zlyhávaním obličiek nesmie byť menšia ako 15 mg/kg. U pacientov so závažným zlyhávaním obličiek sa pred podaním nízkych denných dávok uprednostňuje podávať udržiavaciu dávku v rozmedzí 250 mg a 1 000 mg s odstupom niekoľkých dní.
Pacientom s
anúriou (s takmer žiadnou funkciou obličiek) sa má podávať dávka 15 mg/kg telesnej hmotnosti do dosiahnutia terapeutickej koncentrácie v sére. Udržiavacie dávky sú 1,9 mg/kg telesnej hmotnosti počas 24 hodín. Pre zjednodušenie režimu môžu dospelí pacienti s vážne poškodenou funkciou obličiek namiesto denných dávok dostávať udržiavaciu dávku 250 – 1 000 mg v intervale niekoľkých dní.
Dávkovanie v prípade hemodialýzyU pacientov bez akejkoľvek funkcie obličiek, aj u tých, ktorí pravidelne podstupujú hemodialýzu, je tiež možné nasledovné dávkovanie: saturačná dávka 1 000 mg, udržiavacia dávka 1 000 mg každých 7 – 10 dní.
Ak sa pri hemodialýze používajú polysulfónové membrány (vysokoprietoková dialýza), polčas vankomycínu je znížený. U pacientov s pravidelnou hemodialýzou môže byť potrebná dodatočná udržiavacia dávka.
Monitorovanie koncentrácií vankomycínu v sére:Koncentrácia vankomycínu v sére sa má kontrolovať počas druhého dňa liečby krátko pred podaním nasledujúcej dávky a jednu hodinu po infúzii. Terapeutické hladiny vankomycínu v krvi majú byť v rozmedzí 30 až 40 mg/l (maximálne 50 mg/l) jednu hodinu po ukončení infúzie, minimálna hladina (krátko pred podaním nasledujúcej dávky) v rozmedzí 5 až 10 mg/l.
Koncentrácie sa majú zvyčajne monitorovať 2 až 3-krát týždenne.
Perorálne podanieLiečba kolitídy spôsobenej C. difficileDospelí pacienti: Zvyčajná denná dávka je 0,5 g až 2 g podávaná v 4 rozdelených dávkach (125 mg až 500 mg) počas 7 až 10 dní.
Deti: Zvyčajná denná dávka je 40 mg/kg/deň podaná v 4 rozdelených dávkach až do maximálne 250 mg/dávka počas 7 až 10 dní.
Spôsob podania:Iba na intravenóznu infúziu a nie na intramuskulárne podanie.
Vankomycín sa má parenterálne podávať iba vo forme pomalej intravenóznej infúzie (nie viac ako 10 mg/min – počas minimálne 60 minút), ktorá je dostatočne zriedená (aspoň 500 mg na 100 ml alebo aspoň 1 000 mg na 200 ml).
Pacientom, u ktorých sa vyžaduje obmedzenie príjmu tekutín, sa môže podávať roztok 500 mg/50 ml alebo 1 000 mg/100 ml. Pri týchto vyšších koncentráciách môže byť zvýšené riziko nežiaducich účinkov spojených s podaním infúzie.
Rekonštituovaný roztok sa môže použiť aj na perorálne podanie.
Terapeutické indikácie pre intravenózne a perorálne podanie sú odlišné. Tieto dva spôsoby podania sa nesmú zameniť.
Pokyny na prípravu roztoku pred podaním, pozri časť 6.6 “Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom“.
4.3 Kontraindikácie Precitlivenosť na vankomycín.
4.4 Osobitné upozornenia a opatrenia pri používaníUpozornenia:V prípade vážnych akútnych hypersenzitívnych reakcií (napr. anafylaxia) musí byť liečba vankomycínom okamžite ukončená a má sa začať s bežnými vhodnými bezpečnostnými opatreniami (napr. antihistaminiká, kortikosteroidy a v prípade potreby umelé dýchanie).
Rýchle bolusové podanie (t.j. počas niekoľkých minút) môže byť spojené so závažnou hypotenziou (vrátane šoku a zriedkavo zástavy srdca), histamínovými reakciami a makulopapulárnou alebo erytematóznou vyrážkou („syndróm červeného človeka – red man syndrome“ alebo „syndróm červeného krku – red neck syndrome“). Aby sa zabránilo reakciám v dôsledku rýchleho infúzneho podania, má sa vankomycín podávať pomalou infúziou v zriedenom roztoku (2,5 až 5,0 g/l) rýchlosťou nie viac ako 10 mg/min a počas minimálne 60 minút. Zastavenie infúzie zvyčajne vedie k rýchlemu odzneniu týchto reakcií.
Nefrotoxicita: vankomycín sa musí používať s opatrnosťou u pacientov so zlyhávaním obličiek, pretože možnosť vzniku toxických účinkov je pri stave s dlhodobo vysokými koncentráciami v krvi zvýšená. Pri liečbe týchto pacientov a tých, ktorí sa súbežne liečia inými nefrotoxickými liečivami (ako aminoglykozidové antibiotiká), sa musí vykonať séria vyšetrení funkcie obličiek a dodržiavať vhodné dávkovacie režimy kvôli zníženiu rizika nefrotoxicity na minimum (pozri časť 4.2).
Ototoxicita: ototoxicita, ktorá môže byť prechodná alebo trvalá bola hlásená u pacientov s predchádzajúcou hluchotou, ktorým sa podávali nadmerné intravenózne dávky alebo ktorí boli súbežne liečení inými ototoxickými liečivami ako sú napríklad aminoglykozidové antibiotiká. Hluchote môže predchádzať tinitus. Skúsenosti s inými antibiotikami dokazujú, že hluchota môže progredovať aj napriek ukončeniu liečby. Pre zníženie rizika ototoxicity sa majú pravidelne stanovovať hladiny liečiva v krvi a odporúča sa pravidelné vyšetrenie funkcie sluchu.
Klinicky významné sérové koncentrácie boli hlásené u niektorých pacientov liečených z dôvodu aktívnej pseudomembranóznej kolitídy vyvolanej
C.difficile po podaní viacnásobných perorálnych dávok vankomycínu. Z toho dôvodu môže byť u týchto pacientov vhodné sledovať sérové koncentrácie.
Bezpečnostné opatrenia:Vankomycín pôsobí veľmi dráždivo na tkanivo a spôsobuje nekrózu v mieste vpichu, ak sa podáva intramuskulárne. U viacerých pacientov, ktorým sa podáva vankomycín, môže vzniknúť bolesť a tromboflebitída, ktoré sú niekedy závažné. Frekvencia a závažnosť tromboflebitídy sa môže minimalizovať pomalým podávaním lieku vo forme zriedeného roztoku (pozri časť 6.6) a pravidelnou obmenou miesta vpichu.
Vankomycín sa má používať s opatrnosťou u pacientov s alergickými reakciami na teikoplanín, pretože boli hlásené skrížené reakcie z precitlivenosti medzi vankomycínom a teikoplanínom.
Vplyvom vankomycínu sa môže zvýšiť myokardiálna depresia vyvolaná anestéziou. Počas anestézie musia byť dávky dobre zriedené a podávané pomaly za pozorného sledovania činnosti srdca. Kvôli posturálnej úprave sa zmeny polohy majú oddialiť dovtedy, kým infúzia nie je ukončená.
Všetkým pacientom, ktorým sa podáva vankomycín, sa majú pravidelne robiť hematologické vyšetrenia, vyšetrenia funkcie obličiek a vyšetrenia sluchu.
Počas dlhodobého používania vankomycínu je indikované pravidelné sledovanie hladín vankomycínu v krvi, najmä u pacientov s dysfunkciou obličiek alebo poškodeným sluchovým vnímaním ako aj pri súbežnom podávaní nefrotoxických alebo ototoxických liečiv, napríklad aminoglikozidov.
V takých prípadoch sa má pravidelne sledovať funkcia obličiek a dávkovanie sa má prispôsobiť zníženiu renálnej funkcie.
Pravidelné monitorovanie funkcie sluchu je potrebné u pacientov s poškodenou funkciu sluchu alebo ak sa súbežne podávajú ototoxické lieky a v prípadoch renálnej dysfunkcie.
Použitie u detí a dospievajúcichU predčasne narodených detí a dojčiat môže byť vhodné potvrdiť, či sérové koncentrácie dosahujú želané hodnoty. U detí bolo súbežné používanie vankomycínu a anestetík spojené s erytémom a návalmi tepla podobnými ako spôsobuje histamín. Ak je potrebné podanie vankomycínu kvôli profylaxii pri chirurgickom zákroku, odporúča sa podať anestetikum po ukončení infúzie vankomycínu.
Použitie u starších pacientovPrirodzené znižovanie glomerulárnej filtrácie so zvyšujúcim vekom môže viesť k zvýšeným hladinám vankomycínu v sére. Starší pacienti sú zvlášť náchylní na poškodenie sluchu, v prípade pacientov starších ako 60 rokov sa majú vykonať série vyšetrení funkcie sluchu. Má sa zabrániť súbežnému alebo následnému použitiu iných neurotoxických liečiv.
4.5 Liekové a iné interakcieIné potenciálne nefrotoxické alebo ototoxické liečiváSúbežné alebo následné podávanie vankomycínu s inými potenciálne neurotoxickými a/alebo nefrotoxickými liečivami najmä gentamycínom, amfotericínom B, streptomycínom, neomycínom, kanamycínom, amikacínom, tobramycínom, viomycínom, bacitracínom, polymyxínom B, kolistínom alebo cisplatinou môže znásobiť nefrotoxicitu a/alebo ototoxicitu vankomycínu a následne si vyžaduje pozorné sledovanie pacienta.
V dôsledku synergického účinku (napr. s gentamycínom) sa musí maximálna dávka vankomycínu v týchto prípadoch obmedziť na 500 mg každých 8 hodín.
AnestetikáSúbežné podávanie vankomycínu a anestetík bolo spojené s erytémom, návalmi tepla podobnými ako spôsobuje histamín a anafylaktoidnými reakciami. Toto sa môže zmierniť, ak sa vankomycín podá počas 60 minút pred indukciou anestézie.
MyorelaxanciáAk sa vankomycín podáva počas chirurgického zákroku alebo krátko po ňom, účinok (nervovosvalová blokáda) súbežne podávaných myorelaxancií (napr. sukcinylcholín) môže byť zvýšený alebo predĺžený.
4.6 Fertilita, gravidita a laktáciaGravidita:Nie sú dostupné žiadne skúsenosti týkajúce sa bezpečnosti použitia vankomycínu počas gravidity u ľudí. Reprodukčné toxikologické štúdie na zvieratách nepreukázali účinky na vývoj embrya, plodu alebo obdobie gravidity (pozri časť 5.3).
Avšak vankomycín prestupuje cez placentu, preto sa potenciálne riziko embryonálnej a neonatálnej ototoxicity a nefrotoxicity nemôže vylúčiť. Preto sa má vankomycín podávať počas gravidity len v prípade, keď je to nevyhnutné a po dôslednom zvážení prínosu a rizika liečby.
Laktácia:Vankomycín sa vylučuje do ľudského materského mlieka, a preto sa má počas obdobia laktácie používať len vtedy, ak liečba inými antibiotikami zlyhala. Kvôli možným nežiaducim účinkom na dojča (poruchy intestinálnej flóry s hnačkou, kolonizácia hubami podobnými kvasinkám a možná senzibilizácia) sa má vankomycín podávať dojčiacim matkám s opatrnosťou.
Vzhľadom na dôležitosť tohto lieku pre dojčiacu matku sa má zvážiť rozhodnutie o prerušení dojčenia.
FertilitaNie sú dostupné žiadne štúdie fertility (u mužov ani u žien) pre vankomycín.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeVankomycín nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyNežiaduce účinky uvedené nižšie sú definované podľa konvencií a tried orgánových systémov databázy MedDRA: veľmi časté (³ 1/10); časté (³ 1/100 až < 1/10); menej časté (³ 1/1 000 až < 1/100); zriedkavé (³ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Najčastejšími nežiaducimi účinkami sú flebitídy a pseudoalergické reakcie v súvislosti s príliš rýchlym intravenóznym podaním vankomycínu.
Trieda orgánových systémov
| Skupina frekvencie
|
Poruchy krvi a lymfatického systému
| Zriedkavé
- trombocytopénia
- neutropénia
- agranulocytóza
- eozinofília
|
Poruchy imunitného systému
| Zriedkavé
- anafylaktické reakcie
- reakcie z precitlivenosti
|
Poruchy ucha a labyrintu
| Menej časté
- prechodná alebo trvalá strata sluchu
Zriedkavé
- tinitus
- závrat
|
Poruchy srdca a srdcovej činnosti
| Veľmi zriedkavé
- zástava srdcovej činnosti.
|
Poruchy ciev
| Časté
- zníženie krvného tlaku
- tromboflebitída
Zriedkavé
- vaskulitída
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Časté
- dyspnoe
- stridor.
|
Poruchy gastrointestinálneho traktu
| Zriedkavé
- nauzea
Veľmi zriedkavé
- pseudomembranózna enterokolitída po intravenóznom podaní
|
Poruchy kože a podkožného tkaniva
| Časté
- exantém a zápal sliznice
- pruritus
- urtikária
Veľmi zriedkavé
- exfoliatívna dermatitída
- Stevensov-Johnsonov syndróm
- Lyellov syndróm
- bulózna dermatitída indukovaná IgA
|
Poruchy obličiek a močových ciest
| Časté
- insuficiencia obličiek primárne manifestovaná zvýšením koncentrácií kreatinínu alebo urey v sére
Zriedkavé
- intresticiálna nefritída
- akútne zlyhávanie obličiek
|
Celkové poruchy a reakcie v mieste podania
| Časté
- sčervenanie hornej časti tela a tváre
- bolesť a spazmy hrudníka a svalov chrbta
Zriedkavé
- horúčka zapríčinená liekom
- triaška
|
Počas rýchleho infúzneho podania alebo krátko po ňom sa môžu objaviť anafylaktické reakcie zahŕňajúce hypotenziu, dyspnoe, žihľavku, alebo pruritus. Reakcie ustúpia po ukončení podávania, zvyčajne v intervale 20 minút až 2 hodiny po ukončení podávania.
Ototoxicita bola primárne hlásená u pacientov, ktorým sa podávali vysoké dávky alebo súbežná liečba inými ototoxickými liekmi alebo u pacientov s už existujúcou zníženou funkciou obličiek alebo sluchu.
Po perorálnom podaní sa nedá riziko vyššie spomenutých nežiaducich účinkov vylúčiť, pretože vankomycín sa môže v prípade lézií v tráviacom trakte absorbovať.
4.9 PredávkovanieBola hlásená toxicita v dôsledku predávkovania. 500 mg i. v. u dieťaťa vo veku 2 rokov viedlo k letálnej intoxikácii.
Podanie celkovo 56 g dospelému počas 10 dní viedlo k insuficiencii obličiek. Pri niektorých vysoko rizikových stavoch (napr. v prípade závažného poškodenia obličiek) sa môžu objaviť vysoké hladiny v sére, oto- a nefrotoxické účinky.
Opatrenia v prípade predávkovania:· Špecifické antidotum nie je známe.
· Vyžaduje sa symptomatická liečba za súčasného udržiavania funkcie obličiek.
Vankomycín sa slabo odstraňuje hemodialýzou alebo peritoneálnou dialýzou. Pre zníženie koncentrácií vankomycínu v sére bola použitá hemofiltrácia alebo hemoperfúzia pomocou polysulfónových živíc.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné antibakteriálne liečivá, glykopeptidové antibiotiká,
ATC kód: J01XA01
Mechanizmus účinku:Vankomycín je glykopeptidové antibiotikum. Vankomycín má baktericídny účinok na proliferujúce baktérie tým, že inhibuje biosyntézu bunkovej steny tvorbou komplexov s prekurzormi peptidoglykánu. Navyše porušuje permeabilitu bunkovej membrány baktérie a syntézu RNA.
Mechanizmus (mechanizmy) rezistencie:Rezistencia na vankomycín je založená na nasledujúcich mechanizmoch:
· Zmena cieľovej štruktúry: táto forma rezistencie sa vyskytuje v priebehu posledných niekoľko rokov, najmä u druhov
Enterococcus feacium. Táto zmena je spôsobená nahradením koncovej skupiny D-alanín-D-alanín aminokyselinového bočného reťazca v mureínovom prekurzore skupinou D-Ala-D-laktát, čo má za následok výrazné zníženie afinity vankomycínu.
· U stafylokokov je znížená citlivosť alebo rezistencia založená na nadprodukcii mureínového prekurzoru, na ktorý sa vankomycín viaže.
Neexistuje skrížená rezistencia medzi vankomycínom a inými antibiotikami, avšak skrížená rezistencia vzniká s inými glykopeptidovými antibiotikami, ako je napríklad teikoplanín. Sekundárny vývoj rezistencie počas liečby je zriedkavý.
V niektorých krajinách sú pozorované zvyšujúce sa prípady rezistencie, najmä u enterokokov, zvlášť alarmujúce sú multirezistentné kmene
Enterococcus feacium.Synergický účinokKombinácia vankomycínu s aminoglykozidovým antibiotikom má synergický účinok proti mnohým kmeňom Staphylococcus aureus
, neenterokokovým D-streptokokom, enterokokokom a streptokokom zo skupiny Viridans
. Konbinácia vankomycínu s cefalosporínom má synergický účinok proti niektorým kmeňom Staphylococcus epidermidisrezistentným voči oxacilínu a kombinácia vankomycínu s rifampicínom má synergický účinok proti Staphylococcus epidermidisa čiastočne synergický účinok proti niektorým kmeňom Staphylococcus aureus
. Keďže kombinácia vankomycínu s cefalosporínom môže mať tiež antagonistický účinok proti niektorým kmeňom Staphylococcus epidermidis a v kombinácii s rifampicínom proti niektorým kmeňom Staphylococcus aureus, vhodné je predchádzajúce testovanie na synergický účinok.'
Kvôli izolácii a identifikácii mikroorganizmu spôsobujúceho infekciu a na stanovenie jeho citlivosti na vankomycín sa majú odobrať vzorky pre bakteriálnu kultiváciu.
Hraničné hodnotyHraničné hodnoty minimálnej inhibičnej koncentrácie (MIC) stanovené Európskym výborom pre testovanie antimikrobiálnej citlivosti (European Committee on Antimicrobial Susceptibility Testing, EUCAST) pre
Staphylococcus sp. a
Streptococcus sp. sú: citlivé ≤ 2 mg/l a rezistentné > 2 mg/l, pre
Enterococcus sp. sú: citlivé ≤ 4 mg/l a rezistentné > 4 mg/l a pre tie, ktoré sa nevzťahujú na druh sú: citlivé ≤ 2 mg/l a rezistentné > 4 mg/l.
CitlivosťVýskyt získanej rezistencie môže kolísať v závislosti od geografickej polohy a času pre vybrané druhy potrebné sú lokálne informácie o rezistencii najmä pri liečbe závažných infekcií. Ak je lokálny výskyt rezistencie taký, že prospešnosť liečiva je prinajmenšom u niektorých typov infekcií sporná, je potrebné sa poradiť s odborníkom.
Vankomycín má úzke spektrum účinku:
Často citlivé druhy
|
Aeróbne grampozitívne mikroorganizmy
Staphylococcusaureus
Staphylococcus negatívny na koagulázu
Staphylococcus sp.
Streptococcus pneumoniae
Streptococcussp.
Enterococcusspp.
Anaeróbne mikroorganizmy
Clostridium difficile
|
Druhy, u ktorých získaná rezistencia môže spôsobiť problémy
|
Enterococcus faecium
|
Prirodzene rezistentné mikroorganizmy
|
Gramnegatívne mikroorganizmy, mykobaktérie, huby
|
5.2 Farmakokinetické vlastnostiDistribúciaPo intravenóznom podaní sa vankomycín distribuuje takmer do všetkých tkanív a preniká do pleurálnej, perikardiálnej, ascitickej a synoviálnej tekutiny ako aj srdcového svalu a srdcových chlopní. Dosahujú sa porovnateľne vysoké koncentrácie ako v krvnej plazme. Údaje o koncentráciách vankomycínu v kosti (špongiózna, kompaktná) sa veľmi odlišujú. Zdanlivý distribučný objem v rovnovážnom stave sa udáva ako 0,43 (až do 0,9) l/kg. Ak meningy nie sú postihnuté zápalom, vankomycín prestupuje hemoencefalickou bariérou len v malom množstve.
Vankomycín je viazaný na plazmatické bielkoviny v 30 – 55 % a niekedy aj viac.
Po opakovanom perorálnom podávaní vankomycínu boli pozorované plazmatické koncentrácie vankomycínu liečených na pseudomembranóznu kolitídu zapríčinenú
Clostridium difficile.
ElimináciaVankomycín sa metabolizuje len v malom rozsahu. Po parenterálnom podaní sa vylučuje takmer úplne vo forme mikrobiálne účinného liečiva (približne 75 – 90 % počas 24 hodín) prostredníctvom glomerulárnej filtrácie v obličkách. Vylučovanie do žlče nie je významné (menej ako 5 % dávky).
U pacientov s fyziologickou funkciou obličiek je polčas v sére približne 4 – 6 (5 – 11) hodín, u detí 2,2 – 3 hodiny. Pri poškodenej funkcii obličiek môže byť polčas vankomycínu výrazne predĺžený (až do 7,5 dní). V takýchto prípadoch je vzhľadom na ototoxicitu liečby vankomycínom indikované monitorovanie koncentrácií v plazme.
Priemerné koncentrácie v plazme po i. v. infúznom podaní 1 000 mg vankomycínu počas 60 minút boli približne 63 mg/l na konci infúzie, približne 23 mg/l po 2 hodinách a približne 8 mg/l po 11 hodinách.
Klírens vankomycínu v plazme úzko koreluje s rýchlosťou glomerulárnej filtrácie.
Celkový systémový a renálny klírens vankomycínu môže byť u starších pacientov znížený.
Ako ukázali štúdie u anefrických pacientov, metabolický klírens sa zdá byť veľmi nízky.
Doposiaľ neboli u ľudí identifikované metabolity vankomycínu.
Ak sa vankomycín podáva počas peritoneálnej dialýzy intraperitoneálnou cestou, približne 60 % dosahuje systémovú cirkuláciu počas 6 hodín. Po i.p. podaní 30 mg/kg telesnej hmotnosti sa v sére dosahujú hladiny približne 10 mg/l.
Vysoko polárny vankomycín sa v prípade perorálneho použitia prakticky neabsorbuje. Po perorálnom podaní sa v aktívnej forme objavuje v stolici, preto je vhodným chemoterapeutikom pri pseudomembranóznej a stafylokokovej kolitíde.
Vankomycín ľahko preniká placentou a distribuuje sa do pupočníkovej krvi.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, neodhalili žiadne osobitné riziko pre ľudí.
Obmedzené údaje o mutagénnych účinkoch ukazujú negatívne výsledky, dlhodobé štúdie na zvieratách týkajúce sa karcinogénneho potenciálu nie sú k dispozícii. V štúdiach teratogenity, v ktorých boli potkanom a králikom podávané dávky približne zodpovedajúce dávkam u ľudí vypočítané na základe telesného povrchu (mg/m
2), neboli pozorované žiadne priame alebo nepriame teratogénne účinky.
Štúdie na zvieratách týkajúce sa používania počas perinatálneho/postnatálneho obdobia a týkajúce sa účinkov na fertilitu nie sú dostupné.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokKyselina chlorovodíková (úprava pH)
6.2 InkompatibilityRoztok vankomycínu má nízke pH, čo môže zapríčiniť fyzikálnu alebo chemickú nestabilitu, keď sa mieša s inými zlúčeninami. Z toho dôvodu sa má každý parenterálny roztok pred použitím vizuálne skontrolovať, či neobsahuje zrazeninu alebo či nezmenil farbu. Má sa predísť miešaniu s alkalickými roztokmi.
Tento liek sa nesmie miešať s inými liekmi, okrem tých uvedených v časti 6.6.
6.3 Čas použiteľnosti3 roky
Čas použiteľnosti rekonštituovaného roztoku:Pri rekonštitúcii vo vode na injekciu bola chemická a fyzikálna stabilita roztoku preukázaná po dobu 48 hodín pri 25ºC a medzi 2 -8 °C do 96 hodín.
Čas použiteľnosti nariedeného roztoku:Chemická a fyzikálna stabilita roztoku pripraveného na použitie (s 0,9 % roztokom chloridu sodného alebo 5 % roztokom glukózy) bola preukázaná po dobu 48 hodín pri 25 ºC a do 96 hodín pri teplote medzi 2 -8 °C. Z mikrobiologického hľadiska sa má pripravený infúzny roztok použiť okamžite. Ak sa nepodá okamžite, čas a podmienky uchovávania pred podaním sú zodpovednosťou užívateľa. Doba uchovávania 24 hodín pri teplote 2 -8 °C sa obyčajne sa môže prekročiť len, ak bol infúzny roztok pripravený za kontrolovaných a validovaných aseptických podmienok.
Čas použiteľnosti rekonštituovaného roztoku na perorálne použitie: rekonštituovaný roztok sa má použiť okamžite.
6.4 Špeciálne upozornenia na uchovávaniePrášok
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Rekonštituovaný a nariedený liek
Podmienky na uchovávanie rekonštituovaného a nariedeného lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia Bezfarebná sklená injekčná liekovka typu II s brómobutylovou gumenou zátkou a hliníkovo/plastovým uzáverom typu flip off.
Veľkosti balenia: 1 injekčná liekovka, 5 injekčných liekoviek, 10 injekčných liekoviek, 20 injekčných liekoviek.
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPríprava infúzneho roztokuLiek sa musí rekonštituovať a výsledný koncentrát sa pred použitím musí nariediť.
Vancomycin Mylan 500 mg: obsah jednej liekovky rozpustite v 10 ml vody na injekciu.
Vancomycin Mylan 1 g: obsah jednej liekovky rozpustite v 20 ml vody na injekciu.
Rekonštituovaný roztok má byť číry, bezfarebný až mierne nažltlý roztok bez viditeľných častíc.
Jeden ml rekonštituovaného roztoku obsahuje 50 mg vankomycínu.
Podmienky na uchovávanie rekonštituovaného lieku, pozri časť 6.3.
Vhodné riedidlá pre ďalšie nariedenie sú voda na injekciu, 5 % roztok glukózy alebo 0,9 % roztok chloridu sodného.
V závislosti od spôsobu podania sú potrebné rozličné riedenia.
- Intermitentná infúzia:
Vancomycin Mylan 500 mg:
Rekonštituovaný roztok obsahujúci 500 mg vankomycínu sa musí nariediť s aspoň 100 ml riedidla. Požadovaná dávka má byť podaná intravenóznou infúziou rýchlosťou najviac 10 mg/min počas najmenej 60 minút.
Vancomycin Mylan 1 g:
Rekonštituovaný roztok obsahujúci 1 g vankomycínu sa musí nariediť s aspoň 200 ml riedidla. Požadovaná dávka má byť podaná intravenóznou infúziou rýchlosťou najviac 10 mg/min počas najmenej 60 minút.
- Kontinuálna infúzia:
Má sa použiť iba, ak liečba intermitentnou infúziu nie je možná.
1 g alebo 2 g vankomycínu, zodpovedajúce 2 až 4 liekovkám rekonštituovaného roztoku, sa môže pridať do dostatočne veľkého objemu vyššie spomenutých vhodných riedidiel, aby sa umožnilo infúzne podanie požadovanej dennej dávky počas 24 hodín.
Podmienky na uchovávanie nariedeného lieku, pozri časť 6.3.
Pred podaním sa má rekonštituovaný a nariedený roztok vizuálne skontrolovať na obsah častíc a zmenu zafarbenia. Má sa použiť iba číry a bezfarebný roztok bez obsahu častíc.
Príprava perorálneho roztokuPo úvodnej rekonštitúcii liekovky sa môže vybraná dávka nariediť v 30 ml vody a podať pacientovi na vypitie alebo sa nariedený materiál môže podať nazogastrickou sondou.
LikvidáciaLiekovky sú len na jednorazové použitie. Nepoužitý liek sa musí zlikvidovať.
Nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMylan S.A.S.117 allée des Parcs, 69800 Saint Priest, Francúzsko
8. REGISTRAČNÉ ČÍSLA Vancomycin Mylan 500 mg: 15/0364/11-S
Vancomycin Mylan 1 g: 15/0365/11-S
9. DÁTUM PRVEJ REGISTRÁCIE / PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUMáj 2011