pokynov a len s pomôckami odporúčanými pre tento liek (pozri časť 6.6).
Špecifické odporúčania pre aplikáciu rozprašovačom týkajúce sa požadovaného tlaku a vzdialenosti od tkaniva v závislosti od chirurgického zákroku a dĺžky špičiek aplikátora sú uvedené v častiach 4.4 a 6.6.
Pri chirurgických zákrokoch, pri ktorých sa používa minimálny objem fibrínového tkanivového lepidla, sa odporúča vytlačiť a zlikvidovať prvých niekoľko kvapiek lieku.
4.3 KontraindikácieSamotný Tisseel nie je určený na liečbu masívneho a zvýšeného arteriálneho alebo venózneho krvácania.
Tisseel nie je indikovaný ako náhrada kožných stehov na uzavretie chirurgickej rany.
Tisseel sa nikdy nesmie podať intravaskulárne. Intravaskulárne podanie môže spôsobiť život ohrozujúce trombembolické príhody.
Tisseel sa nesmie používať v prípade precitlivenosti na liečivá alebo na ktorúkoľvek z pomocných látok.
4.4 Osobitné upozornenia a opatrenia pri používaníLen na epiléziové použitie. Nepoužívajte intravaskulárne.
V prípade neúmyselného intravaskulárneho podania lieku môžu nastať život ohrozujúce trombembolické komplikácie.
Pri nanášaní fibrínového tkanivového lepidla pomocou stlačeného plynu sa musí postupovať opatrne.
Nanášanie stlačeným plynom je spájané s potenciálnym rizikom vzduchovej alebo plynovej embólie, pretrhnutia tkaniva alebo zachytenia plynu s kompresiou, čo môže byť život ohrozujúce.
Tisseel sa má aplikovať v tenkej vrstve. Nadmerná hrúbka zrazeniny môže negatívne ovplyvniť účinnosť lieku a priebeh hojenia rany. Pri použití rozprašovačov, ktoré pri podávaní fibrínových tkanivových lepidiel využívajú regulátor tlaku, sa vyskytla život ohrozujúca/smrteľná vzduchová alebo plynová embólia. Táto udalosť zrejme súvisí s použitím rozprašovača s vyšším ako odporúčaným tlakom a/alebo v tesnej blízkosti k povrchu tkaniva. Riziko sa zdá byť vyššie pri rozprašovaní fibrínových tkanivových lepidiel za použitia vzduchu v porovnaní s použitím CO2, a preto sa pri rozprašovaní Tisseelu pri otvorenom chirurgickom zákroku nedá vylúčiť.Pri rozprašovaní Tisseelu sa uistite, že používate tlak v rozsahu odporúčanom výrobcom rozprašovača (tlak a vzdialenosti, pozri časť 6.6).Tisseel sa môže aplikovať rozprašovačom len v prípade, ak je možné správne odhadnúť vzdialenosť rozprašovania podľa odporúčania výrobcu. Nerozprašujte zo vzdialenosti bližšej ako je odporúčaná vzdialenosť.Pri rozprašovaní Tisseelu je potrebné monitorovať zmeny krvného tlaku, pulzu, saturáciu kyslíkom a koncentrácie CO2 na konci výdychu vzhľadom na možnosť vzniku vzduchovej alebo plynovej embólie (pozri tiež časť 4.2).Tisseel sa nesmie používať s rozprašovacím systémom Easy Spray v uzavretých častiach tela.
Pred aplikáciou Tisseelu sa musí dbať na to, aby časti tela mimo požadovanej plochy aplikácie boli dostatočne chránené/kryté, aby sa predišlo prilepeniu tkaniva na nežiaduce miesta.
Ak sa fibrínové tkanivové lepidlá aplikujú na tesne ohraničené plochy, ako napr. mozog alebo miecha, musí sa vziať do úvahy riziko kompresívnych komplikácií.
Tesne pred použitím vytlačte niekoľko prvých kvapiek lieku z aplikačnej kanyly a zlikvidujte ich, aby sa zaistilo riadne zmiešanie zložky lepiaceho proteínu a zložky trombínu.
Podobne ako u iných liekov s obsahom proteínu sa môžu objaviť hypersenzitívne reakcie alergického typu.
Intravaskulárne aplikácia môže u citlivých pacientov zvýšiť pravdepodobnosť a závažnosť akútnych hypersenzitívnych reakcií .
Pri použití Tisseelu boli hlásené hypersenzitívne reakcie a anafylaktické reakcie (aj fatálne vrátane anafylaktického šoku). Príznaky hypersenzitívnych reakcií môžu zahŕňať urtikáriu, generalizovanú urtikáriu, tlak na hrudníku, sipot, hypotenziu. Ak sa vyskytnú tieto príznaky, aplikácia lieku sa musí okamžite ukončiť a musia sa zahájiť aktuálne platné štandardné opatrenia v liečbe šoku. Zvyšný liek sa musí z miesta podania odstrániť.
Tisseel obsahuje syntetický proteín (aprotinín). Aj v prípade výhradne lokálnej aplikácie existuje riziko anafylaktickej reakcie spájanej s prítomnosťou aprotinínu. Riziko sa zdá byť vyššie v prípadoch s predchádzajúcou expozíciou, aj keď bol liek dobre tolerovaný. Preto sa každé použitie aprotinínu alebo liekov obsahujúcich aprotinín musí zaznamenať do zdravotnej dokumentácie pacienta.
Keďže syntetický aprotinín je štrukturálne identický s hovädzím aprotinínom, použitie Tisseelu u pacientov alergických na hovädzie proteíny sa má dôkladne zvážiť.
V dvoch retrospektívnych nerandomizovaných štúdiách u pacientov podstupujúcich operáciu s aortokoronárnym bypassom, ktorým sa aplikovalo fibrínové tkanivové lepidlo, bolo zistené štatisticky významne zvýšené riziko mortality. Aj keď tieto štúdie nepreukázali kauzálnu súvislosť, zvýšené riziko spájané s použitím Tisseelu nemožnou týchto pacientov vylúčiť. Preto je potrebné venovať zvýšenú pozornosť, aby nedošlo k neúmyselnému intravaskulárnemu podaniu lieku.
Je potrebné vyhnúť sa podaniu injekcie do nosovej sliznice, pretože by mohlo dôjsť k trombembolickým komplikáciám v oblasti
arteria ophthalmica.
Injekcia Tisseelu do tkaniva nesie so sebou riziko lokálneho poškodenia tkaniva.
Tisseel sa má aplikovať len v tenkej vrstve. Nadmerná hrúbka zrazeniny môže negatívne ovplyvniť účinnosť lieku a priebeh hojenia rany.
Polysorbát 80 môže spôsobiť lokálne podráždenie kože, ako je kontaktná dermatitída.
Štandardné opatrenia na zabránenie infekcií v dôsledku používania liekov pripravených z ľudskej krvi alebo plazmy zahŕňajú výber darcov, skríning jednotlivých dávok darovanej krvi a zmesí plazmy na špecifické markery infekcie a zahrnutie efektívnych výrobných postupov na inaktiváciu/odstránenie vírusov. Napriek tomu pri podávaní liekov vyrobených z ľudskej krvi alebo plazmy nie je možné úplne vylúčiť prenos infekčných agens. To tiež platí pre neznáme alebo novoobjavené vírusy a iné patogény.
Tieto vykonané opatrenia sa považujú za účinné proti obaleným vírusom, ako sú vírusy ľudskej imunitnej nedostatočnosti (HIV), vírus hepatitídy B (HBV) a hepatitídy C ( HCV) a proti neobalenému vírusu hepatitídy A (HAV).
Vykonané opatrenia môžu byť obmedzene účinné proti neobaleným vírusom, akým je parvovírus B19. Infekcia parvovírusom B19 môže byť závažná pre gravidné ženy (infekcia plodu) a pre jedincov s imunodeficienciou alebo zvýšenou erytropoézou (napr. hemolytická anémia).
Vhodné očkovanie (hepatitída A a B), sa má zvážiť u pacientov, ktorí pravidelne / opakovane dostávajú fibrínové lepidlá pochádzajúce z ľudskej plazmy.
Pri každom podaní Tisseelu pacientovi sa dôrazne odporúča zaznamenať názov a číslo šarže lieku, aby sa zachovalo spojenie medzi pacientom a šaržou lieku.
Prípravky s obsahom oxidovanej celulózy sa nesmú používať s Tisseelom (pozri časť 6.2 Inkompatibility).
4.5 Liekové a iné interakcieNeuskutočnili sa žiadne interakčné štúdie. Podobne ako u porovnateľných liekov alebo roztokov trombínu sa môže tento liek denaturovať kontaktom s roztokmi obsahujúcimi alkohol, jód alebo ťažké kovy (napr. antiseptické roztoky). Pred aplikáciou tohto lieku treba tieto látky odstrániť v maximálnej možnej miere.
Pozri časť 6.2.
4.6 Fertilita, gravidita a laktáciaBezpečnosť použitia fibrínových tkanivových lepidiel/hemostatík počas gravidity alebo dojčenia neboli v kontrolovaných klinických štúdiách stanovené. Experimentálne štúdie na zvieratách nie sú dostatočné na posúdenie bezpečnosti lieku v súvislosti s reprodukciou, embryonálnym a fetálnym vývojom, priebehom gravidity a perinatálnym a postnatálnym vývojom.
Preto sa môže tento liek podávať gravidným a dojčiacim ženám iba v nevyhnutných prípadoch.
Informácie o infekcii parvovírusom B19 nájdete v časti 4.4.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNetýka sa.
4.8 Nežiaduce účinkyV zriedkavých prípadoch sa u pacientov liečených fibrínovými tkanivovými lepidlami/hemostatikami môžu vyskytovať hypersenzitivita alebo alergické reakcie (ktoré môžu zahŕňať, okrem iného, angioedém, pálenie a pichanie v mieste aplikácie , bradykardiu, bronchospazmus, zimnicu, sťažené dýchanie, prechodný erytém (začervenanie), generalizovanú urtikáriu, bolesť hlavy, urtikáriu, hypotenziu, letargiu, nauzeu, pruritus, nepokoj, parestéziu, tachykardiu, tlak na hrudníku, mravčenie, vracanie, sipot), anafylaktické reakcie a anafylaktický šok zahŕňali smrteľnéh prípady.
V ojedinelých prípadoch sa tieto reakcie vyvinuli do ťažkej anafylaxie. Takéto reakcie sa môžu objaviť predovšetkým vtedy, ak sa liek aplikuje opakovane alebo ak sa podáva pacientom so známou precitlivenosťou na aprotinín (pozri časť 4.4) alebo na akúkoľvek inú zložku lieku.
Aj keď bola opakovaná liečba Tisseelom dobre tolerovaná, následné podanie Tisseelu alebo systémové podanie aprotinínu môžu viesť k závažným anafylaktickým reakciám.
V zriedkavých prípadoch sa môžu vyskytnúť protilátky proti zložkám fibrínového tkanivového lepidla/hemostatika.
Neúmyselná intravaskulárna injekcia môže spôsobiť život ohrozujúce trombembolické príhody a DIC. Existuje tiež riziko anafylaktickej reakcie (pozri časť 4.4).
Informácie o bezpečnosti s ohľadom na prenosné agensy nájdete v časti 4.4.
Nežiaduce reakcie uvedené v tejto časti boli hlásené z klinických štúdií zameraných na bezpečnosť a účinnosť Tisseelu a zo skúsenosti s fibrínovými tkanivovými lepidlami spoločnosti Baxter po uvedení na trh (označené
p v tabuľke nežiaducich udalostí nižšie). V klinických skúšaniach sa Tisseel použil ako doplnková hemostáza v kardiochirurgii, cievnej chirurgii, pri úplných endoprotézach bedrového kĺbu a pri operáciách pečene a sleziny. Iné klinické štúdie zahŕňali lepenie lymfatických ciev u pacientov podstupujúcich axilárnu lymfadenektómiu, lepenie anastomóz hrubého čreva a lepenie dura mater vo fossa posterior. Keďže sa frekvencia výskytu nežiaducich udalostí pozorovaných po uvedení na trh nedá vypočítať, všade kde je to možné, bola vypočítaná horná hranica 95% intervalu spoľahlivosti použitím „pravidla troch“ nasledujúcim spôsobom: 3/1146 = 0,0026 alebo 0,26%, čo je "menej časté" (kde "1146" je celkový počet jedincov, ktorí dostali Tisseel v klinických skúšaniach, z ktorých údaje boli zahrnuté do SPC).
Veľmi časté (³ 1/10)
Časté (³ 1/100 až <1/10)
Menej časté (³ 1/1 000 až <1/100)
Zriedkavé (³ 1/10 000 až <1/1 000)
Veľmi zriedkavé (< 1/10 000)
Neznáme (z dostupných údajov)
Trieda orgánového systému (SOC)
| Preferovaný MedDRA termín
| Frekvencia
|
Infekcie a nákazy
| Pooperačná infekcia rany
| Časté
|
Poruchy krvi a lymfatického systému
| Zvýšenie rozkladných
produktov fibrínu
| Menej časté
|
Poruchy imunitného systému
| Hypersenzitívne reakcie*p
| Menej časté
|
Anafylaktické reakcie* p
| Menej časté
|
Anafylaktický šok* p
| Menej časté
|
Parestézia p
| Menej časté
|
Bronchospazmus p
| Menej časté
|
Sipot p
| Menej časté
|
Pruritus p
| Menej časté
|
Erytém p
| Menej časté
|
Poruchy nervového systému
| Poruchy zmyslového vnímania
| Časté
|
Poruchy srdca a srdcovej činnosti
| Bradykardia p
| Menej časté
|
Tachykardia p
| Menej časté
|
Poruchy ciev
| Trombóza axilárnej žily **
| Časté
|
Hypotenzia
| Zriedkavé
|
Hematóm (NOS) p
| Menej časté
|
Arteriálna embólia p
| Menej časté
|
Vzduchová embólia *** p
| Neznáme
|
Embólia cerebrálnej artérie p
| Menej časté
|
Cerebrálny infarkt** p
| Menej časté
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Dyspnoe p
| Menej časté
|
Poruchy gastrointestinálneho traktu
| Nauzea
| Menej časté
|
Intestinálna obštrukcia p
| Menej časté
|
Poruchy kože a podkožného tkaniva
| Vyrážka
| Časté
|
Urtikária p
| Menej časté
|
Porucha hojenia p
| Menej časté
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| Bolesť v končatine
| Časté
|
Celkové poruchy a reakcie v mieste podania
|
|
|
Bolesť
| Časté
|
Zvýšená telesná teplota
| Časté
|
Začervenanie kože p
| Menej časté
|
Edém p
| Menej časté
|
Úrazy, otravy a komplikácie liečebného postupu
| Operačná bolesť
| Menej časté
|
Seróm
| Veľmi časté
|
Angioedém p
| Menej časté
|
* anafylaktické reakcie a anafylaktický šok zahŕňajú prípady s fatálnymi následkami.
** v dôsledku intravaskulárneho podania do sinus petrosus superior.
*** rovnako ako u iných fibrínových tkanivových lepidiel, pri použití zariadenia so stlačeným vzduchom alebo plynom došlo život ohrozujúcim / fatálnym vzduchovým alebo plynovým embóliám; táto udalosť môže mať súvislosť s nevhodným použitím rozprašovacieho systému (napr. na vyšší ako odporúčaný tlak a v tesnej blízkosti povrchu tkaniva).
p Nežiaduce udalosti pozorované po uvedení na trh.
Reakcie súvisiace s liekovou triedouĎalšie nežiaduce reakcie súvisiace s triedou fibrínové tkanivové lepidlo/hemostatikum zahŕňajú: prejavy hypersenzitivity zahŕňajú podráždenie v mieste podania, nepríjemný pocit na hrudníku, triašku, bolesť hlavy, letargiu, nepokoj a vracanie.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité.Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 PredávkovanieNeboli hlásené žiadne prípady predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: lokálne hemostatiká, ATC kód: B02BC; tkanivové lepidlá, ATC kód: V03AK
Systém adhézie fibrínu napodobňuje poslednú fázu fyziologického zrážania krvi. K premene fibrinogénu na fibrín dochádza rozštiepením fibrinogénu na fibrínové monoméry a fibrínopeptidy. Fibrínové monoméry agregujú a vytvárajú fibrínovú zrazeninu. Faktor XIIIa, ktorý vzniká z faktoru XIII spoločným účinkom trombínu a iónov vápnika, stabilizuje zrazeninu zosieťovaním vlákien fibrínu.
Počas hojenia rany plazmín indukuje zvýšenú fibrinolytickú aktivitu a iniciuje sa rozklad fibrínu na rozkladné produkty fibrínu. Proteolytický rozklad fibrínu je inhibovaný antifibrinolytikami. Tisseel obsahuje aprotinín ako antifibrinolytikum na prevenciu predčasného rozkladu zrazeniny.
Na preukázanie účinnosti boli vykonané štúdie
in vivo na štyroch zvieracích modeloch, ktoré čo najvernejšie imitovali stav pacientov. Tisseel bol účinný pri primárnej a sekundárnej hemostáze, ako aj pri hojení rany.
Klinické štúdie preukazujúce hemostázu a podporu sutúr boli vykonané u celkovo 213 pacientov (120 s Tisseelom, 93 s kontrolným liekom), ktorí podstúpili cievne operáciu s ePTFE trubicou, celkovo u 70 pacientov (35 s Tisseelom, 35 s kontrolným liekom), ktorí podstúpili čiastočnú pečeňovú resekciu a u celkovo 317 pacientov (157 s Tisseelom, 160 s predchádzajúcou formuláciou lieku s jednorazovou inaktiváciou vírusu ako kontrolným liekom), ktorí podstúpili operáciu srdca s mimotelovým obehom a mediálnou sternotómiou.
Účinnosť lieku TISSEEL ako doplnku ku konvenčným chirurgickým metódam v lepení anastomóz čriev u pacientov s traumou podstupujúcich uzavretie dočasných kolostómií bola preukázaná v randomizovanej kontrolovanej prospektívnej štúdii v jednom centre uskutočnenej v roku 1986 u celkovo 120 pacientov (61 s Tisseelom , 59 s kontrolným liekom).
5.2 Farmakokinetické vlastnostiTisseel je určený len na epiléziové použitie. Intravaskulárne podanie je kontraindikované. V dôsledku toho neboli u ľudí vykonané žiadne intravaskulárne farmakokinetické štúdie.
Farmakokinetické štúdie u rôznych druhov laboratórnych zvierat neboli vykonané.
Fibrínové tkanivové lepidlá/hemostatiká sú metabolizované rovnakým spôsobom ako endogénny fibrín, fibrinolýzou a fagocytózou.
5.3 Predklinické údaje o bezpečnostiVzhľadom k povahe a špeciálnemu spôsobu použitia (zvyčajne jednorazová, len vo výnimočných prípadoch opakovaná aplikácia niekoľkých ml) a mechanizmu účinku (lokálna účinnosť bez systémového efektu alebo distribúcie do iných orgánov a tkanív) nie sú dostupné predklinické údaje o bezpečnosti Tisseelu ohľadom chronickej toxicity, karcinogenity, reprodukčnej a vývojovej toxicity alebo stimulácie imunity.
Štúdie toxicity s jednorazovou dávkou u potkanov a králikov nepreukázali akútnu toxicitu Tisseelu. Okrem toho v príslušných
in vitro testoch sa nepotvrdila mutagenita. Roztok lepiaceho proteínu bol tiež dobre tolerovaný bunkovými kultúrami ľudských fibroplastov
in vitro, čím bola preukázaná výborná bunková kompatibilita a nebola potvrdená cytotoxicita. Na základe podrobného prieskumu literatúry sa môže vylúčiť akýkoľvek negatívny účinok alebo toxicita zvyškov organických rozpúšťadiel vo fibrínovom lepidle Tisseel.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látokZložka 1: Roztok lepiaceho proteínu:
ľudský albumín
L-histidín
niacínamid
dihydrátcitrónanu sodného
polysorbát 80 (Tween 80)
voda na injekciu
Zložka 2: Roztok trombínu: ľudský albumín
chlorid sodný
voda na injekciu
6.2 InkompatibilityPrípravky s obsahom oxidovanej celulózy sa nesmú používať s Tisseelom, pretože nízke pH interferuje s aktivitou trombínu.
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6
6.3 Čas použiteľnosti2 roky
6.4 Špeciálne upozornenia na uchovávanieUchovávajte a prepravujte zmrazené (pri
< – 20 °C) bez prerušenia až do aplikácie.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Neotvorený liek rozmrazený pri teplote do 25 °C je možné uchovávať po dobu 72 hodín pri teplote do 25 °C. Ak roztok do 72 hodín po rozmrazení nespotrebujete, Tisseel treba zlikvidovať.
Po rozmrazení znovu nezmrazujte a nevkladajte naspäť do chladničky.
6.5 Druh obalu a obsah baleniaObsah balenia s injekčnou striekačkou PRIMA:1 ml, 2 ml alebo 5 ml roztoku lepiaceho proteínu a 1 ml, 2 ml alebo 5 ml roztoku trombínu v dvojkomorovej naplnenej injekčnej striekačke (z polypropylénu) uzatvorenej ochranným krytom špičky zabalenej v dvoch obaloch a s pomôckou s 2 spojovacími časťami a 4 aplikačnými kanylami.
alebo Obsah balenia s injekčnou striekačkou AST („AdvancedSyringeTechnology“):1 ml, 2 ml alebo 5 ml roztoku lepiaceho proteínu a 1 ml, 2 ml alebo 5 ml roztoku trombínu v predplnenej dvojkomorovej injekčnej striekačke (polypropylén) uzavretej vrchným krytom, balenej v dvoch vreckách, obsahujúcej zariadenie s 2 spojovacími časťami, 4 aplikačné kanyly a jeden dvojitý piest.
alebo
Obsah balenia systému dvoch injekčných striekačiek DSS (Duo Syringe System):1 ml, 2 ml alebo 5 ml roztoku lepiaceho proteínu a 1 ml, 2 ml alebo 5 ml roztoku trombínu v dvoch predplnených injekčných striekačkách (polypropylén) uzavretých vrchným krytom, balených v dvoch vreckách obsahujúcich zariadenie s 2 spojovacími časťami a 4 aplikačné kanyly.
Veľkosti balení:Tisseel je dostupný v baleniach nasledujúcich veľkostí: 1 x 2 ml (1 ml + 1 ml), 1 x 4 ml (2 ml + 2 ml) a 1 x 10 ml (5 ml + 5 ml).
Na trh nemusia byť uvedené všetky veľkosti balenia.
Ďalšie príslušenstvo na aplikáciu lieku je možné obstarať od spoločnosti BAXTER.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomVšeobecnéPred podaním Tisseelu prikryte všetky časti tela mimo požadovanej plochy aplikácie, aby sa predišlo prilepeniu tkaniva na nežiaduce miesta.
Chirurgické rukavice a nástroje navlhčite pred kontaktom roztokom chloridu sodného, aby sa zabránilo prilepeniu fibrínového tkanivového lepidla Tisseel na ne.
Návod na lepenie povrchov: Jedno 2 ml balenie Tisseelu (t. j. 1 ml roztoku lepiaceho proteínu
plus 1 ml roztoku trombínu) je dostatočné na pokrytie plochy minimálne 10 cm
2.
Potrebná dávka závisí od veľkosti povrchu, ktorý treba lepiť.
Jednotlivé dve zložky Tisseelu NEAPLIKUJTE oddelene. Obidve zložky sa musia aplikovať spolu.
Tisseel NEVYSTAVUJTE teplotám nad 37 °C. NEVYSTAVUJTE účinku mikrovĺn.
Liek NEROZMRAZUJTE držaním v rukách.
Tisseel NEPOUŽÍVAJTE, pokiaľ nie je úplne rozmrazený a zohriaty na 33 °C – 37 °C.
Ochranný kryt injekčnej striekačky odstráňte len v prípade, ak došlo k úplnému rozmrazeniu a ohriatiu.
Pre injekčnú striekačku PRIMA: na uľahčenie odstránenia ochranného krytu špičky z injekčnej striekačky rozkývajte ochranný kryt špičky pohybom smerom dozadu a dopredu, potom ochranný kryt injekčnej striekačky stiahnite.
Z injekčnej striekačky vytlačte všetok vzduch, potom nasaďte spojovaciu časť a aplikačnú kanylu.
Návod na prípravu a použitie:Roztok lepiaceho proteínu a roztok trombínu sú obsiahnuté v injekčnej striekačke na okamžité použitie. Liek je zabalený do dvoch sterilných obalov za aseptických podmienok. Vnútorný obal a jeho obsah sú sterilné, pokiaľ nedošlo k poškodeniu vonkajšieho obalu. Pomocou sterilnej techniky preneste sterilný vnútorný obal a obsah do sterilného prostredia.
Injekčnú striekačku na okamžité použitie možno rozmraziť A zohriať jedným z nasledujúcich spôsobov:1. Rýchle rozmrazenie/zohriatie (sterilný vodný kúpeľ) – odporúčaný spôsob2. Rozmrazenie/zohriatie v nesterilnom vodnom kúpeli
3. Rozmrazenie/zohriatie v inkubátore
4. Injekčnú striekačku na okamžité použitie možno tiež rozmraziť a uchovávať pri izbovej teplote (neprevyšujúcej 25 °C) počas menej ako 72 hodín. Pred použitím sa vyžaduje zahriatie.
1) Rýchle rozmrazenie/zohriatie (sterilný vodný kúpeľ) – odporúčaný spôsobOdporúča sa rozmraziť a zohriať obe zložky lepidla v sterilnom vodnom kúpeli pri teplote 33 – 37 °C.
- Teplota vodného kúpeľa nesmie presiahnuť teplotu 37 °C. Na kontrolu stanoveného rozsahu teplôt vodného kúpeľa použite teplomer a v prípade potreby vodu vymeňte.
Ak na rozmrazenie a zohriatie používate sterilný vodný kúpeľ, pred vložením do sterilného vodného kúpeľa vyberte naplnenú injekčnú striekačku z obalov.
Pokyny:Preneste vnútorný obal do sterilného prostredia, vyberte injekčnú striekačku na okamžité použitie z vnútorného obalu a umiestnite ju priamo do sterilného vodného kúpeľa. Uistite sa, že obsah injekčnej striekačky na okamžité použitie je úplne ponorený vo vode.
Tabuľka 1: Minimálne časy rozmrazovania a zohrievania pri použití sterilného vodného kúpeľa Veľkosť balenia
| Minimálne časy rozmrazovania a zohrievania
Sterilný vodný kúpeľ 33 °C až 37 °C
Liek vybratý z obalov
|
PRIMA
| AST
| DSS
|
2 ml
| 5 minút
| 5 minút
| 8 minút
|
4 ml
| 5 minút
| 5 minút
| 9 minút
|
10 ml
| 10 minút
| 12 minút
| 13 minút
|
Ponechajte injekčnú striekačku na okamžité použitie v oboch obaloch a umiestnite ju na príslušnú dobu (pozri tabuľku 2) do vodného kúpeľa mimo sterilného prostredia. Uistite sa, že obaly sú po celú dobu rozmrazovania ponorené vo vode. Po rozmrazení vyberte obaly z vodného kúpeľa, osušte vonkajší obal a preneste vnútorný obal s injekčnou striekačkou na okamžité použitie do sterilného prostredia.
Tabuľka 2: Minimálne časy rozmrazovania a zohrievania pri použití nesterilného vodného kúpeľa Veľkosť balenia
| Minimálne časy rozmrazovania a zohrievania
Nesterilný vodný kúpeľ 33 °C až 37 °C
Liek v obaloch
|
PRIMA
| AST
| DSS
|
2 ml
| 15 minút
| 30 minút
| 31 minút
|
4 ml
| 20 minút
| 40 minút
| 46 minút
|
10 ml
| 35 minút
| 80 minút
| 64 minút
|
Ponechajte injekčnú striekačku na okamžité použitie v oboch obaloch a umiestnite ju mimo sterilného prostredia na príslušnú dobu (pozri tabuľku 3) do inkubátora. Po rozmrazení/zohriatí vyberte obaly z inkubátora, odstráňte vonkajší obal a vnútorný obal s injekčnou striekačkou na okamžité použitie preneste do sterilného prostredia.
Tabuľka 3: Minimálne časy rozmrazovania a zohrievania v inkubátore Veľkosť balenia
| Minimálne časy rozmrazovania a zohrievania
33 °C až 37 °C, Inkubátor
Liek v obaloch
|
PRIMA
| AST
| DSS
|
2 ml
| 40 minút
| 40 minút
| 62 minút
|
4 ml
| 50 minút
| 85 minút
| 77 minút
|
10 ml
| 90 minút
| 105 minút
| 114 minút
|
4) Rozmrazovanie pri izbovej teplote (nie vyššej ako 25 °C) PRED zohriatímPokyny:Ponechajte injekčnú striekačku na okamžité použitie v obidvoch obaloch a rozmrazujte ju pri izbovej teplote mimo sterilného prostredia počas príslušnej doby (pozri tabuľku 4). Po rozmrazení injekčnú striekačku vo vonkajšom obale zohrejte v inkubátore, aby ste liek pred použitím ohriali.
Tabuľka 4: Minimálne časy rozmrazovania pri izbovej teplote mimo sterilného prostredia a časy dodatočného zohrievania v inkubátore na 33 °C až 37 °C Veľkosť balenia
| Minimálne časy rozmrazovania lieku pri izbovej teplote
(do 25 °C) s následným dodatočným zohrievaním pred použitím v inkubátore pri teplote 33 °C až maximálne 37 °C
Liek v obaloch
|
PRIMA
|
AST
|
DSS
|
Rozmrazovanie pri izbovej teplote
(do 25 °C)
| Zohrievanie v inkubátore
(33 – 37 °C)
| Rozmrazovanie pri izbovej teplote
(do 25 °C)
| Zohrievanie v inkubátore
(33 – 37 °C)
| Rozmrazovanie pri izbovej teplote
(do 25 °C)
| Zohrievanie v inkubátore
(33 – 37 °C)
|
2 ml
| 80 minút
| + 11 minút
| 60 minút
| + 15 minút
| 82 minút
| + 28 minút
|
4 ml
| 90 minút
| + 13 minút
| 110 minút
| + 25 minút
| 117 minút
| + 30 minút
|
10 ml
| 160 minút
| + 25 minút
| 160 minút
| + 35 minút
| 167 minút
| + 44 minút
|
Po rozmrazení pri izbovej teplote sa liek musí použiť do 72 hodín od vybratia z mrazničky.
Stabilita po rozmrazeníPo rozmrazení a zohriatí (pri teplote 33 °C až 37 °C, spôsob 1, 2 a 3) bola chemická a fyzikálne stabilita lieku preukázaná počas 12 hodín pri teplote 33 °C až 37 °C.
Pri lieku
rozmrazenom pri izbovej teplote v neotvorenom obale (spôsob 4), sa chemická a fyzikálna stabilita lieku preukázala počas 72 hodín pri teplotách neprevyšujúcich 25 °C. Bezprostredne pred použitím zohrejte na 33 °C až 37 °C.'
Z mikrobiologického hľadiska, pokiaľ spôsob otvorenia/rozmrazenia nevylučuje riziká mikrobiálnej kontaminácie, sa liek má použiť okamžite po zohriatí na teplotu 33 °C až 37 °C.
Ak sa nepoužije okamžite, za časy a podmienky uchovávania pri používaní je zodpovedný používateľ.
Po začatí rozmrazovania opätovne nezmrazujte ani neuchovávajte v chladničke.
Zaobchádzanie po rozmrazení/pred použitímObe zložky tkanivového lepidla uchovávajte do použitia pri teplote 33 – 37 °C, aby sa oba roztoky optimálne zmiešali a fibrínové tkanivové lepidlo optimálne stuhlo.
Roztoky lepiaceho proteínu a trombínu majú byť číre alebo slabo opaleskujúce. Nepoužívajte roztoky, ktoré sú zakalené alebo sú v nich usadeniny. Rozmrazený liek pred použitím vizuálne skontrolujte, či neobsahuje tuhé častice, či nemá zmenenú farbu alebo či nedošlo k inej zmene vzhľadu. V prípade akýchkoľvek zmien roztoky zlikvidujte.
Rozmrazený roztok lepiaceho proteínu má byť mierne viskózna tekutina. Ak má roztok konzistenciu stuhnutého gélu, treba predpokladať, že bol denaturovaný (pravdepodobne z dôvodu prerušenia chladového reťazca alebo prehriatia počas zohrievania). V tomto prípade Tisseel za žiadnych okolností NEPOUŽÍVAJTE.
- Injekčnú striekačku vyberte z obalov až tesne pred použitím.
- Tisseel použite, iba keď je úplne rozmrazený a zohriaty (tekutá konzistencia).
· Ochranný kryt injekčnej striekačky odstráňte až tesne pred použitím. Pre injekčnú striekačku PRIMA: na uľahčenie odstránenia ochranného krytu špičky z injekčnej striekačky rozkývajte ochranný kryt špičky pohybom dozadu a dopredu, potom ochranný kryt injekčnej striekačky stiahnite.
Podávanie injekčnou striekačkou PRIMA:Pre aplikáciu pripojte dvojkomorovú injekčnú striekačku na okamžité použitie s roztokom lepiaceho proteínu a roztokom trombínu k spojovacej časti a k aplikačnej kanyle – obe sú súčasťou aplikačnej súpravy s aplikačnými pomôckami. Spoločný piest dvojkomorovej injekčnej striekačky na okamžité použitie zaručuje, že aplikačná kanyla sa cez spojovaciu časť plní rovnakými objemami oboch zložiek tkanivového lepidla, ktoré sa v nej miešajú a následne aplikujú.
Návod na použitie pre injekčnú striekačku PRIMA: dvojkomorová injekčná striekačka
|
|
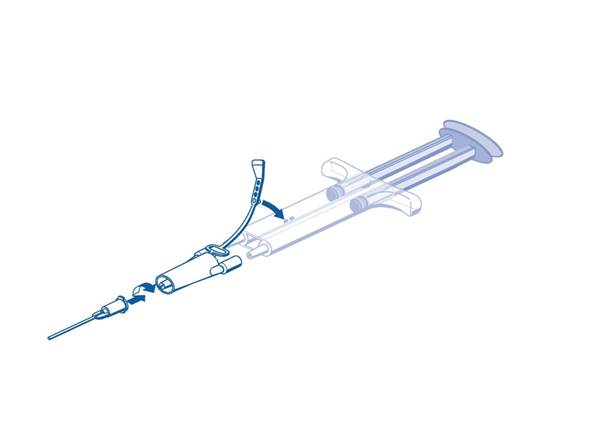
· Pred nasadením akejkoľvek aplikačnej pomôcky vytlačte z injekčnej striekačky všetok vzduch.
· Upevnite spojovaciu časť a upevňovací pás k bočnej strane injekčnej striekačky pomocou dierky pre upevňovací pás.
· Pripojte dýzy dvojkomorovej injekčnej striekačky na okamžité použitie k spojovacej časti a uistite sa, že sú pevne nasadené.
o Zaistite spojovaciu časť utiahnutím upevňovacieho pásu k dvojkomorovej injekčnej striekačke na okamžité použitie.
o Ak sa upevňovací pás roztrhne, použite náhradnú spojovaciu časť pribalenú k súprave.
o Ak nemáte žiadnu rezervnú spojovaciu časť k dispozícii, stále je možné systém použiť, ale treba zaistiť pevnosť spojenia, aby sa predišlo priesaku.
o Zvyšný vzduch vo vnútri spojovacej časti NEVYTLÁČAJTE.
· Na spojovaciu časť nasaďte aplikačnú kanylu.
o NEVYTLÁČAJTE vzduch, ktorý zostal vo vnútri spojovacej časti a vo vnútri aplikačnej kanyly, až kým skutočne nezačnete s aplikáciou, pretože môže dôjsť k upchatiu otvoru kanyly.
PodávaniePred aplikáciou Tisseelu sa musí štandardnými postupmi vysušiť povrch rany (napr. striedavou aplikáciou tlakových obväzov, tampónov, použitím odsávacích pomôcok). Na vysušenie miesta nepoužívajte stlačený vzduch alebo plyn.
· Naneste zmes roztoku lepiaceho proteínu a trombínu na povrch príjemcu alebo na povrchy častí, ktoré chcete zlepiť, pomalým zatláčaním na zadnú časť spoločného piestu.
· Pri chirurgických zákrokoch, pri ktorých sa vyžaduje použitie minimálnych objemov lepiaceho fibrínu, sa odporúča vytlačiť a zlikvidovať prvých niekoľko kvapiek lieku.
· Po aplikácii Tisseelu počkajte aspoň 2 minúty, aby sa dosiahla dostatočná polymerizácia.
alebo
Podávanie injekčnou striekačkou AST:Pre aplikáciu pripojte dvojkomorovú injekčnú striekačku na okamžité použitie s roztokom lepiaceho proteínu a roztokom trombínu k spojovacej časti a k aplikačnej kanyle – obe sú súčasťou aplikačnej súpravy. Spoločný piest dvojkomorovej injekčnej striekačky na okamžité použitie podobne ako aj aplikačné pomôcky pribalené k súprave, zaručuje, že aplikačná kanyla sa cez spojovaciu časť plní rovnakými objemami oboch zložiek tkanivového lepidla, ktoré sa v nej miešajú a následne aplikujú.
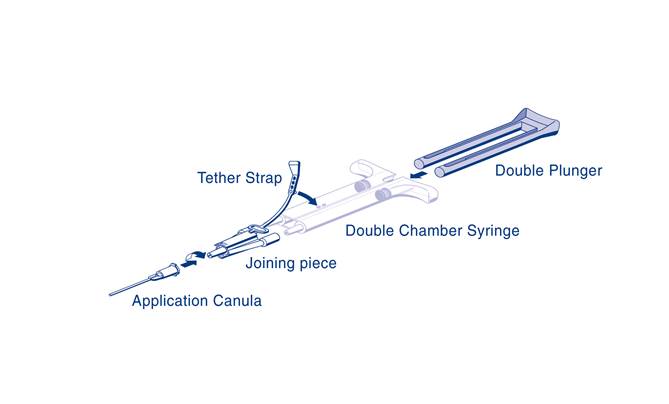 Návod na použitie pre injekčnú striekačku AST:
Návod na použitie pre injekčnú striekačku AST:· Pred nasadením akejkoľvek aplikačnej pomôcky vytlačte z injekčnej striekačky všetok vzduch.
· Upevnite spojovaciu časť a upevňovací pás k bočnej strane injekčnej striekačky pomocou dierky pre upevňovací pás.
· Pripojte dýzy dvojkomorovej injekčnej striekačky na okamžité použitie k spojovacej časti a uistite sa, že sú pevne nasadené.
o Zaistite spojovaciu časť utiahnutím upevňovacieho pásu k dvojkomorovej injekčnej striekačke na okamžité použitie.
o Ak sa upevňovací pás roztrhne, použite náhradnú spojovaciu časť pribalenú k súprave.
o Ak nemáte žiadnu rezervnú spojovaciu časť k dispozícii, stále je možné systém použiť, ale treba zaistiť pevnosť spojenia, aby sa predišlo priesaku.
o Zvyšný vzduch vo vnútri spojovacej časti NEVYTLÁČAJTE.
o Na spojovaciu časť nasaďte aplikačnú kanylu.NEVYTLÁČAJTE vzduch, ktorý zostal vo vnútri spojovacej časti a vo vnútri aplikačnej kanyly, až kým skutočne nezačnete s aplikáciou, pretože môže dôjsť k upchatiu otvoru kanyly.
PodávaniePred aplikáciou Tisseelu sa musí štandardnými postupmi vysušiť povrch rany (napr. striedavou aplikáciou tlakových obväzov, tampónov, použitím odsávacích pomôcok). Na vysušenie miesta nepoužívajte stlačený vzduch alebo plyn.
· Naneste zmes roztoku lepiaceho proteínu a trombínu na povrch príjemcu alebo na povrchy častí, ktoré chcete zlepiť, pomalým zatláčaním na zadnú časť spoločného piestu.
· Pri chirurgických zákrokoch, pri ktorých sa vyžaduje použitie minimálnych objemov fibrínového tkanivového lepidla, sa odporúča vytlačiť a zlikvidovať prvých niekoľko kvapiek lieku.
· Po aplikácii Tisseelu počkajte aspoň 2 minúty, aby sa dosiahla dostatočná polymerizácia.
alebo
Podávanie systémom dvoch injekčných striekačiek:Pre aplikáciu pripojte dve jednorazové injekčné striekačky s roztokom lepiaceho proteínu a roztokom trombínu k spojovacej časti a aplikačnej kanyle, ktoré sú súčasťou aplikačnej súpravy (DUPLOJECT COMBI). Spoločný piest držiaku pre dve injekčné striekačky DUPLOJECT zaručuje, že aplikačná kanyla sa cez spojovaciu časť plní rovnakými objemami oboch zložiek, ktoré sa v nej miešajú a následne aplikujú.
Návod na použitie systému dvoch injekčných striekačiek : Držiak pre dve injekčné striekačky
|
|
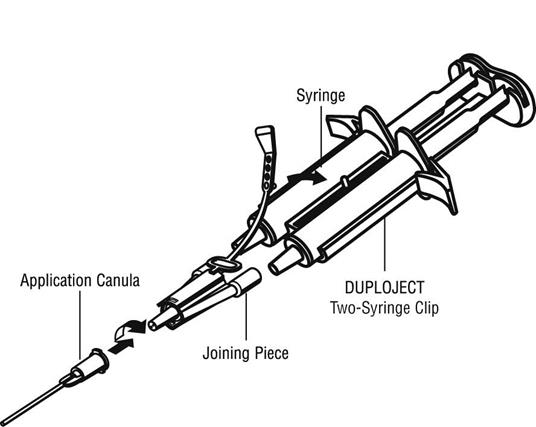
· Pred nasadením akejkoľvek aplikačnej pomôcky odstráňte z injekčnej striekačky všetok vzduch.
· Upevnite spojovaciu časť a upevňovací pás k bočnej strane injekčnej striekačky pomocou miesta na nasadenie upevňovacieho pásu.
· Pripojte dýzy systému dvoch injekčných striekačiek k spojovacej časti a uistite sa, že sú pevne nasadené.
o Zaistite spojovaciu časť utiahnutím upevňovacieho pásu k držiaku pre dve injekčné striekačky DUPLOJECT.
o Ak sa upevňovací pás roztrhne, použite náhradnú spojovaciu časť pribalenú k súprave.
o Ak nemáte žiadnu samostatnú spojovaciu časť k dispozícii, stále je možné systém použiť, ale treba zaistiť pevnosť spojenia, aby sa predišlo priesaku.
o Vo vnútri spojovacej časti NEVYTLÁČAJTE žiaden zvyšný vzduch.
· Na spojovaciu časť nasaďte aplikačnú kanylu.
o NEVYTLÁČAJTE vzduch, ktorý zostal vo vnútri spojovacej časti a vo vnútri aplikačnej kanyly, až kým skutočne nezačnete s aplikáciou, pretože môže dôjsť k upchatiu aplikačnej kanyly.
PodávaniePred aplikáciou Tisseelu sa musí štandardnými postupmi vysušiť povrch rany (napr. striedavou aplikáciou tlakových obväzov, tampónov, použitím odsávacích pomôcok). Na vysušenie miesta nepoužívajte stlačený vzduch alebo plyn.
· Naneste zmes roztoku lepiaceho proteínu a trombínu na povrch príjemcu alebo na povrch častí, ktoré chcete zlepiť, pomalým zatláčaním na zadnú časť spoločného piestu.
· Pri chirurgických zákrokoch, pri ktorých sa vyžaduje použitie minimálnych objemov fibrínového tkanivového lepidla, sa odporúča vytlačiť a zlikvidovať prvých niekoľko kvapiek lieku.
· Po aplikácii Tisseelu počkajte aspoň 2 minúty, aby sa dosiahla dostatočná polymerizácia
Poznámka:Ak sa aplikácia zložiek fibrínového tkanivového lepidla preruší, môže dôjsť k upchatiu kanyly. V takomto prípade vymeňte aplikačnú kanylu za novú bezprostredne pred pokračovaním v aplikácii. Ak dôjde k upchatiu otvoru spojovacej časti, použite náhradnú spojovaciu časť, ktorá je súčasťou balenia.
Po zmiešaní zložiek tkanivového lepidla dochádza k tuhnutiu fibrínového tkanivového lepidla za niekoľko sekúnd z dôvodu vysokej koncentrácie trombínu (500 IU/ml).
Fibrínové tkanivové lepidlo možno aplikovať aj pomocou ďalšieho príslušenstva, ktoré dodáva spoločnosť BAXTER a ktoré je špeciálne na to určené napr. na endoskopické použitie, pri minimálne invazívnych chirurgických zákrokoch alebo pri aplikácii na rozsiahle plochy alebo ťažko prístupné oblasti. Pri používaní týchto aplikačných pomôcok postupujte pozorne podľa ich návodu na použitie.
V niektorých prípadoch sa pri aplikácii používa biologicky kompatibilný materiál, napr. kolagénová hubka, ako nosič alebo na vystuženie.
Aplikácia rozprašovačomPri aplikácii Tisseelu pomocou rozprašovača sa uistite, že používate tlak a vzdialenosť od tkaniva v rozsahu odporúčanom výrobcom nasledovne:
Odporúčaný tlak, vzdialenosť a pomôcky na aplikáciu Tisseelu rozprašovaním
|
Chirurgický zákrok
| Súprava rozprašovača,
ktorá sa má použiť
| Špičky aplikátora, ktoré sa majú použiť
| Regulátor tlaku, ktorý sa má použiť
| Odporúčaná vzdialenosť od cieľového tkaniva
| Odporúčaný tlak rozprašovača
|
Otvorená rana
| Súprava rozprašovača Tisseel/Artiss
| -
| EasySpray
| 10 – 15 cm
| 1,5 – 2,0 bar
(21,5 – 28,5 psi)
|
Súprava rozprašovača Tisseel/Artiss, balenie po 10 kusov
| -
| EasySpray
|
|
Laparoskopické/minimálne invazívne zákroky
| -
| Aplikátor Duplospray MIS 20 cm
| Regulátor Duplospray MIS
| 2 – 5 cm
| 1,2 – 1,5 bar
(18 – 22 psi)
|
Regulátor Duplospray MIS NIST B11
|
Aplikátor Duplospray MIS 30 cm
| Regulátor Duplospray MIS
|
Regulátor Duplospray MIS NIST B11
|
Aplikátor Duplospray MIS 40 cm
| Regulátor Duplospray MIS
|
Regulátor Duplospray MIS NIST B11
|
Vymeniteľná špička
| Regulátor Duplospray MIS
|
Regulátor Duplospray MIS NIST B11
|
| | | | | | |
Pri rozprašovaní Tisseelu je potrebné monitorovať zmeny krvného tlaku, pulzu, saturácie kyslíkom a koncentrácie CO2 na konci výdychu vzhľadom na možnosť vzniku vzduchovej alebo plynovej embólie (pozri časti 4.2 a 4.4).Pri aplikácii Tisseelu v uzavretom hrudnom alebo brušnom priestore sa odporúča použiť systém aplikátora a regulátora DuploSpray MIS. Postupujte podľa návodu na používanie pomôcky DuploSpray MIS.
LikvidáciaVšetok nepoužitý liek alebo odpad vzniknutý z liekov sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Baxter Slovakia s.r.o.
Dúbravská cesta 2
84104 Bratislava
Slovensko
8. REGISTRAČNÉ ČÍSLO
87/0388/14-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 25.novembra 2014
Dátum posledného predĺženia registrácie:
10. DÁTUM REVÍZIE TEXTU
01/2017