
trexónu / bupropiónu sú porovnateľné s koncentráciami pozorovanými po podaní jednej dávky bupropiónu SR 150 mg; nevykonala sa však žiadna štúdia, ktorá by stanovila koncentrácie bupropiónu a jeho metabolitov po opakovanom podaní tabliet naltrexónu / bupropiónu v porovnaní s tabletami bupropiónu SR. Keďže nie je známe, či riziko záchvatov pri bupropióne je spôsobené bupropiónom alebo metabolitom bupropiónu, a nie sú k dispozícii údaje preukazujúce porovnateľnosť plazmatických koncentrácií po opakovanom podaní, je zatiaľ neisté či opakované podanie naltrexónu / bupropiónu môže byť spojené s podobnou mierou výskytu záchvatov ako pri
bupropióne SR 300 mg. V klinických skúšaniach u subjektov, ktorí dostávali naltrexón / bupropión bol
výskyt záchvatov približne 0,06 % (2/3239 subjektov) verzus 0,0 % (0/1515 subjektov) u placeba. Výskyt záchvatov, spolu s výskytom záchvatov u subjektov, ktorí dostávali naltrexón / bupropión vo veľkom klinickom skúšaní s kardiovaskulárnymi výsledkami (CVOT) nebol vyšší ako výskyt záchvatov pri bupropióne podávanom samostatne vo schválených dávkach.
Riziko záchvatov súvisí aj s faktormi na strane pacienta, klinickými okolnosťami, a súbežnými liekmi, ktoré je potrebné zvážiť pri výbere pacientov na liečbu naltrexónom / bupropiónom. Naltrexón / bupropión sa má vysadiť a liečbu ním už znova nezačínať u pacientov, u ktorých sa počas liečby týmto liekom vyskytli záchvaty. Je potrebná opatrnosť pri predpisovaní naltrexónu / bupropiónu pacientom
s predispozičnými faktormi, ktoré môžu zvýšiť riziko záchvatov a ktoré zahŕňajú:
• anamnézu úrazu hlavy
• nadmerné užívanie alkoholu alebo závislosť na kokaíne alebo stimulantoch
• keďže liečba naltrexónom / bupropiónom môže viesť k nižším hladinám glukózy u pacientov s diabetom, dávka inzulínu a/alebo perorálnych antidiabetík sa má nastaviť tak, aby sa minimalizovalo riziko hypoglykémie, ktorá by mohla predisponovať pacienta k záchvatu
• súbežné podávanie iných liekov, ktoré môžu znižovať záchvatový prah, vrátane antipsychotík, antidepresív, antimalarík, tramadolu, teofylínu, systémových steroidov, chinolónov a sedatívnych antihistaminík
Naltrexón / bupropión je kontraindikovaný u pacientov s nádorom cetrálneho nervového systému, ťažkým znížením funkcie pečene, diagnózou bulímie alebo anorexie v súčasnosti alebo v minulosti, alebo u pacientov pri odvykaní od sedatív (pozri časť 4.3).
Počas liečby naltrexónom / bupropiónom sa má minimalizovať konzumácia alkoholu alebo sa má alkoholu úplne vyhnúť.
PacientidostávajúciopioidnéanalgetikáNaltrexón / bupropión sa nesmie podať pacientom, ktorí sa dlhodobo liečia opiátmi (pozri časť 4.3). Ak sa vyžaduje liečba opiátmi, liečba naltrexónom / bupropiónom sa musí ukončiť. Pacienti vyžadujúci intermitentnú liečbu opiátmi môžu dočasne prerušiť liečbu naltrexónom / bupropiónom a nezvyšovať dávku opiátu nad štandardnú dávku. Počas klinických skúšaní s naltrexónom / bupropiónom bolo vylúčené užívanie súbežnej liečby opioidmi alebo opioidom podobnými liekmi, vrátane analgetík alebo antitusík. Avšak približne 12 % subjektov súbežne užívalo opioidy alebo
opioidom podobné lieky počas náboru do klinického skúšania naltrexónom / bupropiónom, a väčšina z nich pokračovala v skúšanej liečbe bez prerušenia dávky naltrexónu / bupropiónu a bez nežiaducich následkov.
SnahaprekonaťblokáduSnaha prekonať akúkoľvek opioidovú blokádu spôsobenú naltrexónom tým, že sa podá veľké množstvo exogénnych opioidov, je veľmi nebezpečná a môže viesť k fatálnemu predávkovaniu alebo ohrozeniu života opioidmi (napr. zástava dychu, obehový kolaps). Pacienti si musia byť vedomí, že po prerušení liečby naltrexónom / bupropiónom môžu byť citlivejší na nižšie dávky opioidov.
AlergickéreakcieV klinických skúšaniach s bupropiónom boli hlásené anafylatoidné/anafylaktické reakcie charakterizované príznakmi ako pruritus, urtkária, angioedém a dyspnoe vyžadujúce lekársku starostlivosť. Ďalej boli po uvedení lieku na trh zriedkavé spontánne hlásenia výskytu multiformného erytému, Stevensov
ho-Johnsonovho syndrómu a anafylaktického šoku spojeného s bupropiónom. Pacienti musia prestať užívať naltrexón / bupropión a poradiť sa s lekárom, ak sa u nich počas liečby vyskytne alergická alebo anafylaktoidná/anafylaktická reakcia (napr. kožná vyrážka, pruritus, žihľavka, bolesť v hrudníku, edém a dýchavičnosť).
V súvislosti s bupropiónom boli hlásené artralgia, myalgia a horúčka s vyrážkou a iné symptómy naznačujúce oneskorenú hypersezitivitu. Tieto symptómy sa podobajú sérovej chorobe. Pacienti majú byť poučení, aby upozornili predpisujúceho lekára v prípade, že sa u nich prejaví niektorý z týchto symptómov. Pri podozrení na sérovú chorobu sa má naltrexón / bupropión vysadiť.
Zvýšeniekrvnéhotlaku
Na začiatku klinických skúšaní 3. fázy s naltrexónom / bupropiónom sa pozorovalo prechodné priemerné zvýšenie systolického a diastolického krvného tlaku až o 1 mmHg v porovnaní s hodnotou pri vstupe. V klinickom skúšaní s kardiovaskulárnymi výsledkami (CVOT) s pacientmi so zvýšeným rizikom kardiovaskulárnej príhody sa pozorovalo aj priemerné zvýšenie systolického a diastolického krvného tlaku o približne 1 mmHg z hodnôt pri vstupe v porovnaní s placebom. V klinickej praxi však bola u pacientov užívajúcich iné lieky s bupropiónom hlásená hypertenzia, v niektorých prípadoch ťažká a vyžadujúca si akútnu liečbu.
Krvný tlak a pulz sa má zmerať pred začatím liečby naltrexónom / bupropiónom a má sa kontrolovať v pravidelných intervaloch, ktoré zodpovedajú zvyčajnej klinickej praxi. Ak sa u pacientov vyskytne klinicky relevantné a trvalé zvýšenie krvného tlaku alebo rýchlosti pulzu v dôsledku liečby naltrexónom / bupropiónom, liek sa má vysadiť.
Naltrexón / bupropión by sa mal dávať s opatrnosťou pacientom s kontrolovanou hypertenziou a nesmie sa dávať pacientom s nekontrolovanou hypertenziou (pozri časť 4.3).
KardiovaskulárneochorenieNie sú klinické skúsenosti stanovujúce bezpečnosť naltrexónu / bupropiónu u pacientov s nedávnym infarktom myokardu, nestabilným srdcovým ochorením alebo kongestívnym zlyhaním srdca triedy III alebo IV podľa NYHA. Naltrexón / bupropión sa majú používať s opatrnosťou u pacientov s aktívnym
ochorením koronárnych artérií (napr. prebiehajúca angina pectoris alebo infarkt myokardu v nedávnej minulosti) alebo anamnézou cerebrovaskulárneho ochorenia.
Hepatotoxicita
V dokončených klinických skúšaniach s naltrexónom / bupropiónom, v ktorých boli denné dávky naltrexóniumchloridu v rozpätí od 16 mg do 48 mg, bolo hlásené liekové poškodenie pečene (drug- induced liver injury, DILI). Na základe hlásení z obdobia po uvedení na trh sa taktiež vyskytli prípady zvýšenej hladiny pečeňových enzýmov. Pacienti s podozrením na DILI by mali prestať užívať naltrexón / bupropión.
Staršieosoby
Klinické štúdie s naltrexónom / bupropiónom nezahŕňali dostatočné množstvo subjektov vo veku 65 rokov a viac, aby bolo možné stanoviť, či ich odpoveď na liečbu je odlišná od mladších subjektov. Starší pacienti môžu byť citlivejší k nežiaducim reakciám centrálneho nervového systému na naltrexón
/ bupropión. Naltrexón a bupropión sa vo významnej miere vylučujú obličkami a riziko nežiaducich
reakcií na naltrexón / bupropión môže byť väčší u pacientov so zníženou renálnou funkciou, poruchou, ktorá je častejšia u starších osôb. Z týchto dôvodov by sa mal naltrexón / bupropión používať s opatrnosťou u pacientov starších ako 65 rokov a neodporúča sa ho používať u pacientov starších ako
75 rokov.
Poruchafunkcieobličiek
Naltrexón / bupropión neboli rozsiahlo hodnotené u pacientov s nedostatočnosťou obličiek. Naltrexón
/ bupropión je kontraindikovaný u pacientov s koncovým štádiom zlyhania obličiek alebo s ťažkou poruchou obličiek a neodporúča sa u pacientov s miernou až stredne ťažkou poruchou funkcie obličiek z dôvodu vyššej koncentrácie lieku a častejšiemu výskytu nežiaducich reakcií na liek u osôb s poruchou funkcie obličiek (pozri časti 4.2, 4.8 a 5.2). U osôb so zvýšeným rizikom poruchy funkcie obličiek, najmä u osôb s diabetom alebo u starších osôb, by sa pred začatím liečby naltrexónom / bupropiónom mal vykonať odhad rýchlosti glomerulárnej filtrácie (eGFR).
Poruchafunkciepečene
Naltrexón / bupropión nebol hodnotený u subjektov s poruchou funkcie pečene. Naltrexón / bupropión je kontraindikovaný u pacientov s ťažkou poruchou funkcie pečene a neodporúča sa u pacientov s miernou alebo stredne závažnou poruchou funkcie pečene (pozri časti 4.2, 4.8 a 5.2).
Neuropsychiatrické symptómyaaktiváciamánie
Aktivácia mánie a hypománie bola hlásená u pacientov s poruchami nálady, ktorí boli liečení inými podobnými liekmi na depresiu. V klinických skúšaniach hodnotiacich účinok naltrexónu / bupropiónu
u obéznych jedincov, s vylúčením subjektov užívajúcich antidepresíva, nebola hlásená aktivácia mánie alebo hypománie. Naltrexón / bupropión sa má používať s opatrnosťou u pacientov s mániou v anamnéze.
Údaje u zvierat poukazujú na možnosť abúzu bupropiónu. Skúšania zamerané na náchylnosť k abúzu u ľudí a rozsiahle klinické skúsenosti však ukazujú, že bupropión má nízky potenciál pre vyvolanie abúzu.
Laktóza
Tento liek obsahuje laktózu (monohydrát laktózy). Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Inhibítorymonoaminooxidázy(IMAO)
Vzhľadom na to, že inhibítory monoaminooxidázy A a B taktiež zvyšujú aktivitu katecholaminergných dráh, mechanizmom odlišným od bupropiónu, naltrexón / bupropión sa nesmie užívať spolu s IMAO (pozri časť 4.3).
O
pioidové
analgetiká
Naltrexón / bupropión je kontraindikovaný u pacientov aktuálne závislých na dlhodobej opioidovej liečbe alebo liečbe opioidovým agonistom (napr. metadónom), alebo u pacientov pri akútnom vysadení opiátov (pozri časť 4.3). Z dôvodu antagonistického účinku naltrexónu na opioidných receptoroch nemôže pacient užívajúci naltrexón / bupropión úplne profitovať z liečby liekom
obsahujúcim opioid, ako sú lieky na kašeľ a prechladnutie, lieky proti hnačke a opioidné analgetiká. U pacientov, ktorých stav si vyžaduje intermitentnú liečbu opiátmi sa má liečba naltrexónom / bupropiónom dočasne prerušiť a dávka opiátu sa nemá zvyšovať nad štandardnú dávku (pozri časť
4.4). Ak je nutná liečba opiátmi, liečba naltrexónom / bupropiónom sa musí prerušiť. Naltrexón / bupropión sa môže užívať s opatrnosťou v prípade, že sa dlhodobá liečby opioidmi vysadila na 7 až 10 dní, aby sa predišlo vzniku abstinenčných príznakov.
LiečivámetabolizovanéenzýmamicytochrómuP450(CYP)
Bupropión je na svoj hlavný aktívny metabolit hydroxybupropión metabolizovaný primárne cytochrómom P450 CYP2B6; preto existuje možnosť interakcie, ak sa podá s liekom, ktorý indukuje alebo inhibuje CYP2B6. Aj keď bupropión nie je metabolizovaný izoenzýmom CYP2D6, bupropión
a jeho hlavný metabolit, hydroxybupropión, inhibujú metabolickú dráhu CYP2D6 a je možné, že
ovplyvňujú lieky metabolizované CYP2D6.
Substráty CYP2D6
V klinických skúšaniach bol naltrexón / bupropión (32 mg naltrexóniumchloridu /360 mg
bupropiónchloridu denne) podávaný spolu s 50mg dávkou metoprololu (substrát CYP2D6). Naltrexón
/ bupropión zvýšili AUC metoprololu približne 4-krát a Cmax metoprololu približne 2-krát, v porovnaní so samotným metoprololom. Podobné klinické interakcie liečiv, ktorých dôsledkom bolo zvýšenie farmakokinetickej expozície substrátu CYP2D6, boli pozorované aj pri bupropióne ako samotnom lieku s dezipramínom a venlafaxínom.
Má sa pristupovať s opatrnosťou k súbežnému podávaniu bupropiónu s liečivami, ktoré sú metabolizované izoenzýmom CYP2D6, kam patria aj určité antidepresíva (SSRI a veľa tricyklických antidepresív, napr. dezipramén, imipramín, paroxetín), antipsychotiká (napr. haloperidol, risperidón a tioridazín), beta-blokátory (napr. metoprolol) a antiarytmiká typu 1C (napr. propafenón a flekainid), a má sa začať na dolnej hranici rozmedzia dávky súbežne podávaného lieku. Aj keď citalopram (SSRI) nie je primárne metabolizovaný prostredníctvom CYP2D6, v jednom skúšaní bupropión zvýšil Cmax citalopramu o 30 % a AUC citalopramu o 40 %. Lieky, ktoré vyžadujú metabolickú aktiváciu prostredníctvom CYP2D6 na to, aby boli účinné (napr. tamoxifén), môžu mať zníženú účinnosť, ak sa podávajú súčasne s inhibítormi CYP2D6, ako napr. bupropiónom. Ak sa naltrexón / bupropión pridáva do režimu liečby pacienta, ktorý už užíva liek metabolizovaný CYP2D6, má sa zvážiť potreba
zníženia dávky prvotne užívaného lieku, najmä u súbežne podávaných liekov s úzkym terapeutickým indexom. Ak je to vhodné, má sa u liekov s úzkym terapeutickým indexom, ako sú tricyklické antidepresíva zvážiť možnosť terapeutického monitorovania hladiny lieku.
Induktory, inhibítory a substráty CYP2B6
Bupropión sa metabolizuje na svoj hlavný aktívny metabolit, hydroxybupropión najmä prostredníctvom izoenzýmu CYP2B6. Existuje možnosť liekovej interakce medzi naltrexónom / bupropiónom a liekom, ktorý indukuje alebo je substrátom izoenzýmu CYP2B6.
Keďže sa bupropión v rozsiahlej miere metabolizuje, odporúča sa opatrnosť pri súbežnom podávaní naltrexónu / bupropiónu s liekmi, o ktorých je známe, že indukujú CYP2B6 (napr. karbamazepín, fenytoín, ritonavir, efavirenz), pretože tieto potom môžu ovplyvniť klinickú účinnosť naltrexónu / bupropiónu. V skupine skúšaní so zdravými dobrovoľníkmi sa preukázalo, že ritonavir (v dávke
100 mg dvakrát denne alebo 600 mg dvakrát denne) alebo ritonavir 100 mg plus 400 mg lopinaviru dvakrát denne znížili expozíciu bupropiónu a jeho hlavných metabolitov v závislosti na dávke o 20 % a 80 % v uvedenom poradí. Podobne, efavirenz v dávke 600 mg raz denne počas dvoch týždňov znížil expozíciu bupropiónu u zdravých dobrovoľníkov približne o 55 %.
Súbežné podávanie liekov, ktoré môžu ovplyvniť metabolizmus bupropiónu cez izoenzým CYP2B6 (napr. substráty pre CYP2B6: cyklofosfamid, ifosfamid a inhibítory CYP2B6: orfenadrín, tiklopidín,
klopidogrel), môže viesť k zvýšeným plazmatickým hladinám bupropiónu a nižším hladinám aktívneho metabolitu, hydroxybupropiónu. Klinické následky inhibície metabolizmu bupropiónu cez enzým CYP2B6 a následné zmeny v pomere medzi bupropiónom a hydroxybupropiónom v
súčasnosti nie sú známe, ale potenciálne by mohli viesť k zníženej účinnosti naltrexónu / bupropiónu.
SubstrátyOCT2
Bupropión a jeho metabolity kompetitívne inhibujú OCT2 v bazolaterálnej membráne renálnych tubulov, ktoré sú zodpovedné za sekréciu kreatinínu, spôsobom podobným ako substrát OCT2 cimetidín. Preto je mierne zvýšenie kreatinínu pozorované po dlhodobej liečbe naltrexónom / bupropiónom skôr spôsobené inhibíciou OCT2 a nie je prejavom zmien v klírense kreatinínu. Použitie naltrexónu / bupropiónu spolu s inými substrátmi OCT2 (napr. metformínom) v klinických skúšaniach neznamenalo potrebu úpravy dávky alebo iných opatrení.
Inéinterakcie
Aj keď klinické údaje neodhalili farmakokinetickú interakciu medzi bupropiónom a alkoholom,
u pacientov, ktorí počas liečby bupropiónom konzumovali alkohol, boli hlásené zriedkavé prípady neuropsychiatrických nežiaducich udalostí alebo zníženej tolerancie alkoholu. Nie sú známe žiadne farmakokinetické interakcie medzi naltrexónom a alkoholom. Konzumácia alkoholu počas liečby naltrexónom / bupropiónom sa má minimalizovať alebo sa jej treba vyhnúť.
Je potrebná opatrnosť pri predpisovaní naltrexónu / bupropiónu pacientom s predispozičnými faktormi, ktoré môžu zvýšiť riziko záchvatov a ktoré zahŕňajú:
• keďže liečba naltrexónom / bupropiónom môže viesť k nižším hladinám glukózy u pacientov s diabetom, dávka inzulínu a/alebo perorálnych antidiabetík sa má nastaviť tak, aby sa minimalizovalo riziko hypoglykémie, ktorá by mohla predisponovať pacienta k záchvatu
• súbežné podávanie iných liekov, ktoré môžu znižovať záchvatový prah, vrátane antipsychotík, antidepresív, antimalarík, tramadolu, teofylínu, systémových steroidov, chinolónov a sedatívnych antihistaminík
Naltrexón / bupropión je kontraindikovaný u pacientov dostávajúcich súbežnú liečbu inhibítormi monoaminooxidázy, bupropiónom alebo naltrexónom, pacienti podstupujúci akútne odvykanie od alkoholu alebo benzodiazepínov, pacienti v súčasnosti závislí na dlhodobej liečbe opiátmi alebo agonistami opiátov (pozri časť 4.3).
Opatrnosť je potrebná pri podávaní naltrexónu / bupropiónu pacientom, ktorí súbežne užívajú buď levodopu, alebo amantadín. Obmedzené klinické údaje poukazujú na vyšší výskyt nežiaducich účinkov (napr. nauzea, vracanie a neuropsychiatrické nežiaduce udalosti - pozri časť 4.8) u pacientov užívajúcich bupropión súbežne s levodopou alebo s amantadínom.
Podávanie naltrexónu / bupropiónu s inhibítormi alebo induktormi UGT 1A2 a 2B7 sa má s opatrnosťou, pretože tieto látky môžu meniť expozíciu naltrexónu.
Naltrexón / bupropión neboli skúmané spolu s alfa-blokátormi alebo klonidínom.
Keďže sa bupropión v rozsiahlej miere metabolizuje, odporúča sa opatrnosť pri súbežnom podávaní naltrexónu / bupropiónu s liekmi, o ktorých je známe, že inhibujú metabolizmus (napr. valproát), pretože môžu ovplyvniť klinickú účinnosť a bezpečnosť.
Naltrexón / bupropión sa má radšej užívať s jedlom, keďže je známe, že plazmatické koncentrácie naltrexónu aj bupropiónu sú vyššie pri jedle a údaje o bezpečnosti a účinnosti z klinických skúšaní sú založené na podávaní s jedlom.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú žiadne alebo len obmedzené klinické údaje o použití naltrexónu / bupropiónu u tehotných žien. Kombinácia nebola skúšaná v štúdiách reprodukčnej toxicity. Štúdie s naltrexónom preukázali
reprodukčnú toxicitu (pozri časť 5.3); štúdie s bupropiónom na zvieratách jednoznačne nepreukázali poškodenie reprodukcie. Potenciálne riziko pre človeka nie je známe.
Naltrexón / bupropión sa nesmú používať počas tehotenstva alebo u žien, ktoré sa v súčasnosti pokúšajú otehotnenieť.
DojčenieNaltrexón a bupropión a ich metabolity sa vylučujú do ľudského materského mlieka.
Keďže sú k dispozícii iba obmedzené údaje o systémovej expozícii naltrexónu a bupropiónu u dojčiat
/novorodencov, ktorí boli dojčení, nie je možné vylúčiť riziko pre novorodencov/dojčatá. Naltrexón / bupropión sa nesmie používať počas laktácie.
FertilitaNie sú k dispozícii údaje o fertilite pri použití kombinácie naltrexónu a bupropiónu. Štúdie reprodukčnej toxicity s bupropiónom neodhalili žiadny účinok na fertilitu. Naltrexón podávaný perorálne potkanom spôsobil signifikantný vzostup pseudogravidít a zníženie gravidít potkanov pri asi
30-násobku dávky naltrexónu v porovnaní s naltrexónom / bupropiónom. Význam týchto pozorovaní
pre ľudskú fertilitu nie je známy (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNaltrexón / bupropión má menší vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pri vedení vozidiel alebo obsluhovaní strojov sa má zohľadniť možnosť výskytu závratov počas liečby (pozri časť 4.8).
4.8 Nežiaduce účinkyZhrnutiebezpečnostnéhoprofiluBezpečnosť naltrexónu / bupropiónu sa hodnotila v piatich dvojito zaslepených placebom kontrolovaných klinických skúšaniach u 4 754 subjektov s nadváhou alebo obezitou (3 239 subjektov liečených naltrexónom / bupropiónom a 1 515 subjektov liečených placebom) s dĺžkou liečby maximálne 56 týždňov.
V klinických skúšaniach prerušilo liečbu z dôvodu nežiaducej udalosti 23,8 % subjektov užívajúcich naltrexón / bupropión a 11,9 % subjektov užívajúcich placebo. Hlavné nežiaduce reakcie na naltrexón
/ bupropión sú nauzea, zápcha, vracanie, závraty a sucho v ústach. Hlavné nežiaduce reakcie, ktoré
viedli k vysadeniu naltrexónu / bupropiónu boli nauzea, bolesť hlavy, závraty a vracanie.
ZhrnutienežiaducichreakciívtabuľkeNežiaduce reakcie hlásené pri kombinácii s fixnou dávkouBezpečnostný profil naltrexónu / bupropiónu (NB) predstavený nižšie vychádza z klinických skúšaní vykonaných s kombináciou s pevnou dávkou (výskyt nežiaducich reakcií minimálne 0,1 % a dvojnásobné v porovnaní s placebom). Zoznam nižšie poskytuje aj informácie o nežiaducich reakciách na jednotlivé zložky, naltrexón (N) a bupropión (B), ktoré sú uvedené v ich príslušných SPC.
Frekvencie nežiaducich reakcií sú zoradené nasledovne: Veľmi časté (≥1/10), Časté (≥1/100 až
<1/10), Menej časté (≥1/1 000 až <1/100); zriedkavé (>1/10 000 až <1/1 000); veľmi zriedkavé (<1/10
000); neznáme (z dostupných údajov).
Tabuľka 1.
Nežiaduce reakcie hlásené u subjektov, ktorí dostávali naltrexón/bupropión, naltrexón a bupropión
Trieda orgánových systémov Frekvencia Nežiaduce reakcie (liek*)Infekcie a nákazy Menej časté perorálny herpes simplex (N), tinea pedis (N) Poruchy krvi a lymfatického systému Časté zníženie počtu lymfocytov (NB)

Menej časté lymfadenopatia (N)
T
rieda orgánových systémov Frekvencia Nežiaduce reakcie (liek*)
Zriedkavé idiopatická trombocytopenická purpura (N) Poruchy imunitného systému ** Časté hypersenzitívne reakcie ako žihľavka (B)
Veľmi zriedkavé
viac hypersenzitívnych reakcií vrátane angioedému, dyspnoe/ bronchospazmu a anafylaktického šoku.
Artralgia, myalgia a horúčka boli tiež hlásené v súvislosti s vyrážkou a inými príznakmi naznačujúc oneskorenú precitlivenosť. Tieto príznaky môžu pripomínať sérovú chorobu. (B)
Poruchy metabolizmu a výživy Časté znížená chuť do jedla (N)
Menej časté dehydratácia (NB), anorexia (B) Zriedkavé zmeny v hladinách glukózy v krvi (B)
Psychické poruchy Veľmi časté úzkosť (N), insomnia (N,B)
Časté podráždenosť (N), afektívna porucha (N),
depresia (B), úzkosť (B)
Menej časté abnormálne sny (NB,N)a, nervozita (NB,N)a, disociácia (pocit bytia „mimo“) (NB), napätie (NB), agitácia (NB,N,B)a, rýchle zmeny nálady (NB), stavy zmätenosti (N), depresia (N), halucinácie (N), paranoja (N), dezorientácia (N), nočné mory (N), poruchy libida (N), zmätenosť (B)
Zriedkavé podráždenosť (B), samovražedné predstavy (N), samovražedné pokusy (N), nepriateľské správanie (B), halucinácie (B), depersonalizácia (B), abnormálne sny zahŕňajúce nočné mory (B)
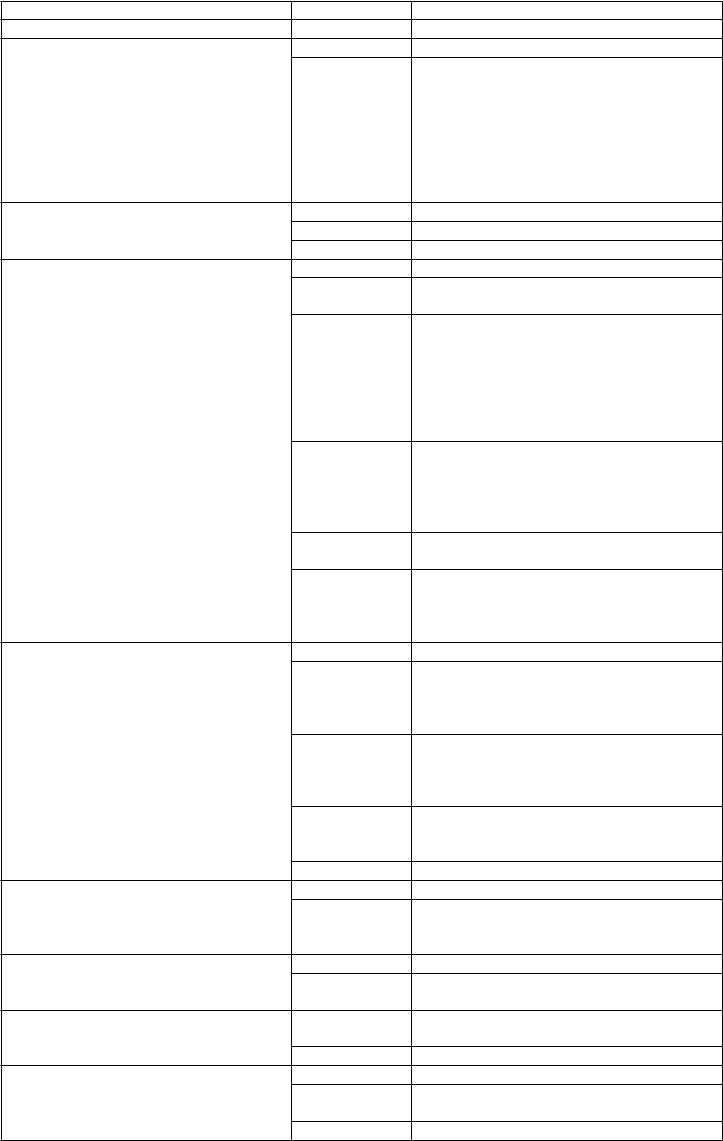
Veľmi zriedkavé
bludy (B), paranoidné predstavy (B), nepokoj
(B), agresivita (B)
Neznáme suicidálne myšlienky a suicidálne správanie (B)****, psychóza (B), úzkosť (NB), halucinácie (NB), nespavosť (NB), podráždenosť (NB)
Poruchy nervového systému Veľmi časté bolesť hlavy (N), nepokoj (N)
Časté závrat (NB,N,B)a, tremor (NB,N,B)a, dysgeúzia (NB), porucha pozornosti (NB), letargia (NB), poruchy sústredenia (B), bolesť hlavy (B), poruchy chuti (B)
Menej časté intenčný tremor (NB), porucha rovnováhy (NB), amnézia (NB), zhoršenie mentálnych funkcií (NB), presynkopa (NB), somnolencia (N)
Zriedkavé dystónia (B), ataxia (B), parkinsonizmus (B), poruchy koordinácie (B), zhoršenie pamäte (B), parestézia (B), synkopa (B), záchvaty (B)***
Neznáme bolesť hlavy (NB) Poruchy oka Časté zvýšená sekrécia sĺz (N)
Menej časté poruchy videnia (N), podráždenie oka (N), opuch oka (N), bolesť oka alebo astenopia (N), fotofóbia (N), poruchy videnia (B)
Poruchy ucha a labyrintu Časté tinnitus (NB,N,B)a, vertigo (NB,N)a
Menej časté nevoľnosť pri pohybe (NB), bolesť uší (N), diskomfort uší (N)
Poruchy srdca a srdcovej činnosti Časté palpitácie (NB,N,B)a, zmena elektrokardiogramu (N)
Menej časté tachykardia (NB,N,B)a
Poruchy ciev Časté návaly tepla (NB)
Menej časté zmeny krvného tlaku (N), zvýšenie krvného tlaku (niekedy závažné) (B), návaly (N,B)
Zriedkavé vazodilatácia (B), posturálna hypotenzia (B)
T
rieda orgánových systémov Frekvencia Nežiaduce reakcie (liek*)
Nezmáme hypertenzia (NB)
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté bolesti na hrudníku (N)
Menej časté opuch nosa (N), diskomfort nosa (N), výtok z nosa (N), kýchanie (N), orofaryngeálna bolesť (N), zvýšená tvorba hlienov (N), poruchy
dutín (N), dyspnoe (N), dysfónia (N), kašeľ
(N), zívanie (N)
Poruchy gastrointestinálneho traktu Veľmi časté bolesť brucha (N), nauzea (NB,N)a, zápcha
(NB,N,B)a, vracanie (NB,N)a
Časté suchosť v ústach (NB,N,B)a, bolesť zubov (NB)b, bolesť v hornej časti brucha (NB), hnačka (N), gastrointestinálne zmeny zahŕňajúce nauzeu a vracanie (B), bolesť brucha (B)
Menej časté bolesť v dolnej časti brucha (NB), eruktácia
(NB)
opuch pier (NB), zubné kazy (NB)b, hematochézia (NB),
hernia (NB), flatulencia (N), hemoroidy (N), vred (N)
Neznáme Brušný dyskomfort (NB), dyspepsia (NB) Poruchy pečene a žlčových ciest Menej časté cholecystitída (NB), poruchy pečene (N),
zvýšená hladina bilirubínu v krvi (N),
hepatitída (N), zvýšené hladiny pečeňových enzýmov (NB)
Zriedkavé žltačka (B), hepatitída (B)
Poruchy kože a podkožného tkaniva Časté hyperhidróza (NB), pruritus (NB,N,B)a, alopécia (NB,N)a, vyrážka (N,B), potenie (B)

Menej časté akné (N), seborea (N)
Zriedkavé multiformný erytém a Stevens
ov-Johnsonov syndróm (B).
exacerbácia psoriázy (B) Neznáme vyrážka (NB)
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Veľmi časté artralgia (N), myalgia (N)
Menej časté protrúzia medzistavcových platničiek (NB), bolesť čeľuste (NB), bolesť slabín (N)
Zriedkavé zášklby (B)
Veľmi zriedkavé
rabdomyolýza (N)
Poruchy obličiek a močových ciest Menej časté časté nutkanie na močenie (NB), polakizúria
(N), dyzúria (N)
Zriedkavé Časté močenie a/alebo retencia moču (B)
Poruchy reprodukčného systému a prsníkov
Celkové poruchy a reakcie v mieste podania
Časté oneskorená ejakulácia (N)
Menej časté nepravidelná menštruácia (NB), vaginálne krvácanie (NB), erektilná dysfunkcia (NB,N)a, vulvovaginálna suchosť (NB)
Časté pocit paniky (NB), zvýšená energia (N), zimnica (N), horúčka (B), hyperhidróza (N)
Menej časté pocit nenormálnosti (NB), asténia (NB,N,B)a, smäd (NB,N)a, pocit horúčavy (NB,N)a, zvýšená chuť do jedla (N), zvyšovanie
telesnej hmotnosti (N), pyrexia (N), chlad na periférii (N), bolesť (N), bolesť v hrudníku (B)
Neznáme únava (NB)
Laboratórne a funkčné vyšetrenia Menej časté zvýšená hladina kreatinínu v krvi (NB), znížený hematokrit (NB)
 T
rieda orgánových systémov Frekvencia Nežiaduce reakcie (liek*)
T
rieda orgánových systémov Frekvencia Nežiaduce reakcie (liek*)
* N = naltrexón; B = bupropión; NB = naltrexón / bupropión
** Precitlivenosť sa môže prejaviť ako kožné reakcie. Pozri „Poruchy imunitného systému“ a „Poruchy kože a podkožného tkaniva“.
*** Incidencia záchvatov je približne 0,1 % (1/1 000). Najčastejším typom záchvatov sú generalizované tonicko-klonické záchvaty -- typ záchvatu, ktorý v niektorých prípadoch môže spôsobiť post-iktálnu zmätenosť alebo poruchy pamäti (pozri časť 4.4).
**** Prípady suicidálnych myšlienok a suicidálneho správania boli hlásené počas liečby bupropiónom (pozri časť 4.4).
a Nežiaduce reakcie boli uvedené v skupine s danou frekvenciou pre NB, ak boli pozorované u NB a u
jednej či oboch samostatných zložkách.
b Bolesť zubov a zubné kazy pri splnení kritérií pre zaradenie do tejto tabuľky, sú zaradené do skupiny s pacientmi so suchými ústami, v ktorej sa pozorovala vyššia incidencia bolesti zubov a zubných kazov u subjektov liečených NB v porovnaní s placebom.
Opis vybraných nežiaducich reakciíZáchvaty: Incidencia záchvatov pri naltrexóne / bupropióne počas klinického programu bola 0,06 % (2/3239 subjektov). Oba prípady záchvatov v skupine subjektov liečených naltrexónom / bupropiónom sa považovali za závažné a viedli k prerušeniu liečby (pozri časť 4.4). V skupine s placebom neboli žiadne prípady záchvatov.
Gastrointestinálne nežiaduce účinky: Veľká väčšina subjektov liečených naltrexónom / bupropiónom, u ktorých sa vyskytla nauzea, hlásila tento účinok počas 4 týždňov po začatí liečby. Všeobecne tieto udalosti odznejú samé; väčšina udalostí sa vyrieši do 4 týždňov a v 24. týždeň boli vyriešené takmer všetky udalosti. Podobne aj väčšina udalostí zápchy u subjektov liečených naltrexónom / bupropiónom bola hlásená počas fázy zvyšovania dávky. Doba do vyriešenia zápchy bola podobná u pacientov liečených naltrexónom / bupropiónom a subjektmi liečenými placebom. Približne polovica subjektov liečených naltrexónom / bupropiónom, u ktorých sa vyskytlo vracanie, nahlásila túto udalosť v priebehu fázy zvyšovania dávky. Doba do vyriešenia vracania bola zvyčajne krátka (do jedného
týždňa) a takmer všetky udalosti sa vyriešili najneskôr do 4 týždňov. Výskyt týchto častých
nežiaducich gastrointestinálnych reakcií pri naltrexóne / bupropióne v porovnaní s placebom bol
nasledujúci: nauzea (31,8 % verzus 6,7 %), zápcha (18,1 % verzus 7,2 %) a vracanie (9,9 % verzus 2,9
%). Incidencia ťažkej nauzey, ťažkej zápchy a ťažkého vracania bola nízka, ale bola vyššia u
subjektov liečených naltrexónom / bupropiónom v porovnaní so subjektmi liečenými placebom (ťažká nauzea: naltrexón / bupropión 1,9 %, placebo <0,1 %; ťažká zápcha: naltrexón / bupropión 0,6 %, placebo 0,1 %; ťažké vracanie: naltrexón / bupropión 0,7 %, placebo 0,3 %). Žiadne udalosti nauzey, zápchy alebo vracania neboli považované za závažné.
Iné časté nežiaduce reakcie: Väčšina subjektov liečených naltrexónom / bupropiónom, ktorí hlásili závraty, bolesť hlavy, nespavosť alebo suchosť v ústach, hlásila tieto účinky vo fáze zvyšovania dávky. Suchosť v ústach môže byť spojená s bolesťou zubov a zubnými kazmi; v podskupine pacientov so suchosťou v ústach bola pozorovaná vyššia incidencia bolesti zubov a zubných kazov u subjektov liečených naltrexónom / bupropiónom v porovnaní so subjektmi liečenými placebom. Výskyt ťažkej bolesti hlavy, ťažkých závratov a ťažkej nespavosti bol nízky, ale vyšší u subjektov liečených naltrexónom / bupropiónom v porovnaní so subjektmi liečenými placebom (ťažká bolesť
hlavy: naltrexón/bupropión 1,1 %, placebo 0,3 %; ťažké závraty: naltrexón / bupropión 0,6 %, placebo
0,2 %; ťažká nespavosť: naltrexón / bupropión 0,4 %, placebo <0,1 %). Žiadne udalosti závratov, suchosti úst, bolesti hlavy alebo insomnie neboli u subjektov liečených naltrexónom / bupropiónom považované za závažné.
Starší pacientiStarší pacienti môžu byť citlivejší na niektoré nežiaduce reakcie naltrexónu / bupropiónu týkajúce sa centrálneho nervového systému (najmä závrat a tremor). V kategóriách s vyšším vekom je vyššia incidencia gastrointestinálnych porúch. Častými udalosťami vedúcimi k vysadeniu u starších osôb sú nauzea, vracanie, závraty, zápcha.
D
i
abetes 2. typu
U pacientov s diabetom 2. typu liečených naltrexónom / bupropiónom sa vyskytovala vyššia incidencia gastrointestinálnych nežiaducich udalostí, najmä nauzey, vracania a hnačky, než u
subjektov bez diabetu. Pacienti s diabetom 2. typu sú náchylnejší na tieto udalosti z dôvodu súbežného používania liekov (napr. metformínu) alebo je u nich pravdepodobnejší výskyt základnej gastrointestinálnej poruchy (napr. gastroparézy), ktorá ich predisponuje k gastrointestinálnym príznakom.
Porucha funkcie obličiek
Pacienti so stredne závažnou poruchou funkcie obličiek majú vyššiu incidenciu nežiaducich účinkov spojených s gastrointestinálnym traktom a centrálnym nervovým systémom, a preto majú títo pacienti všeobecne nižšiu znášanlivosť naltrexónu / bupropiónu. Typy udalostí týkajúcich sa znášanlivosti boli podobné udalostiam pozorovaným u pacientov s normálnou funkciou obličiek (pozri časti 4.2, 4.4 a
5.2).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 Predávkovanie
Skúsenostispredávkovanímučloveka
Nie sú klinické skúsenosti s predávkovaním pri užívaní kombinácie bupropión a naltrexón. Maximálna denná dávka pri užívaní kombinácie bupropión a naltrexón podávaná v klinických skúšaniach obsahovala 50 mg naltrexóniumchloridu a 400 mg bupropiónchloridu. Najzávažnejšie klinické komplikácie užitia nadmernej dávky kombinácie bupropiónu a naltrexónu súvisia skôr s bupropiónom.
Bupropión
Bolo hlásené akútne požitie dávok bupropiónu prevyšujúcich desaťnásobok maximálnej terapeutickej dávky (ekvivalent približne 8-násobného prekročenia odporúčanej dennej dávky
naltrexónu / bupropiónu). V približne tretine týchto prípadov predávkovania boli hlásené záchvaty.
Ďalšie závažné reakcie hlásené pri predávkovaní bupropiónom samotným zahŕňali halucinácie, stratu vedomia, sínusovú tachykardiu a zmeny EKG ako poruchy vedenia vzruchu (vrátane predĺženia QRS) alebo arytmie. Horúčka, svalová rigidita, rabdomyolýza, hypotenzia, stupor, kóma a respiračné zlyhanie boli hlásené najmä vtedy, keď bol bupropión súčasťou predávkovania viacerými liekmi.
Hoci väčšina pacientov sa zotavila bez následkov, u pacientov, ktorí požili príliš veľké dávky liečiva, boli hlásené úmrtia spojené s bupropiónom.
Naltrexón
Skúsenosti s predávkovaním naltrexónom v monoterapii u ľudí sú obmedzené. V jednom skúšaní sa u dobrovoľníkov užívajúcich 800 mg naltrexóniumchloridu denne (ekvivalent 25-násobku odporúčanej dennej dávky naltrexónu / bupropiónu) počas jedného týždňa nevyskytli žiadne prejavy toxicity.
Manažmentpredávkovania
Zabezpečte voľné dýchacie cesty, oxygenáciu a ventiláciu. Má sa monitorovať srdcový rytmus a vitálne funkcie. EEG monitorovanie sa odporúča aj prvých 48 hodín po požití. Odporúčajú sa aj všeobecné podporné a symptomatické opatrenia. Neodporúča sa vyvolávať vracanie.
Má sa použiť živočíšne uhlie. Pri užívaní kombinácie bupropiónu a naltrexónu nie sú skúsenosti s použitím nútenej diurézy, dialýzy, hemoperfúzie alebo výmennej transfúzie na manažovanie predávkovania. Nie je známe žiadne špecifické antidotum na kombináciu bupropiónu a naltrexónu.
Z dôvodu rizika súvisiaceho s dávkou pri bupropióne sa pri podozrení na predávkovanie naltrexónom / bupropiónom má zvážiť hospitalizácia. Na základe štúdií na zvieratách sa odporúča, aby sa záchvaty liečili intravenóznym podávaním benzodiazepínov a prípadne inými podpornými opatreniami.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: liečivá proti obezite s výnimkou dietetík, centrálne pôsobiace liečivá na obezitu.
ATC kód: A08AA62 bupropión a naltrexón.
Mechanizmuspôsobeniaafarmakodynamické účinky
Nie je úplne známy presný neurochemický účinok naltrexónu / bupropiónu na potlačenie chuti do jedla. Liek má dve zložky: naltrexón, μ-opioidový antagonista, a bupropión,
a slabý inhibítor spätného vychytávania dopamínu a noradrenalínu v neurónoch. Tieto zložky ovplyvňujú dve hlavné oblasti v mozgu, najmä oblúkovité jadro hypotalamu a mezolimbický dopaminergný systém odmeny.
V oblúkovitom jadre hypotalamu bupropión stimuluje pro-opiomelanokortínové (POMC) neuróny, ktoré uvoľňujú α-melanocyty stimulujúci hormón (α-MSH), ktorý sa potom viaže na receptory pre melanokortín 4 (MC4-R) a stimuluje ich. Keď sa uvoľní α-MSH, POMC neuróny simultánne uvoľnia endogénneho agonistu μ-opioidových receptorov β-endorfín. Väzba β-endorfínu na μ-opioidové receptory POMC neurónov sprostredkuje negatívnu spätnú väzbu na POMC neurónoch, čo vedie k zníženiu uvoľňovania α-MSH. Blokádou tejto inhibičnej spätnej väzby naltrexónom sa plánuje uľahčiť silnejšiu a dlhšie trvajúcu aktiváciu POMC neurónov, a tým zosilniť účinok bupropiónu na
energetickú rovnováhu. Predklinické údaje naznačujú, že ak sa podajú spoločne, môžu mať naltrexón a bupropión v tejto oblasti väčší ako len aditívny účinok na zníženie príjmu potravy.
KlinickáúčinnosťabezpečnosťÚčinky naltrexónu / bupropiónu na chudnutie, udržanie hmotnosti, obvod pása, zloženie tela,
s obezitou súvisiace markery kardiovaskulárnych a metabolických parametrov a hodnotenia hlásené pacientmi sa skúmali v dvojito zaslepených, placebom kontrolovaných klinických skúšaniach fázy II a III, ktoré sa týkali obezity (BMI v rozsahu 27-45 kg/m2), s trvaním skúšania od 16 do 56 týždňov a randomizáciou na užívanie naltrexóniumchloridu (16 až 50 mg/deň) a/alebo bupropiónchloridu (300
až 400 mg/deň) alebo placeba.
Účinok na chudnutie a udržanie hmotnostiVykonali sa štyri multicentrické dvojito zaslepené placebom kontrolované klinické skúšania fázy III týkajúce sa obezity (NB-301, NB-302, NB-303 a NB-304) u 4 536 subjektov randomizovaných na užívanie naltrexónu / bupropiónu alebo placeba, aby sa zhodnotil účinok naltrexónu / bupropiónu v spojení s úpravou životného štýlu. Liečba sa začala obdobím postupného zvyšovania dávky. V troch z týchto skúšaní (NB-301, NB-302 a NB-304) bol primárny koncový bod naplánovaný na 56. týždeň a v jednom skúšaní (NB-303) bol primárny koncový bod naplánovaný na 28. týždeň, ale skúšanie pokračovalo až do 56. týždňa. Skúšania NB-301, NB-303 a NB-304 zahŕňali pravidelné pokyny zo skúšajúceho pracoviska, aby sa redukoval príjem kalórií a zvýšila fyzická aktivita, zatiaľ čo NB-302 zahŕňala intenzívny program na úpravu správania, ktorý tvorilo 28 stretnutí poradných skupín počas
56 týždňov, ako aj predpísanie prísnej diéty a cvičebného plánu. NB-304 hodnotila subjekty s
diabetom 2. typu , ktorí nedosahujú glykemický cieľ HbA1c <7 % (53 mmol/mol) iba samotným užívaním perorálnych antidiabetík alebo diétou a cvičením. Súčasťou NB-303 bola re-randomizácia zaslepeným spôsobom a pridanie vyššej dávky naltrexónu (naltrexóniumchlorid
48 mg/bupropiónchlorid 360 mg) 28. týždeň polovici kohorty so subjektmi s aktívnou liečbou, ktorí
nereagovali dostatočne na liečbu, a z toho dôvodu sa primárny koncový bod porovnávajúci zmenu hmotnosti s 32 mg naltrexónchloridu /360 mg bupropiónchloridu verzus placebo vyhodnocoval v 28. týždni.
Z celkovej populácie 4 536 subjektov v skúšaniach fáze III s naltrexónom / bupropiónom, malo pri vstupe (baseline) 25 % hypertenziu, 33 % hladinu glukózy na lačno ≥100 mg/dl (5,6 mmol/l), 54 % malo pri vstupe dyslipidémiu a 11 % malo diabetes mellitus 2. typu.
V kombinovaných skúšaniach fázy III bol priemerný vek 46 rokov, 83 % bolo žien a 77 % boli belosi,
18 % boli černosi a 5 % boli iné rasy. Východisková stredná hodnota BMI bola 36 kg/m2 a stredná hodnota obvodu pása bola 110 cm. Dva primárne koncové body boli percentuálna zmena východiskovej hodnoty telesnej hmotnosti a proporcie subjektov, ktorí dosiahli ≥5 % celkového zníženia telesnej hmotnosti. Zhrnutie dát týkajúcich sa strednej zmeny telesnej hmotnosti reflektuje populáciu so zámerom liečiť (ITT), definovanú ako subjekty, ktoré boli randomizované, mali zmeranú východiskovú telesnú hmotnosť a vykonalo sa u nich aspoň jedno meranie telesnej hmotnosti po východiskovom stave v priebehu definovanej fázy liečby, s použitím analýzy posledného preneseného pozorovania (LOCF), ako aj analýzu subjektov, ktorí liečbu dokončili. Pri zhrnutí percentuálneho pomeru subjektov, ktorí dosiahli ≥5% alebo ≥10% redukciu telesnej hmotnosti bola použitá analýza vstupného preneseného pozorovania (BOCF-baseline observation carried forward) všetkých randomizovaných subjektov. Celková adherencia bola podobná medzi skúšaniami aj medzi liečebnými skupinami. Miera adherencie k liečbe bola v integrovaných skúšaniach fázy III: 67 % NB verzus 74 % placebo v 16. týždni, 63 % NB verzus 65 % placebo v 26. týždni, 55 % NB verzus 55 % placebo v 52. týždni.
Ako vidno v tabuľke 2, v NB-301 mali subjekty v skúšaní stredný percentuálny úbytok telesnej hmotnosti -5,4 % pri užívaní naltrexónu / bupropiónu v porovnaní s -1,3 % u subjektov liečených placebom. Úbytok hmotnosti o aspoň 5 % v porovnaní s východiskovou telesnou hmotnosťou sa pozoroval častejšie u subjektov liečených naltrexónom / bupropiónom (31 %) v porovnaní s placebom (12 %) (Tabuľka 3). Výraznejší úbytok hmotnosti sa pozoroval v kohorte subjektov, ktorí dokončili 56 týždňov liečby naltrexónom / bupropiónom (-8,1 %) v porovnaní s placebom (-1,8 %). Porovnateľné výsledky boli pozorované v skúšaní NB-303, ktoré malo podobný dizajn, a kde sa pozoroval signifikantný úbytok hmotnosti u subjektov liečených naltrexónom / bupropiónom v porovnaní s placebom v primárnom koncovom ukazovateli meranom v 28. týždni a podávanom až do 56. týždňa
od začiatku liečby (Tabuľka 3).
Naltrexón / bupropión sa hodnotili aj v kombinácii s intenzívnym poradenstvom na zmenu správania v skúšaní NB-302. S poradenstvom korešpondoval väčší úbytok telesnej hmotnosti v porovnaní so vstupnou hodnotou pri liečbe naltrexónom / bupropiónom (-8,1 %) v porovnaní so skúšaním NB-301
(-5,4 %) v 56. týždni a pri podávaní placeba (-4,9 %) v porovnaní so skúšaním NB-301 (-1,3 %).
Účinky liečby pozorované u subjektov s diabetes mellitus 2. typu (Skúšanie NB-304), obéznych alebo s nadváhou, boli o niečo menej výrazné ako účinky pozorované v iných skúšaniach fázy III. Naltrexón
/ bupropión (-3,7 %) boli u tejto populácie signifikantne (p<0,001) viac účinné ako podávanie placeba
(-1,7 %).
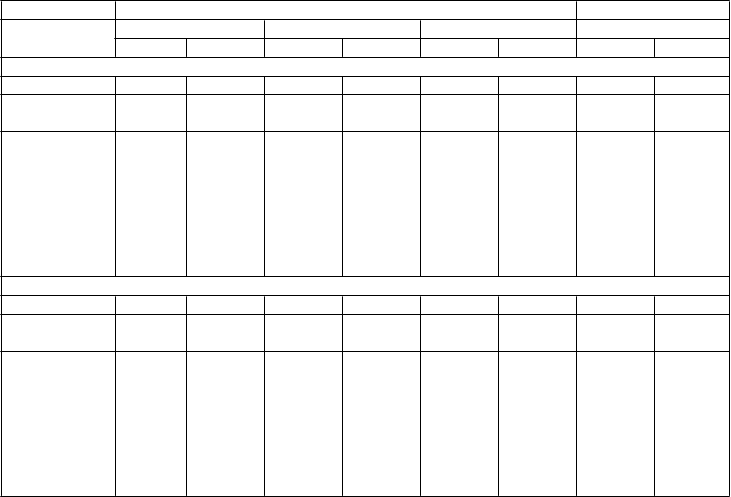
Priemerný úbytok hmotnosti (% zmena) z východiskovej hodnoty do 56. týždňa u naltrexónu / bupropiónu (NB) v skúšaniach fázy III NB-301, NB-302 a NB-304 a z východiskovej hodnoty do 28. týždňa v skúšaní fázy III NB-303
Údaje z 56. Týždňa Údaje z 28. týždňaNB-301 NB-302 NB-304 NB-303NB PBO NB PBO NB PBO NB PBOPopulácia so zámerom liečiť
n 538 536 565 196 321 166 943 474
Východisková
hodnota (kg) 99,8 99,5 100,3 101,8 104,2 105,3 100,4 99,4
Priemerné (95% IS) % zmeny od
východiskovej hodnoty (metódou najmenších štvorcov)
-5,4*
(-6,0, -
4,8)
-1,3
(-1,9, -0,7)
-8,1*
(-8,8, -7,4)
-4,9
(-6,1, -3,7)
-3,7*
(-4,3, -3,1)
-1,7
(-2,5, -0,9)
-5,7*
(-6,1, -5,3)
-1,9
(-2,4, -1,4)
T
í, čo dokončili sériu analýz ++
n 296 290 301 106 175 100 619 319
Vychodisková
hodnota (kg) 99,8 99,2 101,2 100,4 107,0 105,1 101,2 99,0
Priemerné
(95% IS) %
zmeny od
východiskovej hodnoty (metódou najmenších štvorcov)
-8,1
(-9,0, -
7,2)
-1,8
(-2,7, -0,9)
-11,5
(-12,6, -'
10,4)
-7,3
(-9,0, -5,6)
-5,9
(-6,8, -5,0)
-2,2
(-3,4, -1,0)
-7,8
(-8,3, -7,3)
-2,4
(-3,0, -1,8)
IS, interval spoľahlivosti; LS, najmenšie štvorce.
95% interval spoľahlivosti vypočítaný ako ± 1,96 × štandardná chyba.
+ Subjekty, ktoré boli randomizované, mali zmeranú východiskovú telesnú hmotnosť a vykonalo sa u nich aspoň jedno meranie telesnej hmotnosti po východiskovom stave v priebehu definovanej fázy liečby. Výsledky sú založené na poslednom prenesenom pozorovaní (LOCF).
++ Subjekty, ktorí mali meranie východiskovej hodnoty telesnej hmotnosti a nasledujúce merania telesnej hmotnosti a dokončili 56 týždňov (skúšania NB-301, NB-302 a NB-304) alebo 28 týždňov (NB-303) liečby.
* Rozdiel oproti placebu, p<0,001
Skúšania NB-301, NB-302 a NB-303 boli vykonané u subjektov obéznych alebo s nadváhou alebo subjektov s komorbiditami. Skúšanie NB-302 malo intenzívnejší program zmeny správania, zatiaľ čo primárny koncový ukazovateľ skúšania NB-303 bol hodnotený v 28. týždni, aby bola možná opätovná randomizácia na odlišné dávky v neskoršej časti skúšania. Skúšanie NB-304 bolo vykonané u subjektov obéznych alebo s nadváhou a mali diabetes mellitus 2. typu.
Percentuálny podiel subjektov s úbytkom telesnej hmotnosti ≥5 % alebo ≥10 % v porovnaní s
východiskovou hodnotou bol väčší pri naltrexóne / bupropióne v porovnaní s placebom vo všetkých štyroch skúšaniach fázy III týkajúcich sa obezity (Tabuľka 3).
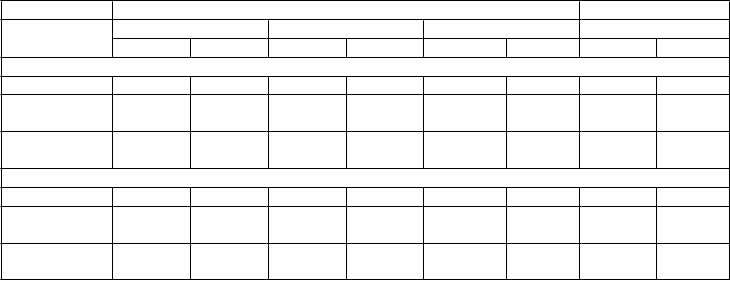
Percentuálny podiel (%) subjektov s úbytkom ≥5 % a ≥10 % telesnej hmotnosti od východiskovej hodnoty do 56. týždňa v skúšaniach fázy III NB 301, NB 302 a NB-304 a od východiskovej hodnoty do 28. týždňa v skúšaní fázy III NB 303
Dáta z 56. týždňa Dáta z 28. týždňaNB-301 NB-302 NB-304 NB-303NB PBO NB PBO NB PBO NB PBO Randomizovaná populácia +
n 583 581 591 202 335 170 1001 495
≥5 % Úbytok
hmotnosti 31* 12 46** 34 28* 14 42* 14
≥10 % Úbytok
hmotnosti 17* 5 30* 17 13** 5 22* 6
Tí, čo dokončili liečbu++
n 296 290 301 106 175 100 619 319
≥5 % Úbytok
hmotnosti 62 23 80 60 53 24 69 22
≥10 % Úbytok
hmotnosti 34 11 55 30 26 8 36 9
+ S metódou vstupného preneseného pozorovania (BOCF-baseline observation carried forward)
++ Subjekty, ktorí mali meranie východiskovej hodnoty telesnej hmotnosti a nasledujúce merania telesnej hmotnosti a dokončili 56 týždňov (skúšania NB-301, NB-302 a NB-304) alebo 28 týždňov (NB-303) liečby.
* Rozdiel oproti placebu, p<0,001
** Rozdiel oproti placebu, p<0,01
Skúšania NB-301, NB-302 a NB-303 boli vykonané u subjektov obéznych alebo s nadváhou alebo subjektov
s komorbiditami. Skúšanie NB-302 malo intenzívnejší program zmeny správania, zatiaľ čo primárny koncový ukazovateľ skúšania NB-303 bol hodnotený v 28. týždni, aby bola možná opätovná randomizácia na odlišné dávky v neskoršej časti skúšania. Skúšanie NB-304 bolo vykonané u subjektov obéznych alebo s nadváhou
a mali diabetes mellitus 2. typu
Zo subjektov, u ktorých sa sledovali údaje v 16. týždni v štyroch skúšaniach fázy III, malo 50,8 %
subjektov randomizovaných na užívanie naltrexónu / bupropiónu úbytok ≥5 % ich východiskovej telesnej hmotnosti, v porovnaní s 19,3 % subjektov liečených placebom (respondéri v 16. týždni). V jednom roku bol priemerný úbytok telesnej hmotnosti (s použitím LOCF metodológie) medzi
týmito respondérmi v 16. týždni, ktorí dostávali naltrexón / bupropión, 11,3 %, s 55% úbytkom ≥10 % telesnej hmotnosti. Respondéri v 16. týždni, ktorí dostávali naltrexón / bupropión, mali navyše vysokú mieru zotrvania 87 % z nich dokončilo 1 rok liečby. Hranica ≥5 % úbytku hmotnosti v 16. týždni
mala 86,4% pozitívnu prediktívnu hodnotu a 84,8% negatívnu prediktívnu hodnotu pri stanovení, či
subjekt liečený naltrexónom / bupropiónom dosiahne aspoň 5%-ný úbytok hmotnosti v 56. týždni. U pacientov, ktorí nesplnili kritérium skorej odpovede, nebola zistená vyššia znášanlivosť alebo problémy s bezpečnosťou v porovnaní s pacientmi, ktorí mali výhodnú skorú odpoveď.
Účinok na kardiovaskulárne a metabolické parametreVo všetkých skúšaniach fázy III bolo u subjektov liečených naltrexónom / bupropiónom verzus placebom zlepšenie v obvode pása (vrátane subjektov s diabetes mellitus 2. typu), triglyceridov,
HDL-C a pomeru LDL-C/HDL-C (Tabuľka 4). U subjektov liečených naltrexónom / bupropiónom, u
ktorých bola zistená vychodisková dyslipidémia bez ohľadu na liečbu dyslipidémie, boli pozorované zlepšenia v triglyceridoch, HDL-C a pomere LDL-C/HDL-C. Zmeny strednej hodnoty krvného tlaku sú opísané v časti 4.4. Navyše u subjektov, ktorí nemali diabetes mellitus 2. typu, sa zistilo zníženie v hodnote inzulínu nalačno a HOMA-IR, meradlo inzulínovej rezistencie, u subjektov liečených naltrexónom / bupropiónom.
Účinky na kontrolu glykémie u obéznych subjektov s diabetom 2. typuPo 56 týždňoch liečby u subjektov s diabetom 2. typu (NB-304), naltrexón / bupropión v porovnaní s placebom vykazoval zlepšenie parametrov kontroly glykémie (Tabuľka 4). Väčšie zlepšenie HbA1c v porovnaní s placebom bolo pozorované pri prvom meraní nasledujúcom po východiskovom meraní (16. týždeň, p<0,001). Stredná zmena HbA1c od východiskovej hodnoty v 56. týždni bola -0,63 % u subjektov liečených naltrexónom / bupropiónom v porovnaní so subjektmi užívajúcimi placebo -
0,14 % (p<0,001). U subjektov s východiskovou hodnotou HbA1c >8 % (64 mmol/mol), boli zmeny
HbA1c v koncových bodoch -1,1 % a -0,5 % pre naltrexón / bupropión v porovnaní s placebom, v uvedenom poradí. Zlepšenie bolo pozorované u subjektov liečených naltrexónom / bupropiónom verzus placebom v parametroch glukózy nalačno, inzulínu nalačno, HOMA-IR a percentuálneho podielu subjektov, ktorí vyžadovali záchranný diabetický liek.
Tabuľka 4.
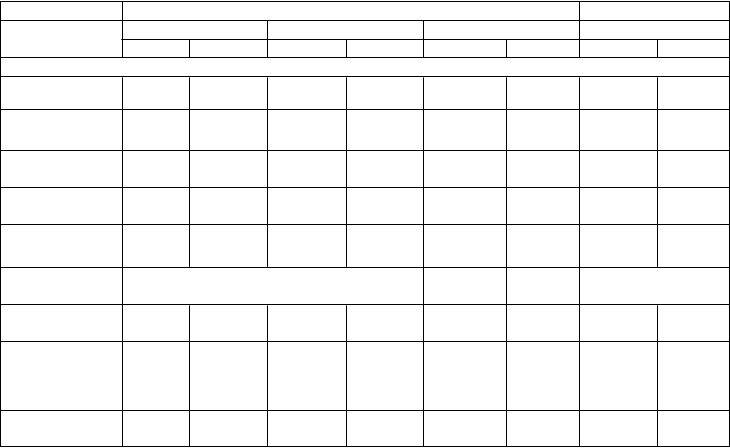
Zmena v kardiovaskulárnych a metabolických parametroch od východiskového stavu po 56. týždeň v skúšaniach fázy III NB-301, NB-302, a NB-304 a od východiskového stavu po 28. týždeň v skúšaní fázy III NB-303
Dáta z 56. týždňa Dáta z 28. týždňaNB-301 NB-302 NB-304 NB-303NB PBO NB PBO NB PBO NB PBOAnalýza celej sady +
n 471 511 482 193 265 159 825 456
Obvod pása, cm -6,2* -2,5 -10,0* -6,8 -5,0* -2,9 -6,2* -2,7
Triglyceridy,
% zmena -12,7* -3,1 -16,6* -8,5 -11,2* -0,8 -7,3* -1,4
HDL-C,
mg/dl 3,4* -0,1 4,1* 0,9 3,0* -0,3 1,2* -1,4
Pomer
LDL-C/HDL-C -0,21* -0,05 -0,05* 0,12 -0,15* 0,04 -0,15* 0,07
HbA1c, % Neaplikovateľné -0,6* -0,1 Neaplikovateľné
Glukóza
nalačno, mg/dl -3,2* -1,3 -2,4 -1,1 -11,9 -4,0 -2,1 -1,7
Inzulín nalačno,
% zmena -17,1* -4,6 -28,0* -15,5 -13,5 -10,4 -14,1* -0,5
HOMA-IR,
% zmena -20,2* -5,9 -29,9* -16,6 -20,6 -14,7 -16,4* -4,2
+ Na základe LOCF s posledným preneseným pozorovaním pri užívaní lieku.
* p-hodnota<0,05 (nominálne hodnoty) v porovnaním so skupinou dostávajúcou placebo.
Skúšania NB-301, NB-302 a NB-303 boli vykonané u subjektov obéznych alebo s nadváhou alebo subjektov s komorbiditami. Skúšanie NB-302 malo intenzívnejší program zmeny správania, zatiaľ čo primárny koncový ukazovateľ skúšania NB-303 bol hodnotený v 28. týždni, aby bola možná opätovná randomizácia na odlišné dávky v neskoršej časti skúšania. Skúšanie NB-304 bolo vykonané u subjektov obéznych alebo s nadváhou a mali diabetes mellitus 2. typu
Účinok na zloženie telaV podskupine subjektov sa meralo zloženie tela s použitím DEXA (dual energy X-ray absorptiometry
- analýzy absorpcie pomocou dvoch energií X-žiarenia) (naltrexón / bupropión = 79 subjektov a placebo = 45 subjektov) a vyšetrenia CT („multislice computed tomography“)(naltrexón / bupropión =
34 subjektov a placebo = 24 subjektov). Vyšetrenie DEXA ukázalo, že liečba naltrexónom / bupropiónom v porovnaní s placebom bola spojená s väčším znížením celkového telesného tuku a viscerálneho adipózneho tkaniva v porovnaní s východiskovým stavom. Ako sa očakávalo, subjekty liečené naltrexónom / bupropiónom majú oproti východiskovému stavu väčšie priemerné zvýšenie percentuálneho podielu celkovej hmoty v tele bez tuku v porovnaní so subjektmi liečenými placebo. Tieto výsledky poukazujú na to, že väčšina úbytku celkovej telesnej hmotnosti bola spôsobená redukciou adipózneho tkaniva, vrátane viscerálneho adipózneho tkaniva.
PediatrickápopuláciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom Mysimba v jednej alebo vo viacerých podskupinách pediatrickej populácie s obezitou (informácie o použití
v pediatrickej populácii, pozri časť 4.2). Naltrexón / bupropión sa nesmie používať u detí a dospievajúcich.
5.2 Farmakokinetické vlastnosti
Na základe priemerného pomeru AUC0-∞ a 90% intervalov spoľahlivosti preukázali výsledky klinických skúšaní relatívnej biologickej dostupnosti po jednej dávke u zdravých dobrovoľníkov, že naltrexón / bupropión tablety, pri úprave dávky, sú bioekvivalentné naltrexónu s okamžitým uvoľňovaním (IR) alebo bupropiónu s predĺženým uvoľňovaním (PR) podávaným samostatne.
Absorpcia
Po jednom perorálnom podaní tabliet s naltrexónom / bupropiónom zdravým subjektom bola maximálna koncentrácia naltrexónu a bupropiónu dosiahnutá približne 2 a 3 hodiny po podaní naltrexónu / bupropiónu, v uvedenom poradí. Pri meraní AUC sa nezistili žiadne rozdiely v biologickej dostupnosti naltrexónu alebo bupropiónu pri podávaní v kombinácii v porovnaní so samostatným podávaním každého z nich. Avšak vzhľadom na predĺžený charakter uvoľňovania liečiv naltrexónu / bupropiónu, Cmax naltrexónu bola výrazne nižšia v porovnaní so samostatným podaním
50 mg naltrexóniumchloridu IR (asi 2-násobný rozdiel po úprave dávky). Cmax bupropiónu pri podaní kombinácie naltrexón / bupropión (180 mg bupropióniumchloridu) bola ekvivalentná Cmax bupropiónu
PR (150 mg bupropióniumchloridu), čo svedčí o tom, že Cmax bupropiónu dosiahnutá pri kombinácii
naltrexón / bupropión (360 mg bupropióniumchloridu /deň) je porovnateľná s Cmax dosahovanou komerčne dostupným bupropiónom PR (300 mg bupropiónchloridu/deň) podávaným samostatne.
Naltrexón a bupropión sa dobre vstrebávajú z gastrointestinálneho traktu (absorbuje sa >90 %), avšak naltrexón podstupuje významný „first pass effect“ a preto je systémová biologická dostupnosť obmedzená a do obehového systému sa dostane iba 5-6 % nezmeneného naltrexónu.
Vplyv jedla
Keď sa naltrexón / bupropión podá spolu s jedlom bohatým na tuky, AUC naltrexónu sa zvýši 2,1-krát a Cmax naltrexónu 3,7-krát, AUC bupropiónu sa zvýši 1,4-krát a Cmax bupropiónu 1,8-krát. V ustálenom stave spôsobí jedlo zvýšenie AUC naltrexónu1,7-krát a Cmax 1,9-krát a AUC bupropiónu 1,1-krát a
Cmax 1,3-krát. Klinické skúsenosti zahŕňajú podávanie za rôznych podmienok vo vzťahu k jedlu a podporujú užívanie tabliet naltrexónu / bupropiónu s jedlom.
Distribúcia
Priemerný distribučný objem v ustálenom stave bol pri podaní ako naltrexón / bupropión, Vss/F, 5697
litrov pre naltrexón a 880 litrov pre bupropión.
Väzba na plazmatické proteíny nie je veľká ani u naltrexónu (21 %) ani bupropiónu (84 %), čo znamená nízky potenciál liekových interakcií spôsobených vytesnením z väzby na plazmatické proteíny.
Biotransformáciaaeliminácia
Po podaní jednej dávky tabliet naltrexónu / bupropiónu zdravým subjektom bol priemerný eliminačný polčas T½ približne 5 hodín pre naltrexón a 21 hodín pre bupropión.
Naltrexón
Hlavný metabolit naltrexónu je 6-beta-naltrexol. Hoci je menej silný ako naltrexón, 6-beta-naltrexol sa metabolizuje pomalšie a preto je v obehu vo výrazne vyšších koncentráciách ako naltrexón. Naltrexón a 6-beta-naltrexol sa nemetabolizujú enzýmami cytochrómu P450 a štúdie in vitro ukázali, že pri ich metabolizácii nie je pravdepodobná inhibícia alebo indukcia dôležitých izoenzýmov. Naltrexón sa primárne metabolizuje na 6-beta-naltrexol enzýmami dihydrodiol dehydrogenázami (DD1, DD2 a DD4). Ďalšími veľkými metabolickými dráhami je tvorba metabolitov 2-hydroxy-3-O-metylnaltrexón a 2-hydroxy-3-O-metyl-6-beta-naltrexol, o ktorých sa predpokladá, že sú sprostredkované
katechol-O-metyl transferázami (COMT) a glukuronidáciou, o ktorej sa predpokladá, že je sprostredkovaná enzýmami UGT1A1 a UGT2B7.
Naltrexón a jeho metabolity sa vylučujú primárne obličkami (37 až 60 % dávky). Odvodená hodnota renálneho vylučovania naltrexónu po perorálnom podaní, upravená podľa väzby na plazmatické proteíny, je 89 ml/min. Enzým zodpovedný za hlavnú dráhu eliminácie nie známy. Dráha vylučovania stolicou je minoritná.
Bupropión
Bupropión sa v rozsiahlej miere metabolizuje na tri hlavné metabolity: hydroxybupropión, treohydrobupropión a erytrohydrobupropión. Metabolity majú dlhšie eliminačné polčasy ako bupropión a vo väčšej miere sa akumulujú. In vitro zistenia naznačili, že hlavným izoenzýmom zahrnutým do tvorby hydroxybupropiónu je CYP2B6, zatiaľ čo CYP1A2, 2A6, 2C9, 3A4 a 2E1 sú zahrnuté menej. Naopak pri tvorbe treohydrobupropiónu literatúra uvádza sprostredkovanie
11-beta-hydroxysteroid dehydrogenázou 1. Nie je známa metabolická dráha zodpovedná za tvorbu
erytrohydrobupropiónu.
Bupropión a jeho metabolity inhibujú CYP2D6. Väzba hydroxybupropiónu na plazmatické proteíny je podobná ako väzba bupropiónu (84 %), zatiaľ čo ďalšie dva metabolity majú približne polovičnú väzbu.
Po perorálnom podaní 200 mg 14C-bupropiónchloridu ľuďom, 87 % dávky rádioaktivity bolo získaných späť z moču a 10 % zo stolice. Z perorálnej dávky bolo 0,5 % vylúčené v nezmenenej forme, čo je v súlade s rozsiahlym metabolizmom bupropiónu.
Akumulácia
Po podávaní naltrexónu / bupropiónu dvakrát denne sa naltrexón neakumuluje, zatiaľ čo 6-beta- naltrexol sa v priebehu času akumuluje. Podľa jeho biologického polčasu sa odhaduje, že 6-beta- naltrexol dosiahne koncentrácie v rovnovážnom stave približne za 3 dni. Metabolity bupropiónu (a do menšej miery nemetabolizovaný bupropión) sa akumulujú a koncentrácie v rovnovážnom stave dosahujú približne za jeden týždeň. Nevykonala sa žiadna štúdia porovnávajúca AUC alebo Cmax naltrexónu / bupropiónu tabliet s predĺženým uvoľňovaním s bupropiónom PR alebo naltrexónom IR podanými ako samostatný agens v usporiadaní s podávaním viacerých dávok (t.j. pri ustálenom stave).
Špeciálnepopulácie
Pohlavie a rasa
Súhrnné analýzy dát týkajúcich sa naltrexónu / bupropiónu neodhalili žiadne relevantné rozdiely vo farmakokinetických parametroch bupropiónu alebo naltrexónu, ktoré by súviseli s pohlavím alebo rasou. Avšak vo významnom rozsahu boli skúmané iba subjekty belošského a negroidného pôvodu. Nie je potrebná úprava dávky podľa pohlavia alebo rasy.
Staršie osoby
Farmakokinetika naltrexónu / bupropiónu sa nehodnotila u populácie starších osôb. U starších osôb by sa mala dodržiavať opatrnosť pri výbere dávky a môže byť užitočné monitorovať renálnu funkciu, pretože metabolity naltrexónu a bupropiónu sa vylučujú močom a u starších ľudí je väčšia pravdepodobnosť zníženej renálnej funkcie. Naltrexón / bupropión sa neodporúča u pacientov starších ako 75 rokov.
Fajčiari
Súhrnné analýzy dát týkajúcich sa naltrexónu / bupropiónu neodhalili žiadne relevantné rozdiely v plazmatických koncentráciách bupropiónu alebo naltrexónu u fajčiarov v porovnaní s nefajčiarmi. Účinok fajčenia cigariet na farmakokinetiku bupropiónu boli skúmané u 34 zdravých dobrovoľníkov – mužov a žien; 17 boli dlhodobí fajčiari cigariet a 17 boli nefajčiari. Po perorálnom podaní jednej
dávky 150 mg bupropiónchloridu nebol štatisticky významný rozdiel medzi fajčiarmi a nefajčiarmi v
Cmax, polčase, Tmax, AUC alebo klírense bupropiónu alebo jeho aktívnych metabolitov.
Porucha funkcie pečene
Nie sú dostupné farmakokinetické údaje s naltrexónom / bupropiónom u pacientov s poruchou funkcie pečene. Na základe informácií z literatúry a z existujúcich materiálov pre individuálne zložky je systémová expozícia výrazne vyššia pri bupropióne a jeho metabolitoch (dvakrát až trikrát), a pri naltrexóne a jeho metabolitoch (až 10-krát vyššia) u subjektov s cirhózou vykazujúcich stredne ťažkú až ťažkú poruchu funkcie pečene. Naltrexón / bupropión je kontrandikovaný u pacientov s ťažkou
poruchou funkcie pečene a neodporúča sa u pacientov s miernou až stredne ťažkou poruchou funkcie pečene.
Porucha funkcie obličiek
Nebola vykonaná špeciálne zameraná farmakokinetická štúdia s naltrexónom / bupropiónom u subjektov s poruchou funkcie obličiek. Na základe informácií z literatúry a z existujúcich materiálov pre individuálne zložky je systémová expozícia výrazne vyššia pri bupropióne a jeho metabolitoch (dvakrát až trikrát), a pri naltrexóne a jeho metabolitoch u subjektov so stredne závažnou až ťažkou poruchou funkcie obličiek. Naltrexón / bupropión je kontraindikovaný u pacientov s renálnym zlyhaním v koncovom štádiu alebo u pacientov s ťažkou poruchou funkcie obličiek a neodporúča sa u pacientov so stredne ťažkou poruchou funkcie obličiek.
5.3 Predklinické údaje o bezpečnosti
Účinky kombinovaného použitia bupropiónu a naltrexónu neboli skúmané u zvierat. Neklinické údaje o samostatných zložkách, pri ktorých sa vychádzalo z konvenčných štúdií
bezpečnosti, farmakológie, toxicity po opakovanej dávke, genotoxicity a karcinogénneho potenciálu
neodhalili osobitné riziko pre ľudí. Ak sa nejaký účinok v neklinických štúdiách prejavil, bol pozorovaný iba pri expozíciách dostatočne presahujúcich maximálnu expozíciu u ľudí, takže má iba malý význam pre klinické použitie. Avšak existuje určitý dôkaz o hepatotoxicite pri zvyšujúcej sa dávke, keď bolo zistené reverzibilné zvýšenie pečeňových enzýmov u ľudí s terapeutickými a vyššími dávkami (pozri časti 4.4 a 4.8). Pečeňové zmeny boli pozorované u zvierat v štúdiách s bupropiónom, ale tie sú spôsobené induktorom hepatálnych enzýmov. U ľudí bupropión pri odporúčaných dávkach neindukuje svoj vlastný metabolizmus. To naznačuje, že zistenia týkajúce sa pečene u laboratórnych zvierat majú iba obmedzený význam pri hodnotení a stanovovaní rizík bupropiónu.
Reprodukčnátoxicita
Naltrexón (100 mg/kg/deň, približne 30-násobná dávka naltrexónu v naltrexónu / bupropiónu pri výpočte na základe mg/m2) spôsobil signifikantné zvýšenie pseudogravidity u potkanov. Došlo tiež k zníženiu počtu gravidít u spárených samíc potkanov. Pri tejto úrovni dávky nebol zistený žiaden účinok na samčiu fertilitu. Význam týchto pozorovaní na plodnosť u ľudí nie je známy.
Preukázalo sa , že naltrexón má embryocidný účinok u potkanov, ktorým bola podaná dávka
naltrexónu 100 mg/kg/deň (30-násobok dávky naltrexónu / bupropiónu) pred a v priebehu gestácie, a u králikov liečených naltrexónom v dávke 60 mg/kg/deň (36-násobok dávky naltrexónu / bupropiónu) v priebehu obdobia organogenézy.
Štúdie fertility bupropiónu u potkanov pri dávkach až 300 mg/kg/deň alebo 8-násobku dávky bupropiónu pri podaní naltrexónu / bupropiónu, neodhalili žiadny dôkaz zníženej fertility.
Genotoxicita
Naltrexón bol negatívny v nasledujúcich in vitro štúdiách genotoxicity: test reverznej bakteriálnej mutácie (Amesov test), test dedičnej translokácie, test výmeny sesterských chromatíd v bunkách CHO a test mutácie génu myšieho lymfómu. Naltrexón bol negatívny aj v in vivo mikronukleových testoch na myšiach. Ale naproti tomu mal pozitívne výsledky v nasledujúcich testoch: test pohlavne viazanej recesívnej letality Drosophila melanogaster, nešpecifické poškodenie DNA v testoch opráv E. coli a buniek WI-38 a urinalýze reziduí metylovaného histidínu. Klinický význam týchto dvojznačných nálezov nie je známy.
Údaje o genotoxicite svedčia o tom, že bupropión je slabý bakteriálny mutagén, ale nie cicavčí mutagén, a preto nemá žiadny význam ako ľudská genotoxická látka. Skúšania na myšiach
a potkanoch potvrdzujú absenciu karcinogénnych účinkov u týchto živočíšnych druhov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro
t
a
blety: cysteíniumchlorid mikrokryštalická celulóza hydroxypropylcelulóza magnéziumstearát bezvodá laktóza monohydrát laktózy krospovidón typ A
hlinitý lak indigokarmínu (E132)
hypromelóza edetát disodný
koloidný oxid kremičitý
Filmovýobaltablety:
polyvinylalkohol
oxid titaničitý (E171) makrogol 3350 mastenec
hlinitý lak indigokarmínu E132
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30°C.
6.5 Druh obalu a obsah balenia
PVC/PCTFE/PVC/Alumíniové blistre. Veľkosť balenia: 28, 112 tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Orexigen Therapeutics Ireland Limited
2nd Floor
Palmerston House, Fenian Street
Dublin 2
Írsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU1/14/988/001-002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26 marca 2015
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.