telukastu ako alternatívnej liečebnej možnosti k nízkodávkovým inhalačným kortikosteroidom u detí od 2 do 5 rokov s ľahkou perzistujúcou astmou sa má zvážiť iba u pacientov, ktorí nemajú v nedávnej anamnéze závažné astmatické záchvaty vyžadujúce použitie perorálnych kortikosteroidov a u ktorých sa preukázalo, že nedokážu používať inhalačné kortikosteroidy (pozri časť 4.1). Ľahká perzistujúca astma je definovaná ako príznaky astmy vyskytujúce sa viac ako jedenkrát týždenne, ale menej ako jedenkrát denne, nočné príznaky vyskytujúce sa viac ako dvakrát mesačne, ale menej ako jedenkrát týždenne, s normálnou funkciou pľúc medzi jednotlivými epizódami. Ak sa následne nedosiahne uspokojivá kontrola astmy (zvyčajne počas jedného mesiaca) potrebné zvážiť prídavnú alebo odlišnú protizápalovú liečbu na základe krokového systému liečby astmy. Kontrola astmy má byť u pacientov pravidelne sledovaná.
Montelukast Teva ako profylaxia astmy u pacientov vo veku 2 až 5 rokov, u ktorých je prevládajúcou zložkou bronchokonstrikcia vyvolaná námahouU pacientov vo veku od 2 do 5 rokov môže bronchokonstrikcia vyvolaná námahou predstavovať prevládajúci prejav perzistujúcej astmy, ktorý si vyžaduje liečbu inhalačnými kortikosteroidmi. Stav pacientov sa má vyhodnotiť po 2 až 4 týždňoch liečby montelukastom. Ak sa nedosiahne uspokojivá odpoveď, je potrebné zvážiť prídavnú alebo odlišnú terapiu.
Liečba Montelukastom Teva v súvislosti s inými antiastmatikami:Keď sa liečba liekom Montelukast Teva granulát používa ako prídavná liečba k inhalačným kortikosteroidom, Montelukast Teva granulát nemá náhle nahradiť inhalačné kortikosteroidy (pozri časť 4.4).
Iné dostupné sily/liekové formy:10 mg filmom obalené tablety sú určené pre dospelých a mladistvých vo veku 15 a viac rokov.
5 mg žuvacie tablety sú určené pre pediatrických pacientov vo veku od 6 do 14 rokov.
4 mg žuvacie tablety sú určené ako alternatívna lieková forma pre pediatrických pacientov vo veku od 2 do 5 rokov.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok.
4.4 Osobitné upozornenia a opatrenia pri používaníDiagnóza perzistujúcej astmy u veľmi malých detí (6 mesiacov – 2 rokov) má byť stanovená pediatrom alebo pneumológom.
Pacienti majú byť upozornení, aby nikdy nepoužívali perorálny montelukast na liečbu akútnych záchvatov astmy a aby mali pre tento účel vždy k okamžitej dispozícii svoj zvyčajný vhodný záchranný (úľavový) liek. V prípade výskytu akútneho záchvatu sa má použiť krátkodobo pôsobiaci inhalačný β‑agonista. Pacienti sa majú čo najskôr poradiť s lekárom, ak potrebujú viac inhalácií krátkodobo pôsobiacich β‑agonistov ako zvyčajne.
Montelukast nemá náhle nahradiť inhalačné alebo perorálne kortikosteroidy.
Nie sú k dispozícii údaje preukazujúce, že pri súbežnom podávaní montelukastu je možné znížiť dávku perorálnych kortikosteroidov.
V zriedkavých prípadoch sa u pacientov liečených antiastmatikami, vrátane montelukastu, môže vyskytnúť systémová eozinofília, niekedy spolu s klinickými znakmi vaskulitídy zhodnými s Churgovým‑Straussovej syndrómom, čo je stav, ktorý sa často lieči systémovými kortikosteroidmi. Tieto prípady boli zvyčajne, ale nie vždy, spojené so znížením dávky perorálnych kortikosteroidov alebo s vysadením perorálnych kortikosteroidov. Možnosť, že používanie antagonistov leukotriénových receptorov môže súvisieť s rozvojom Churgovho‑Straussovej syndrómu, nie je možné vylúčiť ani potvrdiť. Lekári majú pacientov pozorne sledovať kvôli eozinofílii, vaskulitickému exantému, zhoršujúcim sa pľúcnym príznakom, srdcovým komplikáciám a/alebo neuropatii. Pacienti, u ktorých vzniknú tieto príznaky, majú byť znovu vyšetrení a ich liečebný režim sa má prehodnotiť.
4.5 Liekové a iné interakcieMontelukast sa môže podávať spolu s inými liekmi bežne používanými na profylaxiu a dlhodobú liečbu astmy. V štúdiách liekových interakcií nemala odporúčaná klinická dávka montelukastu klinicky významný vplyv na farmakokinetiku nasledujúcich liekov: teofylín, prednizón, prednizolón, perorálne kontraceptíva (etinylestradiol/noretindrón 35/1), terfenadín, digoxín a warfarín.
Plocha pod krivkou plazmatickej koncentrácie (AUC) montelukastu bola znížená o približne 40 % u jedincov, ktorým bol súbežne podávaný fenobarbital. Vzhľadom k tomu, že montelukast je metabolizovaný prostredníctvom CYP 3A4, opatrnosť je potrebná, najmä u detí, keď sa montelukast podáva súbežne s induktormi CYP 3A4, ako sú fenytoín, fenobarbital a rifampicín.
Štúdie
in vitro ukázali, že montelukast je silne účinný inhibítor CYP 2C8. Údaje z klinickej štúdie liekových interakcií medzi montelukastom a rosiglitazónom (skúšobný substrát reprezentujúci lieky metabolizované predovšetkým prostredníctvom CYP 2C8) preukázali, že montelukast neinhibuje
in vivo CYP 2C8
. Preto sa neočakáva, že montelukast výrazne zmení metabolizmus liekov metabolizovaných týmto enzýmom (napr. paklitaxel, rosiglitazón a repaglinid).
4.6 Gravidita a laktáciaPoužitie počas gravidityŠtúdie na zvieratách nepreukázali škodlivé účinky na graviditu alebo
embryonálny/fetálny vývoj.
Obmedzené údaje z databázy údajov o výsledkoch gravidity nesvedčia o príčinnej súvislosti medzi montelukastom a vrodenými chybami (t.j. defekty končatín), ktoré boli celosvetovo zriedkavo hlásené po uvedení lieku na trh.
Montelukast sa môže používať počas gravidity iba v nevyhnutných prípadoch.
Použitie počas laktácieŠtúdie na potkanoch ukázali, že montelukast sa vylučuje do mlieka (pozri časť 5.3). Nie je známe, či sa montelukast vylučuje do ľudského mlieka.
Montelukast granulát môžu používať dojčiace matky iba v nevyhnutných prípadoch.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeočakáva sa, že montelukast ovplyvní pacientovu schopnosť viesť vozidlo alebo obsluhovať stroje. Vo veľmi zriedkavých prípadoch však jedinci hlásili ospalosť alebo závraty.
4.8 Nežiaduce účinkyMontelukast bol hodnotený v klinických štúdiách nasledovným spôsobom:
• 10 mg filmom obalené tablety u približne 4 000 dospelých pacientov vo veku 15 rokov a starších
• 5 mg žuvacie tablety u približne 1 750 pediatrických pacientov vo veku od 6 do 14 rokov
• 4 mg žuvacie tablety u 851 pediatrických pacientov vo veku od 2 do 5 rokov a
• 4 mg granulát u 175 pediatrických pacientov vo veku od 6 mesiacov do 2 rokov.
Montelukast bol hodnotený v klinických štúdiách u pacientov s intermitentnou astmou nasledovným spôsobom:
• 4 mg granulát a žuvacie tablety u 1038 pediatrických pacientov vo veku od 6 mesiacov do 5 rokov.
V klinických štúdiách boli nasledujúce nežiaduce reakcie súvisiace s liekom hlásené u pacientov liečených montelukastom často (≥ 1/100 až < 1/10) a s väčším výskytom ako u pacientov liečených placebom:
Trieda orgánových systémov
| Dospelí vo veku 15 rokov a starší
(dve 12‑týždňové štúdie; n=795)
| Pediatrickí pacienti vo veku od 6 do 14 rokov
(jedna 8‑týždňová štúdia; n=201)
(dve 56‑týždňové štúdie; n=615)
| Pediatrickí pacienti vo veku od 2 do 5 rokov
(jedna 12‑týždňová štúdia; n=461)
(jedna 48‑týždňová štúdia; n=278)
| Pediatrickí pacienti vo veku od 6 mesiacov do 2 rokov
(jedna 6‑týždňová štúdia; n=175)
|
Poruchy nervového systému
| bolesť hlavy
| bolesť hlavy
|
| hyperkinéza
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
|
|
| astma
|
Poruchy gastrointestinálneho traktu
| bolesť brucha
|
| bolesť brucha
| hnačka
|
Poruchy kože a podkožného tkaniva
|
|
|
| Ekzematózna dermatitída, vyrážka
|
Celkové poruchy a reakcie v mieste podania
|
|
| smäd
|
|
V klinických štúdiách u obmedzeného počtu pacientov sa počas dlhodobej liečby, trvajúcej až 2 roky u dospelých a až 12 mesiacov u pediatrických pacientov vo veku od 6 do 14 rokov, bezpečnostný profil nezmenil.
Celkovo bolo 502 pediatrických pacientov vo veku od 2 do 5 rokov liečených montelukastom počas aspoň 3 mesiacov, 338 počas 6 mesiacov alebo dlhšie a 534 pacientov počas 12 mesiacov alebo dlhšie. Počas dlhodobej liečby sa bezpečnostný profil nezmenil ani u týchto pacientov.
Pri liečbe pediatrických pacientov vo veku od 6 mesiacov do 2 rokov sa nezmenil bezpečnostný profil liečbou v trvaní do 3 mesiacov.
Skúsenosti po uvedení lieku na trhTrieda orgánových systémov
| Pomenovanie nežiadúcich učinkov
| Kategória frekvencie*
|
Infekcie a nákazy
| infekcia horného dýchacieho traktu †
| veľmi časté
|
Poruchy krvi a lymfatického systému
| zvýšený sklon ku krvácaniu
| zriedkavé
|
Poruchy imunitného systému
| reakcie precitlivenosti vrátane anafylaxie
| menej časté
|
hepatálna eozinofilová infiltrácia
| veľmi zriedkavé
|
Psychické poruchy
| poruchy snov zahŕňajúce nočné mory, insomnia, somnambulizmus, podráždenosť, anxieta, nepokoj, agitovanosť zahŕňajúca agresívne správanie alebo hostilitu, depresia
| menej časté
|
tremor
| zriedkavé
|
halucinácie, suicidálne myšlienky a správanie (suicidalita)
| veľmi zriedkavé
|
Poruchy nervového systému
| závrat, ospalosť, parestézia/hypestézia, záchvat
| menej časté
|
Poruchy srdca a srdcovej činnosti
| palpitácie
| zriedkavé
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| epistaxa
| menej časté
|
Churgov-Straussovej Syndróm (CSS) (pozri časť 4.4)
| veľmi zriedkavé
|
Poruchy gastrointestinálneho traktu
| hnačka ‡, nauzea‡, vracanie ‡
| časté
|
sucho v ústach, dyspepsia
| menej časté
|
Poruchy pečene a žlčových ciest
| zvýšené hladiny sérových transamináz (ALT, AST)
| časté
|
hepatitída (vrátane cholestatického, hepatocelulárneho a zmiešaného poškodenia pečene)
| veľmi zriedkavé
|
Poruchy kože a podkožného tkaniva
| vyrážka ‡
| časté
|
podliatina, urtikária, pruritus
| menej časté
|
angioedém
| zriedkavé
|
nodózny erytém
| veľmi zriedkavé
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| artralgia, myalgia vrátane svalových kŕčov
| menej časté
|
Celkové poruchy a reakcie v mieste podania
| pyrexia‡
| časté
|
asténia/únava, nevoľnosť, edém,
| menej časté
|
*Kategória frekvencie : Definovaná pre každé pomenovanie nežiadúceho učinku výskytom hláseným v databáze klinických skúšaní: veľmi časté (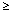 1/10), časté ( 1/10), časté (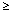 1/100 to <1/10), menej časté ( 1/100 to <1/10), menej časté (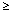 1/1000 to <1/100), zriedkavé ( 1/1000 to <1/100), zriedkavé (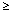 1/10,000 to <1/1000), veľmi zriedkavé (<1/10,000). 1/10,000 to <1/1000), veľmi zriedkavé (<1/10,000).
†Tento nežiaduci učinok, hlásený v klinických skúšaniach ako veľmi častý u pacientov, ktorí užívali montelukast, bol tiež hlásený ako veľmi častý u pacientov, ktorí užívali placebo.
‡ Tento nežiaduci učinok, hlásený v klinických skúšaniach ako častý u pacientov, ktorí užívali montelukast, bol tiež hlásený ako častý u pacientov, ktorí užívali placebo.
|
4.9 PredávkovanieNie sú k dispozícii špecifické informácie o liečbe predávkovania montelukastom. V štúdiách zameraných na liečbu chronickej astmy bol montelukast podávaný dospelým pacientom v dávkach do 200 mg/deň počas 22 týždňov a v krátkodobých štúdiách v dávkach do 900 mg/deň počas približne jedného týždňa, pričom tieto dávky nespôsobili klinicky významné nežiaduce účinky.
Prípady akútneho predávkovania sa vyskytli po uvedení lieku na trh a v klinických štúdiách s montelukastom. Zahŕňajú prípady u dospelých a detí s požitím až 1 000 mg dávky (približne 61 mg/kg u 42‑mesačného dieťaťa). Zistené klinické a laboratórne nálezy zodpovedali bezpečnostnému profilu u dospelých a pediatrických pacientov. Vo väčšine prípadov predávkovania sa nevyskytli žiadne nežiaduce účinky. Najčastejšie sa vyskytujúce nežiaduce účinky zodpovedali bezpečnostnému profilu montelukastu a zahŕňali bolesť brucha, ospalosť, smäd, bolesť hlavy, vracanie a psychomotorickú hyperaktivitu.
Nie je známe, či sa montelukast dá z organizmu odstrániť peritoneálnou dialýzou alebo hemodialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné systémové liečivá chorôb spojených s obštrukciou dýchacích ciest , antagonista leukotriénových receptorov
ATC kód: RO3D CO3
.
Cysteinyl-leukotriény (LTC
4, LTD
4, LTE
4) sú účinné zápalové eikosanoidy uvoľňované z rôznych buniek vrátane mastocytov a eozinofilov. Tieto dôležité proastmatické mediátory sa viažu na cysteinyl-leukotriénové (CysLT) receptory, ktoré sa nachádzajú v dýchacích cestách človeka a v dýchacích cestách spôsobujú napríklad bronchokonstrikciu, sekréciu hlienu, ovplyvnenie cievnej permeability a mobilizáciu eozinofilov.
Montelukast je perorálne aktívna látka, ktorá sa viaže s vysokou afinitou a selektivitou na CysLT
1 receptor. V klinických štúdiách montelukast inhibuje bronchokonstrikciu navodenú inhaláciou LTD
4 pri dávkach už od 5 mg. Bola pozorovaná bronchodilatácia v priebehu 2 hodín po perorálnom podaní. Bronchodilatačný účinok spôsobený β-agonistom bol aditívny k účinku montelukastu. Liečba montelukastom inhibovala včasnú aj neskorú fázu bronchokonstrikcie, vyvolanej pôsobením antigénu. Montelukast, v porovnaní s placebom, znížil výskyt eozinofilov v periférnej krvi u dospelých a pediatrických pacientov. V samostatnej štúdii liečba montelukastom významne znížila počet eozinofilov v dýchacích cestách (meraných v spúte). U dospelých a pediatrických pacientov vo veku od 2 do 14 rokov montelukast, v porovnaní s placebom, znížil výskyt eozinofilov v periférnej krvi, pričom sa zlepšili klinické ukazovatele astmy.
V štúdiách s dospelými pacientmi vykázala denná dávka montelukastu 10 mg, v porovnaní s placebom, významné zlepšenie v rannom FEV
1 (zmena 10,4% vs. 2,7% v porovnaní s východiskovým stavom), dopoludňajšej maximálnej výdychovej rýchlosti (PEFR) (zmena 24,5 l/min vs. 3,3 l/min v porovnaní s východiskovým stavom) a významné zníženie celkového použitia β-agonistu (zmena -26,1% vs. -4,6% v porovnaní s východiskovým stavom). Pri porovnaní s placebom pacienti hlásili významné zlepšenie v hodnotení denných a nočných symptómov astmy.
Štúdie u dospelých pacientov preukázali schopnosť montelukastu zosilniť klinický účinok inhalačných kortikosteroidov (percentuálna zmena v porovnaní s východiskovým stavom pri inhalačnom beklometazóne s montelukastom vs. beklometazón, pre FEV
1: 5,43% vs. 1,04%; použitie β-agonistu:
- 8,70% vs. 2,64%). Pri porovnaní s inhalačným beklometazónom (200 µg 2-krát denne so spacerom (nadstavcom)) sa po montelukaste zistila rýchlejšia počiatočná odpoveď, hoci počas celého trvania 12-týždňovej štúdie mal beklometazón väčší priemerný liečebný účinok (percentuálna zmena v porovnaní s východiskovým stavom pri montelukaste vs. beklometazón, pre FEV
1: 7,49% vs. 13,3%; použitie β-agonistu: -28,28% vs. -43,89%). U vysokého percenta pacientov liečených montelukastom, v porovnaní s beklometazónom, sa však dosiahla podobná klinická odpoveď (napr. 50% pacientov liečených beklometazónom dosiahlo zlepšenie FEV
1 v priemere 11% alebo viac v porovnaní s východiskovým stavom pričom pri liečbe montelukastom dosiahlo rovnakú odpoveď približne 42% pacientov).
V 8-týždňovej štúdii u pediatrických pacientov vo veku od 6 do 14 rokov podávanie montelukastu 5 mg jedenkrát denne významne zlepšilo respiračné funkcie v porovnaní s placebom (zmena FEV
1 8,71% vs. 4,16% v porovnaní s východiskovým stavom; zmena dopoludňajšieho PEFR 27,9 l/min vs. 17,8 l/min v porovnaní s východiskovým stavom) a zníženie použitia β-agonistu „podľa potreby“ (zmena -11,7% vs. +8,2% v porovnaní s východiskovým stavom).
V 12-mesačnej štúdii porovnávajúcej účinnosť montelukastu s inalačným flutikazónom na kontrolu astmy u pediatrických pacientov vo veku 6 až 14 rokov s miernou perzistentnou astmou, montelukast nebol menej účinný ako flutikazón vo zvyšovaní percenta dní bez záchrannej astmatickej terapie (rescue-free days, RFD), čo bol primárny cieľový ukazovateľ. Počas 12-mesačnej liečby sa priemerné percento astma RFD zvýšilo zo 61,6 na 84,0 v skupine s montelukastom a z 60,9 na 86,7 v skupine s flutikazónom. Medziskupinový rozdiel v LS (priemer najmenších štvorcov) vo zvýšení percenta astma RFD bol štatisticky významný ( -2,8 s 95% IS -4,7, -0,9), ale v rámci limitu, ktorý bol vopred definovaný ako klinicky nie menej účinný.
Montelukast a flutikazón tiež zlepšili kontrolu astmy podľa sekundárnych premenných hodnotených počas 12-mesačnej doby trvania liečby:
· FEV
1 sa zvýšil z 1,83 l na 2,09 l v skupine s montelukastom a z 1,85 l na 2,14 l v skupine s flutikazónom. Medziskupinový rozdiel v LS (priemer najmenších štvorcov) zvýšenia FEV
1 bol –0,02 l s 95% IS –0,06; 0,02. Priemerný nárast oproti východiskovej hodnote v % predikovaného FEV
1 bol 0,6% v liečebnej skupine s montelukastom a 2,7% v liečebnej skupine s flutikazónom. Rozdiel podľa LSM (least squares means) oproti východiskovej hodnote v % predikovaného FEV
1 bol signifikantný: -2,2% s 95% IS -3,6, -0,7.
· Percento dní s použitím β-agonistu kleslo z 38,0 na 15,4 v skupine s montelukastom a z 38,5 na 12,8 v skupine s flutikazónom. Medziskupinový rozdiel v podľa LSM (least squares means) v percente dní s použitím β-agonistu bol signifikantný: 2,7 s 95% IS 0,9, 4,5.
· Percento pacientov s astmatickým záchvatom (astmatický záchvat definovaný ako obdobie zhoršenia astmy, ktoré si vyžiadalo liečbu perorálnymi steroidmi, neplánovanú návštevu ambulancie lekára, pohotovosti alebo hospitalizáciu) bolo 32,2 v skupine s montelukastom a 25,6 v skupine s flutikazónom; miera pravdepodobnosti (95 % IS) bola 1,38 (1,04; 1,84).
· Percento pacientov, ktorí použili systémové (hlavne perorálne) kortikosteroidy počas trvania štúdie, bolo 17,8 % v skupine s montelukastom a 10,5 % v skupine s flutikazónom. Medziskupinový rozdiel podľa LSM (least squares means) bol 7,3% s 95% IS 2,9; 11,7.'
V 12-týždňovej placebom-kontrolovanej štúdii s pediatrickými pacientmi vo veku 2 až 5 rokov podávanie montelukastu 4 mg jedenkrát denne zlepšilo parametre kontroly astmy v porovnaní s placebom, bez ohľadu na súčasne podávanú kontrolnú liečbu (inhalačné/nebulizované kortikosteroidy alebo inhalačný/nebulizovaný dinátriumkromoglykát). Šestdesiat percent pacientov nedostávalo žiadnu inú kontrolnú liečbu. Pri porovnaní s placebom priniesol montelukast zlepšenie denných symptómov astmy (vrátane kašľa, sipotu, ťažkostí s dýchaním alebo obmedzenia fyzickej aktivity) a nočných symptómov. Montelukast v porovnaní s placebom taktiež pri zhoršení astmy znížil použitie β-agonistov „podľa potreby" a záchrannej liečby kortikosteroidmi. Pacienti, ktorí dostávali montelukast, mali viac dní bez astmy než pacienti, ktorí dostávali placebo. Liečebný účinok bol dosiahnutý po prvej dávke.
V 12-mesačnej placebom-kontrolovanej štúdii s pediatrickými pacientmi vo veku 2 až 5 rokov s miernou astmou a epizódami zhoršovania podávanie montelukastu 4 mg jedenkrát denne významne (p≤0,001) znížilo ročnú mieru epizód zhoršovania astmy (exacerbation episodes, EE) v porovnaní s placebom (1,60 EE vs. 2,34 EE), [EE sa definuje ako ≥3 po sebe nasledujúce dni s dennými príznakmi vyžadujúcimi užitie β-agonistu alebo kortikosteroidov (perorálne alebo inhalačne), prípadne hospitalizáciu kvôli astme]. Percentuálne zníženie ročnej miery EE bolo 31,9%, s 95% IS 16,9, 44,1.
V placebom kontrolovanej štúdii u pediatrických pacientov vo veku 6 mesiacov až 5 rokov, ktorí mali intermitentnú astmu, ale nemali perzistujúcu astmu, sa liečba montelukastom podávala počas 12-mesačného obdobia, buď v režime so 4 mg montelukastu jedenkrát denne alebo ako séria 12-dňových cyklov, z ktorých každý začal, keď nastala epizóda intermitentných príznakov. Medzi pacientmi liečenými 4 mg montelukastu alebo placebom sa nepozoroval významný rozdiel v počte epizód astmy vyúsťujúcich do astmatického záchvatu, definovaného ako epizóda astmy vyžadujúca si využitie zdravotnej starostlivosti, ako napr. neplánovaná návšteva ambulancie lekára, pohotovosti alebo nemocnice, alebo liečbu perorálnymi, intravenóznymi alebo intramuskulárnymi kortikosteroidmi.
Účinnosť montelukastu u pediatrických pacientov vo veku 6 mesiacov až 2 roky podporuje extrapolácia údajov z účinnosti preukázanej u pacientov s astmou vo veku 2 rokov a starších, a je založená na podobných údajoch farmakokinetiky, ako aj predpokladu , že priebeh ochorenia, patofyziológia a účinok lieku sú v podstate podobné medzi týmito populáciami.
V 12-týždňovej štúdii u dospelých sa preukázalo významné zníženie námahovej bronchokonstrikcie (exercise-induced bronchoconstriction, EIB) (maximálny pokles FEV
1 22,33% pre montelukast vs. 32,40% pre placebo; čas obnovenia FEV
1 na hodnotu pred námahou ±5% 44,22 min vs. 60,64 min). Tento účinok bol počas 12-týždňového trvania štúdie konzistentný.
Zníženie EIB bolo preukázané aj v krátkodobej štúdii u pediatrických pacientov vo veku 6 až 14 rokov (maximálny pokles FEV
1 18,27% vs. 26,11%; čas obnovenia FEV
1 na hodnotu pred námahou ±5% 17,76 min vs. 27,98 min). V oboch štúdiách bol tento účinok preukázaný na konci dávkovacieho intervalu s dávkovaním jedenkrát denne.
U astmatických pacientov citlivých na kyselinu acetylsalicylovú, ktorí dostávali súčasne inhalačné a/alebo perorálne kortikosteroidy liečba montelukastom významne zlepšila kontrolu astmy v porovnaní s placebom (zmena FEV
1 8,55% vs. -1,74% v porovnaní s východiskovým stavom a zníženie celkového použitia β-agonistu -27,78% vs. 2,09% v porovnaní s východiskovým stavom).
5.2 Farmakokinetické vlastnostiAbsorpcia: Montelukast sa po perorálnom podaní rýchlo absorbuje. Po podaní 10 mg filmom obalenej tablety dospelým nalačno sa priemerná maximálna plazmatická koncentrácia (C
max) dosiahne do troch hodín (T
max). Priemerná perorálna biologická dostupnosť je 64 %. Perorálna biologická dostupnosť a C
max nie sú ovplyvnené obvyklým jedlom. Bezpečnosť a účinnosť boli preukázané v klinických štúdiách, v ktorých bola 10 mg filmom obalená tableta podávaná bez ohľadu na čas požitia jedla.
Po podaní 5 mg žuvacej tablety dospelým nalačno sa C
max dosiahne do dvoch hodín. Priemerná perorálna biologická dostupnosť je 73 % a obvyklé jedlo ju zníži na 63 %.
Po podaní 4 mg žuvacej tablety pediatrickým pacientom vo veku od 2 do 5 rokov nalačno sa C
max dosiahne do 2 hodín po podaní. Priemerná C
max je o 66 % vyššia, zatiaľ čo priemerná C
min je nižšia ako u dospelých, ktorí užijú 10 mg tabletu.
Granulátová forma 4-mg je bioekvivalentná k 4-mg žuvacej tablete ak je podaná dospelým nalačno. U pediatrických pacientov vo veku 6 mesiacov až 2 roky, sa dosiahne C
max 2 hodiny po podaní 4 mg granulátu. C
max je skoro 2-násobne vyššia u dospelých užívajúcich 10 mg tabletu. Súbežné podanie jablčného pyré alebo štandardného jedla s vysokým obsahom tukov s granulátom nemalo klinicky významný účinok na farmakokinetiku montelukastu ako je stanovené hodnotou AUC (1225.7 vs 1223.1 ng.hr/ml s jablčným pyré alebo bez neho a 1191.8 vs 1148.5 ng.hr/ml so štandardným jedlom s vysokým obsahom tukov a bez neho).
Distribúcia: Väzba montelukastu na plazmatické bielkoviny je viac ako 99 %. Rovnovážny distribučný objem montelukastu je v priemere 8‑11 litrov. Štúdie na potkanoch, ktorým bol podávaný rádioaktívne značený montelukast, svedčia o minimálnom prechode montelukastu hematoencefalickou bariérou. Koncentrácie rádioaktívne značenej látky boli okrem toho po 24 hodinách po podaní dávky vo všetkých ostatných tkanivách minimálne.
Biotransformácia: Montelukast sa intenzívne metabolizuje. V štúdiách u dospelých a detí, ktorým bola podávaná terapeutická dávka, neboli plazmatické koncentrácie metabolitov montelukastu v rovnovážnom stave zistiteľné.
Štúdie
in vitro na mikrozómoch ľudskej pečene svedčia o tom, že na metabolizme montelukastu sa podieľa cytochróm P450 3A4, 2A6 a 2C9. Na základe ďalších výsledkov štúdií
in vitro na mikrozómoch ľudskej pečene sa zistilo, že terapeutické plazmatické koncentrácie montelukastu neinhibujú cytochrómy P450 3A4, 2C9, 1A2, 2A6, 2C19 alebo 2D6. Metabolity sa na terapeutickom účinku podieľajú iba v minimálnej miere.
Eliminácia: Plazmatický klírens montelukastu u zdravých dospelých je v priemere 45 ml/min. Po perorálnej dávke rádioaktívne značeného montelukastu sa 86 % rádioaktivity zistilo v 5‑dňovom zbere stolice a < 0,2 % sa zistili v moči. Tieto zistenia spolu s odhadovanou perorálnou biologickou dostupnosťou montelukastu svedčia o tom, že montelukast a jeho metabolity sa vylučujú takmer výlučne žlčou.
Charakteristické vlastnosti u pacientov: U starších pacientov, pacientov s ľahkou až stredne ťažkou hepatálnou insuficienciou nie je potrebná úprava dávky. Štúdie u pacientov s poruchou funkcie obličiek sa neuskutočnili. Vzhľadom k tomu, že montelukast a jeho metabolity sa vylučujú žlčou, neočakáva sa, že u pacientov s poruchou funkcie obličiek bude potrebná úprava dávky. Nie sú k dispozícii údaje o farmakokinetike montelukastu u pacientov s ťažkou hepatálnou insuficienciou (Childovo- Pughove skóre > 9).
Pri podávaní vysokých dávok montelukastu (20‑ a 60‑násobne vyšších ako odporúčaná dávka pre dospelých) bolo pozorované zníženie plazmatickej koncentrácie teofylínu. Tento účinok nebol pozorovaný pri podávaní odporúčanej dávky 10 mg jedenkrát denne.
5.3 Predklinické údaje o bezpečnostiV štúdiách toxicity na zvieratách boli pozorované prechodné, mierne zmeny biochemických ukazovateľov v sére zahŕňajúcich hladiny ALT, glukózy, fosforu a triglyceridov. Prejavy toxicity u zvierat boli zvýšené vylučovanie slín, gastrointestinálne príznaky, riedka stolica a nerovnováha iónov. Tieto prejavy sa vyskytli po podaní dávky, po ktorej sa dosiahla > 17‑násobne vyššia systémová expozícia ako po podaní klinickej dávky. U opíc sa nežiaduce účinky vyskytli po dávke 150 mg/kg/deň (> 232‑násobok systémovej expozície dosiahnutej po podaní klinickej dávky). V štúdiách na zvieratách montelukast nemal vplyv na fertilitu alebo reprodukčnú schopnosť pri systémovej expozícii viac ako 24‑násobne prevyšujúcej klinickú systémovú expozíciu. Mierne zníženie telesnej hmotnosti mláďat bolo zaznamenané v štúdii fertility na samiciach potkanov, ktorým bola podávaná dávka 200 mg/kg/deň (> 69‑násobok klinickej systémovej expozície). V štúdiách na králikoch bol v porovnaní so súbežne liečenými kontrolnými zvieratami pozorovaný vyšší výskyt neúplnej osifikácie pri systémovej expozícii > 24‑násobne vyššej ako klinická systémová expozícia dosiahnutá po podaní klinickej dávky. U potkanov neboli pozorované žiadne abnormality. Zistilo sa, že montelukast prechádza placentárnou bariérou a vylučuje sa do materského mlieka zvierat.
Po jednorazovom perorálnom podaní sodnej soli montelukastu myšiam a potkanom v dávkach do 5 000 mg/kg (15 000 mg/m
2 u myší a 30 000 mg/m
2 u potkanov), ktoré predstavovali maximálnu skúšanú dávku, sa nevyskytli žiadne úmrtia. Táto dávka zodpovedá 25 000‑násobku odporúčanej dennej dávky pre dospelých pacientov (v prepočte na dospelého pacienta s telesnou hmotnosťou 50 kg).
Preukázalo sa, že montelukast v dávkach do 500 mg/kg/deň (približne > 200‑násobok v prepočte na systémovú expozíciu) nemal u myší fototoxický účinok pri použití spektra UVA, UVB alebo viditeľného svetla.
V štúdiách
in vitro a
in vivo na hlodavcoch nemal montelukast mutagénny ani tumorogénny účinok.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokManitol (Pearlitol 50C)
Hydroxypropyl celulóza (Klucel LF)
Nátriumlaurylsulfát
Magnéziumstearát
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti36 mesiacov
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred svetlom a vlhkosťou.
6.5 Druh obalu a obsah baleniaUchovávané v ílovitoobalených sulfátových / LDPE / Al / Surlyn vreckách v:
Škatuli so 7, 20, 28, 30, 98 vreckami.
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciuNepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
TEVA Pharmaceuticals Slovakia s.r.o.
Bratislava
Slovenská republika
8. REGISTRAČNÉ ČÍSLO
14/0479/11-S
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU 01/2013