e alergický na akékoľvek lieky alebo potraviny.
Upozornenia a opatreniaPredtým, ako začnete používať Haemate P, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
·
v prípade alergických reakcií alebo anafylaktickej reakcii (závažná alergická reakcia, ktorá spôsobuje vážne ťažkosti s dýchaním alebo závrat). Môžu sa vyskytnúť alergické reakcie z precitlivenosti. Váš lekár vás bude informovať o prvotných príznakoch reakcií z precitlivenosti ako je žihľavka, pocit tiesne na hrudníku, sipot, pokles krvného tlaku a anafylaxia (závažná alergická reakcia, ktorá spôsobuje vážne ťažkosti s dýchaním alebo závrat).
Ak sa u vás vyskytnú tieto príznaky, prerušte ihneď užívanie lieku a kontaktujte vášho lekára.· ak sa vyskytne tvorba
inhibítorov (neutralizačných protilátok). To znamená, že podaný koagulačný faktor nebude účinný a nedosiahne sa očakávaný úspech liečby.
Von Willebrandova choroba· ak je u vás známe riziko vzniku krvných zrazenín (trombotických príhod vrátane kvrnej zrazeniny v pľúcach) najmä vtedy, ak máte klinické alebo laboratórne rizikové faktory (napr. nevykonaná predoperačná a pooperačná tromboprofylaxia (prevencia), žiadna skorá mobilizácia, obezita, predávkovanie, rakovina). V takom prípade sa vyžaduje sledovanie, či sa u vás nevyskytnú prvotné príznaky trombózy. Podľa súčasných odporúčaní by sa mala zahájiť profylaktická liečba.
Váš lekár starostlivo zváži prínos liečby Haemate P v porovnaní s rizikom týchto komplikácií.
Bezpečnosť z hľadiska vírusov
Pri výrobe liekov z ľudskej krvi alebo plazmy, je potrebné dodržiavať určité opatrenia, aby sa zabránilo prenosu infekcií na pacientov. Tieto opatrenia zahŕňajú:
· starostlivý výber darcov krvi a plazmy s cieľom vylúčiť potenciálnych nositeľov infekcií a
· testovanie jednotlivých odberov krvi a zmiešanej plazmy na prítomnosť vírusov/infekcií
· pri spracovaní krvi alebo plazmy sa zaraďujú také kroky, pri ktorých sú vírusy zneškodnené alebo odstránené
Napriek týmto opatreniam pri podávaní liekov vyrobených z ľudskej krvi alebo plazmy nie je možné úplne vylúčiť možnosť prenosu infekcie. Platí to aj pre akékoľvek neznáme alebo nové vírusy a iné typy infekcií.
Vykonané opatrenia sú účinné pre obalené vírusy, ako je vírus ľudskej imunitnej nedostatočnosti (HIV, vírus AIDS), vírus hepatitídy B a vírus hepatitídy C (infekčný zápal pečene) a pre neobalené vírusy ako je vírus hepatitídy A (infekčný zápal pečene). Tieto opatrenia môžu mať obmedzený účinok proti neobaleným vírusom, ako je parvovírus B19.
Infekcia parvovírusom B19 môže byť nebezpečná:
· pre gravidné ženy (infekcia plodu)
· pre jedincov, ktorí majú oslabený imunitný systém alebo trpia na niektorý druh anémie (napríklad kosáčikovitá alebo hemolytická anémia)
Ak pravidelne/opakovane používate lieky s von Willebrandovým faktorom alebo koagulačným faktorom VIII vyrobené z ľudskej plazmy, váš lekár vám môže odporučiť, aby ste zvážili vakcináciu proti hepatitíde A a B.
Je nutné, aby sa pri každom podaní Haemate P zaznamenal dátum podania, číslo šarže a množstvo podaného lieku, aby sa udržiavali záznamy o použitých šaržách.
Iné lieky a Haemate P
· Ak teraz používate alebo ste v poslednom čase používali, či práve budete používať ďalšie lieky, povedzte to svojmu lekárovi alebo lekárnikovi.
· Haemate P sa nesmie miešať s inými liekmi, riedidlami a rozpúšťadlami.
Tehotenstvo, dojčenie a plodnosť · Ak ste tehotná alebo dojčíte, poraďte sa so svojím lekárom alebo lekárnikom skôr ako začnete užívať akýkoľvek liek.
· Pretože sa u žien hemofília A vyskytuje zriedkavo, nie sú dostupné skúsenosti s užívaním faktora VIII počas tehotenstva a dojčenia.
· Čo sa týka von Willebrandovej choroby, ženy sú dokonca viacej ohrozené ako muži v dôsledku ďalších rizík krvácania ako sú menštruácia, tehotenstvo, námaha, pôrod a gynekologické komplikácie. Na základe postmarketingových skúseností môže byť pri prevencii a liečbe akútnych krvácaní doporučené nahradenie pomocou VWF. Pre substitučnú liečbu s VWF u tehotných alebo dojčiacich žien nie sú dostupné žiadne klinické štúdie.
· Počas tehotenstva a dojčenia by sa mal Haemate P podávať iba vtedy, keď je jednoznačne indikovaný.
Vedenie vozidiel a obsluha strojov
Haemate P nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Haemate P obsahuje sodík
Haemate P obsahuje do 35 mg sodíka na 500 IU. Prosím, rátajte s tým, keď máte diétu s nízkym obsahom sodíka.
3. Ako používať Haemate P
Liečbu má začať a viesť lekár, ktorý ma skúsenosti s týmto typom ochorenia.
DávkovanieMnožstvo von Willebrandovho faktora a faktora VIII, ktoré potrebujete, a doba liečby budú závisieť na viacerých faktoroch ako sú Vaša telesná hmotnosť, závažnosť vašej choroby, miesta a intenzity krvácania, alebo od potreby zabrániť krvácaniu počas operácie alebo vyšetrenia (pozri časť „
Nasledujúca informácia je určená len pre lekárov a zdravotníckych pracovníkov”). Ak vám bol Haemate P predpísaný na domáce používanie, váš lekár vám poskytne informácie, akým spôsobom si podávať injekcie a aké množstvo lieku užívať.
Dodržujte pokyny vášho lekára alebo zdravotnej sestry z centra pre liečbu hemofílie.Ak použijete viac Haemate P, ako máte Neboli hlásené žiadne príznaky predávkovania VWF a FVIII. Napriek tomu riziko tvorby krvných zrazenín (trombózy) nemôže byť vylúčené v prípade závažného predávkovania, najmä liekmi s obsahom VWF ako liečiva, ktoré obsahujú veľké množstvo FVIII.
Rekonštitúcia a aplikáciaVšeobecné pokyny:· Prášok musí byť zmiešaný (rekonštituovaný) s rozpúšťadlom (tekutinou) a natiahnutý z injekčnej liekovky v aseptických podmienkach.
· Roztok by mal byť číry alebo slabo opalizujúci. Po filtrácii/natiahnutí (pozri ďalej) sa rekonštituovaný liek pred aplikáciou vizuálne skontroluje, či neobsahuje častice alebo zmenu sfarbenia. Aj v prípade presného dodržiavania postupu rozpúšťania prášku je možné pozorovať niekoľko vločiek alebo častíc. Tieto čiastočky sa úplne odstránia filtrom, ktorý je súčasťou Mix2Vial zariadenia. Filtrácia nemá vplyv na vypočítané dávky.
· Nepoužívajte viditeľne zakalené roztoky alebo roztoky, ktoré po filtrácii ešte obsahujú vločky alebo častice.
· Po aplikácii sa nepoužitý liek alebo odpadový materiál musia znehodnotiť v súlade s národnými požiadavkami a podľa pokynov vášho lekára.
RekonštitúciaZohrejte neotvorené liekovky s Haemate P a rozpúšťadlom na teplotu miestnosti. Toto môžete urobiť buď udržiavaním liekoviek pri teplote miestnosti približne 1 hodinu, alebo podržaním liekoviek v rukách na niekoľko minút. Liekovky
nesmiete vystaviť priamemu zdroju tepla. Liekovky nesmú byť zohriate na teplotu prevyšujúcu teplotu ľudského tela (37 °C).
Opatrne odstráňte ochranné viečka z liekoviek obsahujúcich prášok a rozpúšťadlo, očistite odkryté gumové zátky obidvoch liekoviek jedným tampónom napusteným alkoholom a nechajte zaschnúť. Teraz môže byť rozpúšťadlo prenesené na substanciu pomocou pripojeného setu Mix2Vial. Prosím, postupujte podľa pokynov uvedených ďalej.
 1 1
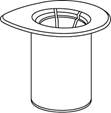
| 1. Otvorte Mix2Vial balenie vyklopením viečka. Nevyťahujte Mix2Vial liekovku z blistra!
|
 2 2
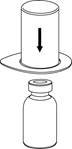
| 2. Postavte injekčnú liekovku s rozpúšťadlom na rovný a čistý povrch a pevne ju držte. Uchopte Mix2Vial spoločne s blistrom a zatlačte hrot konca modrého adaptéru priamo dole cez zátku liekovky s rozpúšťadlom.
|
 3 3
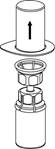
| 3. Opatrne odstráňte blister zo súpravy Mix2Vial tak, že ho držíte za okraj a ťaháte zvislo hore. Presvedčte sa, že ste vytiahli iba blistrový obal a nie Mix2Vial súpravu.
|
 4 4
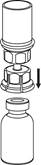
| 4. Postavte injekčnú liekovku s liekom na rovný a tvrdý povrch. Obráťte liekovku s rozpúšťadlom a pripojeným setom Mix2Vial a zatlačte hrot priehľadného konca adaptéra rovno dole cez zátku injekčnej liekovky s liekom. Rozpúšťadlo sa automaticky nasaje do liekovky s liekom.
|
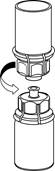 5 5
| 5. Uchopte jednou rukou časť setu uchytenú na liekovke s liekom a druhou rukou časť setu uchytenú na liekovke s rozpúšťadlom a odskrutkujte set opatrne na dve časti, aby sa zabránilo nadmernej tvorbe peny pri rozpúšťaní lieku.
Odstráňte injekčnú liekovku s rozpúšťadlom a pripojeným modrým adaptérom Mix2Vial setu.
|
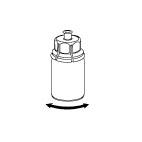 6 6
| 6. Jemne otáčajte injekčnú liekovku s pripojeným priehľadným adaptérom kým sa liek úplne nerozpustí. Netrepte.
|
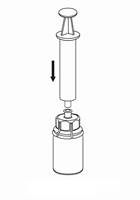 7 7
| 7. Nasajte vzduch do prázdnej sterilnej injekčnej striekačky. Kým je liekovka s liekom postavená dnom dole, spojte injekčnú striekačku s nástavcom Mix2Vial Luer Lock a vstreknite vzduch do liekovky s liekom.
|
Natiahnutie a aplikácia  8 8
| 8. Obráťte systém hore dnom a súčasne držte piest striekačky stlačený. Natiahnite roztok pomaly do striekačky vyťahovaním piestu.
|
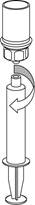 9 9
| 9. Po natiahnutí roztoku do striekačky, uchopte pevne valec striekačky (piest smeruje stále dole) a odpojte priehľadný adaptér Mix2Vial setu od striekačky.
|
AplikáciaNa injekciu Haemate P je vhodné použiť jednorazové plastové injekčné striekačky, pretože roztoky tohto typu majú tendenciu priľnúť k zabrúsenému sklenenému povrchu, ktorý majú všetky sklenené injekčné striekačky.
Rekonštituovaný roztok by sa mal podávať pomaly do žily rýchlosťou nie vyššou ako 4 ml za minútu. Ubezpečte sa, že do naplnenej injekčnej striekačky neprenikla krv. Liek natiahnutý do striekačky sa má použiť okamžite.
Ak je potrebné podávať väčšie dávky faktora, môžu sa podávať tiež infúziou. Pre tento účel je treba previesť rekonštituovaný produkt do schváleného infúzneho systému. Infúziu vykonajte podľa pokynov vášho lekára.
Pozorujte sa, či sa u vás nevyskytne akákoľvek okamžitá reakcia. Ak sa vyskytne akákoľvek reakcia, ktorá môže súvisieť s podaním Haemate P, infúziu/injekciu musíte prerušiť (pozri tiež časť 2).
Ak máte ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo lekárnika.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj Haemate P môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Nasledujúce vedľajšie účinky boli pozorované veľmi zriedkavo (u menej ako 1 z 10 000 pacientov):
·
Náhla alergická reakcia (napríklad opuch, pálenie a štípanie v mieste infúzie, návaly chladu alebo tepla, svrbenie rozšírené po celom tele, bolesť hlavy, žihľavka, pokles krvného tlaku, malátnosť, napínanie, nepokoj, zrýchlenie srdcovej činnosti, pocit tiesne na hrudníku, svrbenie, vracanie, sipot) boli pozorované veľmi zriedkavo, avšak tieto príznaky v niektorých prípadoch môžu predstavovať príznaky anafylaktické reakcie (vrátane šoku).
·
Zvýšenie telesnej teploty (horúčka).
Von Willebrandova choroba·
Riziko trombotických / tromboembolických príhod vrátane krvnej zrazeniny v pľúcach (riziko vzniku a putovanie krvných zrazenín do tepnového / žilného systému s možným dopadom na orgány je veľmi nízke).
· Trvale nadmerné hladiny FVIII:C v plazme u pacientov, ktorí dostávajú lieky s VWF, môžu viesť k zvýšenému riziku tvorby krvných zrazenín (pozri tiež časť 2).
· U pacientov s von Willebrandovou chorobou sa môžu veľmi zriedkavo vytvárať inhibítory VWF (neutralizačné protilátky). Pokiaľ sa také inhibítory vyskytnú, prejaví sa to nedostatočnou klinickou odpoveďou, s možnými prejavmi krvácania. K tomu dochádza najmä u pacientov so zvláštnou formou von Willebrandovej choroby, takzvaným typom 3. Tieto protilátky sú precipitačné a môžu sa vyskytnúť v sprievode s anafylaktickými reakciami. Z toho dôvodu pacienti, ktorí trpia práve anafylaktickou reakciou, by mali byť vyšetrení na prítomnosť inhibítora. V takých prípadoch sa odporúča kontaktovať špecializované centrum pre liečbu hemofílie.
Hemofília A· Veľmi zriedkavo sa u vás môžu tvoriť inhibítory (neutralizačné protilátky) proti faktoru VIII. Ich prítomnosť v tele sa prejaví ako nedostatočná klinická odpoveď vedúca k permanentnému krvácaniu. V takých prípadoch sa odporúča kontaktovať špecializované centrum pre liečbu hemofílie.
Vedľajšie účinky u detí a dospievajúcich
Očakáva sa, že frekvencia, typ a závažnosť nežiaducich účinkov u detí je rovnaká ako u dospelých .
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo lekárnika. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa. Vedľajšie účinky môžete hlásiť aj priamo prostredníctvom národného systému hlásenia uvedeného v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať Haemate P
·
Tento liek uchovávajte mimo dohľadu a dosahu detí. · Nepoužívajte Haemate P po dátume exspirácie, ktorý je uvedený na štítku a na škatuľke.
· Uchovávajte pri teplote neprevyšujúcej 25 °C.
· Neuchovávajte v mrazničke.
· Uchovávajte injekčnú liekovku v škatuľke na ochranu pred svetlom.
· Haemate P neobsahuje konzervačné látky, preto sa má pripravený roztok použiť okamžite pokiaľ je to možné.
· Ak pripravený roztok nie je podaný okamžite, musí sa použiť do 8 hodín.
· Liek natiahnutý do striekačky sa má použiť okamžite.
6. Obsah balenia a ďalšie informácie
Čo Haemate P obsahujeLiečivá sú:ľudský von Willebrandov faktor a ľudský koagulačný faktor VIII
Ďalšie zložky sú:ľudský albumín, kyselina aminooctová, chlorid sodný, trinátriumcitrát, hydroxid sodný alebo kyselina chlorovodíková (v malých množstvách pre úpravu pH)
Rozpúšťadlo: Voda na injekciu
Ako vyzerá Haemate P a obsah baleniaHaemate P je vo forme bieleho prášku a je dodávaný s vodou na injekciu ako rozpúšťadlom. Pripravený roztok má byť číry až slabo opalizujúci, to znamená, že môže drobnými čiastočkami rozptýliť svetlo, avšak nesmie obsahovať žiadne viditeľné častice.
Obsah baleniaBalenie s 250 IU obsahuje:1 injekčnú liekovku s práškom
1 injekčnú liekovku s 5 ml vody na injekciu
Jedna aplikačná súprava obsahuje:
- 1 filtračnú prenosovú súpravu 20/20
- 1 jednorazovú 5 ml injekčnú striekačku
- 1 súpravu na podanie do žily
- 2 alkoholové tampóny
- 1 nesterilnú náplasť
Balenie s 500 IU obsahuje:1 injekčnú liekovku s práškom
1 injekčnú liekovku s 10 ml vody na injekciu'
Jedna aplikačná súprava obsahuje:
- 1 filtračnú prenosovú súpravu 20/20
- 1 jednorazovú 10 ml injekčnú striekačku
- 1 súpravu na podanie do žily
- 2 alkoholové tampóny
- 1 nesterilnú náplasť
Balenie s 1000 IU obsahuje:1 injekčnú liekovku s práškom
1 injekčnú liekovku s 15 ml vody na injekciu
Jedna aplikačná súprava obsahuje:
- 1 filtračnú prenosovú súpravu 20/20
- 1 jednorazovú 20 ml injekčnú striekačku
- 1 súpravu na podanie do žily
- 2 alkoholové tampóny
- 1 nesterilnú náplasť
Držiteľ rozhodnutia o registrácii a výrobca
CSL Behring GmbH
Emil-von-Behring-Straße 76
35041 Marburg
Nemecko
Táto písomná informácia pre používateľa bola naposledy aktualizovaná
v novembri 2014.Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
Dávkovanievon Willebrandova choroba: Všeobecne, 1 IU/kg VWF:RCo zvýši hladinu VWF:RCo v obehu o 0,02 IU/ml (2 %).
Mala by sa dosiahnuť hladina VWF:RCo > 0,6 IU/ml (60 %) a hladina FVIII:C >0,4 IU/ml (40 %).
Na dosiahnutie hemostázy sa zvyčajne odporúča 40 - 80 IU/kg von Willebrandovho faktora (VWF:RCo) a 20 - 40 IU/kg FVIII:C telesnej hmotnosti.
Úvodná dávka von Willebrandovho faktora by mala byť 80 IU/kg, najmä u pacientov s typom 3 von Willebrandovej choroby, kde sa na udržanie adekvátnych hladín požadujú väčšie dávky, ako u iných typov von Willebrandovej choroby.
Prevencia hemorágie v prípade chirurgického zákroku alebo vážnej traumy:
Na prevenciu masívneho krvácania počas alebo po chirurgickom zákroku má sa injekcia podať 1 alebo 2 hodiny pred chirurgickým zákrokom.
Príslušná dávka sa má podávať každých 12 - 24 hodín. Dávka a doba liečby závisí na klinickom stave pacienta, na type a závažnosti krvácania a na hladinách oboch faktorov VWF:RCo a FVIII:C.
Pri používaní lieku obsahujúceho ako liečivo VWF, mal by si byť ošetrujúci lekár vedomý, že pokračujúca liečba môže spôsobiť nadmerný vzostup hladín FVIII:C. Po 24 - 48 hodinách liečby by sa malo zvážiť zníženie dávok a/alebo predĺženie intervalu medzi dávkami tak, aby sa zabránilo nekontrolovanému vzostupu FVIII:C.
Pediatrická populácia
Dávkovanie pre deti závisí od telesnej hmotnosti, a preto je odvodené od rovnakých pravidiel ako pre dospelých. Frekvencia podania v individuálnych prípadoch by mala byť zameraná na klinický účinok.
Hemofília ADávkovanie a dĺžka substitučnej terapie závisí od závažnosti deficitu faktora VIII, od miesta a rozsahu krvácania a od klinického stavu pacienta.
Počet podaných jednotiek faktora VIII sa vyjadruje v medzinárodných jednotkách (IU), ktoré sú stanovené oproti súčasnému štandardu WHO pre lieky obsahujúce faktor VIII. Aktivita faktora VIII v plazme sa vyjadruje buď v percentách (vzhľadom k normálnej ľudskej plazme) alebo v IU (vzhľadom k medzinárodnému štandardu pre faktor VIII v plazme).
1 IU aktivity faktora VIII zodpovedá množstvu faktora VIII v l ml normálnej ľudskej plazmy.
Požadovaná liečba
Výpočet požadovanej dávky faktora VIII vychádza z empirického predpokladu, že podanie 1 IU faktora VIII na kg telesnej hmotnosti zvýši aktivitu faktora VIII v plazme asi o 2 % (2 IU/dl) normálnej aktivity. Požadovaná dávka sa stanoví podľa nasledujúceho vzorca:
Požadované jednotky = telesná hmotnosť (kg) x požadovaný vzostup FVIII (% alebo IU/dl) x 0,5Množstvo, ktoré sa má podať, a frekvencia podávania má vždy smerovať ku klinickej účinnosti v individuálnom prípade.
V prípade nasledujúcich hemoragických príhod aktivita faktora VIII nemá počas zodpovedajúceho obdobia klesnúť pod stanovenú hladinu plazmatickej aktivity (v % normálu alebo IU/dl).
Nasledujúca tabuľka môže byť použitá ako návod pre stanovenie dávky pri hemoragických príhodách a chirurgických výkonoch:
Stupeň krvácania/
Typ chirurgického výkonu
| Požadovaná hladina
faktora VIII (% alebo IU/dl)
| Frekvencia dávkovania (hodiny)/ Dĺžka trvania terapie (dni)
|
Krvácanie
|
|
|
Začínajúca hemartróza, krvácanie do svalstva alebo do ústnej dutiny
| 20 - 40
| Infúziu opakovať každých 12 -24 hodín. Najmenej 1 deň, kým sa krvácanie nezastaví, čo sa prejaví ústupom bolestí alebo zahojením.
|
Rozsiahlejšia hemartróza , krvácanie do svalstva alebo hematóm
| 30 - 60
| Infúziu opakovať každých 12 – 24 hodín , počas 3 – 4 alebo viacerých dní, kým bolesť a akútna slabosť neustúpi
|
Život ohrozujúce krvácanie
| 60 – 100
| Infúziu opakovať každých 8 – 24 hodín až kým nepominie ohrozenie života
|
Chirurgické výkony
|
|
|
Menší chirurgický výkon vrátane extrakcie zubov
| 30 - 60
| Každých 24 hodín, najmenej 1 deň, až do zahojenia.
|
Veľké chirurgické výkony
| 80 – 100
(pred a po operácii)
| Infúziu opakovať každých 8 – 24 hodín, pokiaľ nedôjde k uspokojivému zahojeniu rany, potom pokračovať v liečbe najmenej 7 dní a udržiavať aktivitu faktora VIII medzi 30 % – 60 % (IU/dl).
|
Profylaxia
Na dlhodobú profylaxiu krvácania u pacientov s ťažkou hemofíliou A sa zvyčajne odporúčajú dávky faktora VIII 20 – 40 IU na kg telesnej hmotnosti v intervaloch 2 – 3 dni. V niektorých prípadoch, obzvlášť u mladších pacientov, môže byť potrebné podávať liek v kratších intervaloch alebo vo vyšších dávkach.
V priebehu liečby sa odporúča stanovovať hladiny faktora VIII, aby sa prispôsobila veľkosť dávky, ktorá má byť podaná, a frekvencia opakovania infúzií. Predovšetkým v prípade väčších chirurgických výkonov je nevyhnutné presné monitorovanie substitučnej liečby prostredníctvom koagulačnej analýzy (aktivity plazmatického faktora VIII). U jednotlivých pacientov môže byť odpoveď na liečbu faktorom VIII rozdielna, v závislosti od rôzneho faktora VIII
in vivo a rôzneho biologického polčasu.
U pacientov sa má monitorovať, či nedochádza k tvorbe inhibítorov faktora VIII. (pozri tiež časť 2).
Pacienti predtým neliečení
V súčasnosti nie sú údaje o bezpečnosti a účinnosti Haemate u predtým neliečených pacientov.
Pediatrická populácia
Nie sú k dispozícii žiadne údaje z klinických štúdií týkajúcich sa dávkovania Haemate P u detí.
Špeciálne upozornenia a opatrenia pre použitiePri používaní liečivého prípravku obsahujúceho ako liečivo VWF, by si mal byť ošetrujúci lekár vedomý, že pokračujúca liečba môže spôsobiť nadmerný vzostup hladín FVIII:C. Pacienti, ktorí dostávajú lieky s VWF ako liečivom a obsahujúce FVIII, by mali byť monitorovaní, aby sa zamedzilo výskytu trvale nadmerných hladín FVIII:C, čo by mohlo viesť k zvýšeniu rizika trombotických príhod. Súčasne by sa malo zvážiť zavedenie protitrombotických opatrení.
Nežiaduce účinkyVšetci pacienti by mali v prípadoch, kedy je potrebné podávať veľmi vysoké alebo často opakované dávky, alebo kedy sú prítomné inhibítory, alebo keď sú v predoperačnej alebo pooperačnej starostlivosti, byť sledovaní, či sa u nich vyskytnú príznaky hypervolémie. Okrem toho pacienti s krvnými skupinami A, B a AB majú byť sledovaní kvôli možným príznakom intravaskulárnej hemolýzy a/alebo poklesu hodnôt hematokrítu.