ácaní sa odporúča dávka 50 až 75 U FEIBY 50 U/ml/kg telesnej hmotnosti v 12-hodinových intervaloch. V liečbe sa má pokračovať, pokým sa neobjavia jasné znaky zlepšenia klinického stavu, ako napríklad zmiernenie bolesti, zmenšenie opuchu alebo zvýšenie hybnosti kĺbu.
Pri závažnom krvácaní do svalov a mäkkých tkanív, akým je krvácanie do retroperitoneálneho priestoru sa odporúča dávka 100 U/kg telesnej hmotnosti v 12-hodinových intervaloch.
Slizničné krvácanieOdporúča sa dávka 50 U/kg telesnej hmotnosti každých 6 hodín za starostlivého sledovania pacienta (vizuálna kontrola krvácania, opakované stanovenie hodnoty hematokritu). Ak nedôjde k zastaveniu krvácania, dávka sa môže zvýšiť na 100 U/kg telesnej hmotnosti, nesmie sa však prekročiť denná dávka 200 U/kg telesnej hmotnosti.
Iné závažné krvácaniaPri závažnom krvácaní, akým je krvácanie do CNS, sa odporúča dávka 100 U/kg telesnej hmotnosti v
12-hodinových intervaloch. V jednotlivých prípadoch sa FEIBA 50 U/ml môže podávať v 6-hodinových intervaloch, pokým sa nedosiahne jasné zlepšenie klinického stavu. (Nesmie sa prekročiť maximálna denná dávka 200 U/kg telesnej hmotnosti.)
2. Chirurgické zákrokyMá sa podávať dávka 50 ‑ 100 U/kg telesnej hmotnosti v 6-hodinových intervaloch, pričom sa nesmie prekročiť maximálna denná dávka.
3. Profylaxia · Profylaxia krvácania u pacientov s vysokým titrom inhibítora a s častým krvácaním, u ktorých nebola úspešná imunotolerančná liečba („immune tolerance induction“, ITI) alebo sa o nej neuvažuje:
Odporúča sa dávka 70 ‑ 100 U/ kg telesnej hmotnosti každý druhý deň. Táto dávka sa môže zvýšiť až na 100 U/ kg telesnej hmotnosti denne, ak pacient stále krváca, alebo sa môže postupne znížiť.
· Profylaxia krvácania u pacientov s vysokým titrom inhibítora, ktorí podstupujú ITI (imunotolerančnú liečbu):
FEIBA 50 U/ml sa môže podávať súbežne s koncentrátmi faktora VIII, v rozmedzí dávky od 50 do 100 U/kg telesnej hmotnosti dvakrát denne, až kým nedôjde k poklesu inhibítora faktora VIII na < 2 BU.*
* 1 Bethesda jednotka (Bethesda Unit, BU) je definovaná ako množstvo protilátok, ktoré inhibuje
50 % aktivity faktora VIII v čerstvej štandardnej ľudskej plazme po 2- hodinovej inkubácii pri teplote 37 °C.
4.2.2 Sledovanie liečbyAk nenastala adekvátna odpoveď na liečbu liekom FEIBA odporúča sa vyšetriť počet trombocytov, pretože za nevyhnutnú podmienku účinnosti lieku sa považuje dostatočný počet funkčne intaktných trombocytov.
Vzhľadom na komplexný mechanizmus účinku nie je k dispozícii žiadne priame monitorovanie účinných látok.
Koagulačné testy ako doba zrážania plnej krvi („whole blood clotting time“, WBCT), tromboelastogram (TEG, r-hodnota) a aPPT sú zvyčajne len mierne skrátené a nemusia korelovať s klinickým zlepšením.
Preto majú tieto testy len obmedzený význam pre hodnotenie liečby s FEIBA. Pozri časť 4.4.
4.2.3 Spôsob podávaniaFEIBA sa musí podávať intravenózne ako injekcia alebo infúzia. Rýchlosť podávania má zaistiť pohodlie pre pacienta a nemá prekročiť 2 U/kg telesnej hmotnosti za minútu.
4.3 Kontraindikácie Ak sú k dispozícii terapeutické alternatívy, FEIBA sa nesmie použiť v nasledujúcich situáciách :· Hypersenzivita na liečivú látku alebo na ktorúkoľvek zložku
· Diseminovaná intravaskulárna koagulácia (DIK)
· Akútna trombóza alebo embólia (vrátane infarktu myokardu)
Pozri časť 4.4.
4.4 Osobitné upozornenia a opatrenia pri používaníUPOZORNENIATromboembolické príhody:Počas liečby liekom FEIBA sa vyskytli tromboembolické príhody, ako je diseminovaná intravaskulárna koagulopatia (DIK), venózna trombóza, pľúcna embólia, infarkt myokardu a cievna mozgová príhoda.
Tieto príhody sa vyskytli po dávke vyššej ako maximálna denná dávka 200 U/kg telesnej hmotnosti alebo u pacientov s ďalšími rizikovými faktormi (vrátane DIK, pokročilá ateroskleróza, pomliaždeniny, septikémia) pre tromboembolické príhody. Súčasné liečenie s rekombinantným faktorom VIIa môže viesť k zvýšenému riziku vzniku tromboembolickej príhody. U pacientov s vrodenou alebo získanou hemofíliou je nutné vždy vziať do úvahy možnú prítomnosť týchto rizikových faktorov.
U pacientov s rizikom DIK, arteriálnej alebo venóznej trombózy sa FEIBA 50 U/ml používa obzvlášť opatrne. Pozri časť 4.3.
Pri prvých príznakoch alebo symptómoch tromboembolickej príhody sa musí podávanie infúzie okamžite ukončiť a musia sa zahájiť náležité diagnostické a liečebné opatrenia.
Celková jednotlivá dávka by nemala prekročiť 100 U/kg telesnej hmotnosti a maximálna denná dávka 200 U /kg telesnej hmotnosti, pokiaľ závažnosť krvácania neoprávňuje a neospravedlňuje použitie vyšších dávok. Ak sa liek podáva na zastavenie krvácania, má sa podávať len po dobu nevyhnutnú na dosiahnutie terapeutického cieľa.
Reakcie z precitlivenosti alergického typu:FEIBA môže vyvolať reakcie z precitlivenosti alergického typu, ako je urtikária, angioedém, gastrointestinálne prejavy, bronchospamus a hypotenzia; tieto reakcie môžu byť závažné a môžu byť systémové (napr. anafylaxia spojená s urtikáriou a angioedémom, bronchospazmus a cirkulačný šok). Takisto boli hlásené ďalšie reakcie na infúziu ako triaška, pyrexia a hypertenzia. Pri prvých príznakoch a symptómoch hypersenzitívnej reakcie sa podávanie infúzie musí zastaviť a začať náležitá liečba.
Pri zvažovaní opakovaného podania lieku FEIBA 50 U/ml pacientom so známou alebo predpokladanou precitlivenosťou na liečivú látku alebo na akúkoľvek inú zložku je nutné starostlivo posúdiť očakávaný prínos a riziká opakovaného podania, pričom je treba zohľadniť známy alebo predpokladaný typ precitlivenosti (alergický alebo nealergický), vrátane možných liečebných a/alebo preventívnych zásahov alebo alternatívnych terapeutických liečiv.
Monitorovanie liečbyNesmie sa prekročiť jednotlivá dávka 100 U/kg telesnej hmotnosti a denná dávka 200 U/kg telesnej hmotnosti. Pacienti dostavajúci viac než 100 U/kg telesnej hmotnosti musia byť starostlivo monitorovaní pre možné rozvinutie DIK a/alebo akútnej koronárnej ischémie. Vysoké dávky FEIBA sa majú podávať len po dobu nevyhnutne potrebnú k zastaveniu krvácania.
Ak nastanú významné zmeny krvného tlaku alebo tepovej frekvencie, alebo ak sa objavia dýchacie ťažkosti, kašeľ alebo bolesť na hrudi, musí byť podávanie infúzie okamžite ukončené a začaté vhodné diagnostické a liečebné opatrenia. Laboratórne parametre poukazujúce na DIK sú znížené hladiny fibrinogénu, zníženie počtu trombocytov a/alebo prítomnosť fibrín/fibrinogén degradačných produktov (FDP).
Získaná hemofíliaPacienti s hemofíliou s inhibítorom alebo pacienti so získanými inhibítormi koagulačných faktorov, ktorí sú liečení s FEIBA, môžu mať zvýšený sklon ku krvácaniu a v rovnakom čase zvýšené riziko trombózy.
Laboratórne testy a klinická účinnosťIn vitro testy ako je aPTT, doba zrážania plnej krvi (WBCT) a tromboelastogram (TEG) ako dôkaz účinnosti liečby nemusia korelovať s klinickým obrazom. Preto nemôžu byť úspešné pokusy normalizovať laboratórne hodnoty zvyšovaním dávky FEIBA a dokonca sa zásadne neodporúčajú, pretože pri predávkovaní hrozí spustenie DIK.
Význam počtu trombocytovAk je odpoveď na liečbu FEIBA nedostatočná, odporúča sa vyšetriť počet trombocytov, pretože pre účinnosť FEIBA je nevyhnutný dostatočný počet funkčne neporušených trombocytov.
Opatrenia na prevenciu prenosu infekčných agensovŠtandardné opatrenia na predchádzanie infekciám v dôsledku použitia liekov vyrobených z ľudskej krvi alebo plazmy zahŕňajú výber darcov, skríning jednotlivých odberov a zásob plazmy pre špecifické markery infekcie a zaradenie účinných výrobných krokov, ktoré inaktivujú/odstraňujú vírusy. Napriek tomu ak sa podávajú lieky z ľudskej krvi a plazmy, nemôže byť úplne vylúčená možnosť prenosu infekcie. To platí aj pre akékoľvek neznáme alebo novoobjavené vírusy alebo iné typy patogénov.
Tieto opatrenia sa považujú za efektívne pre obalené vírusy, ako je vírus ľudskej imunodeficiencie (HIV), vírus hepatitídy B (HBV) a hepatitídy C (HCV), a pre neobalený vírus hepatitídy A (HAV. Prijaté opatrenia môžu mať obmedzený účinok proti vírusom bez obalu, ako je parvovírus B19. Infekcia parvovírusom B19 môže byť závažná pre tehotné ženy (infekcia plodu) a pre jedincov s imunodeficienciou alebo zvýšenou tvorbou červených krviniek (napr. hemolytická anémia).
Dôrazne sa odporúča pri každom podní lieku FEIBA 50 U/ml zaznamenať názov a číslo šarže lieku, aby bolo možné spätne priradiť pacientovi šaržu lieku.
U pacientov, ktorí pravidelne/opakovane dostávajú lieky pripravené z ľudskej plazmy, vrátane FIEBA NF 50 U/ml, by sa malo zvážiť vhodné očkovanie (hepatitída A a B).
OPATRENIATromboembolické komplikácieV nasledujúcich situáciách sa FEIBA používa iba vtedy, ak sa neočakáva efekt liečby vhodnými koncentrátmi krvných koagulačných faktorov, napr. život ohrozujúce krvácanie alebo riziko krvácania (napr. poúrazové alebo pooperačné) v prípade vysokého titra inhibítora.
• Diseminovaná intravaskulárna koagulácia (DIK).
• Poškodenie pečene: Pacienti s poruchou funkcie pečene majú zvýšené riziko vzniku DIK vzhľadom
na oneskorené odstraňovanie aktivovaných koagulačných faktorov.
• Ischemická choroba srdca, akútna trombóza a / alebo embólia.
Rôzna odpoveď na „bypassing“ prípravkyVzhľadom na faktory špecifické pre daného pacienta sa môže jeho odpoveď na „bypassový“ prípravok rôzniť a pri danom krvácavom stave môže pacient na jeden typ reagovať a na druhý nie. Ak nedostatočne odpovedá na jeden typ „bypassového“ prípravku, má sa zvážiť podanie iného.
Anamnestické odpovedePodávanie lieku FEIBA pacientom s inhibítormi môže vyvolať úvodný „anamnestický“ vzostup hladín inhibítora. S pokračujúcim podávaním FEIBA môže inhibítor po čase klesnúť. Klinické a publikované údaje naznačujú, že účinnosť FEIBA nie je znížená.
Protilátky proti povrchovým antigénom hepatitídy B (anti HBsAg) a interpretácia vyšetreniaPo podaní vysokých dávok FEIBA, môže prechodný vzostup pasívne prenesených protilátok proti povrchovým antigénom vírusu hepatitídy B zapríčiniť chybnú pozitívnu interpretáciu výsledkov sérologického vyšetrenia.
Pediatrickí pacienti:
Kazuistiky a údaje z obmedzených klinických štúdií naznačujú, že FEIBA sa môže použiť u detí mladších ako 6 rokov.
Profylaktické použitieSú k dispozícii iba obmedzené klinické údaje o použití FEIBA na profylaxiu krvácania u hemofilikov.
Faktory brané do úvahy v súvislosti s pomocnou látkouFEIBA 50 U/ml obsahuje približne 4 mg sodíka (vypočítané množstvo) na 1 ml; to je približne 40 mg sodíka pre FEIBA 500 U, približne 80 mg sodíka (vypočítané množstvo) v jednom ml pri podani 1000 U FEIBA. Musí sa to zohľadniť u pacientov, ktorí majú diétu s nízkym obsahom sodíka.
4.5 Liekové a iné interakcieNeboli vykonané žiadne adekvátne a kontrolované štúdie s kombinovaným alebo sekvenčným podávaním FEIBA a rekombinantného faktora VIIa alebo antifibrinolytík.
Pri súčasnom podávaní FEIBA spolu s antifibrinolytikami, napr. s kyselinou tranexámovou a aminokaprónovou je potrebné zvážiť možnosť tromboembolickej príhody. Preto sa antifibrinolytiká nemajú podať skôr ako približne 6 až 12 hodín po podaní lieku FEIBA.
V súčasnom podaní rFVIIa sa podľa dostupných údajov in vitro v a klinických pozorovaní môžu vyskytnúť potenciálne liekové interakcie (čo môže viesť k nežiaducim účinkom, ako sú tromboembolické príhody).
4.6 Ferilita, gravidita a laktáciaNie sú žiadne adekvátne údaje o použití FEIBA 50 U/ml počas gravidity a laktácie.
Lekári musia vyvážiť potenciálne riziko a ordinovať liek FEIBA iba v nevyhnutných prípadoch, berúc do úvahy, že gravidita a popôrodné obdobie je spojené so zvýšeným rizikom tromboembolických príhod a že niektoré komplikácie gravidity sú spojené so zvýšeným rizikom DIK.
Reprodukčné štúdie na zvieratách s liekom FEIBA 50 U/ml neboli zrealizované a ani účinky lieku FEIBA na fertilitu neboli v kontrolovaných klinických pokusoch stanovené.
Pozri časť 4.4. informácia o infekcii parvovírusom B19.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNepozoroval sa žiadny vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinkyNežiaduce reakcie uvedené v tejto časti boli hlásené z postregistračného sledovania a pochádzajú z 2 štúdií s použitím lieku FEIBA na liečbu krvácavých epizód u pediatrických a dospelých pacientov s hemofíliou A alebo B a s inhibítormi faktorov VIII alebo IX. Jedna štúdia zahŕňa aj pacientov so získanou hemofíliou s inhibítorom faktora VIII (2 zo 49 pacientov).
Boli pridané aj údaje z tretej štúdie, ktorá porovnávala profylaxiu a liečbu “on-demand”.
Frekvencia podľa konvencií MedDRA:
veľmi časté ≥ 1/10
časté ≥ 1/100 až <1/10
menej časté ≥ 1/1,000 až <1/100
zriedkavé ≥ 1/10,000 až <1/1,000
veľmi zriedkavé < 1/10,000
neznáme (z dostupných údajov)
Nežiaduce reakcie z klinických štúdií
|
Trieda orgánových systémov (SOC)
| Výraz uprednostnený podľa MedDRA
| Frekvencia*
|
Poruchy krvi a lymfatického systému
| Diseminovaná intravaskulárna koagulácia (DIK)
Zvýšený titer inhibítora (anamnestická odpoveď)* a
| Neznáme
Neznáme
|
Poruchy imunitného systému
| hypersenzitivitac
Žihľavka
Anafylaktická reakcia
| Časté
Neznáme
Neznáme
|
Poruchy nervového systému
| Parestézia
Zníženie citlivosti
Trombotická cievna mozgová príhoda (CMP)
Embolická DMP
Bolesť hlavyc
Ospalosť*
Závratb
Skreslenie chuti*
| Neznáme
Neznáme
Neznáme
Neznáme
Časté
Neznáme
Časté
Neznáme
|
Poruchy srdca
srdcovej činnosti
| Infarkt myokardu
Tachykardia
| Neznáme
Neznáme
|
Poruchy ciev
| Trombóza
Arteriálna trombóza
Venózna trombóza
Embólia (tromboembolické komplikácie)
Hypotenziac
Hypertenzia
Začervenanie (Flush)
| Neznáme
Neznáme
Neznáme
Neznáme
Časté
Neznáme
Neznáme
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| Pľúcna embólia
Bronchospazmus
Dychčanie
Kašeľ
Dyspnoe*
| Neznáme
Neznáme
Neznáme
Neznáme
Neznáme
|
poruchy gastrointestinálneho traktu
| Vracanie
Hnačka
Brušná nevoľnosť
Nauzea*
| Neznáme
Neznáme
Neznáme
Neznáme
|
poruchy kože a podkožného tkaniva
| Znížená citlivosť tváre
Angioedém
Koprivka
Svrbenie
Vyrážka (rash)c
| Neznáme
Neznáme
Neznáme
Neznáme
Časté
|
celkové poruchy a reakcie v mieste podania
| Bolesť v mieste vpichu
Malátnosť
Pocit tepla, chladu
Triaška*
Pyrexia*
Bolesť na hrudníku*
Diskomfort na hrudníku*
| Neznáme
Neznáme
Neznáme
Neznáme
Neznáme
Neznáme
Neznáme
|
Laboratórne a funkčné vyšetrenia
| Pokles krvného tlaku
Pozitivita protilátok proti povrchovému antigénu hepatitídy Bc
| Neznáme
Časté
|
*presný odhad výskytu týchto nežiaducich reakcií nie je možný z dostupných údajov.
a Zvýšený titer inhibítora (anamnestická odpoveď) [výraz nie je uprednostnený podľa MedDRA] znamená vzostup už predtým prítomného titra inhibítora po podaní lieku FEIBA. Pozri časť 4.4 .
bNežiaduce účinky publikovné v pôvodných a preventívnych štúdiách. Uvádzaná frekvencia je iba z preventívnych štúdií.
cNežiaduce účinky publikované v preventívnych štúdiách. Uvádzaná frekvencia je z preventívnych štúdií.
Skupinové reakcieĎalšie príznaky reakcií z precitlivenosti na lieky vyrobené z ľudskej plazmy zahŕňajú letargiu a nepokoj.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovanieNiektoré hlásené tromboembolické príhody sa vyskytli po dávke vyššej ako maximálna denná dávka 200 U/kg telesnej hmotnosti.
Ak sa vyskytli príznaky alebo symptómy tromboembolickej príhody má sa podávanie infúzie ihneď zastaviť a majú sa zaviesť náležité diagnostické a terapeutické opatrenia. Pozri Časť 4.4 .
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: aktivovaný protrombínový komplex proti protilátkam faktora VIII
ATC kód
: B02BD03
Hoci bola FEIBA 50 U/ml vyvinutá začiatkom 70-tych rokov a jej aktivita obchádzajúca inhibítor faktora VIII bola preukázaná
in vitro aj
in vivo, jej účinná zložka je stále predmetom vedeckej diskusie. Posledné výskumy však naznačujú úlohu špecifických zložiek aktivovaného protrombínového komplexu, zymogénu protrombínu (FII) a aktivovaného faktora X (FXa) v mechanizme účinku FEIBA 50 U/ml.
5.2 Farmakokinetické vlastnostiKeďže FEIBA 50 U/ml sa skladá z rôznych koagulačných faktorov a jej jednotlivé zložky majú rôzny polčas, nie je možné urobiť definitívny záver týkajúci sa farmakokinetických vlastností FEIBY 50 U/ml.
5.3 Predklinické údaje o bezpečnostiŠtúdie akútnej toxicity sa zrealizovali na myšiach s funkčne vyradeným faktorom VIII a na normálnych myšiach a potkanoch s použitím dávok prevyšujúcich maximálnu dennú dávku odporúčanú pre ľudí (> 200 U/kg telesnej hmotnosti). Na ich základe je možné usúdiť, že vedľajšie účinky spojené s FEIBOU 50 U/ml sú hlavne dôsledkom hyperkoagulácie spôsobenej farmakologickými vlastnosťami.
Štúdie toxicity po opakovanom podávaní na zvieratách sú prakticky neuskutočniteľné vzhľadom na interferenciu s tvorbou protilátok proti heterológnym proteínom.
Nakoľko sa ľudské krvné koagulačné faktory nepovažujú za karcinogénne alebo mutagénne, nepokladalo sa za potrebné zrealizovať experimentálne štúdie na zvieratách, na heterológnych druhoch.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látok
Prášok:
Chlorid sodný
Nátriumcitrát dihydrát
Rozpúšťadlo: Voda na injekciu
6.2 InkompatibilityV súvislosti s liekom neboli vykonané žiadne štúdie kompatibility. Preto sa FEIBA 50 U/ml nesmie miešať s inými liekmi alebo rozpúšťadlami.
Pred a po podaní FEIBY 50 U/ml sa odporúča prepláchnuť centrálny žilový katéter vhodným roztokom, napr. izotonickým fyziologickým roztokom.'
Koagulačné faktory vyrobené z ľudskej plazmy sa môžu adsorbovať na vnútorný povrch určitých typov injekčných /infúznych pomôcok. Ak by sa tak stalo, mohlo by to spôsobiť zlyhanie liečby. Preto sa na podanie lieku FEIBA 50 U/ml môžu používať iba schválené infúzne pomôcky.
6.3 Čas použiteľnostiDva roky.
Chemická a fyzikálna stabilita pripraveného roztoku je preukázaná 3 hodiny pri teplote 20 °C až 25 °C.
Z mikrobiologického hľadiska sa má FEIBA 50 U/ml použiť ihneď po rozpustení prášku.
Ak sa roztok pripravený na použitie nepodá okamžite, za podmienky a čas uchovávania je zodpovedný používateľ.
Roztok pripravený na použitie sa nesmie uchovávať v chladničke.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25 °C. Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu obsahu pred svetlom.
6.5 Druh obalu a obsah baleniaFEIBA 50 U/ml prášok a rozpúšťadlo sa dodávajú v injekčných liekovkách (injekčná liekovka s práškom: sklo hydrolytického typu I pre 500 U a hydrolytický typ II pre 1000 U;
injekčná liekovka s rozpúšťadlom: sklo hydrolytického typu I pre 10 ml a 20 ml) uzavretých butylkaučukovou zátkou a ochranným viečkom.
FEIBA 50 U/ml je dostupná v nasledujúcich formách balení:
1 x 500 U
1 x 1000 U
Balenie 500 U alebo 1000 U obsahuje:
1 injekčnú liekovku s FEIBOU 50 U/ml (500 U/ 1000 U) ‑ prášok na prípravu roztoku na intravenózne
podanie
1 injekčnú liekovku uzavretú gumovou zátkou s 10 ml / 20 ml vody na injekciu
1 jednorazovú injekčnú striekačku
1 jednorazovú ihlu
1 krídelkovú ihlu so spojkou (infúznu súpravu s krídlovým adaptérom)
1 ihlu s filtrom
1 obojstrannú ihlu
1 odvzdušňovaciu ihlu
alebo
1 injekčnú liekovku s FEIBOU 50 U/ml (500 U/ 1000 U) ‑ prášok na prípravu roztoku na intravenózne
podanie
1 injekčnú liekovku uzavretú gumovou zátkou s 10 ml / 20 ml vody na injekciu
1 Baxject II Hi-Flow - Bezihlová prenosová pomôcka určená na prenos a zmiešanie liekov obsiahnutých
v dvoch injekčných liekovkách do injekčnej striekačky
1 jednorazovú injekčnú striekačku
1 jednorazovú ihlu
1 krídelkovú ihlu so spojkou (infúznu súpravu s krídlovým adaptérom)
Nie všetky balenia môžu byť dostupné na trhu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomNa prípravu roztoku FEIBY 50 U/ml použite iba sterilnú vodu na injekciu a pomôcku na rekonštitúciu poskytnutú v balení. Počas celej prípravy používajte aseptickú techniku.
Prášok FEIBY 50 U/ml sa má rekonštituovať až tesne pred podaním. Potom sa má roztok použiť okamžite (roztok neobsahuje konzervačné látky).
Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že FEIBA 50 U/ml je úplne rozpustená, inak prejde menej aktívnej látky cez filter pomôcky.
Po rekonštitúcii pred podaním sa má roztok skontrolovať na obsah častíc alebo zmenu farby. Nepoužívajte roztoky, ktoré sú zakalené alebo obsahujú usadeniny.
Nepoužívajte, ak je bezihlová prenosová pomôcka (t.j. BAXJECT II Hi-Flow) alebo obojstranná ihla, jej systém sterilnej bariéry alebo jej obal poškodený alebo ukazuje akýkoľvek znak znehodnotenia.
Ak sa použijú iné zariadenia ako tie, ktoré sú dodávané s FEIBA, zabezpečte použitie adekvátneho filtra s veľkosťou pórov aspoň 149 µm.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Rekonštitúcia prášku na injekčný roztok s použitím pomôcky BAXJECT II Hi-Flow:1. Zohrejte injekčnú liekovku s rozpúšťadlom (vodou na injekciu) na teplotu miestnosti (15 °C ‑ 25 °C), napr. ponorením do vodného kúpeľa na niekoľko minút (na max. +37 °C), ak je to potrebné.
2. Odstráňte ochranné viečko z injekčnej liekovky s FEIBOU 50 U/ml a z injekčnej liekovky s rozpúšťadlom a očistite gumové zátky obidvoch injekčných liekoviek. Injekčné liekovky umiestnite na rovný povrch.
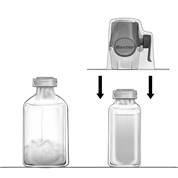
3. Otvorte balenie pomôcky BAXJECT II Hi-Flow odtrhnutím papierového viečka bez toho, aby ste sa dotkli vnútrajška (obr. a). Nevyberajte pomôcku z balenia.
4. Otočte balenie nahor a prepichnite zátku injekčnej liekovky s rozpúšťadlom čírym plastovým bodcom (obr. b). Uchopte balenie za jeho okraj a stiahnite balenie z BAXJECTu II Hi-Flow (obr. c). Neodstraňujte modré viečko z pomôcky BAXJECT II Hi-Flow.
5. S BAXJECTom II Hi-Flow pripevneným na injekčnú liekovku s rozpúšťadlom obráťte systém tak, aby bola injekčná liekovka s rozpúšťadlom navrchu. Purpurovým plastovým bodcom prepichnite zátku injekčnej liekovky s FEIBOU 50 U/ml Vákuum nasaje rozpúšťadlo do injekčnej liekovky s FEIBOU 50 U/ml (obr. d).
6. Jemne rozvírte, ale nepretrepávajte, kým sa všetka látka nerozpustí. Uistite sa, že FEIBA 50 U/ml je úplne rozpustená, inak neprejde aktívna látka cez filter pomôcky.
Obrázok a
| Obrázok b
| Obrázok c
|

| 
| 
|
Návod na injekciu/infúziu:
1.Odstráňte modré viečko z BAXJECTu II Hi-Flow. Vezmite injekčnú striekačku a pevne ju pripojte k BAXJECTu II Hi-Flow (Nenasajte vzduch do injekčnej striekačky) (obr. e). Na zabezpečenie pevného spojenia striekačky s BAXJECTom II Hi-Flow sa odporúča použiť striekačku so systémom luer lock (otočte striekačkou v smere hodinových ručičiek, kým nebude pevne nasadená).
2.Prevráťte systém tak, aby rozpustený liek bol hore. Natiahnite roztok FEIBY 50 U/ml do injekčnej striekačky POMALÝM potiahnutím piestu smerom dozadu a uistite sa, že počas natiahnutia je pevné spojenie medzi striekačkou a BAXJECTom II Hi-Flow (obr. f).
3.Odpojte injekčnú striekačku.
4.Ak je roztok v striekačke napenený, počkajte, kým pena opadne. Roztok podávajte pomaly intravenózne cez infúznu súpravu s krídlovým adaptérom (alebo cez jednorazovú ihlu).
Obrázok d
| Obrázok e
| Obrázok f
|

| 
| 
|
Neprekročte rýchlosť podávania injekcie 2 U FEIBY 50 U/ml/kg telesnej hmotnosti za minútu.Rekonštitúcia prášku na injekčný roztok s použitím obojstrannej ihly:1. Zohrejte neotvorenú injekčnú liekovku s rozpúšťadlom (vodou na injekciu) na teplotu miestnosti, napr. ponorením do sterilného vodného kúpeľa, v ktorom sa zohreje v priebehu niekoľkých minút (na max. +37 °C), ak je to potrebné.
2. Odstráňte ochranné viečko z injekčnej liekovky s práškom a z injekčnej liekovky s rozpúšťadlom (obr. A) a očistite gumové zátky obidvoch injekčných liekoviek.
3. Odstráňte ochranný kryt z jedného konca pribalenej obojstrannej ihly tak, že ho otočíte a potiahnete (obr. B). Odokrytým koncom ihly prepichnite gumovú zátku injekčnej liekovky s rozpúšťadlom (obr. C).
4. Odstráňte ochranný kryt z druhého konca obojstrannej ihly a dávajte pozor, aby ste sa nedotkli odkrytého konca.
5. Obráťte injekčnú liekovku s rozpúšťadlom nad injekčnú liekovku s práškom a voľným koncom obojstrannej ihly prepichnite gumovú zátku injekčnej liekovky s práškom (obr. D). Vákuum v injekčnej liekovke s práškom nasaje rozpúšťadlo.
6. Oddeľte obidve injekčné liekovky tak, že vytiahnete ihlu z injekčnej liekovky s práškom (obr. E). Injekčnú liekovku s práškom jemne pretrepte alebo premiešajte krúživým pohybom, aby sa urýchlilo rozpustenie prášku.
7. Po úplnom rozpustení prášku zapichnite pribalenú odvzdušňovaciu ihlu (obr. F) a prípadná vzniknutá pena sa vytratí. Vytiahnite odvzdušňovaciu ihlu.
Injekcia/infúzia:1. Odstráňte ochranný kryt z pribalenej ihly s filtrom tak, že ho otočíte a potiahnete a nasaďte ihlu na sterilnú jednorazovú injekčnú striekačku. Natiahnite roztok do injekčnej striekačky (obr. G).
2. Odpojte ihlu s filtrom od injekčnej striekačky a roztok aplikujte pomaly intravenózne cez pribalenú infúznu súpravu s krídlovým adaptérom (alebo cez pribalenú jednorazovú ihlu).

 Obr. A Obr. B Obr. C Obr. D Obr. E Obr. F Obr. GNeprekročte rýchlosť podávania injekcie 2 U FEIBY 50 U/ml/kg telesnej hmotnosti za minútu.
Obr. A Obr. B Obr. C Obr. D Obr. E Obr. F Obr. GNeprekročte rýchlosť podávania injekcie 2 U FEIBY 50 U/ml/kg telesnej hmotnosti za minútu.Ak sa používajú iné pomôcky ako tie, ktoré sa dodávajú spolu s FEIBOU 50 U/ml, zaistite použitie vhodného filtra s veľkosťou pórov aspoň 149 µm.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBaxalta Innovations GmbH
Industriestrasse 67
A-1221 Viedeň
Rakúsko
8. REGISTRAČNÉ ČÍSLO 16/0225/13-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 05. mája 1980
Dátum posledného predĺženia registrácie: 25. novembra 2005
10. DÁTUM REVÍZIE TEXTUMáj 2020
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke www.sukl.sk