zenín v krvných cievach. To vedie k spotrebovaniu koagulačných faktorov v celom tele).
- Ak výsledky laboratórnych vyšetrení a/alebo klinické príznaky jednoznačne svedčia pre poškodenie pečene, kedy je zvýšené riziko vzniku DIK, pretože sa spomalene odbúravajú aktivované koagulačné faktory.
- Ak je prítomná ischemická choroba srdca, akútna trombóza a/alebo embólia.
FEIBA sa môže použiť iba v prípadoch život ohrozujúceho krvácania.
Upozornenia a opatrenia Pred podaním lieku FEIBA sa informujte u svojho lekára, pretože môže dôjsť k reakciám z precitlivenosti rovnako ako pri použití všetkých vnútrožilovo podávaných liekov pripravených z plazmy. Aby ste vedeli rozpoznať alergickú reakciu v čo najkratšom čase, musíte poznať možné včasné príznaky reakcie z precitlivenosti, akými sú
- erytém (začervenanie kože),
- kožná vyrážka,
- žihľavka (urtikária),
- svrbenie,
- opuch pier a jazyka,
- pískavé dýchanie,
- pocit zovretia hrudníka,
- celkový pocit choroby,
- závraty,
- náhly pokles krvného tlaku.
Ďalšími príznakmi reakcie z precitlivenosti na deriváty krvnej plazmy sú letargia a nepokoj.
Ak sa u vás vyskytne jeden alebo viacero z týchto príznakov, ihneď zastavte podávanie infúzie a skontaktujte sa so svojím lekárom. Uvedené príznaky môžu byť včasnými prejavmi anafylaktického šoku. Závažné príznaky vyžadujú okamžitú lekársku pomoc. Pacientom s predpokladanou precitlivenosťou na liek, alebo na ktorúkoľvek z jeho zložiek, podá lekár FEIBA znovu len po starostlivom posúdení očakávaného prínosu a rizika opakovaného podania a/alebo ak sa predpokladá, že nezareagujete na inú preventívnu liečbu alebo alternatívne lieky.
- ak sa u vás objavia výrazné zmeny krvného tlaku alebo tepovej frekvencie, ťažkosti s dýchaním, kašeľ alebo bolesť na hrudníku. Ihneď zastavte podávanie infúzie a skontaktujte sa so svojím lekárom. Váš lekár zaháji vhodné diagnostické a terapeutické opatrenia.
- Pacienti s hemofíliou s prítomnosťou inhibítorov alebo so získanými inhibítormi koagulačných faktorov. Počas liečby FEIBA môžu mať títo pacienti zvýšený sklon ku krvácaniu a v rovnakom čase zvýšené riziko trombózy.
Počas liečby liekom FEIBA sa vyskytli tromboembolické príhody, ako je diseminovaná intravaskulárna koagulopatia (DIK), žilová trombóza, pľúcna embólia, infarkt myokardu a mozgová mŕtvica. Niektoré tromboembolické príhody sa vyskytli pri podávaní vysokých dávok lieku FEIBA. Súčasné liečenie s rekombinantným faktorom VIIa môže viesť k zvýšenému riziku vzniku tromboembolickej príhody.
Keď sú lieky vyrábané z ľudskej kvi alebo plazmy, dodržiavajú sa určité opatrenia, aby sa zabránilo prenosu infekcií na pacientov. Tieto opatrenia zahŕňajú starostlivý výber darcov krvi a plazmy, aby sa zabezpečilo vylúčenie tých, ktorí môžu prenášať infekcie. Každá darovaná krv a poolovaná plazma sa vyšetruje na prítomnosť vírusov/infekcií. Výrobcovia týchto liekov zahŕňajú do procesu spracovania krvi a plazmy aj kroky na inaktiváciu (zneškodnenie), alebo odstránenie vírusov. Napriek týmto opatreniam, pri podávaní liekov, ktoré sú pripravené z ľudskej krvi alebo plazmy, nie je možné úplne vylúčiť možnosť prenosu infekcie. Platí to aj pre neznáme alebo novoobjavené vírusy alebo iné typy infekcií.
Tieto opatrenia sa považujú za efektívne pre obalené vírusy, ako je vírus ľudskej imunodeficiencie (HIV), vírus hepatitídy B a hepatitídy C, a pre neobalený vírus hepatitídy A . Prijaté opatrenia môžu mať obmedzený účinok proti vírusom bez obalu, ako je parvovírus B19. Infekcia parvovírusom B19 môže byť nebezpečná pre tehotné ženy (infekcia plodu) a pre jedincov s imunodeficienciou alebo zvýšenou tvorbou červených krviniek (napr. kosáčikovitá choroba alebo hemolytická anémia).
U pacientov, ktorým sa podávajú pravidelne alebo opakovane lieky s obsahom faktora VIII pripravené z ľudskej plazmy, treba zvážiť očkovanie (proti hepatitíde A a B).
Po podaní vysokých dávok FEIBA sa môže vyskytnúť prechodné zvýšenie pasívne prenesených protilátok proti povrchovému antigénu vírusu hepatitídy B (anti HBsAg), ktoré môže viesť k nesprávnej interpretácii pozitivity sérologického vyšetrenia.
Pri každom podaní dávky FEIBA sa dôrazne odporúča zaznamenať názov a číslo šarže lieku, aby sa zachoval záznam o použitých šaržách.
Iné lieky a FEIBA Ak užívate alebo ste v poslednom čase užívali ešte iné lieky, vrátane liekov, ktorých výdaj nie je viazaný na lekársky predpis, prosím, oznámte to svojmu lekárovi alebo lekárnikovi.
Neboli zrealizované žiadne adekvátne a dobre kontrolované štúdie s kombinovaným alebo sekvenčným podávaním FEIBA a rekombinantného Faktora VIIa alebo antifibrinolytík.
Pri súčasnom podávaní FEIBA spolu s antifibrinolytikami, napr. s kyselinou tranexámovou a aminokaprónovou je potrebné zvážiť možnosť zvýšeného rizika trombózy. Ak je liečba oboma liekmi nevyhnutná, medzi podaním týchto dvoch liekov sa musí dodržať časový odstup aspoň 6 - 12 hodín.
Podľa dostupných in vitro údajov a klinických pozorovaní pri súčasnom podávaní rFVIIa nie je možné vylúčiť liekové interakcie, ktoré môžu viesť k tromboembolickej príhode.
Tak ako všetky ostatné krvné koagulačné faktory, ani FEIBA sa pred podaním nesmie miešať s inými liekmi, keďže by to mohlo narušiť účinnosť a bezpečnosť lieku. Pred a po podaní FEIBY sa odporúča prepláchnuť žilový katéter fyziologickým roztokom.
Tehotenstvo, dojčenie a plodnosťVáš lekár rozhodne, či sa FEIBA môže použiť počas tehotenstva a dojčenia. Keďže počas tehotenstva existuje zvýšené riziko trombózy, FEIBA sa môže podávať iba pod prísnym lekárskym dohľadom a iba vtedy, ak je to úplne nevyhnutné.
Vedenie vozidiel a obsluha strojovNepozorovali sa žiadne účinky FEIBY na schopnosť viesť vozidlá a obsluhovať stroje.
Dôležité upozornenie o niektorých zložkách FEIBA FEIBA, 25 U/ml obsahuje približne 4 mg sodíka (vypočítane množstvo) na 1 ml, čo je približne 80 mg sodíka pri podaní veľkosti balenia 500 U.
FEIBA, 50 U/ml obsahuje približne 4 mg sodíka (vypočítane množstvo) na 1 ml, čo je približne 40 mg sodíka pri podaní veľkosti balenia 500 U (jednotiek), približne 80 mg sodíka pri podaní veľkosti balenia 1000 U.
Je dôležité venovať tomu pozornosť u pacientov na diéte s nízkym obsahom sodíka.
3. Ako používať FEIBU Rozpustite lyofilizovaný prášok FEIBY v pribalenom rozpúšťadle a roztok podajte vnútrožilovo.
Vždy používajte FEIBU presne tak, ako vám povedal váš lekár. Ak si niečím nie ste istý, overte si to u svojho lekára alebo lekárnika.
Potrebnú dávku a časové intervaly podávania vám individuálne určí váš lekár, a to po zohľadnení závažnosti poruchy zrážania krvi, miesta a rozsahu krvácania, vášho celkového zdravotného stavu a vašej reakcie na liek. Nemeňte si dávku, ktorú vám určil váš lekár a neprestaňte si podávať liek bez súhlasu lekára.
Ak máte dojem, že účinok FEIBY je príliš silný alebo príliš slabý, prosím povedzte to svojmu lekárovi alebo lekárnikovi.
Pred podaním zohrejte liek na teplotu miestnosti alebo teplotu tela, ak je to potrebné.
Prášok FEIBY sa má rozpustiť až tesne pred podaním. Potom sa má roztok použiť okamžite (liek neobsahuje konzervačné látky). Jemne rozvírte, kým sa všetka látka nerozpustí. Uistite sa, že FEIBA je úplne rozpustená, inak prejde menej jednotiek aktívnej látky cez filter pomôcky.
Roztoky, ktoré sú zakalené alebo obsahujú usadeniny, sa musia vhodným spôsobom zlikvidovať. Otvorené nádobky s roztokom nepoužívajte opakovane.
Použite iba pribalené rozpúšťadlo (sterilizovanú vodu na injekciu) a pomôcky na rozpustenie prášku.
Ak sa používajú iné pomôcky ako tie, ktoré sa dodávajú spolu s FEIBOU, zaistite použitie vhodného filtra s veľkosťou pórov aspoň 149 µm.
Nepoužívajte liek, ak je systém sterilnej bariéry alebo obal poškodený alebo má akýkoľvek znak znehodnotenia.
Zaznamenajte podanie lieku na pribalený samolepiaci štítok.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Pre podanie ihlouRozpustenie prášku na prípravu injekčného roztokuPočas celej prípravy používajte aseptickú (sterilnú) techniku.
1. Zohrejte neotvorenú injekčnú liekovku obsahujúcu rozpúšťadlo (vodu na injekciu) na teplotu miestnosti, napr. ponorením do sterilného vodného kúpeľa, v ktorom sa zohreje v priebehu niekoľkých minút (na max. +37 °C), ak je to potrebné.
2. Odstráňte ochranné viečko z injekčnej liekovky s práškom a z injekčnej liekovky s rozpúšťadlom a očistite gumové zátky obidvoch injekčných liekoviek (obr.A)
3. Odstráňte ochranný kryt z jedného konca pribalenej obojstrannej ihly tak, že ho otočíte a potiahnete (obr. B). Odokrytým koncom ihly prepichnite gumovú zátku injekčnej liekovky s rozpúšťadlom (obr. C).
4. Odstráňte ochranný kryt z druhého konca obojstrannej ihly a dávajte pozor, aby ste sa nedotkli odkrytého konca.
5. Obráťte injekčnú liekovku s rozpúšťadlom nad injekčnú liekovku s práškom a voľným koncom obojstrannej ihly prepichnite gumovú zátku injekčnej liekovky s práškom (obr. D). Rozpúšťadlo sa nasaje podtlakom (vákuom) v injekčnej liekovke s práškom.
6. Oddeľte obidve injekčné liekovky tak, že vytiahnete ihlu z injekčnej liekovky s práškom (obr. E). Injekčnú liekovku s práškom jemne pretrepte alebo premiešajte krúživým pohybom, aby sa urýchlilo rozpustenie prášku.
7. Po úplnom rozpustení prášku zapichnite pribalenú odvzdušňovaciu ihlu (obr. F) a prípadná vzniknutá pena sa vytratí. Vytiahnite odvzdušňovaciu ihlu.
Injekcia/infúzia:Počas celej prípravy používajte aseptickú (sterilnú) techniku.
1. Odstráňte ochranný kryt z pribalenej ihly s filtrom tak, že ho otočíte a potiahnete a nasaďte ihlu na sterilnú jednorazovú injekčnú striekačku. Natiahnite roztok do injekčnej striekačky (obr. G).
2. Odpojte ihlu s filtrom od injekčnej striekačky a roztok podávajte pomaly vnútrožilovo cez pribalenú infúznu súpravu s krídlovým adaptérom (alebo cez pribalenú jednorazovú ihlu).
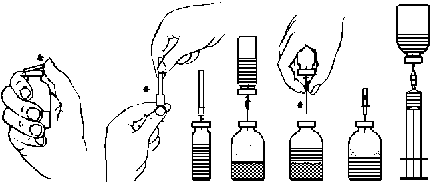
Obr. A Obr. B Obr. C Obr. D Obr. E Obr. F Obr. G
Pre podanie pomocou BAXJECT II Hi Flow
Rozpustenie prášku na prípravu injekčného roztokuPočas celej prípravy používajte aseptickú (sterilnú) techniku.
1. Zohrejte neotvorenú injekčnú liekovku obsahujúcu rozpúšťadlo (vodu na injekciu) na teplotu miestnosti, napr. ponorením do sterilného vodného kúpeľa, v ktorom sa zohreje v priebehu niekoľkých minút (na max. +37 °C), ak je to potrebné.
2. Odstráňte ochranné viečko z FEIBA a z injekčnej liekovky s rozpúšťadlom a očistite gumové zátky obidvoch injekčných liekoviek. Umiestnite fľaštičky na rovný povrch.
3. Otvorte balíček BAXJECT II Hi-Flow - postupne odtrhnite papierový kryt, bez toho, aby ste sa dotkli vnútrajška (Obr. a). Nevyberajte prenosné zariadenie z obalu.
4. Otočte balíček a priehľadným plastovým tŕňom prepichnite zátku rozpúšťadla (obr. b). Uchopte balenie za jeho okraj a stiahnite obal z BAXJECTu II Hi-Flow (obr. c). Neodstraňujte modré viečko z BAXJECTu II Hi-Flow.
5. Obráťte liekovku s rozpúšťadlom aj prenosné zariadenie nad liekovku s práškom tak, aby injekčná liekovka s rozpúšťadlom bola na hornej strane prístroja. Vložte fialový plastový hrot BAXJECT II Hi-Flow cez zátku fľaštičky FEIBA. Rozpúšťadlo sa nasaje podtlakom (vákuom) v injekčnej liekovke s práškom. (obr. D).
6. Jemne premiešajte celý systém ale netraste, pokiaľ sa nerozpustí celý obsah liekovky. Uistite sa, že FEIBA sa úplne rozpustí, inak by sa aktívna látka nedostala cez filter pomôcky.
Pokyny na injekčný / infúzny roztok:1. Odstráňte modré viečko z BAXJECTu II Hi-Flow. Pevne pripojte injekčnú striekačku na BAXJECT II Hi-Flow. NENAŤAHUJTE VZDUCH do injekčnej striekačky. (Obr. e). V záujme zabezpečenia pevného spojenia medzi injekčnou striekačkou a BAXJECT II Hi-Flow, sa odporúča použite injekčnej striekačky so závitom (otočte injekčnú striekačku v smere hodinových ručičiek až do polohy stop pri montáži).
2. Obráťte systém tak, že rozpustený prášok je na vrchu. Natiahnite roztok FEIBA do injekčnej striekačky POMALÝM ťahaním piestu von. Uistite sa, že BAXJECT II Hi-Flow a injekčná striekačka sú v priebehu celého naťahovania obsahu liekovky pevne spojené. (obr. f)
3. Odpojte striekačku.
4. Pokiaľ dôjde k napeneniu prípravku v injekčnej striekačke, počkajte, až pena sa vytratí. Natiahnutý roztok podávajte pomaly intravenózne pomocou priloženého infúzneho setu (alebo jednorazovej ihly).
Neprekročte rýchlosť podávania injekcie/infúzie 2 U (jednotky) FEIBY /kg telesnej hmotnosti za minútu.Ak použijete viac FEIBY, ako máteProsím informujte o tom svojho lekára. Predávkovanie FEIBOU môže zvýšiť riziko nežiaducich udalostí, akými sú tromboembólia (tvorba krvnej zrazeniny, ktorá sa dostane do krvnej cievy), spotrebná koagulopatia (DIK) alebo infarkt myokardu.
4. Možné vedľajšie účinkyTak ako všetky lieky, aj FEIBA môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Ak začnete pociťovať akýkoľvek vedľajší účinok ako závažný alebo ak spozorujete vedľajšie účinky, ktoré nie sú uvedené v tejto písomnej informácii pre používateľa, prosím povedzte to svojmu lekárovi alebo lekárnikovi.Na hodnotenie nežiaducich účinkov sú používané nasledujúce frekvencie:
Veľmi časté: : môžu sa vyskytnúť u viac ako 1 z 10 ľudí
|
Časté: môžu postihnúť až 1 z 10 ľudí
|
Menej časté: môžu postihnúť až 1 zo 100 ľudí
|
Zriedkavé: môžu sa vyskytnúť až u 1 z 1000 ľudí
|
Veľmi zriedkavé: môžu sa vyskytnúť až u 1 z 10000 ľudí
|
Neznáme: z dostupných údajov frekvenciu nemožno odhadnúť
|
V klinických štúdiách boli hlásené ako časté nasledujúce nežiaduce účinky:
- precitlivenosť,
- bolesti hlavy,
- závraty,
- hypotenzia,
- vyrážka,
- pozitivita protilátok proti HBs antigénu.
Z postmarketingových skúseností boli zaznamenané tieto nežiaduce účinky ako neznáme:
Poruchy krvi a lymfatického systému: diseminovaná intravaskulárna koagulopatia (DIK) ), zvýšený titer inhibítora.
Poruchy imunitného systému: alergické reakcie, žihľavka po celom tele (urtikária).
Poruchy nervového systému: znížená citlivosť končatín (hypoestézia), abnormálna alebo znížená citlivosť (parestézia), náhla cievna mozgová príhoda následkom trombózy alebo embólie, ospalosť (somnolencia), zmenené vnímanie chuti (dysgeúzia).
Poruchy srdca a srdcovej činnosti: infarkt myokardu, búšenie srdca (tachykardia).
Poruchy ciev: tvorba krvných zrazenín a ich putovanie v cievach (tromboembolické príhody), zvýšený krvný tlak (hypertenzia), návaly.
Poruchy dýchacej sústavy, hrudníka a mediastína: upchatie pľúcnej artérie (pľúcna embólia), náhle zúženie dýchacej trubice (bronchospazmus), sipot, kašeľ, sťažené dýchanie (dyspnoe)
Poruchy gastrointestinálneho traktu: vracanie, hnačka, brušný diskomfort, nevoľnosť (nauzea).
Poruchy kože a podkožného tkaniva: znížená citlivosť tváre , opuch tváre, jazyka a pier (angioedém), žihľavka po celom tele (urtikária), svrbenie (pruritus).
Celkové poruchy a reakcie v mieste podania: bolesť miesta vpichu, celkový diskomfort, pocit tepla, triaška, horúčka, bolesť na hrudníku, diskomfort na hrudníku.
Laboratórne a funkčné vyšetrenia: pokles tlaku krvi.
Rýchla vnútrožilová injekcia alebo infúzia môže spôsobiť bodavú bolesť a zníženú citlivosť tváre a končatín, ako aj pokles krvného tlaku.
Infarkt myokardu sa vyskytol po podávaní dávok prevyšujúcich najvyššiu dennú dávku a/alebo pri dlhodobom podávaní a/alebo pri prítomnosti rizikových faktorov vzniku tromboembólie.
Hlásenie vedľajších účinkovAk sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať FEIBU Uchovávajte mimo dohľadu a dosahu detí.
Uchovávajte pri teplote do 25 °C. Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu obsahu pre svetlom.
Nepoužívajte liek po dátume exspirácie, ktorý je uvedený na štítku a pôvodnom obale.
Dátum exspirácie sa vzťahuje na posledný deň v mesiaci.
Lieky sa nesmú likvidovať odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo FEIBA obsahujePrášokLiečivo: plazmatický proteín s aktivitou obchádzajúcou inhibítor koagulačného faktora VIII obsahuje:
FEIBA 25 U/ml obsahuje:
- 500 U plazmatického proteínu s aktivitou obchádzajúcou inhibítor faktora VIII, celkový obsah ľudského plazmatického proteínu je 200 ‑ 600 mg.
1 ml obsahuje 25 U* (jednotiek) plazmatického proteínu s aktivitou obchádzajúcou inhibítor faktora VIII.
FEIBA 50 U/ml obsahuje:
- 500 U plazmatického proteínu s aktivitou obchádzajúcou inhibítor faktora VIII, celkový obsah ľudského plazmatického proteínu je 200 ‑ 600 mg.
- 1000 U plazmatického proteínu s aktivitou obchádzajúcou inhibítor faktora VIII, celkový obsah ľudského plazmatického proteínu je 400 ‑ 1200 mg.
1 ml obsahuje 50 U* (jednotiek) plazmatického proteínu s aktivitou obchádzajúcou inhibítor faktora VIII.
FEIBA obsahuje tiež faktory II, IX a X, predovšetkým v neaktivovanej forme, ako ajaktivovaný
faktor VII. Antigén koagulačného faktora VIII (F VIII C:Ag) a faktory systému kalikreín-kinín sú
prítomné iba v stopových množstvách alebo vôbec nie.
* 1 jednotka FEIBY skracuje aktivovaný parciálny tromboplastinový čas (aPTT) v plazme s'
inhibítorom faktora VIII na 50 % hodnoty pufra (blanku).
- Ďalšie zložky sú: chlorid sodný a nátriumcitrát dihydrát.
Rozpúšťadlo- Sterilizovaná voda na injekciu.
Ako vyzerá FEIBA a obsah baleniaLiek sa dodáva vo forme lyofilizovaného prášku alebo sypkej hmoty bielej až sivobielej alebo slabozelenej farby. Prášok a rozpúšťadlo sa dodávajú v injekčných liekovkách vyrobených zo skla a uzavretých gumovou zátkou.
Pripravený roztok má hodnotu pH medzi 6,8 a 7,6.
Veľkosť balenia:1 kus
FEIBA 25 U/ml:
1 x 500 U (20 ml rozpúšťadla)
FEIBA 50 U/ml je dostupná v nasledujúcich formách:
1 x 500 U (10 ml rozpúšťadla)
1 x 1000 U (20 ml rozpúšťadla)
Obsah (pre podanie ihlou):FEIBA 25 U/ml:
1 injekčná liekovka 500 U prášok a rozpúšťadlo na injekčný alebo infúzny roztok
1 injekčná liekovka s 20 ml vody na injekciu
1 jednorazová injekčná striekačka
1 jednorazová ihla
1 ihla s filtrom
1 obojstranná ihla
1 odvzdušňovacia ihla
1 krídielková ihla so spojkou (infúzna súprava s krídlovým adaptérom)
FEIBA 50 U/ml
1 injekčná liekovka s 500 U/ 1000 U prášok a rozpúšťadlo na injekčný alebo infúzny roztok
1 injekčná liekovka s 10 ml/ 20 ml vody na injekciu
1 obojstranná ihla
1 odvzdušňovacia ihla
1 jednorazová injekčná striekačka
1 jednorazová ihla
1 krídelková ihla so spojkou (infúzna súprava s krídlovým adaptérom)
Obsah (pre podanie BAXJECT II Hi-Flow):FEIBA 25 U/ml:
1 injekčná liekovka s 500 U ‑
prášok a rozpúšťadlo na injekčný alebo infúzny roztok
1 injekčná liekovka uzavretá gumovou zátkou s 20 ml vody na injekciu
1 BAXJECT II Hi-Flow - Bezihlová prenosová pomôcka určená na prenos a zmiešanie liekov
obsiahnutých v dvoch injekčných liekovkách do injekčnej striekačky
1 jednorazová injekčná striekačka
1 jednorazová ihla
1 krídielková ihla so spojkou (infúzna súprava s krídlovým adaptérom)
FEIBA 50 U/ml
1 injekčná liekovka s 500 U/ 1000 U - prášok a rozpúšťadlo na injekčný alebo infúzny roztok
1 injekčná liekovka s 10 ml /20 ml vody na injekciu
1 BAXJECT II Hi-Flow
1 jednorazová injekčná striekačka
1 jednorazová ihla
1 krídelková ihla so spojkou (infúzna súprava s krídlovým adaptérom)
Držiteľ rozhodnutia o registrácii a výrobcaDržiteľ rozhodnutia o registrácii Baxalta Innovations GmbH
Industriestrasse 67
A-1221 Viedeň
Rakúsko
VýrobcaBaxter AG
Industriestrasse 67
A-1221 Viedeň
Rakúsko
Takeda Manufacturing Austria AG
Industriestrasse 67
A-1221 Viedeň
Rakúsko
Táto písomná informácia bola naposledy aktualizovaná v 05/2020.Podrobné informácie o tomto lieku sú dostupné na internetovej stránke www.sukl.sk
__________________________________________________________________________________
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:Liečbu má začať a viesť lekár so skúsenosťami v liečbe hemofílie.
DávkovanieDávkovanie a trvanie liečby závisí od závažnosti hemostatickej poruchy, lokalizácie a rozsahu krvácania a klinického stavu pacienta.
Dávkovanie a frekvencia jednotlivých dávok sa vždy riadi podľa individuálneho klinického účinku.
Všeobecne sa odporúča podávať 50 - 100 U FEIBA /kg telesnej hmotnosti (TH), neprekračovať jednorazovú dávku 100 U/kg TH a maximálnu dennú dávku 200 U /kg TH, pokiaľ závažnosť krvácania neoprávňuje a neospravedlňuje použitie vyšších dávok.
Vzhľadom na faktory špecifické pre daného pacienta sa môže jeho odpoveď na „bypassový“ prípravok rôzniť a pri danom krvácavom stave môže pacient na jeden typ reagovať a na druhý nie. Ak nedostatočne odpovedá na jeden typ „bypassového“ prípravku, má sa zvážiť podanie iného.
Použitie v pediatrii (deti):Skúsenosti u detí mladších ako 6 rokov sú obmedzené; pre klinické podmienky dieťaťa sa môže upraviť rovnaký dávkovací režim ako u dospelých.
1. Spontánne krvácanieKrvácanie do kĺbov, svalov a mäkkých tkanívPri miernom až stredne závažnom krvácaní sa odporúča dávka 50 ‑ 75 U/kg TH v 12‑hodinových intervaloch. V liečbe sa má pokračovať, až kým sa neobjavia jasné klinické znaky zlepšenia, ako je zmiernenie bolesti, zmenšenie opuchu alebo zvýšenie hybnosti kĺbu.
Pri závažnom krvácaní do svalov a mäkkých tkanív, akým je krvácanie do retroperitoneálneho priestoru, sa odporúča dávka 100 U/kg TH v 12‑hodinových intervaloch.
Slizničné krvácanieOdporúča sa dávka 50 U/kg TH každých 6 hodín za starostlivého sledovania pacienta (vizuálna kontrola krvácania, opakované stanovenie hematokritu). Ak nenastane zastavenie krvácania, dávka sa môže zvýšiť na 100 U /kg TH, nesmie sa však prekročiť denná dávka 200 U/kg TH.
Iné závažné krvácaniaPri závažnom krvácaní, akým je krvácanie do CNS, sa odporúča dávka 100 U/kg TH v 12‑hodinových intervaloch. V jednotlivých prípadoch sa FEIBA môže podávať v 6‑hodinových intervaloch, až kým sa nedosiahne jasné zlepšenie klinického stavu. Nesmie sa prekročiť maximálna denná dávka 200 U/kg TH.
2. Chirurgické zákrokyPodáva sa dávka 50 ‑ 100 U/kg TH v 6-hodinových intervaloch, pričom sa nesmie prekročiť maximálna denná dávka.
3. Profylaxia· Profylaxia krvácania u pacientov s vysokým titrom inhibítora a s častým krvácaním, u ktorých nebola úspešná ITI („immune tolerance induction“, imunotolerančná liečba) alebo sa o nej neuvažuje:
Odporúča sa dávka 70 ‑ 100 U/ kg telesnej hmotnosti každý druhý deň. Táto dávka sa môže zvýšiť až na 100 U/ kg telesnej hmotnosti denne, ak pacient stále krváca, alebo sa môže postupne znížiť.
· Profylaxia krvácania u pacientov s vysokým titrom inhibítora, ktorí podstupujú ITI (imunotolerančná liečba):
FEIBA sa môže podávať súbežne s koncentrátmi faktora VIII, v rozmedzí dávky od 50 do 100 U/kg telesnej hmotnosti dvakrát denne, až kým nedôjde k zníženiu inhibítora faktora VIII na < 2 BU.*
* 1 Bethesda jednotka (Bethesda Unit, BU) je definovaná ako množstvo protilátok, ktoré inhibuje 50 % aktivity FVIII v priemernej čerstvej ľudskej plazme po 2‑hodinovej inkubácii pri teplote 37 °C.
Sledovanie Vzhľadom na komplexný mechanizmus účinku nie je k dispozícii žiadne priame sledovanie účinných látok.
Koagulačné testy ako doba zrážania plnej krvi ( WBCT), tromboelastogram (TEG, r-hodnota) a aPPT sú zvyčajne len mierne skrátené a nemusia korelovať s klinickým zlepšením. Preto majú tieto testy len obmedzený význam pre hodnotenie liečby prípravkom FEIBA.
Spôsob podávaniaFEIBA sa má podávať pomaly intravenózne (rýchlosťou najviac 2 U FEIBY/kg TH za minútu).
Prášok FEIBY sa má rozpustiť až tesne pred podaním. Potom sa má roztok použiť okamžite (liek neobsahuje konzervačné látky). Nesmú sa používať roztoky, ktoré sú zakalené alebo obsahujú usadeniny. Nespotrebované množstvo pripraveného lieku sa má vhodným spôsobom zlikvidovať.
Sledovanie liečbyNesmú sa prekročiť jednotlivé dávky 100 U/kg TH a denné dávky 200 U/kg TH. Pacienti dostavajúci viac než 100 U/kg telesnej hmotnosti musia byť starostlivo monitorovaní pre možné rozvinutie DIK a/alebo akútnej koronárnej ischémie. Vysoké dávky FEIBA sa majú podávať len v čase nevyhnutne potrebnom pre zastavenie krvácania.
Ak nastanú významné zmeny krvného tlaku alebo tepovej frekvencie, alebo ak sa objavia dýchacie ťažkosti, kašeľ alebo bolesť na hrudi, treba infúziu okamžite ukončiť a začať vhodné diagnostické a liečebné opatrenia. Laboratórne parametre poukazujúce na DIK sú znížené hladiny fibrinogénu, zníženie počtu trombocytov, a/alebo prítomnosť fibrín/fibrinogén degradačných produktov (FDP). Ďalšie známky svedčiace pre DIC sú signifikantne predĺžený trombínový čas, protrombínový čas alebo aPTT. U hemofilických pacientov s inhibítorom alebo u pacientov so získanými inhibítormi faktorov VIII, IX a XI je aPTT predĺžené vzhľadom na základné ochorenie.
Podanie lieku FEIBA pacientom s inhibítormi môže vyvolať úvodný anamnestický vzostup hladín inhibítora. S pokračujúcim podávaním FEIBA môže inhibítor po čase klesnúť. Klinické a publikované údaje naznačujú, že účinnosť FEIBA nie je znížená.
Pacienti s hemofíliou s inhibítorom alebo so získanými inhibítormi koagulačných faktorov, ktorí sa liečia s liekom FEIBA, môžu mať zvýšený sklon ku krvácaniu a v rovnakom čase zvýšené riziko trombózy.
Laboratórne vyšetrenia a klinická účinnosťIn vitro testy ako je aPTT, doba zrážania plnej krvi (WBCT) a tromboelastogram (TEG) ako kontrola účinnosti liečby nemusia korelovať s klinickým obrazom. Preto nemôžu byť úspešné pokusy normalizovať laboratórne hodnoty zvyšovaním dávky FEIBA a dokonca sa zásadne neodporúčajú, pretože pri predávkovaní hrozí spustenie DIK.
Význam počtu trombocytovAk je odpoveď na liečbu FEIBOU nedostatočná, odporúča sa vyšetriť počet trombocytov, pretože pre účinnosť FEIBA je nevyhnutný dostatočný počet funkčne intaktných trombocytov.
Ďalšie informácie podporujúce použitie pomôcky Baxject II Hi-Flow:- Pomôcka je sterilizovaná gama žiarením.
- Je určená iba na jednorazové použitie.
- Pomôcka neobsahuje latex.

Nepoužívajte, ak je obal poškodený

