
1500
IU,2000
IU,
3000
IU
prášok
a
rozpúšťadlo
na
injekčný
roztok
Prášok a rozpúšťadlo na injekčný roztok
Biely/takmer biely prášok a číre a bezfarebné rozpúšťadlo.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba a profylaxia krvácania u pacientov s hemofíliou B (vrodený nedostatok faktora IX). Benefix je vhodný pre všetky vekové skupiny.
4.2 Dávkovanie a spôsob podávania
Liečba má byť začatá pod dohľadom lekára so skúsenosťami v liečbe hemofílie. Monitorovanieliečby
V priebehu liečby sa odporúča stanoviť hladiny faktora IX, čo je potrebné pre stanovenie podávaných
dávok a frekvencie opakovaných infúzií. Odpovede individuálnych pacientov na faktor IX sa môžu líšiť, a tak dosahovať rôzne biologické polčasy a rôzne hodnoty in vivo výťažnosti. Dávka vypočítaná
na základe telesnej hmotnosti si môže vyžadovať úpravu v prípade pacientov s nedostatočnou
hmotnosťou alebo s nadváhou. Presné sledovanie substitučnej liečby pomocou koagulačnej analýzy
(aktivita faktora IX v plazme) je nevyhnutné najmä v prípade rozsiahlych operačných zákrokov.
Pri použití jednostupňovej skúšky zrážania založenej na in vitro tromboplastínovom čase (aPTT) pre stanovenie aktivity faktora IX vo vzorkách krvi pacientov, môžu byť výsledky aktivity faktora IX v plazme významne ovplyvnené typom aPTT činidla a referenčným štandardom použitým pri skúške. To je dôležité najmä pri zmene laboratória a/alebo činidiel použitých pri skúške.
Dávkovanie
Dávkovanie a trvanie substitučnej terapie závisia na stupni nedostatku faktora IX, mieste a rozsahu krvácania a na klinickom stave pacienta.
Počet podaných jednotiek faktora IX sa vyjadruje v medzinárodných jednotkách (IU), ktoré súvisia so súčasným štandardom WHO pre koncentráty faktora IX. Aktivita faktora IX v plazme sa vyjadruje buď v percentách (pomer k normálnej aktivite ľudskej plazmy) alebo v medzinárodných jednotkách (pomer k medzinárodnému štandardu pre faktor IX v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora IX je ekvivalentná množstvu faktora IX v jednom ml normálnej ľudskej plazmy.
Liečba on demand (podľa potreby)
Výpočet požadovanej dávky BeneFIXu môže byť založený na zistení, že jedna jednotka aktivity faktora IX na kg telesnej hmotnosti by mala zvýšiť hladinu cirkulujúceho faktora IX v priemere o
0,8 IU/dl (rozpätie od 0,4 do 1,4 IU/dl) u pacientov ³ 12 rokov (ďalšie informácie v časti 5.2).
Požadované dávkovanie sa určuje pomocou nasledujúcej rovnice:

Počet
požadovaných
IU faktora IX
= telesná hmotnosť (v kg) X požadované zvýšenie
faktora IX (%) alebo
(IU/dl)
X recipročná
výťažnosť
Príklad: pre obnovu 0,8 IU/dl vzorec znie:
Počet
požadovaných
IU faktora IX
= telesná hmotnosť (v kg) X želané zvýšenie faktora
IX (%) alebo (IU/dl)
X 1,3 IU/kg
Množstvo a frekvencia dávky majú byť vždy zamerané na klinickú účinnosť liečiva v individuálnom
prípade.
V prípade nasledujúcich krvácavých príhod nemá aktivita faktora IX za príslušné obdobie klesnúť pod danú hladinu aktivity v plazme (v % normálnej aktivity alebo v IU/dl). Nasledujúcu tabuľku možno použiť ako smerodajnú pre dávkovanie v prípadoch krvácania a operácií:
Stupeň krvácania/typ
chirurgického zákroku
Požadovaná
hladina faktora IX
Frekvencia dávok (hodiny)/Trvanie
liečby (dni)
(%)
alebo
(IU/dl) Krvácanie
Skoré krvácanie do kĺbov,
krvácanie svalov alebo ústnej dutiny
Rozsiahlejšie krvácanie do kĺbov, krvácanie do svalov alebo hematómy
20-40 Opakujte každých 24 hodín.
Minimálne 1 deň, kým sa krvácanie – indikované bolesťou - nezastaví alebo sa nedocieli zahojenie.
30-60 Opakujte infúziu každých 24 hodín počas 3-4 dní alebo dlhšie, kým
bolesť a akútna imobilita nevymiznú.
Život ohrozujúce krvácanie 60-100 Opakujte infúziu každých 8 až 24
hodín, kým ohrozenie nepominie.
 Operácia
Operácia Menšia
Vrátane extrakcie zubu
Rozsiahla
30-60
80-100
(pred- a pooperačne)
Každých 24 hodín, minimálne
1 deň, kým sa nedocieli zahojenie.

Opakujte infúziu každých 8-24 hodín, kým sa rana primerane nezahojí, potom pokračujte v liečbe minimálne ďalších 7 dní na udržanie aktivity faktora IX od 30% do 60% (IU/dl)
 Profylaxia
Profylaxia
BeneFIX možno podávať pacientom s ťažkou hemofíliou B. V klinickej štúdii bežnej sekundárnej profylaxie bola priemerná dávka predtým liečených pacientov (PTP) 40 IU/kg (rozpätie od 13 do
78 IU/kg) v intervaloch od 3 do 4 dní. U mladších pacientov môžu byť potrebné kratšie dávkovacie
intervaly alebo vyššie dávky.
V niektorých prípadoch, predovšetkým u mladších pacientov, sú potrebné kratšie intervaly dávkovania alebo vyššie dávky.
PediatrickápopuláciaOhľadom liečby on-demand a chirurgických zákrokov u detí menej ako 6 ročných liečených
BeneFIXom je k dispozícii len limitovaná dokumentácia.
Stredná dávka (± štandardná odchýlka) pre profylaxiu bola 63,7 (±19,1) IU/kg v intervale od 3 do
7 dní. U mladších pacientov môžu byť potrebné kratšie intervaly a vyššie dávky. Spotreba FIX na rutinnú profylaxiu u 22 vyhodnotiteľných pacientov bola 4607 (± 1849) IU/kg za rok
a 378 (± 152) IU/kg za mesiac.
Je potrebné prísne sledovať aktivitu faktora IX v plazme podľa klinických indikácií a zároveň vypočítať farmakokinetické parametre, ako sú výťažnosť a biologický polčas pre vhodnú úpravu dávok.
Staršípacienti
Do klinických štúdií BeneFIXu nebol zahrnutý dostatočný počet osôb vo veku 65 a viac rokov, aby bolo možné stanoviť, či miera ich odpovede bude odlišná od mladších osôb. Podobne ako u každého pacienta liečeného BeneFIXom, aj u starších pacientov je potrebné individuálne stanovenie dávky.
Spôsobpodávania
BeneFIX sa podáva intravenóznou infúziou po rekonštitúcii lyofilizovaného prášku na injekčný roztok so sterilným roztokom 0,234 % chloridu sodného (pozri časť 6.6).
BeneFIX má byť podávaný pomalou infúziou. Vo väčšine prípadov bola zvolená rýchlosť infúzie do
4 ml za minútu. Rýchlosť podávania sa má zvoliť tak, aby sa pacient cítil pohodlne.
V prípade podozrenia na hypersenzitívnu reakciu, ktorá môže byť spôsobená podávaním BeneFIXu, je potrebné znížiť rýchlosť infúzie alebo infúziu zastaviť (pozri časti 4.4 a 4.8).
Aglutináciačervenýchkrviniekvhadičke/injekčnejstriekačke
Existujú hlásenia o aglutinácii červených krviniek v hadičke/injekčnej striekačke pri podávaní BeneFIXu. Dosiaľ neboli v súvislosti s týmto pozorovaním hlásené žiadne nežiaduce reakcie. Pre minimalizáciu možnosti aglutinácie je dôležité obmedziť množstvo krvi vstupujúce do hadičky. Krv nemá vstúpiť do injekčnej striekačky. Ak sa pozoruje aglutinácia červených krviniek
v hadičke/injekčnej striekačke, znehodnoťte všetok materiál (hadičky, injekčnú striekačku a roztok
BeneFIXu) a začnite podávanie s novým balením.
Kontinuálnainfúzia
Podávanie kontinuálnou infúziou nebolo schválené a nie je odporúčané (pozri tiež časti 4.4 a 6.6). Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Známa alergická reakcia na proteíny škrečka.
4.4 Osobitné upozornenia a opatrenia pri používaní
Hypersenzitivita
Pri použití BeneFIXu je možný vznik hypersenzitívnych reakcií alergického typu. Produkt obsahuje stopové množstvo proteínov škrečka. Eventuálne život ohrozujúce anafylaktické/anafylaktoidné reakcie sa vyskytli pri koncentrátoch faktora IX vrátane BeneFIXu. V prípade výskytu symptómov hypersenzitivity je potrebné pacientom odporučiť, aby okamžite ukončili užívanie lieku a kontaktovali lekára. Pacienti majú byť informovaní o skorých prejavoch precitlivenosti zahŕňajúcich ťažkosti
s dýchaním, dychovú nedostatočnosť, opuchy, žihľavku, generalizovanú urtikáriu, svrbenie, zvieravý pocit na hrudi, bronchospazmus, laryngospazmus, pískanie, hypotenziu, rozmazané videnie a anafylaxiu.
V niektorých prípadoch sa tieto reakcie vyvinuli do ťažkej anafylaxie. V prípade šoku sa majú dodržať obvyklé medicínske postupy pre liečbu šoku. V prípade závažných alergických reakcií je potrebné zvážiť alternatívne opatrenia na zastavenie krvácania.
Inhibítory
Prítomnosť inhibítorov je menej častým javom u predtým liečených pacientov (PTP). Keďže počas klinických štúdií sa u jedného PTP následne liečeného BeneFIXom vyvinul klinicky významný slabo reagujúci inhibítor a skúsenosti s imunogenicitou rekombinantného faktora IX sú stále obmedzené,
pacienti liečení BeneFIXom sa musia prísne sledovať na tvorbu inhibítorov faktora IX, ktoré sa majú titrovať v Bethesda jednotkách pomocou vhodných biologických testov.
Údaje v literatúre preukázali súvislosť medzi výskytom inhibítora faktora IX a alergickými reakciami. Preto sa u pacientov s výskytom alergických reakcií má stanoviť prítomnosť inhibítora. Je potrebné poznamenať, že pacienti s inhibítormi faktora IX môžu byť vystavení zvýšenému riziku
anafylaxie následnou expozíciou faktorom IX. Predbežné informácie naznačujú možný vzťah medzi prítomnosťou rozsiahlych delečných mutácií v géne pre faktor IX u pacienta a zvýšeným rizikom
tvorby inhibítora a akútnych reakcií z precitlivenosti. U pacientov, u ktorých sú známe rozsiahle delečné mutácie v géne pre faktor IX, je potrebné dôsledne sledovať výskyt príznakov a symptómov
akútnych reakcií z precitlivenosti, hlavne počas skorých fáz iniciálneho užívania lieku.
Kvôli riziku alergických reakcií na koncentráty faktora IX má byť iniciálne podávanie faktora IX, podľa úsudku lekára, uskutočnené pod lekárskym dozorom, kde môže byť poskytnutá vhodná medicínska starostlivosť v prípade alergických reakcií.
Trombóza
Napriek tomu, že BeneFIX obsahuje iba faktor IX, treba pripustiť riziko trombózy a diseminovanej intravaskulárnej koagulácie (DIC). Keďže používanie koncentrátov komplexu faktora IX historicky
súvisí s rozvojom tromboembolických komplikácií, použitie produktov s obsahom faktora IX môže
byť nebezpečné u pacientov s príznakmi fibrinolýzy a u pacientov s diseminovanou intravaskulárnou koaguláciou (DIC). Kvôli možnému riziku trombotických komplikácií je potrebné začať klinické sledovanie skorých príznakov trombotickej a konzumpčnej koagulopatie spolu s príslušnými biologickými testami pri podávaní produktu pacientom s ochorením pečene, pacientom po absolvovaní operácie, novorodencom alebo pacientom s rizikom trombotického fenoménu alebo DIC. V každej z týchto situácií sa musí zhodnotiť prospech liečby BeneFIXom v porovnaní s rizikom týchto komplikácií.
Bezpečnosť a účinnosť podávania BeneFIXu kontinuálnou infúziou nebola stanovená (pozri tiež časti
4.2 a 4.8). Vyskytli sa post-marketingové hlásenia trombotických príhod, vrátane život ohrozujúceho syndrómu hornej dutej žily u kriticky chorých novorodencov, ktorí dostávali kontinuálnu infúziu
BeneFIXu cez centrálny venózny katéter (pozri tiež časť 4.8).
Kardiovaskulárnepríhody
U pacientov s kardiovaskulárnymi rizikovými faktormi môže substitučná terapia s FIX zvýšiť kardiovaskulárne riziká.
Nefrotickýsyndróm
U pacientov s hemofíliou B, s inhibítormi faktora IX a alergickými reakciami v anamnéze bol pri pokusoch o vyvolanie imunitnej tolerancie (ITI) hlásený nefrotický syndróm. Bezpečnosť a účinnosť
podávania BeneFIXu pre vyvolanie imunitnej tolerancie nebola stanovená.
Osobitnéskupinypacientov
Z klinických štúdií s BeneFIXom sa nezískali dostatočné údaje o liečbe predtým neliečených pacientov (PUP).
Záznamopoužití
Dôrazne sa odporúča pri každom podaní BeneFIXu pacientovi zaznamenať názov a číslo šarže lieku, aby sa zachovala súvislosť medzi pacientom a šaržou lieku. Pacienti môžu použiť jeden
z odlepovacích štítkov na fľaštičke pre zaznamenanie čísla šarže vo svojom denníku alebo pre hlásenie
nežiaducich účinkov.
4.5 Liekové a iné interakcie
Neboli zaznamenané žiadne interakcie produktov ľudského koagulačného faktora IX (rDNA) s liekmi.
4.6 Fertilita, gravidita a laktácia
Neuskutočnili sa žiadne interakčné štúdie na zvieratách s faktorom IX. Kvôli zriedkavému výskytu hemofílie B u žien nie sú dostupné skúsenosti ohľadom užívania faktora IX počas gravidity a dojčenia. Preto smie byť faktor IX v období gravidity a dojčenia používaný, iba ak je to jasne indikované.
Vplyv BeneFIXu na fertilitu sa nestanovil.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
BeneFIX nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Hypersenzitivita alebo alergické reakcie (ktoré môžu zahŕňať angioedém, pálenie a pichanie v mieste infúzie, zimnicu, sčervenanie, generalizovanú urtikáriu, bolesť hlavy, žihľavku, hypotenziu, letargiu, nauzeu, nepokoj, tachykardiu, zvieravý pocit na hrudi, mravenčenie, vracanie, pískanie) boli pozorované a môžu v niektorých prípadoch viesť až k závažnej anafylaxii (vrátane šoku).
V niektorých prípadoch tieto reakcie vyústili až do ťažkej anafylaxie a došlo k nim v tesnej časovej súvislosti s rozvojom inhibítorov faktora IX (pozri tiež časť 4.4). Nefrotický syndróm bol
zaznamenaný po pokuse o indukciu imunitnej tolerancie u pacientov s hemofíliou B s inhibítorom
faktora IX a anamnézou alergických reakcií.
Veľmi zriedkavo bolo pozorované vytváranie protilátok proti proteínom škrečka v súvislosti s hypersenzitívnymi reakciami.
Pacienti s hemofíliou B môžu vytvoriť neutralizujúce protilátky (inhibítory) proti faktoru IX. Ak sa tieto inhibítory vyskytnú, prejaví sa to nedostatočnou klinickou reakciou. V takýchto prípadoch sa odporúča kontaktovať špecializované centrum pre liečbu hemofílie.
Existuje potenciálne riziko tromboembolických príhod po podaní koncentrátov faktora IX, pozri časť
4.4
Zoznamnežiaducichreakciízostavenýdotabuľky
Tabuľka uvedená nižšie je zostavená v súlade s triedami orgánových systémov podľa databázy MedDRA (trieda orgánových systémov – SOC, úroveň preferovaných termínov – PTL). Frekvencie boli hodnotené podľa nasledujúcej konvencie: veľmi časté (≥ 1/10); časté (≥ 1/100 až <1/10); menej časté (≥ 1/1 000 až <1/100), neznáme (z dostupných údajov). V tabuľke sú uvedené nežiaduce účinky hlásené v klinických štúdiách u predtým liečených pacientov a z postmarketingovej skúsenosti. Frekvencie sú založené na všetkých liečbou ovplyvnených nežiaducich účinkoch v súhrnných klinických štúdiách s 224 pacientmi.
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda
orgánových
systémov
Veľmi
časté
≥
1/10
Časté
≥
1/100
až
<
1/10
Menej
časté
≥
1/1
000
až
<
1/100
Frekvencia
neznáma
(
z
dostupných
údajov)
Infekcie a nákazy celulitída v mieste vpichua
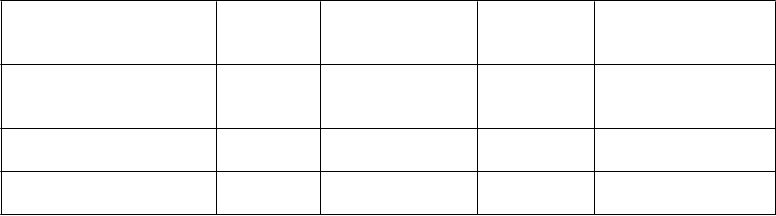
Poruchy krvi a lymfatického systému Poruchy imunitného systému
inhibícia faktora IXb
hypersenzitivitac anafylaktická reakcia*
Trieda
orgánových
systémov
Poruchy nervového systému
Veľmičasté
≥1/10
bolesť hlavyd
Časté
≥1/100
až<1/10
závraty, dysgeúzia
Menejčasté
≥1/1000až
<1/100
somnolencia, triaška
Frekvencianeznáma(zdostupnýchúdajov)
Poruchy oka porucha zrakue
Poruchy srdca a srdcovej činnosti
Poruchy ciev flebitída, sčervenanieg
tachykardiaf
hypotenziah syndróm hornej dutej žilyi,*,
hlboká žilová trombóza*,
trombóza*,
tromboflebitída*
Poruchy dýchacej sústavy, hrudníka a mediastína Poruchy gastrointestinálneho traktu
kašeľj
vracanie, nauzea
Poruchy kože a podkožného tkaniva Poruchy obličiek
a močových ciest
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
vyrážkak, urtikária
pyrexia nepríjemný pocit v oblasti hrudníkao, reakcia v oblasti vpichun, bolesť v oblasti vpichum
Infarkt obličiekl
nedostatočná liečebná reakcia*
nedostatočné obnovenie faktora IXp, *

* nežiaduce reakcie, ktoré boli identifikované po uvedení lieku na trh
a vrátane celulitídy
b tvorba prechodného inhibítora pri nízkej titrácii
c vrátane hypersensitivity na lieky, angioedému, bronchospazmu, pískania, dýchavičnosti a laryngospazmu
d vrátane migrény, sínusovej bolesti hlavy
e vrátane scintilačného skotómu a rozmazaného videnia
f vrátane zvýšeného srdcového tepu, sínusovej tachykardie
g vrátane návalov tepla, pocitu tepla, teplej pokožky
h vrátane poklesu krvného tlaku
i syndróm hornej dutej žily (SVC) u kriticky chorých novorodencov, pri prijímaní kontinuálnej infúzie
BeneFIXu cez centrálny venózny katéter
j vrátane produktívneho kašľa
k vrátane makulárnej vyrážky, papulárnej vyrážky, makulopapulárnej vyrážky
l vyvinutý 12 dní po podaní BeneFIXu v prípade krvácania u pacientov s pozitívnym výskytom protilátok na hepatitídu C
m vrátane bolesti a nepohodlia v mieste vpichu
n vrátane svrbenia a začervenania v mieste vpichu
o vrátane bolesti na hrudi a tlaku na hrudi
p toto je doslovný termín, databáza MedDRA 17.1 neuvádza preferovaný termín (PT)
OpisvybranýchnežiaducichreakciíPrecitlivenosť/alergické reakcieAk existuje podozrenie na hypersenzitívnu reakciu, ktorá môže mať súvislosť s podávaním BeneFIXu, pozri časti 4.2. a 4.4.
Tvorba inhibítorov
Klinicky významný, slabo reagujúci inhibítor bol zistený u 1 zo 65 pacientov užívajúcich BeneFIX (vrátane 9 pacientov, ktorí sa zúčastnili iba na operačnej štúdii), ktorému boli v minulosti podávané'
plazmatické koncentráty. Tento pacient bol schopný pokračovať v liečbe BeneFIXom bez príznakov
zvýšenia inhibítora alebo anafylaxie (pozri časť 4.4).
PediatrickápopuláciaAlergické reakcie sa môžu vyskytnúť častejšie u detí než u dospelých.
Nie sú k dispozícii dostatočné údaje, ktoré by poskytli informácie o výskyte inhibítorov u predtým neliečených pacientov (PUPs) (pozri tiež časť 5.1).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV prípade koncentrátov s rekombinantným koagulačným faktorom IX neboli hlásené žiadne príznaky predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: krvný koagulačný faktor IX proti krvácaniu; ATC kód: B02BD09
SpôsobúčinkuBeneFIX obsahuje rekombinantný koagulačný faktor IX (nonakog alfa). Rekombinantný koagulačný faktor IX je glykoproteín pozostávajúci z jedného reťazca s približnou molekulovou hmotnosťou
55 000 Daltonov a patrí k serínovým proteázam skupiny koagulačných faktorov závislých na
vitamíne K. Rekombinantný koagulačný faktor IX je proteínové liečivo na báze rekombinantnej DNA, ktoré má štrukturálne a funkčné vlastnosti porovnateľné s endogénnym faktorom IX. Faktor IX je
aktivovaný komplexom faktor VII/ tkanivový faktor vo vonkajšej dráhe ako aj faktorom XIa vo
vnútornej koagulačnej dráhe. Aktivovaný faktor IX v kombinácii s aktivovaným faktorom VIII aktivuje faktor X. To vedie v konečnom dôsledku k premene protrombínu na trombín. Trombín následne premieňa fibrinogén na fibrín, a tak môže vzniknúť koagulum. Aktivita faktora IX chýba alebo je značne znížená u pacientov s hemofíliou B a substitučná terapia môže byť potrebná.
FarmakodynamickéúčinkyHemofília B je dedičná, na pohlavie viazaná porucha hemokoagulácie spôsobená znížením hladiny faktora IX a vedie k nadmernému krvácaniu do kĺbov, svalov alebo vnútorných orgánov, buď
spontánne alebo následkom náhodného úrazu alebo operačného zákroku. Substitučnou terapiou sa zvýšia plazmatické hladiny faktora IX a umožnia tak dočasnú nápravu nedostatku faktora a úpravu
tendencie ku krvácaniu.
Pediatrická
populácia
Analýza účinnosti v štúdii 3090A1-301-WW bola založená na 22 vyhodnotiteľných pediatrických pacientoch na profylaktickom režime, vrátane 4 pacientov na on-demand liečbe, u ktorých po krátkom čase došlo k zmene na profylaxiu. Dvaja pacienti podstúpili chirurgický zákrok (obriezka a zavedenie portokaválneho katétra). Analýza bezpečnosti 25 vyhodnotiteľných pacientov odráža bezpečnostný profil aký sa očakával. Jediný dokumentovaný závažný nežiaduci účinok spojený s BeneFIX-om bol hlásený od jediného PUP s precitlivelosťou a rozvojom inhibítorov.
Dve otvorené štúdie potvrdili bezpečnosť BeneFIXu podávaného v dávke 100 IU/kg raz týždenne. Biologický polčas tohto prípravku (pozri časť 5.2) a obmedzené údaje z farmakokinetickej štúdie týkajúce sa režimu podávania raz týždenne však neumožňujú všeobecné odporúčanie tohto režimu podávania ako dlhodobej profylaxie u pacientov so závažnou hemofíliou B.
5.2 Farmakokinetické vlastnosti
V randomizovanej, skríženej farmakokinetickej štúdii bolo preukázané, že BeneFIX, rekonštituovaný v 0,234 % roztoku chloridu sodného, je z farmakokinetického hľadiska rovnaký ako predtým registrovaný BeneFIX (rekonštituovaný v sterilnej vode) u 24 predtým liečených pacientov (vo veku
≥12 rokov) v dávke 75 IU/kg. Na dôvažok, farmakokinetické parametre boli ďalej sledované u tých istých 23 pacientov po opakovanom podaní BeneFIXu po dobu šiestich mesiacov a nezistila sa žiadna
zmena v porovnaní s parametrami získanými pri úvodnom hodnotení. Súhrn farmakokinetických údajov je predložený v tabuľke 1.
Tabuľka 1. Odhad farmakokinetických parametrov pre BeneFIX (75 IU/kg) pri východiskovom vyšetrení a v 6. mesiaci u predtým liečených pacientov s hemofíliou B
Parameter Východisková hodnota n = 24
Priemer ± SD
6. mesiac n = 23
Priemer ± SD
Cmax (IU/dl) 54,5 ± 15,0 57,3 ± 13,2
AUC∞ (IU∙h/dl) 940 ± 237 923 ± 205
t1/2 (h) 22,4 ± 5,3 23,8 ± 6,5
CL (ml/h/kg) 8,47 ± 2,12 8,54 ± 2,04
Výťažnosť
(IU/dl na IU/kg) 0,73 ± 0,20 0,76 ± 0,18
Skratky: AUC∞ = plocha pod krivkou plazmatickej koncentrácie vo vzťahu k času od nuly po nekonečno; Cmax = maximálna koncentrácia; t1/2 = eliminačný polčas plazmy; CL = klírens; SD = štandardná odchýlka.
Populačný farmakokinetický model bol vyvinutý na základe údajov zozbieraných od 73 pacientov vo
veku od 7 mesiacov do 60 rokov. Parametre odhadnuté pomocou finálneho 2-priestorového modelu sú uvedené v tabuľke 2. Dojčatá a deti mali vyšší klírens, väčší objem distribúcie, kratší polčas a nižšiu
obnovu ako dospievajúci a dospelí. Terminálna fáza nebola pokrytá jednoznačne kvôli nedostatku
údajov nad rámec 24 hodín u detských pacientov < 6 ročných.
Tabuľka 2. Priemer ± SD farmakokinetických parametrov odhadnutých na základe individuálnych odchýliek z populačnej farmakokinetickej analýzy
Veková skupina (roky)
Dojčatá
<2
Deti
2 až < 6
Deti
6 až < 12
Adolescenti
12 až < 18
Dospelí
18 až 60
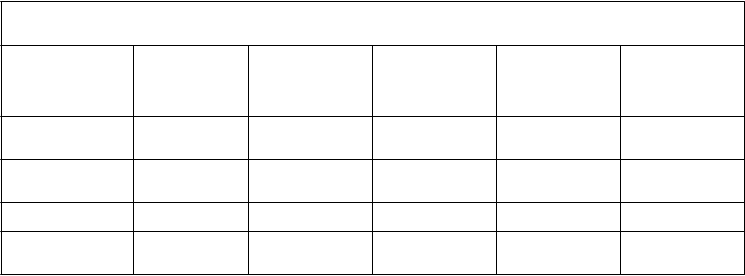

Počet 7 16 1 19 30
Klírens
(ml/h/kg) 13,1 ± 2,1 13,1 ± 2,9 15,5 9,2 ± 2,3 8,0 ± 0,6
Vss (ml/kg) 252 ± 35 257 ± 25 303 234 ± 49 225 ± 59
Eliminačný
polčas (h) 15,6 ± 1,2 16,7 ± 1,9 16,3 21,5 ± 5,0 23,9 ± 4,5
Výťažnosť (IU/dl na IU/kg)
0,61 ± 0,10 0,60 ± 0,08 0,47 0,69 ± 0,16 0,74 ± 0,20
 5.3 Predklinické údaje o bezpečnosti
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií genotoxicity neodhalili žiadne špecifické riziko pre ľudí.
Štúdie karcinogenného potenciálu, reprodukčnej toxicity a fetálneho vývoja neboli vykonané.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokPrášok Sacharóza Glycín
L-histidín
Polysorbát 80
RozpúšťadloRoztok chloridu sodného
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi. Má sa použiť iba priložená infúzna súprava. Neúspech liečby sa môže vyskytnúť ako dôsledok adsorpcie ľudského koagulačného faktora IX na vnútorné povrchy niektorých častí infúzneho aparátu.
6.3 Čas použiteľnosti2 roky
Rekonštituovaný liek neobsahuje konzervačnú látku a má sa použiť okamžite alebo do 3 hodín po rekonštitúcii. Chemická a fyzikálna stabilita pre použitie bola preukázaná počas 3 hodín pri teplote do
25 °C.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 30 °C. Nezmrazujte.
6.5 Druh obalu a obsah baleniaBeneFIX250IU,500IU,1000IU,1500IU,2000IU,3000IUprášokarozpúšťadlonainjekčnýroztokBeneFIX 250 IU, 500 IU, 1000 IU, 1500 IU, 2000 IU, 3000 IU prášku v 10 ml injekčnej liekovke (zo
skla typu I) s uzáverom (chlorobutyl) a odnímateľným krytom (hliníkovým) a 5 ml číreho, bezfarebného rozpúšťadla v naplnenej striekačke (zo skla typu I) s uzáverom piestu (bromobutyl), krytom hrotu striekačky (bromobutyl) a sterilným adaptérom liekovky na rekonštitúciu, sterilná infúzna súprava, dva alkoholové tampóny, jedna náplasť a gáza.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
BeneFIX sa podáva intravenóznou infúziou po rekonštitúcii lyofilizovaného prášku na injekciu s priloženým rozpúšťadlom (0,234 % w/v roztok chloridu sodného) v naplnenej striekačke (pre podrobné informácie o rekonštitúcii pozri časť 3 príbalového letáku).
BeneFIX po rekonštitúcii obsahuje polysorbát-80, o ktorom je známe, že zvyšuje mieru extrakcie
di-(2-etylhexyl)ftalátu (DEHP) z polyvinylchloridu (PVC). Túto skutočnosť treba zobrať do úvahy pri príprave a podávaní BeneFIX. Dôležité je, aby sa presne dodržiavali odporúčania uvedené v časti 4.2.
Nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
Pretože použitie BeneFIXu kontinuálnou infúziou nebolo hodnotené, BeneFIX sa nemá miešať s infúznymi roztokmi ani podávať v infúzii.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIPfizer Limited Ramsgate Road Sandwich
Kent CT13 9NJ Veľká Británia
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/97/047/004
EU/1/97/047/005
EU/1/97/047/006
EU/1/97/047/009
EU/1/97/047/007
EU/1/97/047/008
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 27. augusta 1997
Dátum posledného predĺženia registrácie: 20. júla 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
http://www.ema.europa.eu.