
ukujúce glukuronidáciu
Silné lieky indukujúce enzýmy UGT by mohli viesť k zvýšenému metabolizmu a zníženej účinnosti febuxostatu. Monitorovanie kyseliny močovej v sére sa preto odporúča 1-2 týždne po začatí liečby silným liekom indukujúcim glukuronidáciu. Naopak, skončenie liečby indukujúcim liekom by mohlo viesť k zvýšeným koncentráciám febuxostatu v plazme.
Kolchicín/indometacín/hydrochlortiazid/warfarín
Febuxostat možno podávať súčasne s kolchicínom alebo indometacínom bez potreby upraviť
dávku febuxostatu alebo súčasne podávaného liečiva.
Pri podávaní febuxostatu s hydrochlortiazidom nie je potrebná žiadna úprava dávky pre febuxostat.
Pri podávaní febuxostatu s warfarínom nie je potrebná žiadna úprava dávky pre warfarín. Po začatí terapie febuxostatom je potrebné u pacientov, ktorým je podávaný warfarín alebo podobné látky zvážiť sledovanie antikoagulačnej aktivity.
Dezipramín/ substráty CYP2D6.
Pri pokusoch in vitro sa ukázalo, že febuxostat je slabým ihhibítorom CYP2D6 . V štúdii so zdravými subjektmi spôsobilo 120 mg ADENURICU QD priemerne 22% nárast AUC desipraminu, CYP2D6 substrátu, čo naznačuje možný slabý inhibičný účinok febuxostatu na enzým CYP2D6 in vivo. Preto sa nepredpokladá, že súčasné podávanie febuxostatu s inými substrátmi CYP2D6 bude vyžadovať upravenie dávky pre tieto liečivá.
Antacidy
Ukázalo sa, že pri súčasnom užití antacidov s obsahom hydroxidu horečnatého a hydroxidu hlinitého sa oneskorí absorpcia febuxostatu (približne o 1 hodinu) a o 32% sa zníži hodnota Cmax, ale nebola pozorovaná žiadna významná zmena AUC. Febuxostat možno preto užívať bez ohľadu na užívanie antacidov.
4.6 Gravidita a laktácia
Gravidita
Údaje o veľmi obmedzenom počte gravidných žien užívajúcich febuxostat nepreukázali žiadne nežiaduce účinky na graviditu alebo na zdravie plodu/novorodenca. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývoj alebo pôrod (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Febuxostat sa nesmie používať počas gravidity.
Dojčenie
Nie je známe, či sa febuxostat vylučuje do ľudského mlieka. Štúdie na zvieratách preukázali vylučovanie tohto liečiva do mlieka a zhoršený vývin kojených mláďat. Nemožno vylúčiť riziko pre dojča. Febuxostat sa nesmie používať počas dojčenia.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Podobne ako u iných inhibítorov xantínoxidázy boli pozorované nežiaduce účinky, ako napríklad ospanlivosť, závraty a parestézia. Pacienti by mali dbať na opatrnosť pred tým, než budú viesť motorové vozidlo, obsluhovať stroje alebo sa podieľať na nebezpečných
aktivitách, pokiaľ nie sú pevne presvedčení, že ADENURIC neovplyvňuje nežiaduco ich výkonnosť.
4.8 Nežiaduce účinky
V klinických štúdiách bola celkovo 2531 subjektom podaná minimálne jedna dávka
ADENURICU (10 mg - 300 mg).
Randomizované kontrolované štúdie fázy 3
V randomizovaných kontrolovaných klinických štúdiách fázy 3 bolo viac ako 1000 pacientov liečených odporúčanými dávkami 80 mg alebo 120 mg (536 subjektov zahrnutých v 28- týždňovej štúdii a 507 subjektov zahrnutých v 52-týždňovej štúdii). Udalosti spojené
s liečbou (ADR) boli väčšinou mierne alebo stredne závažné.
Najčastejšie hlásené ADR (hodnotenie vyšetrovateľa) sú abnormality funkcie pečene (3,5%), hnačka (2,7%), bolesť hlavy (1,8%), nevoľnosť (1,7%), vyrážka (1,5 %).
V porovnaní so skupinou podstupujúcou liečbu alopurinolom bol v celkovej skupine podstupujúcej liečbu febuxostatom pozorovaný a vyšetrovateľom hlásený číselne vyšší výskyt kardiovaskulárnych príhod v pivotnej fáze 3 (1,3 oproti 0,3 príhodám na 100 pacient-rokov) a dlhodobých rozšírených štúdiách (1,4 oproti 0,7 príhodám na 100 pacient-rokov), hoci sa nenašli žiadne štatisticky významné rozdiely a u febuxostatu nebol potvrdený žiadny príčinný vzťah. Rizikové faktory, ktoré boli identifikované u týchto pacientov, zahŕňali anamnézu aterosklerotického ochorenia srdca a/alebo infarktu myokardu alebo chronického srdcového zlyhania .
Nižšie sú uvedené časté (od ≥ 1/100 do < 1/10), menej časté (od ≥ 1/1 000 do < 1/100) a zriedkavé (od ≥ 1/10 000 do < 1/1 000) nežiaduce reakcie, u ktorých je podozrenie, že súvisia s liekmi (hodnotenie vyšetrovateľa) a ktoré sa vyskytovali v skupinách podstupujúcich liečbu
80 mg/120 mg a boli pozorované viac ako raz v celkovej skupine podstupujúcej liečbu febuxostatom.
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Abnormálne laboratórne a funkčné vyšetrenia
| Menej časté
Zvýšenie amylázy v krvi, zníženie počtu trombocytov, zvýšenie kreatinínu v krvi, pokles hemoglobínu, zvýšenie močoviny v krvi, zvýšenie LDH, zvýšenie triglyceridov
| Ochorenia srdca a poruchy srdcovej činnosti
| Zriedkavé
Palpitácie (búšenie srdca)
| Poruchy nervového systému
| Časté
Bolesť hlavy
Menej časté
Závraty, parestézia, ospanlivosť, zmenená chuť
| Poruchy a ochorenia gastrointestinálneho traktu
| Časté
Hnačka*, nevoľnosť*
Menej časté
Bolesti brucha, gastroezofageálny reflux, vracanie*, suchosť v ústach, dyspepsia, zápcha, častá stolica, nadúvanie, gastrointestinálne potiaže,
| Poruchy obličiek a močovej sústavy
| Menej časté
Nefrolitiáza, hematúria, polakiúria
Zriedkavé
Obličková nedostatočnosť
| Poruchy kože a podkožného
| Časté
|
|
|
Tabuľka 1: Nežiaduce reakcie súvisiace s liečbou v randomizovaných kontrolných štúdiách fázy 3
tkaniva
|
Vyrážka**
Menej časté
Dermatitída, urtikária, pruritus
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Menej časté
Artralgia, artritída, myalgia, svalové kŕče, bolesti svalov a kĺbov
|
Poruchy metabolizmu a výživy
|
Menej časté
Zvýšenie hmotnosti, zvýšená chuť do jedla
|
Cievne poruchy
|
Menej časté
Hypertenzia, začervenenie, návaly tepla
|
Celkové ochorenia a reakcie v mieste podania
|
Menej časté
Únava, edém, symptómy podobné chrípke
Zriedkavé
Telesná slabosť, smäd
|
Ochorenia pečene a žlčových ciest
|
Časté
Abnormality pri teste funkcie pečene (LFT)
|
Psychiatrické poruchy a ochorenia
|
Menej časté Znížené libido Zriedkavé
Nervozita, nespavosť
|
* Hnačka, nevoľnosť a vracanie sú častejšie u pacientov, ktorí sú súčasne liečení kolchicínom
** V klinických štúdiách neboli zaznamenané žiadne závažné vyrážky ani závažné hypersenzitívne reakcie.
Otvorené dlhodobé rozšírené štúdieV dlhodobých otvorených rozšírených štúdiách bol počet pacientov liečených febuxostatom
80 mg/120 mg maximálne 1 rok 906, maximálne 2 roky 322, maximálne 3 roky 57 a maximálne 4 roky 53. Udalosti spojené s liečbou zaznamenané počas dlhodobých otvorených rozšírených štúdií boli podobné ako udalosti zaznamenané v štúdiách fázy 3 (pozri tabuľku 1). Najčastejšie zaznamenané udalosti spojené s liečbou (hodnotenie vyšetrovateľa) sú tieto: abnormality funkcie pečene, hnačka, bolesti hlavy, vyrážka, hypertenzia.
Nasledujúce udalosti spojené s liečbou boli v celkovej skupine liečenej febuxostatom zaznamenané viac ako raz a boli zaznamenané ako menej časté u subjektov, ktorí užívali
80 mg/120 mg febuxostatu v dlhodobých otvorených rozšírených štúdiách (maximálne 4 roky, >1 900 pacient-rokov expozície). Tieto udalosti spojené s liečbou buď neboli zaznamenané alebo boli zaznamenané pre tieto dávky s nižšou frekvenciou v kľúčových štúdiách fázy 3: Diabetes, hyperlipidémia, nespavosť, hypoestézia, abnormálne EKG, kašeľ, dyspnoe, zmena sfarbenia kože, kožné lézie, burzitída, proteinúria, obličková nedostatočnosť, erektilná dysfunkcia, zvýšenie draslíka v krvi, zvýšenie THS v krvi, znížený počet lymfocytov, zníženie počtu bielych krviniek.
4.9 Predávkovanie
Nebol hlásený žiaden prípad predávkovania. Liečba pacientov s prejavmi predávkovania je podporná a symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Prípravky inhibujúce produkciu kyseliny močovej, ATC kód: M04AA03
Mechanizmus činnosti
Kyselina močová je koncový produkt metabolizmu purínov a vytvára sa v stupňoch hypoxantín → xantín → kyselina močová. Obidva stupne v uvedenom mechanizme sú katalyzované xantínoxidázou (XO). Febuxostat je derivát 2-aryltiazolu, ktorý dosahuje terapeutický účinok zníženia kyseliny močovej v sére selektívnou inhibíciou XO. Febuxostat je potentný nepurínový selektívny inhibítor XO (NP-SIXO), ktorého hodnota Ki in vitro je
menej ako jeden nanomol. Ukázalo sa, že febuxostat účinne inhibuje oxidované aj redukované formy XO. V terapeutických koncentráciách febuxostat neinhibuje iné enzýmy, ktoré sa zúčastňujú na metabolizme purínu alebo pyrimidínu, konkrétne guaníndeaminázu, hypoxantínguanínfosforibozyltransferázu, orotát fosforibozyltransferázu, orotidín monofosfát dekarboxylázu alebo purínnukleozidfosforylázu.
Výsledky klinických štúdií
Účinnosť ADENURICU bola preukázaná v dvoch kľúčových štúdiách fázy 3 (štúdia APEX a štúdia FACT popísané nižšie), ktoré boli uskutočnené na základe 1832 pacientov
s hyperurikémiou a dnou. V každej kľúčovej štúdii fázy 3 preukázal ADENURIC vynikajúcu schopnosť znížiť a udržať koncentrácie kyseliny močovej v sére porovnateľné s alopurinolom. Primárny koncový bod účinnosti v každej štúdii predstavoval podiel pacientov, u ktorých boli koncentrácie kyseliny močovej v sére za posledné 3 mesiace < 6,0 mg/dl (357 µmol/l). Do týchto štúdií neboli zahrnutí žiadni pacienti s orgánovými transplantáciami (pozri časť 4.2).
Štúdia APEX: Štúdia účinnosti febuxostatu kontrolovaná na základe alopurinolu a placeba (APEX) bola randomizovaná, dvojito zaslepená, multicentrická štúdia fázy 3 v trvaní 28 týždňov. Randomizovaných bolo tisícsedemdesiatdva pacientov (1072): placebo (n=134), ADENURIC 80 mg QD (n=267), ADENURIC 120 mg QD (n=269), ADENURIC 240 mg QD (n=134) alebo alopurinol (300 mg QD [n=258] u pacientov so základnou hodnotou kreatinínu v sére ≤1,5 mg/dl alebo 100 mg QD [n=10] u pacientov so základnou hodnotou
kreatinínu v sére >1,5 mg/dl a ≤2,0 mg/dl). Dvestoštyridsať mg febuxostatu (dvojnásobne
vyššia dávka ako je najvyššia odporúčaná dávka) bolo použitých ako dávka na vyhodnotenie
bezpečnosti.
Štúdia APEX ukázala štatisticky významné zlepšenie výsledkov obidvoch liekov ADENURIC 80 mg QD a ADENURIC 120 mg QD pri liečbe oproti tradične používaným dávkam alopurinolu 300 mg (n = 258) /100mg (n = 10) v liečbe pri znižovaní kyseliny močovej pod úroveň 6 mg/dl (357 µmol/l) (pozri tabuľku 2 a obrázok 1).
Štúdia FACT: Skúšobná štúdia kontrolovaná febuxostatom a alopurinolom (FACT) bola randomizovaná, dvojito zaslepená, multicentrická štúdia fázy 3 v trvaní 52 týždňov.
Sedemstošesťdesiat pacientov (760) bolo randomizovaných: ADENURIC 80 mg QD (n=256), ADENURIC 120 mg QD (n=251) alebo alopurinol 300 mg QD (n=253).
Štúdia FACT ukázala štatisticky významné zlepšenie výsledkov obidvoch liekov
ADENURIC 80 mg a ADENURIC 120 mg QD pri liečbe
oproti tradične používaným
dávkam alopurinolu 300 mg v liečbe pri znižovaní kyseliny močovej a udržovaní jej hodnoty pod 6 mg/dl (357 µmol/l).
V tabuľke 2 je zhrnutá primárna účinnosť výsledkov v koncovom bode:
Tabuľka 2Percento pacientov s koncentráciami kyseliny močovej v sére <6,0 mg/dl (357µmol/l) Posledné tri mesačné návštevy
Štúdia
|
ADENURIC
80 mg QD
|
ADENURIC
120 mg QD
| Alopurinol
300 /
100 mg QD1
|
APEX
(28 týždňov)
| 48% *
(n=262)
| 65% *, #
(n=269)
| 22%
(n=268)
|
FACT
(52 týždňov)
| 53%*
(n=255)
| 62%*
(n=250)
| 21%
(n=251)
|
Kombinované
výsledky
| 51%*
(n=517)
| 63%*, #
(n=519)
| 22%
(n=519)
|
1 výsledky od subjektov, ktorým bolo podávané buď 100 mg QD (n=10: pacienti
so sérovým kreatinínom >1,5 a ≤2,0 mg/dl) alebo 300 mg QD (n=509) boli kvôli analýzam zoskupení.
* p < 0,001 oproti alopurinolu, # p < 0,001 oproti 80 mg
|
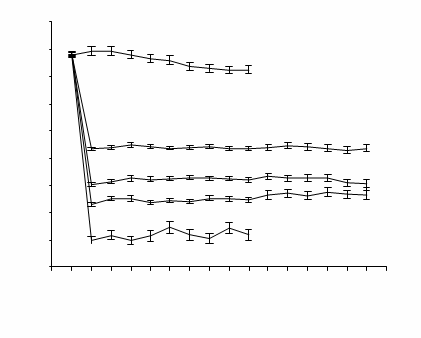
Schopnosť ADENURICU znížiť koncentrácie kyseliny močovej v sére bola pohotová
a pretrvávala. Zníženie koncentrácie kyseliny močovej v sére na <6,0 mg/dl (357 µmol/l) bolo zaznamenané počas návštevy v 2. týždni a udržovalo sa na rovnakej úrovni počas celej liečby. Priemerné koncentrácie kyseliny močovej v sére v čase pre každú skupinu podstupujúcu
liečbu z kľúčovej štúdie fázy 3 sú znázornené na obrázku 1.
Obrázok 1 Priemerné koncentrácie kyseliny močovej v sére v kombinovaných štúdiách fázy 3
11
10 Placebo
9
8
7 Al lopurinol
6
ADENURIC 80 mg
5
4
ADENURIC 120 mg
3
ADENURIC 240 mg
2
B L 2 4 6 8 12 16 20 24 28 32 36 40 44 48 52
Týždeň
BL=baseline SEM=standard error of the mean
Poznámka: 509 pacientom bolo podávané 300 mg QD alopurinolu; 10 pacientom so sérovým kreatinínom >1,5 a
< 2,0 mg/dl bolo podávaných 100 mg QD. (10 pacientov z 268 v štúdii APEX).
Na vyhodnotenie bezpečnosti febuxostatu sa použilo 240 mg febuxostatu, čo je dvojnásobne vyššia dávka ako je najvyššia odporúčaná dávka.
Primárny koncový bod u podskupiny pacientov s poškodením obličiekŠtúdia APEX hodnotila účinnosť u 40 pacientov s poškodením obličiek (t.j. základný sérový kreatinín > 1,5 mg/dl a <=2,0 mg/dl). U subjektov s poškodením obličiek, ktorí boli náhodne vybratí na užívanie alopurinolu, bola pokrytá dávka 100 mg QD. ADENURIC dosiahol primárny koncový bod účinnosti u 44% (80 mg QD), 45% (120 mg QD) a 60% (240 mg QD) pacientov v porovnaní s 0 % v skupine užívajúcej 100 mg QD alopurinolu a skupine užívajúcej placebo.
Medzi percentuálnym poklesom kyseliny močovej v sére u zdravých subjektov bez ohľadu na ich funkciu obličiek neboli žiadne klinicky významné rozdiely (58% v skupine s normálnou funkciou obličiek a 55% v skupine so závažným poškodením obličiek).
Primárny koncový bod u skupiny pacientov s koncentráciou kyseliny močovej v sére ≥ 10mg/dlPribližne u 40% pacientov (kombinované APEX a FACT) bola základná koncentrácia kyseliny močovej v sére ≥ 10 mg/dl. V tejto podskupine ADENURIC dosiahol primárny koncový bod účinnosti u 41% (80 mg QD), 48% (120 mg QD) a 66% (240 mg QD) pacientov v porovnaní s 9% v skupine užívajúcej 300 mg/100 mg QD alopurinolu a 0 % v skupine užívajúcej placebo.
Klinické výstupy: percento pacientov, ktorí vyžadovali liečbu kvôli vzplanutiu dnavého záchvatu a zmene veľkosti tofov.Percento pacientov, ktorí vyžadovali liečbu kvôli vzplanutiu dnavého záchvatu (štúdia APEX a FACT) bolo číselne nižšie v skupinách, ktoré dosiahli priemernú neskoršiu koncentráciu urátov v sére <6,0 mg/dl, <5,0 mg/dl, alebo <4,0 mg/dl v porovnaní so skupinou, ktorá dosiahla priemernú neskoršiu koncentráciu urátov v sére ≥6,0 mg/dl počas posledných 32 týždňov obdobia liečby (intervaly 20. týždeň – 24. týždeň až 48 – 52. týždeň).
Údaje získané počas dvoch rokov trvania otvorenej dlhodobej rozšírenej štúdie fázy 3 ukázali, že udržovanie koncentrácií urátov v sére <6 mg/dl (<357 µmol/l) malo za následok zníženie výskytu dnavých záchvatov u menej než 3% subjektov, ktorí si vyžadovali liečbu záchvatu
(t.j. viac než 97% pacientov nevyžadovalo liečbu záchvatu) v 16. až 24. mesiaci. Toto bolo spojené so zmenšením veľkosti tofu, ktoré viedlo k úplnému rozpusteniu u 54% subjektov v
24. mesiaci.
Počas klinických štúdií fázy 3 boli pozorované mierne abnormálnosti pri teste funkcie pečene u pacientov liečených febuxostatom (3,5%). Frekvencie výskytu týchto odchýlok boli podobné ako pri liečbe alopurinolom (pozri časť 4.4). Zvýšené hodnoty TSH (>5,5 µIU/ml) boli pozorované u pacientov liečených febuxostatom dlhodobo (5,0%) a pacientov liečených alopurinolom (5,8%) v dlhodobých otvorených rozšírených štúdiách (pozri časť 4.4).
Celkové podávanie ADENURICU v kľúčových štúdiách fázy 3 a dlhodobých rozšírených štúdiách je väčšie ako 2700 pacient-rokov.
5.2 Farmakokinetické vlastnosti
U zdravých subjektov sa maximálne koncentrácie febuxostatu v plazme (Cmax) a plocha pod krivkou koncentrácie febuxostatu v plazme v priebehu času (AUC) zvýšili úmerne k dávke podľa toho, či boli podávané jednotlivé alebo viaceré dávky 10 mg až 120 mg. Pri dávkach medzi 120 mg a 300 mg je vyšší nárast AUC ako nárast úmerný dávke pozorovaný v prípade febuxostatu. Pri podávaní dávok 10 mg až 240 mg každých 24 hodín nedochádza k žiadnemu významnejšiemu nárastu. Febuxostat má zjavný priemerný polčas eliminácie (t1/2) približne 5 až 8 hodín.
Farmakokinetické/ farmakodynamické analýzy jednotlivých skupín boli vykonané u 211 pacientov s hyperurikémiou a dnou, ktorí boli liečení ADENURICOM v množstve 40-240 mg QD. Vo všeobecnosti sú farmakokinetické parametre febuxostatu určené týmito analýzami v súlade s parametrami získanými u zdravých subjektov, čo znamená, že zdravé subjekty sú reprezentatívnou vzorkou na hodnotenie farmakokinetických, resp. farmakodynamických vlastností u skupiny pacientov s dnou.
Absorpcia
Febuxostat sa absorbuje veľmi rýchlo (tmax 1,0-1,5 hod.) a dobre (minimálne 84%).
Po jednej dávke alebo viacerých perorálnych 80 a 120 mg dávkach podávaných raz za deň
má Cmax hodnotu približne 2,8-3,2 µg/ml v prípade 80 mg dávok a 5,0-5,3 µg/ml v prípade
120 mg dávok. Absolútna biologická dostupnosť febuxostatu vo forme tabliet nebola
stanovená.
Po viacerých perorálnych 80 mg dávkach podávaných raz denne alebo 120 mg dávke s jedlom obsahujúcim vysoký podiel tukov bol odmeraný 49% a 38% pokles Cmax a 18% a 16% pokles AUC. V príslušných testoch však nebola pozorovaná žiadna klinicky významná zmena v percentuálnom poklese kyseliny močovej v sére (viacero 80 mg dávok). ADENURIC je preto možné užívať bez ohľadu na jedlo.
Distribúcia
Typický rovnovážny objem distribúcie (Vss/F) febuxostatu je po podaní perorálnych dávok
10-300 mg od 29 do 75 l. Febuxostat sa viaže na proteíny v plazme s hodnotou približne 99,2
%, (primárne na albumín), a je konštantný v priebehu celého rozsahu koncentrácie
dosiahnutého dávkami 80 a 120 mg. Väzba aktívnych metabolitov na proteíny v plazme má rozsah približne od 82% do 91%.
Metabolizmus
Febuxostat sa metabolizuje do značnej miery konjugáciou prostredníctvom enzýmového systému uridíndifosfát-glukuronyltransferázy (UDPGT) a oxidáciou prostredníctvom cytochrómového P450 (CYP) systému. Boli identifikované štyri farmakologicky aktívne hydroxylové metabolity, z ktorých sa tri vyskytujú v ľudskej plazme. Štúdie in vitro s ľudskými pečeňovými mikrozómami ukázali, že tieto oxidačné metabolity boli vytvorené primárne pomocou CYP1A1, CYP1A2,
CYP2C8 alebo CYP2C9 a febuxostat- glukuronid bol vytvorený najmä pomocou UGT 1A1,
1A8 a 1A9.
Eliminácia
Febuxostat sa eliminuje prostredníctvom pečene aj prostredníctvom obličiek. Po podaní perorálnej dávky 80 mg febuxostatu označeného 14C bolo približne 49% dávky znova získaného v moči ako nezmenený febuxostat (3%), acylglukuronid liečiva (30%), jeho známe oxidačné metabolity a ich konjugáty (13%), a iné neznáme metabolity (3%). Okrem vylučovania obličkami bolo približne 45% dávky znova získaného v stolici ako nezmenený febuxostat (12%), acylglukuronid liečiva (1%), jeho známe oxidačné metabolity a ich konjugáty (25%), a iné neznáme metabolity (7%).
Špecifické skupiny pacientov
Obličková nedostatočnosť
Po viacerých dávkach 80 mg ADENURICU u pacientov s miernou, strednou alebo závažnou obličkovou nedostatočnosťou sa hodnota Cmax febuxostatu vzhľadom na subjekty s normálnou funkciou obličiek nezmenila. Priemerná celková AUC febuxostatu sa zvýšila približne 1,8- násobne od 7,5 μg⋅h/ml v skupine s normálnou funkciou obličiek po 13,2 μg.h/ml v skupine
so závažnou renálnou dysfunkciou. Hodnoty Cmax a AUC aktívnych metabolitov sa zvýšili 2-
násobne pre Cmax a 4-násobne pre AUC. U pacientov s miernym alebo stredným poškodením
obličiek však nie je potrebná žiadna úprava dávky.
Poškodenie pečene
Po viacerých 80 mg dávkach ADENURICU u pacientov s miernym poškodením pečene (Child-Pugh trieda A) alebo stredne závažným poškodením pečene (Child-Pugh trieda B) sa hodnoty Cmax a AUC febuxostatu a jeho metabolitov významne nezmenili v porovnaní so subjektmi s normálnou funkciou pečene. Neboli uskutočnené štúdie u pacientov so závažným poškodením pečene (Child-Pugh trieda C).
Vek
Neboli pozorované žiadne významné zmeny AUC febuxostatu alebo jeho metabolitov po viacerých perorálnych dávkach ADENURICU u starších ľudí v porovnaní s mladšími zdravými subjektmi.
Pohlavie
Po viacerých perorálnych dávkach ADENURICU boli hodnoty Cmax o 24% vyššie u žien ako u mužov a hodnoty AUC boli o 12% vyššie u žien ako u mužov. Hodnoty Cmax a AUC upravené podľa hmotnosti boli však podobné medzi oboma pohlaviami. Nie je potrebná žiadna úprava dávky na základe pohlavia.
5.3 Predklinické údaje o bezpečnosti
Účinky v predklinických štúdiách sa všeobecne pozorovali pri expozíciách vyšších než je maximálna expozícia u ľudí.
Karcinogenéza, mutagenéza, poruchy plodnosti
U samčích potkanov bol štatisticky významný nárast tumorov močového mechúra
(prechodnobunkový papilóm a karcinóm) zistený iba v spojení s množstvom xantínu
v skupine s vysokou dávkou pri dávke približne 11 krát vyššej, ako je podávaná u ľudí. Nebol pozorovaný signifikantný nárast žiadneho iného typu tumoru v samčích ani v samičích myšiach ani potkanoch. Tieto nálezy sa pokladajú za dôsledok purínového metabolizmu
a zloženia moču špecifického pre príslušný druh a nemajú žiadny význam pre klinické použitie.
Štandardná skupina testov na genotoxicitu neodhalila žiadne biologicky významné genotoxické účinky pre febuxostat.
Zistilo sa, že febuxostat, podávaný v perorálnych dávkach maximálne 48 mg za deň, nemal žiadne účinky na plodnosť a reprodukciu u samčích ani samičích potkanov.
Neboli zistené žiadne dôkazy oslabenej plodnosti, teratogénnych účinkov alebo poškodenia plodu spôsobené febuxostatom. Pri použití dávok približne 4,3 krát vyšších ako sú expozície používané u ľudí sa zistila toxicita pre matky spojená s vysokými dávkami, ktorá bola sprevádzaná znížením indexu kojenia a zníženým vývinom mláďat u potkanov. Teratologické štúdie uskutočnené u gravidných samíc potkanov pri použití dávok približne 4,3-krát vyšších ako expozície u ľudí a u gravidných samíc králikov 13-krát vyšších ako expozície u ľudí, neodhalili žiadne teratogénne účinky.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety monohydrát laktózy mikrokryštalická celulóza magnéziumstearát hydroxypropylcelulóza sodná soľ kroskarmelózy
koloidný hydratovaný oxid kremičitý
Obal tablety
Opadry II, žltá, 85F42129, obsah:
polyvinyl alkohol oxid titaničitý (E171) makrogoly 3350 mastenec
žltý oxid železnatý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaPriehľadný (Aclar/PVC/hliník) blister so 14 tabletami.
ADENURIC 80 mg je k dispozícii vo veľkosti balení s 28 a 84 filmom obalenými tabletami. Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBeaufour Ipsen Pharma
24 rue Erlanger
75781 Paris Cedex 16
France
8. REGISTRAČNÉ ČÍSLO (
ČÍSLA)EU/1/08/447/001
EU/1/08/447/002
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE21/04/2008
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto produkte sú dostupné na internetovej stránke Európskej liekovej agentúry (EMEA)
http://www.emea.europa.eu/
1. NÁZOV LIEKU
ADENURIC 120 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tableta obsahuje 120 mg febuxostatu.
Pomocné látky: Každá tableta obsahuje 114,75 mg monohydrátu laktózy. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta.
Svetložltá až žltá tableta, potiahnutá filmom, v tvare kapsuly, na jednej strane vtlačené číslo
"120".
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba chronickej hyperurikémie pri stavoch, v ktorých už došlo k ukladaniu urátov (vrátane anamnézy alebo prítomnosti tofu a/alebo dnavej artritídy).
4.2 Dávkovanie a spôsob podávania
Odporúčaná perorálna dávka ADENURICU je 80 mg denne bez ohľadu na jedlo. Ak je po 2-4 týždňoch koncentrácia kyseliny močovej v sére > 6 mg/dl (357 µmol/l), môže sa zvážiť podávanie ADENURICU 120 mg raz denne.
ADENURIC funguje dostatočne rýchlo, aby bolo možné opätovné vyšetrenie kyseliny močovej v sére po 2 týždňoch. Terapeutickým cieľom je znížiť a udržiavať kyselinu močovú v sére pod 6 mg/dl (357µmol/l).
Odporúča sa profylaxia vzplanutia dnavého záchvatu minimálne 6 mesiacov (pozri časť 4.4).
Špecifické skupiny pacientov
Obličková nedostatočnosť
U pacientov s miernym alebo stredne závažným poškodením obličiek nie je potrebná žiadna úprava dávky. Účinnosť a bezpečnosť neboli úplne vyhodnotené u pacientov s vážnym poškodením obličiek (klírens kreatinínu <30 ml/min, pozri časť 5.2)
Poškodenie pečene
Odporúčané dávkovanie u pacientov s miernym poškodením pečene je 80 mg. U pacientov
so stredne závažným poškodením pečene sú k dispozícii iba obmedzené informácie. Účinnosť
a bezpečnosť febuxostatu neboli preštudované u pacientov so závažným poškodením pečene
(Child Pugh trieda C).
Starší pacienti
Nie je potrebná žiadna úprava dávky u starších pacientov (pozri časť 5.2).
Deti a dospievajúci
Keďže nie sú žiadne skúsenosti s použitím u detí a dospievajúcich, použitie febuxostatu u týchto pacientov sa neodporúča.
Príjemcovia transplantovaných orgánov
Keďže nie sú žiadne skúsenosti s použitím u príjemcov transplantovaných orgánov, použitie febuxostatu sa u týchto pacientov neodporúča (pozri časť 5.1).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na niektorú z pomocných látok (pozri časť 4.8).
4.4 Osobitné upozornenia a opatrenia pri používaní
Kardiovaskulárne poruchy
U pacientov s ischemickou chorobou srdca alebo chronickým srdcovým zlyhávaním sa liečba febuxostatom neodporúča (pozri časť 4.8).
Akútne dnavé záchvaty
Liečba febuxostatom sa nesmie začať, pokiaľ úplne neodznie akútny dnavý záchvat. Tak ako
v prípade iných liekov na zníženie urátov sa po začatí liečby môžu vyskytnúť dnavé záchvaty, a to kvôli zmene koncentrácie kyseliny močovej v sére vyplývajúcej z mobilizácie urátov uložených v tkanivách. Pri začatí liečby febuxostatom sa odporúča profylaxia záchvatu najmenej 6 mesiacov pomocou NSAID alebo kolchicínu.
Ak sa dnavý záchvat vyskytne počas liečby febuxostatom, liečba sa nesmie prerušiť. Dnavý záchvat je potrebné zvládnuť podľa vhodnosti pre príslušného pacienta. Nepretržité podávanie febuxostatu znižuje frekvenciu a intenzitu dnavých záchvatov.
Ukladanie xantínu
Podobne ako v prípade iných liekov na zníženie urátov by sa u pacientov, u ktorých je významne zvýšená rýchlosť ukladania urátov (napr. malígne ochorenie a jeho liečba, Leschov-Nyhanov syndróm), mohla absolútna koncentrácia xantínu v moči v ojedinelých prípadoch zvýšiť natoľko, že bude možné jej ukladanie v močovom trakte. Keďže nie sú žiadne skúsenosti s užívaním febuxostatu, u týchto skupín sa jeho užívanie neodporúča.
Merkaptopurín/azatioprín
Použitie febuxostatu sa neodporúča u pacientov, ktorí sú súčasne liečení merkaptopurínom alebo azatioprínom (pozri časť 4.5).
Teofylín
Febuxostat by sa mal používať opatrne u pacientov, ktorí sú súčasne liečení teofylínom
a u pacientov na začiatku liečby febuxostatom by sa mala monitorovať koncentrácia teofylínu
(pozri časť 4.5).
Poruchy pečene
Počas tretej fázy klinických štúdií boli u pacientov liečených febuxostatom pozorované mierne odchýlky v testoch funkcie pečene (3,5%). Pred začatím liečby febuxostatom a potom v pravidelných intervaloch sa odporúča vyšetriť funkciu pečene na základe klinického hodnotenia (pozri časť 5.1).
Poruchy štítnej žľazy
V otvorených rozšírených dlhodobých štúdiách boli u pacientov s dlhodobou liečbou febuxostatom (5.0%) pozorované zvýšené hodnoty TSH (>5,5 µIU/ml). Pri použití
febuxostatu u pacientov so zmenenou funkciou štítnej žľazy sa vyžaduje opatrnosť (pozri časť
5.1).
Laktóza
Tablety febuxostatu obsahujú laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie , lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Merkaptopurín/azatioprín
Napriek tomu, že neboli uskutočnené štúdie interakcie s febuxostatom, je známe, že inhibícia xantínoxidázy má za následok zvýšenie koncentrácií merkaptopurínu alebo azatioprínu. Na základe mechanizmu činnosti febuxostatu na inhibíciu xantínoxidázy sa súčasné používanie febuxostatu neodporúča.
Liekové interakčné štúdie febuxostatu s cytotoxickou chemoterapiou neboli vykonané. Nie sú k dispozícii žiadne údaje týkajúce sa bezpečnosti febuxostatu počas cytotoxickej terapie.
Teofylín
Napriek tomu, že s febuxostatom neboli uskutočnené interakčné štúdie, inhibícia xantínoxidázy môže spôsobiť zvýšenie koncentrácie teofylínu (inhibícia metabolizmu teofylínu bola pozorovaná pri použití iných inhibítorov xantínoxidázy). V prípade súčasného podávania týchto liečív sa preto odporúča opatrnosť, a u pacientov na začiatku liečby febuxostatom sledovanie koncentrácie teofylínu.
Naproxen a iné látky inhibujúce glukuronidáciu
Metabolizmus febuxostatu závisí na enzýmoch UGT. Lieky inhibujúce glukuronidáciu, ako napríklad NSAIDs a probenecid by teoreticky mohli ovplyvniť eliminovanie febuxostatu.
U zdravých osôb bolo súčasné užívanie 250 mg BID febuxostatu a naproxenu spojené so zvýšenou expozíciou febuxostatu (Cmax 28%, AUC 41% and t1/2 26%). V klinických štúdiách nebolo užívanie naproxenu ani iných inhibítorov NSAIDs/Cox-2 spojené so žiadnym signifikantným zvýšením nežiaducich účinkov.
Febuxostat možno podávať spolu s naproxenom, pričom nie je potrebná žiadna úprava dávky febuxostatu alebo naproxenu.
Látky indukujúce glukuronidáciu
Silné lieky indukujúce enzýmy UGT by mohli viesť k zvýšenému metabolizmu a zníženej účinnosti febuxostatu. Monitorovanie kyseliny močovej v sére sa preto odporúča 1-2 týždne po začatí liečby silným liekom indukujúcim glukuronidáciu. Naopak, skončenie liečby indukujúcim liekom by mohlo viesť k zvýšeným koncentráciám febuxostatu v plazme.
Kolchicín/indometacín/hydrochlortiazid/warfarín
Febuxostat možno podávať súčasne s kolchicínom alebo indometacínom bez potreby upraviť
dávku febuxostatu alebo súčasne podávaného liečiva.
Pri podávaní febuxostatu s hydrochlortiazidom nie je potrebná žiadna úprava dávky pre febuxostat.
Pri podávaní febuxostatu s warfarínom nie je potrebná žiadna úprava dávky pre warfarín. Po začatí terapie febuxostatom je potrebné u pacientov, ktorým je podávaný warfarín alebo podobné látky zvážiť sledovanie antikoagulačnej aktivity.
Dezipramín/ substráty CYP2D6.
Pri pokusoch in vitro sa ukázalo, že febuxostat je slabým ihhibítorom CYP2D6 . V štúdii so zdravými subjektmi spôsobilo 120 mg ADENURICU QD priemerne 22% nárast AUC dezipramínu, CYP2D6 substrátu, čo naznačuje možný slabý inhibičný účinok febuxostatu na enzým CYP2D6 in vivo. Preto sa nepredpokladá, že súčasné podávanie febuxostatu s inými substrátmi CYP2D6 bude vyžadovať upravenie dávky pre tieto liečivá.
Antacidy
Ukázalo sa, že pri súčasnom užití antacidov s obsahom hydroxidu horečnatého a hydroxidu hlinitého sa oneskorí absorpcia febuxostatu (približne o 1 hodinu) a o 32% sa zníži hodnota Cmax, ale nebola pozorovaná žiadna významná zmena AUC. Febuxostat možno preto užívať bez ohľadu na užívanie antacidov.
4.6 Gravidita a laktácia
Gravidita
Údaje o veľmi obmedzenom počte gravidných žien užívajúcich febuxostat nepreukázali žiadne nežiaduce účinky na graviditu alebo na zdravie plodu/novorodenca. Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývoj alebo pôrod (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Febuxostat sa nesmie používať počas gravidity.
Dojčenie
Nie je známe, či sa febuxostat vylučuje do ľudského mlieka. Štúdie na zvieratách preukázali vylučovanie tohto liečiva do mlieka a zhoršený vývin kojených mláďat. Nemožno vylúčiť riziko pre dojča. Febuxostat sa nesmie používať počas dojčenia.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Podobne ako u iných inhibítorov xantínoxidázy boli pozorované nežiaduce účinky, ako napríklad ospanlivosť, závraty a parestézia. Pacienti by mali dbať na opatrnosť pred tým, než budú viesť motorové vozidlo, obsluhovať stroje alebo sa podieľať na nebezpečných
aktivitách, pokiaľ nie sú pevne presvedčení, že ADENURIC neovplyvňuje nežiaduco ich výkonnosť.
4.8 Nežiaduce účinky
V klinických štúdiách bola celkovo 2531 subjektom podaná minimálne jedna dávka
ADENURICU (10 mg - 300 mg).
Randomizované kontrolované štúdie fázy 3
V randomizovaných kontrolovaných klinických štúdiách fázy 3 bolo viac ako 1000 pacientov liečených odporúčanými dávkami 80 mg alebo 120 mg (536 subjektov zahrnutých v 28- týždňovej štúdii a 507 subjektov zahrnutých v 52-týždňovej štúdii). Udalosti spojené
s liečbou (ADR) boli väčšinou mierne alebo stredne závažné.
Najčastejšie hlásené ADR (hodnotenie vyšetrovateľa) sú abnormality funkcie pečene (3,5%), hnačka (2,7%), bolesť hlavy (1,8%), nevoľnosť (1,7%), vyrážka (1,5 %).
V porovnaní so skupinou podstupujúcou liečbu alopurinolom bol v celkovej skupine podstupujúcej liečbu febuxostatom pozorovaný a vyšetrovateľom hlásený číselne vyšší výskyt kardiovaskulárnych príhod v pivotnej fáze 3 (1,3 oproti 0,3 príhodám na 100 pacient-rokov) a dlhodobých štúdiách (1,4 oproti 0,7 príhodám na 100 pacient-rokov), hoci sa nenašli žiadne štatisticky významné rozdiely a u febuxostatu nebol potvrdený žiadny príčinný vzťah. Rizikové faktory, ktoré boli identifikované u týchto pacientov, zahŕňali anamnézu aterosklerotického ochorenia srdca a/alebo infarktu myokardu alebo chronického srdcového zlyhania.
Nižšie sú uvedené časté (od ≥ 1/100 do < 1/10), menej časté (od ≥ 1/1 000 do < 1/100) a zriedkavé (od ≥ 1/10000 do < 1/1000) nežiaduce reakcie, u ktorých je podozrenie, že súvisia
s liekmi (hodnotenie vyšetrovateľa) a ktoré sa vyskytovali v skupinách podstupujúcich liečbu
80 mg/120 mg a boli pozorované viac ako raz v celkovej skupine podstupujúcej liečbu febuxostatom.
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Abnormálne laboratórne a funkčné vyšetrenia
| Menej časté
Zvýšenie amylázy v krvi, zníženie počtu trombocytov, zvýšenie kreatinínu v krvi, pokles hemoglobínu, zvýšenie močoviny v krvi, zvýšenie LDH, zvýšenie triglyceridov
| Ochorenia srdca a poruchy srdcovej činnosti
| Zriedkavé
Palpitácie (búšenie srdca)
| Poruchy nervového systému
| Časté
Bolesť hlavy
Menej časté
Závraty, parestézia, ospanlivosť, zmenená chuť
| Poruchy a ochorenia gastrointestinálneho traktu
| Časté
Hnačka*, nevoľnosť*
Menej časté
Bolesti brucha, gastroezofageálny reflux, vracanie*, suchosť v ústach, dyspepsia, zápcha, častá stolica, nadúvanie, gastrointestinálne potiaže,
| Poruchy obličiek a močovej sústavy
| Menej časté
Nefrolitiáza, hematúria, polakiúria
Zriedkavé
Obličková nedostatočnosť
|
|
|
Tabuľka 1: Nežiaduce reakcie súvisiace s liečbou v randomizovaných kontrolných štúdiách fázy 3
Poruchy kože a podkožného tkaniva
|
Časté Vyrážka** Menej časté
Dermatitída, urtikária, pruritus
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
Menej časté
Artralgia, artritída, myalgia, svalové kŕče, bolesti svalov a kĺbov
|
Poruchy metabolizmu a výživy'
|
Menej časté
Zvýšenie hmotnosti, zvýšená chuť do jedla
|
Cievne poruchy
|
Menej časté
Hypertenzia, začervenenie, návaly tepla
|
Celkové ochorenia a reakcie v mieste podania
|
Menej časté
Únava, edém, symptómy podobné chrípke
Zriedkavé
Telesná slabosť, smäd
|
Ochorenia pečene a žlčových ciest
|
Časté
Abnormality pri teste funkcie pečene (LFT)
|
Psychiatrické poruchy a ochorenia
|
Menej časté Znížené libido Zriedkavé
Nervozita, nespavosť
|
* Hnačka, nevoľnosť a vracanie sú častejšie u pacientov, ktorí sú súčasne liečení kolchicínom
** V klinických štúdiách neboli zaznamenané žiadne závažné vyrážky ani závažné hypersenzitívne reakcie.
Otvorené dlhodobé rozšírené štúdieV dlhodobých otvorených rozšírených štúdiách bol počet pacientov liečených febuxostatom
80 mg/120 mg maximálne 1 rok 906, maximálne 2 roky 322, maximálne 3 roky 57 a maximálne 4 roky 53. Udalosti spojené s liečbou zaznamenané počas dlhodobých otvorených rozšírených štúdií boli podobné ako udalosti zaznamenané v štúdiách fázy 3 (pozri tabuľku 1). Najčastejšie zaznamenané udalosti spojené s liečbou (hodnotenie vyšetrovateľa) sú tieto: abnormality funkcie pečene, hnačka, bolesti hlavy, vyrážka, hypertenzia.
Nasledujúce udalosti spojené s liečbou boli v celkovej skupine liečenej febuxostatom zaznamenané viac ako raz a boli zaznamenané ako menej časté u subjektov, ktorí užívali
80 mg/120 mg febuxostatu v dlhodobých otvorených rozšírených štúdiách (maximálne 4 roky, >1900 pacient-rokov expozície). Tieto udalosti spojené s liečbou buď neboli zaznamenané alebo boli zaznamenané pre tieto dávky s nižšou frekvenciou v kľúčových štúdiách fázy 3: Diabetes, hyperlipidémia, nespavosť, hypoestézia, abnormálne EKG, kašeľ, dyspnoe, zmena sfarbenia kože, kožné lézie, burzitída, proteinúria, obličková nedostatočnosť, erektilná dysfunkcia, zvýšenie draslíka v krvi, zvýšenie THS v krvi, znížený počet lymfocytov, zníženie počtu bielych krviniek.
4.9 Predávkovanie
Neboli hlásený žiaden prípad predávkovania. Liečba pacientov s prejavmi predávkovania je symptomatická a podporná.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Prípravky inhibujúce produkciu kyseliny močovej, ATC kód: M04AA03
Mechanizmus činnosti
Kyselina močová je koncový produkt metabolizmu purínov a vytvára sa v stupňoch hypoxantín → xantín → kyselina močová. Obidva stupne v uvedenom mechanizme sú katalyzované xantínoxidázou (XO). Febuxostat je derivát 2-aryltiazolu, ktorý dosahuje terapeutický účinok zníženia kyseliny močovej v sére selektívnou inhibíciou XO. Febuxostat je potentný nepurínový selektívny inhibítor XO (NP-SIXO), ktorého hodnota Ki in vitro je
menej ako jeden nanomol. Ukázalo sa, že febuxostat účinne inhibuje oxidované aj redukované formy XO. V terapeutických koncentráciách febuxostat neinhibuje iné enzýmy, ktoré sa zúčastňujú na metabolizme purínu alebo pyrimidínu, konkrétne guaníndeaminázu, hypoxantínguanínfosforibozyltransferázu, orotát fosforibozyltransferázu, orotidín monofosfát dekarboxylázu alebo purínnukleozidfosforylázu.
Výsledky klinických štúdií
Účinnosť ADENURICU bola preukázaná v dvoch kľúčových štúdiách fázy 3 (štúdia APEX a štúdia FACT popísané nižšie), ktoré boli uskutočnené na základe 1832 pacientov
s hyperurikémiou a dnou. V každej kľúčovej štúdii fázy 3 preukázal ADENURIC vynikajúcu schopnosť znížiť a udržať koncentrácie kyseliny močovej v sére porovnateľné s alopurinolom. Primárny koncový bod účinnosti v každej štúdii predstavoval podiel pacientov, u ktorých boli koncentrácie kyseliny močovej v sére za posledné 3 mesiace < 6,0 mg/dl (357 µmol/l). Do týchto štúdií neboli zahrnutí žiadni pacienti s orgánovými transplantáciami (pozri časť 4.2).
Štúdia APEX: Štúdia účinnosti febuxostatu kontrolovaná na základe alopurinolu a placeba (APEX) bola randomizovaná, dvojito zaslepená, multicentrická štúdia fázy 3 v trvaní 28 týždňov. Randomizovaných bolo tisícsedemdesiatdva pacientov (1072): placebo (n=134), ADENURIC 80 mg QD (n=267), ADENURIC 120 mg QD (n=269), ADENURIC 240 mg QD (n=134) alebo alopurinol (300 mg QD [n=258] u pacientov so základnou hodnotou kreatinínu v sére ≤1,5 mg/dl alebo 100 mg QD [n=10] u pacientov so základnou hodnotou
kreatinínu v sére >1,5 mg/dl a ≤2,0 mg/dl). Dvestoštyridsať mg febuxostatu (dvojnásobne
vyššia dávka ako je najvyššia odporúčaná dávka) bolo použitých ako dávka na vyhodnotenie
bezpečnosti.
Štúdia APEX ukázala štatisticky významné zlepšenie výsledkov obidvoch liekov ADENURIC 80 mg QD a ADENURIC 120 mg QD pri liečbe oproti tradične používaným dávkam alopurinolu 300 mg (n = 258) /100mg (n = 10) v liečbe pri znižovaní kyseliny močovej pod úroveň 6 mg/dl (357 µmol/l) (pozri tabuľku 2 a obrázok 1).
Štúdia FACT: Skúšobná štúdia kontrolovaná febuxostatom a alopurinolom (FACT) bola randomizovaná, dvojito zaslepená, multicentrická štúdia fázy 3 v trvaní 52 týždňov.
Sedemstošesťdesiat pacientov (760) bolo randomizovaných: ADENURIC 80 mg QD (n=256), ADENURIC 120 mg QD (n=251), alebo alopurinol 300 mg QD (n=253).
Štúdia FACT ukázala štatisticky významné zlepšenie výsledkov obidvoch liekov
ADENURIC 80 mg a ADENURIC 120 mg QD pri liečbe
oproti tradične používaným
dávkam alopurinolu 300 mg v liečbe pri znižovaní kyseliny močovej a udržovaní jej hodnoty pod 6 mg/dl (357 µmol/l).
V tabuľke 2 je zhrnutá primárna účinnosť výsledkov v koncovom bode:
Tabuľka 2Percento pacientov s koncentráciami kyseliny močovej v sére <6,0 mg/dl (357µmol/l) Posledné tri mesačné návštevy
Štúdia
|
ADENURIC
80 mg QD
|
ADENURIC
120 mg QD
| Alopurinol
300 /
100 mg QD1
|
|
APEX
(28 týždňov)
| 48% *
(n=262)
| 65% *, #
(n=269)
| 22%
(n=268)
|
FACT
(52 týždňov)
| 53%*
(n=255)
| 62%*
(n=250)
| 21%
(n=251)
|
Kombinované
výsledky
| 51%*
(n=517)
| 63%*, #
(n=519)
| 22%
(n=519)
|
| 1 výsledky od subjektov, ktorým bolo podávané buď 100 mg QD (n=10: pacienti
so sérovým kreatinínom >1,5 a ≤2,0 mg/dl) alebo 300 mg QD (n=509) boli kvôli analýzam zoskupení.
* p < 0,001 oproti alopurinolu, # p < 0,001 oproti 80 mg
|
| | | | | |
Schopnosť ADENURICU znížiť koncentrácie kyseliny močovej v sére bola pohotová
a pretrvávala. Zníženie koncentrácie kyseliny močovej v sére na <6,0 mg/dl (357 µmol/l) bolo zaznamenané počas návštevy v 2. týždni a udržovalo sa na rovnakej úrovni počas celej liečby. Priemerné koncentrácie kyseliny močovej v sére v čase pre každú skupinu podstupujúcu
liečbu z kľúčovej štúdie fázy 3 sú znázornené na obrázku 1.
Obrázok 1 Priemerné koncentrácie kyseliny močovej v sére v kombinovaných štúdiách fázy 3
11
10 Placebo
9
8
7 Al lopurinol
6

ADENURIC 80 mg
5
4
ADENURIC 120 mg
3
ADENURIC 240 mg
2
B L 2 4 6 8 12 16 20 24 28 32 36 40 44 48 52
Týždeň
BL=baseline SEM=standard error of the mean
Poznámka: 509 pacientom bolo podávané 300 mg QD alopurinolu; 10 pacientom so sérovým kreatinínom >1,5 a
< 2,0 mg/dl bolo podávaných 100 mg QD. (10 pacientov z 268 v štúdii APEX).
Na vyhodnotenie bezpečnosti febuxostatu sa použilo 240 mg febuxostatu, čo je dvojnásobne vyššia dávka ako je najvyššia odporúčaná dávka.
Primárny koncový bod u podskupiny pacientov s poškodením obličiekŠtúdia APEX hodnotila účinnosť u 40 pacientov s poškodením obličiek (t.j. základný sérový kreatinín > 1,5 mg/dl a <=2,0 mg/dl). U subjektov s poškodením obličiek, ktorí boli náhodne vybratí na užívanie alopurinolu, bola pokrytá dávka 100mg QD. ADENURIC dosiahol primárny koncový bod účinnosti u 44% (80 mg QD), 45% (120 mg QD) a 60% (240 mg QD) pacientov v porovnaní s 0% v skupine užívajúcej 100 mg QD alopurinolu a skupine užívajúcej placebo.
Medzi percentuálnym poklesom kyseliny močovej v sére u zdravých subjektov bez ohľadu na ich funkciu obličiek neboli žiadne klinicky významné rozdiely (58% v skupine s normálnou funkciou obličiek a 55% v skupine so závažným poškodením obličiek).
Primárny koncový bod u skupiny pacientov s koncentráciou kyseliny močovej v sére ≥ 10mg/dlPribližne u 40% pacientov (kombinované APEX a FACT) bola základná koncentrácia kyseliny močovej v sére ≥ 10 mg/dl. V tejto podskupine ADENURIC dosiahol primárny koncový bod účinnosti u 41% (80 mg QD), 48% (120 mg QD) a 66% (240 mg QD) pacientov v porovnaní s 9% v skupine užívajúcej 300 mg/100 mg QD alopurinolu a 0 % v skupine užívajúcej placebo.
Klinické výstupy: percento pacientov, ktorí vyžadovali liečbu kvôli vzplanutiu dnavého záchvatu a zmene veľkosti tofov.Percento pacientov, ktorí vyžadovali liečbu kvôli vzplanutiu dnavého záchvatu (štúdia APEX a FACT) bolo číselne nižšie v skupinách, ktoré dosiahli priemernú neskoršiu koncentráciu urátov v sére <6,0 mg/dl, <5,0 mg/dl alebo <4,0 mg/dl v porovnaní so skupinou, ktorá dosiahla priemernú neskoršiu koncentráciu urátov v sére ≥6,0 mg/dl počas posledných 32 týždňov obdobia liečby (intervaly 20. týždeň – 24. týždeň až 48 – 52. týždeň).
Údaje získané počas dvoch rokov trvania otvorenej dlhodobej rozšírenej štúdie fázy 3 ukázali, že udržovanie koncentrácií urátov v sére <6 mg/dl (<357 µmol/l) malo za následok zníženie výskytu dnavých záchvatov u menej než 3% subjektov, ktorí si vyžadovali liečbu záchvatu
(t.j. viac než 97% pacientov nevyžadovalo liečbu záchvatu) v 16. až 24. mesiaci. Toto bolo spojené so zmenšením veľkosti tofu, ktoré viedlo k úplnému rozpusteniu u 54% subjektov v
24. mesiaci.
Počas klinických štúdií fázy 3 boli pozorované mierne abnormálnosti pri teste funkcie pečene u pacientov liečených febuxostatom (3,5%). Frekvencie výskytu týchto odchýlok boli podobné ako pri liečbe alopurinolom (pozri časť 4.4). Zvýšené hodnoty TSH (>5,5 µIU/ml) boli pozorované u pacientov liečených febuxostatom dlhodobo (5,0%) a pacientov liečených alopurinolom (5,8%) v dlhodobých otvorených rozšírených štúdiách (pozri časť 4.4).
Celkové podávanie ADENURICU v kľúčových štúdiách fázy 3 a dlhodobých rozšírených štúdiách je väčšie ako 2700 pacient-rokov.
5.2 Farmakokinetické vlastnosti
U zdravých subjektov sa maximálne koncentrácie febuxostatu v plazme (Cmax) a plocha pod krivkou koncentrácie febuxostatu v plazme v priebehu času (AUC) zvýšili úmerne k dávke podľa toho, či boli podávané jednotlivé alebo viaceré dávky 10 mg až 120 mg. Pri dávkach medzi 120 mg a 300 mg, je vyšší nárast AUC ako nárast úmerný dávke pozorovaný v prípade febuxostatu. Pri podávaní dávok 10 mg až 240 mg každých 24 hodín nedochádza k žiadnemu významnejšiemu nárastu. Febuxostat má zjavný priemerný polčas eliminácie (t1/2) približne 5 až 8 hodín.
Farmakokinetické/ farmakodynamické analýzy jednotlivých skupín boli vykonané u 211 pacientov s hyperurikémiou a dnou, ktorí boli liečení ADENURICOM v množstve 40-240 mg QD. Vo všeobecnosti sú farmakokinetické parametre febuxostatu určené týmito analýzami v súlade s parametrami získanými u zdravých subjektov, čo znamená, že zdravé subjekty sú reprezentatívnou vzorkou na hodnotenie farmakokinetických, resp. farmakodynamických vlastností u pacientov s dnou.
Absorpcia
Febuxostat sa absorbuje veľmi rýchlo (tmax 1,0-1,5 hod.) a dobre (minimálne 84%).
Po jednej dávke alebo viacerých perorálnych 80 a 120 mg dávkach podávaných raz za deň
má Cmax hodnotu približne 2,8-3,2 µg/ml v prípade 80 mg dávok a 5,0-5,3 µg/ml v prípade
120 mg dávok. Absolútna biologická dostupnosť febuxostatu vo forme tabliet nebola
stanovená.
Po viacerých perorálnych 80 mg dávkach podávaných raz denne alebo 120 mg dávke s jedlom obsahujúcim vysoký podiel tukov bol odmeraný 49% a 38% pokles Cmax a 18% a 16% pokles AUC. V príslušných testoch však nebola pozorovaná žiadna klinicky významná zmena v percentuálnom poklese kyseliny močovej v sére (viacero 80 mg dávok). ADENURIC je preto možné užívať bez ohľadu na jedlo.
Distribúcia
Typický rovnovážny objem distribúcie (Vss/F) febuxostatu je po podaní perorálnych dávok
10-300 mg od 29 do 75 l. Febuxostat sa viaže na proteíny v plazme s hodnotou približne 99,2
%, (primárne na albumín), a je konštantný v priebehu celého rozsahu koncentrácie
dosiahnutého dávkami 80 a 120 mg. Väzba aktívnych metabolitov na proteíny v plazme má rozsah približne od 82% do 91%.
Metabolizmus
Febuxostat sa metabolizuje do značnej miery konjugáciou prostredníctvom enzýmového systému uridíndifosfát-glukuronyltransferázy (UDPGT) a oxidáciou prostredníctvom cytochrómového P450 (CYP) systému. Boli identifikované štyri farmakologicky aktívne hydroxylové metabolity, z ktorých sa tri vyskytujú v ľudskej plazme. Štúdie in vitro s ľudskými pečeňovými mikrozómami ukázali, že tieto oxidačné metabolity boli vytvorené primárne pomocou CYP1A1, CYP1A2,
CYP2C8 alebo CYP2C9 a febuxostat- glukuronid bol vytvorený najmä pomocou UGT 1A1,
1A8 a 1A9.
Eliminácia
Febuxostat sa eliminuje prostredníctvom pečene aj prostredníctvom obličiek. Po podaní perorálnej dávky 80 mg febuxostatu označeného 14C bolo približne 49% dávky znova získaného v moči ako nezmenený febuxostat (3%), acylglukuronid liečiva (30%), jeho známe oxidačné metabolity a ich konjugáty (13%), a iné neznáme metabolity (3%). Okrem vylučovania obličkami bolo približne 45% dávky znova získaného v stolici ako nezmenený febuxostat (12%), acylglukuronid liečiva (1%), jeho známe oxidačné metabolity a ich konjugáty (25%), a iné neznáme metabolity (7%).
Špecifické skupiny pacientov
Obličková nedostatočnosť
Po viacerých dávkach 80 mg ADENURICU u pacientov s miernou, strednou alebo závažnou obličkovou nedostatočnosťou sa hodnota Cmax febuxostatu vzhľadom na subjekty s normálnou funkciou obličiek nezmenila. Priemerná celková AUC febuxostatu sa zvýšila približne 1,8- násobne od 7,5 μg⋅h/ml v skupine s normálnou funkciou obličiek po 13,2 μg.h/ml v skupine
so závažnou renálnou dysfunkciou. Hodnoty Cmax a AUC aktívnych metabolitov sa zvýšili 2-
násobne pre Cmax a 4-násobne pre AUC. U pacientov s miernym alebo stredným poškodením
obličiek však nie je potrebná žiadna úprava dávky.
Poškodenie pečene
Po viacerých 80 mg dávkach ADENURICU u pacientov s miernym poškodením pečene (Child-Pugh trieda A) alebo stredne závažným poškodením pečene (Child-Pugh trieda B) sa hodnoty Cmax a AUC febuxostatu a jeho metabolitov významne nezmenili v porovnaní so subjektmi s normálnou funkciou pečene. Neboli uskutočnené štúdie u pacientov so závažným poškodením pečene (Child-Pugh trieda C).
Vek
Neboli pozorované žiadne významné zmeny AUC febuxostatu alebo jeho metabolitov po viacerých perorálnych dávkach ADENURICU u starších ľudí v porovnaní s mladšími zdravými subjektmi.
Pohlavie
Po viacerých perorálnych dávkach ADENURICU boli hodnoty Cmax o 24% vyššie u žien ako u mužov a hodnoty AUC boli o 12% vyššie u žien ako u mužov. Hodnoty Cmax a AUC upravené podľa hmotnosti boli však podobné medzi oboma pohlaviami. Nie je potrebná žiadna úprava dávky na základe pohlavia.
5.3 Predklinické údaje o bezpečnosti
Účinky v predklinických štúdiách sa všeobecne pozorovali pri expozíciách vyšších než je maximálna expozícia u ľudí.
Karcinogenéza, mutagenéza, poruchy plodnosti
U samčích potkanov bol štatisticky významný nárast tumorov močového mechúra
(prechodnobunkový papilóm a karcinóm) zistený iba v spojení s množstvom xantínu
v skupine s vysokou dávkou pri dávke približne 11 krát vyššej, ako je podávaná u ľudí. Nebol pozorovaný signifikantný nárast žiadneho iného typu tumoru v samčích ani v samičích myšiach ani potkanoch. Tieto nálezy sa pokladajú za dôsledok purínového metabolizmu
a zloženia moču špecifického pre príslušný druh a nemajú žiadny význam pre klinické použitie.
Štandardná skupina testov na genotoxicitu neodhalila žiadne biologicky významné genotoxické účinky pre febuxostat.
Zistilo sa, že febuxostat podávaný v perorálnych dávkach maximálne 48 mg za deň, nemal žiadne účinky na plodnosť a reprodukciu u samčích ani samičích potkanov.
Neboli zistené žiadne dôkazy oslabenej plodnosti, teratogénnych účinkov alebo poškodenia plodu spôsobené febuxostatom. Pri použití dávok približne 4,3 krát vyšších ako sú expozície používané u ľudí sa zistila toxicita pre matky spojená s vysokými dávkami, ktorá bola sprevádzaná znížením indexu kojenia a zníženým vývinom mláďat u potkanov. Teratologické štúdie uskutočnené u gravidných samíc potkanov pri použití dávok približne 4,3-krát vyšších ako expozície u ľudí a u gravidných samíc králikov 13-krát vyšších ako expozície u ľudí, neodhalili žiadne teratogénne účinky.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety monohydrát laktózy mikrokryštalická celulóza magnéziumstearát hydroxypropylcelulóza sodná soľ kroskarmelózy
koloidný hydratovaný oxid kremičitý
Obal tablety
Opadry II, žltá, 85F42129, obsah:
polyvinyl alkohol oxid titaničitý (E171) makrogoly 3350 mastenec
žltý oxid železnatý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaPriehľadný (Aclar/PVC/hliník) blister so 14 tabletami.
ADENURIC 120 mg je k dispozícii vo veľkosti balení s 28 a 84 filmom obalenými tabletami. Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBeaufour Ipsen Pharma
24 rue Erlanger
75781 Paris Cedex 16
France
8. REGISTRAČNÉ ČÍSLO (
ČÍSLA)EU/1/08/447/003
EU/1/08/447/004
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE21/04/2008
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto produkte sú dostupné na internetovej stránke Európskej liekovej agentúry (EMEA)
http://www.emea.europa.eu/