5pt'>
50 – 60
3,5 mg* kyseliny zoledrónovej
|
|
40 – 49
|
3,3 mg* kyseliny zoledrónovej
|
|
30 – 39
|
3,0 mg* kyseliny zoledrónovej
|
*
Dávky sa vypočítali pri predpokladanej AUC 0,66 (mg x hod/l) (CLcr
= 75 ml/min). Predpokladá sa, že pri znížených dávkach u pacientov
s poruchou funkcie obličiek sa dosiahne rovnaká AUC ako AUC, ktorá sa
pozorovala u pacientov s klírensom kreatinínu 75 ml/min.
Po
začiatku liečby sa pred každou dávkou lieku Zoledronic Acid Fresenius Kabi majú stanoviť hladiny sérového
kreatinínu a liečba sa má zamietnuť ak sa funkcia obličiek zhorší. V klinických
skúšaniach sa zhoršenie funkcie obličiek definovalo nasledovne:
-
U pacientov s normálnou
východiskovou hladinou sérového kreatinínu (< 1,4 mg/dl
alebo < 124 μmol/l) zvýšenie
o 0,5 mg/dl alebo 44 μmol/l;
-
U pacientov s východiskovou hladinou
sérového kreatinínu mimo normy (> 1,4 mg/dl alebo > 124 μmol/l),
zvýšenie o 1,0 mg/dl alebo 88 μmol/l.
V klinických
skúšaniach sa pokračovalo v liečbe kyselinou zoledrónovou, len ak sa
hladina kreatinínu vrátila na 10 % východiskovej hodnoty (pozri
časť 4.4). V liečbe liekom Zoledronic Acid Fresenius
Kabi sa má pokračovať s rovnakou dávkou, aká sa podávala
pred prerušením liečby.
Deti a dospievajúci
Bezpečnosť
a účinnosť kyseliny zoledrónovej u detí vo veku 1 až 17 rokov sa
nestanovili. V súčasnosti dostupné údaje sú opísané v častiach 4.4 a 5.1,
ale neumožňujú uviesť odporúčania na
dávkovanie.
Spôsob podania
Intravenózne použitie.
Infúzny
koncentrát Zoledronic Acid Fresenius Kabi 4 mg/5 ml sa má ďalej nariedený v 100 ml (pozri
časť 6.6) podať formou jednorazovej intravenóznej infúzie počas nie menej
ako 15 minút.
U pacientov
s miernou až stredne závažnou poruchou funkcie obličiek sa odporúčajú
znížené dávky Zoledronic acid Fresenius Kabi (pozri časť „Dávkovanie“ vyššie a časť 4.4).
Pokyny na prípravu znížených dávok lieku Zoledronic
Acid Fresenius Kabi
Odoberte primeraný objem potrebného koncentrátu
nasledovne:
-
4,4 ml na dávku 3,5 mg
-
4,1 ml na dávku 3,3 mg
-
3,8 ml na dávku 3,0 mg
Odobraté
množstvo koncentrátu sa musí ďalej nariediť so 100 ml sterilného 0,9 %
m/V roztoku chloridu sodného alebo 5 % m/V roztoku glukózy. Dávka sa musí
podať formou jednorazovej intravenóznej infúzie počas nie menej ako 15 minút.
Koncentrát
Zoledronic Acid Fresenius Kabi sa
nesmie miešať s infúznymi roztokmi obsahujúcimi vápnik alebo iné dvojmocné
katióny ako napr. Ringerov laktátový roztok a má sa podať formou
intravenózneho roztoku v osobitnej infúznej súprave.
Pred podaním a po podaní lieku Zoledronic
Acid Fresenius Kabi musia byť pacienti
dobre
hydratovaní.
4.3 Kontraindikácie
Precitlivenosť na liečivo, na iné
bisfosfonáty alebo na ktorúkoľvek z pomocných látok uvedených v časti
6.1.
Laktácia (pozri časť 4.6)
4.4 Osobitné upozornenia a opatrenia
pri používaní
Všeobecné
Pred
liečbou liekom Zoledronic Acid Fresenius Kabi musia byť pacienti vyšetrení, aby sa zabezpečilo, že sú dostatočne
hydratovaní.
U pacientov s rizikom zlyhávania
srdca sa má predísť nadmernej hydratácii.
Po
začatí liečby liekom Zoledronic Acid Fresenius Kabi sa majú pozorne sledovať štandardné metabolické parametre súvisiace
s hyperkalciémiou ako napr. sérové hladiny vápnika, fosfátu a horčíka.
Ak sa objaví hypokalciémia, hypofosfatémia alebo hypomagneziémia, môže byť
potrebná krátkodobá doplnková liečba. U pacientov s neliečenou
hyperkalciémiou sa vo všeobecnosti vyskytuje určitý stupeň poruchy funkcie
obličiek, preto sa má zvážiť pozorné sledovanie funkcie obličiek.
Na
liečbu osteoporózy a Pagetovej choroby kostí sú dostupné iné lieky
obsahujúce kyselinu zoledrónovú ako liečivo. Pacienti, ktorí sa liečia liekom Zoledronic
Acid Fresenius Kabi sa nemajú súbežne
liečiť inými liekmi obsahujúcimi kyselinu zoledrónovú alebo akýkoľvek iný
bisfosfonát, pretože účinky kombinácie týchto liečiv nie sú známe.
Insuficiencia obličiek
Pacienti
s TIH s dôkazom zhoršenia funkcie obličiek sa majú náležite vyšetriť
so zvážením, či možný prínos liečby Zoledronic Acid Fresenius
Kabi prevažuje nad možným rizikom.
Rozhodnutie
liečiť pacientov s metastázami kosti pri prevencii príhod súvisiacich so
skeletom má zohľadniť, že nástup účinku liečby je 2 – 3 mesiace.
Kyselina
zoledrónová používaná tak, ako je uvedené v častiach 4.1 a 4.2 sa
spájala s hláseniami poruchy funkcie obličiek. Faktory, ktoré môžu zvýšiť
možnosť zhoršenia funkcie obličiek zahŕňajú dehydratáciu, už existujúcu poruchu
funkcie obličiek, viacnásobné liečebné cykly Zoledronic acid Fresenius Kabi a iných bisfosfonátov ako aj
použitie iných liekov s nefrotoxickým účinkom. Zatiaľ čo pri 4 mg
dávke kyseliny zoledrónovej podanej počas 15 minút sa riziko zníži, zhoršenie
funkcie obličiek sa stále môže objaviť. Zhoršenie funkcie obličiek, vyústenie
do zlyhania obličiek a dialýzy sa hlásilo u pacientov po úvodnej
dávke alebo jednorazovej dávke 4 mg kyseliny zoledrónovej. U niektorých
pacientov sa pri dlhodobom podávaní kyseliny zoledrónovej v odporúčaných
dávkach na predchádzanie príhod súvisiacich so skeletom objavujú aj zvýšenia
sérových hladín kreatinínu, hoci menej často.
U pacientov
sa pred každou dávkou lieku Zoledronic acid Fresenius Kabi
majú stanoviť sérové hladiny kreatinínu. Po začatí liečby
sa u pacientov s metastázami kosti s miernou až stredne závažnou
poruchou funkcie obličiek odporúčajú nižšie dávky lieku Zoledronic acid Fresenius Kabi. U pacientov, u ktorých
sa objaví dôkaz zhoršenia funkcie obličiek počas liečby sa nemá podať Zoledronic
acid Fresenius Kabi. Zoledronic acid Fresenius Kabi sa má opätovne podať len ak sa
hladina kreatinínu vrátila na 10 % východiskovej hodnoty.
Liečba
liekom Zoledronic Acid Fresenius Kabi
sa má opätovne začať s rovnakou dávkou ako pred prerušením liečby.
Z pohľadu
možného vplyvu kyseliny zoledrónovej na funkciu obličiek, nedostatok údajov
o klinickej bezpečnosti u pacientov so závažnou poruchou funkcie
obličiek (v klinických skúšaniach definovaná ako hladina sérového kreatinínu
≥ 400 μmol/l alebo ≥ 4,5 mg/dl u pacientov
s THI a ≥ 265 μmol/l alebo ≥ 3,0 mg/dl u pacientov
s rakovinou a metastázami kosti) na začiatku a len obmedzené
farmakokinetické údaje u pacientov so závažnou poruchou funkcie obličiek
na začiatku (klírens kreatinínu < 30 ml/min), sa použitie lieku Zoledronic
acid Fresenius Kabi neodporúča
u pacientov so závažnou poruchou funkcie obličiek.
Insuficiencia pečene
Keďže
u pacientov so závažnou insuficienciou pečene sú dostupné len obmedzené
údaje, nie možné poskytnúť žiadne osobitné odporúčania pre túto populáciu
pacientov.
Osteonekróza čeľuste
U pacientov
sa hlásila osteonekróza čeľuste (ONJ), najmä u tých pacientov, ktorí mali
rakovinu a ktorí dostávali lieky inhibujúce resorpciu kosti ako napr.kyselinu
zoledrónovú. Mnohí z týchto pacientov dostávali aj chemoterapiu a kortikosteroidy.
Väčšina hlásených prípadov súvisela s dentálnymi výkonmi ako napr.
extrakcia zuba. U mnohých sa objavili príznaky lokálnej infekcie
zahŕňajúce osteomyelitídu.
Pred liečbou bisfosfonátmi sa u pacientov so súbežnými rizikovými
faktormi (napr. rakovina, chemoterapia, kortikosteroidy, slabá dentálna
hygiena) má zvážiť vyšetrenie zubov s náležitou preventívnou zubnou
starostlivosťou.
Ak je to možné, títo pacienti sa majú počas
liečby vyhnúť invazívnym dentálnym zákrokom. Pacientom, u ktorých sa
vyvinie osteonekróza čeľuste počas liečby bisfosfonátmi, môže dentálna
chirurgia zhoršiť stav. Pre pacientov vyžadujúcich dentálne zákroky neexistujú
žiadne dostupné údaje, ktoré by naznačovali, či prerušenie liečby bisfosfonátmi
znižuje riziko osteonekrózy čeľuste. Klinické posúdenie ošetrujúcim lekárom má
usmerňovať plán liečby každého pacienta založený na individuálnom posúdení
prínosu a rizika.
Bolesť svalov a kostí
Počas
skúsenosti po uvedení lieku na trh sa u pacientov, ktorí dostávali kyselinu
zoledrónovu tak, ako je uvedené v časti 4.1 a 4.2, hlásila silná
a zriedkavo obmedzujúca bolesť kostí, kĺbov a/alebo svalov. Takéto
hlásenia však neboli časté. Čas od začiatku liečby po nástup príznakov kolísal
od jedného dňa do niekoľkých mesiacov. U väčšiny pacientov príznaky
ustúpili po prerušení liečby. Obnovenie liečby kyselinou zoledrónovou alebo
iným bisfosfonátom viedlo v podskupine pacientov k opätovnému výskytu
príznakov.
Atypické
zlomeniny stehennej kosti
Pri
liečbe bisfosfonátmi boli hlásené atypické subtrochanterické a diafyzárne
zlomeniny stehennej kosti, predovšetkým u pacientov, ktorí sa dlhodobo
liečili na osteoporózu. Tieto priečne alebo krátke šikmé zlomeniny môžu
vzniknúť kdekoľvek pozdĺž stehennej kosti, tesne pod malým trochanterom až
po suprakondylickú časť. K týmto zlomeninám dochádza po minimálnej alebo
žiadnej traume a u niektorých pacientok sa niekoľko týždňov až
mesiacov pred vznikom úplnej zlomeniny stehennej kosti vyskytne bolesť v stehne
alebo slabine, pri zobrazovacom vyšetrení často spojená s charakteristikami
únavovej zlomeniny. Zlomeniny sú často bilaterálne, preto sa má u pacientov
liečených bisfosfonátmi, ktoré utrpeli zlomeninu stehennej kosti, vyšetriť aj
kontralaterálna stehenná kosť. Hlásené bolo tiež nedostatočné hojenie týchto
zlomenín. U pacientov s podozrením na atypickú zlomeninu stehennej
kosti sa má na základe individuálneho zhodnotenia prínosu a rizika zvážiť
prerušenie liečby bisfosfonátmi.
Počas
liečby bisfosfonátmi treba pacientov poučiť, aby hlásili akúkoľvek bolesť
v stehne, bedre alebo slabine a každého pacienta s takýmito
príznakmi je potrebné vyšetriť na prítomnosť neúplnej zlomeniny stehennej
kosti.
Tento liek obsahuje
menej ako 1 mmol sodíka (23 mg) v dávke, t.j. v podstate „bez obsahu sodíka”.
4.5 Liekové a iné interakcie
V klinických
skúšaniach sa kyselina zoledrónová použitá tak, ako je uvedené v časti 4.1
a 4.2, podávala súbežne s bežne používanými protinádorovými látkami,
diuretikami, antibiotikami a analgetikami bez výskytu klinicky zjavných
interakcií. Kyselina zoledrónová in vitro nevykazuje žiadnu významnú
väzbu na plazmatické bielkoviny a neinhibuje ľudské enzýmy P450 (pozri
časť 5.2), ale žiadne formálne klinické interakčné skúšania sa nevykonali.
Opatrnosť sa odporúča
pri súbežnom podávaní bisfosfonátov s aminoglykozidmi, pretože obidve
liečivá môžu mať aditívny účinok, čo má za následok nižšiu sérovú hladinu
vápnika počas dlhších období, ako sa požaduje.
Pri použití lieku Zoledronic
Acid s inými potenciálne nefrotoxickými liekmi je nutná opatrnosť. Počas
liečby sa má pozornosť venovať aj možnému vzniku hypomagneziémie.
U pacientov
s mnohopočetným myelómom sa môže zvýšiť riziko poruchy funkcie obličiek
pri používaní lieku Zoledronic acid Fresenius
Kabi v kombinácii s talidomidom.
Hlásenia o ONJ
pochádzali od pacientov liečených kyselinou zoledrónovou (ako je uvedené
v častiach 4.1 a 4.2) a súbežne antiangiogénnymi liekmi.
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii nie
sú žiadne dostatočné údaje o použití kyseliny zoledrónovej u gravidných
žien. Štúdie reprodukčnej toxicity kyseliny zoledrónovej na zvieratách
preukázali reprodukčnú toxicitu (pozri časť 5.3). Možné riziko pre ľudí
nie je známe. Zoledronic acid Fresenius
Kabi sa počas gravidity nemá
používať.
Laktácia
Nie je známe, či sa
kyselina zoledrónová vylučuje do ľudského mlieka. Zoledronic acid Fresenius Kabi je u dojčiacich žien kontraindikovaný (pozri časť 4.3).
Fertilita
Možné
nežiaduce účinky kyseliny zoledrónovej na fertilitu generácie rodičov a generácie
F1 sa vyhodnotili u potkanov. Výsledkom boli vystupňované farmakologické
účinky, pri ktorých sa predpokladá, že súvisia s inhibíciou metabolizmu vápnika
skeletu vyvolanou touto látkou, ktorá spôsobila hypokalciémiu, čo je skupinový
účinok bisfosfonátov, dystokiu a predčasné ukončenie skúšania. Tieto
výsledky tak znemožnili stanovenie definitívneho účinku kyseliny zoledrónovej
na fertilitu ľudí.
4.7 Ovplyvnenie
schopnosti viesť vozidlá a obsluhovať stroje
Nežiaduce reakcie ako napr. závrat a somnolencia môžu
mať vplyv na schopnosť viesť vozidlá a obsluhovať stroje, preto je
potrebné postupovať s opatrnosťou pri používaní lieku Zoledronic acid Fresenius Kabi v čase vedenia vozidla a obsluhy
strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostného
profilu
Do troch dní po podaní kyseliny
zoledrónovej tak, ako je uvedené v časti 4.1 a 4.2, sa často hlásila
reakcia akútnej fázy s príznakmi, ktoré zahŕňali bolesť kosti, horúčku,
únavu, bolesť kĺbov, bolesť svalov a zimnice, tieto príznaky obvykle
ustúpia počas niekoľkých dní (pozri opis vybraných nežiaducich reakcií).
Významné identifikované
riziká pri kyseline zoledrónovej v schválených indikáciách sú nasledovné:
Porucha
funkcie obličiek, osteonekróza čeľuste, reakcia akútnej fázy, hypokalciémia,
nežiaduce udalosti súvisiace s očami, fibrilácia predsiení, anafylaxia.
Frekvencie každého z týchto identifikovaných rizík sa uvádzajú v tabuľke
1.
Tabuľkový zoznam
nežiaducich reakcií
Nasledujúce nežiaduce
reakcie uvedené v tabuľke 1 sa zozbierali z klinických skúšaní
a hlásení po uvedení lieku na trh po prevažne dlhodobej liečbe 4 mg kyseliny
zoledrónovej:
Tabuľka 1
Nežiaduce
reakcie sú zoradené podľa frekvencie, najčastejšie ako prvé, s použitím
nasledujúcej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000
až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000),
neznáme (nedá sa odhadnúť z dostupných údajov).
|
Poruchy
krvi a lymfatického systému
Časté:
|
anémia
|
|
Menej časté:
|
trombocytopénia,
leukopénia
|
|
Zriedkavé:
|
pancytopénia
|
|
Poruchy
imunitného systému
Menej časté:
|
reakcia z precitlivenosti
|
|
Zriedkavé:
|
angioedém
|
|
Psychické
poruchy
Menej časté:
|
úzkosť, porucha spánku
|
|
Zriedkavé:
|
zmätenosť
|
|
Poruchy
nervového systému
Časté:
|
bolesť hlavy
|
|
Menej časté:
|
závrat, parestézia, porucha vnímania chuti, hypestézia,
hyperestézia, tremor, somnolencia
|
|
Poruchy
oka
Časté:
|
konjunktivitída
|
|
Menej časté:
|
rozmazané videnie, skleritída a zápal
orbity
|
|
Veľmi časté:
|
uveitída, episkleritída
|
|
Poruchy
srdca a srdcovej činnosti
Menej časté:
|
hypertenzia, hypotenzia, atriálna fibrilácia,
hypotenzia vedúca k synkope kolapsu cirkulácie
|
|
Zriedkavé:
|
bradykardia
|
|
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté:
|
dyspnoe, kašeľ,
bronchokonstrikcia
|
|
Poruchy gastrointestinálneho traktu
Časté:
|
nauzea, vracanie,
anorexia
|
|
Menej časté:
|
hnačka, zápcha, bolesť brucha, dyspepsia, stomatitída,
sucho v ústach
|
|
Poruchy
kože a podkožného tkaniva
Menej časté:
|
pruritus, vyrážka (vrátane erytematóznej a makulárnej
vyrážky), zvýšené potenie
|
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
Časté:
|
bolesť kosti, bolesť svalov, artralgia
bolesť postihujúca celé telo
|
|
Menej časté:
|
kŕče svalov, osteonekróza čeľuste*
|
|
Poruchy obličiek
a močových ciest
Časté:
|
porucha funkcie
obličiek
|
|
Menej časté:
|
akútne zlyhanie obličiek, hematúria,
proteinúria
|
|
Celkové poruchy a reakcie v mieste
podania
Časté:
|
horúčka, syndróm podobný chrípke (zahŕňajúci únavu, zimnicu,
nevoľnosť a sčervenanie)
|
|
Menej časté:
|
asténia, periférny edém, reakcie v mieste podania
injekcie (zahŕňajúce bolesť, podráždenosť, opuch, induráciu), bolesť
hrudníka, zvýšenie telesnej hmotnosti, anafylaktická reakcia/šok, urtikária
|
|
Laboratórne
a funkčné vyšetrenia
Veľmi časté:
|
hypofosfatémia
|
|
Časté:
|
zvýšená hladina kreatinínu a močoviny
v krvi
|
|
Menej časté:
|
hypomagneziémia, hypokaliémia
|
|
Zriedkavé:
|
hyperkaliémia, hypernatriémia
|
|
* Na základe klinických skúšok s posúdením
možných prípadov osteonekrózy čeľuste. Keďže tieto hlásenia sú ovplyvnené
mätúcimi faktormi, nie je možné spoľahlivo stanoviť príčinnú súvislosť
s expozíciou lieku.
|
Opis vybraných
nežiaducich reakcií
Porucha funkcie
obličiek
Kyselina
zoledrónová použitá tak, ako je uvedené v častiach 4.1 a 4.2 sa
dávala do súvislosti s hláseniami poruchy funkcie obličiek. V súhrnnej
analýze údajov o bezpečnosti z registračných klinických skúšaní
prevencie príhod súvisiacich so skeletom u pacientov s pokročilými zhubnými
nádormi postihujúcich kosť bola frekvencia nežiaducich udalostí poruchy funkcie
obličiek, pri ktorých bolo podozrenie na súvislosť s kyselinou zoledrónovou
(nežiaduce reakcie) nasledovná: mnohopočetný myelóm (3,2 %), karcinóm
prostaty (3,1 %), karcinóm prsníka (4,3 %), nádory pľúc a iné
solídne nádory (3,2 %). Faktory, ktoré môžu zvýšiť možnosť zhoršenia
funkcie obličiek zahŕňajú dehydratáciu, už prítomnú poruchu funkcie obličiek,
viacnásobné cykly podávania kyseliny zoledrónovej alebo iných bisfosfonátov,
ako aj súbežné používanie nefrotoxických liekov alebo podanie infúzie za kratší
čas, než sa v súčasnosti odporúča. Zhoršenie funkcie obličiek,
progredujúce do zlyhania obličiek a dialýzy sa hlásilo u pacientov po
úvodnej dávke alebo po jednorazovej dávke 4 mg kyseliny zoledrónovej
(pozri časť 4.4).
Osteonekróza
čeľuste
Prevažne
u pacientov s rakovinou liečených liekmi inhibujúcimi resorpciu
kosti, ako je kyselina zoledrónová, sa hlásili prípady osteonekrózy (primárne
čeľustí). Mnohí z týchto pacientov mali príznaky lokálnej infekcie vrátane
osteomyelitídy a väčšina hlásení sa týka pacientov s rakovinou po
extrakcii zubov alebo iných dentálnych chirurgických zákrokoch. Osteonekróza
čeľuste má viaceré zdokumentované rizikové faktory vrátane diagnózy rakoviny,
súčasne podanej liečby (napr. chemoterapie, rádioterapie, kortikosteroidov)
a sprievodných ochorení (napr. anémie, koagulopatií, infekcie, ochorenia
ústnej dutiny). Hoci sa nestanovila príčinná súvislosť, odporúča sa vyvarovať
sa dentálnych chirurgických zákrokov, pretože sa môže predĺžiť obdobie
zotavenia (pozri časť 4.4).
Fibrilácia
predsiení
V jednom
3-ročnom randomizovanom, dvojito zaslepenom, kontrolovanom klinickom skúšaní,
v ktorom sa hodnotila účinnosť a bezpečnosť 5 mg kyseliny
zoledrónovej podávanej raz ročne oproti placebu, v liečbe
postmenopauzálnej osteoporózy (PMO), bola celková incidencia fibrilácie
predsiení 2,5 % (96 z 3 862) u pacientok, ktoré dostávali 5 mg
kyseliny zoledrónovej a 1,9 % (75 z 3 852) u pacientok,
ktoré dostávali placebo. Miera výskytu závažných nežiaducich udalostí
fibrilácie predsiení ako bola 1,3 % (51 z 3 862) u pacientok,
ktoré dostávali 5 mg kyseliny zoledrónovej a 0,6 % (22 z 3 852)
u pacientok, ktoré dostávali placebo. Nerovnováha pozorovaná v tomto
klinickom skúšaní sa nepozorovala v iných skúšaniach s kyselinou
zoledrónovou vrátane skúšaní 4 mg kyseliny zoledrónovej každé 3 – 4 týždne
u onkologických pacientov. Mechanizmus, ktorý spôsobil zvýšenú incidenciu
fibrilácie predsiení v tomto jedinom klinickom skúšaní, nie je známy.
Reakcia akútnej
fázy
Táto nežiaduca reakcia
lieku pozostáva zo skupiny príznakov, ktoré zahŕňajú horúčku, bolesť svalov,
bolesť hlavy, bolesť končatín, nauzeu, vracanie, hnačku a bolesť kĺbov.
Čas ich nástupu je ≤ 3 dni po infúzii kyseliny zoledrónovej a táto
reakcia sa tiež označuje ako príznaky „podobné chrípke“ alebo „po podaní“.
Atypické
zlomeniny stehennej kosti
Po uvedení lieku na trh
boli hlásené nasledovné reakcie (frekvencia zriedkavé):
Atypické
subtrochanterické a diafyzárne zlomeniny stehennej kosti (skupinová
nežiaduca reakcia na bisfosfonáty).
4.9 Predávkovanie
Klinické
skúsenosti s akútnym predávkovaním kyselinou zoledrónovou sú obmedzené.
Hlásilo sa chybné podanie dávky až do 48 mg kyseliny zoledrónovej.
Pacientov, ktorí dostali vyššie ako odporúčané dávky (pozri časť 4.2), je
potrebné starostlivo sledovať, pretože sa pozorovala porucha funkcie obličiek
(vrátane zlyhania obličiek) a poruchy sérových elektrolytov (vrátane
vápnika, fosforu a horčíka). V prípade hypokalciémie sa majú podať
infúzie glukónanu vápenatého, ak je to klinicky indikované.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: ovplyvňujúce
stavbu a mineralizáciu kostí, bisfosfonáty, ATC kód: M05BA08
Kyselina zoledrónová
patrí do skupiny bisfosfonátov a účinkuje primárne na kosť. Je inhibítorom
resorpcie kosti, spôsobenej osteoklastmi.
Selektívny účinok
bisfosfonátov na kosť je založený na ich vysokej afinite k mineralizovanej
kosti, ale presný mechanizmus na molekulárnej úrovni, ktorý vedie k inhibícii
aktivity osteoklastov, ešte stále nie je jasný. V dlhodobých skúšaniach na
zvieratách kyselina zoledrónová tlmí resorpciu kosti bez nepriaznivého
ovplyvnenia tvorby, mineralizácie alebo mechanických vlastností kosti.
Okrem toho, že je kyselina
zoledrónová silným inhibítorom resorpcie kosti, má aj viaceré protinádorové
vlastnosti, ktoré by mohli prispievať k jej celkovej účinnosti pri liečbe
metastátujúceho ochorenia kosti. V predklinických skúšaniach sa preukázali
nasledujúce vlastnosti:
- In
vivo: inhibícia resorpcie kosti osteoklastmi, ktorá mení mikroprostredie
kostnej drene a robí ho menej priaznivým pre rast nádorových buniek,
antiangiogenetický účinok a analgetický účinok.
- In
vitro: inhibícia proliferácie osteoblastov, priamy cytostatický a proapoptotický
účinok na nádorové bunky, synergický cytostatický účinok s inými
protinádorovými liečivami, antiadhezívny a antiinvazívny účinok.
Výsledky klinických
skúšaní pri prevencii príhod súvisiacich so skeletom u pacientov s pokročilými
zhubnými nádormi postihujúcimi kosť
Prvé
randomizované, dvojito zaslepené klinické skúšanie kontrolované placebom
porovnávalo 4 mg kyseliny zoledrónovej s placebom pri prevencii
príhod súvisiacich so skeletom (SRE) u pacientov s rakovinou
prostaty. Kyselina zoledrónová v dávke 4 mg významne znížila podiel
pacientov, u ktorých sa objavila aspoň jedna SRE, predĺžila medián času do
výskytu prvej SRE o > 5 mesiacov a znížila výskyt príhod
pripadajúcich na pacienta za rok - mieru morbidity skeletu. Analýza
viacpočetných príhod ukázala zníženie rizika vzniku SRE v skupine 4 mg
kyseliny zoledrónovej o 36 % v porovnaní s placebom.
Pacienti, ktorí dostávali 4 mg kyseliny zoledrónovej, hlásili menšie stupňovanie
bolesti ako pacienti, ktorí dostávali placebo, pričom rozdiel dosiahol
štatistickú významnosť v 3., 9., 21., a 24. mesiaci. Menej pacientov
liečených 4 mg kyseliny zoledrónovej utrpelo patologické zlomeniny. Účinky
liečby boli menej výrazné u pacientov s blastickými léziami. Výsledky
účinnosti sú uvedené v tabuľke 2.
V druhom
klinickom skúšaní zahŕňajúcom solídne nádory okrem rakoviny prsníka alebo
prostaty, kyselina zoledrónová v dávke 4 mg významne znížila podiel
pacientov s SRE, predĺžila medián času do výskytu prvej SRE o > 2 mesiace
a znížila mieru morbidity skeletu. Analýza viacpočetných príhod preukázala
zníženie rizika vzniku SRE v skupine 4 mg kyseliny zoledrónovej
o 30,7 % v porovnaní s placebom. Výsledky účinnosti sú
uvedené v tabuľke 3.
Tabuľka 2: Výsledky účinnosti (pacienti s rakovinou prostaty liečení
hormónmi)
|
|
Akákoľvek SRE (+TIH)
|
Zlomeniny*
|
Liečba ožarovaním kosti
|
|
|
4 mg kyseliny zoledrónovej
|
Placebo
|
4 mg kyseliny zoledrónovej
|
Placebo
|
4 mg kyseliny zoledrónovej
|
Placebo
|
|
N
|
214
|
208
|
214
|
208
|
214
|
208
|
|
Podiel pacientov s SRE (%)
|
38
|
49
|
17
|
25
|
26
|
33
|
|
Hodnota p
|
0,028
|
0,052
|
0,119
|
|
Medián času do výskytu SRE
(dni)
|
488
|
321
|
NR
|
NR
|
NR
|
640
|
|
Hodnota p
|
0,009
|
0,020
|
0,055
|
|
Miera morbidity skeletu
|
0,77
|
1,47
|
0,20
|
0,45
|
0,42
|
0,89
|
|
Hodnota p
|
0,005
|
0,023
|
0.060
|
|
Zníženie rizika utrpieť viacpočetné príhody** (%)
|
36
|
-
|
NA
|
NA
|
NA
|
NA
|
|
Hodnota p
|
0,002
|
NA
|
NA
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Zahŕňa zlomeniny
stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom,
celkový počet ako aj čas do každej príhody počas klinického skúšania
NR nedosiahol sa
NA neaplikovateľné
Tabuľka 3: Výsledky účinnosti (solídne nádory iné
ako rakovina prsníka alebo prostaty)
|
|
Akákoľvek SRE (+TIH)
|
Zlomeniny*
|
Liečba ožarovaním kosti
|
|
|
4 mg kyseliny zoledrónovej
|
Placebo
|
4 mg kyseliny zoledrónovej
|
Placebo
|
4 mg kyseliny zoledrónovej
|
Placebo
|
|
N
|
257
|
250
|
257
|
250
|
257
|
250
|
|
Podiel pacientov s SRE (%)
|
39
|
48
|
16
|
22
|
29
|
34
|
|
Hodnota p
|
0,039
|
0,064
|
0,173
|
|
Medián času do výskytu SRE (dni)
|
236
|
155
|
NR
|
NR
|
424
|
307
|
|
Hodnota p
|
0,009
|
0,020
|
0,079
|
|
Miera morbidity skeletu
|
1,74
|
2,71
|
0,39
|
0,63
|
1,24
|
1,89
|
|
Hodnota p
|
0,012
|
0,066
|
0,099
|
|
Zníženie rizika utrpieť viacpočetné príhody** (%)
|
30,7
|
-
|
NA
|
NA
|
NA
|
NA
|
|
Hodnota p
|
0,003
|
NA
|
NA
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Zahŕňa zlomeniny
stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom,
celkový počet ako aj čas do každej príhody počas klinického skúšania
NR nedosiahol sa
NA neaplikovateľné
V treťom
randomizovanom, dvojito zaslepenom klinickom skúšaní fázy III sa porovnávali 4 mg
kyseliny zoledrónovej a 90 mg pamidronátu každé 3 až 4 týždne
u pacientov s mnohopočetným myelómom alebo rakovinou prsníka a minimálne
jednou léziou kosti. Výsledky preukázali, že kyselina zoledrónová v dávke
4 mg vykazuje účinnosť porovnateľnú s 90 mg pamidronátu pri
prevencii SRE. Analýza viacpočetných príhod ukázala významné zníženie rizika
vzniku SRE o 16% u pacientov liečených 4 mg kyseliny
zoledrónovej v porovnaní s pacientmi, ktorí dostávali pamidronát.
Výsledky účinnosti sú uvedené v tabuľke 4.
Tabuľka 4: Výsledky
účinnosti (pacienti s rakovinou prsníka a mnohopočetným myeolómom)
|
|
Akákoľvek SRE (+TIH)
|
Zlomeniny*
|
Liečba ožarovaním kosti
|
|
|
4 mg kyseliny zoledrónovej
|
Pam
90 mg
|
4 mg kyseliny zoledrónovej
|
Pam
90 mg
|
4 mg kyseliny zoledrónovej
|
Pam
90 mg
|
|
N
|
561
|
555
|
561
|
555
|
561
|
555
|
|
Podiel pacientov s SRE (%)
|
48
|
52
|
37
|
39
|
19
|
24
|
|
<'span lang=SK>Hodnota p
|
0,198
|
0,653
|
0,037
|
|
Medián času do výskytu SRE (dni)
|
376
|
356
|
NR
|
714
|
NR
|
NR
|
|
Hodnota p
|
0,151
|
0,672
|
0,026
|
|
Miera morbidity skeletu
|
1,04
|
1,39
|
0,53
|
0,60
|
0,47
|
0,71
|
|
Hodnota p
|
0,084
|
0,614
|
0,015
|
|
Zníženie rizika utrpieť viacpočetné príhody** (%)
|
16
|
-
|
NA
|
NA
|
NA
|
NA
|
|
Hodnota p
|
0,030
|
NA
|
NA
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Zahŕňa zlomeniny
stavcov a iné zlomeniny
** Zohľadňuje všetky príhody súvisiace so skeletom,
celkový počet ako aj čas do každej príhody počas klinického skúšania
NR nedosiahol sa
NA neaplikovateľné
Kyselina zoledrónová
v dávke 4 mg sa skúmala aj v dvojito zaslepenom, randomizovanom
klinickom skúšaní kontrolovanom placebom u 228 pacientok s preukázanými
metastázami do kosti pri rakovine prsníka, v ktorom sa hodnotil účinok 4 mg
kyseliny zoledrónovej na pomer výskytu príhod súvisiacich so skeletom (SRE),
vypočítaný ako celkový počet SRE príhod (okrem hyperkalciémie a po úprave
vzhľadom na predchádzajúcu zlomeninu), delený obdobím celkového rizika.
Pacientky dostávali buď 4 mg kyseliny zoledrónovej alebo placebo každé
štyri týždne počas jedného roka. Pacientky boli rovnomerne rozdelené do skupín
liečby kyselinou zoledrónovou a placebom.
Miera
výskytu SRE (príhody/osoborok) bola 0,628 pri kyseline zoledrónovej a 1,096
pri placebe. Podiel pacientok s minimálne jednou SRE (okrem
hyperkalciémie) bol 29,8% v skupine liečenej kyselinou zoledrónovou oproti
49,6% v skupine s placebom (p = 0,003). Medián času do vzniku
prvej SRE sa v liečebnej skupine s kyselinou zoledrónovou na konci
klinického skúšania nedosiahol a v porovnaní s placebom bol
významne dlhší (p = 0,007). V porovnaní s placebom kyselina
zoledrónová v dávke 4 mg znížila riziko SRE o 41 % v analýze
viacpočetných príhod (pomer rizika = 0,59, p = 0,019).
V skupine
liečenej kyselinou zoledrónovou sa v porovnaní s placebom pozorovalo
štatisticky významné zlepšenie pri hodnotení bolesti (pri použití Brief Pain
Inventory, BPI) po 4 týždňoch a v každom neskoršom čase počas
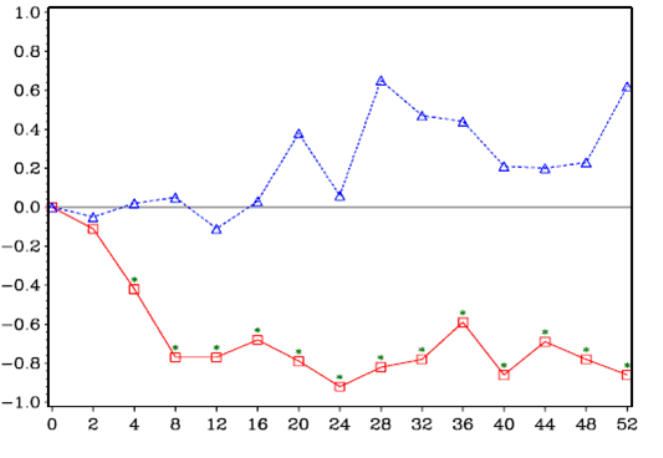
klinického skúšania (Obrázok 1). Hodnotenie bolesti pri kyseline zoledrónovej
bolo trvale pod východiskovou hodnotou a zmiernenie bolesti sprevádzala
tendencia k poklesu analgetického skóre.
 Obrázok 1: Priemerné zmeny skóre podľa BPI oproti východiskovej
hodnote. Vyznačené sú štatisticky významné rozdiely (*p < 0,05) pri
porovnaniach liečby (4 mg kyseliny zoledrónovej oproti placebu)
Obrázok 1: Priemerné zmeny skóre podľa BPI oproti východiskovej
hodnote. Vyznačené sú štatisticky významné rozdiely (*p < 0,05) pri
porovnaniach liečby (4 mg kyseliny zoledrónovej oproti placebu)
Trvanie
klinického skúšania (týždne)
|
|
Placebo Δ
4 mg
kyseliny zoledrónovej �
|
|
Výsledky klinických skúšaní pri liečbe TIH
Klinické skúšania pri hyperkalciémii vyvolanej nádorom (TIH)
preukázali, že pre účinok kyseliny zoledrónovej je charakteristický pokles
sérovej hladiny vápnika a pokles vylučovania vápnika močom. V klinických
skúšaniach fázy I na zistenie dávky sa u pacientov s miernou až
stredne závažnou hyperkalciémiou vyvolanou nádorom (TIH) skúšali účinné dávky
v rozmedzí približne 1,2–2,5 mg.
Na zhodnotenie účinkov
4 mg kyseliny zoledrónovej v porovnaní s 90 mg pamidronátu
sa vo vopred plánovej analýze zlúčili výsledky dvoch pivotných multicentrických
skúšaní s pacientmi s TIH. Normalizácia korigovanej sérovej hladiny vápnika
bola rýchlejšia na 4. deň pri 8 mg kyseliny zoledrónovej a na 7. deň
pri 4 mg a 8 mg kyseliny zoledrónovej. Pozorovali sa nasledujúce
miery odpovede na liečbu:
Tabuľka 5: Podiel pacientov
s úplnou odpoveďou na liečbu podľa dní v zlúčených klinických
skúšaniach TIH
|
|
4. deň
|
7. deň
|
10. deň
|
|
4 mg kyseliny zoledrónovej (N = 86)
|
45,3 % (p = 0,104)
|
82,6 % (p = 0,005)*
|
88,4 % (p = 0,002)*
|
|
8 mg
kyseliny zoledrónovej (N = 90)
|
55,6 %
(p = 0,021)*
|
83,3%
(p = 0,010)*
|
86,7%
(p = 0,015)*
|
|
90 mg
pamidronátu (N=99)
|
33,3 %
|
63,6 %
|
69,7 %
|
|
* Hodnoty p v porovnaní s pamidronátom.
|
Medián času do dosiahnutia
normokalciémie bol 4 dni. Medián času do relapsu (opätovné zvýšenie
sérovej hladiny vápnika korigovanej podľa albumínu na ≥ 2,9 mmol/l) bol
30 až 40 dní u pacientov liečených kyselinou zoledrónovou oproti
17 dňom u pacientov liečených 90 mg pamidronátu (hodnoty p:
0,001 pre 4 mg a 0,007 pre 8 mg kyseliny zoledrónovej). Medzi
oboma dávkami kyseliny zoledrónovej neboli štatisticky významné rozdiely.
V klinických skúšaniach
bolo 69 pacientov s relapsom alebo bez odpovede na začiatočnú liečbu
(4 mg, 8 mg kyseliny zoledrónovej alebo 90 mg pamidronátu) opäť
liečených 8 mg kyseliny zoledrónovej. Podiel takýchto pacientov, u ktorých
sa dosiahla odpoveď, bol približne 52 %. Pretože sa títo pacienti liečili
len dávkou 8 mg, nie sú k dispozícii žiadne údaje, ktoré by umožnili
porovnanie s dávkou 4 mg kyseliny zoledrónovej.
V klinických
skúšaniach s pacientmi s hyperkalciémiou vyvolanou nádorom (TIH) bol
celkový profil bezpečnosti u všetkých troch skupín liečby (4 mg
a 8 mg kyseliny zoledrónovej a 90 mg pamidronátu) podobný
čo do typu a závažnosti.
Deti a dospievajúci
Výsledky
klinických skúšaní v liečbe závažnej osteogenesis imperfecta u detských
a dospievajúcich pacientov vo veku od 1 do 17 rokov
Účinky intravenózne
podávanej kyseliny zoledrónovej pri liečbe detských a dospievajúcich
pacientov (vo veku od 1 do 17 rokov) so závažnou osteogenesis imperfecta
(typy I, III a IV) sa porovnali s intravenózne podávaným pamidronátom
v jednej medzinárodnej, multicentrickej, randomizovanej, otvorenej štúdii
so 74 a 76 pacientmi v každej liečebnej skupine. Skúšaná liečba
trvala 12 mesiacov a predchádzalo jej 4- až 9-týţdňové obdobie
skríningu, v ktorom sa počas najmenej 2 týždňov užívali doplnky
vitamínu D a elementárneho vápnika. V klinickom programe pacienti vo
veku od 1 do < 3 roky dostávali 0,025 mg/kg kyseliny
zoledrónovej (až do najvyššej jednorazovej dávky 0,35 mg) každé 3 mesiace
a pacienti vo veku od 3 do 17 rokov dostávali 0,05 mg/kg
kyseliny zoledrónovej (až do najvyššej jednorazovej dávky 0,83 mg) každé
3 mesiace. Na preskúmanie dlhodobej celkovej bezpečnosti a bezpečnosti
pre obličky pri podávaní kyseliny zoledrónovej raz za rok alebo dvakrát za rok počas
12 mesiacov liečby v extenzii u detí, ktoré v základnej
štúdii ukončili jeden rok liečby buď kyselinou zoledrónovou, alebo
pamidronátom, sa vykonalo rozsiahle skúšanie.
Primárnym
cieľovým ukazovateľom v tomto skúšaní bola percentuálna zmena minerálnej
denzity kosti (BMD) v lumbálnej časti chrbtice po 12 mesiacoch liečby
oproti východiskovým hodnotám. Odhadované účinky liečby na BMD boli podobné,
ale usporiadanie klinického skúšania nepostačovalo na preukázanie
noninferiority účinnosti kyseliny zoledrónovej. Najmä účinnosť na incidenciu
zlomenín alebo bolesť sa jednoznačne nepreukázala. Zlomeniny dlhých kostí dolných
končatín boli hlásené ako nežiaduce udalosti u približne 24 % (femur)
a 14 % (tíbia) pacientov so závažnou osteogenesis imperfecta
liečených kyselinou zoledrónovou oproti 12 % a 5 % pacientov
liečených pamidronátom, bez ohľadu na typ ochorenia a kauzalitu, ale
celková incidencia zlomenín bola porovnateľná u pacientov liečených
kyselinou zoledrónovou a pamidronátom: 43 % (32/74) oproti 41 %
(31/76). Interpretáciu rizika zlomenín komplikuje skutočnosť, že zlomeniny sú
ako súčasť priebehu ochorenia častou udalosťou u pacientov so závažnou
osteogenesis imperfecta.
Typ
nežiaducich reakcií, ktoré sa pozorovali v tejto populácii, bol podobný,
ako sa predtým zaznamenal u dospelých s pokročilými zhubnými nádormi
postihujúcimi kosť (pozri časť 4.8). Nežiaduce reakcie usporiadané podľa
frekvencie sú uvedené v tabuľke 6. Požila sa nasledujúca obvyklá
klasifikácia: veľmi časté (≥ 1/10),
časté (≥ 1/100 až < 1/10),
menej časté (≥ 1/1 000 až
< 1/100), zriedkavé (≥ 1/10 000
až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme
(nedá sa odhadnúť z dostupných údajov).
Tabuľka
6: Nežiaduce reakcie pozorované u deti a dospievajúcich
so závažnou osteogenesis imperfecta1
|
Poruchy
nervového systému
Časté:
|
bolesť hlavy
|
|
Poruchy
srdca a srdcovej činnosti
Časté:
|
tachykardia
|
|
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté:
|
nazofaryngitída
|
|
Poruchy
gastrointestinálneho traktu
Veľmi časté:
|
vracanie, nauzea
|
|
Časté:
|
bolesť brucha
|
|
Poruchy
kostrovej a svalovej sústavy a spojivového tkaniva
Časté:
|
bolesť v končatinách, bolesť kĺbov, bolesť svalov
a kostí
|
|
Celkové
poruchy a reakcie v mieste podania
Veľmi časté:
|
pyrexia, únava
|
|
Časté:
|
reakcie akútnej
fázy, bolesť
|
|
Laboratórne
a funkčné vyšetrenia
Veľmi časté:
|
hypokalciémia
|
|
Časté:
|
hypofosfatémia
|
1 Nežiaduce udalosti vyskytujúce sa s frekvenciou
< 5 % boli medicínsky vyhodnotené a preukázalo sa, že tieto
prípady zodpovedajú stanovenému bezpečnostnému profilu kyseliny zoledrónovej
(pozri časť 4.8).
U detských a dospievajúcich
pacientov so závažnou osteogenesis imperfecta sa zdá, že kyselina zoledrónová
je v porovnaní s pamidronátom spojená s výraznejším rizikom
reakcie akútnej fázy, hypokalciémie a nevysvetlenej tachykardie, ale tieto
rozdiely sa pri ďalších infúziách znižovali.
Európska
agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií
pre kyselinu zoledrónovú vo všetkých vekových podskupinách detí a dospievajúcich
v liečbe hyperkalciémie vyvolanej nádorom a v prevencii príhod
súvisiacich so skeletom u pacientov s postihnutím kostí pri
pokročilých malignitách (pre informácie o použití u detí a dospievajúcich,
pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Pri jednorazových
a opakovaných infúziách trvajúcich 5 a 15 minút, ktorými sa
podalo 2, 4, 8 a 16 mg kyseliny zoledrónovej 64 pacientom
s metastázami v kosti, sa zistili nasledujúce farmakokinetické údaje,
ktoré nezáviseli od dávky.
Po začatí infúzie
kyseliny zoledrónovej sa plazmatické koncentrácie kyseliny zoledrónovej rýchlo
zvýšili a dosiahli maximum na konci podania infúzie, po ktorom nasledoval
rýchly pokles na < 10 % maxima po 4 hodinách
a < 1 % maxima po 24 hodinách, s následným dlhým
obdobím veľmi nízkych koncentrácií nepresahujúcich 0,1 % maxima pred
druhou infúziou kyseliny zoledrónovej na 28. deň.
Intravenózne podaná
kyselina zoledrónová sa eliminuje trojfázovým procesom: rýchle dvojfázové
vymiznutie zo systémového obehu s polčasmi t1/2α 0,24
a t1/2β 1,87 hodiny, po ktorých nasleduje dlhá
eliminačná fáza s konečným polčasom eliminácie t1/2γ 146 hodín.
Po opakovanom podávaní každých 28 dní nedošlo k akumulácii kyseliny
zoledrónovej v plazme. Kyselina zoledrónová sa nemetabolizuje a vylučuje
sa nezmenená obličkami. Počas prvých 24 hodín sa v moči nájde 39 ±
16 % podanej dávky, zatiaľ čo zvyšok sa v zásade viaže na tkanivo
kosti. Z kostného tkaniva sa veľmi pomaly uvoľňuje späť do systémového
obehu a vylučuje sa obličkami. Celkový telesný klírens je 5,04 ±
2,5 l/hod, a to nezávisle od dávky a bez ovplyvnenia pohlavím,
vekom, rasou a telesnou hmotnosťou. Predĺženie infúzie z 5 na 15 minút
znížilo koncentráciu kyseliny zoledrónovej na konci infúzie o 30 %,
ale neovplyvnilo plochu pod krivkou koncentrácie oproti času.
Tak ako aj pri iných
bisfosfonátoch, variabilita farmakokinetických parametrov kyseliny zoledrónovej
medzi pacientmi bola vysoká.
Nie sú dostupné žiadne
farmakokinetické údaje o kyseline zoledrónovej u pacientov s hyperkalciémiou
alebo u pacientov s insuficienciou pečene. Kyselina zoledrónová in
vitro neinhibuje ľudské enzýmy P450, nevykazuje biotransformáciu
a v štúdiách na zvieratách sa v stolici našli < 3 %
podanej dávky, čo naznačuje, že funkcia pečene nezohráva významnú úlohu vo
farmakokinetike kyseliny zoledrónovej.
Pri určení vzťahu medzi
renálnym klírensom kyseliny zoledrónovej a klírensom kreatinínu
predstavoval renálny klírens 75 ± 33 % klírensu kreatinínu, ktorého
priemerná hodnota bola 84 ± 29 ml/min (rozmedzie 22–143 ml/min)
u 64 sledovaných pacientov s karcinómom. Analýza v tejto
skupine ukázala, že u pacienta s klírensom kreatinínu 20 ml/min
(závažné poškodenie funkcie obličiek) alebo 50 ml/min (stredne závažné
poškodenie) bude zodpovedajúci predpokladaný klírens kyseliny zoledrónovej 37 %
alebo 72 % hodnoty u pacienta, ktorý má klírens kreatinínu 84 ml/min.
Sú dostupné len obmedzené farmakokinetické údaje o pacientoch so závažnou
insuficienciou obličiek (klírens kreatinínu < 30 ml/min).
Kyselina zoledrónová
nemá afinitu ku krvinkám a jej väzba na plazmatické bielkoviny je nízka
(približne 56 %) a nezávisí od koncentrácie kyseliny zoledrónovej.
Osobitné skupiny
pacientov
Deti a dospievajúci
Obmedzené
farmakokinetické údaje u detí so závažnou osteogenesis imperfecta
naznačujú, že farmakokinetika kyseliny zoledrónovej u detí vo veku 3 až
17 rokov je podobná ako u dospelých pri podobnej hladine dávok mg/kg.
Vek, telesná hmotnosť, pohlavie a klírens kreatinínu zrejme nemajú žiadny
vplyv na systémovú expozíciu kyseline zoledrónovej.
5.3 Predklinické údaje o bezpečnosti
Akútna toxicita
Najvyššia jednorazová
intravenózna dávka bez letálneho účinku bola 10 mg/kg telesnej hmotnosti
u myší a 0,6 mg/kg u potkanov.
Subchronická a chronická
toxicita
Kyselina zoledrónová je
dobre tolerovaná, keď sa subkutánne podávala potkanom a intravenózne psom
v dávkach do 0,02 mg/kg denne počas 4 týždňov. Podávanie 0,001 mg/kg/deň
subkutánne potkanom a 0,005 mg/kg intravenózne psom raz za 2–3
dni počas až 52 týždňov bolo tiež dobre tolerové.
Najčastejším nálezom
v štúdiách pri opakovanom podávaní bolo zväčšenie primárnej trabekulárnej
časti kosti v metafýzach dlhých kostí u rastúcich zvierat pri takmer
všetkých dávkach, čo bol nález v súlade s farmakologickou
antiresorpčnou účinnosťou látky.
Bezpečné
rozmedzie dávok vzhľadom na účinky na obličky bolo úzke v štúdiách pri
dlhodobom opakovanom parenterálnom podávaní zvieratám, ale kumulatívne hladiny
bez nežiaducich príhod v štúdiách pri jednorazovom podaní (1,6 mg/kg)
a pri opakovanom podávaní až do jedného mesiaca (0,06–0,6 mg/kg/deň)
nenaznačili účinky na obličky pri dávkach ekvivalentných alebo prevyšujúcich
najvyššiu plánovanú terapeutickú dávku u ľudí. Dlhodobejšie opakované
podávanie v dávkach, ktoré zahrnulo aj najvyššiu plánovanú terapeutickú
dávku kyseliny zoledrónovej u ľudí, vyvolalo toxické účinky v iných orgánoch
vrátane gastrointestinálneho traktu, pečene, sleziny a pľúc, ako aj
v mieste podania intravenóznej injekcie.
Reprodukčná toxicita
Kyselina zoledrónová
bola teratogénna u potkanov v subkutánnych dávkach > 0,2 mg/kg. Hoci sa u králikov nepozorovala žiadna
teratogenita alebo fetotoxicita, zistila sa toxicita pre matky. Dystokia sa
pozorovala pri najnižšej skúšanej dávke u potkanov (0,01 mg/kg
telesnej hmotnosti).
Mutagenita a karcinogenita
Kyselina
zoledrónová nebola mutagénna vo vykonaných testoch mutagenity a testy na
karcinogenitu neposkytli žiadne dôkazy o karcinogénnom potenciále.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol
Trinátriumcitrát
Voda na injekciu
6.2 Inkompatibility
Aby sa
predišlo možným inkompatibilitám, koncentrát Zoledronic acid Fresenius Kabi sa má riediť 0,9 % m/V
roztokom chloridu sodného alebo 5 % m/V roztokom glukózy.
Koncentrát
Zoledronic Acid Fresenius Kabi sa
nesmie miešať s infúznymi roztokmi obsahujúcimi vápnik alebo iné dvojmocné
katióny ako napr. Ringerov laktátový roztok a má sa podať formou
intravenózneho roztoku v osobitnej infúznej súprave.
6.3 Čas použiteľnosti
30 mesiacov
Po nariedení:
Chemická a fyzikálna stabilita bola preukázaná počas 24 hodín pri teplote 2 °C – 8 °C.
Z mikrobiologického
hľadiska sa má nariedený roztok použiť okamžite. Ak sa nepoužije okamžite, za
dĺžku a podmienky uchovávania pred použitím je zodpovedný používateľ
a za normálnych okolností nemá presiahnuť 24 hodín
pri teplote 2 °C – 8 °C.
Roztok uchovávaný v chladničke sa má pred podaním zohriať na izbovú
teplotu.
6.4 Špeciálne upozornenia na
uchovávanie
Tento liek nevyžaduje žiadne zvláštne
podmienky na uchovávanie.
Podmienky na uchovávanie pripraveného lieku,
pozri časť 6.3.
6.5 Druh
obalu a obsah balenia
Plastová injekčná liekovka vyrobená z bezfarebného
polypropylénu s brómbutylovou gumovou zátkou a hliníkovým viečkom
a s plastovým flip-off uzáverom.
Balenie obsahuje 1, 4 alebo 10 injekčných
liekoviek.
Nie všetky veľkosti balenia musia byť uvedené
na trh.
6.6 Špeciálne opatrenia na likvidáciu
a iné zaobchádzanie s liekom
Pred
podaním sa 5 ml koncentrátu z jednej injekčnej liekovky alebo objem
odobratý podľa potreby má ďalej nariediť so 100 ml infúzneho roztoku bez
obsahu vápnika (0,9 % m/V roztok chloridu sodného alebo 5 % m/V
roztok glukózy).
Štúdie
so sklenenými fľaštičkami, ako aj s mnohými
inými druhmi obalov vyrobených z polyvinylchloridu, polyetylénu a polypropylénu
(naplnených 0,9 % m/V roztokom chloridu sodného alebo 5 % m/V
roztokom glukózy) nepreukázali inkompatibilitu s liekom Zoledronic acid
Fresenius Kabi.
Ďalšie
informácie o zaobchádzaní s liekom Zoledronic acid Fresenius Kabi vrátane pokynov na prípravu znížených dávok sa uvádzajú v časti
4.2.
Počas prípravy infúzie sa musia dodržiavať
aseptické postupy. Len na jednorazové použitie.
Použiť sa má len číry roztok bez viditeľných
častíc a bez zafarbenia.
Zdravotníckym
pracovníkom sa odporúča, aby nespotrebovaný Zoledronic acid Fresenius Kabi nelikvidovali prostredníctvom
kanalizácie.
Nepoužitý
liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Fresenius Kabi s.r.o. Želetavská 1525/1, 140
00 Praha 4 . Česká republika
8. REGISTRAČNÉ ČÍSLO
87/0494/12-S
9. DÁTUM PRVEJ REGISTRÁCIE/
PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU