
iebehu prvých dvoch dní vysadzovania liečby, ale
vzácne boli hlásené takéto príznaky u pacientov, ktorí nedopatrením vynechali dávku. Zvyčajne tieto príznaky vymiznú bez liečby, obyčajne v priebehu 2 týždňov, hoci u niektorých osôb to môže trvať dlhšie (2-3 mesiace alebo viac). Preto sa pri vysadzovaní liečby odporúča postupné znižovanie dávky
duloxetínu počas minimálne 2 týždňov, podľa potreby pacienta (pozri časť 4.2).
H
yponatriémia
Pri podávaní YENTREVE bola hlásená hyponatriémia, vrátane prípadov, kedy sérová koncentrácia sodíka bola nižšia ako 110 mmol/l. Hyponatriémia môže byť spôsobená syndrómom neadekvátnej sekrécie antidiuretického hormónu (syndrome of inappropriate anti-diuretic hormone, SIADH). Najviac prípadov hyponatriémie bolo hlásených u starších pacientov, najmä ak boli spojené s nedávnou anamnézou alebo s predispozičnými podmienkami k poruche rovnováhy tekutín.
U pacientok so zvýšeným rizikom vzniku hyponatrémie ako sú staršie pacientky, pacientky s cirhózou
alebo dehydratované pacientky alebo pacientky liečené diuretikami je potrebná opatrnosť.
Depresia, suicidálne myšlienky a správanie
Hoci YENTREVE nie je indikovaný na liečbu depresie, jeho liečivo (duloxetín) existuje aj ako antidepresívum. Depresiu sprevádza vyššie riziko suicidálnych myšlienok, sebapoškodzovania a samovraždy (udalosti spojené so samovraždou). Toto riziko pretrváva, až kým sa nedostaví
signifikantná remisia. Keďže zlepšenie nemusí nastať v priebehu prvých niekoľkých alebo viacerých týždňov liečby, pacient má byť starostlivo sledovaný, až kým sa toto zlepšenie nedostaví. Je
všeobecná klinická skúsenosť, že v skorých fázach zotavovania môže riziko samovraždy vzrásť. Pacienti s anamnézou udalostí spojených so samovraždou alebo tí, ktorí vykazovali významnú mieru suicidálnych myšlienok pred začatím liečby majú vyššie riziko výskytu suicidálnych myšlienok alebo
suicidálneho správania a majú byť počas liečby starostlivo sledovaní. Metaanalýza placebom
kontrolovaných klinických štúdií s antidepresívami u psychiatrických ochorení ukázala zvýšené riziko suicidálneho správania u antidepresív v porovnaní s placebom u pacientov mladších ako 25 rokov.
Počas užívania duloxetínu alebo krátko po jeho vysadení boli zaznamenané prípady výskytu
suicidálnych myšlienok a suicidálneho správania (pozri časť 4.8). Lekári majú pacientov povzbudiť, aby kedykoľvek oznámili akékoľvek znepokojujúce myšlienky alebo pocity alebo príznaky depresie.
Ak sa pri liečbe YENTREVE objavia u pacienta príznaky nepokoja alebo depresie je potrebné
vyhľadať odbornú lekársku pomoc, keďže depresia je závažná porucha zdravotného stavu. Ak by sa rozhodlo o zahájení farmakoterapie antidepresívami, odporúča sa postupné vysadenie YENTREVE (pozri časť 4.2).
Podávanie deťom a mladistvým mladším ako 18 rokov
YENTREVE sa nemá užívať na liečbu detí a mladistvých mladších ako 18 rokov. V klinických štúdiách bolo u detí a mladistvých liečených antidepresívami častejšie pozorované suicidálne správanie (suicidálne pokusy a suicidálne myšlienky) a hostilita (prevažne agresia, protichodné správanie a zlosť) v porovnaní s tými, ktorým bolo podávané placebo. Ak je aj napriek tomu rozhodnuté o liečbe na základe klinickej potreby, pacientka má byť starostlivo monitorovaná na prítomnosť suicidálnych symptómov. Navyše chýbajú údaje o bezpečnosti dlhodobého podávania u detí a adolescentov týkajúce sa rastu, dospievania a kognitívneho a behaviorálneho vývoja.
Lieky obsahujúce duloxetín
Duloxetín sa používa pod rôznymi obchodnými názvami vo viacerých indikáciách (liečba diabetickej
neuropatickej bolesti, depresívnej poruchy, generalizovanej úzkostnej poruchy a stresovej
inkontinencie moču). Je nutné vyvarovať sa používania viac ako jedného z týchto produktov súčasne.
Hepatitída/zvýšené hepatálne enzýmy
Pri podávaní duloxetínu boli hlásené prípady poškodenia pečene, vrátane závažných nárastov hladín hepatálnych enzýmov (>10 násobok hornej hranice normy), hepatitídy a žltačky (pozri časť 4.8).
Väčšina z nich sa objavila počas prvých mesiacov liečby. Charakter poškodenia pečene bol prevažne
hepatocelulárny. Duloxetín sa má užívať s opatrnosťou u pacientok liečených inými liekmi, ktoré sú spájané s poškodením pečene.
Akatízia/psychomotorický nepokoj
Užívanie duloxetínu je spájané so vznikom akatízie, ktorá sa prejavuje subjektívne nepríjemným alebo trýznivým nepokojom a potrebou pohybovať sa, často sprevádzané neschopnosťou pokojne sedieť
alebo stáť. Najväčšia pravdepodobnosť jej výskytu je v priebehu prvých týždňov liečby. Na pacientov,
u ktorých sa vyskytnú tieto príznaky, by mohlo mať zvýšenie dávky negatívny dopad.
Sacharóza
YENTREVE tvrdé gastrorezistentné kapsuly obsahujú sacharózu. Pacienti so zriedkavo sa vyskytujúcimi dedičnými ťažkosťami typu intolerancie fruktózy, poruchami vstrebávania glukózy- galaktózy alebo nedostatku sacharázy-izomaltázy tento liek nemajú užívať.
4.5 Liekové a iné interakcie
Inhibítory monoaminooxidázy (IMAO): z dôvodu rizika vzniku sérotonínového syndrómu duloxetín sa
nemá používať v kombinácii s neselektívnymi ireverzibilnými IMAO alebo minimálne 14 dní od ukončenia liečby IMAO. Vychádzajúc z polčasu duloxetínu, liečbu s IMAO je možné začať najskôr 5 dní po vysadení YENTREVE (pozri časť 4.3).
Súčasné užívanie YENTREVE so selektívnymi reverzibilnými IMAO, ako je moklobemid, sa neodporúča (pozri časť 4.4). Antibiotikum linezolid je reverzibilným neselektívnym IMAO a nemá sa podávať pacientom užívajúcim YENTREVE (pozri časť 4.4).
Inhibítory CYP1A2: keďže CYP1A2 sa zúčastňuje na metabolizme duloxetínu, súčasné užívanie duloxetínu spolu so silnými inhibítormi CYP1A2 pravdepodobne vedie k zvýšenej koncentrácii duloxetínu. Fluvoxamín (100 mg raz denne) ako silný inhibítor CYP1A2, znížil zdanlivý plazmatický klírens duloxetínu o približne 77 %, pričom 6-násobne vzrástla AUCo-t . YENTREVE sa preto nemá podávať v kombinácii so silnými inhibítormi CYP1A2 typu fluvoxamínu (pozri časť 4.3).
Lieky s vplyvom na CNS: pri užívaní YENTREVE v kombinácii s inými centrálne pôsobiacimi liekmi
a látkami, vrátane alkoholu a liekov so sedatívnym účinkom (napr. benzodiazepíny, morfínomimetiká,
antipsychotiká, fenobarbital, sedatívne antihistaminiká) sa odporúča postupovať s opatrnosťou.
Sérotonínové látky: sérotonínový syndróm bol zriedkavo hlásený u pacientok, ktoré užívali selektívne inhibítory spätného vychytávania sérotonínu (SSRI/SNRI) spolu s látkami, ktoré majú sérotonergické účinky. Opatrnosť sa odporúča v prípade, ak sa YENTREVE užíva súčasne so sérotonergickými látkami, akými sú SSRI, SNRI a tricyklické antidepresíva ako je klomipramín alebo amitriptylín, IMAO, akými sú moklobemid alebo linezolid, s ľubovníkom bodkovaným (Hypericum perforatum) či triptánmi, tramadolom, petidínom a tryptofánom (pozri časť 4.4).
Vplyv duloxetínu na iné lieky
Lieky metabolizované CYP1A2: súčasné podávanie duloxetínu (60 mg dvakrát denne) nemalo významný vplyv na farmakokinetiku teofylínu, ktorý je substrátom CYP1A2.
Lieky metabolizované CYP2D6: duloxetín je mierny inhibítor CYP2D6. Keď sa duloxetín v dávke
60 mg dvakrát denne podal súčasne s jednorazovou dávkou dezipramínu (substrát CYP2D6), AUC
dezipramínu sa trojnásobne zvýšila. Súčasné podávanie duloxetínu (40 mg dvakrát denne) zvyšuje
AUC tolterodínu (2 mg dvakrát denne) v rovnovážnom stave o 71%, nijako však neovplyvňuje farmakokinetiku jeho aktívneho 5-hydroxymetabolitu; úprava dávkovania sa neodporúča. Opatrnosť sa odporúča, ak sa duloxetín podáva spolu s liekmi, ktoré sú metabolizované prevažne izoenzýmom CYP2D6 (risperidón, tricyklické antidepresíva [TCAs] ako sú nortriptylín, amitriptylín a imipramín), najmä ak majú tieto úzky terapeutický index (ako je flekainid, propafenón a metoprolol).
Perorálne kontraceptíva a iné steroidné látky: výsledky in vitro štúdií preukázali, že duloxetín neindukuje katalytickú aktivitu izoenzýmu CYP3A. Špecifické in vivo liekové interakčné štúdie sa nevykonali.
Antikoagulanciá a antiagreganciá: Opatrnosť je potrebná, keď sa duloxetín kombinuje s perorálnymi antikoagulanciami alebo antiagreganciami kvôli možnému zvýšeniu rizika krvácania, ktoré sa pripisuje farmakodynamickej interakcii. Okrem toho sa zaznamenali zvýšené hodnoty INR
u pacientov liečených warfarínom, ktorým sa súčasne podával duloxetín. Avšak súčasné podávanie
duloxetínu s warfarínom zdravým dobrovoľníkom v ustálenom stave v rámci farmakologického klinického skúšania nemalo za následok klinicky významné zmeny INR oproti počiatočným hodnotám ani zmeny farmakokinetiky R- alebo S- warfarínu.
V
plyv iných liekov na duloxetín
A
ntacidá a antagonisti H2 receptorov: súčasné podávanie YENTREVE a antacíd obsahujúcich hliník a horčík či famotidínu nijako významne neovplyvnilo rýchlosť alebo rozsah absorpcie duloxetínu po
podaní dávky 40 mg perorálne.
Induktory CYP1A2: Analýzy populačných farmakokinetických štúdií preukázali, že fajčiari mali
takmer o 50% nižšie plazmatické koncentrácie duloxetínu ako nefajčiari.
4.6 Fertilita, gravidita a laktácia
Fertilita
Duloxetín nemal vplyv na mužskú fertilitu a u žien bol vplyv evidentný iba pri dávkach spôsobujúcich materskú toxicitu.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití duloxetínu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu pri hladinách systémovej expozície duloxetínu (AUC) nižších ako je
maximálna klinická expozícia (pozri časť 5.3).
Nie je známe potenciálne riziko u ľudí.
Epidemiologické údaje naznačujú, že používanie SSRI počas tehotenstva, zvlášť v pokročilom štádiu tehotenstva, môže zvýšiť riziko perzistentnej pľúcnej hypertenzie u novorodencov (PPHN). Hoci žiadna štúdia nesledovala súvislosť medzi PPHN a liečbou SNRI, toto potenciálne riziko sa nedá vylúčiť pri duloxetíne, berúc do úvahy podobný mechanizmus účinku (inhibícia spätného vychytávania sérotonínu).
Podobne ako u iných sérotonergických liekoch sa u novorodenca môžu objaviť symptómy z prerušenia liečby, keď matka užívala duloxetín krátko pred pôrodom. Symptómy z vysadenia pozorované pri duloxetíne môžu zahŕňať hypotóniu, tras, nepokoj, problémy s príjmom potravy, ťažkosti s dýchaním
a kŕče. Väčšina prípadov sa vyskytla buď pri pôrode alebo niekoľko dní po pôrode.
YENTREVE sa má užívať počas gravidity len ak potenciálny prínos prevýši potenciálne riziko pre plod. Ženy treba poučiť, aby oznámili svojmu lekárovi, ak otehotnejú alebo plánujú otehotnieť počas liečby.
Laktácia
Duloxetín je veľmi málo vylučovaný do materského mlieka vychádzajúc zo štúdie so 6 dojčiacimi ženami, ktoré nedojčili svoje deti. Odhadovaná denná dávka u dojčaťa v mg/kg je približne 0,14%
dávky podanej matke (pozri časť 5.2). Keďže nie je známa bezpečnosť podávania duloxetínu u dojčiat, YENTREVE je kontraindikovaný počas dojčenia (pozri časť 4.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. YENTREVE môže súvisieť s útlmom a závratom. Pacienti sa majú poučiť, že v prípade, ak sa u nich objaví útlm alebo závrat, majú sa vyvarovať potenciálne nebezpečných úloh, akými sú vedenie vozidiel alebo obsluha strojov.
4.8 Nežiaduce účinky
a. Zhrnutie bezpečnostného profilu
Najčastejšie hlásenými nežiaducimi udalosťami u pacientok liečených YENTREVE v klinických
štúdiách SUI a ostatných porúch funkcie dolných močových ciest boli nauzea, sucho v ústach, únava a zápcha. Analýza údajov zo štyroch 12-týždňových, placebom kontrolovaných klinických štúdií
s pacientkami trpiacimi SUI, zahŕňajúcich 958 pacientok liečených duloxetínom a 955 pacientok
liečených placebom ukázala, že nástup uvádzaných nežiaducich udalostí sa zvyčajne objavoval počas prvého týždňa liečby. Väčšina z najčastejšie sa vyskytujúcich nežiaducich udalostí však bola mierna či stredne závažná a do 30 dní odznela (napr. nevoľnosť).
b. Tabuľkové zhrnutie nežiaducich reakcií
Tabuľka 1 uvádza výskyt nežiaducich reakcií zaznamenaný zo spontánnych hlásení a v placebom kontrolovaných klinických štúdiách
Tabuľka 1: Nežiaduce reakcie
Frekvencia výskytu: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej
závažnosti.
Veľmi časté Časté Menej časté Zriedkavé Veľmi zriedkavé
Infekcie a nákazy
P
oruchy imunitného systému
P
oruchy endokrinného systému
Laryngitída
Hypersenzitivita Anafylaktická reakcia
P
oruchy metabolizmu a výživy Pokles chuti do jedla
Psychické poruchy
Hypotyreóza
Dehydratácia Hyperglykémia (hlásená hlavne u pacientov s diabetom) Hyponatriémia SIADH6
Nespavosť Agitácia Pokles libida Úzkosť
Porucha spánku
Poruchy nervového systému Bolesť hlavy Závrat Spavosť Parestézia Tras
Letargia
Poruchy oka
Škrípanie zubami Dezorientácia Apatia Abnormálny orgazmus Abnormálne sny
Nervozita
Porucha pozornosti
Porucha chuti Znížená kvalita spánku
Samovražedné správanie5, 6
Samovražedné myšlienky5, 7
Mánia6
Halucinácie
Agresia a hnev4, 6
Sérotonínový syndróm6
Kŕče1
Myoklónia
Akatízia6
Psychomotorický nepokoj6
Extrapyramídové symptómy6
Dyskinéza Syndróm nepokojných nôh

Nejasné videnie Mydriáza Zhoršenie zraku Suché oči
Glaukóm
V
eľmi časté Časté Menej časté Zriedkavé Veľmi zriedkavé
P
oruchy ucha a labyrintu
Vertigo Tinitus1
Bolesť ucha
P
oruchy srdca a srdcovej činnosti
P
oruchy ciev
Palpitácie
Tachykardia
Supraventriku- lárna arytmia, hlavne atriálna fibrilácia6
Hypertenzia3, 7
Sčervenanie
Synkopa2
Zvýšený krvný tlak3
Hypertenzná kríza3
Ortostatická hypotenzia2
Chlad periférnej
časti končatín
P
oruchy dýchacej sústavy, hrudníka a mediastína
Zívanie Zvieranie hrdla
Epistaxa
Poruchy gastrointestinálneho traktu
Nauzea
Sucho v ústach
Zápcha
Hnačka
Bolesť brucha
Vracanie
Dyspepsia
Gastrointestinálne krvácanie7
Gastroenteritída
Stomatitída Grganie Gastritída Dysfágia Plynatosť Zápach dychu
Hematochézia Mikroskopická kolitída9
P
oruchy pečene a žlčových ciest
P
oruchy kože a podkožného tkaniva
Hepatitída3
Zvýšené hladiny pečeňových enzýmov (ALT, AST, alkalická fosfatáza)
Akútne poškodenie
pečene
Zlyhanie pečene6
Žltačka6
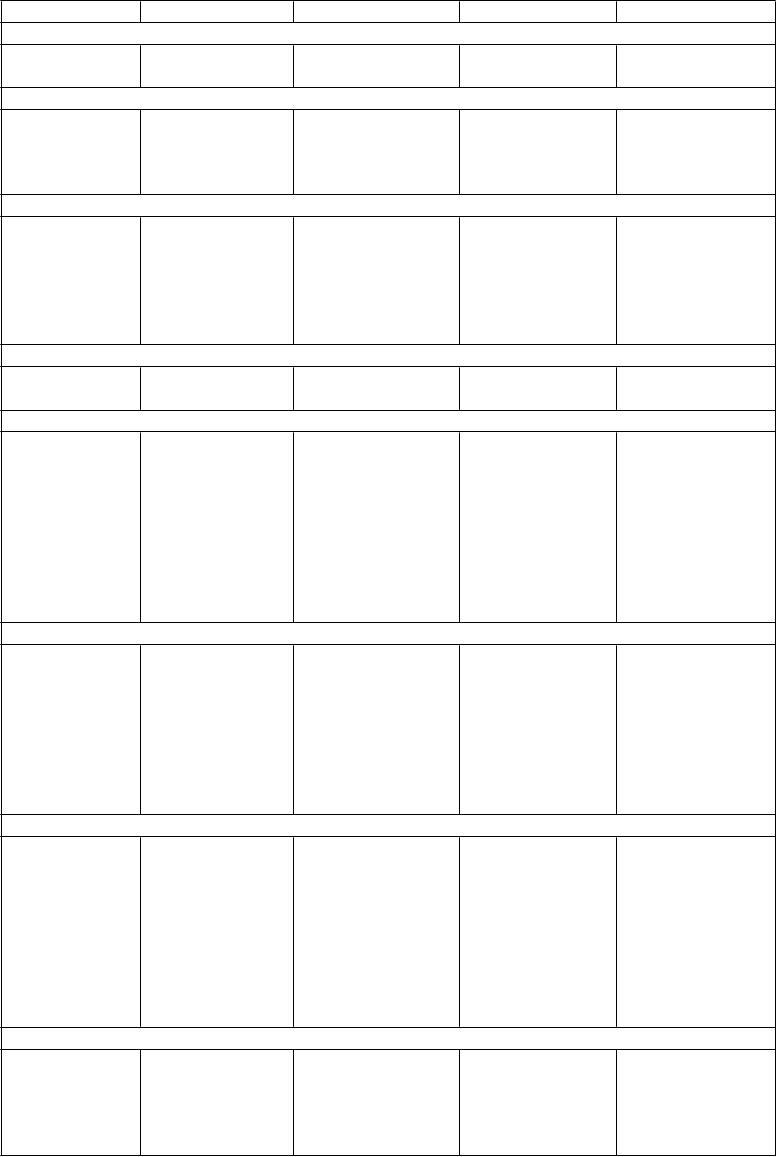
Zvýšené potenie Vyrážka Nočné potenie Urtikária Kontaktná dermatitída Studený pot
Zvýšený sklon k tvorbe modrín
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Bolesť svalov a kostí
Napätie svalov
Svalový kŕč
Trizmus
Stevensov- Johnsonov syndróm6
Angioneurotický edém6
Fotosenzitívne
reakcie
Zášklby svalov
Kožná vaskulitída
V
eľmi časté Časté Menej časté Zriedkavé Veľmi zriedkavé
P
oruchy obličiek a močových ciest
Močenie s oneskoreným štartom Dyzúria Noktúria Polakizúria Abnormálny zápach moču
Poruchy reprodukčného systému a prsníkov Gynekologické krvácanie Menopauzálne symptómy
Celkové poruchy a reakcie v mieste podania
Zadržiavanie moču6
Polyúria
Slabý prúd moču
Poruchy menštruácie Galaktorea Hyperprolaktinémi a
Únava Asténia
Zimnica
Bolesť v hrudi7
Pády8
Neobvyklé pocity
Pocit chladu Smäd Malátnosť Pocit tepla
Porucha chôdze
Laboratórne a funkčné vyšetrenia
Pokles hmotnosti Nárast hmotnosti Zvýšená hladina cholesterolu v krvi Zvýšená hladina kreatinínfosfokinázy v krvi
Zvýšená hladina draslíka v krvi
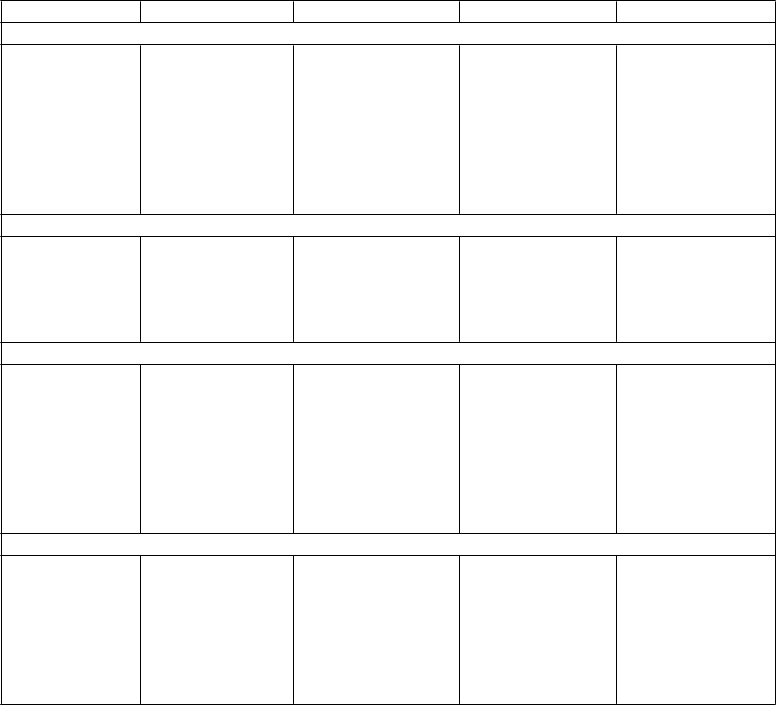
1 Boli hlásené tiež prípady kŕčov a tinitu po skončení liečby.
2 Hlavne na začiatku liečby boli hlásené prípady ortostatickej hypotenzie a synkopy.
3 Pozri časť 4.4
4 Boli hlásené prípady agresie a hnevu hlavne na začiatku liečby alebo po skončení liečby.
5 Boli hlásené prípady samovražedných myšlienok a samovražedného správania počas liečby
duloxetínom alebo v krátkom čase po skončení liečby (pozri časť 4.4).
6 Odhadovaná frekvencia na základe post-marketingového sledovania nežiaducich reakcií:
nepozorované v placebom kontrolovaných klinických skúšaniach.
7 Nie je štatisticky významný rozdiel oproti placebu.
8 Pády boli častejšie u starších pacientov (>65 rokov).
9 Odhadovaná frekvencia na základe údajov zo všetkých klinických skúšaní.
c. Opis vybraných nežiaducich reakciíVysadenie duloxetínu (hlavne náhle) vedie často k vzniku príznakov z vysadenia. Najčastejšie sú
hlásené tieto príznaky: závrat, senzorické poruchy (vrátane parestézie alebo vnemov ako pri elektrickom šoku, namä v hlave), poruchy spánku (vrátane insomnie a intenzívnych snov), únava, ospalosť, agitovanosť alebo úzkosť, nauzea a/alebo vracanie, tras, bolesť hlavy, myalgia, podráždenosť, hnačka a zvýšené potenie.
Zvyčajne sú tieto reakcie, v prípade SSRI a SNRI, slabé až mierne a samé odznejú, avšak u niektorých pacientov môžu byť vážne a/alebo dlhšieho trvania. Preto sa odporúča, ak nie je liečba duloxetínom ďalej potrebná, postupné vysadenie liečby znižovaním dávky (pozri časti 4.2 a 4.4).
Srdcovou frekvenciou korigovaný QT interval u pacientok liečených duloxetínom sa nijako neodlišoval od hodnôt zistených u pacientok liečených placebom. Nezaznamenali sa žiadne klinicky významné rozdiely medzi hodnotami QT, PR, QRS alebo QTcB u pacientok liečených duloxetínom alebo placebom.
V 12-týždňovej akútnej fáze troch klinických štúdií s duloxetínom u pacientov trpiacich diabetickou neuropatickou bolesťou došlo u pacientov liečených duloxetínom k miernemu, avšak štatisticky významnému zvýšeniu hladiny glukózy v krvi nalačno. Hodnoty HbA1c boli stabilné aj u pacientov liečených duloxetínom aj u pacientov s placebom. V pokračovacej fáze týchto štúdií, ktorá trvala až 52 týždňov, sa objavilo v oboch skupinách pacientov zvýšenie hodnoty HbA1c, pričom priemerné
zvýšenie bolo o 0,3% vyššie v skupine pacientov liečených duloxetínom. Zaznamenalo sa tiež mierne
zvýšenie glukózy v krvi nalačno a celkového cholesterolu u pacientov liečených duloxetínom, pričom
tieto laboratórne testy v kontrolnej skupine ukázali mierny pokles.
Hlásenie podozrení na nežiaduce reakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V*. k
4.9 PredávkovanieZaznamenali sa prípady predávkovania duloxetínom samotným alebo v kombinácii s inými liekmi, v dávke 5 400 mg. Vyskytlo sa i niekoľko prípadov úmrtia, najmä pri predávkovaní kombináciou liekov, ale aj pri predávkovaní samotným duloxetínom v dávke približne 1000 mg. Príznaky
a symptómy predávkovania (samotným duloxetínom alebo v kombinácii s inými liekmi) zahŕňajú somnolenciu, kómu, sérotonínový syndróm, záchvaty, vracanie a tachykardiu.
Nie je známe žiadne špecifické antidotum duloxetínu, ale ak sa vyskytne sérotonínový syndróm, má sa zvážiť špecifická liečba (ako je cyproheptadín a/alebo kontrola teploty). Má sa zabezpečiť priechodnosť dýchacích ciest. Zároveň sa odporúča monitorovať funkciu srdca a vitálne funkcie, spolu s náležitými symptomatickými a podpornými opatreniami. Výplach žalúdka sa môže indikovať, ak je prevedený ihneď po požití alebo u symptomatických pacientok. Aktívne uhlie môže byť prospešné
na obmedzenie absorpcie. Duloxetín má rozsiahly distribučný objem a je nepravdepodobné, že by forsírovaná diuréza, hemoperfúzia či plazmaferéza mohli byť prospešné.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné antidepresíva. ATC kód: N06AX21
Mchanizmus účinkuDuloxetín je kombinovaný inhibítor spätného vychytávania sérotonínu (5-HT) a noradrenalínu (NA). V malej miere inhibuje spätné vychytávanie dopamínu bez významnej afinity k histamínovým, dopaminergickým, cholinergickým a adrenergickým receptorom.
Farmakodynamické účinkyZvýšené hladiny 5-HT a NE v krížovej mieche viedli v štúdiách na zvieratách k zvýšenému svalovému
tonusu močovej rúry prostredníctvom zvýšenej stimulácie priečne pruhovaného svalu zvierača močovej rúry pudendálnym nervom, výhradne počas fázy zadržiavania moču. Podobný mechanizmus
vedie u žien k silnejšiemu uzatvoreniu močovej rúry počas fázy zadržiavania moču fyzickým tlakom,
čím možno vysvetliť účinnosť duloxetínu v liečbe žien trpiacich SUI.
K
li
n
i
cká účinnosť a bezpečnosť
Účinnosť duloxetínu v dávke 40 mg dvakrát denne v liečbe SUI bola stanovená v štyroch dvojito
zaslepených, placebom kontrolovaných štúdiách, v rámci ktorých bolo z 1 913 žien (vo veku 22 až
83 rokov) so SUI 958 náhodne zaradených do programu liečby duloxetínom a 955 do programu liečby placebom. Primárnymi ukazovateľmi účinnosti boli Frekvencia výskytu epizód inkontinencie (Incontinence Episode Frequency (IEF) stanovená na základe denníkových záznamov a skóre špecifického dotazníka pre zisťovanie kvality života u pacientok trpiacich inkontinenciou (Incontinence Specific Quality of Life Questionnaire (I-QOL).
Frekvencia výskytu epizód inkontinencie (Incontinence Episode Frequency – IEF): vo všetkých štyroch štúdiách skupina liečená duloxetínom zaznamenala 50% alebo viac mediánový pokles IEF v porovnaní s 33% v placebom kontrolovanej skupine. Rozdiely sa pozorovali pri každej návšteve
po 4 týždňoch (duloxetín 54% a placebo 22%), po 8 týždňoch (52% a 29%) a po 12 týždňoch (52%
a 33%) liečby.
V doplnkovej štúdii zameranej výlučne na pacientky so závažnou SUI, bola kompletná odpoveď
na liečbu duloxetínom dosiahnutá do 2 týždňov.
Účinnosť YENTREVE nebola hodnotená dlhšie ako 3 mesiace v placebom kontrolovaných štúdiách. Klinický prínos YENTREVE v porovnaní s placebom sa nepreukázal u žien s miernou SUI, ktoré boli v randomizovaných štúdiách definované ako tie s IEF < 14 za týždeň. U týchto žien nevykazuje YENTREVE vyššiu účinnosť v porovnaní s konzervatívnejšími behaviorálnymi zákrokmi.
Kvalita života: Skóre dotazníka kvality života pri inkontinencii (I-QOL - Incontinence Quality of Life) sa významne zlepšilo v skupine pacientok liečených duloxetínom v porovnaní so skupinou liečenou placebom (9,2 oproti 5,9 v zlepšení skóre, p<0,001). Podľa globálnej stupnice zlepšenia (Patient
Global Improvement - PGI) považovalo svoje symptómy stresovej inkontinencie moču za zlepšené významne viac žien liečených duloxetínom v porovnaní s tými ženami, ktoré dostávali placebo (64,6%
oproti 50,1%, p<0,001).
YENTREVE a absolvovaná operačná liečba na zabezpečenie kontinencie moču: na základe obmedzených údajov možno predpokladať, že prínos YENTREVE nie je menší u pacientok, ktoré predtým podstúpili operáciu na zabezpečenie kontinencie.
YENTREVE a tréning svalstva panvového dna (Pelvic Floor Muscle Training (PFMT)): počas 12- týždňovej, zaslepenej, randomizovanej, kontrolovanej štúdie preukázal YENTREVE väčšie poklesy ukazovateľa IEF a to tak v porovnaní s liečbou placebom ako aj so samotným PFMT. Kombinovaná terapia (duloxetín + PFMT) preukázala výraznejšie zlepšenie oboch ukazovateľov – množstva použitých hygienických vložiek i pre toto ochorenie špecifických ukazovateľov kvality života – ako liečba samotným YENTREVE či samotný tréning svalstva panvového dna (PFMT).
Dojčiace matky: Dispozícia duloxetínu bola skúmaná u 6 dojčiacich žien, ktoré boli minimálne 12
týždňov po pôrode. Duloxetín je detekovateľný v materskom mlieku a rovnovážne koncentrácie v materskom mlieku tvoria asi jednu štvrtinu plazmatickej koncentrácie. Množstvo duloxetínu
v materskom mlieku je približne 7 µg/deň pri dávkovaní 40 mg 2x denne. Laktácia neovplyvňovala
farmakokinetiku duloxetínu.
Deti a dospievajúci
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií pre YENTTREVE
s ohľadom na všetky vekové podskupiny detí a dospievajúcich v liečbe stresovej inkontinencie moču.
Pozri časť 4.2 pre informáciu o pediatrickom použití.
5.2 Farmakokinetické vlastnosti
Duloxetín sa podáva ako samostatný enantiomér. Duloxetín je extenzívne metabolizovaný prostredníctvom oxidatívnych enzýmov (CYP1A2 a polymorfný CYP2D6) a následne konjugáciou.
Farmakokinetika duloxetínu preukazuje veľkú interindividuálnu variabilitu (všeobecne 50-60%), na ktorej sa čiastočne podieľa pohlavie, vek, fajčenie a úroveň metabolizmu CYP2D6.
Absorpcia: Duloxetín sa po perorálnom podaní dobre vstrebáva, pričom k maximálnej koncentrácii
(Cmax) dochádza 6 hodín po podaní dávky. Absolútna perorálna biologická dostupnosť duloxetínu je
32% až 80% (priemer 50%; N=8 osôb). Potrava predlžuje čas potrebný na dosiahnutie najvyššej
koncentrácie zo 6 na 10 hodín a okrajovo zmenšuje rozsah absorpcie (priemerne o 11%).
Distribúcia: Duloxetín sa približne z 96% viaže na ľudské plazmatické proteíny. Duloxetín sa viaže tak na albumín ako i na α1-kyslý-glykoproteín. Poškodenie funkcie obličiek či pečene neovplyvňuje väzbu na proteíny.
Biotransformácia: Duloxetín sa extenzívne metabolizuje a jeho metabolity sa vylučujú predovšetkým močom. Tak CYP2D6 ako aj CYP1A2 katalyzujú tvorbu dvoch hlavných metabolitov: glukuronidového konjugátu 4-hydroxyduloxetínu a sulfátového konjugátu 5-hydroxy 6- metoxyduloxetínu. Na základe in vitro štúdií možno považovať cirkulujúce metabolity duloxetínu za farmakologicky neaktívne. Farmakokinetika duloxetínu u pacientok, ktoré sú slabými metabolizátormi CYP2D6, nebola špecificky sledovaná. Na základe obmedzených údajov možno predpokladať, že plazmatické hladiny duloxetínu sú u týchto pacientok vyššie.
Eliminácia: Eliminačný polčas duloxetínu po perorálnom podaní sa pohybuje v rozsahu od 8do 17 hodín (priemerne 12 hodín). Plazmatický klírens duloxetínu sa po intravenóznom podaní pohybuje v rozpätí 22 l/h až 46 l/h (priemerne 36 l/h). Zjavný plazmatický klírens duloxetínu po perorálnom podaní sa pohybuje od 33 to 261 l/h (priemerne 101 l/h).
Špeciálne skupiny pacientov:
Vek: farmakokinetické rozdiely boli zisťované medzi mladšími a staršími ženami (≥65 rokov)
(u starších pacientok bola zvýšená hodnota AUC približne o 25% a polčas predĺžený približne o 25%), ich veľkosť však nie je taká, aby bolo nutné upravovať dávku.
Porucha funkcie obličiek: pacientky s koncovým štádiom ochorenia obličiek (End Stage Renal Disease (ESRD)) podrobujúce sa dialýze mali oproti zdravým osobám dvakrát vyššie hodnoty Cmax a AUC duloxetínu. Dostupné farmakokinetické údaje o duloxetíne u pacientok s miernym až stredne závažným poškodením funkcie obličiek sú len obmedzené.
Nedostatočnosť pečene: stredne závažná porucha pečene (Child Pugh trieda B) ovplyvňovala farmakokinetiku duloxetínu. V porovnaní so zdravými osobami, u pacientok so stredne závažnou poruchou pečene bol zistený zjavný plazmatický klírens duloxetínu o 79% nižší, terminálny polčas
2,3 krát dlhší a AUC 3,7 krát väčšie. U pacientok s miernou až stredne závažnou nedostatočnosťou pečene nebola sledovaná farmakokinetika duloxetínu a jeho metabolitov.
5.3 Predklinické údaje o bezpečnosti
Duloxetín nebol genotoxický v rámci štandardnej série testov a u potkanov nebol ani karcinogénny. V štúdii na karcinogenicitu boli v pečeni potkanov pozorované multijadrové bunky bez prítomnosti iných histopatologických zmien. Mechanizmus a klinický význam tohto javu nie je známy.
U samíc myší, ktoré užívali duloxetín počas dvoch rokov, bol pozorovaný zvýšený výskyt hepatocelulárnych adenómov a karcinómov iba pri vysokých dávkach (144 mg/kg/deň), tieto však boli považované za sekundárne následky indukcie mikrozomálnych hepatálnych enzýmov. Nie je známe,
či sú tieto údaje získané pozorovaním myší, relevantné pre ľudí. U samíc potkanov, ktorým bol podávaný duloxetín pred a počas párenia a skorého štádia gravidity, bol zaznamenaný pokles príjmu materskej potravy a telesnej hmotnosti, poruchy estrálneho cyklu, pokles indexu živonarodeného
a žijúceho potomstva a retardáciu rastu potomstva pri hladinách systémovej expozície odhadovaných
väčšinou ako maximálna klinická expozícia (AUC). V štúdii na embryotoxicitu u králikov bola pri nižších hladinách systémovej expozície ako je maximálna klinická expozícia (AUC) zaznamenaná
vyššia frekvencia výskytu kostrových a kardiovaskulárnych malformácií. Žiadne malformácie neboli
zaznamenané v inej štúdii testujúcej vyššiu dávku odlišnej soli duloxetínu. V štúdii pre/postnatálnej toxicity u potkanov indukoval duloxetín nežiaduce účinky na správanie potomstva pri nižších hladinách systémovej expozície ako je maximálna klinická expozícia (AUC).
Štúdie s mláďatami potkanov ukázali prechodné účinky v neurobehaviorálnej oblasti, taktiež signifikantné zníženie telesnej hmotnosti a príjmu potravy, indukciu hepatálnych enzýmov
a hepatocelulárnu vakuolizáciu pri dávkach 45mg/kg/deň. Všeobecný profil toxicity duloxetínu
u mláďat potkanov bol podobný s tým u dospelých potkanov. Výška dávky, ktorá nevyvoláva
nežiaduce účinky, bola stanovená na 20 mg/kg/deň.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly:
Hypromelóza
Acetosukcinát hypromelózy
Sacharóza Zrnený cukor Mastenec
Oxid titaničitý (E 171) Trietylcitrát
Obal kapsuly: Želatína Nátriumlaurylsulfát Oxid titaničitý (E 171) Indigokarmín (E 132)
Červený oxid železitý (E 172) Žltý oxid železitý (E 172)
Potravinársky čierny atrament
Potravinársky atrament:
Syntetický čierny oxid železitý (E 172) Propylénglykol
Šelak
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou. Uchovávajte pri teplote neprevyšujúcej
30°C.
6.5 Druh obalu a obsah balenia
Blistre vyrobené z polyvinylchloridu (PVC), polyetylénu (PE) a polychlorotrifluoroetylénu (PCTFE),
zapečatené hliníkovou fóliou.
Balenia po 28, 56, 98, 140 a 196 (balenie 2x98) kapsúl.
Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIEli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Holandsko.
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/04/280/002
EU/1/04/280/003
EU/1/04/280/004
EU/1/04/280/005
EU/1/04/280/006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 11. augusta 2004
Dátum posledného predĺženia registrácie: 24. júna 2009
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránka Európskej liekovej agentúry
(EMA)
http://www.ema.europa.eu/
1. NÁZOV LIEKU
YENTREVE 20 mg tvrdé gastrorezistentné kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá kapsula obsahuje 20 mg duloxetínu (vo forme hydrochloridu). Pomocné látky so známym účinkom:
každá kapsula môže obsahovať až 37 mg sacharózy.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá gastrorezistentná kapsula.
Nepriehľadné, modré telo s potlačou „20 mg“ a nepriehľadné modré viečko s potlačou „9544“.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
YENTREVE je indikovaný pre ženy na liečbu stredne závažnej až závažnej stresovej inkontinencie
moču (SUI).
YENTREVE je indikovaný u dospelých.
Ďalšie informácie nájdete v časti 5.1.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Odporúčaná dávka YENTREVE je 40 mg dvakrát denne bez ohľadu na príjem potravy. Po 2-4
týždňoch liečby sa má stav pacientok prehodnotiť za účelom zistenia úžitku a znášanlivosti tejto
liečby. Pre niektoré pacientky môže byť prínosné začať liečbu dávkou 20 mg dvakrát denne v priebehu dvoch týždňov, kým sa dávka zvýši na odporúčanú dávku 40 mg dvakrát denne. Postupné zvyšovanie
dávky môže znížiť, aj keď nevylučuje riziko nauzey a závratov.
Avšak o účinnosti YENTREVE 20 mg dvakrát denne sú dostupné len obmedzené údaje.
Účinnosť YENTREVE nebola hodnotená dlhšie ako 3 mesiace v placebom kontrolovaných štúdiách. Úžitok liečby sa má prehodnocovať v pravidelných intervaloch.
Kombinácia YENTREVE s programom tréningu svalstva panvového dna (PFMT) môže byť účinnejšia ako liečba samotná. Odporúča sa zváženie súčasného PFMT.
Porucha funkcie pečene:
YENTREVE sa nesmie podávať ženám s ochorením pečene, ktoré môže vyústiť do poškodenia
funkcie pečene (pozri časti 4.3 a 5.2).
Porucha funkcie obličiek:
U pacientok s miernou alebo stredne závažnou dysfunkciou obličiek (klírens kreatinínu 30 až
80 ml/min) nie je nutné upravovať dávkovanie. YENTREVE sa nesmie podávať pacientkam so závažným poškodením pečene (klírens kreatinínu <30 ml/min, pozri časť 4.3)
P
ediatrická populácia
Bezpečnosť a účinnosť duloxetínu na liečbu stresovej inkontinencie moču neboli stanovené. K dispozícii nie sú žiadne údaje.
Osobitné skupiny
Staršie pacientky:
Pri liečbe starších pacientok sa má postupovať opatrne.
Vysadenie liečby:
Je potrebné vyhnúť sa náhlemu vysadeniu. Pri ukončovaní liečby YENTREVE sa má dávka znižovať postupne aspoň počas jedného až dvoch týždňov, aby sa znížilo riziko vzniku symptómov z vysadenia
(pozri časť 4.4 a 4.8). Ak sa po znížení dávky alebo po vysadení liečby objavia neznesiteľné príznaky
z vysadenia, je potrebné zvážiť podávanie predtým predpísanej dávky. Neskôr môže lekár pokračovať
v znižovaní dávky, ale oveľa postupnejšie.
Spôsob podania
Perorálne použitie.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na niektorú z pomocných látok uvedených v časti 6.1. Ochorenie pečene s následkom poškodenia funkcie pečene (pozri časť 5.2).
YENTREVE sa nemá používať v kombinácii s neselektívnymi, ireverzibilnými inhibítormi monoaminooxidázy - IMAO (pozri časť 4.5).
YENTREVE sa nemá podávať v kombinácii s inhibítormi CYP1A2 ako sú fluvoxamín, ciprofloxacín alebo enoxacín, pretože kombinácia spôsobuje zvýšenie plazmatických koncentrácií duloxetínu (pozri časť 4.5).
Závažné renálne poškodenie (klírens kreatinínu <30 ml/min) (pozri časť 4.4).
Zahájenie liečby liekom YENTREVE je kontraindikované u pacientok s nekontrolovanou hypertenziou, pretože by mohlo vystaviť pacientky potenciálnemu riziku vzniku hypertenznej krízy (pozri časti 4.4 a 4.8).
4.4 Osobitné upozornenia a opatrenia pri používaní
Mánia a záchvaty
Pacientkám, ktoré majú v anamnéze mániu či diagnózu bipolárnej poruchy a/alebo záchvaty, sa má podávať YENTREVE s opatrnosťou.
Sérotonínový syndróm
Tak ako pri ostatných sérotonergických látkach, môže sa pri liečbe duloxetínom vyskytnúť sérotonínový syndróm. ktorý je potenciálne život ohrozujúcim stavom, najmä pri súčasnom podávaní
iných sérotonínových látok (vrátane SSRI, SNRI, tricyklických antidepresív alebo triptánov), látok,
ktoré upravujú metabolizmus sérotonínu ako napr. IMAO alebo antipsychotiká či ďalšie dopamínové antagonisty, ktoré môžu mať vplyv na sérotonergický neurotransmiterový systém (pozri časti 4.3
a 4.5).
Symptómy sérotonínového syndrómu môžu zahŕňať zmeny psychického stavu (napr. agitáciu, halucinácie, kómu), autonómnu nestabilitu (napr. tachykardiu, labilný krvný tlak, hypertermiu), neuromuskulárne aberácie (napr. hyperreflexiu, nekoordináciu) a/alebo gastrointestinálne symptómy (napr. nauzea, vracanie, hnačka).
Ak je súčasné podávanie duloxetínu a iných sérotonergických látok, ktoré môžu ovplyvniť sérotonergické a/alebo dopaminergické neurotransmiterové systémy, klinicky opodstatnené, odporúča sa dôkladné sledovanie pacienta, najmä na začiatku liečby a pri zvyšovaní dávok.
Ľubovník bodkovaný
Nežiaduce reakcie sa môžu častejšie vyskytovať v priebehu súčasného užívania YENTREVE
a bylinných prípravkov obsahujúcich ľubovník bodkovaný (Hypericum perforatum).
Mydriáza
Mydriáza bola hlásená v spojení s duloxetínom, preto sa má duloxetín pacientkám so zvýšeným
vnútroočným tlakom alebo pacientkám s rizikom výskytu akútneho glaukómu s úzkym uhlom
predpisovať s opatrnosťou.
Tlak krvi a srdcová frekvencia
U niektorých pacientov bolo užívanie duloxetínu spojené so zvýšeným krvným tlakom a klinicky
významnou hypertenziou. Môže to súvisieť s noradrenergným pôsobením duloxetínu. V súvislosti s duloxetínom boli zaznamenané prípady hypertenznej krízy, hlavne u pacientov s preexistujúcou hypertenziou. Preto sa u pacientov so známou hypertenziou a/alebo iným ochorením srdca odporúča monitorovanie krvného tlaku, najmä počas prvého mesiaca liečby. Pacientom, ktorých zdravotný stav by sa mohol zhoršiť zvýšením srdcovej frekvencie alebo zvýšením krvného tlaku, sa má duloxetín podávať opatrne. Opatrnosť je tiež potrebná, keď sa duloxetín podáva s liekmi, ktoré môžu narušiť jeho metabolizmus (pozri časť 4.5). U pacientov, u ktorých sa vyskytlo trvalé zvýšenie krvného tlaku počas užívania duloxetínu, je potrebné zvážiť buď zníženie dávky alebo postupné vysadenie duloxetínu (pozri časť 4.8). U pacientov s nekontrolovanou hypertenziou sa nemá zahájiť liečba duloxetínom (pozri časť 4.3).
Porucha funkcie obličiek
U pacientok so závažným poškodením funkcie obličiek, ktoré sa podrobujú hemodialýze (klírens kreatinínu <30 ml/min), sa vyskytli zvýšené plazmatické koncentrácie duloxetínu. U pacientok so závažným renálnym poškodením, pozri časť 4.3. Informácie týkajúce sa pacientok s miernou alebo stredne závažnou dysfunkciou obličiek sú uvedené v časti 4.2.
Krvácanie
V súvislosti so selektívnymi inhibítormi spätného vychytávania sérotonínu (SSRI) a selektívnymi inhibítormi spätného vychytávania sérotonínu/noradrenalínu (SNRI), vrátane duloxetínu, boli
zaznamenané abnormality spojené s krvácaním, ako sú ekchymóza, purpura a gastrointestinálne
krvácanie. U pacientok užívajúcich antikoagulanciá a/alebo lieky, o ktorých je známe, že ovplyvňujú funkciu krvných doštičiek (napr.: nesteroidné protizápalové lieky (NSAID) alebo kyselina
acetylsalicylová (ASA)) a u pacientok náchylných na krvácanie sa odporúča postupovať opatrne.
Prerušenie liečby
Pri prerušení liečby je výskyt príznakov z vysadenia častý, hlavne ak je vysadenie náhle (pozri časť
4.8). V klinických štúdiách sa nežiaduce účinky pri náhlom vysadení liečby vyskytovali približne
u 44% pacientov liečených YENTREVE a u 24% pacientov užívajúcich placebo.
Riziko príznakov z vysadenia pozorovaných u SSRI a SRNI môže závisieť od niekoľkých faktorov, vrátane dĺžky liečby, dávky a rýchlosti znižovania dávky. Najčastejšie hlásené reakcie sú uvedené
v časti 4.8. Zvyčajne sú symptómy slabé alebo mierne, avšak u niektorých pacientov môžu mať závažnejší charakter. Obyčajne sa objavia v priebehu prvých dvoch dní vysadzovania liečby, ale
vzácne boli hlásené takéto príznaky u pacientov, ktorí nedopatrením vynechali dávku. Zvyčajne tieto príznaky vymiznú bez liečby, obyčajne v priebehu 2 týždňov, hoci u niektorých osôb to môže trvať dlhšie (2-3 mesiace alebo viac). Preto sa pri vysadzovaní liečby odporúča postupné znižovanie dávky
duloxetínu počas minimálne 2 týždňov, podľa potreby pacienta (pozri časť 4.2).
Hyponatriémia
Pri podávaní YENTREVE bola hlásená hyponatriémia, vrátane prípadov, kedy sérová koncentrácia sodíka bola nižšia ako 110 mmol/l. Hyponatriémia môže byť spôsobená syndrómom neadekvátnej
sekrécie antidiuretického hormónu (syndrome of inappropriate anti-diuretic hormone, SIADH). Najviac prípadov hyponatriémie bolo hlásených u starších pacientov, najmä ak boli spojené s nedávnou anamnézou alebo s predispozičnými podmienkami k poruche rovnováhy tekutín.
U pacientok so zvýšeným rizikom vzniku hyponatrémie ako sú staršie pacientky, pacientky s cirhózou
alebo dehydratované pacientky alebo pacientky liečené diuretikami je potrebná opatrnosť.
Depresia, suicidálne myšlienky a správanie
Hoci YENTREVE nie je indikovaný na liečbu depresie, jeho liečivo (duloxetín) existuje aj ako
antidepresívum. Depresiu sprevádza vyššie riziko suicidálnych myšlienok, sebapoškodzovania a samovraždy (udalosti spojené so samovraždou). Toto riziko pretrváva, až kým sa nedostaví signifikantná remisia. Keďže zlepšenie nemusí nastať v priebehu prvých niekoľkých alebo viacerých týždňov liečby, pacient má byť starostlivo sledovaný, až kým sa toto zlepšenie nedostaví. Je všeobecná klinická skúsenosť, že v skorých fázach zotavovania môže riziko samovraždy vzrásť. Pacienti s anamnézou udalostí spojených so samovraždou alebo tí, ktorí vykazovali významnú mieru suicidálnych myšlienok pred začatím liečby majú vyššie riziko výskytu suicidálnych myšlienok alebo suicidálneho správania a majú byť počas liečby starostlivo sledovaní. Metaanalýza placebom
kontrolovaných klinických štúdií s antidepresívami u psychiatrických ochorení ukázala zvýšené riziko suicidálneho správania u antidepresív v porovnaní s placebom u pacientov mladších ako 25 rokov.
Počas užívania duloxetínu alebo krátko po jeho vysadení boli zaznamenané prípady výskytu
suicidálnych myšlienok a suicidálneho správania (pozri časť 4.8). Lekári majú pacientov povzbudiť, aby kedykoľvek oznámili akékoľvek znepokojujúce myšlienky alebo pocity alebo príznaky depresie.
Ak sa pri liečbe YENTREVE objavia u pacienta príznaky nepokoja alebo depresie je potrebné
vyhľadať odbornú lekársku pomoc, keďže depresia je závažná porucha zdravotného stavu. Ak by sa
rozhodlo o zahájení farmakoterapie antidepresívami, odporúča sa postupné vysadenie YENTREVE (pozri časť 4.2).
Podávanie deťom a mladistvým mladším ako 18 rokov
YENTREVE sa nemá užívať na liečbu detí a mladistvých mladších ako 18 rokov. V klinických štúdiách bolo u detí a mladistvých liečených antidepresívami častejšie pozorované suicidálne správanie (suicidálne pokusy a suicidálne myšlienky) a hostilita (prevažne agresia, protichodné správanie a zlosť) v porovnaní s tými, ktorým bolo podávané placebo. Ak je aj napriek tomu rozhodnuté o liečbe na základe klinickej potreby, pacientka má byť starostlivo monitorovaná na prítomnosť suicidálnych symptómov. Navyše chýbajú údaje o bezpečnosti dlhodobého podávania u detí a adolescentov týkajúce sa rastu, dospievania a kognitívneho a behaviorálneho vývoja.
Lieky obsahujúce duloxetín
Duloxetín sa používa pod rôznymi obchodnými názvami vo viacerých indikáciách (liečba diabetickej
neuropatickej bolesti, depresívnej poruchy, generalizovanej úzkostnej poruchy a stresovej
inkontinencie moču). Je nutné vyvarovať sa používaniu viac ako jedného z týchto produktov súčasne.
Hepatitída/zvýšené hepatálne enzýmy
Pri podávaní duloxetínu boli hlásené prípady poškodenia pečene, vrátane závažných nárastov hladín hepatálnych enzýmov (>10 násobok hornej hranice normy), hepatitídy a žltačky (pozri časť 4.8).
Väčšina z nich sa objavila počas prvých mesiacov liečby. Charakter poškodenia pečene bol prevažne
hepatocelulárny. Duloxetín sa má užívať s opatrnosťou u pacientok liečených inými liekmi, ktoré sú spájané s poškodením pečene.
Akatízia/psychomotorický nepokoj
Užívanie duloxetínu je spájané so vznikom akatízie, ktorá sa prejavuje subjektívne nepríjemným alebo trýznivým nepokojom a potrebou pohybovať sa, často sprevádzané neschopnosťou pokojne sedieť
alebo stáť. Najväčšia pravdepodobnosť jej výskytu je v priebehu prvých týždňov liečby. Na pacientov, u ktorých sa vyskytnú tieto príznaky, by mohlo mať zvýšenie dávky negatívny dopad.
Sacharóza
YENTREVE tvrdé gastrorezistentné kapsuly obsahujú sacharózu. Pacienti so zriedkavo sa vyskytujúcimi dedičnými ťažkosťami typu intolerancie fruktózy, poruchami vstrebávania glukózy- galaktózy alebo nedostatku sacharázy-izomaltázy tento liek nemajú užívať.
4.5 Liekové a iné interakcie
I
nhibítory monoaminooxidázy (IMAO): z dôvodu rizika vzniku sérotonínového syndrómu duloxetín sa
nemá používať v kombinácii s neselektívnymi ireverzibilnými IMAO alebo minimálne 14 dní
od ukončenia liečby IMAO. Vychádzajúc z polčasu duloxetínu, liečbu s IMAO je možné začať najskôr 5 dní po vysadení YENTREVE (pozri časť 4.3).
Súčasné užívanie YENTREVE so selektívnymi reverzibilnými IMAO, ako je moklobemid, sa neodporúča (pozri časť 4.4). Antibiotikum linezolid je reverzibilným neselektívnym IMAO a nemá sa podávať pacientom užívajúcim YENTREVE (pozri časť 4.4).
Inhibítory CYP1A2: keďže CYP1A2 sa zúčastňuje na metabolizme duloxetínu, súčasné užívanie duloxetínu spolu so silnými inhibítormi CYP1A2 pravdepodobne vedie k zvýšenej koncentrácii duloxetínu. Fluvoxamín (100 mg raz denne) ako silný inhibítor CYP1A2, znížil zdanlivý plazmatický klírens duloxetínu o približne 77 %, pričom 6-násobne vzrástla AUCo-t . YENTREVE sa preto nemá podávať v kombinácii so silnými inhibítormi CYP1A2 typu fluvoxamínu (pozri časť 4.3).
Lieky s vplyvom na CNS: pri užívaní YENTREVE v kombinácii s inými centrálne pôsobiacimi liekmi
a látkami, vrátane alkoholu a liekov so sedatívnym účinkom (napr. benzodiazepíny, morfínomimetiká,
antipsychotiká, fenobarbital, sedatívne antihistaminiká) sa odporúča postupovať s opatrnosťou.
Sérotonínové látky: sérotonínový syndróm bol zriedkavo hlásený u pacientok, ktoré užívali selektívne inhibítory spätného vychytávania sérotonínu (SSRI/SNRI) spolu s látkami, ktoré majú sérotonergické účinky. Opatrnosť sa odporúča v prípade, ak sa YENTREVE užíva súčasne so sérotonergickými látkami, akými sú SSRI, SNRI a tricyklické antidepresíva ako je klomipramín alebo amitriptylín, IMAO, akými sú moklobemid alebo linezolid, s ľubovníkom bodkovaným (Hypericum perforatum) či triptánmi, tramadolom, petidínom a tryptofánom (pozri časť 4.4).
Vplyv duloxetínu na iné lieky
Lieky metabolizované CYP1A2: súčasné podávanie duloxetínu (60 mg dvakrát denne) nemalo významný vplyv na farmakokinetiku teofylínu, ktorý je substrátom CYP1A2.
Lieky metabolizované CYP2D6: duloxetín je mierny inhibítor CYP2D6. Keď sa duloxetín v dávke
60 mg dvakrát denne podal súčasne s jednorazovou dávkou dezipramínu (substrát CYP2D6), AUC
dezipramínu sa trojnásobne zvýšila. Súčasné podávanie duloxetínu (40 mg dvakrát denne) zvyšuje AUC tolterodínu (2 mg dvakrát denne) v rovnovážnom stave o 71%, nijako však neovplyvňuje farmakokinetiku jeho aktívneho 5-hydroxymetabolitu; úprava dávkovania sa nedporúča. Opatrnosť sa odporúča, ak sa duloxetín podáva spolu s liekmi, ktoré sú metabolizované prevažne izoenzýmom CYP2D6 (risperidón, tricyklické antidepresíva [TCAs] ako sú nortriptylín, amitriptylín a imipramín), najmä ak majú tieto úzky terapeutický index (ako je flekainid, propafenón a metoprolol).
Perorálne kontraceptíva a iné steroidné látky: výsledky in vitro štúdií preukázali, že duloxetín neindukuje katalytickú aktivitu izoenzýmu CYP3A. Špecifické in vivo liekové interakčné štúdie sa nevykonali.
Antikoagulanciá a antiagreganciá: Opatrnosť je potrebná, keď sa duloxetín kombinuje s perorálnymi antikoagulanciami alebo antiagreganciami kvôli možnému zvýšeniu rizika krvácania, ktoré sa pripisuje farmakodynamickej interakcii. Okrem toho sa zaznamenali zvýšené hodnoty INR'
u pacientov liečených warfarínom, ktorým sa súčasne podával duloxetín. Avšak súčasné podávanie
duloxetínu s warfarínom zdravým dobrovoľníkom v ustálenom stave v rámci farmakologického klinického skúšania nemalo za následok klinicky významné zmeny INR oproti počiatočným hodnotám ani zmeny farmakokinetiky R- alebo S- warfarínu.
V
plyv iných liekov na duloxetín
A
ntacidá a antagonisti H2 receptorov: súčasné podávanie YENTREVE a antacíd obsahujúcich hliník a horčík či famotidínu nijako významne neovplyvnilo rýchlosť alebo rozsah absorpcie duloxetínu po podaní dávky 40 mg perorálne.
Induktory CYP1A2: Analýzy populačných farmakokinetických štúdií preukázali, že fajčiari mali
takmer o 50% nižšie plazmatické koncentrácie duloxetínu ako nefajčiari.
4.6 Fertilita, gravidita a laktácia
Fertilita
Duloxetín nemal vplyv na mužskú fertilitu a u žien bol vplyv evidentný iba pri dávkach spôsobujúcich materskú toxicitu.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití duloxetínu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu pri hladinách systémovej expozície duloxetínu (AUC) nižších ako je maximálna klinická expozícia (pozri časť 5.3).
Nie je známe potenciálne riziko u ľudí.
Epidemiologické údaje naznačujú, že používanie SSRI počas tehotenstva, zvlášť v pokročilom štádiu tehotenstva, môže zvýšiť riziko perzistentnej pľúcnej hypertenzie u novorodencov (PPHN). Hoci žiadna štúdia nesledovala súvislosť medzi PPHN a liečbou SNRI, toto potenciálne riziko sa nedá vylúčiť pri duloxetíne, berúc do úvahy podobný mechanizmus účinku (inhibícia spätného vychytávania sérotonínu).
Podobne ako u iných sérotonergických liekoch sa u novorodenca môžu objaviť symptómy z prerušenia liečby, keď matka užívala duloxetín krátko pred pôrodom. Symptómy z vysadenia pozorované pri duloxetíne môžu zahŕňať hypotóniu, tras, nepokoj, problémy s príjmom potravy, ťažkosti s dýchaním
a kŕče. Väčšina prípadov sa vyskytla buď pri pôrode alebo niekoľko dní po pôrode.
YENTREVE sa má užívať počas gravidity len ak potenciálny prínos prevýši potenciálne riziko pre plod. Ženy treba poučiť, aby oznámili svojmu lekárovi, ak otehotnejú alebo plánujú otehotnieť počas liečby.
Laktácia
Duloxetín je veľmi málo vylučovaný do materského mlieka vychádzajúc zo štúdie so 6 dojčiacimi ženami, ktoré nedojčili svoje deti. Odhadovaná denná dávka u dojčaťa v mg/kg je približne 0,14%
dávky podanej matke (pozri časť 5.2). Keďže nie je známa bezpečnosť podávania duloxetínu u dojčiat,
YENTREVE je kontraindikovaný počas dojčenia (pozri časť 4.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. YENTREVE môže súvisieť s útlmom a závratom. Pacienti sa majú poučiť, že v prípade, ak sa u nich objaví útlm alebo závrat, majú sa vyvarovať potenciálne nebezpečných úloh, akými sú vedenie vozidiel alebo obsluha strojov.
4.8 Nežiaduce účinky
a. Zhrnutie bezpečnostného profilu
Najčastejšie hlásenými nežiaducimi udalosťami u pacientok liečených YENTREVE v klinických
štúdiách SUI a ostatných porúch funkcie dolných močových ciest boli nauzea, sucho v ústach a únava. Analýza údajov zo štyroch 12-týždňových, placebom kontrolovaných klinických štúdií s pacientkami trpiacimi SUI, zahŕňajúcich 958 pacientok liečených duloxetínom a 955 pacientok liečených placebom ukázala, že nástup uvádzaných nežiaducich udalostí sa zvyčajne objavoval počas prvého týždňa
liečby. Väčšina z najčastejšie sa vyskytujúcich nežiaducich udalostí však bola mierna či stredne
závažná a do 30 dní odznela (napr. nevoľnosť).
b. Tabuľkové zhrnutie nežiaducich reakcií
Tabuľka 1 uvádza výskyt nežiaducich reakcií zaznamenaný zo spontánnych hlásení a v placebom kontrolovaných klinických štúdiách
Tabuľka 1: Nežiaduce reakcie
Frekvencia výskytu: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až < 1/1 000), veľmi zriedkavé (<1/10 000).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej
závažnosti.
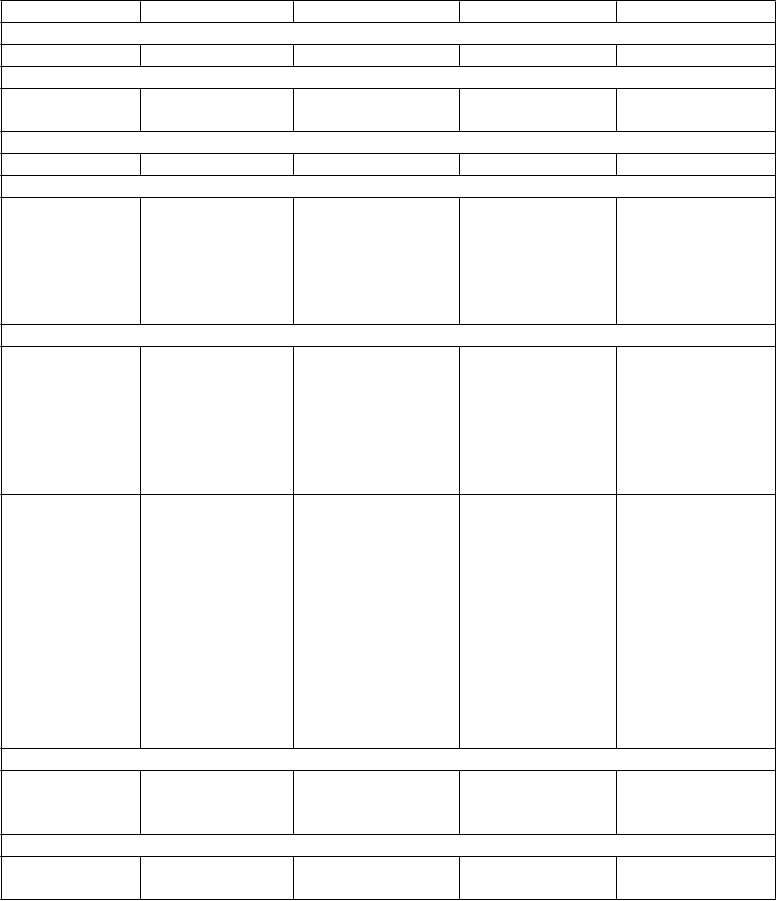
Veľmi časté Časté Menej časté Zriedkavé Veľmi zriedkavé
Infekcie a nákazy
P
oruchy imunitného systému
P
oruchy endokrinného systému
Laryngitída
Hypersenzitivita Anafylaktická reakcia
P
oruchy metabolizmu a výživy Pokles chuti do jedla
Psychické poruchy
Hypotyreóza
Dehydratácia Hyperglykémia (hlásená hlavne u pacientov s diabetom) Hyponatriémia SIADH6
P
oruchy oka
Nespavosť Agitácia Pokles libida Úzkosť
Porucha spánku
Bolesť hlavy Závrat Letargia Spavosť
Tras
Parestézia
Škrípanie zubami Dezorientácia Apatia Abnormálny orgazmus Abnormálne sny
Nervozita
Porucha pozornosti
Porucha chuti Znížená kvalita spánku
Samovražedné správanie5, 6
Samovražedné myšlienky5, 7
Mánia6
Halucinácie
Agresia a hnev4, 6
Sérotonínový syndróm6
Kŕče1
Myoklónia
Akatízia6
Psychomotorický nepokoj6
Extrapyramídové symptómy6
Dyskinéza Syndróm nepokojných nôh
Nejasné videnie Mydriáza Zhoršenie zraku Suché oči
Glaukóm
 P
oruchy ucha a labyrintu
P
oruchy ucha a labyrintu
Vertigo Tinitus1
Bolesť ucha
V
eľmi časté Časté Menej časté Zriedkavé Veľmi zriedkavé
P
oruchy srdca a srdcovej činnosti
P
oruchy ciev
Hypertenzia3, 7
Sčervenanie
Palpitácie
Tachykardia
Synkopa2
Zvýšený krvný tlak3
Supraventriku- lárna arytmia, hlavne atriálna fibrilácia6
Hypertenzná kríza3
Ortostatická hypotenzia2
Chlad periférnej
časti končatín
P
oruchy dýchacej sústavy, hrudníka a mediastína
Zívanie Zvieranie hrdla
Epistaxa
Poruchy gastrointestinálneho traktu
Nauzea
Sucho v ústach
Zápcha
Hnačka
Bolesť brucha
Vracanie
Dyspepsia
Gastrointestinálne krvácanie7
Gastroenteritída
Grganie
Stomatitída Gastritída Dysfágia Plynatosť Zápach dychu
Hematochézia Mikroskopická kolitída9
P
oruchy pečene a žlčových ciest
P
oruchy kože a podkožného tkaniva
Hepatitída3
Zvýšené hladiny pečeňových enzýmov (ALT, AST, alkalická fosfatáza)
Akútne poškodenie
pečene
Zlyhanie pečene6
Žltačka6
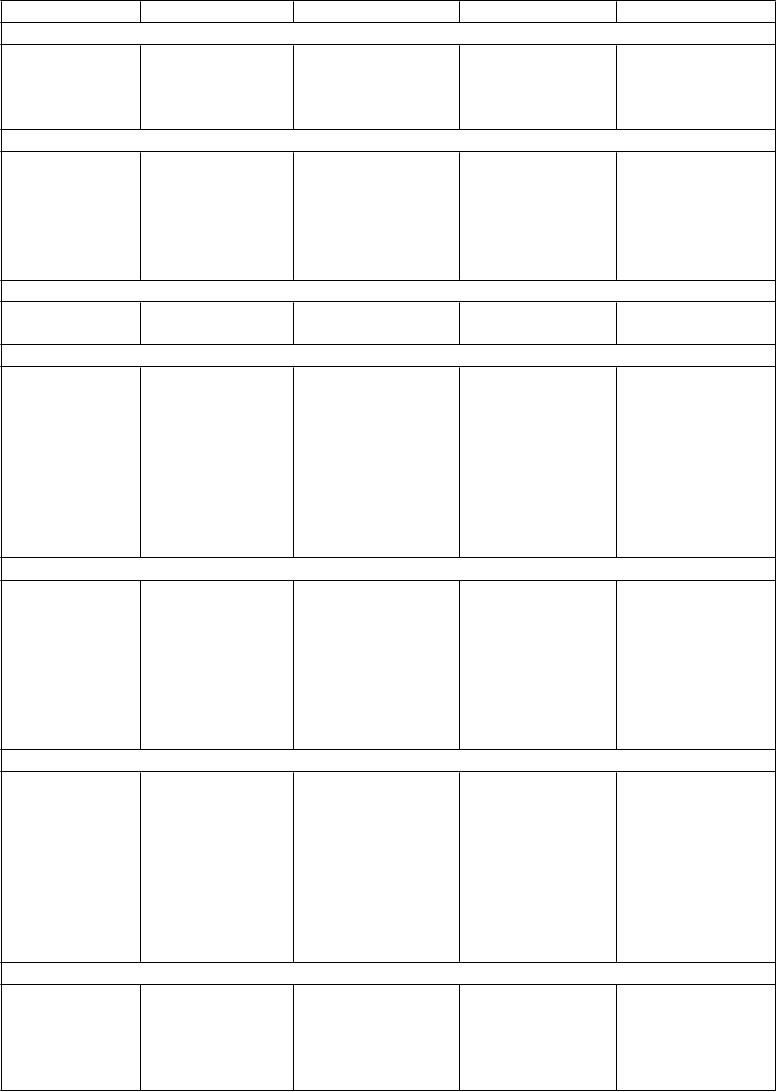
Zvýšené potenie Vyrážka Nočné potenie Urtikária Kontaktná dermatitída Studený pot
Zvýšený sklon k tvorbe modrín
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Bolesť svalov a kostí
Napätie svalov Svalový kŕč Trizmus
Stevensov- Johnsonov syndróm6
Angioneurotický edém6
Fotosenzitívne
reakcie
Zášklby svalov
Kožná vaskulitída
V
eľmi časté Časté Menej časté Zriedkavé Veľmi zriedkavé
P
oruchy obličiek a močových ciest
Močenie s oneskoreným štartom Dyzúria Noktúria Polakizúria Abnormálny zápach moču
Poruchy reprodukčného systému a prsníkov Gynekologické krvácanie Menopauzálne symptómy
Zadržiavanie
moču6
Polyúria
Slabý prúd moču
Galaktorea Hyperpro- laktinémia
C
elkové poruchy a reakcie v mieste podania
Únava Asténia
Zimnica
Bolesť v hrudi7
Pády8
Neobvyklé pocity
Pocit chladu Smäd Malátnosť Pocit tepla
Porucha chôdze
Laboratórne a funkčné vyšetrenia
Pokles hmotnosti Nárast hmotnosti Zvýšená hladina cholesterolu v krvi Zvýšená hladina kreatinínfosfokinázy v krvi
Zvýšená hladina draslíka v krvi

1 Boli hlásené tiež prípady kŕčov a tinitu po skončení liečby.
2 Hlavne na začiatku liečby boli hlásené prípady ortostatickej hypotenzie a synkopy.
3 Pozri časť 4.4
4 Boli hlásené prípady agresie a hnevu hlavne na začiatku liečby alebo po skončení liečby.
5 Boli hlásené prípady samovražedných myšlienok a samovražedného správania počas liečby
duloxetínom alebo v krátkom čase po skončení liečby (pozri časť 4.4).
6 Odhadovaná frekvencia na základe post-marketingového sledovania nežiaducich reakcií:
nepozorované v placebom kontrolovaných klinických skúšaniach.
7 Nie je štatisticky významný rozdiel oproti placebu.
8 Pády boli častejšie u starších pacientov (>65 rokov) .
9 Odhadovaná frekvencia na základe údajov zo všetkých klinických skúšaní.
c. Opis vybraných nežiaducich reakciíVysadenie duloxetínu (hlavne náhle) vedie často k vzniku príznakov z vysadenia. Najčastejšie sú
hlásené tieto príznaky: závrat, senzorické poruchy (vrátane parestézie alebo vnemov ako pri elektrickom šoku, namä v hlave), poruchy spánku (vrátane insomnie a intenzívnych snov), únava, ospalosť, agitovanosť alebo úzkosť, nauzea a/alebo vracanie, tras, bolesť hlavy, myalgia, podráždenosť, hnačka a zvýšené potenie.
Zvyčajne sú tieto reakcie, v prípade SSRI a SNRI, slabé až mierne a samé odznejú, avšak u niektorých pacientov môžu byť vážne a/alebo dlhšieho trvania. Preto sa odporúča, ak nie je liečba duloxetínom
ďalej potrebná, postupné vysadenie liečby znižovaním dávky (pozri časti 4.2 a 4.4).
Srdcovou frekvenciou korigovaný QT interval u pacientok liečených duloxetínom sa nijako neodlišoval od hodnôt zistených u pacientok liečených placebom. Nezaznamenali sa žiadne klinicky významné rozdiely medzi hodnotami QT, PR, QRS alebo QTcB u pacientok liečených duloxetínom alebo placebom.
V 12-týždňovej akútnej fáze troch klinických štúdií s duloxetínom u pacientov trpiacich diabetickou neuropatickou bolesťou došlo u pacientov liečených duloxetínom k miernemu, avšak štatisticky významnému zvýšeniu hladiny glukózy v krvi nalačno. Hodnoty HbA1c boli stabilné aj u pacientov liečených duloxetínom aj u pacientov s placebom. V následnej fáze týchto štúdií, ktorá trvala až 52 týždňov, sa objavilo v oboch skupinách pacientov zvýšenie hodnoty HbA1c, pričom priemerné zvýšenie bolo o 0,3% vyššie v skupine pacientov liečených duloxetínom. Zaznamenalo sa tiež mierne zvýšenie glukózy v krvi nalačno a celkového cholesterolu u pacientov liečených duloxetínom, pričom tieto laboratórne testy v kontrolnej skupine ukázali mierny pokles.
Hlásenie podozrení na nežiaduce reakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V*.
4.9 PredávkovanieZaznamenali sa prípady predávkovania duloxetínom samotným alebo v kombinácii s inými liekmi, v dávke 5 400 mg. Vyskytlo sa i niekoľko prípadov úmrtia, najmä pri predávkovaní kombináciou liekov, ale aj pri predávkovaní samotným duloxetínom v dávke približne 1000 mg. Príznaky
a symptómy predávkovania (samotným duloxetínom alebo v kombinácii s inými liekmi) zahŕňajú
somnolenciu, kómu, sérotonínový syndróm, záchvaty, vracanie a tachykardiu.
Nie je známe žiadne špecifické antidotum duloxetínu, ale ak sa vyskytne sérotonínový syndróm, má sa zvážiť špecifická liečba (ako je cyproheptadín a/alebo kontrola teploty). Má sa zabezpečiť priechodnosť dýchacích ciest. Zároveň sa odporúča monitorovať funkciu srdca a vitálne funkcie, spolu s náležitými symptomatickými a podpornými opatreniami. Výplach žalúdka sa môže indikovať, ak je prevedený ihneď po požití alebo u symptomatických pacientok. Aktívne uhlie môže byť prospešné
na obmedzenie absorpcie. Duloxetín má rozsiahly distribučný objem a je nepravdepodobné, že by forsírovaná diuréza, hemoperfúzia či plazmaferéza mohli byť prospešné.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné antidepresíva. ATC kód: N06AX21
Mechanizmus účinkuDuloxetín je kombinovaný inhibítor spätného vychytávania sérotonínu (5-HT) a noradrenalínu (NA). V malej miere inhibuje spätné vychytávanie dopamínu bez významnej afinity k histamínovým, dopaminergným, cholinergným a adrenergným receptorom.
Farmakodynamické účinkyZvýšené hladiny 5-HT a NE v krížovej mieche viedli v štúdiách na zvieratách k zvýšenému svalovému
tonusu močovej rúry prostredníctvom zvýšenej stimulácie priečne pruhovaného svalu zvierača močovej rúry pudendálnym nervom, výhradne počas fázy zadržiavania moču. Podobný mechanizmus
vedie u žien k silnejšiemu uzatvoreniu močovej rúry počas fázy zadržiavania moču fyzickým tlakom,
čím možno vysvetliť účinnosť duloxetínu v liečbe žien trpiacich SUI.
K
li
n
i
cká účinnosť a bezpečnosť
Účinnosť duloxetínu v dávke 40 mg dvakrát denne v liečbe SUI bola stanovená v štyroch dvojito
zaslepených, placebom kontrolovaných štúdiách, v rámci ktorých bolo z 1 913 žien (vo veku 22 až
83 rokov) so SUI 958 náhodne zaradených do programu liečby duloxetínom a 955 do programu liečby placebom. Primárnymi ukazovateľmi účinnosti boli Frekvencia výskytu epizód inkontinencie (Incontinence Episode Frequency (IEF)) stanovená na základe denníkových záznamov a skóre špecifického dotazníka pre zisťovanie kvality života u pacientok trpiacich inkontinenciou (Incontinence Specific Quality of Life Questionnaire (I-QOL)).
Frekvencia výskytu epizód inkontinencie (Incontinence Episode Frequency – IEF): vo všetkých štyroch štúdiách skupina liečená duloxetínom zaznamenala 50% alebo viac mediánový pokles IEF v porovnaní s 33% v placebom kontrolovanej skupine. Rozdiely sa pozorovali pri každej návšteve
po 4 týždňoch (duloxetín 54% a placebo 22%), po 8 týždňoch (52% a 29%) a po 12 týždňoch (52%
a 33%) liečby.
V doplnkovej štúdii zameranej výlučne na pacientky so závažnou SUI, bola kompletná odpoveď
na liečbu duloxetínom dosiahnutá do 2 týždňov.
Účinnosť YENTREVE nebola hodnotená dlhšie ako 3 mesiace v placebom kontrolovaných štúdiách. Klinický prínos YENTREVE v porovnaní s placebom sa nepreukázal u žien s miernou SUI, ktoré boli v randomizovaných štúdiách definované ako tie s IEF < 14 za týždeň. U týchto žien nevykazuje YENTREVE vyššiu účinnosť v porovnaní s konzervatívnejšími behaviorálnymi zákrokmi.
Kvalita života: Skóre dotazníka kvality života pri inkontinencii (I-QOL - Incontinence Quality of Life) sa významne zlepšilo v skupine pacientok liečených duloxetínom v porovnaní so skupinou liečenou placebom (9,2 oproti 5,9 v zlepšení skóre, p<0,001). Podľa globálnej stupnice zlepšenia (Patient
Global Improvement - PGI) považovalo svoje symptómy stresovej inkontinencie moču za zlepšené významne viac žien liečených duloxetínom v porovnaní s tými ženami, ktoré dostávali placebo (64,6%
oproti 50,1%, p<0,001).
YENTREVE a absolvovaná operačná liečba na zabezpečenie kontinencie moču: na základe obmedzených údajov možno predpokladať, že prínos YENTREVE nie je menší u pacientok, ktoré predtým podstúpili operáciu na zabezpečenie kontinencie.
YENTREVE a tréning svalstva panvového dna (Pelvic Floor Muscle Training (PFMT)): počas 12- týždňovej, zaslepenej, randomizovanej, kontrolovanej štúdie preukázal YENTREVE väčšie poklesy ukazovateľa IEF a to tak v porovnaní s liečbou placebom ako aj so samotným PFMT. Kombinovaná terapia (duloxetín + PFMT) preukázala výraznejšie zlepšenie oboch ukazovateľov – množstva použitých hygienických vložiek i pre toto ochorenie špecifických ukazovateľov kvality života – ako liečba samotným YENTREVE či samotný tréning svalstva panvového dna (PFMT).
Deti a dospievajúci
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií pre YENTTREVE s ohľadom na všetky vekové podskupiny detí a dospievajúcich v liečbe stresovej inkontinencie moču. Pozri časť 4.2 pre informáciu o pediatrickom použití.
5.2 Farmakokinetické vlastnosti
Duloxetín sa podáva ako samostatný enantiomér. Duloxetín je extenzívne metabolizovaný prostredníctvom oxidatívnych enzýmov (CYP1A2 a polymorfný CYP2D6) a následne konjugáciou. Farmakokinetika duloxetínu preukazuje veľkú interindividuálnu variabilitu (všeobecne 50-60%),
na ktorej sa čiastočne podieľa pohlavie, vek, fajčenie a úroveň metabolizmu CYP2D6.
Absorpcia: Duloxetín sa po perorálnom podaní dobre vstrebáva, pričom k maximálnej koncentrácii
(Cmax) dochádza 6 hodín po podaní dávky. Absolútna perorálna biologická dostupnosť duloxetínu je
32% až 80% (priemer 50%; N=8 osôb). Potrava predlžuje čas potrebný na dosiahnutie najvyššej
koncentrácie zo 6 na 10 hodín a okrajovo zmenšuje rozsah absorpcie (priemerne o 11%).
D
i
stribúcia: Duloxetín sa približne z 96% viaže na ľudské plazmatické proteíny. Duloxetín sa viaže tak na albumín ako i na α1-kyslý-glykoproteín. Poškodenie funkcie obličiek či pečene neovplyvňuje väzbu na proteíny.
Biotransformácia: Duloxetín sa extenzívne metabolizuje a jeho metabolity sa vylučujú predovšetkým močom. Tak CYP2D6 ako aj CYP1A2 katalyzujú tvorbu dvoch hlavných metabolitov: glukuronidového konjugátu 4-hydroxyduloxetínu a sulfátového konjugátu 5-hydroxy 6- metoxyduloxetínu. Na základe in vitro štúdií možno považovať cirkulujúce metabolity duloxetínu za farmakologicky neaktívne. Farmakokinetika duloxetínu u pacientok, ktoré sú slabými metabolizátormi CYP2D6, nebola špecificky sledovaná. Na základe obmedzených údajov možno predpokladať, že plazmatické hladiny duloxetínu sú u týchto pacientok vyššie.
Eliminácia: Eliminačný polčas duloxetínu po perorálnom podaní sa pohybuje v rozsahu od 8do 17 hodín (priemerne 12 hodín). Plazmatický klírens duloxetínu sa po intravenóznom podaní pohybuje v rozpätí 22 l/h až 46 l/h (priemerne 36 l/h). Zjavný plazmatický klírens duloxetínu po perorálnom podaní sa pohybuje od 33 to 261 l/h (priemerne 101 l/h).
Špeciálne skupiny pacientov:
Vek: farmakokinetické rozdiely boli zisťované medzi mladšími a staršími ženami (≥65 rokov)
(u starších pacientok bola zvýšená hodnota AUC približne o 25% a polčas predĺžený približne o 25%), ich veľkosť však nie je taká, aby bolo nutné upravovať dávku.
Porucha funkcie obličiek: pacientky s koncovým štádiom ochorenia obličiek (End Stage Renal Disease (ESRD)) podrobujúce sa dialýze mali oproti zdravým osobám dvakrát vyššie hodnoty Cmax a AUC duloxetínu. Dostupné farmakokinetické údaje o duloxetíne u pacientok s miernym až stredne
závažným poškodením funkcie obličiek sú len obmedzené.
Nedostatočnosť pečene: stredne závažná porucha pečene (Child Pugh trieda B) ovplyvňovala farmakokinetiku duloxetínu. V porovnaní so zdravými osobami, u pacientok so stredne závažnou poruchou pečene bol zistený zjavný plazmatický klírens duloxetínu o 79% nižší, terminálny polčas
2,3 krát dlhší a AUC 3,7 krát väčšie. U pacientok s miernou až stredne závažnou nedostatočnosťou pečene nebola sledovaná farmakokinetika duloxetínu a jeho metabolitov.
Dojčiace matky: Dispozícia duloxetínu bola skúmaná u 6 dojčiacich žien, ktoré boli minimálne 12
týždňov po pôrode. Duloxetín je detekovateľný v materskom mlieku a rovnovážne koncentrácie v materskom mlieku tvoria asi jednu štvrtinu plazmatickej koncentrácie. Množstvo duloxetínu
v materskom mlieku je približne 7/deň µg pri dávkovaní 40 mg 2x denne. Laktácia neovplyvňovala
farmakokinetiku duloxetínu.
5.3 Predklinické údaje o bezpečnosti
Duloxetín nebol genotoxický v rámci štandardnej série testov a u potkanov nebol ani karcinogénny. V štúdii na karcinogenicitu boli v pečeni potkanov pozorované multijadrové bunky bez prítomnosti iných histopatologických zmien. Mechanizmus a klinický význam tohto javu nie je známy.
U samíc myší, ktoré užívali duloxetín počas dvoch rokov, bol pozorovaný zvýšený výskyt hepatocelulárnych adenómov a karcinómov iba pri vysokých dávkach (144 mg/kg/deň), tieto však boli považované za sekundárne následky indukcie mikrozomálnych hepatálnych enzýmov. Nie je známe,
či sú tieto údaje získané pozorovaním myší, relevantné pre ľudí. U samíc potkanov, ktorým bol podávaný duloxetín pred a počas párenia a skorého štádia gravidity, bol zaznamenaný pokles príjmu
materskej potravy a telesnej hmotnosti, poruchy estrálneho cyklu, pokles indexu živonarodeného
a žijúceho potomstva a retardáciu rastu potomstva pri hladinách systémovej expozície odhadovaných
väčšinou ako maximálna klinická expozícia (AUC). V štúdii na embryotoxicitu u králikov bola pri nižších hladinách systémovej expozície ako je maximálna klinická expozícia (AUC) zaznamenaná vyššia frekvencia výskytu kostrových a kardiovaskulárnych malformácií. Žiadne malformácie neboli zaznamenané v inej štúdii testujúcej vyššiu dávku odlišnej soli duloxetínu. V štúdii pre/postnatálnej
toxicity u potkanov indukoval duloxetín nežiaduce účinky na správanie potomstva pri nižších
hladinách systémovej expozície ako je maximálna klinická expozícia (AUC).
Štúdie s mláďatami potkanov ukázali prechodné účinky v neurobehaviorálnej oblasti, taktiež signifikantné zníženie telesnej hmotnosti a príjmu potravy, indukciu hepatálnych enzýmov
a hepatocelulárnu vakuolizáciu pri dávkach 45mg/kg/deň. Všeobecný profil toxicity duloxetínu u mláďat potkanov bol podobný s tým u dospelých potkanov. Výška dávky, ktorá nevyvoláva nežiaduce účinky, bola stanovená na 20 mg/kg/deň.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly:
Hypromelóza
Acetosukcinát hypromelózy
Sacharóza
Zrnený cukor
Mastenec
Oxid titaničitý (E171)
Trietylcitrát
Obal kapsuly: Želatína Nátriumlaurylsulfát Oxid titaničitý (E171) Indigokarmín (E132)
Potravinársky čierny atrament
Potravinársky atrament:
Syntetický čierny oxid železitý (E172)
Propylénglykol
Šelak
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou. Uchovávajte pri teplote neprevyšujúcej
30°C.
6.5 Druh obalu a obsah balenia
Blistre vyrobené z polyvinylchloridu (PVC), polyetylénu (PE) a polychlorotrifluoroetylénu (PCTFE),
zapečatené hliníkovou fóliou.
Balenia po 28, 56 a 98 kapsúl.
Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIEli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Holandsko.
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/04/280/001
EU/1/04/280/007
EU/1/04/280/008
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 11. augusta 2004
Dátum posledného predĺženia registrácie: 24. júna 2009
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránka Európskej liekovej agentúry
(EMA)
http://www.ema.europa.eu/