
vke lieku Xultophy. Pacienti, u ktorých nastalo významné zlepšenie kontroly hladiny glukózy v krvi (napr. po intenzifikovanej liečbe), môžu pocítiť zmenu obvyklých varovných príznakov hypoglykémie a majú byť o nich primerane poučení. Obvyklé varovné príznaky (pozri časť 4.8) môžu u pacientov dlhodobo chorých na diabetes vymiznúť. Predĺžený účinok lieku Xultophy môže oddialiť zotavenie sa z hypoglykémie.
Hyperglykémia
Neprimerané dávkovanie a/alebo ukončenie antidiabetickej liečby môžu viesť k hyperglykémii a
potenciálne k hyperosmolárnej kóme. V prípade ukončenia liečby Xultophy sa uistite, že bude nasledovať iniciácia alternatívnej anti-diabetickej liečby. Sprievodné ochorenia, najmä infekcie, môžu
tiež viesť k hyperglykémii a vyvolať zvýšenú potrebu antidiabetickej liečby. Zvyčajne sa prvé
príznaky hyperglykémie objavujú postupne počas niekoľkých hodín alebo dní. Patrí k nim smäd,
častejšie močenie, nauzea, vracanie, ospalosť, začervenaná suchá koža, sucho v ústach, nechutenstvo a acetónový dych.
V prípadoch závažnej hyperglykémie sa má zvážiť podanie rýchlo pôsobiaceho inzulínu. Neliečené
prípady hyperglykémie v konečnom dôsledku vedú ku vzniku hyperosmolárnej kómy/diabetickej
ketoacidózy, ktorá je potenciálne smrteľná.
Kombinácia pioglitazónu a inzulínových liekov
Boli zaznamenané prípady zlyhávania srdca, keď sa užíval pioglitazón v kombinácii s inzulínovými
liekmi, zvlášť u pacientov s rizikovými faktormi pre rozvoj kardiálneho zlyhávania. Na toto sa má pamätať, ak sa uvažuje o liečbe s kombináciou pioglitazónu a lieku Xultophy. Ak sa používa táto kombinácia, majú sa u pacientov sledovať príznaky a symptómy zlyhávania srdca, zvýšenie telesnej hmotnosti a edémy. Užívanie pioglitazónu má byť ukončené, ak sa objaví akékoľvek zhoršenie kardiálnych symptómov.
Ochorenia oka
Intenzifikácia liečby inzulínom, ktorý je zložkou lieku Xultophy, a náhle zlepšenie glykemickej
kontroly môžu byť spojené s dočasným zhoršením diabetickej retinopatie, zatiaľ čo dlhodobé
zlepšenie glykemickej kontroly znižuje riziko progresie diabetickej retinopatie.
Tvorba protilátok
Podávanie lieku Xultophy môže viesť k tvorbe protilátok proti inzulínu degludeku a/alebo liraglutidu.
V zriedkavých prípadoch prítomnosť takýchto protilátok môže vyžadovať úpravu dávky lieku
Xultophy, aby sa korigovala tendencia k hyperglykémii alebo hypoglykémii. U veľmi malého počtu pacientov sa po liečbe liekom Xultophy vyvinuli špecifické protilátky proti inzulínu degludeku, protilátky so skríženou reakciou na ľudský inzulín alebo protilátky proti liraglutidu. Tvorba protilátok nebola spojená so zníženou účinnosťou lieku Xultophy.
Akútna pankreatitída
Použitie antagonistov receptora GLP-1, vrátane liraglutidu, zložky Xultophy, bolo spojené s rizikom
rozvoja akútnej pankreatitídy. Bolo hlásených niekoľko prípadov akútnej pankreatitídy. Pacienti majú
byť informovaní o typických príznakoch akútnej pankreatitídy. V prípade podozrenia na pankreatitídu
sa má prerušiť podávanie lieku Xultophy. Ak sa potvrdí akútna pankreatitída, podávanie lieku
Xultophy sa nemá obnoviť. Opatrne sa má postupovať u pacientov s anamnézou pankreatitídy.
Nežiaduce účinky súvisiace so štítnoužľazou
Nežiaduce účinky súvisiace so štítnou žľazou, vrátane zvýšenia kalcitonínu v krvi, strumy a novotvaru
štítnej žľazy, boli hlásené v klinických štúdiách s antagonistami receptora GLP-1 vrátane liraglutidu,
ktorý je súčasťou lieku Xultophy, najmä u pacientov s predchádzajúcim ochorením štítnej žľazy, a preto treba byť opatrný pri používaní lieku Xultophy.
Zápalové ochorenie čriev a diabetická gastroparéza
Nie sú žiadne skúsenosti s použitím lieku Xultophy u pacientov so zápalovým ochorením čriev a
diabetickou gastroparézou. Xultophy sa preto neodporúča u týchto pacientov.
Dehydratácia
Prejavy a príznaky dehydratácie, vrátane poškodenia funkcie a akútneho zlyhania obličiek, boli
zaznamenané v klinických štúdiách s antagonistami receptora GLP-1 vrátane liraglutidu, ktorý je zložkou lieku Xultophy. Pacienti liečení liekom Xultophy majú byť poučení o potenciálnom riziku
dehydratácie v súvislosti s gastrointestinálnymi vedľajšími účinkami a majú urobiť preventívne
opatrenia, aby zabránili strate tekutín.
Zamedzenie chybám pri liečbe
Pacienti musia byť poučení, aby pred každým podávaním injekcie vždy skontrolovali štítok na pere,
aby nedošlo k neúmyselnej zámene medzi liekom Xultophy a inými injekčne podávanými liekmi na
diabetes.
Populácie, ktoré neboli predmetom štúdie
Prechod na Xultophy z dávok bazálneho inzulínu > 40 jednotiek nebol predmetom štúdie.
Prechod z agonistov receptora GLP-1 nebol predmetom štúdie.
Štúdie neskúmali Xultophy v kombinácii s inhibítormi dipeptidyl peptidázy 4 (DPP-4), glinidmi ani prandiálnym inzulínom.
Skúsenosti s použitím u pacientov s kongestívnym zlyhávaním srdca triedy I-II podľa klasifikácie New York Heart Association (NYHA) sú obmedzené a preto treba byť opatrný pri použití lieku Xultophy. Nie sú žiadne skúsenosti s použitím u pacientov s kongestívnym zlyhávaním srdca triedy III-IV podľa klasifikácie NYHA a preto sa Xultophy u týchto pacientov neodporúča.
Pomocné látky
Xultophy obsahuje menej ako 1 mmol sodíka (23 mg) na dávku, preto tento liek v podstate
„neobsahuje sodík“.
4.5 Liekové a iné interakcie
Farmakodynamické interakcie
Neuskutočnili sa žiadne interakčné štúdie s liekom Xultophy.
Viaceré látky majú vplyv na metabolizmus glukózy a môžu vyžadovať úpravu dávky lieku Xultophy. Látky, ktoré môžu znižovať potrebu lieku Xultophy:
Antidiabetiká, inhibítory monoaminooxidázy (IMAO), betablokátory, inhibítory enzýmu konvertujúceho angiotenzín (ACE), salicyláty, anabolické steroidy a sulfónamidy.
Látky, ktoré môžu zvyšovať potrebu lieku Xultophy:
Perorálne kontraceptíva, tiazidy, glukokortikoidy, tyroidálne hormóny, sympatomimetiká, rastové hormóny a danazol.
Betablokátory môžu maskovať príznaky hypoglykémie.
Oktreotid/lanreotid môže zvyšovať alebo znižovať potrebu lieku Xultophy. Alkohol môže zosilniť alebo znížiť hypoglykemický účinok lieku Xultophy.
Farmakokinetické interakcie
Údaje z testov in vitro naznačujú potenciál farmakokinetických liekových interakcií súvisiacich s CYP
a nízku väzbu liraglutidu aj inzulínu degludeku na proteíny.
Malé spomalenie vyprázdňovania žalúdka spôsobené liraglutidom môže mať vplyv na absorpciu súčasne podávaných perorálnych liekov. Interakčné štúdie nepreukázali žiadne klinicky významné spomalenie absorpcie.
Warfarín a iné kumarínové deriváty
Neuskutočnili sa žiadne interakčné štúdie. Nedajú sa vylúčiť klinicky významné interakcie s liečivami so slabou rozpustnosťou alebo s úzkym terapeutickým indexom, ako je warfarín. Po začatí liečby
liekom Xultophy sa u pacientov liečených warfarínom alebo inými kumarínovými derivátmi odporúča
častejšie sledovanie INR (International Normalised Ratio).
Paracetamol
Liraglutid nespôsobil zmenu celkovej expozície paracetamolu po jednorazovej dávke 1 000 mg. Hodnota Cmax paracetamolu sa znížila o 31 % a stredná hodnota tmax sa spomalila maximálne o 15 min. Pri súbežnom podávaní paracetamolu nie je potrebná žiadna úprava dávky.
Atorvastatín
Liraglutid nespôsobil zmenu celkovej expozície atorvastatínu na klinicky významnú úroveň po podaní
jednorazovej dávky 40 mg atorvastatínu. Preto nie je potrebná žiadna úprava dávky atorvastatínu pri jeho podávaní s liraglutidom. Pri podávaní s liraglutidom sa hodnota Cmax atorvastatínu znížila o 38 % a stredná hodnota tmax sa spomalila z 1 na 3 hodiny.
Grizeofulvín
Liraglutid nespôsobil zmenu celkovej expozície grizeofulvínu po podaní jednorazovej dávky 500 mg grizeofulvínu. Hodnota Cmax grizeofulvínu sa zvýšila o 37 %, zatiaľ čo stredná hodnota tmax sa nezmenila. Úpravy dávok grizeofulvínu a iných zložiek s nízkou rozpustnosťou a vysokou permeabilitou nie sú potrebné.
Digoxín
Podanie jednorazovej dávky 1 mg digoxínu spolu s liraglutidom malo za následok zníženie AUC digoxínu o 16 %; hodnota Cmax klesla o 31 %. Stredná hodnota času do dosiahnutia maximálnej koncentrácie (tmax) digoxínu sa spomalila z 1 hodiny na 1,5 hodiny. Na základe týchto výsledkov nie je potrebná žiadna úprava dávky digoxínu.
Lizinopril
Podanie jednorazovej dávky 20 mg lizinoprilu spolu s liraglutidom malo za následok zníženie AUC lizinoprilu o 15 %; hodnota Cmax klesla o 27 %. Stredná hodnota lizinoprilu tmax s liraglutidom sa spomalila zo 6 hodín na 8 hodín. Na základe týchto výsledkov nie je potrebná žiadna úprava dávky lizinoprilu.
Perorálne kontraceptíva
Po podaní jednorazovej dávky perorálneho kontraceptíva znížil liraglutid hodnotu Cmax
etinylestradiolu o 12 % a levonorgestrelu o 13 %. Liraglutid spôsobil spomalenie tmax o 1,5 hodiny pre
obe zložky. Neprejavil sa žiaden klinicky významný účinok na celkovú expozíciu etinylestradiolu ani
levonorgestrelu. Preto sa predpokladá, že antikoncepčný účinok nie je ovplyvnený spoločným
podávaním s liraglutidom.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne klinické skúsenosti s používaním lieku Xultophy, inzulínu degludeku ani
liraglutidu u gravidných žien. Ak si pacientka želá otehotnieť alebo otehotnie, liečba liekom Xultophy
sa má prerušiť.
Reprodukčné štúdie na zvieratách s inzulínom degludekom nepreukázali žiadne rozdiely medzi inzulínom degludekom a ľudským inzulínom, pokiaľ ide o embryotoxicitu a teratogenitu. Štúdie na zvieratách s liraglutidom preukázali reprodukčnú toxicitu, pozri časť 5.3. Nie je známe potenciálne riziko u ľudí.
Laktácia
Nie sú k dispozícii žiadne klinické skúsenosti s používaním lieku Xultophy počas laktácie. Nie je
známe, či sa inzulín degludek alebo liraglutid vylučuje do ľudského mlieka. Pre nedostatok skúseností
sa Xultophy nemá používať počas laktácie.
V prípade potkanov sa inzulín degludek vylučoval do mlieka; koncentrácia v mlieku bola nižšia ako v plazme. Štúdie na zvieratách preukázali nízky prechod liraglutidu a štrukturálne blízkych metabolitov
do materského mlieka. Predklinické štúdie s liraglutidom preukázali spomalenie neonatálneho rastu
u dojčených mláďat potkanov súvisiace s liečbou (pozri časť 5.3).
Fertilita
Nie sú k dispozícii žiadne klinické skúsenosti s vplyvom lieku Xultophy na fertilitu.
Reprodukčné štúdie na zvieratách s inzulínom degludekom nepreukázali žiadne nežiaduce účinky na
fertilitu. Okrem mierneho poklesu počtu živých implantátov, štúdie na zvieratách s liraglutidom nepreukázali škodlivé účinky na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Schopnosť koncentrácie ako aj reakčná schopnosť u pacientov môže byť znížená v dôsledku hypoglykémie. Táto skutočnosť vytvára riziko v situáciách, ktoré si vyžadujú mimoriadnu pozornosť (napr. pri vedení vozidiel alebo pri obsluhe strojov).
Pacienti musia byť poučení ako predchádzať hypoglykémii počas vedenia vozidiel. Toto je obzvlášť dôležité vtedy, ak si nedostatočne uvedomujú, alebo si vôbec neuvedomujú varovné signály hypoglykémie, alebo majú časté hypoglykémie. V týchto situáciách sa má zvážiť vhodnosť vedenia vozidiel.
4.8 Nežiaduce účinky
Prehľad bezpečnostnéhoprofilu
Plán klinickej štúdie lieku Xultophy zahŕňal približne 1300 pacientov liečených liekom Xultophy.
Najčastejšími nežiaducimi reakciami hlásenými počas liečby liekom Xultophy bola hypoglykémia a gastrointestinálne nežiaduce reakcie (pozri časť „Opis vybraných nežiaducich reakcií“ nižšie).
Tabuľkovýzoznamnežiaducichreakcií
Nižšie sú uvedené nežiaduce reakcie súvisiace s liekom Xultophy rozdelené podľa tried orgánových systémov a frekvencie. Kategórie frekvencií sú definované takto: Veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1000), veľmi zriedkavé
(< 1/10 000) a neznáme (nedá sa odhadnúť z dostupných údajov).
Tabuľka 1. Nežiaduce reakcie hlásené v kontrolovaných štúdiách fázy 3Trieda orgánových systémov
| Frekvencia
| Nežiaduca reakcia na liek
|
Poruchy imunitného systému
| Menej časté
| Žihľavka
|
Zriedkavé
| Precitlivenosť
|
Neznáme
| Anafylaktická reakcia
|
Poruchy metabolizmu a
výživy
| Veľmi časté
| Hypoglykémia
|
Časté
| Zníženie chuti do jedla
|
Menej časté
| Dehydratácia
|
Poruchy gastrointestinálneho
traktu
| Časté
| Nauzea, hnačka, vracanie, zápcha, dyspepsia,
gastritída, bolesť brucha, flatulencia,
gastroezofageálna refluxná choroba, abdominálna distenzia
|
Neznáme
| Pankreatitída (vrátane nekrotizujúcej pankreatitídy)
|
Poruchy kože a podkožného
tkaniva
| Menej časté
| Vyrážka
|
Menej časté
| Pruritus
|
Zriedkavé
| Získaná lipodystrofia
|
Celkové poruchy a reakcie
v mieste podávania
| Časté
| Reakcia v mieste podávania injekcie
|
Neznáme
| Periférny edém
|
Laboratórne a funkčné
vyšetrenia
| Menej časté
| Zvýšená tepová frekvencia
|
Opis vybraných nežiaducich reakciíHypoglykémiaHypoglykémia môže nastať vtedy, keď je dávka lieku Xultophy vyššia ako je potrebné. Závažná hypoglykémia môže viesť k bezvedomiu a/alebo kŕčom a môže spôsobiť dočasné alebo trvalé poškodenie činnosti mozgu alebo až smrť. Príznaky hypoglykémie sa zvyčajne objavujú náhle. Môžu medzi ne patriť studený pot, studená, chladná bledá pokožka, vyčerpanosť, nervozita alebo triaška, úzkosť, nezvyčajná únava alebo slabosť, zmätenosť, problémy s koncentráciou, ospalosť, nadmerný hlad, zmeny videnia, bolesť hlavy, nauzea a búšenie srdca. Frekvencie hypoglykémie, prosím pozri časť 5.1.
Alergické reakciePri používaní lieku Xultophy boli hlásené alergické reakcie (manifestované príznakmi a symptómami, ako sú žihľavka (0,3 % pacientov liečených liekom Xultophy), vyrážka (0,8 %), pruritus (0,6 %) a/alebo opuch tváre (0,2 %)). Pri užívaní liraglutidu po jeho uvedení na trh bolo hlásených niekoľko prípadov anafylaktických reakcií s ďalšími príznakmi ako hypotenzia, palpitácie, dýchavičnosť a edém. Anafylaktické reakcie môžu byť potenciálne život ohrozujúce.
Gastrointestinálne nežiaduce reakcieGastrointestinálne nežiaduce reakcie sa môžu vyskytnúť častejšie na začiatku liečby liekom Xultophy
a obvykle sa zmiernia počas niekoľkých dní alebo týždňov pokračujúcej liečby. Nauzea bola hlásená u
8,5 % pacientov a u väčšiny pacientov bola prechodná. Podiel pacientov, ktorí uviedli výskyt nauzey raz za týždeň kedykoľvek počas liečby, bol nižší ako 4 %. Hnačku hlásilo 8,3 % a vracanie 4,2 % pacientov. Frekvencia nauzey a hnačky bola pre liek Xultophy „Častá“ a pre liraglutid „Veľmi častá“. Okrem toho boli u 3,6 % pacientov liečených liekom Xultophy hlásené zápcha, dyspepsia, gastritída, bolesť brucha, flatulencia, gastroezofageálna refluxná choroba, abdominálna distenzia a zníženie chuti do jedla.
U 3,0 % pacientov liečených liekom Xultophy boli hlásené reakcie v mieste podávania injekcie (vrátane hematómu v mieste podávania injekcie, bolesti, hemorágie, erytému, hrčiek, opuchu, zmeny sfarbenia, pruritu, pocitu tepla a zdurenia miesta podávania injekcie). Tieto reakcie boli zvyčajne mierne a prechodné a zvyčajne počas ďalšej liečby vymiznú.
LipodystrofiaLipodystrofia (vrátane lipohypertrofie, lipoatrofie) sa môže vyskytnúť v mieste podávania injekcie. Neustále striedanie miesta podávania injekcie v rámci určenej oblasti podávania môže napomáhať
zníženiu rizika vzniku týchto reakcií.
Zvýšená tepová frekvenciaV klinických štúdiách s liekom Xultophy bolo pozorované stredné zvýšenie tepovej frekvencie z východiskovej hodnoty o 2 až 3 údery za minútu. Dlhodobé klinické účinky zvýšenia tepovej
frekvencie neboli stanovené.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieK dispozícii sú obmedzené údaje o predávkovaní liekom Xultophy.
Hypoglykémia sa môže rozvinúť, ak sa pacientovi podá vyššia dávka lieku Xultophy, ako je potrebné:
• V prípade miernej hypoglykémie je možné podať perorálne pacientovi glukózu alebo potraviny obsahujúce cukor. Preto sa odporúča, aby diabetik mal vždy pri sebe výrobky obsahujúce cukor.
• Pri závažnej hypoglykémii, ak sa pacient nedokáže liečiť sám, mu môže osoba oboznámená
s podávaním injekcie podať intramuskulárne alebo subkutánne glukagón (0,5 až 1 mg) alebo mu môže zdravotnícky pracovník podať intravenózne glukózu. Ak pacient do 10 až 15 minút nezareagoval na glukagón, musí sa mu podať intravenózne glukóza. Po nadobudnutí vedomia sa odporúča podať pacientovi perorálne cukor ako prevenciu proti recidíve.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: zatiaľ nepridelená. ATC kód: zatiaľ nepridelený
Mechanizmus účinkuXultophy je kombinovaný liek, ktorý obsahuje inzulín degludek a liraglutid so vzájomne sa
doplňujúcimi mechanizmami účinku zameranými na zlepšenie glykemickej kontroly.
Inzulín degludek je bazálny inzulín, ktorý vytvára po subkutánnom podávaní injekcie rozpustné multihexaméry, pričom vznikne zásoba, z ktorej sa inzulín degludek kontinuálne pomaly absorbuje do krvného obehu, čo vedie k rovnomernému a stabilnému účinku inzulínu degludeku na znižovanie hladiny glukózy s nízkou variabilitou pôsobenia inzulínu medzi jednotlivými dňami.
Inzulín degludek sa špecificky viaže na ľudský inzulínový receptor, čo vedie k rovnakým farmakologickým účinkom ako v prípade ľudského inzulínu.
Účinok inzulínu degludeku na znižovanie hladiny glukózy v krvi je spôsobený uľahčeným vychytávaním glukózy po naviazaní inzulínu na receptory v svalových a tukových bunkách a súbežnou inhibíciou tvorby glukózy v pečeni.
Liraglutid je analóg glukagónu podobného peptidu-1 (GLP-1) s 97 % sekvenčnou homológiou
s ľudským GLP-1, ktorý sa viaže na receptor pre GLP-1 a aktivuje ho. Po subkutánnom podávaní
pozostáva profil predĺženého účinku z troch mechanizmov: samoviazanie vedúce k pomalej absorpcii;
naviazanie na albumín a vyššia enzymatická stabilita voči enzýmom dipeptidyl-peptidáza IV (DPP- IV) a neutrálna endopeptidáza (NEP), ktorá má za následok dlhý polčas premeny v plazme.
Liraglutid účinkuje prostredníctvom špecifickej interakcie s receptormi GLP-1 a zlepšuje glykemickú kontrolu znížením hladiny glukózy v krvi nalačno aj po jedle. Liraglutid stimuluje sekréciu inzulínu a znižuje nadmerne zvýšenú sekréciu glukagónu mechanizmom závislým od glukózy. V prípade vysokej hladiny glukózy v krvi je teda stimulovaná sekrécia inzulínu a inhibovaná sekrécia glukagónu. Naopak počas hypoglykémie liraglutid znižuje sekréciu inzulínu a nenarušuje sekréciu glukagónu. Mechanizmus znižovania hladiny glukózy v krvi zahŕňa aj mierne spomalenie vyprázdňovania
žalúdka. Liraglutid znižuje telesnú hmotnosť a množstvo telesného tuku prostredníctvom mechanizmov potláčania hladu a zníženia príjmu energie.
Farmakodynamické účinkyXultophy má stabilný farmakodynamický profil s trvaním účinku zodpovedajúcim kombinácii
individuálnych profilov účinku inzulín degludeku a liraglutidu, ktoré umožňujú podávanie lieku Xultophy raz denne kedykoľvek v priebehu dňa s jedlom alebo bez jedla. Xultophy zlepšuje glykemickú kontrolu prostredníctvom pretrvávajúceho poklesu hladiny glukózy v krvi nalačno aj postprandiálne po všetkých jedlách.
Zníženie postprandiálnej glykémie bolo potvrdené v štúdii 4-hodinovým štandardizovaným testom po podaní jedla u pacientov, u ktorých nebola dosiahnutá kompenzácia metformínom samostatne alebo v kombinácii s pioglitazónom. Xultophy znížil výkyvy postprandiálnej glykémie (stredná hodnota viac ako 4 hodiny) výrazne viac ako inzulín degludek. Výsledky boli podobné pre Xultophy aj liraglutid.
Klinická účinnosť abezpečnosťPridanie k perorálne podávaným liekom na zníženie hladiny glukózyPridanie k liečbe metformínom samostatne alebo v kombinácii s pioglitazónomÚčinnosť a bezpečnosť lieku Xultophy v porovnaní s inzulínom degludekom a liraglutidom, všetky podávané raz denne, boli sledované v rámci 26-týždňovej randomizovanej kontrolovanej otvorenej
štúdie typu „treat-to-target“ u pacientov s diabetes mellitus 2. typu s predĺžením o 26 týždňov.
Počiatočná dávka lieku Xultophy bola 10 dávkovacích jednotiek (10 jednotiek inzulínu degludeku a
0,36 mg liraglutidu) a 10 jednotiek inzulínu degludeku a dávka sa titrovala dvakrát týždenne podľa
Tabuľky 2 uvedenej nižšie.
U pacientov v ramene s liraglutidom sa použilo fixné zvyšovanie dávky s počiatočnou dávkou 0,6 mg a jej zvyšovaním o 0,6 mg týždenne až do dosiahnutia udržiavacej dávky 1,8 mg. Maximálna dávka
lieku Xultophy bola 50 dávkovacích jednotiek, pričom v ramene s inzulínom degludekom nebola
žiadna maximálna dávka.
Tabuľka 2. Titrácia lieku Xultophy a inzulínu degludekuGlykémia pred raňajkami*
| Úprava dávky
|
mmol/l
| mg/dl
| Xultophy (dávkovacie jednotky)
| inzulín degludek (jednotky)
|
< 4,0
| < 72
| –2
| –2
|
4,0–5,0
| 72–90
| 0
| 0
|
> 5,0
| > 90
| +2
| +2
|
* Samostatne meraná glykémia
Kľúčové výsledky štúdie sú uvedené na Obrázku 1 a v Tabuľke 3.
60,4 % pacientov liečených liekom Xultophy dosiahlo cieľovú hodnotu HbA1c <7 % bez potvrdených hypoglykémií po 26 týždňoch liečby. Tento podiel bol výrazne vyšší ako bol zaznamenaný pre inzulín degludek (40,9 %) a podobný hodnote zaznamenanej pre liraglutid (57,7 %).
Miera potvrdenej hypoglykémie bola pre Xultophy nižšia ako pri inzulíne degludeku bez ohľadu na
glykemickú kontrolu, pozri Obrázok 1.
IDegLira
IDeg

Lira
IDegLira pozor. výskyt
IDegLira
IDeg
IDeg pozor. výskyt
Čas od randomizácie (týždeň)
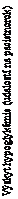
HbA1c (%) na konci liečby
Krivky sú stredné miery hypoglykémie z negatívneho binominálneho modelu s jedinečnými
trajektóriami liečby a symboly sú zaznamenané miery hypoglykémie v porovnaní so strednou

hodnotou HbA1c podľa kvantilov.
DegLira = Xultophy, IDeg = inzulín degludek, Lira = liraglutid, zazn. miera = zaznamenaná miera, PYE = pacientorok expozície
Obrázok 1. Stredná hodnota HbA1c (%) podľa týždňa liečby (vľavo) a miery potvrdenej hypoglykémie za pacientorok expozície v porovnaní so strednou hodnotou HbA1c (%) (vpravo) u pacientov s diabetes mellitus 2. typu, u ktorých nebola dosiahnutá kompenzácia metformínom samostatne alebo v kombinácii s pioglitazónom
Výskyt závažnej hypoglykémie za pacientorok expozície (percento pacientov) definovanej ako
epizóda, pri ktorej je potrebná asistencia inej osoby, bola 0,01 (2 pacienti z 825) pre Xultophy, 0,01 (2
pacienti zo 412) pre inzulín degludek a 0,00 (0 pacientov zo 412) pre liraglutid. Výskyt nočných
hypoglykémií bol podobný pri liečbe liekom Xultophy a inzulínom degludekom.
U pacientov liečených liekom Xultophy sa celkovo prejavilo menej gastrointestinálnych vedľajších účinkov ako u pacientov liečených liraglutidom. Dôvodom môže byť pomalšie zvyšovanie dávky liraglutidovej zložky pri začatí liečby liekom Xultophy v porovnaní so samostatnou liečbou liraglutidom.
Dlhodobé (52 týždňov) údaje u pacientov, ktorí neboli dostatočne kompenzovaní liečbou metformínom
samostatne alebo v kombinácii s pioglitazónom
Účinnosť a bezpečnosť lieku Xultophy bola zachovaná počas 52 týždňov liečby. Zníženie hodnoty HbA1c zo vstupnej hodnoty počas 52 týždňov bola 1,84 % pri lieku Xultophy s odhadovaným rozdielom v liečbe –0,65 % v porovnaní s liraglutidom (p<0,0001) a –0,46 % v porovnaní s inzulínom degludekom (p<0,0001). Telesná hmotnosť sa znížila o 0,4 kg pri odhadovanom rozdiele v liečbe medzi liekom Xultophy a inzulínom degludekom –2,80 kg (p <0,0001) a výskyt potvrdenej hypoglykémie zostal na úrovni 1,8 udalosti za pacientorok expozície, pričom sa zachovalo výrazné zníženie celkového rizika potvrdenej hypoglykémie v porovnaní s inzulínom degludekom.
Pridanie k liečbe sulfonylureou samostatne alebo v kombinácii s metformínom
Účinnosť a bezpečnosť lieku Xultophy pridaného k liečbe sulfonylureou samostatne alebo v kombinácii s metformínom sa skúmala v rámci 26-týždňovej randomizovanej placebom kontrolovanej dvojito zaslepenej štúdie typu „treat-to-target“ u 435 pacientov s diabetes mellitus 2. typu, z ktorých bolo 289 liečených liekom Xultophy. Počiatočná dávka lieku Xultophy bola 10 dávkovacích jednotiek (10 jednotiek inzulínu degludeku a 0,36 mg liraglutidu), pričom dávka bola titrovaná dvakrát
týždenne. Titrácia sa vykonávala podľa údajov uvedených v Tabuľke 2, i keď s cieľovou hodnotou titrácie 4 až 6 mmol/l.

Kľúčové výsledky štúdie sú uvedené na Obrázku 2 a v Tabuľke 3.
IDegLira

Placebo
IDegLira = Xultophy
Čas od randomizácie (týždeň)
O
brázok 2. Stredná hodnota HbA
1c
(
%
) podľa týždňa liečby u pacientov s diabetes mellitus
2. typu s nedostatočnou kompenzáciou sulfonylureou samostatne alebo v kombinácii s
m
etformínom
Výskyt závažnej hypoglykémie za pacientorok expozície (percento pacientov) bol 0,02 (2 pacienti z
288) pre Xultophy a 0,00 (0 pacientov zo 146) pre placebo.
Tabuľka 3. Výsledky z 26-týždňových štúdií s liekom Xultophy u pacientov s diabetes mellitus
|
Predchádzajúca liečba metformínom ± pioglitazónom
| Predchádzajúca liečba
sulfonylureou ± metformínom
|
|
Xultophy
|
Inzulín degludek
|
Liraglutid
| Xultoph
y
| Placebo
| N
| 833
| 413
| 414
| 289
| 146
| HbA1c (%) Východisková hodnota→Koniec štúdie
Priemerná zmena
Odhadovaný rozdiel
|
8,3→6,4
–1,91
|
8,3→6,9
–1,44
–0,47AB[–0,58; –0,36]
|
8,3→7,0
–1,28
–0,64AB[–0,75; –0,53]
|
7,9→6,4
–1,45
|
7,9→7,4
–0,46
–1,02AB[–1,18; –0,87]
| Pacienti (%) s
dosiahnutým HbA1c <7 % Všetci pacienti
Odhadovaný pomer pravdep.
|
80,6
|
65,1
2,38B [1,78; 3,18]
|
60,4
3,26B [2,45; 4,33]
|
79,2
|
28,8
11,95B [7,22; 19,77]
| Pacienti (%) s
dosiahnutým HbA1c ≤6,5 % Všetci pacienti Odhadovaný pomer pravdep.
|
69,7
|
47,5
2,82B [2,17; 3,67]
|
41,1
3,98B [3,05; 5,18]
|
64,0
|
12,3
16,36B [9,05; 29,56]
| Výskyt potvrdenej
hypoglykémie* za pacientorok expozície (percento pacientov) Odhadovaný pomer
|
1,80 (31,9 %)
|
2,57 (38,6 %)
0,68AC [0,53; 0,87]
|
0,22 (6,8 %)
7,61B [5,17; 11,21]
|
3,52 (41,7 %)
|
1,35 (17,1 %)
3,74B [2,28; 6,13]
| Telesná hmotnosť (kg)
Východisková hodnota→Koniec štúdie Priemerná zmena Odhadovaný rozdiel
|
87,2→86,7
–0,5
|
87,4→89,0
1,6
–2,22AB [–2,64; –1,80]
|
87,4→84,4
–3,0
2,44B [2,02; 2,86]
|
87,2→87
,7
0,5
|
89,3→88,3
–1,0
1,48B [0,90; 2,06]
| Glykémia nalačno
(mmol/l) Východisková hodnota→Koniec štúdie Priemerná zmena Odhadovaný rozdiel
|
9,2→5,6
–3,62
|
9,4→5,8
–3,61
–0,17 [–0,41; 0,07]
|
9,0→7,3
–1,75
–1,76B [2,0; –1,53]
|
9,1→6,5
–2,60
|
9,1→8,8
–0,31
–2,30B [–2,72; –1,89]
|
|
|
2. typu s nedostatočnou kompenzáciou metformínom samostatne alebo v kombinácii s pioglitazónom (vľavo) alebo s nedostatočnou kompenzáciou sulfonylureou samostatne alebo v kombinácii s metformínom (vpravo)
D
á
v
k
a na konci štúdie
Inzulín degludek (jednotky) Liraglutid (mg)
Odhadovaný rozdiel, dávka inzulínu degludeku
|
38
1,4
|
53
–
–14,90AB [–17,14;
–12,66]
|
'
–
1,8
|
28
1,0
|
–
–
–
|
Východisková hodnota, koniec štúdie a hodnoty zmeny sa sledujú pri poslednom vykonanom pozorovaní. V hranatých zátvorkách je
uvedený interval spoľahlivosti 95 %.
*Potvrdená hypoglykémia definovaná ako závažná hypoglykémia (epizóda vyžadujúca asistenciu inej osoby) a/alebo mierna hypoglykémia
(glykémia <3,1 mmol/l bez ohľadu na príznaky)
A Cieľ s potvrdenou superioritou lieku Xultophy v porovnaní s komparátorom
B p <0,0001
C p <0,05
Prechod z liečbybazálnyminzulínomÚčinnosť a bezpečnosť lieku Xultophy v porovnaní s inzulínom degludekom, oba podávané raz denne,
sa skúmala v rámci 26-týždňovej randomizovanej dvojito zaslepenej štúdie typu „treat-to-target“
u 2 pacientov s diabetes mellitus 2. typu s nedostatočnou kompenzáciou bazálnym inzulínom (20–
40 jednotiek) a metformínom samostatne alebo v kombinácii so sulfonylureou/glinidmi. Liečby
bazálnym inzulínom a sulfonylureou/glinidmi bola ukončená pri randomizácii.
Počiatočná dávka lieku Xultophy bola 16 dávkovacích jednotiek (16 jednotiek inzulínu degludeku a
0,6 mg liraglutidu) a 16 jednotiek inzulínu degludeku a dávka sa titrovala dvakrát týždenne podľa
Tabuľky 2. Maximálna povolená dávka bola 50 dávkovacích jednotiek lieku Xultophy a 50 jednotiek inzulínu degludeku.
Kľúčové výsledky štúdie sú uvedené v Tabuľke 4 a na obrázku 3.
Tabuľka 4. Výsledky 26-týždňovej štúdie lieku Xultophy u pacientov s diabetes mellitus2. typu s nedostatočnou kompenzáciou bazálnym inzulínom
| Predchádzajúca liečba bazálnym inzulínom
|
| Xultophy
| Inzulín degludek
Maximálna dávka 50 jednotiek
|
N
| 199
| 199
|
HbA1c (%)
Východisková hodnota→Koniec štúdie
Priemerná zmena
Odhadovaný rozdiel
|
8,7→6,9
–1,90
|
8,8→8,0
–0,89
–1,05AB[–1,25; –0,84]
|
Pacienti (%) s dosiahnutým HbA1c <7 %
Všetci pacienti
Odhadovaný pomer pravdep.
|
60,3
|
23,1
5,44B [3,42; 8,66]
|
Pacienti (%) s dosiahnutým HbA1c ≤6,5 %
Všetci pacienti
Odhadovaný pomer pravdep.
|
45,2
|
13,1
5,66B [3,37; 9,51]
|
Výskyt potvrdenej hypoglykémie* za pacientorok expozície (percento
pacientov)
Odhadovaný pomer
|
1,53 (24,1 %)
|
2,63 (24,6 %)
0,66 [0,39; 1,13]
|
Telesná hmotnosť (kg)
Východisková hodnota→Koniec štúdie
Priemerná zmena
Odhadovaný rozdiel
|
95,4→92,7
–2,7
|
93,5→93,5
0,0
–2,51B [–3,21; –1,82]
|
Glykémia nalačno (mmol/l)
Východisková hodnota→Koniec štúdie
Priemerná zmena
Odhadovaný rozdiel
|
9,7→6,2
–3,46
|
9,6→7,0
–2,58
–0,73C [–1,19; –0,27]
|
Dávka na konci štúdie
Inzulín degludek (jednotky) Liraglutid (mg)
Odhadovaný rozdiel, dávka inzulínu degludeku
|
45
1,7
|
45
–
–0,02 [–1,88; 1,84]
|
Východisková hodnota, koniec štúdie a hodnoty zmeny sa sledujú pri poslednom vykonanom pozorovaní. V ‘[]’ je uvedený interval
spoľahlivosti 95 %.
*Potvrdená hypoglykémia definovaná ako závažná hypoglykémia (epizóda vyžadujúca asistenciu inej osoby) a/alebo mierna hypoglykémia
(glykémia <3,1 mmol/l bez ohľadu na príznaky)
A Cieľ s potvrdenou superioritou lieku Xultophy v porovnaní s komparátorom
B p <0,0001
C p <0,05
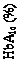
48,7 % pacientov dosiahlo cieľovú hodnotu HbA1c <7 % bez potvrdených hypoglykémií, čo bol
výrazne vyšší podiel ako bol zaznamenaný pri inzulíne degludeku (15,6 %).
IDegLira
IDeg
Čas od randomizácie (týždeň)
IDegLira = Xultophy, IDeg = inzulín degludek
Obrázok 3. Stredná hodnota HbA1c (%) podľa týždňa liečby u pacientov s diabetes mellitus2. typu s nedostatočnou kompenzáciou bazálnym inzulínomVýskyt závažnej hypoglykémie za pacientorok expozície (percento pacientov) bol 0,01 (1 pacient zo
199) pre Xultophy a 0,00 (0 pacientov zo 199) pre inzulín degludek. Výskyt nočných
hypoglykemických udalostí bol podobný pri liečbe liekom Xultophy a inzulínom degludekom.
Ďalšie klinické údajeSekrécia inzulínu/funkcia beta buniekXultophy zlepšuje funkciu beta buniek v porovnaní s inzulínom degludekom na základe hodnotenia funkcie beta buniek pomocou modelu homeostázy (HOMA-β). U 260 pacientov s diabetes mellitus 2.
typu sa preukázalo zlepšenie sekrécie inzulínu v porovnaní s inzulínom degludekom v reakcii na
štandardizovaný test s jedlom. Po 52 týždňoch liečby nie sú dostupné žiadne údaje.
Krvný tlakU pacientov s nedostatočnou kompenzáciou metformínom samostatne alebo v kombinácii s
pioglitazónom znížil Xultophy stredný systolický krvný tlak o 1,8 mmHg v porovnaní so znížením o
0,7 mmHg s inzulínom degludekom a 2,7 mmHg s liraglutidom. U pacientov s dostatočnou
kompenzáciou sulfonylureou samostatne alebo v kombinácii s metformínom sa dosiahlo zníženie
3,5 mmHg s liekom Xultophy a 3,2 mmHg s placebom. Rozdiely neboli štatisticky významné. U pacientov s nedostatočnou kompenzáciou bazálnym inzulínom bolo zníženie stredného systolického krvného tlaku o 5,4 mmHg s liekom Xultophy a 1,7 mmHg s inzulínom degludekom so štatisticky významným odhadovaným rozdielom v liečbe –3,71 mmHg (p=0,0028).
Pediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom Xultophy
vo všetkých podskupinách pediatrickej populácie s diabetes mellitus 2. typu (informácie o použití u pediatrickej populácie, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiFarmakokinetické vlastnosti inzulínu degludeku a liraglutidu podaných formou lieku Xultophy celkovo neboli ovplyvnené klinicky významným spôsobom v porovnaní s jednotlivými injekciami inzulínu degludeku a liraglutidu.
Farmakokinetické vlastnosti lieku Xultophy sa prejavujú v nasledujúcich položkách, pokiaľ nie je uvedené, že uvedené údaje boli zaznamenané pri podávaní inzulínu degludeku alebo liraglutidu samostatne.
Absorpcia
Celková expozícia inzulínu degludeku bola ekvivalentná následnému podávaniu lieku Xultophy v
porovnaní s podávaním inzulínu degludeku samostatne, pričom hodnota Cmax bola vyššia o 12 %. Celková expozícia liraglutidu bola ekvivalentná následnému podávaniu lieku Xultophy v porovnaní s liraglutidom samostatne, pričom hodnota Cmax bola nižšia o 23 %. Rozdiely sa nepovažujú za klinicky relevantné, pretože Xultophy je iniciovaný a titrovaný podľa cieľových hodnôt glykémie u jednotlivých pacientov.
Expozícia inzulínu degludeku a liraglutidu sa zvýšila pomerne s dávkou lieku Xultophy v celom
rozsahu dávky na základe populačnej farmakokinetickej analýzy.
Farmakokinetický profil lieku Xultophy zodpovedá jednej dennej dávke a stabilná koncentrácia inzulínu degludeku a liraglutidu sa dosiahne po 2–3 dňoch denného podávania.
Distribúcia
Inzulín degludek a liraglutid sa vo veľkej miere viažu na plazmatické proteíny (>99 % a >98 %).
Biotransformácia
Inzulín degludek
Degradácia inzulínu degludeku je podobná degradácii ľudského inzulínu. Všetky vzniknuté metabolity sú neaktívne.
Liraglutid
Počas 24 hodín od podania jednorazovej dávky rádiologicky označeného [3H]-liraglutidu zdravým pacientom bol hlavnou zložkou v plazme neporušený liraglutid. Boli zistené dva vedľajšie metabolity
v plazme (≤9 % a ≤5 % celkovej rádioaktivity v plazme). Liraglutid je metabolizovaný podobným
spôsobom ako veľké proteíny, pričom žiaden orgán nebol identifikovaný ako hlavná dráha eliminácie.
Eliminácia
Polčas premeny inzulínu degludeku je približne 25 hodín a polčas premeny liraglutidu je približne
13 hodín.
Osobitné populácie
Starší pacienti
Podľa výsledkov populačnej farmakokinetickej analýzy zahŕňajúcej dospelých pacientov do 83 rokov
liečených liekom Xultophy nemal vek žiaden klinicky relevantný účinok na farmakokinetiku lieku
Xultophy.
Pohlavie
Podľa výsledkov populačnej farmakokinetickej analýzy nemal vek žiaden klinicky relevantný účinok
na farmakokinetiku lieku Xultophy.
Etnický pôvod
Podľa výsledkov populačnej farmakokinetickej analýzy, ktorá zahŕňala belošské, černošské, indické, ázijské a hispánske skupiny pacientov, nemal etnický pôvod žiaden klinicky relevantný účinok na
farmakokinetiku lieku Xultophy.
Poškodenie obličiek
I
nzulín degludek
Nie sú žiadne rozdiely vo farmakokinetických vlastnostiach inzulínu degludeku medzi zdravými pacientami a pacientami s poškodením obličiek.
Liraglutid
Expozícia liraglutidu bola znížená u pacientov s poruchou funkcie obličiek v porovnaní s pacientami s normálnou funkciou obličiek. Expozícia liraglutidu bola znížená o 33 %, 14 %, 27 %, resp. 28 %
u pacientov s miernou (klírens kreatínu CrCl 50–80 ml/min), stredne závažnou (CrCl 30–50 ml/min) a závažnou (CrCl <30 ml/min) poruchou funkcie obličiek a u pacientov v terminálnom štádiu renálneho ochorenia vyžadujúceho si dialýzu.
Poškodenie pečene
Inzulín degludek
Nie sú žiadne rozdiely vo farmakokinetických vlastnostiach inzulínu degludeku medzi zdravými pacientami a pacientami s poškodením pečene.
Liraglutid
V štúdii s jednou dávkou sa hodnotila farmakokinetika liraglutidu u pacientov s rôznymi stupňami poruchy funkcie pečene. Dávka liraglutidu bola u pacientov s miernou až stredne závažnou poruchou
funkcie pečene znížená o 13–23 %, v porovnaní so zdravými pacientami. Dávka bola významne nižšia
(44 %) u pacientov so závažným poškodením funkcie pečene (Childovo-Pughovo skóre > 9).
Pediatrická populácia
Neboli vykonané žiadne štúdie lieku Xultophy u detí a dospievajúcich mladších ako 18 rokov.
5.3 Predklinické údaje o bezpečnosti
Plán predklinických štúdií pre inzulín degludek/liraglutid zahŕňal kľúčové štúdie kombinovanej toxicity počas 90 dní u jedného relevantného druhu (potkany kmeňa Wistar) s cieľom podporiť plán klinickej štúdie. Lokálna znášanlivosť bola hodnotená u králikov a morčiat.
Predklinické údaje o bezpečnosti nepreukázali žiadne riziká pre ľudí na základe toxicity po
opakovanom podávaní.
Lokálne reakcie tkaniva v dvoch štúdiách na králikoch, resp. morčatách, boli obmedzené na mierne
zápalové reakcie.
Nevykonali sa žiadne štúdie kombinácie inzulínu degludeku/liraglutidu zamerané na hodnotenie karcinogenézy, mutagenézy alebo narušenia fertility. Nasledujúce údaje vychádzajú z jednotlivých štúdií inzulínu degludeku a liraglutidu.
Inzulín degludek
Predklinické údaje získané na základe farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne bezpečnostné riziká
pre ľudí.
Pomer mitogénneho indexu k metabolickej sile inzulínu degludeku je nezmenený v porovnaní s
ľudským inzulínom.
Liraglutid
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, alebo genotoxicity, neodhalili žiadne osobitné riziko pre človeka. V 2-ročných
štúdiách karcinogénneho potenciálu u potkanov a myší boli pozorované neletálne tumory C-buniek
štítnej žľazy. U potkanov nebola sledovaná hodnota NOAEL (observed adverse effect level). Tieto tumory neboli pozorované v prípade opíc liečených 20 mesiacov. Výsledky v prípade hlodavcov sú
spôsobené ne-genotoxickým mechanizmom sprostredkovaným špecifickým receptorom pre GLP-1, na
ktorý sú obzvlášť citlivé hlodavce. Je pravdepodobné, že význam u ľudí bude nízky, ale nedá sa úplne vylúčiť. Nezistili sa žiadne ďalšie tumory súvisiace s liečbou.
Štúdie na zvieratách nepreukázali priame účinky na fertilitu okrem mierne zvýšenej predčasnej embryonálnej úmrtnosti pri najvyššej dávke. Podávanie liraglutidu v strednej gestačnej fáze spôsobilo pokles telesnej hmotnosti matky a spomalenie fetálneho rastu s nejednoznačnými účinkami na rebrá
u potkanov a kostrovú variabilitu u králikov. U potkanov bol po expozícii liraglutidu spomalený neonatálny rast, pričom v skupine s vysokou dávkou tento stav pretrval aj v období po odstavení mláďaťa. Nie je známe, či je spomalený rast mláďat spôsobený zníženým príjmom materského mlieka
v dôsledku priameho účinku GLP-1 alebo zníženou produkciou materského mlieka matkou v dôsledku zníženého prísunu kalórií.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Glycerol
Fenol
Octan zinočnatý
Kyselina chlorovodíková (na úpravu pH) Hydroxid sodný (na úpravu pH)
Voda na injekciu
6.2 Inkompatibility
Látky pridané do lieku Xultophy môžu zapríčiniť degradáciu liečiv. Xultophy sa nesmie pridávať do infúznych roztokov.
Tento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky.
Po prvom otvorení je možné liek uchovávať 21 dní pri maximálnej teplote 25°C. Liek sa má
zlikvidovať 21 dní po prvom otvorení.
6.4 Špeciálne upozornenia na uchovávanie
Pred prvým otvorením: Uchovávajte v chladničke (2°C – 8°C). Neuchovávajte v blízkosti mraziacej časti. Neuchovávajte v mrazničke. Nechajte na naplnenom pere nasadený kryt na ochranu pred svetlom.
Po prvom otvorení: Uchovávajte pri teplote do 25°C alebo uchovávajte v chladničke (2°C – 8°C). Neuchovávajte v mrazničke. Nechajte na naplnenom pere nasadený kryt na ochranu pred svetlom.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Jednorazové naplnené pero na viac dávok vyrobené z polypropylénu, polykarbonátu a akrylonitrilbutadiénstyrénu obsahujúce 3 ml roztoku v náplni (sklo typ 1) s piestom (halobutyl) a zátkou (halobutyl/polyizoprén).
Veľkosti balení 1, 3 a 5 a viacnásobné balenie obsahujúce 10 (2 balenia po 5) naplnených pier. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Naplnené pero je určené na použitie s injekčnými ihlami NovoTwist alebo NovoFine s maximálnou
dĺžkou 8 mm a s hrúbkou do 32G.
Naplnené pero je určené na použitie len pre jednu osobu.
Liek Xultophy sa nesmie použiť, ak roztok nie je číry a bezfarebný.
Liek Xultophy, ktorý bol zmrazený, sa nesmie použiť.
Pacient má po každom podávaní injekcie zlikvidovať injekčnú ihlu.
Odpad vzniknutý z lieku treba vrátiť do lekárne v súlade s národnými požiadavkami. Podrobný návod na použitie nájdete v písomnej informácii pre používateľa.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovo Nordisk A/S Novo Allé
DK-2880 Bagsværd
Dánsko
8. REGISTRAČNÉ ČÍSLAEU/1/14/947/001
EU/1/14/947/002
EU/1/14/947/003
EU/1/14/947/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.