
ácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Závažná porucha funkcie pečene (trieda C podľa Childovej-Pughovej klasifikácie). Dojčenie (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
Psychické poruchy
Pitolisant sa má podávať s opatrnosťou pacientom, ktorí majú v anamnéze psychické poruchy,
napríklad závažnú úzkosť alebo závažnú depresiu s rizikom samovražedných myšlienok.
Poruchafunkciepečenealeboobličiek
Pitolisant sa má podávať s opatrnosťou pacientom s poruchou funkcie obličiek alebo so stredne závažnou poruchou funkcie pečene (trieda B podľa Childovej-Pughovej klasifikácie) a režim dávkovania sa má upraviť podľa časti 4.2.
Poruchy gastrointestinálneho traktu
Pri užívaní pitolisantu boli hlásené žalúdočné poruchy, preto sa má podávať s opatrnosťou pacientom
so žalúdočnými poruchami súvisiacimi so žalúdočnou kyselinou (pozri časť 4.8) alebo v prípade
súbežného podávania s látkami dráždiacimi žalúdok, ako sú kortikosteroidy alebo NSAID.
Poruchy výživy
Pitolisant sa má podávať s opatrnosťou pacientom so závažnou obezitou alebo závažnou anorexiou
(pozri časť 4.8). V prípade výraznej zmeny hmotnosti má lekár prehodnotiť liečbu.
Poruchy srdca a srdcovej činnosti
V dvoch štúdiách skúmajúcich interval QT viedli supraterapeutické dávky pitolisantu (3- až 6-
násobok terapeutickej dávky, teda 108 mg až 216 mg) k miernemu až stredne výraznému predĺženiu
intervalu QTc (10 – 13 ms). V klinických skúšaniach nebol pri terapeutických dávkach pitolisantu identifikovaný žiadny osobitný bezpečnostný signál súvisiaci so srdcom. Pacienti s ochorením srdca, ktorí sa súčasne liečia inými liekmi predlžujúcimi interval QT alebo liekmi, o ktorých je známe, že zvyšujú riziko porúch repolarizácie, alebo pacienti, ktorí sa súčasne liečia liekmi, ktoré výrazne zvyšujú hodnotu Cmax a pomer AUC pitolisantu (pozri časť 4.5), alebo pacienti so závažnou poruchou funkcie obličiek alebo stredne závažnou poruchou funkcie pečene (pozri časť 4.4) však majú byť pozorne sledovaní (pozri časť 4.5).
Epilepsia
Pri vysokých dávkach boli v zvieracích modeloch hlásené kŕče (pozri časť 5.3). V klinických
skúšaniach bolo u jedného pacienta s epilepsiou hlásené zhoršenie epilepsie. U pacientov so závažnou epilepsiou sa má postupovať s opatrnosťou.
Ženy vofertilnomveku
Ženy vo fertilnom veku musia používať účinnú antikoncepciu počas liečby a aspoň 21 dní po skončení
liečby (na základe polčasu pitolisantu/metabolitov). Pitolisant môže znižovať účinnosť hormonálnej antikoncepcie. Ak teda pacientka užíva hormonálnu antikoncepciu, má sa použiť alternatívna metóda účinnej antikoncepcie (pozri časti 4.5 a 4.6).
Liekové interakcie
Treba sa vyhnúť kombinácii pitolisantu so substrátmi CYP3A4 s úzkym terapeutickým rozmedzím
(pozri časť 4.5).
Rebound efekt
V klinických skúšaniach nebol hlásený žiadny rebound efekt (návrat príznakov po prerušení/vysadení
liečby). Po skončení liečby však pacienti majú byť monitorovaní.
4.5 Liekové a iné interakcie
Antidepresíva
Tricyklické alebo tetracyklické antidepresíva (napríklad imipramín, klomipramín, mirtazapín) môžu
narušiť účinnosť pitolisantu, lebo majú antagonistický účinok na histamínový receptor H1 a
pravdepodobne rušia účinok endogénneho histamínu vylučovaného v mozgu v dôsledku liečby.
A
ntihistaminiká
Antihistaminiká (antagonisty receptora H1), ktoré prejdú cez hematoencefalickú bariéru (napríklad
feniramíniumhydrogénmaleinát, chlórfeniramín, difenydramín, prometazín, mepyramín), môžu narušiť účinnosť pitolisantu.
Látky predlžujúce intervalQTalebolátky,oktorýchjeznáme,žezvyšujúrizikoporúchrepolarizácie
Pri kombinácii s pitolisantom má byť pacient pozorne sledovaný (pozri časť 4.4).
Farmakokinetické interakcie
Lieky ovplyvňujúce metabolizmus pitolisantu
- Induktory enzýmov
Súčasné podávanie pitolisantu s rifampicínom vo viacnásobných dávkach výrazne znižuje priemernú hodnotu Cmax pitolisantu o približne 39 % a jeho pomer AUC o približne 50 %. Pri súčasnom podávaní pitolisantu so silnými induktormi CYP3A4 (ako je rifampicín, fenobarbital, karbamazepín, fenytoín)
sa má preto postupovať s opatrnosťou. V prípade súčasného užívania ľubovníka bodkovaného
(Hypericum perforatum) s pitolisantom sa má vzhľadom na jeho silný indukčný účinok na CYP3A4 postupovať s opatrnosťou. V prípade kombinácie oboch liečiv má byť pacient klinicky sledovaný a v priebehu tejto kombinovanej liečby a jeden týždeň po skončení liečby induktorom sa má upraviť dávka.
Kombinácia pitolisantu s probenecidom v klinickej štúdii s viacnásobnými dávkami znižuje AUC
pitolisantu približne o 34 %.
- Inhibítory CYP2D6
Súčasné podávanie pitolisantu s paroxetínom výrazne zvyšuje priemernú hodnotu Cmax pitolisantu o približne 47 % a jeho pomer AUC0–72h o približne 105 %. Vzhľadom na 2-násobný nárast expozície pitolisantu sa pri jeho súčasnom podávaní s inhibítormi CYP2D6 (ako je paroxetín, fluoxetín,
venlafaxín, duloxetín, bupropión, chinidín, terbinafín, cinakalcet) má postupovať s opatrnosťou. Počas tejto kombinovanej liečby možno zvážiť úpravu dávkovania.
Lieky, ktorých metabolizmus môže pitolisant ovplyvniť
- Substráty CYP3A4 a CYP2B6
Na základe údajov in vitro môže pitolisant a jeho hlavné metabolity pri terapeutických koncentráciách indukovať CYP3A4 a CYP2B6 a extrapoláciou aj CYP2C, UGT a P-gp. Nie sú k dispozícii žiadne
klinické údaje o rozsahu tejto interakcie. Preto je potrebné vyhnúť sa kombinácii pitolisantu so
substrátmi CYP3A4 s úzkym terapeutickým rozmedzím (napr. s imunosupresívami, docetaxelom,
inhibítormi kinázy, cisapridom, pimozidom, halofantrínom) (pozri časť 4.4). V prípade iných substrátov CYP3A4 a substrátov CYP2B6 (napr. efavirenzu, bupropiónu), CYP2C (napr. repaglinidu, fenytoínu, warfarínu), P-gp (napr. dabigatranu, digoxínu) a UGT (napr. morfínu, paracetamolu, irinotekanu) sa má postupovať s opatrnosťou a ich účinnosť sa má klinicky monitorovať.
Treba sa vyhnúť kombinácii perorálnej antikoncepcie s pitolisantom a použiť inú spoľahlivú metódu
antikoncepcie.
- Substráty OCT1
Pitolisant v množstve 1,33 µM vykazuje inhibíciu OCT1 (transportéry organických katiónov 1) vyššiu
ako 50 %, pričom extrapolovaná hodnota IC50 pitolisantu je 0,795 µM.
Hoci klinický význam tohto účinku nebol stanovený, odporúča sa pri podávaní pitolisantu so substrátom OCT1 (ako je metformín (biguanidy)) postupovať s opatrnosťou (pozri časť 5.2).
Kombinácia pitolisantu s modafinilom alebo nátriumoxybutyrátom ako bežnej liečby narkolepsie bola vyhodnotená u zdravých dobrovoľníkov pri terapeutických dávkach. Nezistili sa žiadne klinicky významné farmakokinetické liekové interakcie s modafinilom ani nátriumoxybutyrátom.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomveku
Ženy vo fertilnom veku musia používať účinnú antikoncepciu počas liečby a aspoň 21 dní po skončení
liečby (na základe polčasu pitolisantu/metabolitov). Pitolisant/metabolity môžu znižovať účinnosť hormonálnej antikoncepcie. Ak teda žena užíva hormonálnu antikoncepciu, má sa použiť alternatívna metóda účinnej antikoncepcie (pozri časť 4.5).
Gravidita
K dispozícii nie sú žiadne alebo len obmedzené množstvo údajov o použití pitolisantu u gravidných
žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu vrátane teratogenity. Preukázalo sa, že pitolisant/metabolity prechádzajú placentou potkanov (pozri časť 5.3).
Pitolisant sa nemá používať počas gravidity, pokiaľ potenciálny prínos neprevažuje nad potenciálnym
rizikom pre plod.
Dojčenie
Štúdia na zvieratách preukázala vylučovanie pitolisantu/metabolitov do mlieka. Dojčenie je preto
kontraindikované počas liečby pitolisantom (pozri časť 4.3).
Fertilita
Štúdia na zvieratách preukázala účinky na parametre spermy bez výrazného vplyvu na reprodukčnúý
výkon samcov a zníženie percenta živých plodov u liečených samíc (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pitolisant má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
Pacientov s abnormálnou úrovňou ospanlivosti užívajúcich pitolisant je potrebné upozorniť, že ich úroveň bdenia sa nemusí vrátiť do normálu. Pacientov s nadmernou dennou ospanlivosťou vrátane pacientov, ktorí užívajú pitolisant, je potrebné často vyšetrovať v súvislosti s úrovňou ospanlivosti a podľa potreby sa im má odporučiť, aby neviedli vozidlá ani nevykonávali iné potenciálne nebezpečné činnosti.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie nežiaduce liekové reakcie hlásené pri užívaní pitolisantu boli nespavosť (8,4 %), bolesť
hlavy (7,7 %), nauzea (4,8 %), úzkosť (2,1 %), podráždenosť (1,8 %), závrat (1,4 %), depresia (1,3 %), tras (1,2 %), poruchy spánku (1,1 %), únava (1,1 %), vracanie (1,0 %), vertigo (1,0 %), dyspepsia (1,0 %), nárast hmotnosti (0,9 %), bolesť v hornej časti brucha (0,9 %). Najzávažnejšie nežiaduce liekové reakcie sú abnormálne zníženie hmotnosti (0,09 %) a spontánny potrat (0,09 %).
Tabuľkovýzoznamnežiaducichreakcií
Nežiaduce reakcie, ktoré boli hlásené pri užívaní pitolisantu v klinických štúdiách zahŕňajúcich viac než 1094 pacientov s narkolepsiou a inými indikáciami, sú ďalej uvedené ako preferované termíny MedDRA podľa triedy orgánových systémov a frekvencie. Frekvencie sú definované takto: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až
<1/1 000), veľmi zriedkavé (<1/10 000). V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie
usporiadané v poradí klesajúcej závažnosti:
Časté Menej časté Zriedkavé
Poruchy metabolizmu a
výživy
Psychické poruchy Nespavosť
Úzkosť
Podráždenosť Depresia Porucha spánku
Poruchy nervového systému Bolesť hlavy Závrat Tras
Znížená chuť do jedla Zvýšená chuť do jedla Zadržiavanie tekutín
Nepokoj Halucinácie Vizuálne a sluchové halucinácie
Afektová labilita Abnormálne sny Dyssomnia Nespavosť s nočným budením
Nespavosť
s neschopnosťou zaspať
Nespavosť so skorým
ranným budením Nervozita Napätie Apatia
Nočné mory Nepokoj Záchvat paniky Znížené libido Zvýšené libido
Dyskinéza Porucha rovnováhy Kataplexia
Narušená pozornosť
Dystónia
Fenomén on-off Hypersomnia Migréna Psychomotorická hyperaktivita
Syndróm nepokojných nôh
Somnolencia Epilepsia Bradykinéza
Parestézia
Anorexia Hyperfágia Porucha chuti
Abnormálne správanie Stav zmätenosti Depresívna nálada Popudlivosť (excitabilita) Obsedantné myšlienky Dysfória Hypnopompické halucinácie
Príznak depresie Hypnagogické halucinácie Duševná porucha
Strata vedomia Tenzná bolesť hlavy Porucha pamäti Nízka kvalita spánku
Poruchy oka Znížená ostrosť videnia
Blefarospazmus
Poruchy ucha a labyrintu Vertigo Tinitus
Poruchy srdca a srdcovej
činnosti
Extrasystoly
Bradykardia
Poruchy ciev Hypertenzia
Hypotenzia
Nával horúčavy
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Stavy v gravidite, v šestonedelí a perinatálnom období
Poruchy reprodukčného
systému a prsníkov
Nauzea Vracanie Dyspepsia
Zívanie
Sucho v ústach Bolesť brucha Hnačka Nepríjemný pocit v bruchu
Bolesť v hornej časti
brucha
Zápcha
Gastroezofageálna refluxná choroba Gastritída Gastrointestinálna bolesť Hyperacidita
Parestézia úst Nepríjemný pocit v žalúdku
Erytém Pruritus Vyrážka Hyperhidróza Potenie
Artralgia Bolesť chrbta Svalová rigidita Svalová slabosť Muskuloskeletálna bolesť
Myalgia
Bolesť v končatine
Polakizúria
Metrorágia
Abdominálna distenzia Dysfágia Flatulencia Odynofágia Enterokolitída
Toxický kožný výsev
Fotosenzitivita
Bolesť krku Muskuloskeletálna bolesť v hrudníku
Spontánny potrat
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Únava Asténia Bolesť v hrudníku Abnormálny pocit
Malátnosť
Edém
Periférny edém
Zvýšená hmotnosť Znížená hmotnosť Zvýšená hladina pečeňových enzýmov
Bolesť Nočné potenie Pocit tiesne
Zvýšená hladina
kreatínfosfokinázy
Predĺžený interval QT na elektrokardiograme Zvýšená srdcová frekvencia
Zvýšená hladina
gamaglutamyltransferázy
Abnormálny celkový fyzický stav Abnormalita repolarizácie na elektrokardiograme Inverzia vlny T na elektrokardiograme
 O
pis
vybraných
nežiaducich
reakcií
Bolesť hlavy a nespavosť
O
pis
vybraných
nežiaducich
reakcií
Bolesť hlavy a nespavosť
Počas klinických štúdií boli hlásené epizódy bolesti hlavy a nespavosti (7,7 % až 8,4 %). Väčšina týchto nežiaducich reakcií bola mierna až stredne závažná. Ak príznaky pretrvávajú, má sa zvážiť
zníženie dennej dávky alebo prerušenie liečby.
Žalúdočné poruchyPočas klinických štúdií boli u 3,5 % pacientov užívajúcich pitolisant hlásené žalúdočné poruchy
spôsobené hyperaciditou. Tieto účinky boli väčšinou mierne až stredne závažné. Ak pretrvávajú, je
možné začať nápravnú liečbu pomocou inhibítora protónovej pumpy.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 PredávkovaniePríznakyPríznaky predávkovania lieku Wakix môžu zahŕňať bolesť hlavy, nespavosť, podráždenosť, nauzeu a
bolesť brucha.
LiečbaV prípade predávkovania sa odporúča hospitalizácia a sledovanie vitálnych funkcií. Nie je k dispozícii
jasne identifikované antidotum.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné liečivá na nervový systém, ATC kód: N07XX11.
MechanizmusúčinkuPitolisant je silný, perorálne pôsobiaci antagonista/inverzný agonista histamínového receptora H3,
ktorý prostredníctvom blokády histamínových autoreceptorov zvyšuje činnosť histamínergných neurónov v mozgu, významného aktivačného systému, ktorý výrazne ovplyvňuje celý mozog. Pitolisant moduluje aj rôzne systémy neurotransmiterov, pričom zvyšuje uvoľňovanie acetylcholínu, noradrenalínu a dopamínu v mozgu. Pri užívaní pitolisantu sa však nezistilo zvýšenie uvoľňovania dopamínu v komplexe prúžkovaného telesa vrátane
nucleus accumbens.
Farmakodynamickéúčinky
U pacientov s narkolepsiou s kataplexiou alebo bez nej pitolisant zlepšuje úroveň a trvanie bdenia a dennej pozornosti posudzovaných na základe objektívnych parametrov schopnosti udržať si bdelosť (napr. test udržania bdelosti (Maintenance of Wakefulness Test – MWT)) a pozornosť (napr. test udržania schopnosti reagovať (Sustained Attention to Response Task – SART)).
Klinická účinnosťabezpečnosťNarkolepsia (s kataplexiou alebo bez nej) je chronický stav. Účinnosť pitolisantu v dávke do 36 mg
raz denne pri liečbe narkolepsie s kataplexiou alebo bez nej bola stanovená v dvoch hlavných, 8- týždňových multicentrických, randomizovaných, dvojito zaslepených, placebom kontrolovaných, paralelných skúšaniach (Harmony I a Harmony CTP). Štúdia Harmony Ibis s podobným rozvrhom bola obmedzená na dávku 18 mg raz denne. V súčasnosti je k dispozícii obmedzené množstvo údajov z otvorenej štúdie o dlhodobej účinnosti lieku Wakix pri tejto indikácii.
Hlavná štúdia (Harmony 1), dvojito zaslepené, randomizované, placebom a modafinilom
(400 mg/deň) kontrolované, paralelné štúdie s pružným prispôsobením dávky zahŕňali 94 pacientov (31 pacientov liečených pitolisantom, 30 pacientov liečených placebom a 33 pacientov liečených modafinilom). Dávkovanie sa začalo dávkou 9 mg raz denne a zvyšovalo sa podľa dosiahnutej účinnosti a tolerancie na 18 mg alebo 36 mg raz denne v intervale 1 týždňa. Väčšina pacientov (60 %) dosiahla dávkovanie 36 mg raz denne. Na posúdenie účinnosti pitolisantu pri nadmernej dennej ospanlivosti (Excessive Daytime Sleepiness – EDS) sa ako primárne kritérium účinnosti použilo skóre podľa Epworthovej stupnice ospanlivosti (Epworth Sleepiness Scale – ESS). Výsledky v skupine s pitolisantom boli výrazne lepšie ako výsledky v skupine s placebom (priemerný rozdiel: –3,33; 95 % IS [–5,83 až –0,83], p < 0,05), ale výrazne sa nelíšili od výsledkov v skupine s modafinilom (priemerný rozdiel: 0,12; 95 % IS [–2,5 až 2,7]). Prebúdzací účinok stanovený pre obe liečivá bol podobný (obrázok 1).
Obrázok 1: Zmeny v skóre podľa Epworthovej stupnice ospanlivosti (ESS) (priemer ± SEM)medzi začiatkom liečby a 8. týždňom v štúdii Harmony 1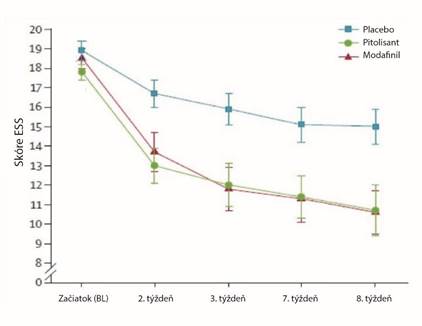
Účinok na ESS sa potvrdil v dvoch laboratórnych testoch bdelosti a pozornosti (test udržania bdelosti (MWT) (p = 0,044) a test udržania schopnosti reagovať (SART) (p = 0,053; takmer, ale nie významný rozdiel)).
Frekvencia záchvatov kataplexie u pacientov s týmto príznakom sa pri užívaní pitolisantu výrazne
(p = 0,034) znížila (–65 %) v porovnaní s placebom (–10 %). Denná miera kataplexie (geometrické
priemery) bola 0,52 na začiatku liečby a 0,18 v čase záverečnej návštevy v prípade pitolisantu a 0,43 na začiatku liečby a 0,39 v čase záverečnej návštevy v prípade placeba, pričom pomer týchto mier bol rR = 0,38 [0,16; 0,93] (p = 0,034).
Druhá hlavná štúdia (Harmony Ibis) zahŕňala 165 pacientov (67 liečených pitolisantom, 33 placebom a 65 modafinilom). Rozvrh štúdie bol podobný ako v štúdii Harmony I okrem toho, že maximálna dávka pitolisantu, ktorú dosiahlo 75 % pacientov, bola 18 mg raz denne namiesto 36 mg v štúdii Harmony I. Keďže významná nerovnováha viedla k tomu, že výsledky sa porovnávali so zoskupením pracovísk alebo bez neho, v prípade najkonzervatívnejšieho prístupu sa zistil nevýznamný pokles skóre ESS s pitolisantom v porovnaní s placebom (pitolisant-placebo = –1,94 s p = 0,065). Výsledky pre mieru kataplexie pri dávke 18 mg raz denne nezodpovedali výsledkom z prvej hlavnej štúdie
(36 mg raz denne).
Zlepšenie v dvoch objektívnych testoch bdelosti a pozornosti (MWT a SART) s pitolisantom bolo významné v porovnaní s placebom (p = 0,009 a p = 0,002 v danom poradí) a nevýznamné v porovnaní s modafinilom (p = 0,713 a p = 0,294 v danom poradí).
Podporná dvojito zaslepená, randomizovaná, paralelná štúdia Harmony CTP, porovnávajúca pitolisant s placebom, bola navrhnutá na stanovenie účinnosti pitolisantu u pacientov s vysokou frekvenciou kataplexie počas narkolepsie. Primárnym koncovým ukazovateľom účinnosti bola zmena v priemernom počte záchvatov kataplexie za týždeň medzi 2 týždňami na začiatku liečby a 4 týždňami obdobia stabilnej liečby na konci štúdie. Do štúdie bolo zahrnutých 105 pacientov s narkolepsiou s vysokou týždennou frekvenciou kataplexie na začiatku liečby (54 pacientov liečených pitolisantom a
51 placebom). Dávkovanie sa začalo dávkou 4,5 mg raz denne a zvyšovalo sa podľa dosiahnutej účinnosti a tolerancie na 9 mg, 18 mg alebo 36 mg raz denne v intervale 1 týždňa. Väčšina pacientov
(65 %) dosiahla dávkovanie 36 mg raz denne.
Pokiaľ ide o primárny koncový ukazovateľ účinnosti, teda týždennú frekvenciu epizód kataplexie (Weekly Rate of Cataplexy episodes – WRC), boli výsledky v skupine s pitolisantom výrazne lepšie ako výsledky v skupine s placebom (p < 0,0001), pričom táto frekvencia od začiatku do konca liečby postupne klesla o 64 % (obrázok 2). Na začiatku liečby bol geometrický priemer hodnoty WRC 7,31 (medián = 6,5 [4,5; 12]) v skupine s placebom a 9,15 (medián = 8,5 [5,5; 15,5]) v skupine s pitolisantom. V stabilnom období (do konca liečby) sa geometrický priemer hodnoty WRC
u pacientov, ktorí zažili aspoň jednu epizódu kataplexie, znížil na 6,79 (medián = 6 [3, 15]) v skupine s placebom a na 3,28 (medián = 3 [1,3; 6]) v skupine s pitolisantom. Pozorovaná hodnota WRC
v skupine s pitolisantom bola približne polovicou hodnoty WRC v skupine s placebom: rozsah účinku
pitolisantu v porovnaní s placebom bol vyjadrený mierou pomeru rR(Pt/Pb), rR = 0,512; 95 % IS
[0,435 až 0,603], p < 0,0001). Rozsah účinku pitolisantu v porovnaní s placebom s použitím modelu pre hodnotu WRC na základe preneseného východiskového pozorovania (Baseline Observation Carried Forward – BOCF) so stredom ako fixným účinkom bol 0,581; 95 % IS [0,493 až 0,686],
p < 0,0001.
O
brázok 2: Zmeny v týždennej frekvencii epizód kataplexie (geometrický priemer) od začiatku liečby do 7. týždňa v štúdii Harmony CTP
'
*p < 0,0001 v porovnaní s placebom
Účinok pitolisantu na EDS sa v tejto populácii hodnotil aj s použitím skóre ESS. V skupine s pitolisantom sa v porovnaní s placebom výrazne znížilo skóre ESS medzi začiatkom a koncom liečby, pričom sa pozorovala priemerná zmena –1,9 ± 4,3 (priemer ± SD) v prípade placeba a –5,4 ± 4,3 v prípade pitolisantu (p < 0,0001) (obrázok 3). Tento účinok na EDS potvrdili výsledky testu udržania bdelosti (MWT). Geometrický priemer pomerov (MWTna konci/MWTna začiatku) bol 1,8 (95 % IS 1,19;
2,71; p = 0,005). Hodnota MWT v skupine s pitolisantom bola o 80 % vyššia ako v skupine
s placebom.
Obrázok 3: Zmeny v skóre podľa Epworthovej stupnice ospanlivosti (ESS) (priemer ± SEM)medzi začiatkom liečby a 7. týždňom v štúdii Harmony CTPPediatrická populáciaEurópska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom Wakix v
jednej alebo vo viacerých podskupinách pediatrickej populácie s narkolepsiou s kataplexiou alebo bez nej (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Expozícia zdravých dobrovoľníkov pitolisantu sa skúmala v štúdiách zahŕňajúcich viac než 200 jedincov, ktorým bol podávaný pitolisant v individuálnych dávkach, ktoré neprevýšili 216 mg, počas maximálne 28 dní.
Absorpcia
Pitolisant sa dobre a rýchlo absorbuje, pričom maximálna koncentrácia v plazme sa dosiahne približne
tri hodiny od podania.
Distribúcia
Pitolisant vykazuje vysokú úroveň viazania na sérové proteíny (> 90 %) a približne rovnakú
distribúciu medzi červené krvinky a plazmu.
Biotransformácia
Metabolizmus pitolisantu u ľudí je úplne charakterizovaný. Hlavné nekonjugované metabolity sú
deriváty hydroxylované na rôznych pozíciách a štiepené formy pitolisantu vedúce k vzniku neaktívneho hlavného metabolitu vo forme karboxylovej kyseliny, ktorý sa nachádza v moči a sére. Tvoria sa pôsobením cytochrómov CYP3A4 a CYP2D6. Boli identifikované viaceré konjugované metabolity, pričom hlavné (neaktívne) sú dva glycínové konjugáty kyslého metabolitu pitolisantu a glukuronid ketónového metabolitu monohydroxylovaného desaturovaného pitolisantu.
Na pečeňových mikrozómoch pitolisant a jeho hlavné metabolity výrazne neinhibujú pôsobenie cytochrómov CYP1A2, CYP2C9, CYP2C19, CYP2C8, CYP2B6, CYP2E1 a CYP3A4 a izoforiem uridíndifosfát-glukuronozyl-transferáz UGT1A1, UGT1A4, UGT1A6, UGT1A9 a UGT2B7 do koncentrácie 13,3 µM, čo je výrazne vyššia hladina ako hladiny dosiahnuté pri terapeutickej dávke. Pitolisant je inhibítor CYP2D6 so stredne silnou účinnosťou (IC50 = 2,6 µM).
Pitolisant indukuje CYP3A4, CYP1A2 a CYP2B6 in vitro. Očakávajú sa klinicky významné interakcie so substrátmi CYP3A4 a CYP2B6 a extrapoláciou aj so substrátmi UGT, CYP2C a P-gp (pozri časť 4.5).
Štúdie in vitro naznačujú, že pitolisant nie je substrátom ani inhibítorom ľudského P-glykoproteínu ani proteínu zodpovedného za rezistenciu pri rakovine prsníka (BCRP). Pitolisant nie je substrátom OATP1B1, OATP1B3. Pitolisant nie je významným inhibítorom OAT1, OAT3, OCT2, OATP1B1, OATP1B3, MATE1 ani MATE2K v testovanej koncentrácii. Pitolisant v množstve 1,33 µM vykazuje vyššiu ako 50 % inhibíciu OCT1 (transportér organických katiónov 1), pričom extrapolovaná hodnota IC50 pitolisantu je 0,795 µM (pozri časť 4.5).
Eliminácia
Pitolisant má polčas v plazme 10 – 12 hodín. Po opakovaných podaniach sa stabilný stav, keď sa
hladina v sére zvýši na približne 100 %, dosiahne po 5 – 6 dňoch podávania. Variabilita medzi jedincami je pomerne vysoká, pričom u niektorých dobrovoľníkov sa zistil profil s odľahlými vysokými hodnotami (bez problémov s toleranciou).
Eliminácia prebieha najmä močom (približne 63 %) prostredníctvom neaktívneho nekonjugovaného metabolitu (BP2.951) a glycínového konjugovaného metabolitu. 25 % dávky sa vylučuje vydychovaným vzduchom a malá frakcia (< 3 %) sa vylučuje stolicou, v ktorej je množstvo pitolisantu alebo BP2.951 zanedbateľné.
Linearita/nelinearita
Keď sa dávka pitolisantu zdvojnásobí z 27 na 54 mg, hodnota AUC0-∞ sa zvýši o približne 2,3.
Osobité populácie
Starší pacienti
Farmakokinetické vlastnosti pitolisantu u pacientov vo veku 68 až 80 rokov sa v porovnaní s mladšími
pacientmi (vo veku 18 až 45 rokov) nelíšia. Vo veku vyššom ako 80 rokov sa kinetika mierne mení
bez klinického významu. K dispozícii sú obmedzené údaje o použití u starších pacientov. Dávkovanie sa má preto upraviť podľa ich stavu funkcie obličiek a pečene (pozri časti 4.2 a 4.4).
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek (stupeň 2 až 4 podľa medzinárodnej klasifikácie chronického
ochorenia obličiek, t. j. klírens kreatinínu 15 až 89 ml/min.) sa hodnoty Cmax a AUC často zvyšovali
2,5-násobne, bez vplyvu na polčas (pozri časť 4.2).
Porucha funkcie pečene
U pacientov s miernou poruchou funkcie pečene (trieda A podľa Childovej-Pughovej klasifikácie) nedošlo k žiadnym významným zmenám vo farmakokinetických vlastnostiach v porovnaní s normálnymi zdravými dobrovoľníkmi. U pacientov so stredne závažnou poruchou funkcie pečene (trieda B podľa Childovej-Pughovej klasifikácie) sa hodnota AUC zvýšila 2,4-násobne a polčas sa zdvojnásobil (pozri časť 4.2). Farmakokinetické vlastnosti pitolisantu po opakovanom podávaní pacientom s poruchou funkcie pečene sa zatiaľ neskúmali.
Pomalí metabolizátori CYP2D6
Expozícia pitolisantu bola vyššia u pomalých metabolizátorov CYP2D6 po jednej dávke
a v rovnovážnom stave; Cmax a AUC(0-tau) bola približne 2,7- a 3,2-násobne vyššia v 1. deň a 2,1- a 2,4-
násobne vyššia v 7. deň. Eliminačný polčas pitolisantu v sére bola u pomalých metabolizátorov
CYP2D6 dlhšia ako u rýchlych metabolizátorov.
Rasa
Vplyv rasy na metabolizmus pitolisantu sa neskúmal.
5.3 Predklinické údaje o bezpečnosti
Po 1 mesiaci u myší, 6 mesiacoch u potkanov a 9 mesiacoch u opíc bola hladina bez nežiaducich účinkov (no adverse effect level – NOAEL) pri perorálnom podaní 75 mg/kg/deň u myší,
30 mg/kg/deň u potkanov a 12 mg/kg/deň u opíc, čo pri porovnaní s expozíciou lieku pri terapeutickej
dávke u ľudí predstavuje u myší bezpečnostnú rezervu 9, u potkanov 1, a opíc 0,4. U potkanov sa
v čase Tmax vyskytli prechodné reverzibilné kŕčové epizódy, ktoré možno pripísať metabolitu hojne
prítomnému u tohto druhu, nie však u ľudí. U opíc boli pri najvyšších dávkach hlásené prechodné
klinické prejavy súvisiace s CNS vrátane vracania, trasu a kŕčov. Pri najvyšších dávkach sa u opíc nezaznamenali žiadne histopatologické zmeny a u potkanov sa vyskytli určité menšie histopatologické zmeny v niektorých orgánoch (pečeň, dvanástnik, týmus, nadoblička a pľúca).
Pitolisant nebol genotoxický ani karcinogénny.
Teratogénny účinok pitolisantu sa pozoroval pri dávkach toxických pre matku (bezpečnostná rezerva teratogenity < 1 u potkanov a králikov). Pitolisant vo vysokých dávkach vyvolával abnormality morfológie a zníženú motilitu spermií samcov potkanov bez významného vplyvu na indexy fertility
a znížil percento živých zárodkov a zvýšil výskyt postimplantačnej straty u samíc potkanov
(bezpečnostná rezerva 1). Spôsobilo to oneskorenie postnatálneho vývoja (bezpečnostná rezerva 1).
Preukázalo sa, že pitolisant/metabolity prechádzajú placentovou bariérou zvierat.
Štúdie toxicity u nedospelých potkanov odhalili, že podanie pitolisantu vo vysokých dávkach vyvoláva mortalitu a kŕčové epizódy závislé od dávky, ktoré možno pripísať metabolitu hojne prítomnému u potkanov, nie však u ľudí.
Pitolisant blokoval kanál hERG s hodnotou IC50 prekračujúcou terapeutické koncentrácie a vyvolal
mierne predĺženie intervalu QTc u psov.
V rámci predklinických štúdií sa uskutočnili štúdie závislosti od lieku a náchylnosti na zneužitie lieku u myší, opíc a potkanov. Nemožno však vyvodiť žiadne konečné závery o štúdiách tolerancie, závislosti a samopodávania.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Vnútro tablety
mikrokryštalická celulóza
krospovidón typu A
mastenec magnéziumstearát
koloidný bezvodný oxid kremičitý
Obal
polyvinylalkohol
oxid titaničitý (E171) makrogol 3350 mastenec
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
Wakix 4,5 mg tableta
3 roky
Wakix 18 mg tableta
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne špeciálne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Fľaša z polyetylénu s vysokou hustotou (HDPE) s bezpečnostným polypropylénovým závitovým
uzáverom odolným voči otvoreniu deťmi obsahujúca desikant (silikagél).
Fľaša s 30 alebo 90 filmom obalenými tabletami.
Wakix 4,5 mg: dostupný v baleniach obsahujúcich 1 fľašu s 30 tabletami.
Wakix 18 mg: dostupný v baleniach obsahujúcich 1 fľašu s 30 tabletami alebo v baleniach obsahujúcich 1 fľašu s 90 tabletami alebo v multibaleniach obsahujúcich 90 (3 fľaše s 30) tabletami. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBioprojet Pharma
9, rue Rameau
75002 Paris
Francúzsko
Tel.: +33 (0)1 47 03 66 33
Fax: +33 (0)1 47 03 66 30
e-mail:
contact@bioprojet.com8. REGISTRAČNÉ ČÍSLAEU/1/15/1068/001
EU/1/15/1068/002
EU/1/15/1068/003
EU/1/15/1068/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 31/03/2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.