
>8 hodín
3 hodiny Trvanie v
súlade s miestom
infekcie
1 Vypočítané s použitím Cockcroftovho-Gaultovho vzorca
2 Liečba môže pokračovať maximálne 14 dní
Osobitné populácie
Populácia starších pacientov
Nie je potrebná úprava dávky na základe veku (pozri časť 5.2).
Porucha funkcie obličiek
V tabuľke 2 sú uvedené odporúčané úpravy dávky pre pacientov s CrCl ≤ 39 ml/min.
Meropeném a vaborbaktám sa odstránia hemodialýzou (pozri časť 5.2). Dávky upravené vzhľadom na poruchu funkcie obličiek sa majú podávať po dialýze.
Tabuľka 2: Odporúčané intravenózne dávky pre pacientov s CrCl ≤ 39 ml/min1
CrCl (ml/min)1 Odporúčaný dávkovací režim2
Dávkovací interval Čas trvania infúzie
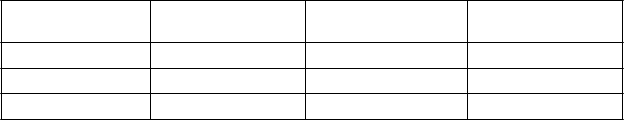
20 až 39 1 g/1 g Každých 8 hodín 3 hodiny
10 až 19 1 g/1 g Každých 12 hodín 3 hodiny
Menej ako 10 0,5 g/0,5 g Každých 12 hodín 3 hodiny
1 Vypočítané s použitím Cockcroftovho-Gaultovho vzorca
2 V tabuľke 1 je uvedené odporúčané trvanie liečby
Porucha funkcie pečeneU pacientov s poruchou funkcie pečene nie je potrebná úprava dávky (pozri časti 4.4 a 5.2).
Pediatrická populáciaBezpečnosť a účinnosť meropenému/vaborbaktámu u detí a dospievajúcich mladších ako 18 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávaniaIntravenózne použitie.
Liek Vabomere sa podáva formou intravenóznej infúzie trvajúcej 3 hodiny. Pokyny na rekonštitúciu a riedenie lieku pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Precitlivenosť na akýkoľvek karbapenémový antibakteriálny liek.
Závažná precitlivenosť (napr. anafylaktická reakcia, závažná kožná reakcia) na akýkoľvek iný druh betalaktámového antibakteriálneho lieku (napr. penicilíny, cefalosporíny alebo monobaktámy).
4.4 Osobitné upozornenia a opatrenia pri používaníReakcie zprecitlivenostiPri použití meropenému a/alebo meropenému/vaborbaktámu boli hlásené závažné a niekedy fatálne
reakcie z precitlivenosti (pozri časti 4.3 a 4.8).
Pacienti s precitlivenosťou na karbapenémy, penicilíny alebo iné betalaktámové antibakteriálne lieky v anamnéze môžu byť precitlivení aj na meropeném/vaborbaktám. Pred začatím liečby liekom Vabomere je potrebné starostlivo preveriť predchádzajúce reakcie z precitlivenosti na betalaktámové antibiotiká.
Ak sa vyskytnú závažné alergické reakcie, liečba liekom Vabomere sa musí okamžite prerušiť a musia sa zaviesť príslušné núdzové opatrenia.
Záchvaty
Počas liečby meropenémom boli hlásené záchvaty (pozri časť 4.8).
Pacienti so známymi záchvatovými poruchami majú pokračovať v antikonvulzívnej liečbe. Pacienti, u ktorých sa vyvinie fokálny tremor, myoklonus alebo záchvaty, sa majú neurologicky vyšetriť a začať s antikonvulzívnou liečbou, ak ešte nebola podávaná. V prípade potreby sa má dávka meropenému/vaborbaktámu upraviť na základe renálnej funkcie (pozri časť 4.2). Alternatívne sa má liečba meropenémom/vaborbaktámom ukončiť (pozri časť 4.5).
Sledovanie funkciepečene
Počas liečby meropenémom/vaborbaktámom sa má starostlivo sledovať funkcia pečene vzhľadom na
riziko hepatotoxicity (hepatálnej dysfunkcie s cholestázou a cytolýzou) (pozri časť 4.8).
U pacientov s existujúcimi poruchami pečene je počas liečby meropenémom/vaborbaktámom potrebné sledovať funkciu pečene. Nie je potrebná úprava dávky (pozri časť 4.2).
Antiglobulínový test (Coombsov test) sérokonverzie
Počas liečby meropenémom/vaborbaktámom sa môže vyskytnúť pozitívny priamy alebo nepriamy
Coombsov test, ako sa pozoruje v prípade meropenému (pozri časť 4.8).
Hnačka súvisiacasbaktériou Clostridiumdifficile
Pri použití meropenému/vaborbaktámu bola hlásená hnačka súvisiaca s baktériou Clostridium difficile.
Tento stav môže mať rôznu závažnosť, od miernej hnačky až po fatálnu kolitídu, čo treba vziať do úvahy
v prípade pacientov, ktorí majú hnačku počas podávania alebo po podaní lieku Vabomere (pozri časť 4.8). Je potrebné zvážiť prerušenie liečby liekom Vabomere a podávanie špecifickej liečby proti
mikroorganizmu Clostridium difficile. Nemajú sa podávať lieky, ktoré inhibujú peristaltiku.
Súbežné použitieskyselinouvalproovou/valproátomsodným/valpromidom
Prípady uvedené v literatúre dokazujú, že súbežné podávanie karbapenémov vrátane meropenému
pacientom užívajúcim kyselinu valproovú alebo divalproex sodný môže znížiť plazmatické hladiny kyseliny valproovej na koncentrácie pod terapeutickým rozsahom v dôsledku tejto interakcie, čím sa zvýši riziko nečakaných záchvatov. Ak je podávanie lieku Vabomere nevyhnutné, treba zvážiť doplňujúcu antikonvulzívnu liečbu (pozri časť 4.5).
Obmedzenia klinickýchúdajov
Komplikované intraabdominálne infekcie
Použitie lieku Vabomere na liečbu pacientov s komplikovanými intraabdominálnymi infekciami je založené na skúsenostiach s meropenénom podávaným v monoterapii a na farmakokinetických- farmakodynamických analýzach meropenému/vaborbaktámu.
Pneumónia získaná v nemocnici vrátane pneumónie súvisiacej s umelou pľúcnou ventiláciou
Použitie lieku Vabomere na liečbu pacientov s pneumóniou získanou v nemocnici vrátane pneumónie súvisiacej s umelou pľúcnou ventiláciou je založené na skúsenostiach s meropenénom podávaným v
monoterapii a na farmakokinetických-farmakodynamických analýzach meropenému/vaborbaktámu.
Pacienti s obmedzenými možnosťami liečby
Použitie lieku Vabomere na liečbu pacientov s infekciami spôsobenými bakteriálnymi organizmami, ktorí majú obmedzené možnosti liečby, je založené na farmakokinetických/farmakodynamických analýzach
meropenému/vaborbaktámu a na obmedzených údajoch z randomizovaného klinického skúšania, v ktorom
bolo 32 pacientov liečených liekom Vabomere a 15 pacientov bolo liečených najlepšou dostupnou liečbou infekcií spôsobených organizmami rezistentnými voči karbapenému (pozri časť 5.1).
Spektrum aktivity meropenému/vaborbaktámu
Meropeném nevykazuje aktivitu proti mikroorganizmu Staphylococcus aureus rezistentnému voči
meticilínu (MRSA) a mikroorganizmu Staphylococcus epidermidis (MRSE) ani proti enterokokom rezistentným voči vankomycínu (VRE). Ak je známe, že tieto patogény prispievajú k infekčnému procesu alebo existuje takéto podozrenie, majú sa použiť alternatívne alebo ďalšie antibakteriálne lieky.
Inhibičné spektrum vaborbaktámu zahŕňa karbapenemázy triedy A (napríklad KPC) a karbapenemázy triedy C. Vaborbaktám neinhibuje karbapenemázy triedy D, ako je OXA-48, ani metalo-β-laktamázy triedy B, ako je NDM a VIM (pozri časť 5.1).
Necitlivé organizmy
Použitie meropenému/vaborbaktámu môže viesť k nadmernému rastu necitlivých organizmov, čo môže
vyžadovať prerušenie liečby alebo iné vhodné opatrenia.
Diéta s kontrolovanýmpríjmomsodíka
Liek Vabomere obsahuje 10,9 mmol (približne 250 mg) sodíka v injekčnej liekovke. To je potrebné vziať
do úvahy pri liečbe pacientov s diétou s kontrolovaným príjmom sodíka.
4.5 Liekové a iné interakcie
Pri súbežnom podávaní meropenému/vaborbaktámu s liekmi s úzkym terapeutickým oknom, ktoré sú prevažne metabolizované enzýmami CYP450 (napr. imunosupresíva, ako je takrolimus, everolimus a cyklosporín, lovastatín, midazolam, sildenafil a warfarín), je potrebná opatrnosť, pretože doteraz nie sú k dispozícii presvedčivé údaje, či môžu byť meropeném alebo vaborbaktám inhibítormi alebo induktormi enzýmov CYP450. Nie je známe, či by potenciálna interakcia mohla viesť k zvýšeným alebo zníženým plazmatickým koncentráciám, a preto je potrebné pacientov sledovať z hľadiska prejavov toxicity aj nedostatočnej účinnosti lieku s úzkym terapeutickým indexom.
Z in vitro údajov vyplýva, že vaborbaktám môže inhibovať CYP2D6 a riziko zvýšených plazmatických koncentrácií citlivých substrátov CYP2D6 in vivo nemožno vylúčiť. Pacientov užívajúcich substráty CYP2D6 s úzkym terapeutickým indexom (napr. dextrometorfán, dezipramín, venlafaxín a metoprolol) je potrebné sledovať z hľadiska prejavov toxicity.
Nie je známe, či meropeném podávaný v monoterapii interaguje s aktívnymi transportnými systémami.
Meropeném je substrátom OAT1 a OAT3, a preto probenecid súťaží s meropenémom o aktívnu tubulárnu sekréciu, a tak inhibuje renálnu exkréciu meropenému. Súbežné podávanie probenecidu s liekom Vabomere sa neodporúča, pretože môže viesť k zvýšeným plazmatickým koncentráciám meropenému.
Súbežné podávanie meropenému a kyseliny valproovej bolo spojené so znížením koncentrácie kyseliny valproovej a následnou stratou kontroly záchvatov. Z údajov z in vitro študií a štúdií na zvieratách vyplýva, že karbapenémy môžu inhibovať hydrolýzu glukuronidového metabolitu kyseliny valproovej (VPA g) späť na kyselinu valproovú, a tak znížiť sérové koncentrácie kyseliny valproovej. Preto sa má podávať doplňujúca antikonvulzívna liečba v prípade, že súbežné podávanie kyseliny valproovej a meropenému/vaborbaktámu je nevyhnutné (pozri časť 4.4).
Perorálne antikoagulanty
Súbežné podávanie antibakteriálnych liekov s warfarínom môže posilniť jeho antikoagulačný účinok.
Bolo hlásených veľa prípadov zvýšenia antikoagulačného účinku perorálne podávaných antikoagulantov vrátane warfarínu u pacientov, ktorí súbežne užívajú antibakteriálne lieky. Toto riziko sa môže líšiť v
závislosti od základnej infekcie, veku a celkového stavu pacienta, takže prispenie antibakteriálneho lieku k
zvýšeniu medzinárodného normalizovaného pomeru (INR) je ťažké posúdiť. Počas súbežného podávania a krátko po súbežnom podávaní lieku Vabomere s perorálnym antikoagulantom sa odporúča často
sledovať INR.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov (menej ako 300 ukončených gravidít)
o použití meropenému/vaborbaktámu u gravidných žien. Štúdie na zvieratách nepreukázali priame alebo nepriame účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3).
Ako preventívne opatrenie je vhodnejšie vyhnúť sa užívaniu lieku Vabomere počas gravidity. Dojčenie
Bolo hlásené, že meropeném sa vylučuje do ľudského mlieka. Nie je známe, či sa vaborbaktám vylučuje
do ľudského mlieka alebo do mlieka zvierat. Keďže riziko u novorodencov/dojčiat nemôže byť vylúčené, dojčenie sa musí pred začatím liečby prerušiť.
Fertilita
Účinky meropenému/vaborbaktámu na fertilitu u ľudí sa neskúmali. Zo štúdií na zvieratách
uskutočnených s meropenémom a vaborbaktámom nevyplývajú škodlivé účinky vzhľadom na fertilitu
(pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Vabomere má mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Počas liečby meropenénom podávaným v monoterapii boli hlásené záchvaty, najmä u pacientov liečených antikonvulzívami (pozri časť 4.4). Meropeném/vaborbaktám môže spôsobiť bolesť havy, parestéziu, letargiu a závraty (pozri časť 4.8). Pri vedení vozidiel alebo obsluhe strojov je preto potrebná opatrnosť.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Najčastejšie nežiaduce reakcie, ktoré sa vyskytli u 322 pacientov v spojených skúšaniach fázy 3, boli bolesť hlavy (8,1 %), hnačka (4,7 %), flebitída v mieste podania infúzie (2,2 %) a nauzea (2,2 %).
Závažné nežiaduce reakcie sa pozorovali u dvoch pacientov (0,6 %), jedna reakcia súvisiaca s infúziou a jeden prípad zvýšenia hladiny alkalickej fosfatázy v krvi. U jedného ďalšieho pacienta bola hlásená závažná nežiaduca reakcia súvisiaca s infúziou (0,3 %).
Tabuľkový zoznamnežiaducichreakcií
Pri použití meropenému podávaného v monoterapii a/alebo počas skúšaní fázy 3 s liekom Vabomere boli
hlásené nasledujúce nežiaduce reakcie. Nežiaduce reakcie sú klasifikované podľa frekvencie a triedy orgánových systémov. Nežiaduce reakcie uvedené v tabuľke s frekvenciou „neznáme“ sa nepozorovali u pacientov, ktorí sa zúčastnili na skúšaniach s liekom Vabomere alebo meropenémom, boli však hlásené po uvedení na trh len v prípade meropenému.
Frekvencie sú definované ako: veľmi časté (≥ 1/10), časté (≥ 1/100 až <1/10), menej časté (≥ 1/1 000 až
<1/100), zriedkavé (≥ 1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (nedá sa odhadnúť z dostupných údajov). V každej triede orgánových systémov sú nežiaduce účinky usporiadané v poradí
klesajúcej závažnosti.
Tabuľka 3: Frekvencia nežiaducich reakcií podľa triedy orgánových systémov
T
rieda orgánových systémov
Časté
(≥ 1/100 až < 1/10)
Menej časté
(≥ 1/1 000 až
< 1/100)
Zriedkavé
(≥ 1/10 000 až
< 1/1 000)
Neznáme
(nedá sa odhadnúť
z dostupných údajov)
Infekcie a nákazy Kolitída zapríčinená baktériou Clostridium difficile
Vulvovaginálna kandidóza
Poruchy krvi a lymfatického systému
Poruchy imunitného systému
Orálna kandidóza
Trombocytémia Leukopénia Neutropénia Eozinofília
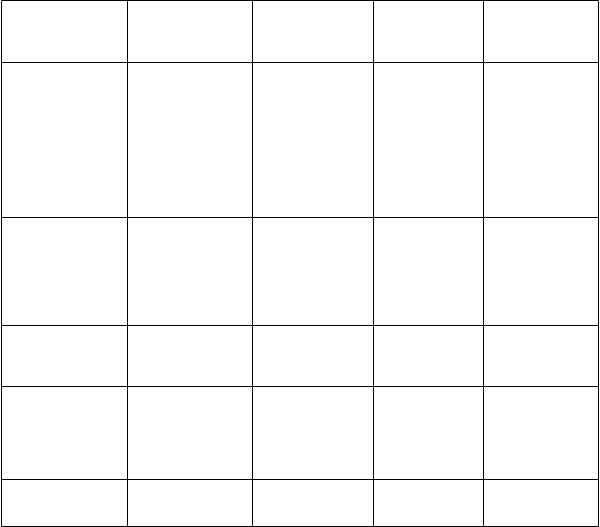
Trombocytopénia Anafylaktická reakcia
Agranulocytóza
Hemolytická anémia
Angioedém
Poruchy metabolizmu a výživy
Hypokaliémia
Hypoglykémia
Precitlivenosť
Znížená chuť do jedla
Hyperkaliémia
Hyperglykémia
Psychické poruchy Insomnia
Halucinácie
T
rieda orgánových systémov
Časté
(≥ 1/100 až < 1/10)
Menej časté
(≥ 1/1 000 až
< 1/100)
Zriedkavé
(≥ 1/10 000 až
< 1/1 000)
Neznáme
(nedá sa odhadnúť
z dostupných údajov)
Poruchy nervového
systému
Bolesť hlavy Tremor
Letargia
Závrat
Kŕče
Parestézia
Poruchy ciev Hypotenzia Flebitída
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Hnačka
Nauzea
Vracanie Zvýšená hladina alanínamino- transferázy
Zvýšená hladina aspartátamino- transferázy
Zvýšená hladina alkalickej fosfatázy v krvi
Bolesť ciev
Bronchospazmus
Abdominálna distenzia
Bolesť brucha
Zvýšená hladina bilirubínu v krvi
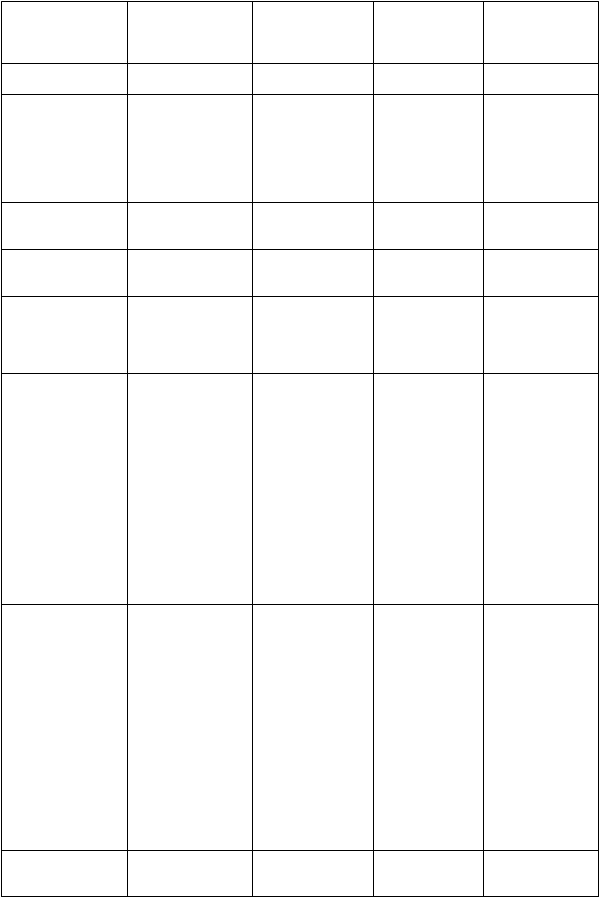
Poruchy kože a podkožného tkaniva
Poruchy obličiek a močových ciest
Zvýšená hladina
laktátdehydro- genázy v krvi
Pruritus Vyrážka Urtikária
Porucha funkcie obličiek
Toxická epidermálna nekrolýza
Stevens- Johnsonov syndróm
Multiformný erytém
Lieková reakcia s eozinofíliou a systémovými symptómami (syndróm DRESS)
T
rieda orgánových systémov
Celkové poruchy
a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Časté(≥ 1/100 až < 1/10)
Flebitída v mieste podania infúzie
Pyrexia
Menej časté(≥ 1/1 000 až
< 1/100) Inkontinencia
Zvýšená hladina kreatinínu v krvi
Zvýšená hladina močoviny v krvi Diskomfort v hrudníku
Reakcia v mieste podania infúzie
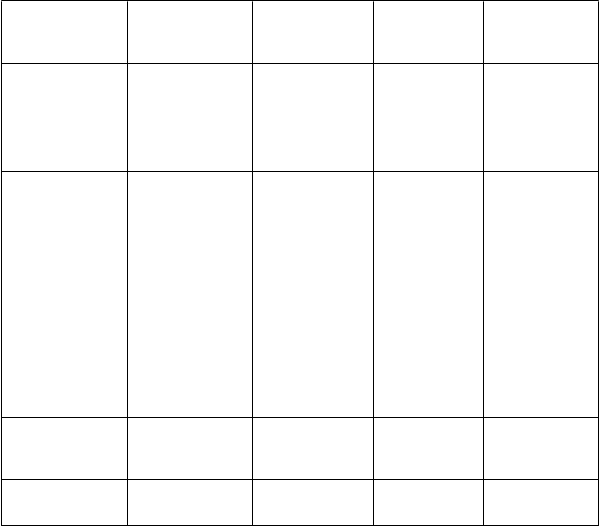
Erytém v mieste podania infúzie
Flebitída v mieste vpichu injekcie
Trombóza v mieste podania infúzie
Bolesť
Zvýšená hladina kreatínfosfokinázy v krvi
Reakcia súvisiaca s infúziou
Zriedkavé(≥ 1/10 000 až
< 1/1 000)
Neznáme(nedá sa odhadnúť
z dostupných údajov)
Priamy a nepriamy pozitívny Coombsov test
H
l
ásenie
podozrení
na
nežiaduce
r
eakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNie sú žiadne skúsenosti s predávkovaním liekom Vabomere.
Obmedzené skúsenosti s meropenémom podávaným v monoterapii po uvedení na trh naznačujú, že ak sa po predávkovaní vyskytnú nežiaduce reakcie, sú konzistentné s profilom nežiaducich reakcií opísaných
v časti 4.8, zvyčajne sú miernej závažnosti a po ukončení liečby alebo znížení dávky odznejú.
V prípade predávkovania prestaňte užívať liek Vabomere a zaveďte všeobecnú podpornú liečbu. U
jedincov s normálnou renálnou funkciou sa uskutoční rýchla renálna eliminácia.
Meropeném a vaborbaktám možno odstrániť hemodialýzou. U jedincov s renálnym ochorením v konečnom štádiu (ESRD), ktorým bol podaný 1 g meropenému a 1 g vaborbaktámu, bola priemerná celková obnova v dialyzáte po hemodialýze 38 % pre meropeném a 53 % pre vaborbaktám.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antibiotiká na systémové použitie, karbapenémy, ATC kód: J01DH52
Mechanizmus účinkuMeropeném pôsobí baktericídne tak, že inhibuje syntézu peptidoglykánovej bunkovej steny naviazaním na
esenciálne proteíny viažuce penicilín (PBP) a inhibíciou ich aktivity.
Vaborbaktám je non-beta laktámový inhibítor serínových betalaktamáz triedy A a triedy C vrátane karbapenemázy mikroorganizmu
Klebsiella pneumoniae, KPC. Pôsobí tak, že vytvorí kovalentne viazaný adukt s betalaktamázami a je stabilný voči hydrolýze sprostredkovanej betalaktamázami. Vaborbaktám neinhibuje enzýmy triedy B (metalo-β-laktamázy) ani karbapenemázy triedy D. Vaborbaktám nemá antibakteriálny účinok.
RezistenciaMechanizmy rezistencie u gramnegatívnych baktérií, o ktorých je známe, že ovplyvňujú
meropeném/vaborbaktám, zahŕňajú organizmy, ktoré produkujú metalo-β-laktamázy alebo oxacilinázy s karbapenemázovou aktivitou.
Mechanizmy bakteriálnej rezistencie, ktoré by mohli znížiť antibakteriálny účinok meropenému/vaborbaktámu, zahŕňajú mutácie génu pre porín ovplyvňujúce permeabilitu vonkajšej membrány a nadmernú expresiu efluxných púmp.
Antibakteriálny účinok v kombinácii s inýmiantibakteriálnymilátkamiV
in vitro štúdiách sa nepreukázal antagonizmus medzi meropenémom/vaborbaktámom a levofloxacínom,
tigecyklínom, polymyxínom, amikacínom, vankomycínom, azitromycínom, daptomycínom alebo linezolidom.
Hraničné hodnoty testovania citlivostiHraničné hodnoty minimálnej inhibičnej koncentrácie (MIC) stanovené Európskym výborom pre

testovanie antimikrobiálnej citlivosti (EUCAST) sú nasledovné:
O
rganizmy
Minimálne inhibičné koncentrácie (mg/l)
 C
it
l
i
vé Rezistentné
C
it
l
i
vé Rezistentné
 Enterobacteriaceae
Enterobacteriaceae ≤ 81 > 81
Pseudomonas aeruginosa ≤ 81 > 81

1Na účely testovania citlivosti je koncentrácia vaborbaktámu nastavená na 8 mg/l.
Farmakokinetický/farmakodynamický vzťahPreukázalo sa, že antimikrobiálny účinok meropenému najlepšie koreluje s percentom dávkovacieho'
intervalu, počas ktorého koncentrácie voľného meropenému v plazme prekračujú minimálnu inhibičnú koncentráciu meropenému. Pokiaľ ide o vaborbaktám, farmakokinetický/farmakodynamický index súvisiaci s antimikrobiálnym účinkom je pomer plazmatickej AUC voľného vaborbaktámu: MIC meropenému/vaborbaktámu.
K
l
i
n
i
cká účinnosťprotikonkrétnympatogénom
V klinických štúdiách sa preukázala účinnosť proti nasledujúcim patogénom, ktoré boli citlivé na
meropeném/vaborbaktám in vitro.
Komplikovaná infekcia močových ciest (cUTI) vrátane pyelonefritídy
Gramnegatívne mikroorganizmy:
· Escherichia coli
· Klebsiella pneumoniae
· Komplex druhu Enterobacter cloacae
Nestanovila sa klinická účinnosť proti nasledujúcim patogénom, ktoré sú relevantné pre schválené indikácie, hoci in vitro štúdie naznačujú, že by mohli byť citlivé na meropeném a/alebo meropeném/vaborbaktám v neprítomnosti získaných mechanizmov rezistencie.
Gramnegatívne mikroorganizmy:
· Citrobacter freundii
· Citrobacter koseri
· Enterobacter aerogenes
· Klebsiella oxytoca
· Morganella morganii
· Proteus mirabilis
· Druh Providencia
· Pseudomonas aeruginosa
· Serratia marcescens
Grampozitívne mikroorganizmy:
· Staphylococcus saprophyticus
· Staphylococcus aureus (len izoláty citlivé na meticilín)
· Staphylococcus epidermidis (len izoláty citlivé na meticilín)
· Streptococcus agalactiae
Anaeróbne mikroorganizmy:
· Bacteroides fragilis
· Bacteroides thetaiotaomicron
· Clostridium perfringens
· Peptoniphilus asaccharolyticus
· Druh Peptostreptococcus (vrátane mikroorganizmov P. micros, P anaerobius, P. magnus)
· Bacteroides caccae
· Prevotella bivia
· Prevotella disiens
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom Vabomere
v jednej alebo vo viacerých podskupinách pediatrickej populácie pre liečbu infekcií spôsobených gramnegatívnymi baktériami (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
D
i
stribúcia
Väzba meropenému na plazmatické proteíny je približne 2 %. Väzba vaborbaktámu na plazmatické
proteíny je približne 33 %.
Distribučný objem meropenému v rovnovážnom stave u pacientov po dávkach
2 g meropenému/2 g vaborbaktámu podávaných formou infúzie v trvaní 3 hodín každých 8 hodín bol
20,2 l a distribučný objem vaborbaktámu bol 18,6 l, z čoho vyplýva, že obidve zlúčeniny sa distribuujú do distribučného objemu zodpovedajúcemu kompartmentu extracelulárnej tekutiny.
Meropeném aj vaborbaktám penetrujú do ľudskej tekutiny bronchiálnej epiteliálnej výstelky (ELF), pričom plazmatická koncentrácia nenaviazaného meropenému je okolo 65 % a vaborbaktámu 79 %. Profily závislosti koncentrácie od času pre ELF a plazmu sú podobné.
Biotransformácia
Meropeném sa eliminuje väčšinou v nezmenenej forme. Asi 25 % podanej dávky sa eliminuje vo forme
inaktívneho otvoreného kruhu.
Vaborbaktám nepodlieha metabolizmu. Eliminácia
Terminálny polčas (t½) je 2,30 hodiny pre meropeném a 2,25 hodiny pre vaborbaktám.
Meropeném aj vaborbaktám sa vylučujú najmä cez obličky. Približne 40 – 60 % dávky meropenému sa vylúči v nezmenenej forme do 24 – 48 hodín a ďalších 25 % sa obnoví vo forme mikrobiologicky inaktívneho produktu hydrolýzy. Eliminácia meropenému obličkami viedla k vysokým terapeutickým koncentráciám v moči. Priemerný renálny klírens meropenému bol 7,7 l/h. Priemerný nerenálny klírens meropenému bol 4,8 l/h, ktorý zahŕňa elimináciu v stolici (~ 2 % dávky) a rozklad v dôsledku hydrolýzy.
Približne 75 až 95 % vaborbaktámu sa vylúči v nezmenenej forme v moči v priebehu 24 – 48 hodín. Eliminácia vaborbaktámu obličkami viedla k vysokým terapeutickým koncentráciám v moči. Priemerný renálny klírens vaborbaktámu bol 10,5 l/h.
Linearita/nelinearita
Cmax a AUC meropenému a vaborbaktámu sú v skúmanom dávkovom rozsahu lineárne (1 g až 2 g pre meropeném a 0,25 g až 2 g pre vaborbaktám) pri podaní vo forme jednej 3-hodinovej intravenóznej
infúzie. Po viacerých intravenóznych infúziách podávaných každých 8 hodín počas 7 dní sa u jedincov s normálnou renálnou funkciou meropeném ani vaborbaktám neakumuluje.
Osobitné populácie
Porucha funkcie obličiek
Vo farmakokinetických štúdiách s meropenénom a vaborbaktámom u pacientov s poruchou funkcie obličiek sa preukázalo, že plazmatický klírens meropenému aj vaborbaktámu koreluje s klírensom kreatinínu.
Porucha funkcie pečene
Keďže meropeném/vaborbaktám nepodliehajú metabolizmu v pečeni, neočakáva sa, že systémový klírens meropenému/vaborbaktámu bude ovplyvnený poruchou funkcie pečene.
Starší pacienti
Farmakokinetické údaje z populačnej farmakokinetickej analýzy preukázali zníženie plazmatického klírensu meropenému/vaborbaktámu, čo koreluje so znížením klírensu kreatinínu súvisiacim s vekom.
Pohlavie a rasa
Na základe populačnej farmakokinetickej analýzy sa nezistil žiadny vplyv pohlavia ani rasy na farmakokinetiku meropenému a vaborbaktámu.
5.3 Predklinické údaje o bezpečnosti
Meropeném
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, reprodukčnej
toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí. S meropenémom sa neuskutočnili štúdie karcinogenity.
Vaborbaktám
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, reprodukčnej
toxicity a genotoxicity neodhalili žiadne osobitné riziko pre ľudí. S vaborbaktámom sa neuskutočnili štúdie karcinogenity.
V štúdiách toxicity po opakovanom podávaní u psov sa po 14 dňoch expozície vaborbakámu podávaného v monoterapii a po 28 dňoch expozície kombinácii meropenému/vaborbaktámu pozoroval minimálny zápal pečene.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Uhličitan sodný
6.2 Inkompatibility
Liek Vabomere nie je chemicky kompatibilný s roztokmi obsahujúcimi glukózu. Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
3 roky
Po rekonštitúcii
Rekonštituovaná injekčná liekovka sa má ďalej okamžite zriediť.
Po zriedení
Preukázalo sa, že chemická a fyzikálna stabilita pri používaní je až 4 hodiny pri teplote 25 °C alebo do
22 hodín pri teplote 2 – 8 °C.
Z mikrobiologického hľadiska sa má liek po rekonštitúcii a zriedení použiť okamžite.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25 °C.
Podmienky na uchovávanie po rekonštitúcii a riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
50 ml injekčná liekovka z číreho skla (typu I) s gumovou (brómbutylovou) zátkou a hliníkovou obrubou s vyklápacím viečkom.
Liek sa dodáva v baleniach obsahujúcich 6 injekčných liekoviek.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pri príprave a podávaní roztoku sa musia používať štandardné aseptické metódy. Prášok na infúzny koncentrát sa musí pred použitím rekonštituovať a ďalej zriediť.
Rekonštitúcia
Z 250 ml infúzneho vaku s injekčným roztokom chloridu sodného 9 mg/ml (0,9 %) sa má pre každú
injekčnú liekovku natiahnuť 20 ml injekčného roztoku chloridu sodného 9 mg/ml (0,9 %) (normálny fyziologický roztok) a rekonštituovať príslušným počtom injekčných liekoviek meropenému/vaborbaktámu na zodpovedajúce dávkovanie lieku Vabomere:
· Rekonštituujte 2 injekčné liekovky pre dávku lieku Vabomere 2 g/2 g
· Rekonštituujte 1 injekčnú liekovku pre dávky lieku Vabomere 1 g/1 g a 0,5 g/0,5 g
Po jemnom zamiešaní kvôli rozpusteniu bude mať rekonštituovaný roztok meropenému/vaborbaktámu približnú koncentráciu meropenému 0,05 g/ml a približnú koncentráciu vaborbaktámu 0,05 g/ml. Konečný objem je približne 21,3 ml. Rekonštituovaný roztok nie je určený na priamu injekciu. Rekonštituovaný roztok sa musí pred podaním intravenóznej infúzie zriediť.
Riedenie
Na prípravu dávky lieku Vabomere 2 g/2 g na intravenóznu infúziu: Ihneď po rekonštitúcii dvoch
injekčných liekoviek sa má z každej z dvoch injekčných liekoviek natiahnuť celý obsah rekonštituovaných injekčných liekoviek a pridať späť do 250 ml infúzneho vaku s injekčným roztokom chloridu sodného
9 mg/ml (0,9 %) (normálny fyziologický roztok). Konečná koncentrácia meropenému a vaborbaktámu na infúziu bude asi 8 mg/ml pre každé liečivo.
Na prípravu dávky lieku Vabomere 1 g/1 g na intravenóznu infúziu: Ihneď po rekonštitúcii jednej injekčnej liekovky sa má z injekčnej liekovky natiahnuť celý obsah rekonštituovanej injekčnej liekovky a pridať späť do 250 ml infúzneho vaku s injekčným roztokom chloridu sodného 9 mg/ml (0,9 %)
(normálny fyziologický roztok). Konečná koncentrácia meropenému a vaborbaktámu na infúziu bude asi
4 mg/ml pre každé liečivo.
Na prípravu dávky lieku Vabomere 0,5 g/0,5 g na intravenóznu infúziu: Ihneď po rekonštitúcii jednej injekčnej liekovky sa má z injekčnej liekovky natiahnuť 10,5 ml obsahu rekonštituovanej injekčnej liekovky a pridať späť do 250 ml infúzneho vaku s injekčným roztokom chloridu sodného 9 mg/ml
(0,9 %) (normálny fyziologický roztok). Konečná koncentrácia meropenému a vaborbaktámu na infúziu bude 2 mg/ml pre každé liečivo.
Zriedený roztok treba pred podaním vizuálne skontrolovať, či neobsahuje pevné častice. Zriedený roztok je číry až svetložltý.
Po zriedení sa má infúzia podať do 4 hodín, ak sa uchováva pri teplote 25 °C, alebo do 22 hodín, ak sa uchováva v chladničke pri teplote 2 – 8 °C.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIRempex London Ltd
115L Milton Park Abingdon Oxfordshire
OX14 4SA
SPOJENÉ KRÁĽOVSTVO
8. REGISTRAČNÉ ČÍSLOEU/1/18/1334/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.