
4.5 Liekové a iné interakcie
Trumenba sa môže podávať súbežne s ktoroukoľvek z týchto očkovacích látok: kombinovanou očkovacou látkou proti toxoidu tetanu, redukovanému toxoidu záškrtu, čiernemu kašľu (acelulárna zložka) a poliovírusu (inaktivovaná zložka) (TdaP-IPV), kvadrivalentnou očkovacou látkou
proti ľudskému papilomavírusu (HPV4), konjugovanou očkovacou látkou proti meningokokom skupín
A, C, Y a W (MenACWY) a kombinovanou očkovacou látkou proti toxoidu tetanu, redukovanému toxoidu záškrtu a čiernemu kašľu (acelulárna zložka) (Tdap).
Pri podaní s inými očkovacími látkami musí byť Trumenba podaná na inom mieste podania injekcie. Trumenba sa nesmie miešať s inými očkovacími látkami v rovnakej injekčnej striekačke.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití očkovacej látky Trumenba u gravidných žien. Možné riziko
pre gravidné ženy nie je známe. Napriek tomu nemá byť očkovanie odmietnuté v prípadoch, kedy existuje jednoznačné riziko vystavenia meningokokovej infekcii.
Štúdie na samiciach králikov nepreukázali žiadne poruchy plodnosti u samíc alebo poškodenie plodu spôsobené očkovacou látkou Trumenba.
Dojčenie
Nie je známe, či sa Trumbenba vylučuje do ľudského mlieka. Trumbenba by mala byť použitá
počas dojčenia len v prípadoch, kedy možné výhody prevažujú nad možnými rizikami.
Fertilita
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska fertility u samíc
(pozri časť 5.3).
Účinky očkovacej látky Trumenba na fertilitu u samcov neboli posúdené.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Trumenba nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Avšak niektoré z účinkov spomenuté v časti 4.8 môžu dočasne ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Prezentovaný bezpečnostný profil je založený na analýze 15 000 účastníkov (vo veku 10 rokov
a starších), ktorí boli očkovaní aspoň 1 dávkou očkovacej látky Trumenba v 11 ukončených klinických štúdiách. Najčastejšími pozorovanými nežiaducimi reakciami bola bolesť, začervenanie a opuch
v mieste očkovania, bolesť hlavy, únava, zimnica, hnačka, bolesť svalov, bolesť kĺbov a nauzea.
Nežiaduce reakcie po posilňovacej dávke u 268 osôb vo veku 15 až 23 rokov boli podobné ako nežiaduce reakcie počas primárnej očkovacej série Trumenbou približne o 4 roky skôr.
Z
o
znam nežiaducichreakciíNežiaduce reakcie hlásené v klinických štúdiách sú zoradené podľa klesajúcej frekvencie výskytu a
závažnosti a sú roztriedené do nasledujúcich kategórií:
Veľmi časté (≥ 1/10) Časté (≥ 1/100 až < 1/10)
Menej časté (≥ 1/1 000 až < 1/100) Zriedkavé (≥ 1/10 000 až < 1/1 000) Veľmi zriedkavé (< 1/10 000) Neznáme (z dostupných údajov)
PoruchyimunitnéhosystémuNeznáme: Alergické reakcie*
PoruchynervovéhosystémuVeľmi časté: Bolesť hlavy
Poruchygastrointestinálnehotraktu Veľmi časté: Hnačka; nauzea Časté: Vracanie
PoruchykostrovejasvalovejsústavyaspojivovéhotkanivaVeľmi časté: Bolesť svalov (myalgia); bolesť kĺbov (artralgia)
CelkovéporuchyareakcievmiestepodaniaVeľmi časté: Zimnica; únava; začervenanie (erytém), opuch (indurácia) a bolesť v mieste vpichu
Časté: Horúčka ≥ 38 °C (pyrexia)
*Nasledujúca reakcia je považovaná za nežiaducu reakciu na očkovaciu látku Trumenba a bola hlásená po jej uvedení na trh. Pretože táto reakcia bola odvodená zo spontánnych hlásení, jej frekvencia výskytu nemohla byť stanovená, a preto je považovaná za neznámu.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieSkúsenosti s predávkovaním sú obmedzené. V prípade predávkovania sa odporúča sledovať vitálne funkcie a možná symptomatická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: očkovacie látky; ATC kód: J07AH09
Mechanizmus účinkuTrumenba je očkovacia látka pozostávajúca z 2 variantov rekombinantného lipidovaného proteínu
viažuceho faktor H (fHbp). fHbp sa nachádza na povrchu meningokokových baktérií a je pre baktérie nevyhnutný, keďže im umožňuje vyhnúť sa imunitnej obrane hostiteľa. Varianty fHbp sa delia do 2
imunologicky rozdielnych podskupín A a B, a viac ako 96 % izolátov meningokokovej séroskupiny B
v Európe exprimuje na bakteriálnom povrchu varianty fHbp z týchto podskupín.
Imunizácia očkovacou látkou Trumenba, ktorá obsahuje jeden variant fHbp z podskupiny A a jeden
z podskupiny B, je určená na stimuláciu produkcie baktericídnych protilátok, ktoré rozpoznávajú fHbp exprimovaný meningokokmi. Test Meningococcal Antigen Surface Expression (MEASURE) bol vyvinutý, aby dal do súvislosti úroveň povrchovej expresie fHbp s usmrcovaním meningokokových kmeňov séroskupiny B v testoch baktericídnej aktivity séra využívajúcich ľudský komplement
(hSBA). Prehľad viac ako 2150 rozdielnych invazívnych izolátov meningokokovej séroskupiny B
zozbieraných v rokoch 2000-2014 v 7 európskych štátoch, USA a Kanade preukázal, že viac ako 91 % všetkých izolátov meningokokovej séroskupiny B exprimovalo dostatočné hladiny fHbp, aby boli citlivé na baktericídne usmrcovanie protilátkami indukovanými očkovacou látkou.
Klinická účinnosťÚčinnosť očkovacej látky Trumenba nebola posúdená v klinických štúdiách. Účinnosť očkovacej látky
bola odvodená z preukázania indukcie tvorby sérových baktericídnych protilátok proti 4 testovaným meningokokovým kmeňom séroskupiny B (pozri časť Imunogenita). 4 testované kmene exprimovali varianty fHbp predstavujúce 2 podskupiny (A a B) a spolu predstavujú meningokokové kmene séroskupiny B spôsobujúce invazívne ochorenie.
ImunogenitaOchrana pred invazívnym meningokokovým ochorením je sprostredkovaná sérovými baktericídnymi
protilátkami proti povrchovým antigénom baktérií. Baktericídne protilátky účinkujú pri usmrcovaní meningokokov spolu s ľudským komplementom. Tento dej je meraný
in vitro testami stanovujúcimi
baktericídnu aktivitu séra proti meningokokom séroskupiny B pomocou ľudského komplementu
(hSBA). Titer hSBA väčší alebo rovný 1:4 sa považuje za ochranný proti meningokokovým ochoreniam. V analýze imunogenity očkovacej látky Trumenba bola odpoveď definovaná ako titer
hSBA aspoň 1:8 alebo 1:16 v závislosti od kmeňa hSBA. 4-násobné zvýšenie titra hSBA v každom
zo 4 primárnych testovaných kmeňov meningokokov séroskupiny B bolo definované nasledovne: (1) U jedincov so základným titrom hSBA < 1:4 bola odpoveď v podobe 4-násobného zvýšenia definovaná ako titer hSBA ≥ 1:16. (2) U jedincov so základným titrom hSBA ≥ 1:4 bola odpoveď v podobe 4-násobného zvýšenia definovaná ako titer hSBA ≥ 4-násobok dolného limitu stanovenia
alebo ≥ 4-násobok základného titra, pričom platí vyššia hodnota. Zložená odpoveď bola definovaná ako odpoveď pri všetkých 4 kmeňoch hSBA kombinovane.
Imunogenita očkovacej látky Trumenba po 2 alebo 3 očkovaniach bola posúdená u jedincov vo veku
11 až 18 rokov v Európe (Štúdia B1971012) a po 3 očkovaniach u jedincov vo veku 10 až 25 rokov na celom svete (Štúdie B1971009 a B1971016).
V štúdii B1971012 bola Trumenba podávaná podľa nasledujúcich schém: Skupina 1 (0, 1 a 6 mesiacov); Skupina 2 (0, 2 a 6 mesiacov); Skupina 3 (0 a 6 mesiacov); Skupina 4 (0 a 2 mesiace); Skupina 5 (0 a 4 mesiace). Z 1 713 randomizovaných jedincov bolo 427 v skupine 1, 430 v skupine 2,
427 v skupine 3, 286 v skupine 4 a 143 v skupine 5. Všetkým jedincom boli podané v rámci štúdie
4 injekcie, buď 2 alebo 3 dávky očkovacej látky Trumenba a 1 alebo 2 dávky fyziologického roztoku. Odpovede v zmysle tvorby sérových baktericídnych protilátok po druhej alebo tretej dávke
v skupinách 1, 2 a 3 sú uvedené v tabuľkách 1 a 2.
Pri druhej a tretej dávke bolo sérum získané približne 1 mesiac po podaní druhej alebo tretej dávky očkovacej schémy.
Tabuľka 1: Imunitné odpovede medzi jedincami vo veku 11 až 18 rokov, ktorým bola podaná Trumenba, po rôznych 2- a 3-dávkových schémach (Štúdia B1971012)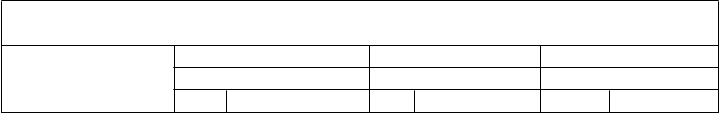 Skupina 1 Skupina 2 Skupina 3(0, 1 a 6 mesiacov) (0, 2 a 6 mesiacov) (0 a 6 mesiacov) N % N % N %
Skupina 1 Skupina 2 Skupina 3(0, 1 a 6 mesiacov) (0, 2 a 6 mesiacov) (0 a 6 mesiacov) N % N % N %
Kmeň hSBA (variant fHbp)
(95 % IS) (95 % IS) (95 % IS)
Dávka
% hSBA ≥ 1:16
Dávka
2 351
73,5 (68,6; 78,0)
34 88,1
4 (84,2; 91,3) 369
93,2 (90,2; 95,6)
PMB80
Dávka
3 360
91,4 (88,0; 94,1)
35 95,0
7 (92,1; 97,0)
-- --
(A22)
≥
4-násobný nárast titra hSBA (%)
Dávka
2 343
Dávka
3 351
% hSBA ≥ 1:8
Dávka
55,7
(50,3; 61,0) 336
78,1
(73,4; 82,3) 349
96,6
73,8 (68,8; 78,4)
84,0 (79,7; 87,6)
97,9
362 80,7 (76,2; 84,6)
-- --
98,4
2 353
(94,1; 98,2) 339
(95,8; 99,2) 370
(96,5; 99,4)
PMB2001
Dávka
3 362
99,4
(98,0; 99,9) 359
98,9 (97,2; 99,7)
-- --
(A56)
≥
4-násobný nárast titra hSBA (%)
Dávka
2 338
Dávka
3 347
% hSBA ≥ 1:8
Dávka
86,1
(81,9; 89,6) 327
93,4
(90,2; 95,8) 347
62,2
90,5 (86,8; 93,5)
94,2 (91,2; 96,4)
70,3
354 90,4 (86,8; 93,3)
-- --
81,1
2 344
(56,9; 67,4) 337
(65,1; 75,2) 359
(76,6; 85,0)
PMB2948
Dávka
3 354
89,0
(85,2; 92,0) 354
88,4 (84,6; 91,6)
-- --
(B24)
≥
4-násobný nárast titra hSBA (%)
Dávka
2 341
Dávka
3 351
% hSBA ≥ 1:8
47,2
(41,8; 52,7) 333
74,6
(69,8; 79,1) 350
54,1 (48,5; 59,5)
75,4 (70,6; 79,8)
357 65,5 (60,4; 70,5)
-- --
Dávka
2 341
54,0 (48,5; 59,3)
33 61,9
1 (56,5; 67,2) 356
77,5 (72,8; 81,8)
PMB2707
Dávka
3 356
88,5 (84,7; 91,6)
35 86,1
2 (82,0; 89,5)
-- --
(B44)
≥
4-násobný nárast titra hSBA (%)
Dávka
2 339
Dávka
3 354
43,4
(38,0; 48,8) 328
82,2
(77,8; 86,0) 349
55,2 (49,6; 60,6)
81,7 (77,2; 85,6)
355 66,8 (61,6; 71,6)
-- --
Zložená odpoveď (Odpoveď pri všetkých 4 kmeňoch hSBA kombinovane)
Pred
dávkou 1 339
3,5
(1,8; 6,1) 333
2,4
(1,0; 4,7) 345
3,2 (1,6; 5,6)
Dávka 2 45,1
(39,5; 50,9) 311
54,3
(48,6; 60,0) 343
73,5 (68,5; 78,1)
Dávka 3 83,1
(78,6; 86,9) 345
81,7 (77,3; 85,7)
-- --
Skratky: hSBA = test baktericídnej aktivity séra využívajúci ľudský komplement; fHbp = proteín viažuci faktor H. Poznámka: Dolný limit stanovenia je titer hSBA = 1:16 pri PMB80 (A22) a 1:8 pri PMB2001 (A56), PMB2948
(B24) a PMB2707 (B44).
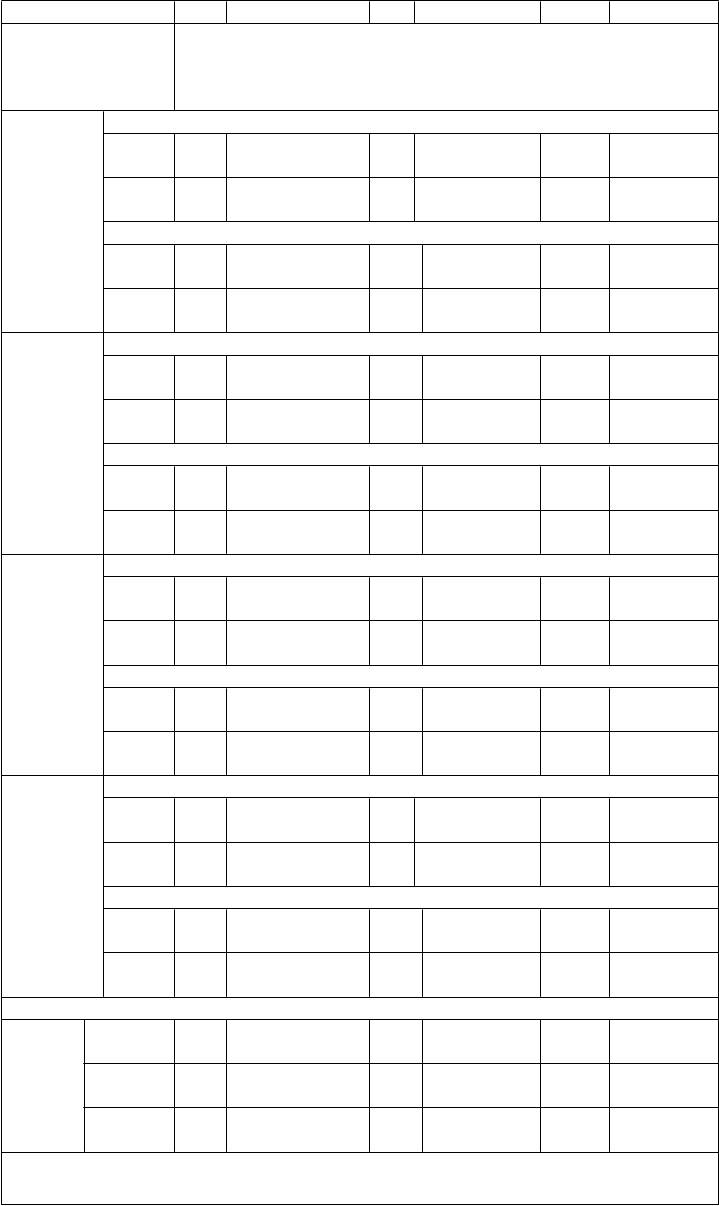
Tabuľka 2: Imunitné odpovede medzi jedincami vo veku 11 až 18 rokov, ktorým bola podaná Trumenba, po rôznych 2- a 3-dávkových schémach (Štúdia B1971012)
Skupina 1 Skupina 2 Skupina 3
(0, 1 a 6 mesiacov) (0, 2 a 6 mesiacov) (0 a 6 mesiacov)
Kmeň hSBA (variant fHbp)
N GMT (95 % IS)
N GMT (95 % IS)
N GMT (95 % IS)
Dávka
GMT hSBA
PMB80 (A22)
Dávka
2
Dávka
351 29,0 (26,0; 32,5)
58,4
344 35,6 (32,2; 39,4)
58,3
369 50,6 (45,9; 55,8)
--
PMB200
3 360
GMT hSBADávka
2 353
(52,4; 64,9) 357

77,3
(68,5; 87,1) 339
(53,2; 63,9)
94,6
(84,6; 105,7) 370
125,6 (112,6; 140,2)
1 (A56)
Dávka
3 362 152,9
(137,2; 170,5)
GMT hSBA155,6 (140,4;
172,4)
-- --
PMB294
8 (B24)
Dávka
2
Dávka
344 13,8 (12,2; 15,6)
29,1
337 14,9 (13,2; 16,7)
25,6
359 20,6 (18,4; 23,2)
-- --
3 354
GMT hSBA
(25,9; 32,7) 354
(23,0; 28,5)
PMB270
7 (B44)
Dávka
2
Dávka
341 13,1 (11,3; 15,1)
40,3
331 15,5 (13,5; 17,9)
35,0
356 22,5 (19,6; 25,7)
-- --
3 356
(35,2; 46,1) 352
(30,6; 39,9)
Skratky: GMT = geometrický priemer titrov; hSBA = test baktericídnej aktivity séra využívajúci ľudský komplement; fHBP = proteín viažuci faktor H.
Štúdia B1971009 bola randomizovaná, multicentrická štúdia 3. fázy s aktívnou kontrolou a
zaslepeným pozorovateľom, v ktorej jedinci vo veku 10 až 18 rokov obdržali 1 z 3 šarží (skupiny 1, 2 a 3) očkovacej látky Trumenba alebo aktívnu kontrolu skladajúcu sa z očkovacej látky proti vírusu hepatitídy A (HAV) a fyziologického roztoku. Celkovo 2 693 účastníkov štúdie obdržalo aspoň
1 dávku očkovacej látky Trumenba a 897 obdržalo aspoň 1 dávku očkovacej látky proti vírusu hepatitídy A (HAV) a fyziologický roztok. Štúdia posudzovala bezpečnosť, znášanlivosť, imunogenitu
a schopnosť vyrobiteľnosti 3 šarží očkovacej látky Trumenba podanej podľa schémy 0, 2 a 6
mesiacov. Odpovede v zmysle tvorby sérových baktericídnych protilátok po tretej dávke v skupine 1
sú uvedené v tabuľkách 3 a 4. Výsledky zo skupín 2 a 3 nie sú prezentované, keďže boli vyhodnotené iba 2 reprezentatívne kmene. Podobné výsledky ako v skupine 1 boli pozorované v skupinách 2 a 3.
Štúdia B1971016 bola randomizovaná, placebom kontrolovaná, multicentrická štúdia 3. fázy so zaslepeným pozorovateľom, v ktorej boli jedinci vo veku 18 až 25 rokov rozdelení do 2 skupín
v pomere 3:1 (Skupina 1: Skupina 2). Skupine 1 bola Trumenba podaná v mesiacoch 0, 2 a 6. Skupine
2 bol podaný fyziologických roztok v mesiacoch 0, 2 a 6. Celkovo 2471 účastníkom štúdie bola podaná očkovacia látka Trumenba a 822 fyziologický roztok. Odpovede v zmysle tvorby sérových
baktericídnych protilátok pozorované po tretej dávke v skupinách 1 a 2 sú uvedené v tabuľkách 3 a 4.
Sérum bolo získané približne 1 mesiac po očkovaní.
Tabuľka 3. Imunitné odpovede medzi jedincami vo veku 10 až 25 rokov 1 mesiac po podaní tretej dávky očkovacej látky Trumenba alebo kontroly, ktoré boli aplikované podľa schémy 0, 2 a 6 mesiacov (štúdia B1971009 a štúdia B1971016)
Štúdia B1971009 (vek 10-18 rokov) Štúdia B1971016 (vek 18-25 rokov) Skupina 1 Skupina 4 Skupina 1 Skupina 2
Trumenba HAV/fyziologic ký roztok
T
rumenba Fyziologický roztok
Kmeň hSBA (variant fHbp)
N %
(95 % IS)
N %
(95 % IS)
N %
(95 % IS)
N %
(95 % IS)
PMB80 (A22)
% hSBA ≥ 1:16
1266
97,8 (96,8;
98,5)
749
34,0 (30,7;
37,6)
1714
93,5 (92,2;
94,6)
577
36,6 (32,6;
40,6)
≥
4-násobný nárast titra hSBA (%)
83,2
9,6
80,5
1225
% hSBA ≥ 1:8
(81,0;
85,2)
99,5
730
(7,6;
12,0)
27,5
1695
(78,6;
82,4)
99,4
568 6,3 (4,5; 8,7)
34,2
PMB200
1 (A56)
122
9
(98,9;
99,8)
363
(23,0;
32,5)
1708
(98,9;
99,7)
552
(30,3;
38,4)
≥
4-násobný nárast titra hSBA (%)
112
8
% hSBA ≥ 1:8
90,2 (88,4;
91,9)
87,1
337
11,3 (8,1;
15,1)
1642
90,0 (88,4;
91,4)
95,1
533
10,3 (7,9 13,2)
30,2
PMB294
8 (B24)
125
0
(85,1;
88,9)
762 7,0 (5,3; 9,0)
1702
(93,9;
96,0)
573
(26,5;
34,1)
≥
4-násobný nárast titra hSBA (%)
123
5
% hSBA ≥ 1:8
79,8 (77,4;
82,0)
89,3
752
2,7
(1,6; 4,1) 1675
79,3 (77,3;
81,2)
87,4
562 5,5 (3,8; 7,7)
11,4
PMB270
7 (B44)
121
0
(87,4;
90,9)
393 5,3 (3,3; 8,1)
1703
(85,8;
89,0)
577
(9,0;
14,3)
≥
4-násobný nárast titra hSBA (%)
120
3
85,9 (83,8;
87,8)
391
1,0 (0,3; 2,6)
1696 79,6 (77,6;
81,5)
573 1,6 (0,7; 3,0)
Zložená odpoveď (Odpoveď pri všetkých 4 kmeňoch hSBA kombinovane)
Pred dávkou 1
108
8
1,1
(0,6; 1,9) 354
2,0 (0,8; 4,0)
1612 7,3 (6,0; 8,6)
541 6,1 (4,2; 8,5)
Dávka 3 117
0
83,5
(81,3;
85,6)
353 2,8 (1,4; 5,1)
1664 84,9 (83,1;
86,6)
535
7,5 (5,4;
10,0)

Skratky: hSBA = test baktericídnej aktivity séra využívajúci ľudský komplement; fHbp = proteín viažuci faktor H. Poznámka: Dolný limit stanovenia je titer hSBA = 1:16 pri PMB80 (A22) a 1:8 pri PMB2001 (A56), PMB2948 (B24) a PMB2707 (B44).
Tabuľka 4. Imunitné odpovede medzi jedincami vo veku 10 až 25 rokov 1 mesiac po podaní tretej dávky očkovacej látky Trumenba alebo kontroly, ktoré boli aplikované podľa schémy 0,
2 a 6 mesiacov (štúdia B1971009 a B1971016)
Štúdia B1971009 (vek 10-18 rokov) Štúdia B1971016 (vek 18-25 rokov) Skupina 1 Skupina 4 Skupina 1 Skupina 2
Trumenba HAV/fyziologický
roztok
Trumenba Fyziologický roztok
Kmeň hSBA (variant fHbp)
PMB80
N GMT (95 % IS)
N GMT (95 % IS)
749 12,6
N GMT (95 % IS)
N GMT (95 % IS)
(A22) 1266 86,8 (82,3; 91,5)
(12,0;
13,4)
1714 74,3 (70,2; 78,6)
577 13,2 (12,4; 14,1)
PMB2001
(A56) 1229
PMB2948
222,5 (210,1;
235,6)
24,1
363 8,8 (7,6; 10,1)
4,5
1708
176,7 (167,8;
186,1)
49,5
552 9,1 (8,2; 10,1)
7,2
(B24) 1250
PMB2707
(B44) 1210
(22,7; 25,5) 762
50,9
(47,0; 55,2) 393
(4,4; 4,7) 1702
4,4
(4,2; 4,6) 1703
(46,8; 52,4) 573
47,6
(44,2; 51,3) 577
(6,6; 7,8)
4,8 (4,6; 5,1)
Skratky: GMT = geometrický priemer titrov; hSBA = test baktericídnej aktivity séra využívajúci ľudský komplement;
fHbp = proteín viažuci faktor H.
V štúdiách B1971009 a B1971016 bol vyhodnotený podiel jedincov, ktorí dosiahli definovaný titer
hSBA po 3 dávkach očkovacej látky Trumenba podanej podľa schémy 0, 2, 6 mesiacov proti panelu
10 ďalších kmeňov, z ktorých každý exprimoval iný variant fHbp (Tabuľka 5). Tieto ďalšie kmene hSBA podporujú a rozširujú šírku pokrytia očkovacou látkou, ktoré bolo demonštrované
4 reprezentatívnymi primárnymi kmeňmi (Tabuľky 3 a 4).
Sérum bolo získané približne 1 mesiac po očkovaní.
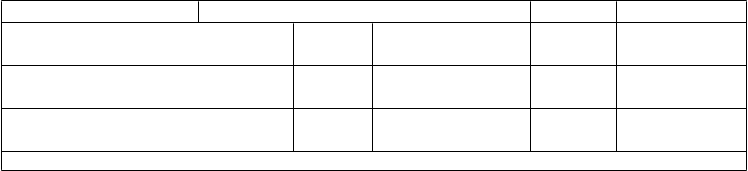
Tabuľka 5. Imunitné odpovede medzi jedincami vo veku 10 až 25 rokov proti 10 ďalším kmeňom 1 mesiac po podaní tretej dávky očkovacej látky Trumenba, ktoré boli aplikované podľa schémy 0, 2 a 6 mesiacov (štúdia B1971009 a štúdia B1971016)
Štúdia B1971009 Štúdia B1971016 (vek 10 až 18 rokov) (vek 18 až 25 rokov)
N % (95 % IS) N % (95 % IS)
Kmeň hSBA (variant fHbp)
Dávka
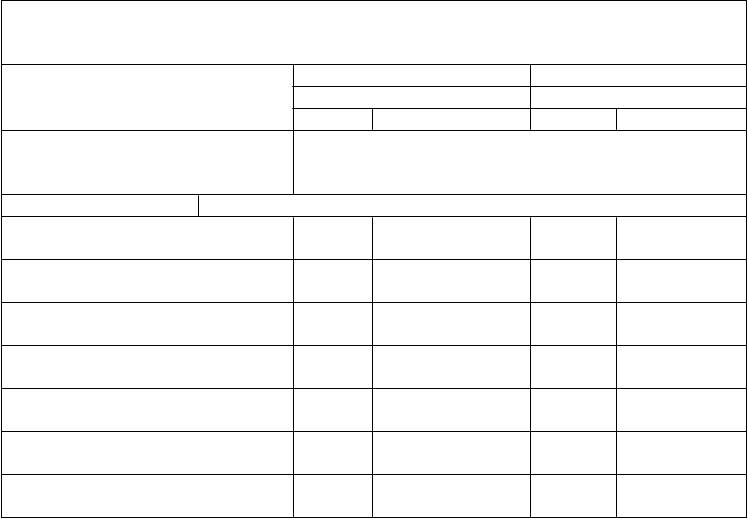 % hSBA ≥ 1:8
% hSBA ≥ 1:8
 PMB3040 (A07)
PMB3040 (A07) 280 96,4 (93,5; 98,3)
PMB1672 (A15) 266 87,2 (82,6; 91,0)
PMB3175 (A29) 278 98,6 (96,4; 99,6)
PMB1256 (B03) 279 92,5 (88,7; 95,3)
PMB866 (B09) 276 86,2 (81,6; 90,1)
PMB431 (B15) 281 98,2 (95,9; 99,4)
PMB648 (B16) 278 81,7 (76,6; 86,0)
277 95,7 (92,6; 97,7)
279 91,8 (87,9; 94,7)
283 99,3 (97,5; 99,9)
273 86,4 (81,8; 90,3)
274 77,0 (71,6; 81,9)
276 96,7 (93,9; 98,5)
273 78,0 (72,6; 82,8)
 % hSBA ≥ 1:16
PMB3010 (A06)
% hSBA ≥ 1:16
PMB3010 (A06) 280 95,7 (92,6; 97,8)
PMB824 (A12) 277 75,1 (69,6; 80,1)
PMB1989 (A19) 275 92,7 (89,0; 95,5)
275 92,0 (88,1; 94,9)
275 71,3 (65,5; 76,5)
284 95,8 (92,7; 97,8)
Skratky: hSBA = test baktericídnej aktivity séra využívajúci ľudský komplement; fHbp = proteín viažuci faktor H.
Pretrvávanieimunitnejodpovedeaodpoveďnaposilňovacieočkovanie
Štúdia B1971033 je otvorená, nadväzujúca štúdia, do ktorej sú zahrnutí jedinci, ktorí boli predtým
účastníkmi primárnej štúdie, vrátane štúdie B1971012. Jedinci boli sledovaní 4 roky a boli im odoberané vzorky krvi a dostali jednu posilňovaciu dávku očkovacej látky Trumenba približne 4 roky
potom, čo im bola podaná primárna séria 2 alebo 3 dávok očkovacej látky Trumenba. Odpovede
v zmysle hSBA u jedincov zaradených zo skupiny 1 (schéma podávania 0, 1 a 6 mesiacov), skupiny 2 (0, 2 a 6 mesiacov) a skupiny 3 (0 a 6 mesiacov) z primárnej štúdie B1971012 sú uvedené v tabuľkách'
6 a 7. 1 mesiac po podaní posilňovacej dávky očkovacej látky Trumenba, ktorá bola podaná približne
4 roky po primárnej sérii 2 dávok (skupina 3) alebo 3 dávok (skupiny 1 a 2), bola pomocou hSBA
sledovaná odpoveď naň.
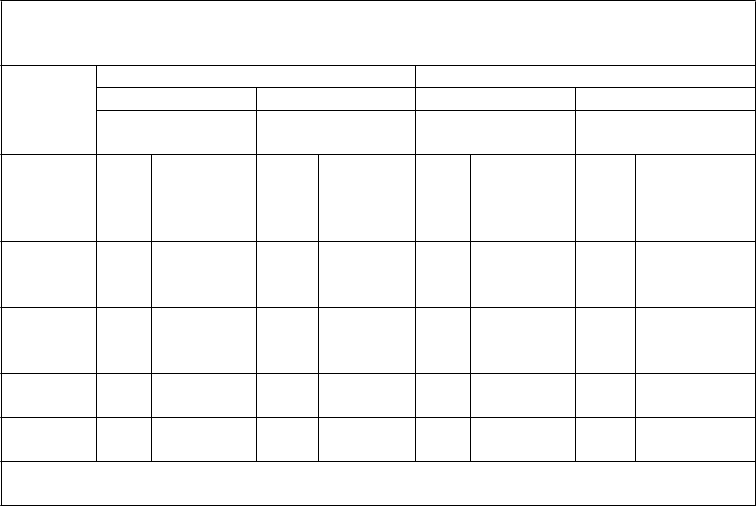
Tabuľka 6: Pretrvávanie imunitnej odpovede a odpovede na posilňovaciu dávku
medzi jedincami vo veku 11 až 18 rokov, ktorým bola podaná primárna séria dávok očkovacej látky Trumenba podľa schémy 0, 1 a 6 mesiacov alebo 0, 2 a 6 mesiacov alebo 0 a 6 mesiacov a
následne posilňovacia dávka 4 roky po primárnej sérii (štúdia B1971033)
Očkovacia skupina z primárnej štúdie B1971012 (ako bola randomizovaná)
Skupina 1 Skupina 2 Skupina 3
(0, 1 a 6 mesiacov) (0, 2 a 6 mesiacov) (0 a 6 mesiacov)
Kmeň hSBA (variant fHbp)
N GMT (95 % IS)
N GMT (95 % IS)
N GMT
(95 % IS)
PMB8
0 (A22)
Časový bod
% hSBA ≥ 1:16
1 mesiac po poslednej
primárnej dávke 100
12 mesiacov po poslednej primárnej dávke 99
48 mesiacov po poslednej primárnej dávke 90
1 mesiac po posilňovacej
91,0 (83,6; 11
95,8) 3
41,4 (31,6; 11
51,8) 1
41,1 (30,8; 10
52,0) 0
98,3 (90,9;
92,0 (85,4;
96,3)
45,0 (35,6;
54,8)
43,0 (33,1;
53,3)
100,0 (93,8;
11 96,5 (91,3;
5 99,0)
11 36,3 (27,4;
3 45,9)
10 39,6 (30,0;
1 49,8)
95,2 (86,5;
dávke 59
% hSBA ≥ 1:8
1 mesiac po poslednej
100,0) 58
100,0) 62
99,0)
99,1
PMB2
primárnej dávke 10
0
12 mesiacov po poslednej primárnej dávke 98
48 mesiacov po poslednej
100,0 (96,4; 11
100,0) 2
73,5 10 (63,6; 81,9) 9
47,1
99,1 (95,1;
100,0)
76,1 (67,0; 83,8)
58,6
11 (95,3;
6 100,0)
10 60,4
6 (50,4; 69,7)
57.6
001 (A56)
primárnej dávke 85
1 mesiac po posilňovacej
(36,1; 58,2) 99
(48,2; 68,4) 99
(47,2; 67,5)
98,4
dávke 59 100,0 (93,9; 100,0)
% hSBA ≥ 1:8100,0
(93,8; 100,0) 62
(91,3;
100,0)
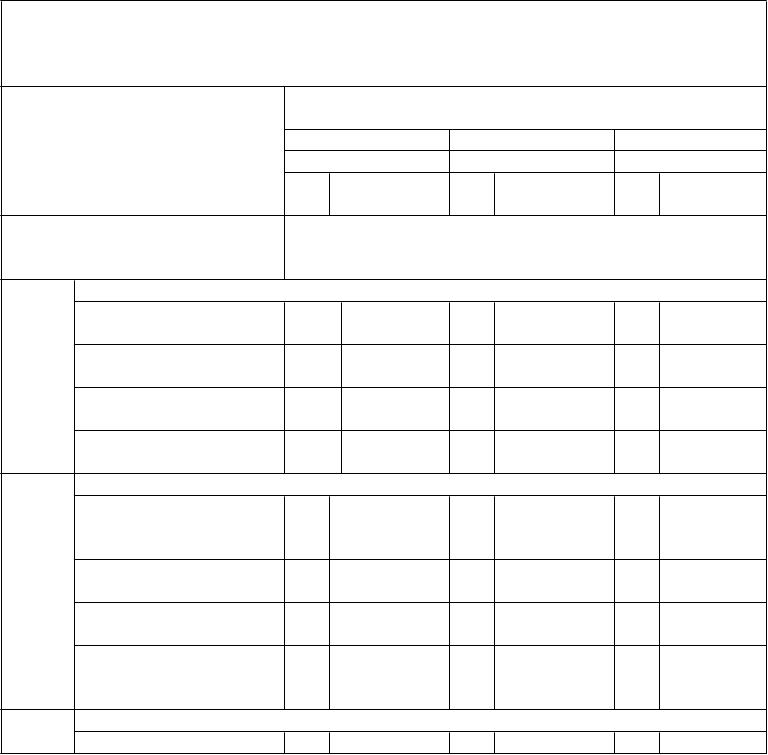
1 mesiac po poslednej 10 90,0 11 88,6 11 81,4
primárnej dávke 0 (82,4; 95,1) 4 (81,3; 93,8) 3 (73,0; 88,1)
12 mesiacov po poslednej primárnej dávke 98
48 mesiacov po poslednej
40,8 10 (31,0; 51,2) 8
41,1
49,1 (39,3; 58,9)
40,8
10 36,9
3 (27,6; 47,0)
10 30,5
PMB2
948
primárnej dávke 90
1 mesiac po posilňovacej
(30.8, 52.0) 98
100.0
(31,0; 51,2)
100,0
5 (21,9; 40,2)
93,4
(B24)
dávke 59
% hSBA ≥ 1:8
(93,9; 100,0) 58
(93,8; 100,0) 61
(84,1; 98,2)
1 mesiac po poslednej
primárnej dávke 99
88,9 11 (81,0; 94,3) 1
87,4 (79,7; 92,9)
11 77,9
3 (69,1; 85,1)
PMB2
707 (B44)
12 mesiacov po poslednej 10
primárnej dávke 0
48 mesiacov po poslednej primárnej dávke 92
1 mesiac po posilňovacej
24,0 11 (16,0; 33,6) 1
20,7 10 (12,9; 30,4) 0
94,9
22,5 (15,1; 31,4)
18,0 (11,0; 26,9)
98,2
11 16,5
5 (10,3; 24,6)
10 18,9
6 (11,9; 27,6)
91,9
dávke 59
(85,9; 98,9) 57
(90,6; 100,0) 62
(82,2; 97,3)
Zložená odpoveď (odpoveď zahŕňajúca všetky 4 hSBA kmene)
1 mesiac po poslednej
primárnej dávke 57
12 mesiacov po poslednej primárnej dávke 55
48 mesiacov po poslednej primárnej dávke 51
1 mesiac po posilňovacej
dávke 59
80,7
(68,1; 90,0) 55
10,9
(4,1; 22,2) 51
15,7
(7,0; 28,6) 55
93,2
(83,5; 98,1) 57
87,3
(75,5; 94,7) 57
13,7
(5,7; 26,3) 49
18,2
(9,1; 30,9) 55
98,2
(90,6; 100,0) 61
77,2 (64,2; 87,3)
20,4 (10,2; 34,3)
16,4 (7,8; 28,8)
91,8 (81,9; 97,3)
Skratky: hSBA = test baktericídnej aktivity séra využívajúci ľudský komplement; fHbp = proteín viažuci faktor.
Poznámka: Dolný limit kvantifikácie je hSBA titer = 1:16 pre PMB80 (A22) a 1:8 pre PMB2001 (A56), PMB2948 (B24) a
PMB2707 (B44).
Tabuľka 7: Pretrvávanie imunitnej odpovede a odpovede na posilňovaciu dávku medzi jedincami
vo veku 11 až 18 rokov, ktorým bola podaná primárna séria dávok očkovacej látky Trumenba podľa schémy 0, 1 a 6 mesiacov alebo 0, 2 a 6 mesiacov alebo 0 a 6 mesiacov a následne
posilňovacia dávka 4 roky po primárnej sérii (štúdia B1971033)
Očkovacia skupina z primárnej štúdie B1971012 (ako bola randomizovaná)
Skupina 1 Skupina 2 Skupina 3
(0, 1 a 6 mesiacov) (0, 2 a 6 mesiacov) (0 a 6 mesiacov)
Kmeň hSBA (variant fHbp)
N GMT (95 % IS)
N GMT (95 % IS)
N GMT (95 % IS)
Časový bod
GMT hSBA
1 mesiac po poslednej 10
primárnej dávke 0
12 mesiacov po poslednej
60,1 (48,6; 11
74,4) 3
14,9 (12,6; 11
56,6 (47,0; 11
68,2) 5
15,8 (13,4; 11
54,7 (47,3;
63,3)
15,6 (13,0;
PMB8
0 (A22)
primárnej dávke 99
48 mesiacov po poslednej primárnej dávke 90
1 mesiac po posilňovacej
17,7)
14,3 (11,9;
17,0)
90,0 (69,6;
1 18,6)
10 15,1 (12,7;
0 18,0)
119,1 (90,0;
3 18,8)
10 14,8 (12,5;
1 17,6)
140,0 (104,2;
dávke 59
GMT hSBA
116,3) 58
157,8) 62
187,9)

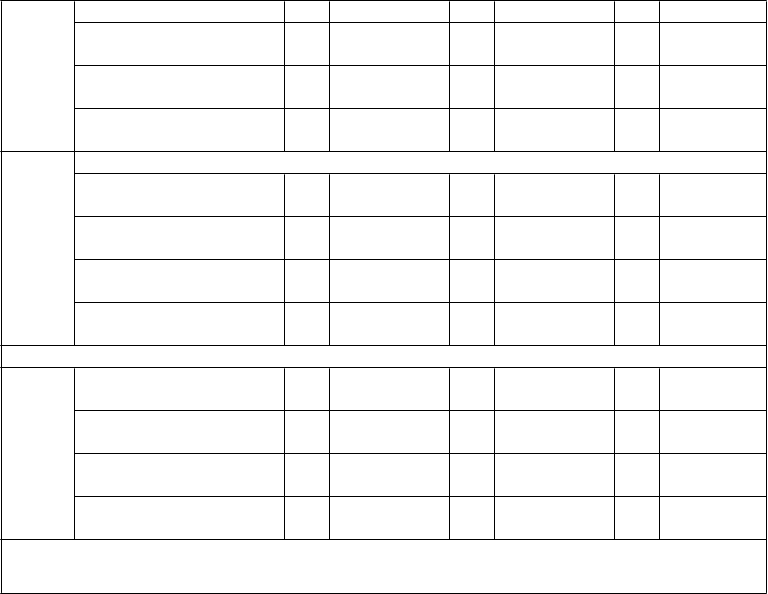
1 mesiac po poslednej 10
primárnej dávke 0
12 mesiacov po poslednej primárnej dávke 98
199,5 (162,7; 11
244,5) 2
25,7 (19,4; 10
34,0) 9
196,2 (161,8; 11
237,9) 6
27,3 (21,0; 10
35,4) 6
142,5 (118,3;
171,7)
18,5 (13,8;
24,7)
PMB2
001 (A56)
48 mesiacov po poslednej primárnej dávke 85
1 mesiac po posilňovacej
dávke 59
GMT hSBA
11,5 (8,6;
15,5) 99
335,4 (262,1;
429,2) 58
17,5 (13,2;
23,3) 99
370,8 (275,8;
498,6) 62
16,0 (12,1;
21,1)
358,0 (262,1;
489,0)
1 mesiac po poslednej 10
primárnej dávke 0
12 mesiacov po poslednej primárnej dávke 98
48 mesiacov po poslednej
29,7 (23,9; 11
36,8) 4
9,7 (7,5; 10
12,4) 8
9,4 (7,3;
30,9 (25,3; 11
37,7) 3
11,5 (9,0; 10
14,6) 3
9,7 (7,6; 10
28,0 (22,0;
35,5)
8,4 (6,7;
10,6)
PMB2
948
primárnej dávke 90
1 mesiac po posilňovacej
12,1) 98
74,6 (55,9;
12,3)
80,3 (62,6;
5 7,5 (6,1; 9,2)
86,0 (62,6;
(B24)
dávke 59
GMT hSBA
99,5) 58
103,1) 61
118,2)
1 mesiac po poslednej
primárnej dávke 99
50,1 (38,0; 11
66,1) 1
41,9 (32,3; 11
54,3) 3
31,4 (23,9;
41,3)
PMB2
12 mesiacov po poslednej primárnej dávke
48 mesiacov po poslednej
10
0 6,4 (5,2; 7,8)
11
1 6,0 (5,1; 7,2)
10
11
5 5,6 (4,8; 6,5)
10
707
primárnej dávke 92 6,0 (5,0; 7,2)
0 5,3 (4,6; 6,1)
6 5,1 (4,6; 5,7)
(B44)
1 mesiac po posilňovacej
dávke 59
109,9 (74,5;
162,0) 57
117,6 (84,5;
163,5) 62
84,6 (57,8;
124,0)
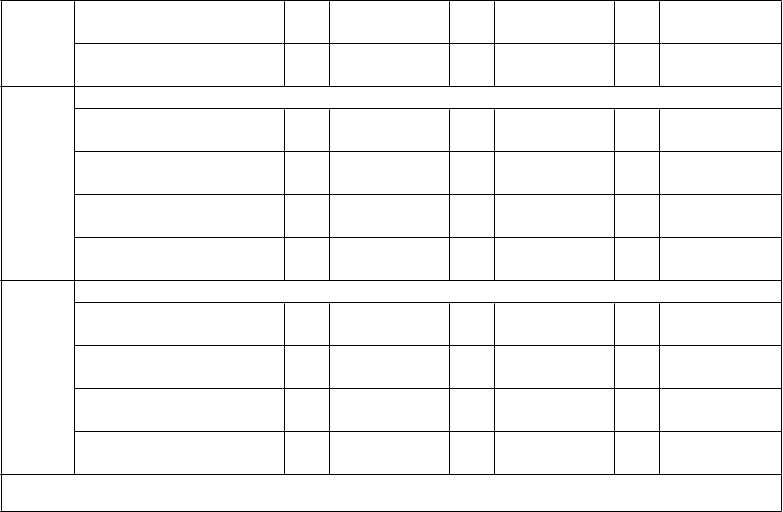
Skratky: GMT = geometrický priemer titrov; hSBA = test baktericídnej aktivity séra využívajúci ľudský komplement; fHbp =
proteín viažuci faktor H.
Európska lieková agentúra udelila odklad z povinnosti predložiť výsledky štúdií s Trumenbou v jednej
alebo vo viacerých podskupinách pediatrickej populácie na prevenciu invazívneho meningokokového ochorenia spôsobeného
N. meningitidis séroskupiny B (informácie o použití v pediatrickej populácii,
pozri časť 4.2).
5.2 Farmakokinetické vlastnostiNeaplikovateľné.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých farmakologických štúdií toxicity po opakovanom podávaní a reprodukčnej a vývojovej toxicity neodhalili žiadne osobitné riziko pre ľudí.
6 FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokChlorid sodný
Histidín
Polysorbát 80 (E433) Voda na injekciu
Pre adsorbent, pozri časť 2.
6.2 InkompatibilityNemiešajte očkovaciu látku Trumenba s inými očkovacími látkami alebo liekmi v rovnakej injekčnej striekačke.
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C - 8 °C).
Injekčné striekačky by mali byť uchovávané v chladničke vodorovne, aby sa minimalizovala doba potrebná na opätovné rozptýlenie roztoku.
Neuchovávajte v mrazničke.
6.5 Druh obalu a obsah balenia
0,5 ml suspenzie v naplnenej injekčnej striekačke (sklo typu I) s plastovou spojkou s luerovým zámkom, zátkou piestu z chlórbutylovej gumy a krytom špičky zo syntetickej
izoprénovej brómbutylovej gumy s plastovým pevným obalom krytu špičky, s ihlou alebo bez ihly. Kryt špičky a gumený piest naplnenej injekčnej striekačky nie sú vyrábané z prírodného kaučuku (latexu).
Veľkosti balenia 1, 5 a 10 naplnených injekčných striekačiek s ihlou alebo bez ihly. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Počas uchovávania môže byť v naplnenej injekčnej striekačke obsahujúcej suspenziu pozorovaná biela usadenina a číry supernatant.
Pred použitím je potrebné s naplnenou injekčnou striekačkou silno zatriasť, aby sa vytvorila homogénna biela suspenzia.
Očkovaciu látku nepoužívajte, pokiaľ nemôže byť resuspendovaná.
Pred podaním očkovaciu látku vizuálne skontrolujte, či neobsahuje pevné častice a nezmenila farbu. Ak sa v očkovacej látke nachádzajú akékoľvek cudzorodé častice a/alebo je zmenený jej vzhľad, nepodávajte ju.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7 DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Pfizer Ltd Ramsgate Road Sandwich
Kent CT13 9NJ Spojené kráľovstvo
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/17/1187/001
EU/1/17/1187/002
EU/1/17/1187/003
EU/1/17/1187/004
EU/1/17/1187/005
EU/1/17/1187/006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE24. máj 2017
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.