
/>Salmeterol/flutikazón-propionát sa nemá používať na liečbu akútnych príznakov astmy, pre ktoré sa
vyžaduje rýchlo a krátkodobo pôsobiaci bronchodilatátor. Pacientov treba poučiť, aby mali svoj núdzový inhalátor vždy dostupný na použitie pri úľave od akútnych záchvatov astmy.
Liečba salmeterolom/flutikazón-propionátom sa nemá začínať u pacientov počas exacerbácie ochorenia
alebo ak sa u nich vyskytne významné zhoršenie alebo akútne zhoršenie astmy.
Počas liečby salmeterolom/flutikazón-propionátom sa môžu vyskytnúť závažné nežiaduce účinky a exacerbácie súvisiace s astmou. Pacientov treba požiadať, aby v prípade, že po začatí liečby salmeterolom/flutikazón-propionátom zostanú príznaky astmy nekontrolované alebo sa zhoršia, pokračovali v liečbe, ale aby vyhľadali lekársku pomoc.
Zvýšená potreba používania úľavových liekov (krátkodobo pôsobiacich bronchodilatátorov) alebo znížená
odpoveď na úľavové lieky naznačujú zhoršenie kontroly astmy a lekár má prehodnotiť stav pacienta.
Náhle a postupujúce zhoršovanie kontroly astmy je potenciálne život ohrozujúce a pacientovi sa má
poskytnúť rýchla lekárska pomoc. Má sa zvážiť liečba zvýšenými dávkami inhalačného kortikosteroidu.
Prerušenie liečby
Liečba salmeterolom/flutikazón-propionátom sa nemá u pacientov s astmou kvôli riziku exacerbácie ukončiť
náhle. Liečba sa má pod dohľadom lekára titrovať nadol.
Súbežné ochorenia
Salmeterol/flutikazón-propionát sa má podávať opatrne u pacientov s aktívnou alebo latentnou pľúcnou
tuberkulózou a plesňovými, vírusovými alebo inými infekciami dýchacích ciest. Ak je to indikované, bezodkladne sa má podať príslušná liečba.
Kardiovaskulárne účinky
Salmeterol/flutikazón-propionát môže pri vysokých terapeutických dávkach zriedkavo spôsobiť srdcové
arytmie, napr. supraventrikulárnu tachykardiu, extrasystoly a atriálnu fibriláciu, ako aj mierne prechodné zníženie draslíka v sére. Salmeterol/flutikazón-propionát sa má používať opatrne u pacientov so závažnými kardiovaskulárnymi poruchami alebo abnormalitami srdcového rytmu a u pacientov s tyreotoxikózou.
Hypokaliémia a hyperglykémia
Lieky obsahujúce beta-adrenergné agonisty môžu u niektorých pacientov, pravdepodobne prostredníctvom
intracelulárneho presunu, spôsobovať významnú hypokaliémiu, ktorá má potenciál viesť k nežiaducim kardiovaskulárnym účinkom. Zníženie hladiny draslíka v sére je zvyčajne prechodné a nevyžaduje si suplementáciu. Počas klinických skúšaní so salmeterolom/flutikazón-propionátom v odporúčaných dávkach sa zriedkavo pozorovali klinicky významné zmeny hladiny draslíka v sére (pozri časť 4.8). Zriedkavo boli hlásené zvýšenia hladiny glukózy v krvi (pozri časť 4.8), čo treba vziať do úvahy pri predpisovaní pacientom s diabetom mellitus v anamnéze.
Salmeterol/flutikazón-propionát sa má používať opatrne u pacientov s diabetom mellitus, nekontrolovanou hypokaliémiou alebo u pacientov s predispozíciou na nízkej hladiny draslíka v sére.
Paradoxný bronchospazmus
Môže sa vyskytnúť paradoxný bronchospazmus s okamžitým zvýšením sipotu a dýchavičnosti po podaní
dávky, ktorý môže byť život ohrozujúci (pozri časť 4.8). Tento stav sa má ihneď liečiť pomocou krátkodobo pôsobiaceho bronchodilatátora. Podávanie salmeterolu/flutikazón-propionátu sa má ihneď prerušiť, stav pacienta sa má vyhodnotiť a ak je to potrebné, má sa podať alternatívna liečba.
Agonisty beta 2 adrenoreceptora
Hlásili sa farmakologické účinky liečby β2-agonistami ako sú tras, palpitácie a bolesť hlavy, ktoré však
zvyknú byť prechodné a s pravidelnou liečbou sa zmierňujú.
Systémové účinky
Pri každom inhalačnom kortikosteroide sa môžu vyskytnúť systémové účinky, a to hlavne pri vysokých
dávkach predpisovaných na dlhé obdobia. Tieto účinky sa vyskytujú s oveľa nižšou pravdepodobnosťou než pri perorálnych kortikosteroidoch. Možné systémové účinky zahŕňajú Cushingov syndróm, cushingoidné znaky, supresiu funkcie nadobličiek, zníženie hustoty kostných minerálov, kataraktu a glaukóm
a zriedkavejšie škálu psychických účinkov alebo účinkov na správanie vrátane psychomotorickej
hyperaktivity, porúch spánku, úzkosti, depresie alebo agresivity (najmä u detí) (ohľadne informácií
o systémových účinkoch inhalačných kortikosteroidov u detí a dospievajúcich pozri odstavec Pediatrická populácia nižšie). Preto je dôležité pacienta pravidelne kontrolovať a znižovať dávku inhalačného kortikosteroidu na najnižšiu dávku, pri ktorej je možné udržať účinnú kontrolu astmy.
Vizuálne poruchy
Pri používaní systémových a lokálnych kortikosteroidov sa môžu hlásiť vizuálne poruchy. Ak sa u pacienta
vyskytnú príznaky ako je rozmazané videnie alebo iné vizuálne poruchy, má sa zvážiť odporučenie pacienta k oftalmológovi na vyhodnotenie možných príčin, ktoré môžu zahŕňať kataraktu, glaukóm alebo zriedkavé ochorenia ako sú centrálna serózna chorioretinopatia (CSCH), ktoré sa hlásili po používaní systémových
a lokálnych kortikosteroidov.
Funkcia nadobličiek
Dlhodobá liečba pacientov vysokými dávkami inhalačných kortikosteroidov môže viesť k supresii funkcie
nadobličiek a akútnej adrenálnej kríze. Veľmi zriedkavé prípady supresie funkcie nadobličiek a akútnej adrenálnej krízy boli tiež opísané pri dávkach flutikazón-propionátu v rozsahu od 500 mikrogramov a menej ako 1 000 mikrogramov. Situácie, ktoré by mohli vyvolať akútnu adrenálnu krízu zahŕňajú traumu, chirurgický zákrok, infekciu alebo akékoľvek náhle zníženie dávky. Prejavujúce sa príznaky sú typicky nejasné a môžu zahŕňať anorexiu, bolesť brucha, pokles telesnej hmotnosti, únavu, bolesť hlavy, nevoľnosť, vracanie, hypotenziu, znížený stav vedomia, hypoglykémiu a záchvaty. Počas obdobia stresu a pri plánovaných chirurgických zákrokoch sa má zvážiť liečba ďalšími systémovými kortikosteroidmi.
Prínosy liečby inhalačným flutikazón-propionátom by mali minimalizovať potrebu perorálne podávaných steroidov, avšak u pacientov, ktorí prechádzajú z liečby perorálnymi steroidmi, môže značný čas pretrvávať riziko zhoršenej funkčnej rezervy nadobličiek. Preto sa majú títo pacienti liečiť s osobitnou pozornosťou
a má sa u nich pravidelne sledovať adrenokortikálna funkcia. Riziko môže existovať aj u pacientov,
u ktorých bola v minulosti potrebná núdzová liečba vysokými dávkami kortikosteroidov. V núdzových
a plánovaných situáciách, ktoré môžu spôsobiť stres, treba vždy pamätať na takúto možnosť reziduálnej poruchy a má sa zvážiť vhodná liečba kortikosteroidmi. Rozsah poruchy funkcie nadobličiek môže pred plánovanými zákrokmi vyžadovať radu špecializovaného lekára.
Liekové interakcie
Ritonavir môže výrazne zvýšiť koncentráciu flutikazón-propionátu v plazme. Preto sa treba vyhnúť
súbežnému používaniu, pokiaľ možný prínos pre pacienta neprevažuje nad rizikom nežiaducich účinkov systémových kortikosteroidov. Pri kombinácii flutikazón-propionátu s inými silnými inhibítormi CYP3A tiež existuje zvýšené riziko systémových nežiaducich účinkov (pozri časť 4.5).
Súbežné používanie systémového ketokonazolu výrazne zvyšuje systémovú expozíciu salmeterolu. To môže viesť k zvýšenému výskytu systémových účinkov (napr. predĺženie intervalu QTc a palpitácie). Treba sa preto vyhnúť súbežnej liečbe ketokonazolom alebo inými silnými inhibítormi CYP3A4, pokiaľ prínosy neprevažujú nad možným zvýšeným rizikom systémových nežiaducich účinkov liečby salmeterolom (pozri časť 4.5).
Pediatrická populácia
Tento liek je indikovaný na použitie u dospievajúcich vo veku 12 rokov a starších (pozri časť 4.2). Je ale
potrebné uviesť, že u detí a dospievajúcich mladších ako 16 rokov užívajúcich vysoké dávky flutikazón- propionátu (typicky ≥ 1 000 mikrogramov/deň) môže existovať osobitné riziko. Môžu sa vyskytnúť systémové účinky, a to hlavne pri vysokých dávkach predpisovaných počas dlhého obdobia. Možné systémové účinky zahŕňajú Cushingov syndróm, cushingoidné znaky, supresiu funkcie nadobličiek, akútnu adrenálnu krízu a spomalenie rastu u detí a dospievajúcich a zriedkavejšie škálu psychických účinkov alebo účinkov na správanie vrátane psychomotorickej hyperaktivity, porúch spánku, úzkosti, depresie alebo agresivity. Má sa zvážiť odporučenie dieťaťa alebo dospievajúceho k lekárovi špecializovanému na respiračné ochorenia u pediatrických pacientov. Odporúča sa pravidelne sledovať telesnú výšku detí dostávajúcich dlhodobú liečbu inhalačnými kortikosteroidmi. Dávka inhalačného kortikosteroidu sa má vždy znížiť na najnižšiu dávku, pri ktorej je možné účinné udržanie kontroly astmy.
Infekcie ústnej dutiny
U niektorých pacientov sa môže vyskytnúť zachrípnutie a kandidóza (afty) úst a hrdla a zriedkavo aj
pažeráka, zapríčinené flutikazón-propionátovou zložkou (pozri časť 4.8). Zachrípnutie aj výskyt kandidózy úst a hrdla sa môžu zmierniť vyplachovaním úst vodou a následným vypľutím vody a/alebo umývaním zubov po použití lieku. Symptomatická kandidóza úst a hrdla sa môže liečiť lokálnou antimykotickou liečbou a súčasne pokračovať v liečbe salmeterolom/flutikazón-propionátom.
Obsah laktózy
Tento liek obsahuje laktózu (pozri časť 4.3). Pacienti so zriedkavými dedičnými problémami galaktózovej
intolerancie, celkovým deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek. Pomocná látka laktóza môže obsahovať malé množstvá mliečnych proteínov, ktoré môžu vyvolať alergické reakcie u ľudí so závažnou precitlivenosťou alebo alergiou na mliečne proteíny.
4.5 Liekové a iné interakcie
Interakcie s betablokátormi
Beta-adrenergné blokátory môžu oslabiť alebo antagonizovať účinok salmeterolu. Treba sa vyhnúť
používaniu neselektívnych aj selektívnych β-blokátorov, pokiaľ nie sú prítomné nevyhnutné dôvody na ich
používanie. Dôsledkom liečby β2-agonistami môže byť potenciálne závažná hypokaliémia (pozri časť 4.4). Osobitná pozornosť sa odporúča v akútnych prípadoch ťažkej astmy, pretože tento účinok môže byť zosilnený súbežnou liečbou derivátmi xantínu, streoidmi a diuretikami.
Salmeterol
Silné inhibítory CYP3A4
Súbežné podávanie ketokonazolu (400 mg perorálne, jedenkrát denne) a salmeterolu (50 mikrogramov inhalačne, dvakrát denne) 15 zdravým jedincom počas 7 dní viedlo k významnému zvýšeniu expozície salmeterolu v plazme (1,4-násobok hodnoty Cmax a 15-násobok hodnoty AUC). To môže viesť k zvýšeniu výskytu iných systémových účinkov liečby salmeterolom (napr. predĺženie intervalu QTc a palpitácie)
v porovnaní so samostatnou liečbou salmeterolom alebo ketokonazolom (pozri časť 4.4).
Nepozorovali sa klinicky významné účinky na krvný tlak, srdcový rytmus, hladiny glukózy v krvi ani hladiny draslíka v krvi. Súbežné podávanie s ketokonazolom nezvýšilo polčas eliminácie salmeterolu ani hromadenie salmeterolu pri opakovanom podávaní.
Treba sa vyhnúť súbežnému podávaniu ketokonazolu, pokiaľ prínosy neprevažujú nad potenciálne zvýšeným rizikom výskytu systémových účinkov liečby salmeterolom. Pravdepodobne existuje podobné riziko interakcie s inými silnými inhibítormi CYP3A4 (napr. itrokonazolom, telitromycínom, ritonavirom).
Stredne silné inhibítory CYP3A4
Súbežné podávanie erytromycínu (500 mg perorálne, trikrát denne) a salmeterolu (50 mikrogramov inhalačne, dvakrát denne) 15 zdravým jedincom počas 6 dní viedlo k malému, ale nie štatisticky významnému zvýšeniu expozície salmeterolu (1,4-násobná hodnota Cmax a 1,2-násobná hodnota AUC). Súbežné podávanie s erytromycínom sa nespájalo so žiadnymi závažnými nežiaducimi účinkami.
Flutikazón-propionát
Pri normálnych okolnostiach sa z dôvodu rozsiahleho metabolizmu prvého prechodu a vysokého
systémového klírensu sprostredkovaného cytochrómom P450 3A4 v črevách a pečeni po inhalačnom podaní dávky dosahujú nízke plazmatické koncentrácie flutikazón-propionátu. Preto sú klinicky významné liekové interakcie spôsobené flutikazón-propionátom nepravdepodobné.
V štúdii liekových interakcií u zdravých jedincov, ktorým bol intranazálne podávaný flutikazón-propionát, zvýšilo 100 mg ritonaviru (veľmi silný inhibítor cytochrómu P450 3A4) podávaného dvakrát denne plazmatické koncentrácie flutikazón-propionátu niekoľko stonásobne, čo viedlo k výrazne zníženým sérovým koncentráciám kortizolu. Pre inhalačný flutikazón-propionát chýbajú informácie o tejto interakcii, očakáva sa však výrazné zvýšenie plazmatických hladín flutikazón-propionátu. Hlásili sa prípady Cushingovho syndrómu a supresie funkcie nadobličiek. Pokiaľ prínos neprevyšuje zvýšené riziko výskytu systémových nežiaducich účinkov glukokortikoidov, treba sa tejto kombinácii vyhnúť (pozri časť 4.4).
V malej štúdii u zdravých dobrovoľníkov zvýšil o niečo slabší inhibítor CYP3A ketokonazol expozíciu flutikazón-propionátu po jednorazovej inhalácii o 150 %. To viedlo k výraznejšiemu zníženiu plazmatickej hladiny kortizolu v porovnaní so samostatne podaným flutikazón-propionátom. Pri súbežnej liečbe inými silnými inhibítormi CYP3A, ako je itrakonazol, a stredne silnými inhibítormi CYP3A, ako je erytromycín, sa tiež očakáva zvýšenie systémovej expozície flutikazón-propionátu a rizika výskytu systémových nežiaducich účinkov. Odporúča sa opatrnosť, a ak je to možné, treba sa vyhnúť dlhodobej liečbe takýmito liekmi.
Pri súbežnej liečbe inhibítormi CYP3A vrátane liekov obsahujúcich kobicistát sa očakáva zvýšenie rizika výskytu systémových vedľajších účinkov. Tejto kombinácii sa treba vyhnúť, pokiaľ prínos neprevyšuje zvýšené riziko výskytu systémových vedľajších účinkov kortikosteroidov, v prípade čoho sa pacienti majú sledovať na výskyt systémových účinkov kortikosteroidov.
Interakcie s inhibítormi P-glykoproteínu
Flutikazón-propionát a salmeterol sú oba slabými substrátmi pre P-glykoproteín (P-gp). Pre flutikazón sa v in
vitro štúdiách nepreukázala inhibícia P-gp. Nie sú k dispozícii žiadne informácie o potenciáli inhibície P-gp salmeterolom. Nevykonali sa žiadne klinické farmakologické štúdie so špecifickým P-gp inhibítorom
a flutikazón-propionátom/salmeterolom.
Sympatomimetiká
Súbežné podávanie iných sympatomimetík (samostatne alebo ako súčasť kombinovanej liečby) môže mať
potenciálne aditívny účinok.
4.6 Fertilita, gravidita a laktácia
Gravidita
Malé množstvo údajov u gravidných žien (300 až 1 000 ukončených gravidít) nepoukazuje na malformácie
alebo fetálnu/neonatálnu toxicitu salmeterolu a flutikazón-propionátu. Štúdie na zvieratách preukázali
reprodukčnú toxicitu po podaní agonistov β2-adrenoreceptora a glukokortikosteroidov (pozri časť 5.3).
Tento liek sa má používať počas gravidity len ak očakávaný prínos pre pacientku opodstatňuje potenciálne
riziko pre plod.
Dojčenie
Nie je známe, či sa salmeterol a flutikazón-propionát/metabolity vylučujú do ľudského mlieka.
Štúdie ukázali, že salmeterol a flutikazón-propionát a ich metabolity sa vylučujú do mlieka laktujúcich
potkanov.
Riziko pre dojčených novorodencov/deti nemôže byť vylúčené. Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu salmeterolom/flutikazón-propionátom sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú dostupné žiadne údaje o ľudskej fertilite. Štúdie na zvieratách však nepreukázali žiadne účinky
salmeterolu ani flutikazón-propionátu na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Tento liek nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn profilu bezpečnosti
Keďže tento liek obsahuje salmeterol a flutikazón-propionát, môže sa očakávať typ a závažnosť nežiaducich
reakcií súvisiacich s každým z liečiv. Po súbežnom podaní týchto dvoch zložiek sa nepozoroval žiadny zvýšený výskyt nežiaducich reakcií.
Najčastejšie hlásenými nežiaducimi reakciami boli nazofaryngitída (6,3 %), bolesť hlavy (4,4 %), kašeľ
(3,7 %) a orálna kandidóza (3,4 %).
Tabuľkový zoznam nežiaducich reakcií
Nežiaduce reakcie, ktoré súviseli so salmeterolom/flutikazón-propionátom, sú uvedené nižšie, zoradené
podľa tried orgánových systémov a frekvencií výskytu. Frekvencie výskytu sú definované ako: veľmi časté
(≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000),
veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov). Frekvencie sú odvodené z údajov z klinických skúšaní.
Tabuľka 1:
Tabuľkový zoznam nežiaducich reakciíTrieda orgánových systémov
|
Nežiaduca reakcia
|
Frekvencia
|
Infekcie a nákazy
| orálna kandidózaa
| časté1
|
chrípka
| časté
|
nazofaryngitída
| časté
|
rinitída
| časté
|
sinusitída
| časté
|
faryngitída
| menej časté
|
infekcie dýchacích ciest
| menej časté
|
kandidóza pažeráka
| zriedkavé
|
Poruchy endokrinného systému
| Cushingov syndróm, cushingoidné znaky, supresia funkcie nadobličiek, spomalenie rastu u detí a dospievajúcich
|
zriedkavé1
|
Poruchy metabolizmu a výživy
| hypokaliémia
| časté2
|
hyperglykémia
| menej časté
|
Psychické poruchy
| úzkosť
| menej časté
|
nespavosť
| menej časté
|
zmeny správania vrátane hyperaktivity a podráždenosti, hlavne u detí
|
menej časté
|
Poruchy nervového systému
| bolesť hlavy
| časté
|
závrat
| časté
|
tras
| menej časté
|
Poruchy oka
| katarakta
| menej časté
|
glaukóm
| zriedkavé1
|
rozmazané videnie
| neznáme1
|
Poruchy srdca a srdcovej
činnosti
| palpitácie
| menej časté1
|
tachykardia
| menej časté
|
atriálna fibrilácia
| menej časté
|
srdcové arytmie (vrátane supraventrikulárnej tachykardie a extrasystol)
|
zriedkavé
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| kašeľ
| časté
|
podráždenie hrdla
| časté
|
zachrípnutie/dysfónia
| časté
|
orofaryngálna bolesť
| časté
|
alergická rinitída
| menej časté
|
upchatý nos
| menej časté
|
paradoxný bronchospazmus
| zriedkavé1
|
Poruchy gastrointestinálneho traktu
| bolesť hornej abdominálnej oblasti
| menej časté
|
dyspepsia
| menej časté
|
Poruchy kože
a podkožného tkaniva
|
kontaktná dermatitída
|
menej časté
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
| bolesť chrbta
| časté
|
myalgia
| časté
|
bolesť končatiny
| menej časté
|
Úrazy, otravy
a komplikácie liečebného
postupu
|
tržná rana
|
menej časté
|
a. zahŕňa orálnu kandidózu, orálne plesňové infekcie, orofaryngálnu kandidózu a plesňovú
orofaryngitídu
1. Pozri časť 4.4
2. Pozri časť 4.5
Popis vybraných nežiaducich reakciíŠpecifické účinky liečby β2-agonistamiHlásili sa farmakologické účinky liečby β2-agonistamy ako sú tras, palpitácie a bolesť hlavy, ktoré však zvyknú byť prechodné a s pravidelnou liečbou sa zmierňujú.
Paradoxný bronchospazmusMôže sa vyskytnúť paradoxný bronchospazmus s okamžitým zvýšením sipotu a dýchavičnosti po podaní dávky (pozri časť 4.4).
Účinky liečby inhalačnými kortikosteroidmiU niektorých pacientov sa môže vyskytnúť zachrípnutie a kandidóza (afty) úst a hrdla a zriedkavo aj
pažeráka, zapríčinené flutikazón-propionátovou zložkou (pozri časť 4.4).
Pediatrická populáciaBezpečnosť a účinnosť Seffalairu Spiromax u pediatrických pacientov vo veku menej ako 12 rokov neboli
stanovené.
Inhalačné kortikosteroidy, vrátane flutikazón-propionátu, zložky Seffalairu Spiromax, môžu viesť k zníženiu rýchlosti rastu u dospievajúcich (pozri časť
4.4 Osobitné upozornenia a opatrenia pri používaní).U pediatrických pacientov dostávajúcich perorálne inhalačné kortikosteroidy vrátane salmeterolu/flutikazón- propionátu sa má rutinne sledovať rast. Na minimalizáciu systémových účinkov perorálnych inhalačných kortikosteroidov vrátane salmeterolu/flutikazón-propionátu sa má dávka každého pacienta titrovať na najnižšiu dávku, ktorou sa účinne kontrolujú príznaky.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie

pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek
podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNie sú k dispozícii žiadne údaje z klinických skúšaní ohľadne predávkovania Seffalairom Spiromax, údaje o predávkovaní oboma liečivami sú však uvedené nižšie:
SalmeterolPrejavy a príznaky predávkovania salmeterolom sú závrat, zvýšenie systolického krvného tlaku, tras, bolesť
hlavy a tachykardia. Ak sa kvôli predávkovaniu β-agonistovou zložkou lieku musí prerušiť liečba salmeterolom/flutikazón-propionátom, má sa zvážiť poskytnutie vhodnej náhrady steroidovej liečby. Okrem toho sa môže vyskytnúť hypokaliémia a preto sa majú sledovať hladiny draslíka v sére. Má sa zvážiť náhrada draslíka.
Flutikazón-propionátAkútneAkútna inhalácia dávok flutikazón-propionátu vyšších ako sú odporúčané dávky môže viesť k prechodnej supresii funkcie nadobličiek. V tomto prípade nie sú potrebné núdzové opatrenia, keďže funkcia nadobličiek sa v priebehu niekoľkých dní obnoví, čo sa potvrdí meraním kortizolu v plazme.
Chronické predávkovanie
Má sa sledovať funkčná rezerva nadobličiek a môže byť potrebná liečba systémovým kortikosteroidom. Po stabilizovaní stavu sa má pokračovať v liečbe inhalačnými kortikosteroidmi v odporúčanej dávke. (pozri časť 4.4: „Funkcia nadobličiek“).
V prípadoch akútneho aj chronického predávkovania flutikazón-propionátom sa má pokračovať v liečbe
salmeterolom/flutikazón-propionátom v dávke vhodnej pre kontrolu príznakov.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiastmatiká, sympatomimetiká v kombinácii s kortikosteroidmi alebo inými
liečivami s výnimkou anticholinergík, ATC kód: R03AK06
Mechanizmus účinku a farmakodynamickéúčinky
Seffalair Spiromax obsahuje salmeterol a flutikazón-propionát, ktoré majú rozdielne spôsoby účinku.
Príslušné mechanizmy účinku oboch liečiv sú uvedené nižšie.
Salmeterol je selektívny, dlhodobo účinkujúci (12 hodín) agonista β2-adrenoreceptora s dlhým bočným reťazcom, ktorý sa viaže na exo-pozíciu receptora.
Flutikazón-propionát podávaný inhalačne v odporúčaných dávkach má glukokortikoidový protizápalový účinok v pľúcach.
Klinická účinnosť a bezpečnosť
Klinické skúšania astmy so Seffalairom Spiromax
Bezpečnosť a účinnosť Seffalairu Spiromax sa hodnotili u 3 004 pacientov s astmou. Vývojový program zahŕňal 2 potvrdzujúce skúšania trvajúce 12 týždňov, 26-týždňové skúšanie bezpečnosti a 3 skúšania na určenie rozsahu dávky. Účinnosť Seffalairu Spiromax sa zakladá na potvrdzujúcich skúšaniach opísaných nižšie.
V dvoch randomizovaných, dvojito zaslepených, placebom kontrolovaných 12-týždňových skúšaniach sa hodnotilo šesť dávok flutikazón-propionátu v rozsahu od 16 µg do 434 µg (vyjadrených ako odmerané dávky) podávaných dvakrát denne pomocou viacdávkového inhalátora suchého prášku (Multidose Dry Powder Inhaler, MDPI) a nezaslepeného komparátoru suchého prášku flutikazón-propionátu (100 µg alebo
250 µg). Skúšanie 201 sa vykonalo u pacientov, ktorých stav nebol na začiatku skúšania kontrolovaný a ktorí boli liečení krátkodobo pôsobiacim β2-agonistom samostatne alebo v kombinácii s nekotrikosteroidovým liekom na astmu. Pacienti používajúci nízke dávky inhalačného kortikosteroidu (IKS) mohli byť do skúšania zaradení po minimálne 2 týždňoch bez užívania lieku. Skúšanie 202 sa vykonalo u pacientov, ktorých stav nebol na začiatku skúšania kontrolovaný a ktorí boli liečení vysokými dávkami IKS s alebo bez dlhodobo pôsobiaceho beta-agonistu (Long-Acting Beta-Agonist, LABA). Odmerané dávky flutikazón-propionátu
Spiromax [Fp MDPI] (16, 28, 59, 118, 225, a 434 µg) použité v skúšaní 201 a skúšaní 202 sa odlišujú od
odmeraných dávok komparátorových liekov (inhalačný prášok flutikazónu) a skúmaných liekov v 3. fáze,
ktoré sú základom odmeraných dávok uvedených na označení (113 a 232 µg pre flutikazón- propionát). Zmeny dávok medzi 2. a 3. fázou viedli k optimalizácii výrobného procesu.
Účinnosť a bezpečnosť 4 dávok salmeterólium-xinafoátu sa vyhodnocovali v dvojito zaslepenej, 6-dielnej krížovej štúdii v porovnaní s jednorazovou dávkou flutikazón-propionátu Spiromax a inhalátorom suchého prášku flutikazón-propionátu/salmeterolu 100/50 µg ako nezaslepeným komparátorom u pacientov
s pretrvávajúcou astmou. Skúmané dávky salmeterolu boli 6,8 µg, 13,2 µg, 26,8 µg a 57,4 µg v kombinácii s 118 µg flutikazón-propionátu podávané prostredníctvom MDPI (vyjadrené ako odmerané dávky). Odmerané dávky salmeterolu (6,8; 13,2; 26,8, and 57,4 µg) použité v tejto štúdii sa mierne odlišujú od
odmeraných dávok komparátorových liekov (inhalačný prášok flutikazónu/salmeterolu) a skúmaných liekov v 3. fáze, ktoré sú základom odmeraných dávok uvedených na označení (113 a 232 µg pre flutikazón- propionát a 14µg pre salmeterol).
Ako dôsledok optimalizácie výrobného procesu zodpovedajú lieky 3. fázy a komerčné lieky lepšie silám komparátorových liekov. Plazma na farmakokinetickú charakterizáciu sa získavala pri každom dávkovacom období.
Dospelí a dospievajúci vo veku 12 rokov a starší:
Vykonali sa dve klinické skúšania 3. fázy. 2 skúšania porovnávali kombináciu fixnej dávky s flutikazón- propionátom samotným alebo s placebom (skúšanie 1 a skúšanie 2).
Skúšania porovnávajúce Seffalair Spiromax (FS MDPI) s flutikazón-propionátom samotným alebo placebomS FS MDPI sa vykonali dve dvojito zaslepené klinické skúšania s paralelnými skupinami, skúšanie 1
a skúšanie 2 u 1 375 dospelých a dospievajúcich pacientov (vo veku 12 rokov a starších, s počiatočnou hodnotou FEV1 40 % až 85 % predpokladanej normálnej hodnoty) s astmou, ktorá nebola optimálne kontrolovaná ich súčasnou liečbou. Všetky liečby sa podávali ako 1 inhalácia dvakrát denne z inhalátora Spiromax a ostatné udržiavacie liečby sa prerušili.
Skúšanie 1: Toto randomizované, dvojito zaslepené, placebom kontrolované, 12-týždňové skúšanie účinnosti
a bezpečnosti porovnávalo Fp MDPI 55 µg a 113 µg (1 inhalácia dvakrát denne) s FS MDPI (14/55 µg a 14/113 µg (1 inhalácia dvakrát denne) a placebom u dospievajúcich (vo veku 12 rokov a starších)
a dospelých pacientov s pretrvávajúcou symptomatickou astmou napriek liečbe nízkymi dávkami alebo strednými dávkami inhalačných kortikosteroidov alebo inhalačných kortikosteroidov/LABA. Pacienti dostávali jednostranne zaslepené placebo MDPI a počas úvodného obdobia prešli z počiatočnej IKS liečby na inhalačný aerosól 40 µg beklometazón-dipropioátu dvakrát denne. Pacienti boli náhodne priradení na podávanie placeba alebo strednej liečebnej dávky nasledovne: 130 dostávalo placebo, 130 dostávalo Fp MDPI 113 µg a 129 dostávalo FS MDPI 14/113 µg. Počiatočné merané hodnoty FEV1 boli medzi liečebnými skupinami podobné. Primárne koncové ukazovatele pre toto skúšanie boli zmena od počiatočnej minimálnej hodnoty FEV1 v 12. týždni pre všetkých pacientov a štandardizovaná hodnota FEV1 AUEC0-12h upravená podľa počiatočnej hodnoty v 12. týždni pre podskupinu 312 pacientov, u ktorých sa vykonávala sériová spirometria po podaní dávky.
Štatistická premenná
|
| Fp MDPI
| FS MDPI
|
Placebo
(N = 129)
| 113 µg dvakrát
denne
(N = 129)
| 14/113 µg dvakrát
denne
(N = 126)
| Zmena minimálnej hodnoty FEV1 (l)
v 12. týždni
|
|
|
| Priemer LS
| 0,053
| 0,204
| 0,315
| Porovnanie s placebom
|
|
|
| Rozdiel v priemere LS
|
| 0,151
| 0,262
|
95 % IS
|
| (0,057;
0,244)
| (0,168;
0,356)
| Hodnota p
|
| 0,0017
| 0,0000
| Porovnanie s Fp MDPI
|
|
|
|
|
|
| Porovnanie so 113 µg:
| Rozdiel v priemere LS
|
|
| 0,111
|
95 % IS
|
|
| (0,017;
0,206)
| Hodnota p
|
|
| 0,0202
|
|
|
Tabuľka 2: Primárna analýza zmeny od počiatočnej minimálnej hodnoty FEV1 v 12. týždni podľa liečebnej skupiny v skúšaní 1 (FAS)Porovnania kombinovanej liečby s monoterapiou neboli kontrolované na multiplicitu.
FEV1 = úsilný expiračný objem (Forced Expiratory Volume) za 1 sekundu; FAS = úplný súbor analýzy (Full Analysis Set); Fp MDPI = flutikazón-propionát vo viacdávkovom inhalátore suchého prášku; FS MDPI = flutikazón-propionát/salmeterol vo viacdávkovom inhalátore suchého prášku; n = počet; LS = najmenšie štvorce (Least Squares); IS = interval spoľahlivosti
K zlepšeniam funkcie pľúc dochádzalo do 15 minút po prvej dávke (15 minút po podaní dávky, rozdiel
zmeny priemeru LS od počiatočnej hodnoty FEV1 bol 0,164 l pre FS MDPI 14/113 µg v porovnaní
s placebom (neupravená hodnota p < 0,0001). K maximálnemu zlepšeniu hodnoty FEV1 vo všeobecnosti docházalo do 6 hodín pre FS MDPI 14/113 µg a zlepšenia sa udržali počas 12 hodín testovania v 1.
a 12. týždni (obrázok 1). Po 12 týždňoch liečby sa nepozorovalo žiadne zníženie 12-hodinového
bronchodilatačného účinku.
Obrázok 1:Primárna analýza sériovej spirometrie: Priemerná zmena od počiatočnej hodnoty FEV1 (l) v 12. týždni podľa časového bodu a liečebnej skupiny v skúšaní 1 (FAS, podskupina sériovej spirometrie)
0,5
0,4
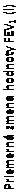
0,3
0,2
OBCHODNÝ NÁZOV SPIROMAX 113/14 µg (N = 60)
FLUTIKAZÓN-PROPIONÁT SPIROMAX 113 µg (N = 69)
PLACEBO (N = 53)
'
1. deň
Počiatočná hodnota ↑
12. týždeň
Počiatočná hodnota
Hodina
FAS = úplný súbor analýzy, FEV1 = úsilný expiračný objem za 1 sekundu
Skúšanie 2: Toto randomizované, dvojito zaslepené, placebom kontrolované, 12-týždňové skúšanie účinnosti
a bezpečnosti porovnávalo flutikazón-propionát vo viacdávkovom inhalátore suchého prášku (Fp MDPI)
113 µg a 232 µg (1 inhalácia dvakrát denne) s flutikazón-propionátom/salmeterolom vo viacdávkovom inhalátore suchého prášku (FS MDPI) 14/113 µg a 14/232 µg (1 inhalácia dvakrát denne) a placebom
u dospievajúcich a dospelých pacientov s pretrvávajúcou symptomatickou astmou napriek liečbe inhalačnými kortikosteroidmi alebo inhalačnými kortikosteroidmi/LABA. Pacienti dostávali jednostranne zaslepené placebo MDPI a počas úvodného obdobia prešli z počiatočnej IKS liečby na MDPI 55 µg dvakrát denne. Pacienti boli náhodne priradení na podávanie liečby nasledovne: 145 pacientov dostávalo placebo,
146 pacientov dostávalo Fp MDPI 113 µg, 146 pacientov dostávalo Fp MDPI 232 µg, 145 pacientov
dostávalo FS MDPI 14/113 µg a 146 pacientov dostávalo FS MDPI 14/232 µg. Počiatočné merané hodnoty FEV1 boli medzi liečebnými skupinami podobné: Fp MDPI 113 µg 2,069 l, Fp MDPI 232 µg 2,075 l, FS MDPI 14/113 µg 2,157 l, FS MDPI 14/232 µg 2,083 l a placebo 2,141 l. Primárne koncové ukazovatele pre toto skúšanie boli zmena od počiatočnej minimálnej hodnoty FEV1 v 12. týždni pre všetkých pacientov
a štandardizovaná hodnota FEV1 AUEC0-12h upravená podľa počiatočnej hodnoty v 12 týždni pre podskupinu 312 pacientov, u ktorých sa vykonávala sériová spirometria po podaní dávky.
Štatistická premenná
|
| Fp MDPI
| FS MDPI
| Placebo
(N = 143)
| 113 µg dvakrát denne
(N = 145)
| 232 µg dvakrát denne
(N = 146)
| 14/113 µg dvakrát denne
(N = 141)
| 14/232 µg dvakrát denne
(N = 145)
| Zmena minimálnej hodnoty FEV1 (l)
v 12. týždni
|
|
|
|
|
| Priemer LS
| -0,004
| 0,119
| 0,179
| 0,271
| 0,272
| Porovnanie s placebom
|
|
|
|
|
| Rozdiel v priemere LS
|
| 0,123
| 0,183
| 0,274
| 0,276
|
95 % IS
|
| (0,038;
0,208)
| (0,098;
0,268)
| (0,189;
0,360)
| (0,191;
0,361)
| Hodnota p
|
| 0,0047
| 0,0000
| 0,0000
| 0,0000
| Porovnanie s Fp MDPI
|
|
|
|
|
|
|
|
|
| Porovnanie so 113 µg:
| Porovnanie s 232 µg:
| Rozdiel v priemere LS
|
|
|
| 0,152
| 0,093
|
95 % IS
|
|
|
| (0,066;
0,237)
| (0,009;
0,178)
| Hodnota p
|
|
|
| 0,0005
| 0,0309
|
|
|
Tabuľka 3: Primárna analýza zmeny od počiatočnej minimálnej hodnoty FEV1 v 12. týždni podľa liečebnej skupiny v skúšaní 2 (FAS)Porovnania kombinovanej liečby s monoterapiou neboli kontrolované na multiplicitu.
FEV1 = úsilný expiračný objem za 1 sekundu; FAS = úplný súbor analýzy; Fp MDPI = flutikazón-propionát vo viacdávkovom inhalátore suchého prášku; FS MDPI = flutikazón-propionát/salmeterol vo viacdávkovom inhalátore suchého prášku; n = počet; LS = najmenšie štvorce; IS = interval spoľahlivosti
K zlepšeniam funkcie pľúc dochádzalo do 15 minút po prvej dávke (15 minút po podaní dávky bol rozdiel
zmeny priemeru LS od počiatočnej hodnoty FEV1 0,160 l a 0,187 l v porovnaní s placebom pre FS MDPI
14/113 µg a 14/232 µg, v uvedenom poradí; neupravená hodnota p < 0,0001 pre obe dávky v porovnaní
s placebom). K maximálnemu zlepšeniu hodnoty FEV1 vo všeobecnosti docházalo do 3 hodín pre obe dávkové skupiny FS MDPI a zlepšenia sa udržali počas 12 hodín testovania v 1. a 12. týždni (obrázok 2). Po
12 týždňoch liečby sa nepozorovalo žiadne zníženie 12-hodinového bronchodilatačného účinku pre žiadnu
z dávok FS MDPI, čo sa vyhodnocovalo podľa hodnoty FEV1 po 12 týždňoch liečby.
Obrázok 2:Primárna analýza sériovej spirometrie: Priemerná zmena od počiatočnej hodnoty FEV1 (l) v 12. týždni podľa časového bodu a liečebnej skupiny v skúšaní 2 (FAS, podskupina sériovej spirometrie)
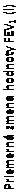
0,5
0,4
0,3
0,2
OBCHODNÝ NÁZOV SPIROMAX 232/14 µg (N = 65)
OBCHODNÝ NÁZOV SPIROMAX 113/14 µg (N = 57)
FLUTIKAZÓN-PROPIONÁT SPIROMAX 232 µg (N = 55)
FLUTIKAZÓN-PROPIONÁT SPIROMAX 113 µg (N = 56)
PLACEBO (N = 41)
1. deň
Počiatočná hodnota ↑
12. týždeň
Počiatočná hodnota
Hodina
FAS = úplný súbor analýzy, FEV1 = úsilný expiračný objem za 1 sekundu
Pediatrická populáciaSkúmali sa pacienti vo veku od 12 do 17 rokov. Súhrnné výsledky z oboch potvrdzujúcich skúšaní zmeny od
počiatočnej hodnoty FEV1 u pacientov vo veku 12-17 rokov sú uvedené nižšie (tabuľka 4). V 12. týždni boli zmeny od počiatočnej hodnoty FEV1 väčšie pre všetky dávkové skupiny Fp MDPI a FS MDPI ako pre skupinu s placebom v rámci všetkých vekových skupín v oboch štúdiách, čo je podobné ako celkové výsledky skúšaní.
Tabuľka 4: Súhrn skutočných hodnôt a zmena od počiatočnej minimálnej hodnoty FEV1 v 12. týždnipodľa liečebných skupín a veku 12-17 rokov (FAS)a
Štatistický
časový bod
|
Placebo
| Flutikazón-propionát Spiromax
| Seffalair Spiromax
|
113 µg dvakrát denne
| 232 µg dvakrát denne
| 14/113 µg dvakrát denne
| 14/232 µg dvakrát denne
|
Počiatočná hodnota
|
n
| 22
| 27
| 10
| 24
| 12
|
Priemer
(SD)
| 2,330; (0,3671)
| 2,249; (0,5399)
|
2,224; (0,4362)
|
2,341; (0,5513)
|
2,598; (0,5210)
|
Medián
| 2,348
| 2,255
| 2,208
| 2,255
| 2,425
|
Min., Max.
| 1,555; 3,075
| 0,915; 3,450
| 1,615; 3,115
| 1,580; 3,775
| 1,810; 3,695
|
Zmena v 12. týždni
|
n
| 22
| 27
| 10
| 24
| 12
|
Priemer
(SD)
|
0,09; (0,3541)
| 0,378; (0,4516)
|
0,558; (0,5728)
|
0,565; (0,4894)
|
0,474; (0,5625)
|
Medián
| 0,005
| 0,178
| 0,375
| 0,553
| 0,375
|
Min., Max.
| -0,850; 0,840
| -0,115; 1,650
| -0,080; 1,915
| -0,265; 1,755
| -0,295; 1,335
|
a Úplný súbor analýzy = FAS
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií so Seffalairom Spiromax vo všetkých podskupinách pediatrickej populácie pre liečbu astmy (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Pre farmakokinetické účely sa každá zložka môže uviesť osobitne.
Salmeterol
Salmeterol účinkuje lokálne v pľúcach, preto jeho plazmatické hladiny nie sú indikátorom terapeutických účinkov. Okrem toho je k dispozícii len obmedzené množstvo údajov o farmakokinetických vlastnostiach salmeterolu z dôvodu technickej zložitosti testovania lieku v plazme, zapríčinenej nízkymi plazmatickými koncentráciami pri terapeutických dávkach (približne 200 pikogramov/ml alebo menej) dosiahnutými po inhalačnom podaní.
Flutikazón-propionát
Absolútna biologická dostupnosť jednorazovej dávky inhalačného flutikazón-propionát u zdravých jedincov je medzi približne 5 % až 11 % nominálnej dávky v závislosti od použitej inhalačnej pomôcky. U pacientov s astmou sa pozoroval nižší stupeň systémovej expozície inhalačnému flutikazón-propionátu.
Absorpcia
K systémovej absorpcii dochádza najmä cez pľúca a je najprv rýchla a neskôr predĺžená. Zvyšok inhalovanej
dávky flutikazón-propionátu sa môže prehltnúť, avšak prispieva len minimálne s systémovej expozícii
z dôvodu nízkej rozpustnosti vo vode a presystémového metabolizmu, vedúcich k perorálnej dostupnosti nižšej než 1 %. Systémová expozícia rastie lineárne so zvyšujúcou sa inhalovanou dávkou.
Distribúcia
Dispozícia flutikazón-propionátu je charakterizovaná vysokým plazmatickým klírensom (1 150 ml/min),
veľkým objemom distribúcie v ustálenom stave (približne 300 l) a terminálnym polčasom približne 8 hodín. Väzba na proteíny je 91 %.
Biotransformácia
Flutikazón-propionát sa zo systémového obehu vylučuje veľmi rýchlo. Hlavnou cestou je metabolizmus na
inaktívny metabolit karboxylovej kyseliny sprostredkovaný cytochrómom P450 3A4. V stolici sa nachádzajú aj iné neidentifikované metabolity.
Eliminácia
Renálny klírens flutikazón-propionátu je zanedbateľný. Menej ako 5 % dávky sa vylučuje hlavne vo forme
metabolitov v moči. Hlavná časť dávky sa vylučuje v stolici vo forme metabolitov alebo ako nezmenené
liečivo.
Pediatrická populácia
Vykonala sa farmakokinetická analýza u pacientov vo veku 12 až 17 rokov. Aj keď podskupiny boli malé,
systémová expozícia flutikazón-propionátu a salmeterolu nebola pre podskupiny 12 až 17 rokov a ≥18 rokov pri všetkých liečbach výrazne odlišná od celkovej populácie štúdie. Zjavný polčas eliminácie (t½) nebol ovplyvnený vekom.
5
.3 Predklinické údaje o bezpečnosti
Jediným bezpečnostným rizikom použitia u ľudí odvodeným zo štúdií na zvieratách so salmeterolom
a flutikazón-propionátom podávanými samostatne boli účinky spojené so zosilnenými farmakologickými účinkami.
Štúdie na laboratórnych zvieratách (miniošípané, hlodavce a psy) preukázali výskyt srdcových arytmií
a náhleho úmrtia (s histologickým dôkazom nekrózy myokardu) pri súbežnom podávaní beta-agonistov a metylxantínov. Klinický význam týchto nálezov nie je známy.
V reprodukčných štúdiách u zvierat sa pre glukokortikosteroidy preukázalo, že spôsobujú zníženú telesnú hmotnosť a/alebo malformácie (rázštep podnebia, malformácie kostry) plodu u potkanov, myší a králikov, ktorým boli subkutánne podávané dávky toxické pre matku. Tieto výsledky štúdií na zvieratách sa však pri odporúčaných dávkach nezdajú byť relevantné pre ľudí, pričom flutikazón-propionát podávaný inhalačne potkanom znížil telesnú hmotnosť plodu, ale nebol teratogénny pri dávkach toxických pre matku, ktoré sú nižšie ako maximálna odporúčaná denná inhalačná dávka pre ľudí na základe telesného povrchu (mg/m2). Skúsenosti s perorálne podávanými kortikosteroidmi naznačujú, že hlodavce sú náchylnejšie na teratogénne účinky kortikosteroidov ako ľudia. Štúdie na zvieratách so salmeterolom ukázali embryofetálnu toxicitu len pri vysokých úrovniach expozície. Po súbežnom podávaní sa u potkanov zistil zvýšený výskyt transponovanej pupočnej tepny a nekompletnej osifikácie okcipitálnej kosti pri dávkach glukokortikosteroidov, o ktorých je známe, že spôsobujú abnormality.
6. FARMACEUTICKÉ ÚDAJE
6.1 Zoznam pomocných látok
Monohydrát laktózy (ktorý môže obsahovať mliečne proteíny).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov.
Po otvorení fóliového obalu: 2 mesiace.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25 °C. Po použití uchovávajte kryt náustku zatvorený.
6.5 Druh obalu a obsah balenia
Inhalátor je biely s polopriehľadným žltým krytom náustku. Časti inhalátora, ktoré prichádzajú do kontaktu s inhalačným práškom alebo sliznicou pacienta, sú vyrobené z akrylonitrilbutadiénstyrénu (ABS), polyetylénu (PE) a polypropylénu (PP). Každý inhalátor obsahuje 60 dávok a je zabalený do fólie s vysúšadlom.
Balenie obsahujúce 1 inhalátor.
Multibalenie obsahujúce 3 (3 balenia po 1) inhalátory.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6
.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITeva B.V., Swensweg 5,
2031 GA Haarlem
Holandsko
8. REGISTRAČNÉ ČÍSLA
EU/1/21/1533/001
EU/1/21/1533/002
EU/1/21/1533/003
EU/1/21/1533/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.com