
>
Bezpečnosť a účinnosť dexrazoxánu u starších pacientov nebola hodnotená a jeho použitie sa u týchto pacientov neodporúča.
Pediatrická populácia
Bezpečnosť a účinnosť Savene u detí mladších ako 18 rokov neboli stanovené a k dispozícii nie sú žiadne údaje.
Spôsobpodávania
Na intravenózne použite po rekonštitúcii a nariedení.
Pokyny na rekonštitúciu a nariedenie Savene pred podaním, pozri časť 6.6.
Indikovaná dávka sa má podať ako intravenózna infúzia trvajúca 1─2 hodiny do veľkej žily na končatine alebo v inej oblasti, ktorá nie je postihnutá extravazáciou. Ochladzovacie postupy, ako prikladanie balíčkov ľadu, treba ukončiť z oblasti najmenej 15 minút pred podávaním Savene, aby sa umožnilo dostatočné prúdenie krvi.
4.3 Kontraindikácie
• Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• U žien vo fertilnom veku nepoužívajúcich antikoncepciu (pozri časť 4.6).
• Dojčenie (pozri časť 4.6).
• Súbežná vakcinácia vakcínou proti žltej zimnici (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Kontinuálnemonitorovanie
Po ošetrení sú nutné pravidelné lokálne vyšetrenia až do zotavenia.
Ak je podozrenie na extravazáciu iných vezikancií než antracyklínov podaných cez rovnaký intravenózny vstup, napr. vincristín, mitomycín a vinorelbín, Savene nemusí byť účinný voči reakciám vyvolaným týmito látkami.
Keďže Savene sa podáva pacientom podstupujúcim cytotoxickú liečbu antracyklínmi, jeho cytotoxický potenciál (vedúci najmä k reverzibilnej hematologickej toxicite s najväčšou krízou na 11-
12. deň) je preto aditívny k ďalšiemu chemoterapeutiku.Preto je nutné pravidelné hematologické
sledovanie.
Monitorovanie funkcie pečene a obličiek
Keďže môže dôjsť (najmä po dávkach vyšších ako 1 000 mg/m2 dexrazoxánu) k dysfunkcii pečene
(zvýšené transaminázy a bilirubín), odporúča sa pred každým podaním dexrazoxánu vykonať u
pacientov so známkami poruchami pečene urobiť rutinné funkčné testy pečene.
Keďže dysfunkcia obličiek môže znížiť rýchlosť eliminácie dexrazoxánu, je potrebné u pacientov s počiatočnými poruchami obličiek sledovať prípadné prejavy hematologickej toxicity.
Anafylaktická reakcia
U pacientov liečených dexrazoxánom a antracyklínmi sa pozorovala anafylaktická reakcia vrátane angioedému, kožných reakcií, bronchospazmu, respiračnej tiesne, hypotenzie a straty vedomia (pozri časť 4.8) . Pred podaním sa má dôkladne zvážiť predošlý záznam o alergii na dexrazoxán (pozri časť
4.3).
O
bsah
sodíka
a
draslíka
Rozpúšťadlo Savene obsahuje draslík (98 mg/500 ml). Je potrebné to vziať do úvahy u pacientov so zníženou funkciou obličiek alebo u pacientov s diétou na kontrolu obsahu draslíka. Hladina draslíka v plazme sa musí dôsledne monitorovať u pacientov s rizikom hyperkaliémie.
Rozpúšťadlo Savene obsahuje aj sodík (1,61 g/500 ml), čo môže byť škodlivé u pacientov s diétou na kontrolu obsahu sodíka.
4.5 Liekové a iné interakcie
Súbežné použitie je kontraindikované:
Vakcína proti žltej zimnici. Riziko fatálneho generalizovaného ochorenia po vakcinácii (pozri časť
4.3).
Súbežné použitie sa neodporúča:
• Iné živé oslabené vakcíny: riziko systémového možného fatálneho ochorenia. Toto riziko je zvýšené u jedincov s imunitou potlačenou ich základným ochorením. Použiť inaktivovanú vakcínu, ak existuje (poliomyelitis) (pozri časť 4.4)
• Dimetylsulfoxid (DMSO) sa nemá používať u pacientov, ktorým sa podáva dexrazoxán na
liečbu antracyklínovej extravazácie (pozri časť 5.3)
• Fenytoín: cytotoxické látky môžu znižovať vstrebávanie fenytoínu, a tým viesť k zhoršeniu kŕčovitých záchvatov. Dexrazoxán sa neodporúča v kombinácii s fenytoínom.
Súbežné podávanie, ktoré sa musí starostlivo zvážiť:
Cyklosporín, takrolimus: Nadmerná imunosupresia s rizikom lymfoproliferatívneho ochorenia.
Interakcie časté u všetkých cytotoxických liečiv:
• Vzhľadom na zvýšené trombotické riziko u pacientov s malígnymi ochoreniami je častá liečba antikoagulanciami. Pacientov liečených antikoagulanciami je potrebné častejšie monitorovať, pretože cytotoxické látky môžu interagovať s perorálnymi antikoagulanciami.
• Dexrazoxán môže byť aditívny k toxicite vyvolanej chemoterapeutickým cyklom, počas ktorého došlo k nehode, čo si vyžaduje pozorné sledovanie hematologických parametrov (pozri časť 4.4)
Interakcie špecifické pre dexrazoxán:
Pri testovaní na piatich hlavných izoenzýmoch cytochrómu P450 CYP1A, CYP2C9, CYP2C19, CYP2D6 a CYP3A4 dexrazoxán neinhiboval žiadny z nich.
4.6 Fertilita, gravidita a laktácia
Ženyvofertilnomveku/antikoncepciažienamužov
Ženy vo fertilnom veku musia počas liečby používať antikoncepciu a ak otehotnejú, musia ihneď informovať svojho lekára (pozri časť 4.3).
Keďže dexrazoxán vykazuje mutagénnu aktivitu, mužom liečeným dexrazoxánom sa odporúča, aby nesplodili dieťa počas liečby a do troch mesiacov po jej ukončení a/alebo používali v tom istom čase antikoncepciu.
Gravidita
Nie sú k dispozícii údaje o použití dexrazoxánu u gravidných žien. Dexrazoxán môže spôsobiť poškodenie plodu, keď sa podáva tehotným ženám. K dispozícii je malé množstvo predklinických
údajov týkajúcich sa reprodukčnej toxicity (pozri časť 5.3). Dexrazoxán sa nesmie podať tehotným ženám, kým to nie je jednoznačne nevyhnutné.
Laktácia
Nie je známe, či sa dexrazoxán vylučuje do mlieka u ľudí. Vzhľadom na potenciálne závažné nežiaduce reakcie u dojčených detí vystavených dexrazoxánu matky musia prerušiť dojčenie počas
liečby liekom Savene (pozri časť 4.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
V štúdii Savene TT01 a TT02 (pozri časť 4.8) sa hlásili u niekoľkých zaradených pacientov závraty, ospalosť a synkopa. Dexrazoxán má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Niekoľko publikovaných štúdií zahrňujúcich vyše 1 000 pacientov preukázalo uniformný model nežiaducich reakcií závislých od dávky. Najčastejšie nežiaduce reakcie sú: nevoľnosť/vracanie, útlm kostnej drene (neutropénia, trombocytopénia), reakcie v mieste podania injekcie, hnačka, stomatitída a zvýšenie hepatálnych transamináz (ALT/AST). Všetky nežiaduce reakcie boli rýchlo reverzibilné.
Nasledujúce informácie sa zakladajú na dvoch klinických štúdiach TT01 a TT02, v ktorých bol
Savene podávaný pacientom s extravazáciou s prebiehajúcimi cyklami chemoterapie.
Nežiaduce reakcie boli typické pre štandardné chemoterapeutiká, ako aj pre dexrazoxán:nevoľnosť/vracanie u približne tretiny pacientov, neutropénia a trombocytopénia približne u polovice pacientov, zriedkavejší bol vzostup koncentrácie pečeňových enzýmov (ALT/AST). Nežiaduce reakcie pozorované v oboch klinických štúdiách sú uvedené nižšie.
Incidencia nežiaducich reakcií (MedDRA) v štúdiách TT01 a TT02 (n=80 pacientov) (Upozornenie: počty pri poruchách krvi a lymfatického systému sú uvedené v samostatnej tabuľke laboratórnych vyšetrení.)
Hlásené nežiaduce reakcie sú zoradené podľa nasledujúcich frekvencií:
Veľmi časté (≥1/10) Časté (≥1/100 až <1/10)
Menej časté (≥1/1 000 až <1/100) Zriedkavé (≥1/10 000 až <1/1 000)
Veľmi zriedkavé (<1/10 000)
Triedy orgánových systémov Frekvencia Nežiaduce reakcie
Infekcie a nákazy Veľmi časté Pooperačná infekcia
Časté Infekcia
Neutropenická infekcia
Poruchy imunitného systému Neznáme Anafylaktické reakcie
Neznáme Precitlivenosť
Poruchy metabolizmu a výživy Časté Zníženie chuti do jedla
Poruchy nervového systému Časté Závraty
Strata zmyslového vnímania
Synkopa
Tras
Poruchy ciev Časté Flebitída
Povrchová tromboflebitída
Venózna trombóza končatín
Poruchy dýchacej sústavy, hrudníka a mediastína Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného
tkaniva
Časté Dyspnoe
Pneumónia Veľmi časté Nevoľnosť Časté Vracanie
Hnačka Stomatitída Sucho v ústach
Časté Alopécia
Pruritus
T
riedy orgánových systémov Frekvencia Nežiaduce reakcie
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Poruchy reprodukčného systému a prsníkov
Celkové poruchy a reakcie v mieste podania
Časté Myalgia
Časté Vaginálne krvácanie
Veľmi časté Bolesť v mieste podania injekcie
Pyrexia
Flebitída v mieste podania injekcie
Erytém v mieste podania injekcie
Časté
Únava
Indurácia v mieste podania injekcie
Opuch v mieste podania injekcie
Periférny edém
Ospalosť
Laboratórne a funkčné
vyšetrenia
Úrazy, otravy a komplikácie liečebného postupu
Časté Zníženie telesnej hmotnosti
Časté Komplikácie pri hojení rán
Incidencia laboratórnych abnormalít v štúdiách TT01 a TT02 (n=80 pacientov)
L
aboratórny test
P
očet pacientov so zmenenými hodnotami
CT
C stupeň 3-4
N %
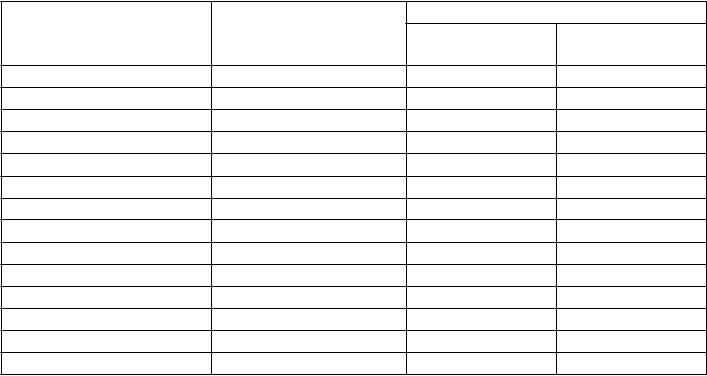
Hemoglobín 80 2 2,5 % Biele krvinky 80 36 45,0 % Neutrofily 78 36 46,2 % Krvné doštičky 80 17 21,3 % Sodík (Hypo) 79 5 6,3 % Draslík (Hypo) 79 2 2,5 % Draslík (Hyper) 79 0 0,0 % Alkalická fosfatáza 77 0 0,0 % Bilirubín 77 1 1,3 % AST 57 2 3,5 % ALT 71 3 3,9 % Kreatinín 76 2 2,6 % LDH 78 0 0,0 % Vápnik celkový (Hypo) 28 2 7,1 %
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieK prejavom a symptómom predávkovania patrí leukopénia, trombocytopénia, nevoľnosť, vracanie, hnačka, kožné reakcie a alopécia. Liečba musí byť symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: liečivá na zníženie toxicity protinádorovej liečby, ATC kód: V03AF02
V literatúre sú popísané dve farmakodynamické vlastnosti dexrazoxánu:
1. prevencia antracyklínovej kardiotoxicity a
2. antineoplastický účinok.
Mechanizmusúčinku
Dexrazoxán má dva hlavné mechanizmy účinku:
1. Chelácia železa prostredníctvom metabolitu s otvoreným kruhom, čím znižuje oxidatívny stres vyvolaný voľnými radikálmi železa spojený s antracyklínom indukovanou kardiotoxicitou.
2 Inhibícia topoizomerázy II.
Nie je známe, v akom rozsahu každý z týchto mechanizmov prispieva k ochrannému účinku proti poškodeniu tkaniva v dôsledku antracyklínovej extravazácie.
Schopnosť chelácie pravdepodobne vyvoláva tiež zvýšené vylučovanie železa a zinku v moči a znižuje koncentráciu vápnika v sére, tak ako je to popísané v niekoľkých štúdiách.
Klinickáúčinnosťabezpečnosť
Klinický program týkajúci sa Savene (dexrazoxánu) zahŕňal dve otvorené, multicentrické štúdie s jedným ramenom. Hlavným cieľom týchto štúdií bolo zistiť účinnosť Savene podávaného intravenózne pri prevencii poškodenia tkaniva v dôsledku náhodnej extravazácie antracyklínu, a tým ochrániť pacienta pred rutinne používaným chirurgickým odstránením postihnutého tkaniva.
Z dôvodu zriedkavého výskytu týchto stavov sú na porovnanie k dispozícii len údaje z minulosti
(chirurgický zákrok u 35-50 % prípadov v jednej krajine zo 100 % biopsiou potvrdených prípadov).
V oboch štúdiách bol dávkovací režim rovnaký. Liečba so Savene sa musela začať do 6 hodín po extravazácii a zopakovať po 24 a 48 hodinách. Prvá a druhá dávka bola 1 000 mg/m2 a tretia dávka bola 500 mg/m2.
Podmienkou zaradenia do časti tejto štúdie na účinnosť bolo potvrdenie antracyklínovej extravazácie fluorescenčnou mikroskopiou jednej alebo viacerých biopsií.
Zo študijných dôvodov do vyhodnotenia účinnosti neboli zaradení pacienti s extravazáciou spôsobenou centrálnym venóznym katétrom (CVAD).
Pacienti s neutrópeniou a trombocytopéniou > CTC 1. stupňa (Common Toxicity Criteria) neboli zaradení do týchto klinických štúdií.
Do štúdie TT01 bolo zaradených 23 pacientov, ktorí boli liečení liekom Savene. Účinnosť
a bezpečnosť bola vyhodnotená u 18 pacientov, u zvyšných 5 pacientov bola vyhodnotená len cytotoxicita. U žiadneho pacienta nebol potrebný chirurgický zákrok.
Do štúdie TT02 bolo zaradených 57 pacientov, ktorým bola podaná prvá dávka lieku Savene. Účinnosť bola vyhodnotená u 36 pacientov. Iba u jedného z 36 pacientov bol potrebný chirurgický zákrok.
V oboch štúdiách bol pacientom podávaný antracyklín. Najčastejšie podávaným antracyklínom bol epirubicín (56 % pacientov).
V oboch štúdiách liečba dexrazoxánom u väčšiny pacientov zabránila tvorbe nekrózy, u väčšiny pacientov umožnila pokračovanie v liečbe nádorového ochorenia podľa rozvrhu(70,4%) znížil sa výskyt komplikácií (bol pozorovaný len nízky počet strednodobých komplikácií).'
5.2 Farmakokinetické vlastnosti
Savene sa musí podávať len intravenózne. Distribúcia
Údaje z literatúry naznačujú, že kinetika dexrazoxánu v sére po intravenóznom podaní sa správa podľa
otvoreného dvojkompartmentového modelu nezávislého od rozvrhu a dávky. Zjavné distribučné objemy sú 0,13─1,3 l/kg (medián 0,49 l/kg). Distribučný objem nezávisí od dávky. Plochy pod krivkou (AUC) sú úmerné k dávke. Distribúcia v tkanivách je rýchla, s najvyššími hladinami nezmenenej materskej zlúčeniny a hydrolyzovaného produktu objavujúcich sa v pečeni a obličkách. Približne 2 % dexrazoxánu sa viažu na proteíny.
Biotransformácia
Dexrazoxán podlieha intracelulárnej hydrolýze, pri ktorej najprv vzniknú dva intermediáty s jedným otvoreným kruhom (B a C) a následne forma s dvomi otvorenými kruhmi (ADR-925), ktorá má
štruktúru podobnú EDTA a je silným chelátorom železa a dvojmocných katiónov, ako sú napr. katióny
vápnika.
Eliminácia
Dexrazoxán vykazuje dvojfázovú kinetiku eliminácie. Počiatočný polčas eliminácie (alfa) je 0,18─1 h
(medián 0,34 h) a terminálny polčas eliminácie je 1,9─9,1 h (medián 2,8 h). Celkovo sa močom vylúči
34 %─60 % nezmeneného dexrazoxánu. Systémový klírens nezávisí od dávky. Farmakokinetika metabolitov je odvodená z jednoduchej štúdie s piatimi pacientmi. Priemerný polčas eliminácie metabolitu B s jedným otvoreným kruhom je 0,9─3,9 h (n=5) a metabolitu C je 0,5─0,8 h (n=3). Polčas eliminácie metabolitu s dvoma otvorenými kruhmi ADR-925 nie sa v literatúre zatiaľ nenachádza. ADR-925 sa v priebehu 15 minút po infúzii 1500 mg/m2 zvýši trojnásobne a zostáva relatívne konštantný na koncentračnom plató po dobu 4 hodín a následne sa jeho hladina zníži po 24 hodinách približne na polovicu. Klírens môže byť znížený u pacientov s nízkym klírensom kreatinínu.
In vitro štúdie dexrazoxánu na ľudských mikrozómoch ukázali vysokú stabilitu dexrazoxánu, čo naznačuje, že hlavný metabolizmus dexrazoxánu sprostredkovaný cytochrómom P450 je nepravdepodobný.
Nie sú k dispozícii dostatočné údaje, aby urobili definitívne závery na intrinsic farmakokinetické faktory ako je vek, pohlavie, rasa a hmotnosť. Inter- a intraindividuálne farmakokinetické variability neboli systematicky študované. Na základe údajov získaných od obmedzeného počtu pacientov bol urobený odhad, že interindividuálna variabilita vypočítaná ako koeficient variácie (CV %) predstavuje približne 30 % hlavných farmakokinetických parametrov.
5.3 Predklinické údaje o bezpečnosti
Dexrazoxán má mutagénne účinky. Karcinogénny potenciál dexrazoxánu sa neštudoval, avšak hlásilo sa, že dlhodobé podávanie razoxánu (racemickej zmesi dexrazoxánu a levrazoxánu) sa spájalo s rozvojom sekundárnych zhubných nádorov u myší (lymfoidné neoplázie) a u potkanov (karcinómy maternice). Oba tieto účinky sa dajú očakávať pri tejto skupine zlúčenín.
Štúdie toxicity po opakovanom podávaní ukázali, že primárnymi cieľovými orgánmi sú tkanivá s rýchlym bunkovým delením: kostná dreň, lymfatické tkanivo, semenníky a tráviaci trakt. Myelosupresia je preto častá. Zreteľný účinok je väčší počas dlhodobého podávania než pri akútnom podaní. Toxicita v kombinácii s doxorubicínom bola aditívna a nie synergická.
Príbuzné liečivo razoxán sa ukázalo byť embryotoxické u myší, potkanov a králikov a teratogénne
u myší a potkanov.
Keď sa myši s experimentálnou extravazáciou daunorubicínu liečili systémovo podaným dexrazoxánom v kombinácii s topickou liečbou DMSO na daunorubicínom postihnutú kožu, v 67 % sa vytvorili malé kožné rany, zatiaľ čo terapia samotným dexrazoxánom u inej skupine myší úplne zabránila tvorbe daunorubicínom vyvolanej kožnej nekrózy. Z tohto dôvodu sa DMSO nesmie používať u pacientov, ktorým bol v rámci liečby antracyklínovej extravazácie podaný dexrazoxán.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Liekovkaspráškom žiadne
Fľaškasrozpúšťadlom:
chlorid sodný
chlorid draselný
chlorid horečnatý, hexahydrát octan sodný, trihydrát glukonát sodný
hydroxid sodný
voda na injekciu
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
Prášokarozpúšťadlo:
3 roky.
Po rekonštitúcii a nariedení:
Bola dokázaná chemická a fyzikálna stabilita po nariedení počas 4 hodín pri uchovávaní pri teplote 2 -
8 °C.
Z mikrobiologického hľadiska sa produkt musí použiť okamžite.
Ak sa liek nepoužije okamžite, za čas a podmienky uschovania pred použitím zodpovedá používateľ a
uschovanie nemá presiahnuť 4 hodiny pri 2 až 8 °C.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 °C.
Injekčné liekovky a fľašky uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky uchovávania po rekonštitúcii a zriedení lieku pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Prášok Savene:
Sklená injekčná liekovka typu I jantárového sfarbenia s gumenou zátkou vyrobenou z chlórobutylu
a s vyklápacím alebo odtrhnuteľným viečkom.
Rozpúšťadlo Savene :
500 ml roztoku vo fľaške vyrobenej zo skla typu I (Ph. Eur.).
Veľkosti balenia:
Savene sa dodáva ako pohotovostné balenie obsahujúce 10 injekčných liekoviek s práškom Savene a 3
fľašky s 500 ml rozpúšťadla Savene.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPred infúziou sa prášok Savene musí rozpustiť v 25 ml rozpúšťadla Savene, čím sa získa roztok s koncentráciou 20 mg dexrazoxánu na ml. Koncentrát je svetložltý. Koncentrát sa potom musí ďalej zriediť zostávajúcim rozpúšťadlom Savene.
Pri rekonštitúcii a riedení je potrebná opatrnosť a osvojenie bežných postupov správneho zaobchádzania s cytotoxickými liekmi. S prípravkom nemajú manipulovať tehotné ženy. Na zabránenie kontaktu s pokožkou sa odporúča použitie rukavíc a ďalšieho ochranného odevu. Reakcie pokožky boli hlásené po kontakte s dexrazoxánom. V prípade kontaktu s pokožkou alebo sliznicami, postihnuté miesto okamžite a dôkladne opláchnite vodou.
Nepoužitý liek alebo odpad vzniknutý z lieku sa musí zlikvidovať v súlade s miestnymi požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIClinigen Healthcare Ltd
Pitcairn House
Crown Square, First Avenue Burton-on-Trent, Staffordshire DE14 2WW
Veľká Británia
8. REGISTRAČNÉ ČÍSLOEU/1/06/350/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. júla 2006
Dátum posledného predĺženia registrácie: 18. júla 2011
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu