
napr. kardiovaskulárny stav, anémia existujúca už pred začiatkom chemoterapie).
- Retacrit možno použiť na zvýšenie tvorby autológnej krvi od pacientov v darcovskom programe. Jeho použitie na túto indikáciu musí byť v rovnováhe s rizikom trombembolických príhod. Liečba sa má podávať len pacientom s miernou anémiou (hemoglobínu, Hb 10 - 13 g/dl
[6,2 - 8,1 mmol/l], bez nedostatku železa), ak nie je možné uchovať krv alebo ak množstvo uchovanej krvi nezodpovedá spotrebe pri plánovaných väčších chirurgických zákrokoch
vyžadujúcich si veľký objem krvi (4 a viac jednotiek u žien alebo 5 a viac jednotiek u mužov).
- Retacrit sa môže použiť na zníženie rizika expozície voči alogénnej transfúzii krvi u dospelých pacientov bez deficitu železa pred plánovanou rozsiahlou ortopedickou operáciou s vysokým rizikom komplikácií súvisiacich s transfúziou. Použitie sa má obmedziť u pacientov so stredne ťažkou anémiou (napríklad hodnota hemoglobínu 10 – 13 g/dl), pre ktorých nie je dostupný program autológneho darcovstva a s očakávanými stredne závažnými stratami krvi (900 až
1 800 ml).
4.2 Dávkovanie a spôsob podania
Liečbu Retacritom je potrebné začať pod dohľadom lekárov, ktorí majú skúsenosti s vedením pacientov s vyššie uvedenými indikáciami.
Dávkovanie
Liečba symptomatickej anémie u dospelých a pediatrických pacientov s chronickým zlyhaním obličiek
Retacrit sa má podávať subkutánne alebo intravenózne.
Cieľová koncentrácia hemoglobínu je 10 až 12 g/dl (6,2 - 7,5 mmol/l), s výnimkou pediatrických pacientov, u ktorých má byť koncentrácia hemoglobínu 9,5 až 11 g/dl (5,9 - 6,8 mmol/l). Horný limit pre cieľovú koncentráciu hemoglobínu sa nemá prekračovať.
Príznaky anémie a jej dôsledky sa môžu líšiť v závislosti od veku, pohlavia a celkového priebehu ochorenia. Je potrebné lekárske zhodnotenie klinického stavu a kondície každého jednotlivého pacienta. Retacrit sa má podávať subkutánne alebo intravenózne, aby zvýšenie hemoglobínu nebolo väčšie ako 12 g/dl (7,5 mmol/l). V dôsledku rozdielov u jedného pacienta sa občas môže pozorovať kolísanie hodnôt hemoglobínu u pacienta nad a pod požadovanú koncentráciu hemoglobínu. Kolísanie hemoglobínu sa má riešiť dávkovaním s ohľadom na cieľové rozpätie hemoglobínu od 10 g/dl
(6,2 mmol/l) do 12 g/dl (7,5 mmol/l).
Je potrebné sa vyhnúť dlhodobej koncentrácii hemoglobínu vyššej ako 12 g/dl; pokyny pre správnu úpravu dávky v prípade, ak hodnoty hemoglobínu presahujú 12 g/dl (7,5 mmol/l), sú uvedené nižšie. Hemoglobín sa nemá zvýšiť o viac ako 2 g/dl (1,25 mmol/l) za štyri týždne. Ak k tomu dôjde, je potrebná úprava dávky podľa pokynov.
Pacienti musia byť starostlivo sledovaní, aby sa zaistilo, že na primeranú kontrolu príznakov anémie sa používa najnižšia schválená účinná dávka Retacritu pri zachovaní koncentrácie hemoglobínu pod hladinou alebo na hladine 12 g/dl (7,5 mmol/l).
Pri zvyšovaní dávok Retacritu u pacientov s chronickým zlyhávaním obličiek je potrebná opatrnosť. U pacientov so slabou odpoveďou hemoglobínu na Retacrit treba uvažovať o alternatívnej príčine slabej odpovede (pozri časti 4.4 a 5.1)
U pacientov s chronickým renálnym zlyhaním a klinicky preukázanou ischemickou chorobou srdca alebo kongestívnym zlyhaním srdca nemá byť pri udržovaní koncentrácie hemoglobínu prekročený horný limit cieľovej koncentrácie hemoglobínu.
Dospelí pacienti na hemodialýzeRetacrit sa má podávať subkutánne alebo intravenózne. Liečba je rozdelená do dvoch fáz:
1. Korekčná fáza: 50 IU/kg 3-krát týždenne. Pokiaľ je nutné dávku upraviť, má sa táto úprava vykonávať postupne, aspoň po dobu štyroch týždňov. V jednotlivých krokoch tejto úpravy sa má dávka zvyšovať alebo znižovať o 25 IU/kg 3-krát týždenne.
2. Udržiavacia fáza: Úprava dávky za účelom udržania hodnôt hemoglobínu (Hb) na požadovanej úrovni: Hb od 10 do 12 g/dl (6,2 - 7,5 mmol/l). Celková odporúčaná týždenná
dávka je 75 až 300 IU/kg.
Podľa dostupných klinických údajov môže byť u pacientov s príliš nízkou úvodnou dávkou hemoglobínu (< 6 g/dl alebo < 3,75 mmol/l) nutné použiť vyššie udržiavacie dávky než u pacientov, ktorých úvodná anémia je menej závažná (Hb > 8 g/dl alebo > 5 mmol/l).
Detskí pacienti na hemodialýzeLiečba je rozdelená do dvoch fáz:
1. Korekčná fáza: 50 IU/kg 3-krát týždenne intravenózne. Pokiaľ je nutné dávku upraviť, má sa táto úprava vykonávať postupne o 25 IU/kg 3-krát týždenne v intervaloch
aspoň 4 týždne, pokým nebude dosiahnutý požadovaný cieľ.
2. Udržiavacia fáza: Úprava dávky za účelom udržania hodnôt hemoglobínu (Hb) na požadovanej úrovni: Hb od 9,5 do 11 g/dl (5,9 - 6,8 mmol/l).
Deti a dospievajúci s telesnou hmotnosťou do 30 kg vyžadujú obvykle vyššie údržbové dávky ako deti a dospelí s telesnou hmotnosťou vyššou než 30 kg. Nasledujúce udržiavacie dávky boli zaznamenané
v klinických skúškach po 6 mesiacoch liečby.
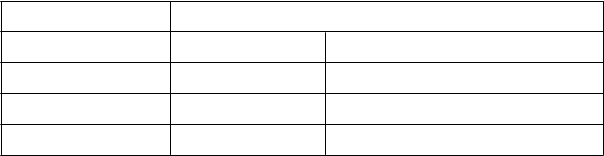
Dávka (IU/kg 3-krát týždenne)
Hmotnosť (kg) Stredná hodnota Obvyklá udržiavacia dávka
< 10 100 75-150
10-30 75 60-150
> 30 33 30-100
Podľa dostupných klinických údajov môže byť u pacientov s príliš nízkou úvodnou dávkou
hemoglobínu (< 6,8 g/dl alebo < 4,25 mmol/l) nutné použiť vyššie udržiavacie dávky než u pacientov, ktorých úvodná anémia je menej závažná (Hb > 6,8 g/dl alebo > 4,25 mmol/l).
Dospelí pacienti na peritoneálnej dialýze
Retacrit sa má podávať subkutánne alebo intravenózne. Liečba je rozdelená do dvoch fáz:
1. Korekčná fáza: Úvodná dávka 50 IU/kg 2-krát týždenne.
2. Udržiavacia fáza: Úprava dávky za účelom udržania hodnôt hemoglobínu (Hb) na požadovanej úrovni: (Hb od 10 do 12 g/dl (6,2 - 7,5 mmol/l). Udržiavacia dávka od 25 do
50 IU/kg 2-krát týždenne v 2 rovnakých dávkach.
Dospelí pacienti so zlyhaním činnosti obličiek zatiaľ nezaradení do dialyzačného programu
Retacrit sa má podávať subkutánne alebo intravenózne. Liečba je rozdelená do dvoch fáz:
1. Korekčná fáza: Úvodná dávka 50 IU/k 3-krát týždenne; nasledovaná v prípade potreby
zvýšením dávky o 25 IU/kg (3-krát týždenne), kým nebude dosiahnutý požadovaný cieľ (nutné vykonávať postupne po dobu aspoň štyroch týždňov).
2. Udržiavacia fáza: Počas udržiavacej fázy, Retacrit môže byť podávaný buď 3-krát týždenne, a pri subkutánnom podaní, jedenkrát týždenne alebo jedenkrát každé dva
týždne. Vhodná úprava dávky a dávkovacích intervalov má byť vykonaná za účelom udržania hodnôt hemoglobínu (Hb) na požadovanej úrovni: Hb od 10 do 12 g/dl (6,2 - 7,5 mmol/l). Predĺženie dávkovacieho intervalu môže
vyžadovať zvýšenie dávky.
Maximálna dávka nemá prekročiť 150 IU/kg 3-krát týždenne, 240 IU/kg (maximálne až do 20 000 IU)
jedenkrát týždenne alebo 480 IU/kg (maximálne až do 40 000 IU) jedenkrát každé dva týždne.
Liečba pacientov s anémiou vyvolanou chemoterapiou
Retacrit sa má pacientom s anémiou (napr. koncentrácia hemoglobínu ≤ 10 g/dl (6,2 mmol/l) podávať
subkutánne. Príznaky anémie a jej dôsledky sa môžu líšiť v závislosti od veku, pohlavia a celkového priebehu ochorenia. Je potrebné lekárske zhodnotenie klinického stavu a kondície každého
jednotlivého pacienta.
V dôsledku rozdielov u jedného pacienta sa občas môže pozorovať kolísanie hodnôt hemoglobínu u pacienta nad a pod požadovanú koncentráciu hemoglobínu. Kolísanie hemoglobínu sa má riešiť dávkovaním s ohľadom na cieľové rozpätie hemoglobínu od 10 g/dl (6,2 mmol/l) do 12 g/dl
(7,5 mmol/l). Je potrebné sa vyhnúť dlhodobej koncentrácii hemoglobínu vyššej ako 12 g/dl
(7,5 mmol/l); pokyny pre správnu úpravu dávky v prípade, ak hodnoty hemoglobínu presahujú 12 g/dl
(7,5 mmol/l), sú uvedené nižšie.
Pacienti musia byť starostlivo sledovaní, aby sa zaistilo, že na primeranú kontrolu príznakov anémie sa používa najnižšia schválená dávka Retacrit.
Liečba Retacritom má pokračovať až do uplynutia jedného mesiaca po skončení chemoterapie. Úvodná dávka je 150 IU/kg podávaná subkutánne 3-krát týždenne. Alternatívne je možné Retacrit
podávať s úvodnou dávkou 450 IU/kg subkutánne raz týždenne.
Pokiaľ sa zvýšil hemoglobín aspoň o 1 g/dl (0,62 mmol/l) alebo sa počet retikulocytov zvýšil o
≥ 40 000 buniek/µl nad referenčnú hodnotu po 4 týždňoch liečby, má dávka zostať na 150 IU/kg 3- krát týždenne alebo 450 IU/kg raz týždenne. Pokiaľ sa zvýšil hemoglobín o < 1 g/dl (0,62 mmol/l) a
počet retikulocytov sa zvýšil o < 40 000 buniek/µl nad referenčnú hodnotu, zvýšte dávku na 300 IU/kg
3-krát týždenne. Pokiaľ sa po ďalších 4 týždňoch liečby dávkou 300 IU/kg 3-krát týždenne zvýšil hemoglobín o ≥ 1 g/dl (0,62 mmol/l) alebo sa počet retikulocytov zvýšil o ≥ 40 000 buniek/µl, má dávka zostať na úrovni 300 IU/kg 3-krát týždenne. Pokiaľ sa ale hemoglobín zvýšil o < 1 g/dl
(0,62 mmol/l) a počet retikulocytov sa zvýšil o < 40 000 buniek/µl nad referenčnú hodnotu, je reakcia nepravdepodobná a liečba sa má prerušiť.
Informácie o odporúčanom dávkovacom režime sú uvedené v nasledujúcom diagrame:
150 IU/kg 3x/týždeň
alebo 450 IU/kg jedenkrát týždenne
4 týždne


Zvýšenie počtu retikulocytov o ≥ 40 000/μl
alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o < 40 000/μl


a zvýšenie hodnoty Hb o < 1 g/dl
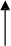
Požadovaná hodnota Hb
(10 - 12 g/dl)
300 IU/kg
3x/týždeň

4 týždne
Zvýšenie počtu retikulocytov o ≥ 40 000/μl
alebo zvýšenie hodnoty Hb o ≥ 1 g/dl
Zvýšenie počtu retikulocytov o < 40 000/μl

a zvýšenie hodnoty Hb o < 1 g/dl
Ukončenie liečby
Hneď ako bol u jednotlivých pacientov dosiahnutý terapeutický cieľ, dávku možno zredukovať o 25 až
50 % tak, aby zostala zachovaná koncentrácia hemoglobínu. Treba uvažovať o titrácii dávky.
Úprava dávky
Pokiaľ je rýchlosť nárastu hemoglobínu o > 2 g/dl (> 1,25 mmol/l) za mesiac, má sa dávka Retacritu znížiť o 25 – 50 %. Hneď ako koncentrácia hemoglobínu prekročí 12 g/dl (7,5 mmol/l), prerušte liečbu, pokiaľ koncentrácia neklesne na 12 g/dl (7,5 mmol/l) alebo nižšie a potom liečbu Retacritom opäť obnovte s dávkou o 25 % nižšou, než bola predchádzajúca dávka.
Liečba dospelých pacientov podstupujúcich chirurgický zákrok, ktorí sa zúčastňujú autológnehodarcovského programuRetacrit sa má podávať intravenózne.
Počas celého obdobia, keď sa daruje krv, sa má Retacrit podať po skončení procedúry darovania krvi. Mierne anemickí pacienti (hematokrit 33 – 39 %), u ktorých je nutné predzásobenie ≥ 4 jednotkami
krvi, sa majú liečiť Retacritom v dávke 600 IU/kg telesnej hmotnosti 2-krát týždenne po dobu 3
týždňov pred chirurgickým zákrokom.
Všetkým pacientom liečeným Retacritom sa má podávať odpovedajúce množstvo doplnkového železa (napr. 200 mg elementárneho železa perorálne raz denne) po celú dobu liečby. Doplňovanie železa sa má začať čo najskôr, aj niekoľko týždňov pred začatím autológneho predzásobenia, aby sa pred začatím liečby Retacritom dosiahli vysoké koncentrácie železa.
Liečba dospelých pacientov pred plánovanou rozsiahlou ortopedickou operáciou
Retacrit sa má podávať subkutánne.
Dávka 600 IU/kg telesnej hmotnosti sa má podávať raz týždenne počas 3 týždňov (21., 14. a 7. deň) pred operáciou a v deň operácie (0. deň). Ak je potrebné skrátiť čas pred operáciou na menej ako 3 týždne, dávka 300 IU/kg telesnej hmotnosti sa má podávať denne počas 10-tich po sebe nasledujúcich dní pred operáciou, v deň operácie a počas 4 dní ihneď po operácii. Ak sa vykonávajú hematologické vyšetrenia počas predoperačného obdobia a koncentrácia hemoglobínu dosahuje 15 g/dl, alebo viac, podávanie Retacritu sa má ukončiť a ďalšie dávky sa nemajú podávať.
Na začiatku liečby Retacritom sa treba uistiť, že pacient nemá deficit železa. Okrem toho majú všetci pacienti dostávať primeranú náhradu železa (napríklad 200 mg železa denne perorálne) počas liečby Retacritom. Ak je to možné, náhrada železa má začať pred liečbou Retacritom, aby sa zabezpečili primerané zásoby železa.
Spôsob podania
Intravenózna injekcia
Dávka sa má podávať aspoň po dobu 1 - 5 minút, v závislosti od celkovej dávky. U pacientov na
hemodialýze je možné podať bolusovú injekciu počas samotnej dialýzy cez vhodný žilový vstup vedení pre dialýzu. Alternatívne je možné injekciu podať na konci samotnej dialýzy cez trubičku
s ihlou zavedenou do píšťali; potom má nasledovať 10 ml chloridu sodného, roztok 9 mg/ml (0,9 %)
k vypláchnutiu trubičky a zaisteniu uspokojivého zavedenia lieku do krvného obehu.
U pacientov, ktorí reagujú na liečbu „chrípkovými“ príznakmi, je lepšie vykonávať vstrieknutie pomalšie.
Retacrit sa nesmie podávať intravenóznou infúziou.
Retacrit sa nesmie používať v kombinácii so žiadnymi ďalšími liekmi (pozri časť 6.2).
Subkutánna injekcia
Všeobecne sa v jednom mieste vpichu nemá prekročiť maximálny objem 1 ml. V prípade väčších
objemov sa má pre injekciu zvoliť viac než len jedno miesto. Injekcie sa vpichujú do končatín alebo do prednej brušnej steny. Pokyny na prípravu lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Pacientom, u ktorých sa po liečbe akýmkoľvek erytropoetínom rozvinie čistá aplázia červených krviniek (PRCA), sa Retacrit ani žiadny iný erytropoetín nesmie podávať (pozri časť 4.4).
- Nekontrolovaná hypertenzia.
- U indikácie „zvýšená dostupnosť autológnej krvi“: infarkt myokardu alebo mŕtvica v priebehu mesiaca, ktorý predchádza liečbe, nestabilná angína pectoris, zvýšené riziko vzniku hlbokožilnej trombózy, ako napr. žilná trombembolická choroba v anamnéze.
- U indikácie rozsiahlej ortopedickej operácie: závažné ochorenie koronárnych, periférnych artérií, karotíd alebo mozgovo-cievne ochorenia, vrátane pacientov s nedávno prekonaným infarktom myokardu alebo mozgovo-cievnou príhodou. Pacienti, ktorým nie je možno
z akéhokoľvek dôvodu podávať adekvátnu antitrombotickú profylaxiu.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné informácie
Počas liečby Retacritom môže rovnako ako u všetkých pacientov užívajúcich erytropoetín dôjsť k
zvýšeniu krvného tlaku. Krvný tlak je potrebné pozorne sledovať a zodpovedajúcim spôsobom upravovať pri všetkých pacientoch, ktorí ešte nemajú skúsenosti s liečbou epoetínom, tak ako aj
u pacientov, ktorí ho užívali, a to pred začatím liečby Retacritom, na jej začiatku a aj v jej priebehu.
Môže vzniknúť potreba zintenzívniť či posilniť liečbu zvýšeného krvného tlaku. Ak nie je možné dostať krvný tlak pod kontrolu, má sa liečba Retacritom prerušiť.
Retacrit sa má používať s opatrnosťou taktiež aj v prípade epilepsie a chronického pečeňového zlyhania.
Počas liečby erytropoetínom môže dôjsť k miernemu nárastu počtu krvných doštičiek v bežnom rozsahu, ktorý bude závislý od podanej dávky. V priebehu kontinuálnej liečby sa počet krvných doštičiek opäť vráti do normálu. Počas prvých 8 týždňov liečby sa odporúča počet krvných doštičiek pravidelne kontrolovať.
Pred začatím liečby Retacritom a v jej priebehu je potrebné vziať do úvahy všetky ďalšie príčiny anémie (nedostatok železa, hemolýzu, stratu krvi, nedostatok vitamínu B12 alebo folátov) a liečiť ich. Vo väčšine prípadov poklesnú hodnoty feritínu v sére súbežne s nárastom objemu červených krviniek oddelených od plazmy. Aby bola zaistená optimálna reakcia na erytropoetín, je potrebné zaistiť adekvátne vysokú koncentráciu železa:
· u pacientov s chronickým renálnym zlyhaním, ktorých koncentrácia feritínu v sére je nižšia než
100 ng/ml, sa odporúča doplňovanie železa, napr. 200 - 300 mg/denne perorálne (100 –
200 mg/denne u detských pacientov);
· u všetkých pacientov s nádorovým ochorením, ktorých saturácia transferínu je nižšia než 20 %, sa odporúča perorálna substitúcia železa 200 - 300 mg/denne.
Všetky tieto doplnkové faktory anémie sa majú taktiež starostlivo zvážiť pri rozhodovaní o zvýšení dávky erytropoetínu u pacientov s nádorovým ochorením.
Paradoxný pokles hemoglobínu a rozvoj závažnej anémie spojenej s nízkym počtom retikulocytov má viesť k prerušeniu liečby a vykonaniu skúšok na protilátky proti erytropoetínu. U pacientov liečených epoetínom a súčasne interferonom a ribavirinom boli hlásené prípady hepatitídy C. Epoetíny nie sú schválené v liečbe anémie spojenej so žltačkou typu C.
V pacientových záznamoch sa má zaznamenať názov predpísanej látky stimulujúcej erytropoézu
(ESA), aby sa zlepšila možnosť vyhľadania ESA.
Počas prípravy pacienta pred samotným chirurgickým zákrokom sa má vždy dodržiavať správna prax manipulácie s krvou.
Pacienti pred plánovanou rozsiahlou ortopedickou operáciou
U pacientov pred plánovanou rozsiahlou ortopedickou operáciou sa má príčina anémie stanoviť a
liečiť, ak je to možné, pred začatím liečby Retacritom.
Trombotické príhody môžu byť rizikom u tejto populácie a túto možnosť treba starostlivo zvážiť voči očakávanému prínosu z liečby.
Pacienti majú dostať primeranú antitrombotickú profylaxiu, pretože u chirurgických pacientov sa môžu vyskytnúť trombotické a cievne príhody, najmä u pacientov s kardiovaskulárnym ochorením. Okrem toho treba dodržiavať špeciálne opatrenia u pacientov s predispozíciou na rozvoj hlbokej žilovej trombózy. Navyše u pacientov s východiskovou koncentráciou hemoglobínu > 13 g/dl nemožno vylúčiť možnosť, že liečba Retacritom sa môže spájať so zvýšeným rizikom pooperačných trombotických/cievnych príhod. Preto sa nemá použiť u pacientov s východiskovou koncentráciou hemoglobínu > 13 g/dl.
Pacienti s chronickým zlyhaním obličiek
Koncentrácia hemoglobínu
U pacientov s chronickým zlyhaním obličiek nemá udržiavacia koncentrácia hemoglobínu prekročiť horný limit cieľovej koncentrácie hemoglobínu, podľa odporúčania v časti 4.2. V klinických štúdiách
sa pozorovalo zvýšené riziko úmrtia, závažných kardiovaskulárnych príhod alebo cerebrovaskulárnych príhod vrátane mŕtvice pri podaní ESAs na dosiahnutie hemoglobínu vyššieho ako 12 g/dl
(7,5 mmol/l).
Kontrolované klinické štúdie nepreukázali signifikantný prínos pripísateľný podávaniu epoetínov, keď sa koncentrácie hemoglobínu zvýšia nad úroveň nevyhnutnú na kontrolu príznakov anémie a na to,
aby sa predišlo krvnej transfúzii.
Koncentrácia hemoglobínu sa má pravidelne merať, kým nebude dosiahnutá stabilná úroveň,
a pravidelne aj potom. Rýchlosť nárastu hemoglobínu má byť približne 1 g/dl (0,62 mmol/l) za mesiac a nemá prekročiť 2 g/dl (1,25 mmol/l) za mesiac, aby sa minimalizovalo riziko vzniku či zhoršenia
hypertenzie.
Pacienti s chronickým zlyhaním obličiek liečení Retacritom subkutánne majú byť sledovaní pravidelne pre stratu účinnosti, ktorá je definovaná ako absentujúca alebo znížená odpoveď na liečbu Retacritom
u pacientov, ktorí predtým na takúto liečbu reagovali. To je charakterizované trvalým poklesom hemoglobínu v dôsledku zvýšenia dávok Retacritu.
Niektorí pacienti s predĺženými dávkovacími intervalmi (väčšia ako jedenkrát týždenne) epoetínu nemusia udržať adekvátnu hladinu hemoglobínu (pozri časť 5.1) a môže to vyžadovať zvýšenie dávok epoetínu. Hladina hemoglobínu by mala byť pravidelne monitorovaná.
Opatrnosť je potrebná pri zvyšovaní dávok Retacritu pacientom s chronickým zlyhaním, obličiek, pretože vysoké kumulatívne dávky epoetínu môžu byť spojené so zvýšeným rizikom úmrtnosti, závažných kardiovaskulárnych a cerebrovaskulárnych príhod. U pacientov so slabou odpoveďou hemoglobínu na epoetíny treba uvažovať o alternatívnej príčine slabej odpovede (pozri časti 4.2 a 5.1)
Žiadna reakcia na liečbu erytropoetínom má viesť k urýchlenému hľadaniu príčinných faktorov. Jedná sa o nedostatok železa, folátov alebo vitamínu B12, intoxikáciu hliníkom, vracajúcu sa infekciu, zápalové alebo traumatické príhody, skrytú stratu krvi, hemolýzu a fibrózu kostnej drene akéhokoľvek pôvodu.
Prípady PRCA spôsobené protilátkami boli u pacientov trpiacich chronickým zlyhaním obličiek, ktorým bol erytropoetín podávaný subkutánne, hlásené veľmi zriedka. U pacientov s náhlym vznikom nedostatočnej účinnosti, ktorá sa definuje ako pokles hemoglobínu (1 - 2 g/dl za mesiac) so zvýšenou nutnosťou transfúzií, je potrebné stanoviť počet retikulocytov a zistiť charakteristické príčiny nedostatočnej reakcie (napr. nedostatok železa, folátu, vitamínu B12, intoxikácia hliníkom, infekcia alebo zápal, strata krvi a hemolýza). Ak sa nepodarí identifikovať žiadnu príčinu, je potrebné pre potreby diagnózy PRCA zvážiť vyšetrenie kostnej drene.
V prípade diagnózy PRCA sa musí liečba Retacritom okamžite prerušiť a zvážiť vykonanie skúšok na protilátky proti erytropoetínu. Pacienti nemajú prechádzať na iný liek, pretože protilátky proti erytropoetínu reagujú krížovo s inými erytropoetínmi. Je potrebné vylúčiť ďalšie príčiny PRCA
a nasadiť odpovedajúcu liečbu.
Odporúča sa pravidelne sledovať počet retikulocytov za účelom zistenia možného výskytu nedostatočnej účinnosti u pacientov s chronickým zlyhaním obličiek.
V ojedinelých prípadoch bola pozorovaná hyperkaliémia. U pacientov s chronickým zlyhaním obličiek môže úprava anémie viesť ku zvýšenej chuti k jedlu a príjmu draslíka a proteínov. Je možné, že bude nutné pravidelne upravovať predpísanú dialýzu, aby sa močovina, kreatinín a draslík udržali v požadovanom rozsahu. U pacientov s chronickým zlyhaním obličiek sa majú sledovať elektrolyty
v sére. V prípade zistenia zvýšenej (alebo zvyšujúcej sa) koncentrácie draslíka v sére je treba zvážiť ukončenie podávania erytropoetínu, pokým nedôjde k úprave hyperkaliémie.
V priebehu liečby erytropoetínom je počas hemodialýzy často nutné zvýšiť v dôsledku nárastu objemu červených krviniek oddelených od plazmy dávku heparínu. Pokiaľ nie je heparinizácia optimálna, je možná oklúzia dialyzačného systému.
Na základe aktuálne dostupných informácií, úprava anémie pomocou erytropoetínu u dospelých pacientov s renálnou insuficienciou zatiaľ nezaradených do dialyzačného programu, mieru progresie renálnej insuficiencie nezrýchľuje.
Dospelí pacienti s nádorovým ochorením a symptomatickou anémiou, ktorí podstupujú chemoterapiu
U pacientov s nádorovým ochorením, ktorí podstupujú chemoterapiu, sa pri posudzovaní vhodnosti
liečby Retacritom (pacient je vystavený riziku nutnosti podania transfúzie) má vziať do úvahy 2 – 3- týždenné oneskorenie medzi podaním erytropoetínu a výskytom červených krviniek vyvolaných
erytropoetínom.
Koncentrácia hemoglobínu sa má starostlivo sledovať, kým nebude dosiahnutá stabilná úroveň,
a pravidelne aj potom. Ak prekročí rýchlosť nárastu hemoglobínu 2 g/dl (1,25 mmol/l) za mesiac alebo, ak koncentrácia hemoglobínu prekročí 12 g/dl (7,5 mmol/l), je potrebné starostlivo upraviť dávku popísanú v časti 4.2, aby sa minimalizovalo riziko trombotických príhod (pozri časť 4.2).
Ako náhle bol u pacientov s nádorovým ochorením, ktorým sa podávajú erytropoetické lieky (pozri časť 4.8), pozorovaný zvýšený výskyt trombotických cievnych príhod, je treba toto riziko dôkladne zvážiť v porovnaní s úžitkom, ktorý môže liečba (pomocou Retacritu) priniesť, zvlášť u pacientov
s nádorovým ochorením so zvýšeným rizikom trombotických cievnych príhod, ako napr. obezitou, a u pacientov s trombotickými cievnymi príhodami v anamnéze (napr. hlbokožilnou trombózou alebo
pľúcnou embóliou).
Dospelí pacienti podstupujúci chirurgický zákrok, ktorí sa zúčastňujú autológneho darcovskéhoprogramu
Je potrebné dodržiavať všetky zvláštne varovania a upozornenia súvisiace s autológnym darcovským
programom, zvlášť s rutinnou náhradou objemu.
Potenciál pre rast nádoru
Epoetíny sú rastové faktory, ktoré stimulujú hlavne tvorbu červených krviniek. Erytropoetínové
receptory sa môžu nachádzať na povrchu mnohých nádorových buniek. Ako u všetkých rastových faktorov existuje obava, že epoetíny môžu stimulovať rast akejkoľvek malignity. V niekoľkých kontrolovaných štúdiách epoetíny nepreukázali zlepšovanie celkového prežívania alebo zníženie rizika progresie nádoru u pacientov s anémiou spojenou s rakovinou.
Niekoľko kontrolovaných klinických štúdií, v ktorých boli epoetíny podávané pacientom trpiacim rôznymi druhmi nádorov, vrátane rakoviny hlavy a krku, rakoviny pľúc a rakoviny prsníka, preukázalo zvýšenú úmrtnosť.
V kontrolovaných klinických štúdiách sa ukázalo, že použitie Epoetínu alfa a iných látok
stimulujúcich erytropoézu (ESAs) bolo spojené so:
· skrátením času do progresie nádoru u pacientov s pokročilou rakovinou hlavy a krku, ktorí boli na radiačnej terapii, ak im uvedené látky boli podávané tak, aby cieľový hemoglobín bol väčší ako 14 g/dl (8,7 mmol/l),
· skráteným celkovým prežívaním a zvýšenou úmrtnosťou po štyroch mesiacoch, pripísateľnými progresii ochorenia u pacientov s metastatickou rakovinou prsníka podstupujúcich chemoterapiu, ak im uvedené látky boli podávané tak, aby cieľový hemoglobín bol v rozmedzí 12 – 14 g/dl (7,5 - 8,7 mmol/l),
· zvýšené riziko úmrtia, ak sú uvedené látky podávané tak, aby cieľový hemoglobín bol 12 g/dl
(7,5 mmol/l) u pacientov s aktívnym malígnym ochorením, ktorí nepodstupujú ani chemoterapiu ani radiačnú terapiu. ESAs nie sú určené na použitie u takejto populácie pacientov.
V súvislosti s vyššie uvedeným je v niektorých klinických situáciách pri liečení anemických pacientov s rakovinou lepšie dať prednosť transfúzii krvi. Rozhodnutie o podaní rekombinantných
erytropoetínov má byť založené na vyhodnotení pomeru prínos/riziko s účasťou pacienta, a to
v špecifickom klinickom kontexte. V tomto štádiu hodnotenia treba zohľadniť faktory ako typ nádoru a jeho štádium; stupeň anémia; očakávanú dĺžku života; prostredie, v ktorom bude pacient liečený;
a preferenciu pacienta (pozri časť 5.1).
Závažné kožné nežiaduce reakcie
V súvislosti s liečbou epoetínom boli hlásené závažné kožné nežiaduce reakcie (SCAR, severe
cutaneous adverse reaction) vrátane Stevensovho-Johnsonovho syndrómu (SJS) a toxickej epidermálnej nekrolýzy (TEN), ktoré môžu byť život ohrozujúce alebo smrteľné. Pri epoetínoch s dlhodobým účinkom boli pozorované závažnejšie prípady.
V čase predpisovania je potrebné pacientov upozorniť na prejavy a symptómy a starostlivo sledovať kožné reakcie. Ak sa objavia prejavy a symptómy naznačujúce reakcie, Retacrit sa musí okamžite vysadiť a je potrebné zvážiť alternatívnu liečbu.
Ak sa u pecienta vyvinula závažná kožná reakcia, ako je SJ alebo TEN kvôli použitiu Retacritu, liečba s Retacritom sa už nikdy nesmie opätovne zahájiť u tohto pacienta.
Tento liek obsahuje fenylalanín, ktorý môže byť škodlivý pre osoby trpiace fenylketonúriou.
Tento liek obsahuje menej než 1 mmol sodíka (23 mg) na dávku, t. j. je v podstate bez obsahu sodíka.
4.5 Liekové a iné interakcie
Neexistujú žiadne dôkazy o tom, že by liečba erytropoetínom menila metabolizmus iných liekov. Pokiaľ ale červené krvinky vyviažu cyklosporín, existuje potenciál pre interakciu s inými liekmi.
V prípade súčasného podávania erytropoetínu s cyklosporínom je treba sledovať koncentráciu
cyklosporínu v krvi a v prípade, že dôjde k nárastu hematokritu, je treba cyklosporín upraviť.
Neexistuje dôkaz o interakcii medzi epoetínom alfa a faktorom stimulujúcim kolónie granulocytov (G- CSF) alebo faktorom stimulujúcim kolónie granulocytov a makrofágov (GM-CSF) vzhľadom na hematologickú diferenciáciu alebo proliferáciu v bioptických vzorkách tumorov in vitro.
4.6 Fertilita, gravidita a laktácia
Neboli vykonané adekvátne a dostatočne riadené štúdie u gravidných žien. Štúdie na zvieratách ukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe, či sa exogénny epoetín zeta vylučuje do ľudského mlieka Preto sa erytropoetín má počas gravidity a laktácie počas všeobecne používať len
v prípade, keď jeho potenciálny úžitok preváži potenciálne riziko pre plod.
Nie sú k dispozícii žiadne údaje o účinkoch epoetínu zeta na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Retacrit nemá žiadny alebo má len zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Zhrnutiebezpečnostnéhoprofilu
Údaje z klinických štúdií s Retacritom sú v súlade s bezpečnostným profilom iných povolených erytropoetínov. Na základe výsledkov klinických skúšok s inými schválenými erytropoetínmi sa približne u 8 % pacientov liečených erytropoetínom prejavia nežiaduce účinky. Nežiaduce účinky počas liečby erytropoetínom sú zaznamenané hlavne u pacientov s chronickým zlyhaním obličiek alebo malignitami. Týmito nežiaducimi účinkami sú najčastejšie bolesť hlavy a zvýšenie krvného tlaku v závislosti od dávky. Môže sa vyskytnúť hypertenzná kríza so symptómami podobnými encefalopatii. Pozornosť sa má venovať náhlym ostrým bolestiam hlavy podobným záchvatom migrény ako možnému varovnému signálu.
U dospelých pacientov s obličkovou insuficienciou, ktorí ešte nepodstúpili dialýzu, bola v štúdiách s predĺženým dávkovacím intervalom zaznamenaná kongescia dýchacích ciest, ktorá zahŕňa prípady kongescie horných dýchacích ciest, kongescie nosa a nazofaryngitídy.
U pacientov liečených erytropoetínmi boli hlásené trombovaskulárne príhody, ako napríklad ischémia myokardu, infarkt myokardu, cerebrovaskulárne príhody (krvácanie do mozgu a mozgový infarkt), prechodné ischemické záchvaty, hlboká žilová trombóza, arteriálna trombóza, pľúcna embólia, aneuryzma, retinálna trombóza a zrážanie krvi v umelej obličke.
Erytroblastopénia sprostredkovaná protilátkami (PRCA) bola zaznamenaná po mesiacoch až rokoch liečby epoetínom alfa. U väčšiny týchto pacientov boli zistené protilátky na erytropoetín (pozri časti
4.3 a 4.4).
Zoznamnežiaducichreakcií uvedenývtabuľke
V tejto časti sa uvádzajú frekvencie nežiaducich reakcií nasledovne: veľmi časté (> 1/10); časté
(> 1/100 až < 1/10); menej časté (> 1/1 000 až < 1/100); zriedkavé (> 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
V rámci každej skupiny frekvencií sú nežiaduce reakcie uvedené v poradí podľa zostupnej závažnosti. Frekvencie sa môžu odlišovať v závislosti od indikácie.
Triedy orgánových systémov
podľa databázy MedDRA Poruchy krvi a lymfatického systému
Frekvencia Nežiaduca reakcia na liek
Veľmi zriedkavé Trombocytóza (pozri časť 4.4) Neznáme Protilátkami sprostredkovaná
erytroblastopénia (PRCA)
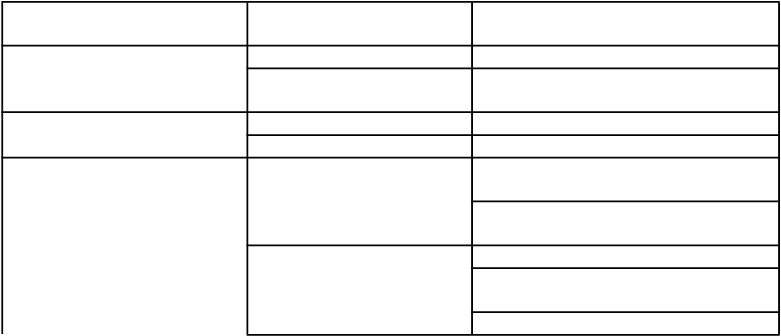
Poruchy imunitného systému Zriedkavé Precitlivenosť
Veľmi zriedkavé Anafylaktická reakcia
Poruchy nervového systému Veľmi časté Závrat (pacienti s chronickým zlyhaním obličiek)
Bolesť hlavy (pacienti s nádorovým ochorením)
Časté Mŕtvica
Závrat (pacienti s nádorovým ochorením)
Bolesť hlavy (pacienti s chronickým
Triedy orgánových systémov podľa databázy MedDRA
Frekvencia Nežiaduca reakcia na liek
zlyhaním obličiek) Menej časté Krvácanie do mozgu Neznáme Mozgový infarkt
Hypertenzná encefalopatia
Prechodné ischemické záchvaty
Poruchy oka Neznáme Retinálna trombóza
Poruchy srdca a srdcovej činnosti
Neznáme Infarkt myokardu
Ischémia myokardu
Poruchy ciev Časté Hlboká žilová trombóza (pacienti s nádorovým ochorením) Zvýšenie krvného tlaku
Neznáme Aneuryzmy
Arteriálna trombóza
Hlboká žilová trombóza (pacienti s chronickým zlyhaním obličiek) Hypertenzná kríza
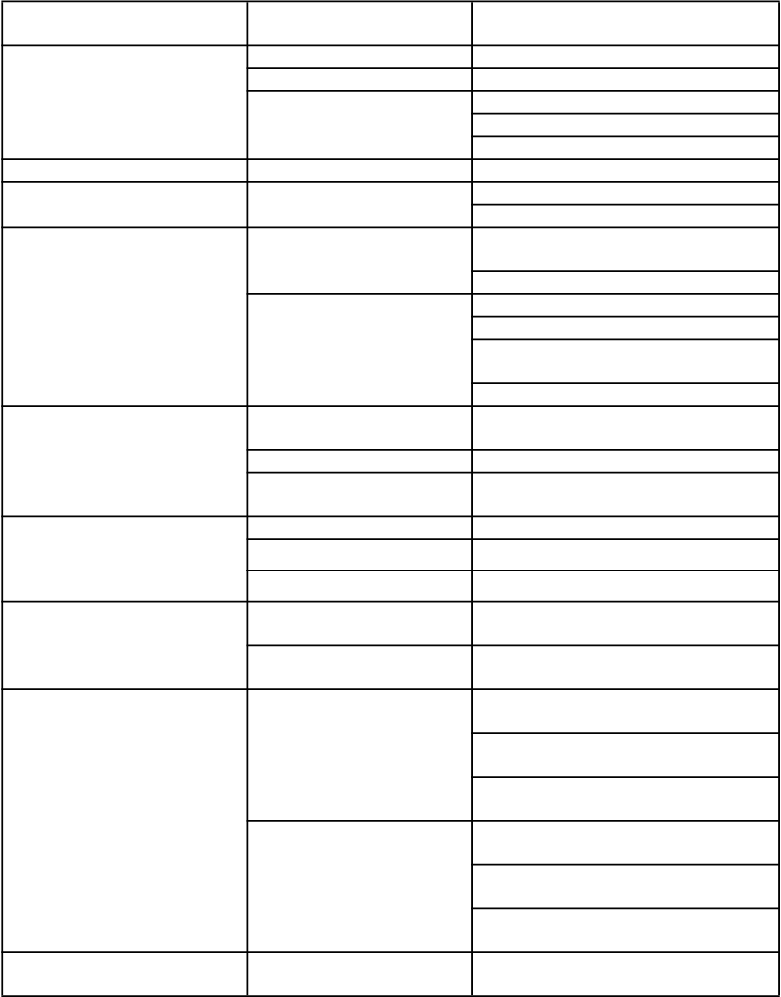
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Celkové poruchy a reakcie v mieste podania
Úrazy, otravy a komplikácie liečebného postupu
Časté Pľúcna embólia (pacienti s nádorovým ochorením)
Menej časté Preťaženie dýchacej sústavy
Neznáme Pľúcna embólia (pacienti s chronickým zlyhaním obličiek)
Časté Nešpecifické kožné vyrážky
Veľmi zriedkavé Angioedém
Neznáme Pruritus
Veľmi časté Bolesti kĺbov (pacienti s chronickým zlyhaním obličiek)
Časté Bolesti kĺbov (pacienti s nádorovým ochorením)
Veľmi časté Príznaky podobné chrípke (pacienti s chronickým zlyhaním obličiek)
Pocit slabosti (pacienti s chronickým zlyhaním obličiek)
Únava (pacienti s chronickým zlyhaním obličiek)
Časté Príznaky podobné chrípke (pacienti s nádorovým ochorením)
Pocit slabosti (pacienti s nádorovým ochorením)
Únava (pacienti s nádorovým ochorením)
Časté Zrážanie krvi v umelej obličke
 Opis
vybraných
nežiaducich
účinkov
Dospelí a pediatrickí hemodialyzovaní pacienti, dospelí pacienti na peritoneálnej dialýze a dospelí
pacienti so zlyhaním činnosti obličiek zatiaľ nezaradení do dialyzačného programu
Opis
vybraných
nežiaducich
účinkov
Dospelí a pediatrickí hemodialyzovaní pacienti, dospelí pacienti na peritoneálnej dialýze a dospelí
pacienti so zlyhaním činnosti obličiek zatiaľ nezaradení do dialyzačného programu
Počas liečby epoetínom alfa je najčastejšou nežiaducou reakciou zvýšenie krvného tlaku v závislosti
od dávky alebo zhoršenie existujúcej hypertenzie. Zvýšenia krvného tlaku je možné liečiť liekmi. Okrem toho sa odporúča monitorovanie krvného tlaku, obzvlášť na začiatku liečby. U jednotlivých pacientov s normálnym alebo nízkym krvným tlakom sa pozorovali aj nasledujúce reakcie:
hypertenzná kríza so symptómami podobnými encefalopatii (napr. bolesti hlavy a stav zmätenosti) a generalizované tonicko-klonické kŕče vyžadujúce okamžitú lekársku pomoc a intenzívnu lekársku starostlivosť. Zvláštna pozornosť sa má venovať náhlym ostrým bolestiam hlavy podobným záchvatom migrény, ako o možný varovný signál.
Môže sa vyskytnúť trombóza cievnej spojky, najmä u pacientov so sklonom k hypotenzii alebo u pacientov s komplikáciami spojenými s arteriovenóznou fistulou (napr. stenóza, aneuryzma atď.). U týchto pacientov sa odporúča včasná kontrola cievnej spojky a profylaxia trombózy podaním napríklad kyseliny acetylsalicylovej.
Dospelí pacienti s nádorovým ochorením a symptomatickou anémiou liečení chemoterapiouU pacientov liečených epoetínom alfa sa môže vyskytnúť hypertenzia. Z tohto dôvodu sa má
starostlivo monitorovať hemoglobín a krvný tlak.
U pacientov liečených erytropoetínmi bol pozorovaný zvýšený výskyt trombovaskulárnych príhod
(pozri časť 4.4 a časť 4.8 – Všeobecné).
Pacienti podstupujúci chirurgický zákrokBez ohľadu na liečbu erytropoetínom môže u pacientov podstupujúcich chirurgický zákrok, ktorí
v dôsledku opakovanej flebotómie trpia niektorým z kardiovaskulárnych ochorení, dôjsť
k trombotickým a vaskulárnym príhodám. Preto sa má u takých pacientov vykonávať rutinná náhrada objemu.
U pacientov s úvodnou koncentráciou hemoglobínu > 13 g/dl sa nemôže vylúčiť možnosť, že liečba
Retacritom sa môže spájať so zvýšeným rizikom pooperačných trombotických/vaskulárnych príhod.
Závažné kožné nežiaduce reakcieV súvislosti s liečbou epoetínom boli hlásené závažné kožné nežiaduce reakcie (SCAR, severe
cutaneous adverse reaction) vrátane Stevensovho-Johnsonovho syndrómu (SJS) a toxickej epidermálnej nekrolýzy (TEN), ktoré môžu byť život ohrozujúce alebo smrteľné (pozri časť 4.4).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovanieTerapeutická rezerva erytropoetínu je veľmi široká. Predávkovanie erytropoetínom môže vyvolať účinky, ktoré sú nadstavbou farmakologických účinkov hormónov. Pokiaľ bude koncentrácia hemoglobínu príliš vysoká, je možné vykonať flebotómiu. V prípade potreby je nutné poskytnúť dodatočnú podpornú starostlivosť.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Iné antianemiká, erytropoetín
ATC kód: B03XA01
Retacrit je biologicky podobný liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu
Farmakodynamické účinky
Erytropoetín je glykoproteín, ktorý stimuluje, ako mitotický stimulační faktor a diferenciační hormón,
tvorbu erytrocytov z prekurzorov v priestore kmeňových buniek.
Zdanlivá molekulová hmotnosť erytropoetínu je 32 000 – 40 000 daltonov. Bielkovinová časť molekuly prispieva asi z 58 % k celkovej molekulárnej hmotnosti a skladá sa zo 165 aminokyselín. Štyri uhľohydrátové reťazce sú s bielkovinou spojené troma N-glykosidickými väzbami a jednou
O-glykosidickou väzbou. Aminokyselinová sekvencia a podobné uhľohydrátové zloženie epoetínu zeta je identické ako u endogénneho ľudského erytropoetínu, ktorý bol izolovaný z moču anemických
pacientov.
Biologická účinnosť erytropoetínu bola preukázaná na niekoľkých zvieracích modeloch in vivo (normálne a anemické potkany, polycytemické myši). Po podaní erytropoetínu sa počet erytrocytov, hodnoty Hb a počet retikulocytov zvýši, a podobne tak narastie aj rýchlosť inkorporácie 59Fe.
Zvýšená rýchlosť inkorporácie 3H-thymidínu do erytroidných nukleotidných buniek sleziny bola zistená in vitro (bunková kultúra myšej sleziny) po inkubácii s erytropoetínom. Pomocou bunkových kultúr buniek ľudskej kostnej drene by bolo možné ukázať, že erytropoetín stimuluje špecificky erytropoézu a neovplyvňuje leukopoézu. Cytotoxické pôsobenie erytropoetínu na bunky kostnej drene sa nepodarilo zistiť.
Podobne ako u iných hematopoetických rastových faktorov preukázal erytropoetín stimulačné vlastnosti in vitro na endoteliálnych ľudských bunkách.
Dospelí pacienti s obličkovou insuficienciou zatiaľ nezaradení do dialyzačného programu
V 2 štúdiách s predĺženým intervalom dávkovania erytropoetínu (3-krát týždenne, jedenkrát za týždeň,
jedenkrát každé 2 týždne a jedenkrát každé 4 týždne) niektorí pacienti s dlhšími dávkovacími intervalmi neudržali dostatočné hladiny hemoglobínu a dosiahli hranicu hemoglobínu, pre ktorú bolo v
protokole definované prerušenie liečby (0 % jedenkrát za týždeň, 3,7 % jedenkrát každé 2 týždne a 3,3
% v skupine s dávkovaním jedenkrát každé 4 týždne).
Klinická účinnosť a bezpečnosť
721 pacientov s nádorovým ochorením a podstupujúcich neplatinovú chemoterapiu bolo zaradených
do troch štúdií kontrolovaných placebom, 389 pacientov s hematologickými malignitami (221 s mnohopočetným myelómom, 144 s ne-Hodgkinovým lymfómom a 24 s ďalšími hematologickými
malignitami) a 332 so solídnymi nádormi (172 s nádorom prsníka, 64 s gynekologickým nádorom, 23
s nádorom pľúc, 22 s nádorom prostaty, 21 s gastrointestinálnym nádorom a 30 s inými typmi nádoru). Do dvoch veľkých otvorených štúdií bolo zaradených 2 697 pacientov s nádorovým ochorením a
podstupujúcich neplatinovú chemoterapiu, 1 895 pacientov bolo so solídnymi nádormi (683 s nádorom
prsníka, 260 s nádorom pľúc, 174 s gynekologickým nádorom, 300 s gastrointestinálnym nádorom a
478 s inými typmi nádoru) a 802 s hematologickými malignitami.
Prospektívna, randomizovaná, dvojito-zaslepená, placebom kontrolovaná štúdia vykonávaná s 375 anemickými pacientmi s rôznymi nemyeloidnými malignitami a podstupujúcimi neplatinovú chemoterapiu ukázala výrazné zníženie následkov súvisiacich s anémiou (napr. únava, znížene energie, zníženie aktivity), merané s použitím nasledujúcich nástrojov a stupníc: všeobecná stupnica funkčného hodnotenia liečby rakoviny - anémie (Functional Assessment of Cancer Therapy-Anaemia
- FACT-An), stupnica únavy FACT-An a lineárne analógové stupnice rakoviny (Cancer Linear Analogue Scale - CLAS). Dve menšie randomizované, placebom kontrolované štúdie neukázali výrazné zlepšenie parametrov kvality života na stupnici EORTC-QLQ-C30 ani na stupnici CLAS.
Erytropoetín je rastový faktor, ktorý stimuluje hlavne tvorbu červených krviniek. Erytropoetínové receptory sa môžu nachádzať na povrchu rôznych nádorových buniek.
Prežitie a progresia nádoru boli predmetom zisťovania v piatich veľkých kontrolovaných štúdiách s celkovým počtom 2 833 pacientov. Štyri z týchto štúdií boli dvojito zaslepené placebom kontrolované štúdie a jedna bola otvorená. Do štúdií boli zahrnutí pacienti liečení chemoterapiou (dve štúdie) alebo boli použité populácie pacientov, u ktorých neboli indikované látky stimulujúce erytropoézu: pacienti s anémiou a rakovinou nepodstupujúci chemoterapiu a pacienti s rakovinou hlavy a krku podstupujúci rádioterapiu. V dvoch štúdiách bola cieľová koncentrácia hemoglobínu'
> 13 g/dl; vo zvyšných troch štúdiách to bolo 12 – 14 g/dl. V otvorenej štúdii nebol rozdiel
v celkovom prežívaní medzi pacientmi liečenými rekombinantným ľudským erytropoetínom
a kontrolnými skupinami pacientov. V štyroch placebom kontrolovaných štúdiách bol pomer rizika pre celkové prežívanie v rozpätí 1,25 a 2,47 v prospech kontrolných skupín. Tieto štúdie ukázali konzistentne nevysvetliteľne štatisticky signifikantne zvýšenú úmrtnosť u pacientov, ktorí trpeli anémiou spojenou s rôznymi bežnými druhmi rakoviny a ktorí užívali rekombinantný ľudský erytropoetín v porovnaní s kontrolnými skupinami. Výsledok celkového prežívania v štúdiách nemožno uspokojivo vysvetliť rozdielmi v incidencii trombózy a súvisiacich komplikácií medzi pacientmi užívajúcimi rekombinantný ľudský erytropoetín a pacientmi v kontrolnej skupine.
Bola vykonaná aj systematická kontrola výsledkov 57 klinických štúdií zahŕňajúcich viac ako 9 000 pacientom s rakovinou. Meta analýza dát o celkovom prežívaní viedla k odhadu pomeru rizika 1,08 v prospech kontrolných skupín (interval spoľahlivosti 95 %: 0,99, 1,18; 42 skúšok a 8 167 pacientov). U pacientov liečených rekomobinantným ľudským erytropoetínom bolo pozorované relatívne zvýšenie rizika trombembolických príhod (relatívne riziko 1,67, 95 % interval spoľahlivosti: 1,35, 2,06, 35 skúšok a 6 769 pacientov). U pacientov s rakovinou liečených rekomobinantným ľudským erytropoetínom je zvýšené rizika trombembolických príhod a nemožno u nich vylúčiť negatívny vplyv na celkové prežívanie. Je nejasné, do akej miery možno tieto výsledky aplikovať na podávanie ľudského rekombinantného erytropoetínu pacientom s rakovinou liečených chemoterapiou s cieľom dosiahnuť koncentrácie hemoglobínu nižšie ako 13 g/dl, pretože počet pacientov s takýmito charakteristikami bol medzi skúmanými dátami nízky.
Analýza údajov na úrovni pacientov sa vykonala u viac ako 13 900 pacientov s rakovinou (chemo-, rádio-, chemorádio-, alebo žiadnou terapiou) zúčastnených v 53 klinických štúdiách zahŕňajúcich niektoré epoetíny. Meta analýza dát o celkovom prežívaní viedla k odhadu pomeru rizika 1,06 v prospech kontrolných skupín (interval spoľahlivosti 95 %: 1,00, 1,12; 53 skúšok a 13 933 pacientov)
a u pacientov s rakovinou liečených chemoterapiou bol pomer rizika celkového prežitia 1,04 (interval spoľahlivosti 95 %: 0,97, 1,11; 38 skúšok a 10 441 pacientov). Meta analýzy tiež dôsledne indikovali podstatne relatívne zvýšenie rizika trombembolických príhod u pacientov s rakovinou liečených rekombinantným ľudským erytropoetínom (pozri časť 4.4).
V randomizovanej, dvojitozaslepenej, placebom kontrolovanej štúdii 4 038 nedialyzovaných pacientov s chronickou renálnou insuficienciou, diabetom 2.typu a koncentráciou hemoglobínu
≤ 11 g/dl, dostávali pacienti buď liečbu darbepoetínom alfa, až pokiaľ nebola dosiahnutá cieľová
koncentrácia hemoglobínu 13 g/dl, alebo dostávali placebo (pozri časť 4.4). Základný cieľ štúdie, t.j. zníženie rizika vzniku príčin mortality, kardiovaskulárnej morbidity alebo terminálneho zlyhania obličiek (end stage renal disease, ESRD), nebol splnený. Analýza jednotlivých zložiek koncových dát štúdie ukázala nasledujúce HR (95 % IS): úmrtie 1,05 (0,92; 1,21), mŕtvica 1,92 (1,38; 2,68), kongestívne zlyhanie srdca (CHF) 0,98 (0,74; 1,08), infarkt myokadru (MI) 0,96 (0,75; 1,23), hospitalizácia kvôli ischémii myokardu 0,84 (0,55; 1,27), terminálne zlyhanie obličiek (ESRD) 1,02 (0,87; 1,18).
Kumulovaná post-hoc analýza z klinických štúdií s ESAs bola urobená u pacientov s chronickým zlyhaním obličiek (dialyzovaní pacienti; pacienti, ktorí ešte neboli dialyzovaní; pacienti s diabetom a pacienti bez diabetu). Pozorovali sa tendencie k zvýšenému riziku úmrtnosti z rôznych príčin,
kardiovaskulárnych a cerebrovaskulárnych príhod spojených s vyššími kumulatívnymi dávkami ESA
nezávisle od stavu diabetu alebo dialýzy (pozri časti 4.2 a 4.4).
5.2 Farmakokinetické vlastnosti
Intravenózne podanie
Meraním erytropoetínu po intravenóznom podaní niekoľkonásobnej dávky odhalilo biologický polčas
približne 4 hodiny u zdravých osôb a o niečo dlhší biologický polčas, približne 5 hodín, u pacientov s renálnym zlyhaním. U deťoch bol zaznamenaný biologický polčas približne 6 hodín.
Subkutánne podanie
Po subkutánnej injekcii sú koncentrácie erytropoetínu v sére omnoho nižšie ako koncentrácie, ktoré sa
dosiahnu po intravenóznej injekcii, koncentrácie sa zvyšujú pomaly a najvyššiu úroveň dosiahnu medzi 12 a 18 hodinami po podaní dávky. Najvyššia úroveň je vždy výrazne pod úrovňou, ktorá sa
dosiahne pri intravenóznom podaní (približne 1/20 hodnoty).
Nedochádza k žiadnej akumulácii: koncentrácie zostávajú rovnaké, či sa merajú 24 hodín po prvej injekcii alebo 24 hodín po poslednej injekcii.
V prípade podkožného podania sa biologický polčas stanovuje obtiažne a odhaduje sa na 24 hodín. Biologická dostupnosť erytropoetínu podávaného subkutánnou injekciou je omnoho nižšia než u intravenózneho lieku a je približne 20 %.
5.3 Predklinické údaje o bezpečnosti
V niektorých predklinických toxikologických štúdiách na psoch a potkanoch, nie však na opiciach, bola liečba erytropoetínom spájaná so subklinickou fibrózou kostnej drene (fibróza kostnej drene je známa komplikácia chronického renálneho zlyhania u ľudí a môže mať súvislosť so sekundárnym hyperparatyroidismom alebo neznámymi faktormi. Výskyt fibrózy kostnej drene v štúdiách pacientov na hemodialýze, ktorí boli liečení erytropoetínom po dobu 3 rokov, nebol v porovnaní
s odpovedajúcou kontrolnou skupinou pacientov na dialýze, ktorí neboli liečení erytropoetínom, zvýšený).
Štúdie na zvieratách ukázali, že erytropoetín znižuje telesnú hmotnosť plodu, spomaľuje osifikáciu a zvyšuje úmrtnosť plodu, pokiaľ je podávaný v týždenných dávkach približne 20-krát vyšších, než je odporúčaná týždenná dávka pre človeka. Sekundárne tieto zmeny zapríčiňujú zníženie hmotnosti matky počas gravidity.
Erytropoetín nevykázal žiadne zmeny v skúškach mutagenity na bakteriálnych a bunkových kultúrach cicavcov a ani in vivo v mikronukleovom teste na myšiach. Dlhodobé štúdie kancerogenity neboli vykonané. V odbornej literatúre je možné nájsť rozporuplné tvrdenia ohľadom skutočnosti, či môže erytropoetín hrať významnejšiu rolu pri podpore nádorového bujnenia. Tieto tvrdenia sú založené na zisteniach in vitro zo vzoriek ľudských nádorov, ale ich dôležitosť v klinickej praxi je neistá.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
fosforečnan disodný dihydrát dihydrogenfosforečnan sodný dihydrát chlorid sodný
chlorid vápenatý dihydrát polysorbát 20
glycín
leucín izoleucín treonín
kyselina glutamová fenylalanín
voda na injekciu
hydroxid sodný (na úpravu pH)
kyselina chlorovodíková (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
30 mesiacov
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Naplnenú injekčnú striekačku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Za účelom ambulantného použitia môže pacient vybrať liek z chladničky a uchovávať ho pri izbovej teplote (nie vyššej ako 25 °C), najviac však po dobu 3 dní.
6.5 Druh obalu a obsah balenia
Retacrit1000 IU/0,3 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 0,3 ml roztoku.
Každé balenie obsahuje 1 alebo 6 naplnených injekčných striekačiek.
Retacrit2000 IU/0,6 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 0,6 ml roztoku.
Každé balenie obsahuje 1 alebo 6 naplnených injekčných striekačiek.
Retacrit3000 IU/0,9 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo
s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 0,9 ml roztoku.
Každé balenie obsahuje 1 alebo 6 naplnených injekčných striekačiek.
Retacrit4000 IU/0,4 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo
s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 0,4 ml roztoku.
Každé balenie obsahuje 1 alebo 6 naplnených injekčných striekačiek.
Retacrit5000 IU/0,5 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo
s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 0,5 ml roztoku.
Každé balenie obsahuje 1 alebo 6 naplnených injekčných striekačiek.
Retacrit6000 IU/0,6 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 0,6 ml roztoku.
Každé balenie obsahuje 1 alebo 6 naplnených injekčných striekačiek.
Retacrit8000 IU/0,8 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 0,8 ml roztoku.
Každé balenie obsahuje 1 alebo 6 naplnených injekčných striekačiek.
Retacrit10000IU/1 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo
s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 1 ml roztoku.
Každé balenie obsahuje 1 alebo 6 naplnených injekčných striekačiek.
Retacrit20000IU/0,5 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo
s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 0,5 ml roztoku.
Každé balenie obsahuje 1, 4 alebo 6 naplnených injekčných striekačiek.
Viacnásobné balenie obsahuje 6 balení (6 balení po 1) naplnených injekčných striekačiek.
Retacrit30000IU/0,75mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 0,75 ml roztoku.
Každé balenie obsahuje 1, 4 alebo 6 naplnených injekčných striekačiek.
Viacnásobné balenie obsahuje 4 balenia (4 balenia po 1) naplnených injekčných striekačiek.
Retacrit40000IU/1 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
Naplnená injekčná striekačka zo skla, typu I s pevnou oceľovou ihlou a piestom potiahnutým polytetrafluóretylénom (PTFE), s ochranným krytom ihly alebo bez ochranného krytu ihly alebo s needle trap systémom.
Každá naplnená injekčná striekačka obahuje 1 ml roztoku.
Každé balenie obsahuje 1, 4 alebo 6 naplnených injekčných striekačiek.
Viacnásobné balenie obsahuje 4 balenia (4 balenia po 1) naplnených injekčných striekačiek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Návod na zaobchádzanie so Retacritom:
1. Vyberte jednu injekčnú striekačku z blistra a skontrolujte, či je v nej obsiahnutý roztok číry, bezfarebný, a nie sú v ňom prakticky žiadne viditeľné častice.
2. Odstráňte z ihly injekčnej striekačky ochranný kryt, podržte injekčnú striekačku vo zvislej polohe a zľahka stlačte piest smerom nahor, čím z injekčnej striekačky a ihly vytlačíte vzduch.
3. Injekčná striekačka je teraz pripravená k použitiu.
Retacrit sa nesmie použiť v prípade, že
· zatavenie blistra je porušené alebo je blister akokoľvek poškodený.
· tekutina je sfarbená alebo sú v nej viditeľné plávajúce častice.
· z naplnenej striekačky došlo k úniku akéhokoľvek množstva tekutiny alebo vo vnútri uzatvoreného blistra došlo ku kondenzácii.
· mohlo dôjsť k jeho náhodnému zmrazeniu.
Tento liek je len pre jednorazové použitie. Netraste liekom.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Hospira UK Limited
Horizon
Honey Lane Hurley Maidenhead SL6 6RJ
Veľká Británia
8. REGISTRAČNÉ ČÍSLO(A)
Retacrit1000 IU/0,3 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/07/431/001 1 naplnená injekčná striekačka
EU/1/07/431/002 6 naplnených injekčných striekačiek
EU/1/07/431/026 1 naplnená injekčná striekačka s ochranným krytom ihly
EU/1/07/431/027 6 naplnených injekčných striekačiek s ochranným krytom ihly
EU/1/07/431/054 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/055 6 naplnených injekčných striekačiek s needle trap
Retacrit2000 IU/0,6 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/07/431/003 1 naplnená injekčná striekačka
EU/1/07/431/004 6 naplnených injekčných striekačiek
EU/1/07/431/028 1 naplnená injekčná striekačka s ochranným krytom ihly EU/1/07/431/029 6 naplnených injekčných striekačiek s ochranným krytom ihly EU/1/07/431/056 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/057 6 naplnených injekčných striekačiek s needle trap
Retacrit3000 IU/0,9 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/07/431/005 1 naplnená injekčná striekačka
EU/1/07/431/006 6 naplnených injekčných striekačiek
EU/1/07/431/030 1 naplnená injekčná striekačka s ochranným krytom ihly
EU/1/07/431/031 6 naplnených injekčných striekačiek s ochranným krytom ihly
EU/1/07/431/058 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/059 6 naplnených injekčných striekačiek s needle trap
Retacrit4000 IU/0,4 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/07/431/007 1 naplnená injekčná striekačka
EU/1/07/431/008 6 naplnených injekčných striekačiek
EU/1/07/431/032 1 naplnená injekčná striekačka s ochranným krytom ihly
EU/1/07/431/033 6 naplnených injekčných striekačiek s ochranným krytom ihly
EU/1/07/431/060 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/061 6 naplnených injekčných striekačiek s needle trap
Retacrit5000 IU/0,5 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/07/431/009 1 naplnená injekčná striekačka
EU/1/07/431/010 6 naplnených injekčných striekačiek
EU/1/07/431/034 1 naplnená injekčná striekačka s ochranným krytom ihly
EU/1/07/431/035 6 naplnených injekčných striekačiek s ochranným krytom ihly
EU/1/07/431/062 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/063 6 naplnených injekčných striekačiek s needle trap
Retacrit6000 IU/0,6 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/07/431/011 1 naplnená injekčná striekačka
EU/1/07/431/012 6 naplnených injekčných striekačiek
EU/1/07/431/036 1 naplnená injekčná striekačka s ochranným krytom ihly
EU/1/07/431/037 6 naplnených injekčných striekačiek s ochranným krytom ihly
EU/1/07/431/064 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/065 6 naplnených injekčných striekačiek s needle trap
Retacrit8000IU/0,8 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/07/431/013 1 naplnená injekčná striekačka
EU/1/07/431/014 6 naplnených injekčných striekačiek
EU/1/07/431/038 1 naplnená injekčná striekačka s ochranným krytom ihly
EU/1/07/431/039 6 naplnených injekčných striekačiek s ochranným krytom ihly
EU/1/07/431/066 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/067 6 naplnených injekčných striekačiek s needle trap
Retacrit10000IU/1 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/07/431/015 1 naplnená injekčná striekačka
EU/1/07/431/016 6 naplnených injekčných striekačiek
EU/1/07/431/040 1 naplnená injekčná striekačka s ochranným krytom ihly EU/1/07/431/041 6 naplnených injekčných striekačiek s ochranným krytom ihly EU/1/07/431/068 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/069 6 naplnených injekčných striekačiek s needle trap
Retacrit20000IU/0,5 mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/07/431/017 1 naplnená injekčná striekačka
EU/1/07/431/020 4 naplnené injekčné striekačky
EU/1/07/431/021 6 naplnených injekčných striekačiek
EU/1/07/431/042 1 naplnená injekčná striekačka s ochranným krytom ihly
EU/1/07/431/045 4 naplnené injekčné striekačky s ochranným krytom ihly EU/1/07/431/046 6 naplnených injekčných striekačiek s ochranným krytom ihly EU/1/07/431/051 6 naplnených injekčných striekačiek (6x1, viacnásobné balenie) EU/1/07/431/070 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/071 4 naplnené injekčné striekačky s needle trap
EU/1/07/431/072 6 naplnených injekčných striekačiek s needle trap
Retacrit30000IU/0,75mlinjekčnýroztokvnaplnenejinjekčnejstriekačke
EU/1/07/431/018 1 naplnená injekčná striekačka
EU/1/07/431/022 4 naplnené injekčné striekačky
EU/1/07/431/023 6 naplnených injekčných striekačiek
EU/1/07/431/043 1 naplnená injekčná striekačka s ochranným krytom ihly
EU/1/07/431/047 4 naplnené injekčné striekačky s ochranným krytom ihly EU/1/07/431/048 6 naplnených injekčných striekačiek s ochranným krytom ihly EU/1/07/431/052 4 naplnené injekčné striekačky (4x1, viacnásobné balenie) EU/1/07/431/073 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/074 4 naplnené injekčné striekačky s needle trap
EU/1/07/431/075 6 naplnených injekčných striekačiek s needle trap
Retacrit40000IU/1 mlinjekčnýroztokvnaplnenejinjekčnejstriekačkeEU/1/07/431/019 1 naplnená injekčná striekačka EU/1/07/431/024 4 naplnené injekčné striekačky EU/1/07/431/025 6 naplnených injekčných striekačiek
EU/1/07/431/044 1 naplnená injekčná striekačka s ochranným krytom ihly
EU/1/07/431/049 4 naplnené injekčné striekačky s ochranným krytom ihly
EU/1/07/431/050 6 naplnených injekčných striekačiek s ochranným krytom ihly EU/1/07/431/053 4 naplnené injekčné striekačky (4x1, viacnásobné balenie) EU/1/07/431/076 1 naplnená injekčná striekačka s needle trap
EU/1/07/431/077 4 naplnené injekčné striekačky s needle trap
EU/1/07/431/078 6 naplnených injekčných striekačiek s needle trap
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 18. decembra 2007
Dátum posledného predĺženia: 15. novembra 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.