
ity faktora IX za účelom úpravy dávky nie je potrebné. V programe klinického skúšania nebola vykonaná úprava dávky. Priemerné najnižšie hladiny faktora IX
v rovnovážnom stave nad 15 % boli pozorované u všetkých vekových skupín, podrobnosti pozri časť
5.2.
Kvôli interferencii polyetylénglykolu (PEG) v jednostupňovej analýze zrážania s rôznymi reakčnými činidlami na stanovenie aPTT sa odporúča použiť chromogénnu analýzu (napr. Rox Factor IX alebo Biophen), kde je potrebné monitorovanie. Ak chromogénna analýza nie je dostupná, odporúča sa použiť jednostupňovú analýzu zrážania s reakčným činidlom na stanovenie aPTT (napr. Cephascreen) spĺňajúce požiadavky na použitie s liekom Refixia. U produktov s modifikovaným dlhodobo účinkujúcim faktorom je známe, že výsledky jednostupňovej analýzy zrážania sú významne závislé od použitého reakčného činidla na stanovenie aPTT a referenčného štandardu. U lieku Refixia niektoré činidlá spôsobia podhodnotenie (30 – 50 %), pričom väčšina činidiel obsahujúcich oxid kremičitý spôsobí nadhodnotenie (viac ako 400 %) aktivity faktora IX. Preto by sa činidlá na báze oxidu kremičitého nemali používať. Ak chromogénna analýza alebo primerane vhodná jednostupňová analýza zrážania nie sú dostupné lokálne, odporúča sa využiť referenčné laboratórium.
Dávkovanie
Počet jednotiek podávaného faktora IX je vyjadrený v medzinárodných jednotkách (IU), ktoré
zodpovedajú súčasnému WHO štandardu pre lieky obsahujúce faktor IX. Aktivita faktora IX v plazme je vyjadrená buď v percentách (porovnaním k normálnej ľudskej plazme), alebo v medzinárodných jednotkách (porovnaním k medzinárodnému štandardu pre faktor IX v plazme).
Profylaxia
40 IU/kg telesnej hmotnosti raz týždenne.
Úprava dávok a intervaly podávania sa majú zvážiť na základe dosiahnutých hladín FIX
a individuálnej tendencii krvácania. Najnižšie hladiny dosiahnuté v režime dávkovania 40 IU/kg raz týždenne sú zhrnuté v časti 5.2.
Pacientom s profylaxiou, ktorí si zabudnú podať dávku, sa odporúča použiť ju ihneď, ako to zistia, a potom pokračovať vo svojej zvyčajnej dávkovacej schéme raz týždenne. Nemá sa podávať dvojitá dávka.
On-demand (podľapotreby)liečba
Dávka a trvanie substitučnej liečby závisia od miesta a závažnosti krvácania, pokyny na dávkovanie pri epizódach krvácania si pozrite v Tabuľke 1.
Tabuľka 1 Liečba epizód krvácania liekom Refixia
Stupeň krvácania Odporúčaná dávka IU/kg lieku Refixia
O
dporúčania ohľadom
dávkovania
Začínajúca
hemartróza, krvácanie do svalov alebo do ústnej dutiny.
Rozsiahlejšia hemartróza, krvácanie do svalov alebo hematóm.
40 Odporúča sa jedna dávka.
Závažné alebo
život ohrozujúce krvácanie.
80 Je možné podať ďalšie dávky
40 IU/kg.
C
hirurgický zákrok
Veľkosť dávky a intervaly dávkovania pri chirurgickom zákroku závisia od zákroku a od miestnych postupov. Všeobecné odporúčania nájdete v Tabuľke 2.
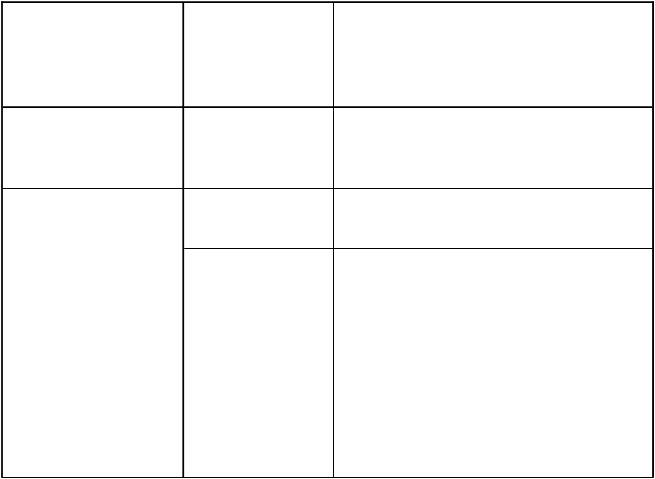 Tabuľka 2 Liečba liekom Refixia pri chirurgickom zákroku
Tabuľka 2 Liečba liekom Refixia pri chirurgickom zákroku
T
yp chirurgického zákroku
O
dporúčaná dávka IU/kg telesnej hmotnosti
O
dporúčania ohľadom dávkovania
Menší chirurgický
zákrok vrátane extrakcie zuba.
40 V prípade potreby je možné podať
ďalšie dávky.
Veľký chirurgický
zákrok.
80 Predoperačná dávka.
40 Zvážte dve opakované dávky 40 IU/kg
(v intervaloch 1–3 dni) v rámci prvého
týždňa po chirurgickom zákroku.
Kvôli dlhému polčasu premeny lieku Refixia môže byť frekvencia dávkovania v období po chirurgickom zákroku po prvom týždni predĺžená na raz týždenne, kým krvácanie neprestane a nedôjde
k zahojeniu.
Pediatrická populáciaOdporúčania ohľadom dávky pre dospievajúcich (12–18 rokov) sú rovnaké ako pre dospelých:
40 IU/kg telesnej hmotnosti. Dlhodobá bezpečnosť lieku Refixia u detí do 12 rokov nebola stanovená.
Spôsob podávaniaIntravenózne použitie.
Refixia sa podáva ako intravenózna bolusová injekcia počas niekoľkých minút po rekonštitúcii prášku na injekciu v histidínovom rozpúšťadle. Rýchlosť podávania sa má určiť tak, aby vyhovovala pacientovi, do maximálnej rýchlosti injekcie 4 ml/min.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
V prípade, keď si liek podáva pacient, alebo liek podáva opatrovateľ je potrebné príslušné školenie.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Známa alergická reakcia na škrečiu bielkovinu.
4.4 Osobitné upozornenia a opatrenia pri používaní
Hypersenzitivita
Pri používaní lieku Refixia sa môžu vyskytnúť hypersenzitívne reakcie alergického typu. Liek
obsahuje stopy škrečích bielkovín. Ak sa objavia príznaky precitlivenosti, pacienti majú byť poučení, aby ihneď prerušili liečbu týmto liekom a obrátili sa na svojho lekára. Pacienti majú byť informovaní o počiatočných prejavoch hypersenzitívnych reakcií, vrátane žihľavky, generalizovanej urtikárie, zvierania na hrudníku, sipotu, hypotenzie a anafylaxie.
V prípade šoku sa má dodržať štandardná medicínska liečba pri šoku.
Inhibítory
Po opakovanej liečbe liekmi s ľudským koagulačným faktorom IX (rDNA) majú byť pacienti monitorovaní ohľadom tvorby neutralizujúcich protilátok (inhibítorov), ktoré sa majú kvantifikovať
Bethesda jednotkami (BU) pomocou príslušného biologického testovania.
V literatúre sa publikovali správy poukazujúce na koreláciu medzi výskytom inhibítora faktora IX
a alergickými reakciami. Preto majú byť pacienti, u ktorých sa vyskytli alergické reakcie, vyšetrení na prítomnosť inhibítora. Je potrebné si uvedomiť, že pacienti s inhibítormi faktora IX môžu mať zvýšené
riziko anafylaxie pri ďalšom vystavení sa faktoru IX.
Kvôli riziku alergických reakcií u liekov s faktorom IX majú byť prvé podania faktora IX, podľa posúdenia ošetrujúceho lekára, vykonané pod lekárskym dohľadom na mieste, kde je možné poskytnúť vhodnú lekársku starostlivosť pri alergických reakciách.
V prípade reziduálnych hladín aktivity FIX, existuje riziko interferencie, keď sa vykoná testovanie inhibítora pomocou Nijmegen modifikovanej metódy Bethesda testu. Preto je na zaistenie detekcie inhibítorov s nízkym titrom potrebný krok predhriatia alebo vhodné vymytie.
Tromboembólia
Kvôli možnému riziku trombotických komplikácií sa má začať klinický dohľad týkajúci sa včasných
prejavov trombotickej a konzumpčnej koagulopatie príslušným biologickým testovaním, keď sa tento
liek podáva pacientom s ochorením pečene, pacientom po operácii, novorodencom alebo pacientom
s rizikom trombotického fenoménu alebo DIC. V každej z týchto situácií sa má zvážiť prínos liečby
liekom Refixia oproti riziku týchto komplikácií.
Kardiovaskulárna príhoda
U pacientov s existujúcimi kardiovaskulárnymi rizikovými faktormi môže substitučná liečba FIX
zvýšiť kardiovaskulárne riziko.
Komplikácie spojené s katétrom
Ak je potrebný centrálny žilový katéter (CVAD, central venous access device), má sa brať do úvahy
riziko komplikácií spojených s CVAD, vrátane bakterémie a trombózy v mieste katetrizácie.
Pediatrická populácia
Refixia nie je určená na používanie u detí (do 12 rokov). Uvedené varovania a upozornenia platia pre dospelých aj dospievajúcich (12–18 rokov).
Obsah sodíka
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej injekčnej liekovke, čo znamená, že
v podstate „neobsahuje sodík“.
Záznam o použití
Dôrazne sa odporúča, aby sa vždy, keď sa Refixia podá pacientovi, zaznamenal názov a číslo šarže
lieku, aby sa zachovalo prepojenie medzi pacientom a šaržou lieku.
4.5 Liekové a iné interakcie
Neboli hlásené žiadne interakcie liekov s ľudským koagulačným faktorom IX (rDNA) s inými liekmi.
4.6 Fertilita, gravidita a laktácia
Neuskutočnili sa žiadne reprodukčné štúdie s faktorom IX na zvieratách. Vzhľadom na zriedkavý výskyt hemofílie B u žien, nie sú dostupné skúsenosti s použitím faktora IX počas gravidity a dojčenia. Preto sa má faktor IX použiť počas gravidity alebo dojčenia, len ak je to jednoznačne indikované.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Refixia nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostného profilu
Hypersenzitivita alebo alergické reakcie (ktoré môžu zahŕňať angioedém, pálenie a štípanie v mieste podania infúzie, triašku, začervenanie, generalizovanú urtikáriu, bolesť hlavy, vyrážku, hypotenziu,
letargiu, nauzeu, nepokoj, tachykardiu, zvieranie na hrudníku, brnenie, vracanie, sipot) boli u liekov
s rekombinantným faktorom IX hlásené zriedkavo a v niektorých prípadoch môžu viesť k závažnej anafylaxii (vrátane šoku). V niektorých prípadoch tieto reakcie viedli k závažnej anafylaxii a vyskytli
sa v tesnej časovej súvislosti s vývojom inhibítorov faktora IX (pozri tiež časť 4.4). Pri pokusoch
navodiť imunitnú toleranciu u pacientov s hemofíliou B s inhibítormi faktora IX a anamnézou alergickej reakcie bol hlásený nefrotický syndróm.
Veľmi zriedkavo bola pozorovaná tvorba protilátok proti škrečím bielkovinám spojená s hypersenzitívnymi reakciami.
U pacientov s hemofíliou B sa môžu tvoriť neutralizujúce protilátky (inhibítory) proti faktoru IX. Ak sa objavia takéto inhibítory, stav sa bude prejavovať ako nedostatočná klinická odpoveď. V týchto prípadoch sa odporúča obrátiť sa na špecializované centrum pre liečbu hemofílie.
Po podaní liekov s faktorom IX existuje možné riziko tromboembolických epizód so zvýšeným rizikom u liekov s nízkou čistotou. Používanie liekov s faktorom IX s nízkou čistotou bolo spojené
s prípadmi infarktu myokardu, diseminovanej intravaskulárnej koagulácie, žilovej trombózy a pľúcnej
embólie. Používanie liekov s faktorom IX s vysokou čistotou ako Refixia je zriedkavo spojené
s takýmito nežiaducimi reakciami.
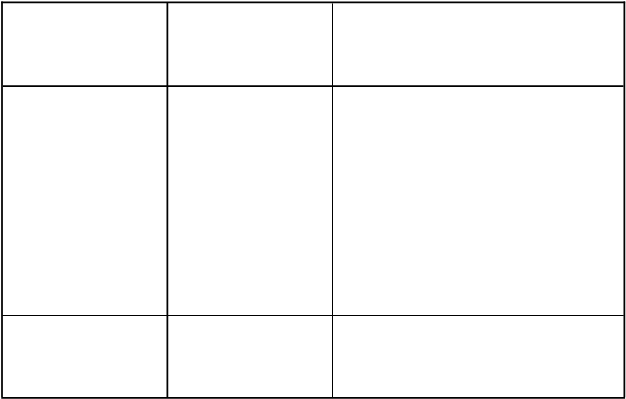
Tabuľkovýzoznamnežiaducichreakcií
Tabuľka nižšie je v súlade s klasifikáciou podľa tried orgánových systémov MedDRA (TOS a
Preferované termíny početnosti).
Frekvencie výskytu boli hodnotené podľa nasledujúcej konvencie: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (nedajú sa odhadnúť z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Celkovo 115 v minulosti liečených mužských pacientov so strednou až závažnou hemofíliou B bolo vystavených lieku Refixia, čo celkovo tvorilo 170 pacientorokov v dokončených klinických skúšaniach.
Tabuľka 3 Frekvencia nežiaducich reakcií v klinických skúšaniach
Trieda orgánových systémov Nežiaduca reakcia Frekvencia
Poruchy imunitného systému Hypersenzitivita
Anafylaxia
Tvorba inhibítorov
Menej časté
Neznáme
Neznáme
Poruchy srdca a srdcovej
činnosti
Palpitácie Menej časté
Poruchy gastrointestinálneho
traktu
Nauzea Časté
Poruchy kože a podkožného
tkaniva
Svrbenie* Časté
Celkové poruchy a reakcie v
mieste podávania
Únava
Návaly tepla
Reakcie v mieste podávania injekcie**
Časté
Menej časté
Časté
*Svrbenie zahŕňa termíny svrbenie a svrbenie ucha
**Reakcie v mieste podávania injekcie zahŕňajú bolesť v mieste podávania injekcie, bolesť v mieste podávania infúzie,
opuch v mieste podávania injekcie, erytém v mieste podávania injekcie a vyrážku v mieste podávania injekcie.
Popis vybraných nežiaducich účinkovV prebiehajúcom klinickom skúšaní u doteraz neliečených pacientov sa po liečbe liekom Refixia
vyskytla anafylaxia v tesnej časovej súvislosti s vývojom inhibítorov faktora IX. Na poskytnutie informácií o incidencii inhibítora u doteraz neliečených pacientov nie sú dostatočné údaje.
Pediatrická populáciaRefixia je určená pre pacientov vo veku 12 rokov a starších. U doteraz liečených dospievajúcich (12–
18 rokov) a dospelých pacientov nebol pozorovaný žiadny rozdiel v bezpečnostnom profile lieku
Refixia.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV klinických skúšaniach bolo hlásené predávkovanie maximálne do 169 IU/kg. Neboli hlásené žiadne príznaky súvisiace s predávkovaním.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antihemoragiká, krvný koagulačný faktor IX, ATC kód: B02BD04.
Mechanizmusúčinku
Refixia je purifikovaný rekombinantný ľudský faktor IX (rFIX) s polyetylénglykolom (PEG)
s molekulovou hmotnosťou 40 kDa konjugovaným na proteín. Priemerná molekulová hmotnosť lieku Refixia je približne 98 kDa a molekulová hmotnosť samotnej proteínovej zložky je 56 kDa. Po aktivácii lieku Refixia je aktivačný peptid vrátane 40 kDa polyetylénglykolovej skupiny odštiepený, čím ostane natívna aktivovaná molekula faktoru IX.
Faktor IX je glykoproteín s jedným reťazcom. Je to koagulačný faktor závislý od vitamínu K a je syntetizovaný v pečeni. Faktor IX je aktivovaný faktorom XIa a komplexom faktora VII/tkanivového faktora. Aktivovaný faktor IX v kombinácii s aktivovaným faktorom VIII aktivuje faktor X. Aktivovaný faktor X konvertuje protrombín na trombín. Trombín potom konvertuje fibrinogén
na fibrín a vytvára sa zrazenina. Hemofília B je dedičná porucha krvnej zrážanlivosti viazaná
na pohlavie zapríčinená zníženými hladinami faktora IX a dôsledkom je profúzne krvácanie do kĺbov, svalov alebo vnútorných orgánov, buď spontánne alebo ako dôsledok úrazu alebo chirurgického zákroku. Pri substitučnej liečbe sa plazmatické hladiny faktora IX zvýšia, čo umožní dočasnú úpravu deficitu faktora a tým sa upravia sklony ku krvácaniu.
Klinickáúčinnosť
Ukončený program klinického skúšania zahŕňal jedno skúšanie fázy 1 a štyri multicentrické nekontrolované skúšania fázy 3.
Profylaxia
Päťdesiatštyri pacientov vo všetkých vekových skupinách bolo liečených týždennou profylaktickou dávkou 40 IU/kg, pričom 23 (43 %) týchto pacientov nemalo žiadne epizódy krvácania.
Pivotné skúšanie
Pivotné skúšanie zahŕňalo 74 dospievajúcich (13–17 rokov) a dospelých (18–65 rokov) v minulosti
liečených pacientov. Skúšanie zahŕňalo jedno otvorené rameno s on-demand (podľa potreby) liečbou počas približne 28 týždňov a dve profylaktické liečebné ramená s jednostranne zaslepenou randomizáciou buď s 10 IU/kg alebo 40 IU/kg raz týždenne počas približne 52 týždňov. Pri porovnaní liečby s 10 IU/kg a 40 IU/kg bola ročná frekvencia krvácania u pacientov v ramene 40 IU/kg o 49 % nižšia ako frekvencia krvácania (95 % IS; 5 %; 73 %) u pacientov v ramene 10 IU/kg (p<0,05).
Medián (IQR) celkovej ročnej frekvencie krvácania (ABR, annual bleeding rate) u pacientov (13–65 rokov) liečených profylaktickou dávkou 40 IU/kg raz týždenne bol 1,04 (0,00; 4,01), pričom traumatická ABR bola 0,00 (0,00; 2,05), kĺbová ABR bola 0,97 (0,00; 2,07) a spontánna ABR bola
0,00 (0,00; 0,99).
Dôležité je, že ABR sa nedá porovnávať medzi rôznymi koncentrátmi faktora a medzi rôznymi klinickými skúšaniami.
V tomto pivotnom skúšaní u dospievajúcich a dospelých pacientov bolo 70 náhlych krvácavých epizód u 16 z 29 pacientov v profylaktickom ramene 40 IU/kg. Celková miera úspešnosti liečby náhlych krvácaní bola 97,1 % (67 zo 69 hodnotených krvácaní). Celkovo 69 (98,6 %) zo 70 epizód krvácania bolo liečených jednou injekciou. Epizódy krvácania boli liečené liekom Refixia 40 IU/kg pri miernom až strednom krvácaní.
Z 29 dospelých a dospievajúcich liečených pacientov bolo 13 pacientov s 20 cieľovými kĺbmi liečených jeden rok týždennou profylaktickou dávkou 40 IU/kg. Osemnásť z týchto 20 kĺbov (90 %) sa na konci skúšania už nepovažovalo za cieľové kĺby.
On-demand (podľapotreby)liečba
V pivotnom skúšaní bolo nerandomizované rameno, kde bolo 15 pacientov liečených v on-demand režime dávkou 40 IU/kg pri miernych až stredných krvácaniach a 80 IU/kg pri závažných krvácaniach.
Celková miera úspešnosti (definovaná ako výborná alebo dobrá) liečba krvácaní bola 95 %, pričom
bolo 98 % krvácaní liečených jednou alebo dvoma injekciami.
Pediatrická populácia
Refixia nie je určená na používanie pre deti mladšie ako 12 rokov (pozri časť 4.2 pre informáciu
o pediatrickom použití).
Bolo vykonané skúšanie zahŕňajúce 25 pediatrických predtým liečených pacientov (vo veku 0–
12 rokov), ktorí dostávali profylaktickú dávku 40 IU/kg raz týždenne.
U detí vo veku 0–12 rokov bol medián (IQR) ročnej frekvencie krvácania 1,0 (0,00; 2,06) a frekvencia spontánneho krvácania bola 0,00 (0,00; 0,00).
Pri liečbe krvácaní u pediatrických pacientov bola celková miera úspešnosti (definovaná ako výborná alebo dobrá) 93 % (39 zo 42 krvácaní), pričom 36 (86 %) krvácaní sa vyriešilo 1 injekciou a 5 (12 %) krvácaní sa vyriešilo 2 injekciami lieku Refixia.
Európska agentúra pre lieky udelila odklad na dokončenie štúdií s liekom Refixia u doteraz
neliečených pacientov (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Celkováhemostatickáúčinnosť
Mierne alebo stredne závažné epizódy krvácania boli liečené liekom Refixia 40 IU/kg a závažné krvácania 80 IU/kg, pričom jedno krvácanie bolo ohodnotené ako závažné. Celkové hodnotenie
hemostatickej účinnosti vykonal pacient alebo opatrovateľ (pri domácej liečbe) alebo skúšajúci na
pracovisku klinického skúšania (pri liečbe pod dohľadom zdravotníckeho pracovníka) pomocou 4- bodovej stupnice výborná, dobrá, stredná alebo slabá. Celková miera úspešnosti liečby krvácaní
(definovaná ako výborná alebo dobrá) bola 93 % (551 z 591). Z 597 liečených krvácaní pozorovaných
u 79 (75 %) zo 105 pacientov sa 521 (87 %) krvácaní vyriešilo 1 injekciou a 60 (10 %) krvácaní sa vyriešilo 2 injekciami lieku Refixia.
Miera úspešnosti a potrebná dávka na liečbu epizód krvácania nezáviseli od miesta krvácania. Miera úspešnosti liečby epizód krvácania tiež nezávisela od toho, či bolo krvácanie traumatického alebo spontánneho pôvodu.
Chirurgický zákrok
Tri skúšania, z ktorých jedno bolo zamerané na chirurgické zákroky, zahŕňali celkom 15 veľkých
a 26 malých chirurgických zákrokov (pacienti vo veku 13 až 56 rokov). Hemostatický účinok lieku
Refixia počas chirurgického zákroku bol potvrdený s mierou úspešnosti 100 % u 15 veľkých chirurgických zákrokov v skúšaniach. Všetky hodnotené malé chirurgické zákroky boli vykonané úspešne.
V skúšaní zameranom na chirurgické zákroky analýza účinnosti zahŕňala 13 veľkých chirurgických zákrokov vykonaných u 13 doteraz už liečených dospelých a dospievajúcich pacientov. Zákroky zahŕňali 9 ortopedických, 1 gastrointestinálny a 3 chirurgické zákroky v ústnej dutine. Pacienti dostali pred operáciou 1 injekciu 80 IU/kg v deň chirurgického zákroku a po operácii injekcie 40 IU/kg. Predoperačná dávka lieku Refixia 80 IU/kg bola účinná a žiadny z pacientov nepotreboval ďalšie dávky v deň chirurgického zákroku. V období po chirurgickom zákroku 1. až 6. deň a 7. až 13. deň, medián počtu ďalších podaných dávok 40 IU/kg bol 2,0; 1,5 v uvedenom poradí. Priemerná celková spotreba lieku Refixia počas chirurgického zákroku a po ňom bola 241 IU/kg (rozsah: 81–460 IU/kg).
5.2 Farmakokinetické vlastnosti
Refixia má v porovnaní s nemodifikovaným faktorom IX predĺžený polčas premeny. Všetky farmakokinetické štúdie lieku Refixia boli vykonané u doteraz už liečených pacientov s hemofíliou B (faktor IX≤2 %). Analýza vzoriek plazmy sa vykonala pomocou jednostupňovej analýzy zrážania.
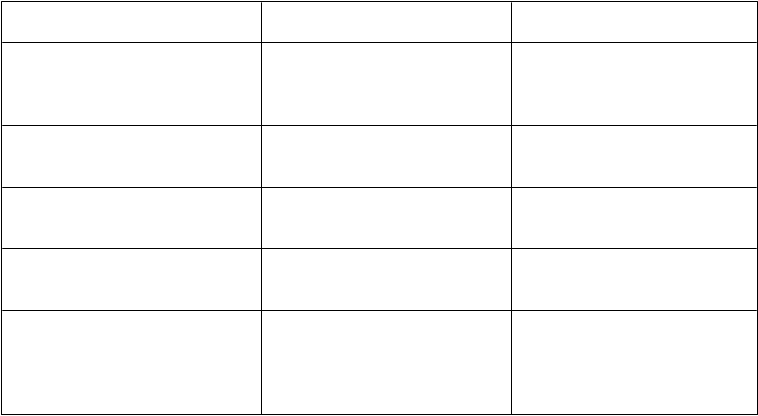
Farmakokinetické parametre v rovnovážnom stave u dospievajúcich a dospelých sú zobrazené v Tabuľke 4.
Tabuľka 4 Farmakokinetické parametre lieku Refixia (40 IU/kg) v rovnovážnom stave u dospievajúcich a dospelých (geometrický priemer (CV %))
F
armakokinetický parameter 13–17 rokov
N=3
'
≥
18 rokov
N=6
Biologický polčas (t1/2) (hodiny) 103 (14) 115 (10)
Relatívna výťažnosť (IR) (IU/ml na IU/kg) 0,018 (28) 0,019 (20)
Plocha pod krivkou (AUC)0 – 168 h (IU*h/ml) 91 (22) 93 (15)
Klírens (CL) (ml/h/kg) 0,4 (17) 0,4 (11)
Priemerný čas zotrvania (MRT, Mean
residence time) (hodiny)
144 (15) 158 (10)
Distribučný objem (Vss) (ml/kg) 61 (31) 66 (12)
Aktivita faktora IX 168 h po podaní dávky
(IU/ml)
0,29 (19) 0,32 (17)
Klírens = klírens prepočítaný na telesnú hmotnosť; relatívna výťažnosť = relatívna výťažnosť 30 min po podaní dávky;
distribučný objem = distribučný objem v stabilizovanom stave prepočítaný na telesnú hmotnosť. CV = koeficient variácie
Všetci pacienti hodnotení vo farmakokinetickej analýze v rovnovážnom stave mali 168 hodín po podaní dávky hodnoty aktivity faktora IX nad 0,24 IU/ml, pričom týždenná dávka bola 40 IU/kg.
Farmakokinetické parametre jednorazovej dávky lieku Refixia sú uvedené podľa veku v Tabuľke 5.
Refixia nie je určená na používanie pre deti mladšie ako 12 rokov.
 Tabuľka 5 Farmakokinetické parametre jednorazovej dávky lieku Refixia (40 IU/kg) u detí, dospievajúcich a dospelých (geometrický priemer (CV %))
Tabuľka 5 Farmakokinetické parametre jednorazovej dávky lieku Refixia (40 IU/kg) u detí, dospievajúcich a dospelých (geometrický priemer (CV %))
F
armakokinetický parameter
0–6 rokov
N=
12
7–12 rokov
N=
13
13–17 rokov
N=3
≥
18 rokov
N=6
Biologický polčas
(t1/2) (hodiny)
70 (16) 76 (26) 89 (24) 83 (23)
Relatívna
výťažnosť (IR)
(IU/ml na IU/kg)
0,015 (7) 0,016 (16) 0,020 (15) 0,023 (11)
Plocha pod krivkou
(AUC)inf (IU*h/ml)
46 (14) 56 (19) 80 (35) 91 (16)
Klírens (CL)
(ml/h/kg)
0,8 (13) 0,6 (22) 0,5 (30) 0,4 (15)
Priemerný čas
zotrvania (MRT, Mean residence
time) (hodiny)
95 (15) 105 (24) 124 (24) 116 (22)
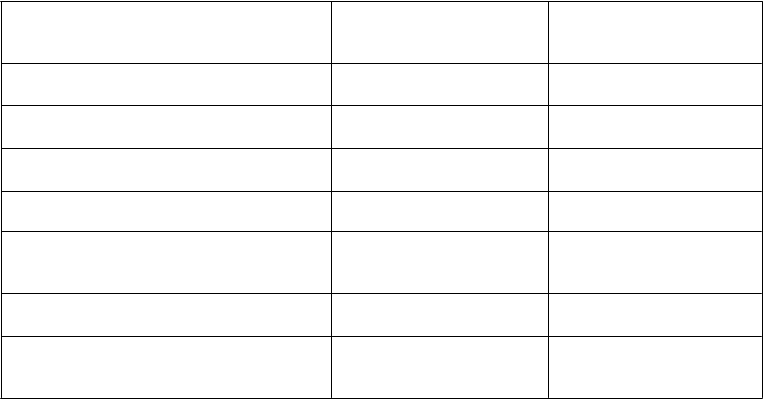
Distribučný objem 72 (15) 68 (22) 59 (8) 47 (16)
F
armakokinetický parameter
0–6 rokov
N=
12
7–12 rokov
N=
13
13–17 rokov
N=3
≥
18 rokov
N=6
(Vss) (ml/kg)
Aktivita faktora IX
168 h po podaní dávky (IU/ml)
0,08 (16) 0,11 (19) 0,15 (60) 0,17 (31)
Klírens = klírens prepočítaný na telesnú hmotnosť; relatívna výťažnosť = relatívna výťažnosť 30 min po podaní dávky;
distribučný objem = distribučný objem v rovnovážnom stave prepočítaný na telesnú hmotnosť. CV = koeficient variácie
Ako sa očakávalo, klírens prepočítaný na telesnú hmotnosť pediatrických pacientov a dospievajúcich bol v porovnaní s dospelými vyšší. U pediatrických pacientov ani u dospievajúcich v klinických štúdiach nebola potrebná žiadna úprava dávky.
Priemerné najnižšie hladiny v rovnovážnom stave sú uvedené v Tabuľke 6. Vychádzajú zo všetkých meraní pred podaním dávky vykonaných každých 8 týždňov v rovnovážnom stave u všetkých pacientov s dávkovaním 40 IU/kg raz týždenne. Refixia nie je určená na používanie pre deti mladšie ako 12 rokov.
Tabuľka 6 Priemer najnižších hladín* lieku Refixia (40 IU/kg) v rovnovážnom stave
0–6 rokov
N=
12
7–12 rokov
N=
13
13–17 rokov
N=9
18–65 rokov
N=
20
Odhad priemeru
najnižších hladín faktora IX (IU/ml)
(95 % IS)
0,15
(0,13;0,18)
0,19
(0,16;0,22)
0,24
(0,20;0,28)
0,29
(0,26;0,33)


* Najnižšie hladiny faktora IX = aktivita faktora IX meraná pred ďalšou týždennou dávkou (5 až 10 dní po podaní dávky) v rovnovážnom stave.
Farmakokinetika bola skúmaná u 16 dospelých a dospievajúcich pacientov, z ktorých 6 malo normálnu telesnú hmotnosť (BMI 18,5–24,9 kg/m2) a 10 malo nadváhu (BMI 25–29,9 kg/m2). Medzi pacientmi s normálnou telesnou hmotnosťou a nadváhou neboli žiadne viditeľné rozdiely vo farmakokinetických profiloch.
5.3 Predklinické údaje o bezpečnostiV štúdii toxicity opakovanej dávky na opiciach bola pozorovaná mierna a prechodná triaška po 3 hodinách po podaní a poľavila do 1 hodiny. Táto triaška tela bola pozorovaná pri dávkach lieku Refixia (3 750 IU/kg), ktoré sú viac ako 90-krát vyššie ako odporúčaná dávka pre ľudí (40 IU/kg). Nebol identifikovaný žiadny mechanizmus vedúci k triaške. V klinických skúšaniach nebola triaška hlásená.
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti a toxicity po opakovanom podávaní na potkanoch a opiciach neodhalili žiadne riziko pre ľudí.
V štúdiách toxicity opakovanej dávky na potkanoch a opiciach sa polyetylénglykol (PEG)
s molekulovou hmotnosťou 40 kDa detegoval imunohistochemickým farbením v epiteliálnych bunkách choroidného plexu v mozgu. Tento nález nebol spojený s poškodením tkaniva ani abnormálnymi klinickými prejavmi.
V štúdií distribúcie a vylučovania u myší a potkanov sa preukázalo, že polyetylénglykolová skupina (PEG) lieku Refixia sa v značnej miere distribuuje a eliminuje z orgánov, a vylučovala sa plazmou do moču (44–56 %) a stolice (28–50 %). Na základe modelovania údajov použitím sledovaných terminálnych polčasov (15–49 dní) v štúdiach distribúcie do tkanív u potkanov, 40 kDa
polyetylénglykolová skupina (PEG) dosiahne rovnovážny stav vo všetkých ľudských tkanivách do 1–
2 rokov liečby.
Dlhodobé štúdie na zvieratách na hodnotenie karcinogénneho potenciálu lieku Refixia alebo štúdie
na stanovenie účinkov lieku Refixia na genotoxicitu, plodnosť, vývoj alebo reprodukciu sa nevykonali.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok: chlorid sodný histidín sacharóza polysorbát 80 manitol
hydroxid sodný (na úpravu pH)
kyselina chlorovodíková (na úpravu pH)
Rozpúšťadlo:
histidín
voda na injekciu
hydroxid sodný (na úpravu pH)
kyselina chlorovodíková (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi, ani
rekonštituovať s infúznymi roztokmi inými ako je histidínové rozpúšťadlo, ktoré je súčasťou balenia.
6.3 Čas použiteľnosti
Pred otvorením:
2 roky. Počas času použiteľnosti sa môže Refixia uchovávať nepretržite pri teplote do 30°C počas obdobia nepresahujúceho 6 mesiacov. Ak bol liek už raz vybratý z chladničky, nesmie sa už
do chladničky vrátiť. Zaznačte si, prosím, na škatuli lieku dátum, kedy ste začali liek uchovávať
pri izbovej teplote.
Po rekonštitúcii:
Chemická a fyzikálna stabilita po rekonštitúcii bola dokázaná počas 24 hodín v chladničke (2 °C –
8 °C) a počas 4 hodín pri uchovávaní pri izbovej teplote (≤30 °C).
Z mikrobilologického hľadiska sa rekonštituovaný roztok má použiť ihneď. Ak sa nepoužije ihneď,
za čas a podmienky uchovávania po rekonštitúcii a pred použitím nesú zodpovednosť používatelia a neodporúča sa uchovávanie dlhší čas ako 4 hodiny pri izbovej teplote (≤30 °C) alebo 24 hodín
v chladničke (2 °C – 8 °C), ak rekonštitúcia prebehla za kontrolovaných a validovaných aseptických
podmienok.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie pri izbovej teplote a po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Každé balenie obsahuje:
– 1 sklenenú injekčnú liekovku (typ I) s práškom a chlórbutylovou gumenou zátkou
– 1 sterilný adaptér injekčnej liekovky na rekonštitúciu
– 1 naplnenú injekčnú striekačku so 4 ml histidínového rozpúšťadla s poistným uzáverom
(polypropylén), gumeným piestom (brómbutyl) a uzáverom so zátkou (brómbutyl)
– 1 nástavec piesta (polypropylén).
Veľkosť balenia 1.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomRefixia sa podáva intravenózne po rekonštitúcii prášku s rozpúšťadlom, ktoré sa dodáva v injekčnej striekačke. Po rekonštitúcii je roztok číra a bezfarebná tekutina bez viditeľných častíc. Rekonštituovaný liek je potrebné pred podávaním vizuálne skontrolovať, či neobsahuje častice a či nie je sfarbený. Nepoužívajte roztoky, ktoré sú zakalené alebo obsahujú usadeniny.
Pokyny na rekonštitúciu lieku pred podávaním, pozri písomnú informáciu pre používateľa. Rýchlosť podávania sa má určiť tak, aby vyhovovala pacientovi, do maximálnej rýchlosti injekcie
4 ml/min.
Budete potrebovať aj infúznu súpravu (hadičku a motýlikovú ihlu), sterilné alkoholové tampóny, gázové tampóny a náplasti. Tieto pomôcky nie sú súčasťou balenia lieku Refixia.
Vždy používajte aseptickú techniku.
LikvidáciaPo aplikácii injekčnú striekačku, infúznu súpravu a injekčnú liekovku s adaptérom zlikvidujte
bezpečným spôsobom.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovo Nordisk A/S Novo Allé
DK-2880 Bagsværd
Dánsko
8. REGISTRAČNÉ ČÍSLAEU/1/17/1193/001
EU/1/17/1193/002
EU/1/17/1193/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.