
dom na časté kŕmenie, by mala byť prvá hladina amoniaku ráno nižšia ako ULN.
Úprava na základe močového fenylacetylglutamínu
Merania hladiny U-PAGN môžu pomôcť pri usmernení úpravy dávkovania glycerolfenylbutyrátu a pri posúdení dodržania užívania. Každý gram U-PAGN vylúčený za 24 hodín pokrýva odpadový dusík
vytvorený z 1,4 gramu potravinových bielkovín. Ak je vylučovanie U-PAGN nedostatočné na pokrytie denného príjmu potravinových bielkovín a hladina amoniaku nalačno je vyššia ako polovica odporúčanej
hodnoty ULN, dávka glycerolfenylbutyrátu sa musí upraviť smerom nahor. Miera úpravy dávky sa musí riadiť podľa množstva potravinových bielkovín, ktoré bolo pokryté, na základe 24 hodinovej hladiny
U-PAGN a odhadovanej dávky glycerolfenylbutyrátu potrebnej na gram strávených potravinových
bielkovín.
Pozorované koncentrácie U-PAGN, ktoré sú nižšie ako nasledujúce hladiny, môžu naznačovať nesprávne podanie lieku a/alebo nedostatočné dodržiavanie užívania lieku:
· 9 000 mikrogramov (mikrogramov/ml) u pacientov mladších ako 2 roky
· 7 000 mikrogramov (mikrogramov/ml) u pacientov vo veku > 2 roky s BSA ≤ 1,3
· 5 000 mikrogramov (mikrogramov/ml) u pacientov vo veku > 2 roky s BSA > 1,3
Ak pozorované koncentrácie U-PAGN klesnú pod tieto hladiny, zhodnoťte dodržiavanie užívania lieku a/alebo účinnosť podávania lieku (napr. prostredníctvom vyživovacej sondy) a zvážte zvýšenie dávky glycerolfenylbutyrátu u pacientov, ktorí dodržiavajú pokyny pre užívanie, s cieľom dosiahnuť optimálnu reguláciu amoniaku (v rámci normálnej hranice u pacientov mladších ako 2 roky a nižšej ako polovičnej ULN u starších pacientov v stave nalačno).
Úprava na základe fenylacetátu a fenylacetylglutamínu v plazme
Príznaky zvracania, nevoľnosti, bolesti hlavy, somnolencie, zmätenosti alebo ospanlivosti za neprítomnosti vysokej hladiny amoniaku alebo interkurentného ochorenia môžu byť prejavmi toxicity spôsobenej kyselinou fenyloctovou (PAA) (pozri časť 4.4 Toxicita spôsobená kyselinou PAA). Preto meranie plazmatických hladín PAA a PAGN môže byť užitočné pri stanovení dávky. Bolo pozorované, že pomer plazmatickej hladiny PAA ku PAGN (obidve merané v mikrogramoch/ml) je celkovo nižší ako 1 u pacientov bez akumulácie PAA. U pacientov s pomerom PAA ku PAGN prevyšujúcim hodnotu 2,5 ďalšie zvyšovanie dávky glycerolfenylbutyrátu nemusí zvýšiť tvorbu PAGN dokonca aj napriek tomu, že plazmatické koncentrácie PAA sú zvýšené, v dôsledku saturácie konjugačnej reakcie. V takýchto prípadoch zvýšenie frekvencie dávky môže spôsobiť zníženie plazmatickej hladiny PAA a pomeru PAA
ku PAGN. Pri zmene dávky glycerolfenylbutyrátu sa musia hladiny amoniaku starostlivo sledovať.
Nedostatok syntázy N-acetylglutamátu (NAGS) a CITRÍNU (citrulinémia 2. typu)
Bezpečnosť a účinnosť lieku RAVICTI na liečbu pacientov s nedostatkom syntázy N-acetylglutamátu
(NAGS) a CITRÍNU (citrulinémia 2. typu) neboli stanovené.
Pediatrická populácia
Pacienti vo vekovom rozmedzí od >2 mesiace do 2 rokov
V súčasnosti dostupné údaje sú opísané v časti 5.2.
Pacienti od narodenia po vek <2 mesiace
Neodporúča sa, pretože bezpečnosť a účinnosť lieku RAVICTI v tejto vekovej skupine neboli doteraz stanovené.
Osobitné populácie
Starší pacienti (najmenej 65 rokov)
Klinické štúdie lieku RAVICTI nezahŕňali dostatočný počet účastníkov vo veku najmenej 65 rokov, aby sa mohlo stanoviť, či odpovedajú inak než mladší účastníci. Vo všeobecnosti je pri výbere dávky u
starších pacientov potrebná zvýšená opatrnosť, pričom sa má zvyčajne začať s dolnou hranicou rozsahu
dávkovania, a do úvahy sa musí vziať vyššia frekvencia poklesu funkcie pečene, obličiek alebo srdca a
súčasne sprievodné ochorenie alebo liečba iným liekom.
Porucha funkcie pečene
Keďže ku konverzii PAA na PAGN dochádza v pečeni, pacienti s ťažkou poruchou funkcie pečene môžu mať zníženú schopnosť konverzie a vyššiu plazmatickú hladinu PAA a plazmatický pomer PAA ku
PAGN. Preto dávkovanie u dospelých a pediatrických pacientov s miernou, stredne ťažkou alebo ťažkou
poruchou funkcie pečene sa musí začať s dolnou hranicou odporúčaného rozsahu dávkovania
(4,5 ml/m2/deň) a udržiavať na najnižšej dávke nevyhnutnej na reguláciu hladín amoniaku u pacienta.
Plazmatický pomer PAA ku PAGN prevyšujúci hodnotu 2,5 môže naznačovať saturáciu kapacity konverzie PAA na PAGN a potrebu zníženia dávky a/alebo zvýšenia frekvencie dávky. Plazmatický
pomer PAA ku PAGN môžu byť užitočný pri monitorovaní dávkovania. (Pozri časť 5.2).
Poruchae funkcie obličiek
Neboli vykonané žiadne štúdie u pacientov s UCD s poruchou funkcie obličiek; bezpečnosť
glycerolfenylbutyrátu u pacientov s poruchou funkcie obličiek nie je známa. RAVICTI sa má používať s obozretnosťou u pacientov so závažnou poruchou funkcie obličiek. Podľa možností takíto pacienti musia začať s najnižšou dávkou nevyhnutnou na reguláciu hladiny amoniaku v krvi a túto dávku si udržiavať.
Spôsob podávania
Perorálne alebo gastrointestinálne použitie.
RAVICTI sa má užívať s jedlom a podávať priamo do úst prostredníctvom perorálnej striekačky. Nepridávajte do lieku veľké množstvo inej kvapaliny, ani ho nemiešajte s inou kvapalinou, pretože glycerolfenylbutyrát je ťažší než voda, čo môže spôsobiť neúplné podanie. Boli vykonané štúdie kompatibility (pozri časť 4.5). RAVICTI sa môže pridať do malého množstva jablkovej šťavy, kečupu alebo pyré a musí sa užiť do 2 hodín pri uchovávaní pri izbovej teplote (25 °C). Liek sa môže zmiešať s medicínskymi výživami (Cyclinex-1, Cyclinex-2, UCD-1, UCD-2, Polycose, Pre Phree a Citrulline) a užiť do 2 hodín pri uchovávaní pri teplote 25 °C alebo do 24 hodín pri uchovávaní v chladničke.
Na začiatku liečby poskytne lekáreň úvodné balenie, ktoré obsahuje liek, adaptér uzatvárateľného veka fľaše a 7 perorálnych striekačiek, označených značkou CE, vo vhodnej veľkosti na podanie správnej
dávky (pozri časť 6.5). Po začatí liečby poskytne lekáreň štandardné balenie, ktoré obsahuje liek a adaptér uzatvárateľného veka fľaše. Ďalšie perorálne striekačky označené značkou CE, ktoré sú kompatibilné s
adaptérom uzatvárateľného veka fľaše, je možné získať z lekárne.
Fľašu s liekom RAVICTI otvorte zatlačením na vrchnák a jeho otočením smerom doľava. Na fľašu pripevnite zatočením adaptér uzatvárateľného veka. Do adaptéru uzatvárateľného veka vložte hrot perorálnej striekačky. Fľašu spolu so stále zasunutou perorálnou striekačkou otočte dnom nahor. Perorálnu striekačku napĺňajte ťahaním piestu dovtedy, kým sa striekačka nenaplní potrebným množstvom lieku. Poklepte po perorálnej striekačke, aby ste z nej odstránili vzduchové bubliny a presvedčte sa, že ste ju naplnili správnym množstvom kvapaliny. Prehltnite kvapalinu z perorálnej striekačky alebo pripevnite perorálnu striekačku na gastronomickú či nazogastrickú sondu. Tá istá perorálna striekačka sa má použiť
na podanie všetkých dávok za jeden deň. Je dôležité, aby sa zabezpečilo udržiavanie čistoty perorálnej striekačky a vysušenie medzi jednotlivými podaniami dávok. Nevyplachujte uzatvárateľné veko fľaše ani
perorálnu striekačku medzi jednotlivými dávkami počas dňa, keďže prítomnosť vody spôsobuje
degradáciu glycerolfenylbutyrátu. Po použití pevne zatvorte záklopku na adaptéri uzatvárateľného veka.
Po podaní poslednej dávky v daný deň sa perorálna striekačka musí znehodnotiť. Uzatvárateľné veko fľaše sa musí znehodnotiť, keď je fľaša prázdna alebo 3 dni po jej otvorení, aj keď nie je prázdna. Po každom otvorení novej fľaše sa musí použiť nové uzatvárateľné veko fľaše.
Tým pacientom, ktorí nie sú schopní užiť liek ústami, sa RAVICTI môže podávať pomocou nazogastrickej alebo gastrostomickej sondy zo silikónu medicínskej triedy označenej symbolom CE.
Ďalšie informácie týkajúce sa spôsobu podávania a štúdií kompatibility/stability pri používaní nájdete v časti 6.6.
Príprava podávania pomocou nazogastrickej alebo gastrostomickej sondy:
Štúdie in vitro hodnotiace percentuálne spracovanie celkovej dávky podanej pomocou nazogastrickej, nozojejunálnej alebo gastrostomickej sondy preukázali, že percento spracovanej dávky bolo > 99 % pri
dávkach >1 ml a 70 % pri 0,5 ml dávke. Pacienti, ktorí sú schopní prehltnúť tekutiny, majú užívať
RAVICTI perorálne, a to platí aj pre pacientov s nazogastrickou a/alebo gastrostomickou sondou. Avšak u pacientov, ktorí nie sú schopní prehĺtať tekutiny, sa môže použiť nazogastrická a/alebo gastrostomická
sonda na podávanie lieku RAVICTI takto:
· Pomocou perorálnej striekačky natiahnite z fľaše predpísanú dávku lieku RAVICTI.
· Vložte hrot perorálnej striekačky do hrotu gastrostomickej/nazogastrickej sondy.
· Pomocou piestu perorálnej striekačky podajte RAVICTI do sondy.
· Jedenkrát prepláchnite pomocou 10 ml vody alebo medicínskeho prípravku a po podaní nechajte
vyplachovaciu tekutinu odtiecť.
Podanie dávok 0,5 ml alebo menších sa neodporúča nazogastrickými, nazojejunálnymi alebo gastrostomickými sondami kvôli nízkemu spracovaniu lieku v dávke.
4.3 Kontraindikácie
· Precitlivenosť na liečivo.
· Liečba akútnej hyperamonémie.
4.4 Osobitné upozornenia a opatrenia pri používaní
Dokonca aj počas liečby glycerolfenylbutyrátom sa u určitej skupiny pacientov môže vyskytnúť akútna
hyperamonémia vrátane hyperamonemickej encefalopatie.
Zníž ená absorpci a f enyl butyr át u pri pankre at ick ej nedost at očnosti al ebo p ri čr evnej mal absorpci i Exokrinné pankreatické enzýmy hydrolyzujú glycerolfenylbutyrát v tenkom čreve a oddeľujú účinnú časť, fenylbutyrát, od glycerolu. Tento proces umožňuje absorbovanie fenylbutyrátu do krvného obehu. Nízka hladina pankreatických enzýmov alebo ich neprítomnosť, alebo črevné ochorenie spôsobujúce malabsorpciu tukov môžu spôsobiť zníženie alebo neprítomnosť trávenia glycerolfenylbutyrátu a/alebo absorpcie fenylbutyrátu a zníženie regulácie plazmatickej hladiny amoniaku. Hladiny amoniaku sa musia starostlivo monitorovať u pacientov s pankreatickou nedostatočnosťou alebo s črevnou malabsorpciou.
Neurotoxicita
U pacientov s rakovinou, ktorí užívali kyselinu PAA intravenózne, boli hlásené reverzibilné klinické prejavy naznačujúce neurotoxicitu (napr. nauzea, zvracanie, somnolencia) v súvislosti s hladinami
fenylacetátu v rozsahu od 499 do 1 285 mikrogramov/ml. Napriek tomu, že to nebolo pozorované v klinických skúšaniach u pacientov s UCD, podozrenie z vysokých hladín kyseliny PAA sa musí uplatniť u
pacientov s nevysvetlenou somnolenciou, zmätenosťou, nauzeou a letargiou, ktorí majú normálnu alebo nízku hladinu amoniaku.
Ak sú prítomné príznaky zvracania, nevoľnosti, bolesti hlavy, somnolencie, zmätenosti alebo ospanlivosti za neprítomnosti vysokej hladiny amoniaku alebo iného interkurentného ochorenia, zmerajte plazmatickú hladinu kyseliny PAA a plazmatický pomer PAA ku PAGN a zvážte zníženie dávky glycerolfenylbutyrátu alebo zvýšenie frekvencie dávkovania, ak hladina kyseliny PAA prekročí hodnotu 500 mikrogramov/l a plazmatický pomer PAA ku PAGN prekročí hodnotu 2,5.
Monitorovanie a laboratórne testy.
Denná dávka sa musí individuálne upraviť podľa odhadovanej schopnosti syntézy močoviny u pacienta, ak existuje, podľa profilu aminokyselín, podľa tolerancie bielkovín a denného príjmu bielkovín potrebných na rast a vývoj. Na udržanie hladín esenciálnych aminokyselín a aminokyselín s rozvetveným reťazcom v normálnom rozmedzí môžu byť nevyhnutné dodatočné prípravky obsahujúce aminokyseliny. Ďalšia úprava môže vychádzať z monitorovania plazmatickej hladiny amoniaku, glutamínu, U-PAGN a/alebo plazmatickej hladiny PAA a PAGN, ako aj plazmatického pomeru PAA ku PAGN (pozri časť
4.2).
Schopnosť ďalší ch li ekov ovpl yvni ť hladinu amoniaku
Kortikosteroidy
Použitie kortikosteroidov môže spôsobiť rozklad telesných bielkovín a zvýšenie plazmatických hladín amoniaku. Pri súčasnom užívaní kortikosteroidov a glycerolfenylbutyrátu dôkladne monitorujte hladiny amoniaku.
Kyselina valproová a haloperidol
Hyperamonémia môže byť indukovaná haloperidolom a kyselinou valproovou. U pacientov s UCD je nevyhnutné monitorovať hladiny amoniaku pri použití kyseliny valproovej alebo haloperidolu.
Probenecid
Probenecid môže inhibovať vylučovanie metabolitov glycerolfenylbutyrátu vrátane PAGN obličkami.
Ž eny vo fertilnom veku/ ant ikonc epci a u mužov a ži en
Ženy vo fertilnom veku musia používať účinnú antikoncepciu (pozri časť 4.6).
Gravidita
RAVICTI sa nemá používať počas gravidity a u žien vo fertilnom veku nepoužívajúcich antikoncepciu,
pokiaľ klinický stav ženy nevyžaduje liečbu glycerolfenylbutyrátom, pozri časť 4.6.
Glycerol
Glycerolfenylbutyrát podávaný v maximálnej odporúčanej dávke obsahuje menej ako 0,5 g glycerolu v
jednej dávke.
4.5 Liekové a iné interakcie
Súčasné užívanie liekov, o ktorých je známe, že inhibujú lipázu, sa má vykonávať opatrne, pretože glycerolfenylbutyrát je hydrolyzovaný tráviacou lipázou na fenylbutyrátovú kyselinu a glycerol. Môže to súvisieť so zvýšeným rizikom liekových interakcií s inhibítormi lipázy a s lipázou obsiahnutou v enzymatických substitučných liečbach pankreasu.
Nedá sa vylúčiť potenciálny účinok na izoenzým CYP2D6 a u pacientov, ktorí užívajú lieky, ktoré sú substrátmi CYP2D6, sa odporúča opatrnosť.
Preukázalo sa že, glycerolfenylbutyrát a/alebo jeho metabolity, PAA a PBA, sú slabými induktormi enzýmu CYP3A4 in vivo. Expozícia glycerolfenylbutyrátu in vivo má za následok približne 32 % zníženie systémovej expozície midazolamu a zvýšenie expozície 1-hydroxy metabolitu midazolamu, čo naznačuje, že stabilné dávkovanie glycerolfenylbutyrátu spôsobuje indukciu CYP3A4. Je možná potenciálna interakcia glycerolfenylbutyrátu ako induktora CYP3A4 a liekov prevažne metabolizovaných cestou CYP3A4. Preto liečebné účinky a/alebo hladiny metabolitov liekov vrátane perorálnej antikoncepcie,
ktoré sú substrátmi pre tento enzým, môžu byť znížené a ich úplný účinok nemôže byť zaručený po súčasnom podaní spolu s glycerolfenylbutyrátom.
Iné lieky, ako kortikosteroidy, kyselina valproová, haloperidol a probenecid, môžu potenciálne ovplyvniť hladiny amoniaku, pozri časť 4.4.
Účinky glycerolfenylbutyrátu na iné izoenzýmy CYP neboli u ľudí preskúmané a nemožno ich vylúčiť. Štúdie kompatibility preukázali chemickú a fyzikálnu stabilitu pri používaní glycerolfenylbutyrátu spolu s
nasledujúcimi potravinami a výživovými doplnkami: jablkový džús, kečup, ovocná šťava a päť
medicínskych výživ (Cyclinex-1, Cyclinex-2, UCD-1, UCD-2, Polycose, Pro Phree a Citrulline), ktoré
zvyčajným spôsobom konzumovali pacienti z UCD (pozri časť 4.2).
4.6 Fertilita, gravidita a laktácia
Ženyvo fertilnom veku/antikoncepciapremužovaženy
Použitie lieku RAVICTI u žien vo fertilnom veku musí byť sprevádzané s používaním účinnej antikoncepcie (pozri časť 4.4).
Gravidita
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). K dispozícii sú obmedzené údaje o
použití glycerolfenylbutyrátu u gravidných žien.
Glycerolfenylbutyrát sa neodporúča užívať v tehotenstve alebo ženám vo fertilnom veku, ktoré nepoužívajú antikoncepciu.
 D
ojčenie
D
ojčenie
Nie je známe, či sa glycerolfenylbutyrát alebo jeho metabolity vylučujú do ľudského mlieka. Riziko u novorodencov/dojčiat nemôže byť vylúčené. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť
liečbu glycerolfenylbutyrátom sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre
ženu.
FertilitaGlycerolfenylbutyrát nemal žiadny účinok na fertilitu alebo reprodukčnú funkciu u samcov a samíc potkanov (pozri časť 5.3). Nie sú k dispozícii žiadne údaje týkajúce sa plodnosti u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeRAVICTI môže mať veľký vplyv na schopnostť viesť vozidlá a obsluhovať stroje, keďže liečba glycerolfenylbutyrátom môže spôsobiť závrat alebo bolesť hlavy (pozri časť 4.8). Pacienti nesmú viesť vozidlá ani obsluhovať stroje, kým sa u nich prejavujú tieto vedľajšie účinky.
4.8 Nežiaduce účinkySúhrn bezpečnostnéhoprofiluHodnotenie nežiaducich reakcií vychádzalo z expozície u 114 pacientov s UCD (65 dospelých a 49 detí vo
veku od 2 mesiacov do 17 rokov) s nedostatočnosťami v CPS, OTC, ASS, ASL, ARG alebo HHH v rámci
4 krátkodobých a 3 dlhodobých klinických skúšaní, v ktorých 90 pacientov absolvovalo 12 mesačné trvanie (stredná hodnota expozície = 51 týždňov).
Na začiatku liečby sa môže vyskytnúť bolesť brucha, nevoľnosť, hnačka a/alebo bolesť hlavy. Tieto reakcie zvyčajne vymiznú do niekoľkých dní, aj keď liečba pokračuje. Najčastejšie hlásené nežiaduce reakcie (> 5 %) počas liečby glycerolfenylbutyrátom boli hnačka, flatulencia a bolesť hlavy (8,8 % pri každej); znížená chuť do jedla (7,0 %), vracanie (6,1 %); únava, nevoľnosť a abnormálny zápach kože (5,3 % pri každej).
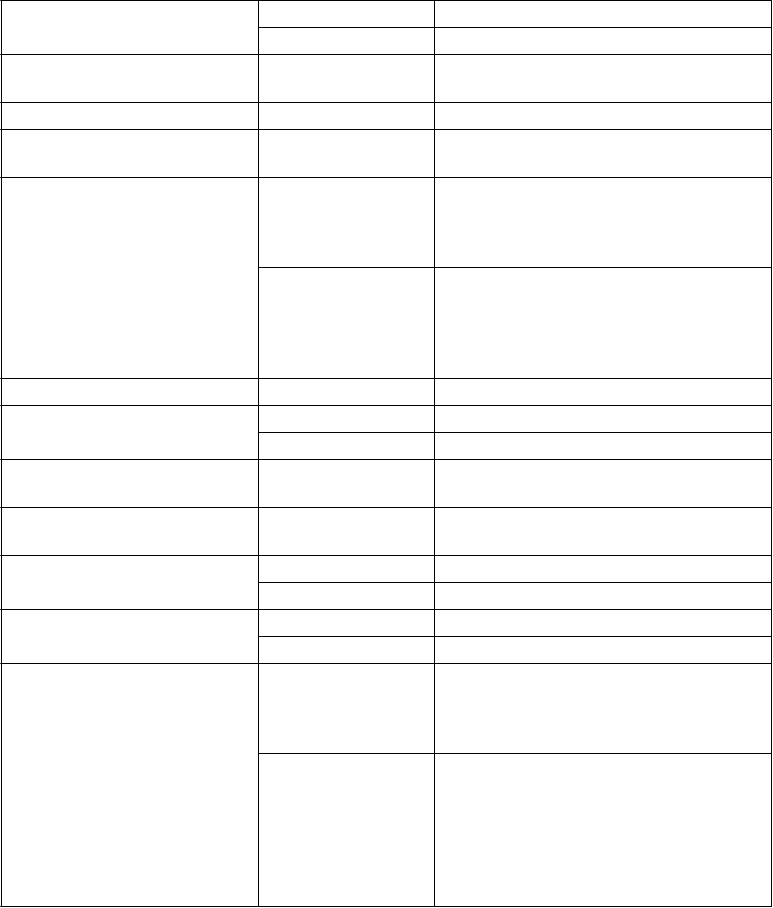
Prehľad neži aduci ch reak cií v t abuľke Nežiaduce reakcie sú uvedené nižšie podľa triedy orgánových systémov a frekvencie. Frekvencie sú definované ako veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000); neznáme (nie je možné odhadnúť z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
Každá nežiaduca reakcia hlásená u jedného pacienta splnila kritériá pre kategóriu menej časté. V dôsledku zriedkavosti populácie s UCD a malej veľkosti databázy populácie na zistenie bezpečnosti lieku (N = 114) je frekvencia nežiaducich reakcií v kategórii zriedkavé a veľmi zriedkavé neznáma.
Trieda orgánových systémov Frekvencia Nežiaduca reakcia Infekcie a nákazy Menej časté Gastrointestinálne vírusové infekcie Poruchy endokrinného systému Menej časté Hypotyreóza
Poruchy metabolizmu a výživy Časté Zníženie chuti do jedla, zvýšenie chuti do
jedla
Menej časté Hypoalbuminémia, hypokaliémia
Psychické poruchy Časté Averzia voči jedlu
Poruchy nervového systému Časté Závrat, bolesť hlavy, tras
Menej časté Dysgeúzia, letargia, parestézia, psychomotorická hyperaktivita,
Poruchy srdca a srdcovej
somnolencia, poruchy reči
Menej časté Stav zmätenosti, depresívna nálada
Komorová arytmia
činnosti Menej časté
Poruchy ciev Menej časté Nával horúčavy
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Menej časté Dysfónia, epistaxa, upchatý nos, bolesť v orofaryngeálnej oblasti, podráždenie hrdla
Časté Flatulencia, hnačka, vracanie, nevoľnosť, bolesť brucha, dyspepsia, abdominálna distenzia, zápcha, nepríjemný pocit v ústach, napínanie na vracanie
Menej časté Nepríjemný pocit v bruchu, abnormálna stolica, sucho v ústach, grganie, nutkanie na defekáciu, bolesť v nadbrušku alebo podbrušku, bolestivá defekácia, steatorea, stomatitída
Poruchy pečene a žlčových ciest Menej časté Bolesť žlčníka
Poruchy kože a podkožného
tkaniva
Poruchy kostrovej a svalovej
Časté Abnormálny zápach kože, akné
Menej časté Alopécia, hyperhidróza, svrbivé vyrážky
Bolesť chrbta, opuch kĺbov, svalové kŕče,
sústavy a spojivového tkaniva Menej časté
Poruchy obličiek a močových
ciest Menej časté
bolesti v končatinách, plantárna fascitída
Bolesť mechúra
Poruchy reprodukčného
systému a prsníkov
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Časté Metrorágia
Menej časté Amenorea, nepravidelná menštruácia
Časté Únava, periférny edém
Menej časté Hlad, pyrexia
Časté Zvýšená hladina aspartátaminotransferázy, alanínaminotransferázy, zvýšená aniónová medzera, znížený počet lymfocytov, znížená hladina vitamínu D
Menej časté Zvýšená hladina draslíka v krvi, zvýšená hladina triglyceridov v krvi, abnormálne hodnoty elektrokardiogramu, zvýšená hladina lipoproteínov s nízkou hustotou, predĺžený protrombínový čas, zvýšený počet bielych krviniek, nárast telesnej hmotnosti, pokles telesnej hmotnosti
 Pediatrická populácia
Pediatrická populácia
K nežiaducim reakciám hláseným viac u pediatrických než u dospelých pacientov počas dlhodobej liečby
glycerolfenylbutyrátom patrili bolesť v nadbrušku (3 zo 49 pediatrických pacientov [6,1 %] v porovnaní s
1 z 51 dospelých [2,0 %] a zvýšená aniónová medzera (2 zo 49 pediatrických pacientov [4,1 %] v porovnaní s 0 z 51 dospelých [0%].
Hláseniepodozrenínanežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 Predávkovanie
Kyselina PAA, aktívny metabolit glycerolfenylbutyrátu, súvisí s prejavmi a príznakmi neurotoxicity (pozri
časť 4.4) a môže dôjsť ku kumulácii u pacientov s predávkovaním. V prípade predávkovania treba
užívanie lieku prerušiť a pacienta treba monitorovať z hľadiska akýchkoľvek prejavov alebo príznakov nežiaducich reakcií.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné liečivá na tráviaci trakt a metabolizmus, rôzne lieky na tráviaci trakt a metabolizmus ATC kód: A16AX09
Mechanizmusúčinku
Glycerolfenylbutyrát je liek viažuci dusík. Je to triglycerid obsahujúci 3 molekuly PBA napojené na
hlavný reťazec glycerolu.
UCD sú dedičné nedostatky enzýmov alebo transportérov nevyhnutných na syntézu močoviny z amoniaku (NH3, NH4+). Absencia týchto enzýmov alebo transportérov vedie k hromadeniu toxických hladín dusíka v krvi a mozgu postihnutých pacientov. Glycerolfenylbutyrát hydrolyzujú pankreatické lipázy, čím sa získava PBA, ktorá sa konvertuje beta oxidáciou na PAA, aktívnu časť glycerolfenylbutyrátu. PAA konjuguje s glutamínom (ktorý obsahuje 2 molekuly dusíka) prostredníctvom acetylácie v pečeni a v obličkách a tvorí PAGN, ktorý sa vylučuje obličkami. Na molárnom základe, PAGN, podobne ako močovina, obsahuje 2 móly dusíka a poskytuje alternatívny prostriedok vylučovania odpadového dusíka.
Farmakodynamické účinky
Farmakologické účinky
V súhrnnej analýze štúdií, v ktorých pacienti prešli z fenylbutyrátu sodného na glycerolfenylbutyrát, bola
hodnota AUC0-24h amoniaku 774,11 [(mikromolov/l)*hodina] počas liečby glycerolfenylbutyrátom a
991,19 [(mikromólov/l)*hodina] počas liečby fenylbutyrátom sodným (n = 80, pomer geometrických
stredných hodnôt 0,84; 95 % intervaly spoľahlivosti 0,740; 0,949).
Elektrofyziológia srdca
Účinok opakovaných dávok glycerolfenylbutyrátu 13,2 g /deň a 19,8 g/deň (približne 69 % a 104 %
maximálnej odporúčanej dennej dávky) na QTc interval bol hodnotený v randomizovanom, placebom a účinnou látkou kontrolovanom (moxifloxacín 400 mg ) krížovom skúšaní so štyrmi liečebnými skupinami
u 57 zdravých účastníkov. Horná hranica jednostranného 95 % IS u najväčšieho, placebom upravovaného
a východiskovou hodnotou korigovaného intervalu QTc bola u glycerolfenylbutyrátu nižšia ako 10 ms, čo preukazuje, že glycerolfenylbutyrát nemal žiadny účinok na predĺženie intervalu QT/QTc. Test citlivosti bol potvrdený významným predĺžením intervalu QTc pozitívnej kontroly moxifloxacínom.
Klinická účinnosťabezpečnosť
Klinické štúdie u dospelých pacientov s UCD
Aktívne kontrolovaná, 4-týždňová, neinferiórna, zaslepená, krížová štúdia (Štúdia 1) Randomizovaná, dvojito zaslepená, aktívne kontrolovaná, krížová, neinferiórna štúdia (Štúdia 1) porovnávala ekvivalentné dávky glycerolfenylbutyrátu s fenylbutyrátom sodným hodnotením
24-hodinových venóznych hladín amoniaku u pacientov s UCD, ktorí užívali fenylbutyrát sodný pred
zaradením na reguláciu UCD. Pacienti museli mať diagnózu UCD zahŕňajúcu nedostatky CPS, OTC alebo
ASS potvrdené enzymatickým, biochemickým alebo genetickým testovaním. Pacienti nesmeli mať
klinicky potvrdenú hyperamonémiu pri zaradení a nesmeli užívať lieky, o ktorých je známe, že zvyšujú hladinu amoniaku (napr. valproát), zvyšujú katabolizmus bielkovín (napr. kortikosteroidy) alebo významne ovplyvňujú renálny klírens (napr. probenecid).
Glycerolfenylbutyrát nebol inferiórny voči fenylbutyrátu sodnému vzhľadom na 24-hodinovú hodnotu AUC u amoniaku. V tejto analýze bolo hodnotených štyridsaťštyri pacientov. Stredné 24-hodinové hodnoty AUC amoniaku počas stabilného dávkovania boli 866 mikromolov/l*hodina u glycerolfenylbutyrátu a 977 mikromolov/l*hodina u fenylbutyrátu sodného (n = 44, pomer geometrických stredných hodnôt 0,91; 95 % intervaly spoľahlivosti 0,799; 1,034).
V súlade s plazmatickou hladinou amoniaku boli hladiny glutamínu v krvi nižšie počas liečby glycerolfenylbutyrátom oproti liečbe fenylbutyrátom sodným v každom ramene krížovej štúdie (pokles o
44,3 ± 154,43 mikromólov/l po glycerolfenylbutyráte v porovnaní s NaPBA, p = 0,064, párový t-test;
p = 0,048, Wilcoxonov znamienkový test poradí).
Otvorená nekontrolovaná rozšírená štúdia u dospelých
Bola vykonaná dlhodobá (12 mesačná), nekontrolovaná, otvorená štúdia (Štúdia 2) na zhodnotenie regulácie mesačných hladín amoniaku a hyperamonemickej krízy za 12-mesačné obdobie. Do štúdie bolo
zaradených celkovo 51 dospelých pacientov vykazujúcich nedostatočnosti CPS, OTC, ASS, ASL, ARG a
HHH a všetci okrem 6 pacientov prešli z fenylbutyrátu sodného na ekvivalentné dávky glycerolfenylbutyrátu. Venózne hladiny amoniaku boli monitorované mesačne. Priemerné venózne hladiny amoniaku nalačno u dospelých pacientov v Štúdii 2 boli v normálnom rozmedzí počas dlhodobej
liečby glycerolfenylbutyrátom (rozsah: 6 – 30 mikromólov/l). Z 51 dospelých pacientov zúčastňujúcich sa na Štúdii 2 bolo u 7 pacientov (14 %) hlásených celkovo 10 hyperamonemických kríz počas liečby
glycerolfenylbutyrátom v porovnaní s 9 pacientmi (18 %), ktorí hlásili celkovo 15 kríz za 12-mesačné obdobie po vstupe do štúdie, pričom boli liečení fenylbutyrátom sodným.
Pediatrická populácia
Klinické štúdie u pediatrických pacientov s UCD
Účinnosť glycerolfenylbutyrátu u pediatrických pacientov vo veku 2 mesiace až 17 rokov vykazujúcich nedostatočnosti OTC, ASS, ASL a ARG bola hodnotená v 2 otvorených štúdiách s fixnou následnosťou a prechodom z fenylbutyrátu sodného na ekvivalentné dávkovanie glycerolfenylbutyrátu (Štúdia 3 a 4). Štúdia 3 trvala 14 dní a Štúdia 4 trvala 10 dní.
Zistilo sa, že glycerolfenylbutyrát nebol inferiórny voči fenylbutyrátu sodnému, čo sa týka regulácie amoniaku v obidvoch z týchto pediatrických štúdií. V súhrnnej analýze krátkodobých štúdií u detí (Štúdia
3 a Štúdia 4) plazmatická hladina amoniaku bola významne nižšia po prechode na glycerolfenylbutyrát;
hodnota AUC0-24h amoniaku bola 626,79 mikromólov/l*hodina počas liečby glycerolfenylbutyrátom a
871,72 mikromólov/l*hodina počas liečby fenylbutyrátom sodným (n = 26, pomer geometrických
stredných hodnôt 0,79; 95 % intervaly spoľahlivosti 0,647; 0,955).
Priemerné hladiny glutamínu v krvi boli takisto nevýznamne nižšie po liečbe glycerolfenylbutyrátom oproti liečbe fenylbutyrátom sodným o -45,2 ± 142,94 mikromólov/l (p = 0,135, párový t-test; p = 0,114, Wilcoxonov znamienkový test poradí).
Otvorené, nekontrolované, rozšírené štúdie u pediatrických pacientov
Boli vykonané dlhodobé (12-mesačné), nekontrolované, nezaslepené štúdie na zhodnotenie regulácie mesačných hladín amoniaku a hyperamonemickej krízy za 12-mesačné obdobie v troch štúdiách (Štúdia 2, do ktorej boli zaradení aj dospelí, a rozšírenia Štúdie 3 a 4). Zaradených bolo celkovo 49 detí vo veku
2 mesiace až 17 rokov s nedostatočnosťami OTC, ASS, ASL a ARG a všetky okrem 1 prešli z fenylbutyrátu sodného na glycerolfenylbutyrát. Priemerné venózne hladiny amoniaku nalačno boli v'
normálnom rozmedzí počas dlhodobej liečby glycerolfenylbutyrátom (rozsah: 17 – 25 mikromólov/l). Zo
49 pediatrických pacientov zúčastnených na týchto rozšírených štúdiách 12 pacientov (25 %) hlásilo celkovo 17 hyperamonemických kríz počas liečby glycerolfenylbutyrátom v porovnaní s 38 krízami
u 21 pacientov (43 %) za predchádzajúce 12-mesačné obdobie pred vstupom do štúdie, pričom boli liečení
fenylbutyrátom sodným.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s
glycerolfenylbutyrátom v jednej alebo vo viacerých podskupinách pediatrickej populácie pri liečbe porúch
močovinového cyklu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Zvrat už existujúceho neurologického postihnutia je nepravdepodobný po liečbe a neurologické zhoršenie môže u niektorých pacientov pokračovať.
5.2 Farmakokinetické vlastnosti
Absorpcia
RAVICTI je prekurzor PBA. Po perorálnom užití sa PBA uvoľní z hlavného reťazca glycerolu do gastrointestinálneho traktu pankreatickou lipázou. PBA získaná z glycerolfenylbutyrátu sa ďalej
konvertuje β-oxidáciou na kyselinu PAA.
U zdravých, dospelých účastníkov, ktorí nalačno užili jednorazovú perorálnu dávku 2,9 ml/m2 glycerolfenylbutyrátu, boli vrcholové plazmatické hladiny PBA, PAA a PAGN dosiahnuté v 2., 4. a 4. hodine v danom poradí. Po podaní jednorazovej dávky glycerolfenylbutyrátu plazmatické koncentrácie PBA boli kvantifikovateľné u 15 z 22 účastníkov v prvom časovom bode vzorky po podaní dávky
(0,25 h). Priemerná maximálna koncentrácia (Cmax) u PBA, PAA a PAGN bola 37,0 mikrogramov/ml,
14,9 mikrogramov/ml a 30,2 mikrogramov/ml v danom poradí. U zdravých účastníkov nebol v plazme
zistený neporušený glycerolfenylbutyrát.
U zdravých účastníkov sa systémová expozícia kyseline PAA, PBA a PAGN zvýšila úmerne veľkosti dávky. Po užívaní 4 ml glycerolfenylbutyrátu po dobu 3 dní (3-krát denne [TID]) boli stredné hodnoty Cmax a AUC 66 mikrogramov/ml a 930 mikrogramov•h/ml u PBA a 28 mikrogramov/ml
a 942 mikrogramov•h/ml u PAA v danom poradí. V rovnakej štúdii po užívaní 6 ml glycerolfenylbutyrátu
po dobu 3 dní (TID) boli stredné hodnoty Cmax a AUC 100 mikrogramov/ml a 1400 mikrogramov•h/ml u
PBA a 65 mikrogramov/ml a 2064 mikrogramov•h/ml u PAA v danom poradí.
U dospelých pacientov s UCD, ktorí užili viaceré dávky glycerolfenylbutyrátu, boli maximálne
plazmatické koncentrácie (Cmaxss) PBA, PAA a PAGN v stabilizovanom stave dosiahnuté v 8., 12. a
10. hodine v danom poradí po podaní prvej dávky v daný deň. U pacientov s UCD nebol v plazme
zistiteľný neporušený glycerolfenylbutyrát.
Podľa modelovania farmakokinetiky populácie a podľa simulácií dávkovania kyselina PBA vstúpi do obehu asi 70 – 75 % pomalšie pri perorálnom podávaní glycerolfenylbutyrátu než u fenylbutyrátu sodného, čo tiež naznačuje, že plocha telesného povrchu je najvýznamnejším kovariátom vysvetľujúcim variabilitu klírensu kyseliny PAA.
Distribúcia
V podmienkach in vitro rozsah väzby ľudskej plazmatickej bielkoviny u metabolitov označených 14C bol
80,6 až 98,0 % u PBA (viac ako 1-250 mikrogramov/ml) a 37,1 až 65,6 % u PAA (viac ako
5-500 mikrogramov/ml). Bielkovinová väzba u PAGN bola 7 až 12 % a neboli zaznamenané žiadne účinky na koncentráciu.
Biotransformácia
Po perorálnom podaní pankreatické lipázy hydrolyzujú glycerolfenylbutyrát a uvoľňujú kyselinu PBA. PBA sa podrobuje β-oxidácii na PAA, ktorá je konjugovaná glutamínom v pečeni a v obličkách prostredníctvom enzýmu fenylacetyl-CoA: Lglutamín-N-acetyltransferázou s tvorbou PAGN. PAGN sa následne vylučuje do moču.
Saturácia konjugácie PAA a glutamínu s tvorbou PAGN bola naznačená zvýšením plazmatického pomeru
PAA ku PAGN pri zvýšení dávky a so zvyšujúcou sa závažnosťou poruchy funkcie pečene.
U zdravých účastníkov po podávaní 4 ml, 6 ml a 9 ml 3-krát denne po dobu 3 dní bol pomer strednej hodnoty AUC0-23h PAA ku PAGN 1; 1,25 a 1,6 v danom poradí. V samostatnej štúdii u pacientov s poruchou funkcie pečene (Child-Pugh B a C) boli pomery stredných hodnôt PAA ku PAGN v rámci všetkých pacientov, ktorí užívali 6 ml a 9 ml dvakrát denne, v rozmedzí od 0,96 do 1,28, a u pacientov, ktorí užívali 9 ml dvakrát denne, boli v rozmedzí od 1,18 do 3,19.
V štúdiách in vitro špecifická aktivita lipáz u glycerolfenylbutyrátu bola pozorovaná v nasledujúcom zostupnom poradí: pankreatická lipáza triglyceridov, karboxyl ester lipáza a pankreatická lipáza napojená na bielkovinu 2. Okrem toho bol glycerolfenylbutyrát hydrolyzovaný in vitro esterázami v ľudskej plazme. V týchto štúdiách in vitro úplné vymiznutie glycerolfenylbutyrátu nevytvorilo molárne ekvivalentnú PBA, čo naznačuje tvorbu mono- alebo bis-esterových metabolitov. Tvorba mono- alebo
bis-esterov však nebola skúmaná u ľudí.
Eliminácia
Stredná (SD) percentuálna hodnota podanej PBA eliminovanej ako PAGN bola približne 68,9 % (17,2) u dospelých pacientov a 66,4 % (23,9) u pediatrických pacientov s UCD v stabilizovanom stave. PAA a PBA predstavovali menšie metabolity v moči, pričom každá vykazovala < 1 % podanej dávky PBA.
Osobitné populácie
Porucha funkcie pečene
V štúdii u pacientov s klinicky dekompenzovanou cirhózou a pečeňovou encefalopatiou (Child-Pugh B a C) stredná hodnota Cmax kyseliny PAA bola 144 mikrogramov/ml (rozsah: 14-358 mikrogramov/ml) po podávaní každodennej dávky 6 ml glycerolfenylbutyrátu dvakrát denne, pričom stredná hodnota Cmax kyseliny PAA bola 292 mikrogramov/ml (rozsah: 57-655 mikrogramov/ml) po podávaní každodennej dávky 9 ml glycerolfenylbutyrátu dvakrát denne. Pomer stredných hodnôt PAA ku PAGN v rámci všetkých pacientov, ktorí užívali 6 ml dvakrát denne, bol v rozmedzí od 0,96 do 1,28 a u pacientov, ktorí užívali 9 ml dvakrát denne, bol v rozmedzí od 1,18 do 3,19. Po viacerých dávkach koncentrácia kyseliny PAA > 200 mikrogramov/l súvisela s plazmatickým pomerom koncentrácií PAA ku PAGN vyšším ako
2,5.
Tieto zistenia súhrnne naznačujú, že konverzia PAA na PAGN môže byť horšia u pacientov s ťažkou poruchou funkcie pečene a že plazmatický pomer PAA ku PAGN > 2,5 identifikuje pacientov s rizikom zvýšených hladín kyseliny PAA.
Porucha funkcie obličiek
Nebola skúmaná farmakokinetika glycerolfenylbutyrát u pacientov s poruchou funkcie obličiek vrátane pacientov s ochorením obličiek v poslednom štádiu (end-stage renal disease, ESRD) alebo pacientov na hemodialýze.
Pohlavie
U zdravých dospelých dobrovoľníkov sa zistil vplyv pohlavia u všetkých metabolitov, pričom ženy vo všeobecnosti mali vyššie plazmatické koncentrácie všetkých metabolitov než muži pri danej veľkosti dávky. U zdravých dobrovoľníčok bola stredná hodnota Cmax kyseliny PAA o 51 % a 120 % vyššia než u dobrovoľníkov mužského pohlavia po podaní 4 ml a 6 ml 3-krát denne po dobu 3 dní v danom poradí. Stredná hodnota AUC0-23h kyseliny PAA normalizovaná dávkou bola o 108 % vyššia u žien než u mužov. Dávkovanie u pacientov s UCD však musí byť individuálne prispôsobené podľa špecifických metabolických potrieb a kapacity zostatkového enzýmu u pacienta, a to bez ohľadu na pohlavie.
Pediatrická populácia
Podľa modelovania farmakokinetiky populácie a podľa simulácií dávkovania je plocha telesného povrchu najvýznamnejším kovariátom vysvetľujúcim variabilitu klírensu kyseliny PAA. Klírens kyseliny PAA bol
7,1 l/h, 10,9 l/h, 16,4 l/h a 24,4 l/h v danom poradí u pacientov s UCD vo veku ≤ 2, 3 až 5, 6 až 11, a 12 až
17 rokov. U 7 pediatrických pacientov vo veku do 2 rokov, ktorí užívali RAVICTI po dobu 12 mesiacov,
sa koncentrácie PAA, PBA a PAGN nezvýšili za celé liečebné obdobie a celkové stredné hodnoty koncentrácií PAA, PBA a PAGN u týchto pacientov boli podobné hodnotám pozorovaným u pediatrických skupín v staršom veku.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po
opakovanom podávaní a genotoxicity neodhalili žiadne osobitné riziko pre ľudí
Karcinogenéza
V štúdii na potkanoch glycerolfenylbutyrát spôsobil štatisticky významné zvýšenie výskytu adenómu acinárnych buniek pankreasu, karcinómu a kombinovaného adenómu alebo karcinómu u samcov a samíc pri podaní 4,7- a 8,4-násobku dávky u dospelých pacientov (6,87 ml/m2/deň na základe kombinovaných hodnôt AUC u PBA a PAA). U samíc potkanov bol takisto zvýšený výskyt týchto nádorov: adenóm folikulárnych buniek štítnej žľazy, karcinóm a kombinovaný adenóm alebo karcinóm, adrenálny kortikálny kombinovaný adenóm alebo karcinóm, cervikálny schwannóm, uterinný endometriálny stromálny polyp a kombinovaný polyp alebo sarkóm.
Glycerolfenylbutyrát nebol tumorigenický pri dávkach do 1 000 mg/kg/deň v 26-týždňovej štúdii na
myšiach.
Glycerolfenylbutyrát bol skúšaný v celom rade štúdií in vitro a in vivo zameraných na genotoxicitu a
nepreukázal žiadnu genotoxickú aktivitu.
Zhorše ni e f erti li ty
Glycerolfenylbutyrát nemal žiaden vplyv na fertilitu ani reprodukčnú funkciu u samcov a samíc potkanov pri klinických mierach expozície, avšak pri perorálnych dávkach približne do 7-násobku dávky u dospelých pacientov bola pozorovaná materská, ako aj samčia toxicita a zvýšil sa počet neživotaschopných embryí.
Vývi nové št údi e
Perorálne podávanie glycerolfenylbutyrátu počas obdobia organogenézy u potkanov a králikov nemalo žiaden vplyv na vývin zárodku a plodu pri 2,7- a 1,9-násobku dávky u dospelých pacientov v danom
poradí. Avšak materská toxicita a nežiaduce účinky na vývin zárodku a plodu vrátane zníženej hmotnosti
plodu a krčných rebier boli pozorované v štúdii na potkanoch pri dávke približne 6-násobku dávky u dospelých pacientov na základe kombinovaných hodnôt AUC u PBA a PAA. U potkanov neboli pozorované žiadne vývinové abnormality po 92. deň po pôrode po perorálnom podaní u gravidných samíc potkanov, počas organogenézy a laktácie.
Št údi e u ml áďat
V štúdii na mláďatách potkanov s každodenným perorálnym podávaním dávok od 2. dňa po pôrode po párenie a počas gravidity po vyzretí sa konečná telesná hmotnosť znížila v závislosti od dávky u samcov o
16 % a u samíc o 12 %. Fertilita (počet gravidných samíc potkanov) sa znížila o 25 % pri dávke
2,6-násobku dávky u dospelých pacientov. Takisto bola pozorovaná toxicita u embryí (zvýšené rezorpcie)
a znížená veľkosť vrhu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Žiadne.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
1 rok.
Po prvom otvorení fľaše sa liek musí použiť do 3 dní a fľašu a jej obsah treba znehodnotiť, aj keď nie je
prázdna.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Fľaša z číreho skla III. triedy s uzáverom z polyetylénu (HDPE) s vysokou hustotou s detskou poistkou.
Každá fľaša obsahuje 25 ml kvapaliny. Veľkosti úvodných balení:
· 1 úvodné balenie, ktoré obsahuje 1 fľašu, 1 adaptér uzatvárateľného veka fľaše a sedem (7)
perorálnych striekačiek označených značkou CE s objemom 1 ml v škatuli
· 1 úvodné balenie, ktoré obsahuje 1 fľašu, 1 adaptér uzatvárateľného veka fľaše a sedem (7)
perorálnych striekačiek označených značkou CE s objemom 3 ml v škatuli
· 1 úvodné balenie, ktoré obsahuje 1 fľašu, 1 adaptér uzatvárateľného veka fľaše a sedem (7)
perorálnych striekačiek označených značkou CE s objemom 5 ml v škatuli a špecifický predpis.
Tieto veľkosti injekčných striekačiek zodpovedajú možnému rozsahu počiatočných dávok a množstvá vystačia na jeden týždeň liečby. Ak je potrebná viac ako jedna striekačka denne, budú poskytnuté ďalšie striekačky. Zvyšné striekačky treba odložiť na použitie s ďalšou fľašou. Každú fľašu treba po 3 dňoch znehodnotiť. Po začatí liečby možno ďalšie perorálne striekačky s označením CE, ktoré sú kompatibilné
s adaptérom uzatvárateľného veka fľaše, získať v lekárni.
Veľkosť štandardného balenia: 1 fľaša a 1 adaptér uzatvárateľného veka fľaše v škatuli.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Každý deň sa má používať jedna perorálna striekačka. Nevyplachujte adaptér uzatvárateľného veka fľaše ani perorálnu striekačku medzi jednotlivými dávkami počas dňa, pretože prítomnosť vody spôsobuje degradáciu glycerolfenylbutyrátu. Po podaní poslednej dávky v daný deň sa perorálna striekačka musí znehodnotiť. Ten istý adaptér uzatvárateľného veka fľaše sa môže používať, kým fľaša nebude prázdna. Po každom otvorení novej fľaše sa musí použiť nový adaptér uzatvárateľného veka.
Bola preukázaná chemická kompatibilita glycerolfenylbutyrátu s nazogastrickou, gastrostomickou a nozojejunálnou sondou zo silikónu medicínskej triedy. Štúdie in vitro hodnotiace percentuálne spracovanie celkovej dávky podanej pomocou nazogastrickej alebo gastrostomickej sondy preukázali, že percento spracovanej dávky bolo > 99 % pri dávkach > 1 ml a 70 % pri 0,5 ml dávke. Preto sa odporúča, aby sa nazogastrické, nazojejunálne alebo gastrostomické sondy používali iba na podanie dávok > 1 ml. Ak je potrebné podať dávku do 0,5 ml pomocou takejto nazogastrickej, nazojejunálnej alebo gastrostomickej sondy, je potrebné vziať na vedomie nízke spracovanie lieku v dávke.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Horizon Therapeutics Limited
90, Long Acre Covent Garden, London, WC2E 9RZ Spojené kráľovstvo tel.: +44 207 717 8482 fax: +44 207 717 8501
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/15/1062/001
EU/1/15/1062/002
EU/1/15/1062/003
EU/1/15/1062/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú uvedené na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu