
rípade, keď prínosy z hľadiska
prevencie ischemických príhod prevýšia riziká závažných krvácaní. Týka sa to predovšetkým
pacientov:
• vo veku ≥ 75 rokov (pozri nižšie).
• so sklonom ku krvácaniu (napr. z dôvodu nedávnej traumy, nedávneho chirurgického zákroku alebo nedávneho alebo opakujúceho sa gastrointestinálneho krvácania alebo aktívnej peptickej
vredovej choroby)
• s telesnou hmotnosťou < 60 kg (pozri časti 4.2 a 4.8). U týchto pacientov sa udržiavacia dávka
10 mg neodporúča. Má sa použiť udržiavacia dávka 5 mg.
• ktorí súčasne užívajú lieky, ktoré môžu zvýšiť riziko krvácania, vrátane perorálnych
antikoagulancií, klopidogrelu, nesteroidných protizápalových liekov (NSAID) a fibrinolytík.
Pre pacientov s aktívnym krvácaním, u ktorých je potrebné zrušenie farmakologického účinku
prasugrelu, môže byť vhodná transfúzia krvných doštičiek.
Používanie Prasugrelu Mylan u pacientov vo veku ≥ 75 rokov sa vo všeobecnosti neodporúča a má sa užívať len s opatrnosťou a po starostlivom individuálnom posúdení prínosu/rizika predpisujúcim lekárom, keď prínosy z hľadiska prevencie ischemických príhod prevýšia riziko závažných krvácaní. V klinickej štúdii fázy 3 bolo u týchto pacientov vyššie riziko krvácania, vrátane fatálneho krvácania, v porovnaní s pacientmi vo veku < 75 rokov. Ak sa tento liek takýmto pacientom predpisuje, má sa použiť nižšia udržiavacia dávka 5 mg; udržiavacia dávka 10 mg sa neodporúča (pozri časti 4.2 a 4.8).
U pacientov s poškodením funkcie obličiek (vrátane terminálneho štádia ochorenia obličiek – ESRD)
a u pacientov so stredne závažným poškodením funkcie pečene sú terapeutické skúsenosti
s prasugrelom obmedzené. U týchto pacientov môže byť zvýšené riziko krvácania. Prasugrel sa má
preto u týchto pacientov používať s opatrnosťou.
Pacientov treba informovať, že zastavenie krvácania pri užívaní prasugrelu (v kombinácii s ASA) môže trvať dlhšie ako zvyčajne a že majú hlásiť svojmu lekárovi akékoľvek (miestom alebo trvaním) nezvyčajné krvácanie.
Riziko krvácania spojené s načasovanímnasycovacejdávkyu NSTEMI
V klinickej štúdii s NSTEMI pacientmi (ACCOAST štúdia), ktorí mali naplánovanú koronárnu angiografiu v priebehu 2 – 48 hodín od randomizácie, ktorým bola podaná nasycovacia dávka prasugrelu v priemere 4 hodiny pred koronárnou angiografiou, sa zvýšilo riziko veľkého a malého krvácania počas operácie v porovnaní s pacientmi, ktorým sa nasycovacia dávka prasugrelu podala počas PCI. Preto u pacientov s UA/NSTEMI, ktorí podstúpia koronárnu angiografiu v priebehu
48 hodín od prijatia, sa má nasycovacia dávka podať počas PCI. (pozri časti 4.2, 4.8 a 5.1).
Chirurgický zákrok
Pacientov treba poučiť, aby informovali lekárov a zubných lekárov o užívaní prasugrelu pred
naplánovaním chirurgického zákroku a pred začatím užívania akéhokoľvek lieku. Ak má pacient podstúpiť elektívny chirurgický zákrok a protidoštičkový účinok nie je žiadaný, Prasugrel Mylan by sa
mal vysadiť minimálne 7 dní pred chirurgickým zákrokom. U pacientov podstupujúcich operáciu
CABG v priebehu 7 dní od vysadenia prasugrelu sa môže pozorovať zvýšená frekvencia (3násobne)
a závažnosť krvácania (pozri časť 4.8). U pacientov, u ktorých sa jednoznačne nedefinovala koronárna
anatómia a urgentná CABG je možnosťou voľby, majú sa starostlivo zvážiť prínosy a riziká prasugrelu.
Hypersenzitivita vrátane angioedému
Boli hlásené hypersenzitívne reakcie vrátane angioedému u pacientov užívajúcich prasugrel vrátane
pacientov s anamnézou hypersenzitivity na klopidogrel. U pacientov so známou alergiou na
tienopyridíny sa odporúča sledovanie výskytu príznakov hypersenzitivity (pozri časť 4.8).
Trombotická trombocytopenická purpura (TTP)
TTP bola hlásená pri používaní prasugrelu. TTP je závažné ochorenie a vyžaduje si okamžitú liečbu.
Morfium a iné opioidy
U pacientov, ktorí súbežne užívajú prasugrel a morfium, sa pozorovala znížená účinnosť prasugrelu
(pozri časť 4.5).
Prasugrel Mylan5 mg Mylan obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej tablete, t.j. v podstate zanedbateľné množstvo sodíka.
Prasugrel Mylan10 mg obsahuje hlinitý lak oranžovejžlteFCF (E110) a sodík
Hlinitý lak oranžovej žlte FCF je azofarbivo, ktoré môže spôsobiť alergické reakcie.
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej tablete, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Warfarín
Súbežné podávanie Prasugrelu Mylan s kumarínovými derivátmi, s výnimkou warfarínu, sa neskúmalo. Z dôvodu možného zvýšeného rizika krvácania sa majú warfarín (alebo iné kumarínové deriváty) a prasugrel súbežne podávať s opatrnosťou (pozri časť 4.4).
Nesteroidné protizápalové lieky (NSAID)
Súbežné podávanie s chronickými NSAID sa neskúmalo. Z dôvodu možného zvýšeného rizika krvácania sa majú chronické NSAID (vrátane COX•2 inhibítorov) a Prasugrel Mylan súbežne podávať s opatrnosťou (pozri časť 4.4).
Prasugrel Mylan sa môže súbežne podávať s liekmi, ktoré sú metabolizované enzýmami cytochrómu P450 (vrátane statínov) alebo s liekmi, ktoré indukujú alebo inhibujú enzýmy cytochrómu P450. Prasugrel Mylan sa môže tiež podávať súčasne s ASA, heparínom, digoxínom a liekmi, ktoré zvyšujú pH žalúdka, vrátane inhibítorov protónovej pumpy a H2 blokátorov. Hoci sa ich používanie neskúmalo v špecifických interakčných štúdiách, v klinickej štúdii fázy 3 sa prasugrel podával súčasne
s heparínom s nízkou molekulovou hmotnosťou, bivalirudínom a GP IIb/IIIa inhibítormi (nie sú
dostupné žiadne informácie týkajúce sa použitého typu GP IIb/IIIa inhibítora), pričom sa nedokázali žiadne klinicky významné nežiaduce interakcie.
Účinky iných liekovnaPrasugrelMylan
Kyselina acetylsalicylová
Prasugrel Mylan sa má podávať súčasne s kyselinou acetylsalicylovou (ASA). Hoci je možná
farmakodynamická interakcia s ASA, ktorá vedie k zvýšenému riziku krvácania, preukázanie účinnosti
a bezpečnosti prasugrelu pochádza od pacientov, ktorí boli súčasne liečení s ASA.
Heparín
Jednorazová intravenózna bolusová dávka nefrakcionovaného heparínu (100 U/kg) významne
neovplyvnila inhibíciu agregácie doštičiek sprostredkovanú prasugrelom. Rovnako ako prasugrel významne neovplyvnil účinok heparínu čo sa týka miery koagulácie. Preto sa obe liečivá môžu podávať súčasne. Pri súčasnom podávaní Prasugrelu Mylan s heparínom je možné zvýšené riziko krvácania.
Statíny
Atorvastatín (80 mg denne) neovplyvňoval farmakokinetiku prasugrelu a jeho inhibíciu agregácie
doštičiek. Preto sa nepredpokladá, že by mali statíny, ktoré sú substrátmi CYP3A, vplyv na farmakokinetiku prasugrelu alebo jeho inhibíciu agregácie doštičiek.
Lieky, ktoré zvyšujú pH v žalúdku
Denné súbežné podávanie ranitidínu (H2 blokátora) alebo lanzoprazolu (inhibítora protónovej pumpy) neovplyvnilo AUC a Tmax aktívneho metabolitu prasugrelu, ale znížilo Cmax o 14 % (ranitidín)a o 29 % (lanzoprazol). V klinickej štúdii fázy 3 bol prasugrel podávaný bez ohľadu na súbežné podávanie
inhibítora protónovej pumpy alebo H2 blokátora. Podanie nasycovacej dávky 60 mg prasugrelu bez
súčasného podania inhibítorov protónovej pumpy môže vyvolať oveľa rýchlejší nástup účinku.
Inhibítory CYP3A
Ketokonazol (400 mg denne), selektívny a silný inhibítor CYP3A4 a CYP3A5, neovplyvnil inhibíciu agregácie doštičiek sprostredkovanú prasugrelom ani AUC a Tmax aktívneho metabolitu prasugrelu, ale znížil jeho Cmax o 34 % až 46 %. Preto sa nepredpokladá, že by mali inhibítory CYP3A, ako sú
azolové antimykotiká, inhibítory HIV proteáz, klaritromycín, telitromycín, verapamil, diltiazem, indinavir, ciprofloxacín a grapefruitová šťava, významný vplyv na farmakokinetiku aktívneho
metabolitu.
Induktory cytochrómov P450
Rifampicín (600 mg denne), silný induktor CYP3A a CYP2B6, a induktor CYP2C9, CYP2C19
a CYP2C8 významne neovplyvňovali farmakokinetiku prasugrelu. Preto sa nepredpokladá, že by mali
známe induktory CYP3A, ako je rifampicín, karbamazepín a iné induktory cytochrómov P450, významný vplyv na farmakokinetiku aktívneho metabolitu.
Morfium a iné opioidy
U pacientov s akútnym koronárnym syndrómom liečených morfiom sa pozorovala oneskorená
a znížená expozícia perorálnym inhibítorom P2Y12, vrátane prasugrelu a jeho aktívneho metabolitu.
Táto interakcia môže súvisieť so zníženou gastrointestinálnou pohyblivosťou a vzťahovať sa aj na iné
opioidy. Klinický význam nie je známy, aleale údaje naznačujú potenciálne zníženú účinnosť prasugrelu u pacientov liečených súbežne morfiom a prasugrelom. U pacientov s akútnym koronárnym syndrómom, u ktorých liečba morfínom nemôže byť oddialená a rýchla inhibícia P2Y12 sa považuje
za rozhodujúcu, je potrebné zvážiť použitie parenterálneho inhibítora P2Y12.
Účinky Prasugrelu Mylan nainélieky
Digoxín
Prasugrel nemá klinicky významný vplyv na farmakokinetiku digoxínu.
Lieky metabolizované CYP2C9
Prasugrel neinhiboval CYP2C9, keďže neovplyvňoval farmakokinetiku Swarfarínu. Z dôvodu
možného zvýšeného rizika krvácania sa majú warfarín a Prasugrel Mylan súbežne podávať
s opatrnosťou (pozri časť 4.4).
Lieky metabolizované CYP2B6
Prasugrel je slabý inhibítor CYP2B6. U zdravých jedincov znižoval prasugrel o 23 % expozíciu
hydroxybupropiónu, metabolitu bupropiónu sprostredkovaného CYP2B6. Tento účinok je pravdepodobne klinicky významný len v prípade, keď by sa prasugrel podával súbežne s liekmi, pre ktoré je CYP2B6 jedinou metabolickou dráhou a ktoré majú úzke terapeutické okno (napr. cyklofosfamid, efavirenz).
4.6 Fertilita, gravidita a laktácia
U gravidných ani dojčiacich žien sa neuskutočnila žiadna klinická štúdia. Gravidita
Štúdie na zvieratách nepreukázali priame škodlivé účinky na graviditu, embryonálny/fetálny vývoj, pôrod alebo postnatálny vývoj (pozri časť 5.3). Vzhľadom na to, že reprodukčné štúdie na zvieratách nie vždy predpovedajú reakciu u ľudí, Prasugrel Mylan sa má podávať počas gravidity len vtedy, ak potenciálny prínos pre matku prevyšuje potenciálne riziko pre plod.
Dojčenie
Nie je známe, či sa prasugrel vylučuje do materského mlieka u ľudí. V štúdiách na zvieratách sa preukázalo vylučovanie prasugrelu do materského mlieka. Používanie prasugrelu počas dojčenia sa
neodporúča.
Fertilita
Prasugrel neovplyvňoval fertilitu potkaních samcov a samíc pri perorálnych dávkach až do expozície,
ktorá je 240-násobkom odporúčanej dennej udržiavacej dávky u ľudí (na základe mg/m²).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Prasugrel nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
U pacientov s akútnym koronárnym syndrómom podstupujúcich PCI bola hodnotená bezpečnosť
v jednej klopidogrelom kontrolovanej štúdii (TRITON), v ktorej bolo 6 741 pacientov liečených
prasugrelom (nasycovacia dávka 60 mg a udržiavacia dávka 10 mg jedenkrát denne) počas
14,5 mesiacov (medián) (5 802 pacientov bolo liečených po dobu dlhšiu ako 6 mesiacov, 4 136
pacientov bolo liečených po dobu dlhšiu ako 1 rok). Pomer vysadenia lieku v štúdii z dôvodu nežiaducich udalostí bol 7,2 % pre prasugrel a 6,3 % pre klopidogrel. Z toho najčastejšou nežiaducou reakciou u oboch liečiv bolo krvácanie, ktoré viedlo k vysadeniu lieku v štúdii (2,5 % pre prasugrel
a 1,4 % pre klopidogrel).
Krvácanie
Krvácanie, ktoré nesúvisí s koronárnym arteriálnym bypassom (CABG)
Frekvencia výskytu krvácavých príhod, ktoré nesúvisia s CABG, u pacientov v štúdii TRITON je uvedená v tabuľke 1. Výskyt rozsiahleho krvácania podľa TIMI, ktoré nesúvisí s CABG, vrátane život ohrozujúceho a fatálneho krvácania, rovnako ako mierneho krvácania podľa TIMI, bol štatisticky významne vyšší u jedincov liečených prasugrelom v porovnaní s klopidogrelom v populácii UA/NSTEMI a u všetkých populácií s ACS. V populácii STEMI sa nepozoroval žiadny významný rozdiel. Najčastejším miestom spontánneho krvácania bol gastrointestinálny trakt (1,7 % pre prasugrel a 1,3 % pre klopidogrel); najčastejším miestom vyvolaného krvácania bolo miesto prepichnutia artérie (1,3 % pre prasugrel a 1,2 % pre klopidogrel).
Tabuľka 1: Výskyt krvácania, ktoré nesúvisí s CABGa (% pacientov)
Všetky ACS UA/NSTEMI STEMI
U
dalosť
Rozsiahle
Prasugrelb + ASA(N = 6741)Klopidogrelb + ASA(N = 6716)Prasugrelb + ASA (N = 5001)Klopidogrelb + ASA(N = 4980)Prasugrelb + ASA(N = 1740)Klopidogrelb + ASA(N = 1736)
(N = 5001)Klopidogrelb + ASA(N = 4980)Prasugrelb + ASA(N = 1740)Klopidogrelb + ASA(N = 1736)
krvácanie
podľa TIMIc
Život
2,2 1,7 2,2 1,6 2,2 2,0
ohrozujúced 1,3 0,8 1,3 0,8 1,2 1,0
Fatálne 0,3 0,1 0,3 0,1 0,4 0,1
Symptomatické
ICHe 0,3 0,3 0,3 0,3 0,2 0,2
Vyžadujúce
inotropné látky 0,3 0,1 0,3 0,1 0,3 0,2
Vyžadujúce
chirurgický zákrok Vyžadujúce
transfúziu
(≥ 4 jednotky)
0,3 0,3 0,3 0,3 0,1 0,2
0,7 0,5 0,6 0,3 0,8 0,8
V
šetky ACS UA/NSTEMI STEMI
U
dalosť
Mierne
Prasugrelb + ASA(N = 6741)Klopidogrelb + ASA(N = 6716)Prasugrelb + ASA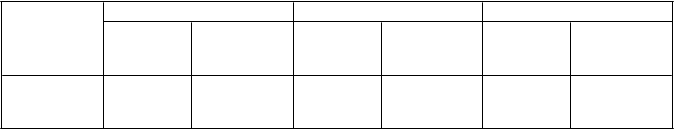 (N = 5001)Klopidogrelb + ASA(N = 4980)Prasugrelb + ASA(N = 1740)Klopidogrelb + ASA(N = 1736)
(N = 5001)Klopidogrelb + ASA(N = 4980)Prasugrelb + ASA(N = 1740)Klopidogrelb + ASA(N = 1736)
krvácanie
podľa TIMIf
2,4 1,9 2,3 1,6 2,7 2,6
a Centrálne posudzované udalosti definované kritériami Študijnej skupiny pre trombolýzu pri infarkte
m
yokardu (Thrombolysis in Myocardial Infarction, TIMI). b Ostatné štandardné liečby boli vhodne použité.
c Akákoľvek inkraniálna hemorágia alebo akékoľvek klinicky zjavné krvácanie súvisiace s poklesom
hemoglobínu ≥ 5 g/dl.
d Život ohrozujúce krvácanie je podskupinou rozsiahleho krvácania podľa TIMI a zahŕňa všetky typy uvedené nižšie v odsadenom texte. Pacienti môžu byť zahrnutí vo viacerých riadkoch.
e ICH = intrakraniálna hemorágia.
f Klinicky zjavné krvácanie súvisiace s poklesom hemoglobínu ≥ 3 g/dl ale < 5 g/dl.
Pacienti
v
o
veku
≥ 75 rokovVýskyt rozsiahleho alebo mierneho krvácania podľa TIMI, ktoré nesúvisí s CABG:
Vek prasugrel
10 mg klopidogrel 75 mg
≥ 75 rokov (N = 1 785)* 9,0 % (1,0 % fatálne) 6,9 % (0,1 % fatálne)
< 75 rokov (N = 11 672)* 3,8 % (0,2 % fatálne) 2,9 % (0,1 % fatálne)
< 75 rokov (N = 7180)** 2,0 % (0,1 % fatálne)a 1,3 % (0,1 % fatálne)

prasugrel
5 mg klopidogrel 75 mg
≥ 75 rokov (N = 2060)** 2,6 % (0,3 % fatálne) 3,0 % (0,5 % fatálne)
* štúdia TRITON u pacientov s ACS podstupujúcich PCI** štúdia TRILOGY-ACS u pacientov nepodstupujúcich PCI (pozri 5.1)a 10 mg prasugrelu; 5 mg prasugrelu ak je hmotnosť < 60 kgPacienti < 60 kgVýskyt rozsiahleho alebo mierneho krvácania podľa TIMI, ktoré nesúvisí s CABG:
Hmotnosť prasugrel
10 mg klopidogrel 75 mg
< 60 kg (N = 664)* 10,1 % (0 % fatálne) 6,5 % (0,3 % fatálne)
≥ 60 kg (N = 12 672)* 4,2 % (0,3 % fatálne) 3,3 % (0,1 % fatálne)
≥ 60 kg (N = 7845)** 2,2 % (0,2 % fatálne)a 1,6 % (0,2 % fatálne)

prasugrel
5 mg klopidogrel 75 mg
< 60 kg (N = 1391)** 1,4 % (0,1 % fatálne) 2,2 % (0,3 % fatálne)
* štúdia TRITON u pacientov s ACS podstupujúcich PCI** štúdia TRILOGY-ACS u pacientov nepodstupujúcich PCI (pozri 5.1)a 10 mg prasugrelu; 5 mg prasugrelu ak je vek ≥ 75 rokovPacienti s hmotnosťou≥60 kg a vekom < 75 rokovU pacientov ≥ 60 kg a vo veku < 75 rokov bol výskyt rozsiahleho alebo mierneho krvácania podľa
TIMI, ktoré nesúvisí s CABG, 3,6 % pre prasugrel a 2,8 % pre klopidogrel; výskyt fatálneho krvácanie bol 2,0 % pre prasugrel a 0,1 % pre klopidogrel.
Krvácanie v súvislosti s CABGV klinickej štúdii fázy 3 podstúpilo 437 pacientov CABG v priebehu štúdie. U týchto pacientov bol
výskyt rozsiahleho alebo mierneho krvácania podľa TIMI v súvislosti s CABG 14,1 % pre
prasugrelovú skupinu a 4,5 % v klopidogrelovej skupine. Vyššie riziko krvácavých príhod u osôb liečených prasugrelom pretrvávalo až 7 dní od poslednej dávky skúmaného liečiva. U pacientov, ktorí užili tienopyridín v priebehu 3 dní pred CABG, bola frekvencia rozsiahleho alebo mierneho krvácania podľa TIMI 26,7 % (12 zo 45 pacientov) v prasugrelovej skupine v porovnaní s 5,0 % (3 zo 60 pacientov) v klopidogrelovej skupine. U pacientov, ktorí užili poslednú dávku tienopyridínu
v priebehu 4 až 7 dní pred CABG, sa frekvencia znížila na 11,3 % (9 z 80 pacientov) v prasugrelovej skupine a 3,4 % (3 z 89 pacientov) v klopidogrelovej skupine. Po uplynutí 7 dní od vysadenia lieku
boli pozorované rovnaké frekvencie krvácania v súvislosti s CABG medzi liečebnými skupinami
(pozri časť 4.4).
Riziko krvácania spojené s načasovanímnasycovacej dávky u NSTEMI
V klinickej štúdii s NSTEMI pacientmi (ACCOAST štúdia), ktorí mali naplánovanú koronárnu angiografiu v priebehu 2 – 48 hodín od randomizácie, kde nasycovacia dávka 30 mg prasugrelu bola podaná v priemere 4 hodiny pred koronárnou angiografiou a následne 30 mg nasycovacia dávka počas PCI sa zvýšilo riziko non-CABG krvácania počas operácie a nepozoroval sa ani iný prínos v porovnaní s pacientmi, ktorým sa podala 60 mg nasycovacia dávka počas PCI (pozri časti 4.4 a 4.8). Pomer TIMI krvácaní nesúvisiacich s CABG počas 7 dní u pacientov bol nasledovný:
Nežiaduci účinok Prasugrel pred koronárnou angiografiou (N = 2 037) %
Prasugrel v čase PCIa
(N = 1 996) %
Rozsiahle krvácanie podľa TIMIb 1,3 0,5
Život ohrozujúcec 0,8 0,2
Fatálne 0,1 0,0
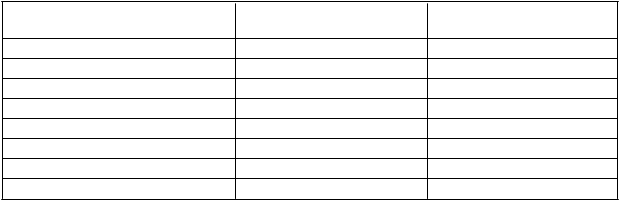
Symptomatické ICHd 0,0 0,0
Vyžadujúce inotropné látky 0,3 0,2
Vyžadujúce chirurgický zákrok 0,4 0,1
Vyžadujúce transfúziu (≥ 4 jednotky) 0,3 0,1
Mierne krvácanie podľa TIMIe 1,7 0,6
a Ostatné štandardné liečby boli vhodne použité. Podľa Protokolu klinického skúšania, všetcipacienti mali denne užívať aspirín a udržiavaciu dávku prasugrelu.b Akákoľvek inkraniálna hemorágia alebo akékoľvek klinicky zjavné krvácanie súvisiace s poklesomhemoglobínu ≥ 5 g/dl.c Život ohrozujúce krvácanie je podskupinou rozsiahleho krvácania podľa TIMIa zahŕňa všetky typyuvedené nižšie v odsadenom texte. Pacienti môžu byť zahrnutí vo viacerých riadkoch.d ICH = intrakraniálna hemorágia.e Klinicky zjavné krvácanie súvisiace s poklesom hemoglobínu ≥ 3 g/dl ale < 5 g/dl.TabuľkovýzoznamnežiaducichreakciíV tabuľke 2 sú zhrnuté hemoragické a nehemoragické nežiaduce reakcie zo štúdie TRITON alebo spontánne hlásené, zoradené podľa frekvencie a triedy orgánových systémov. Frekvencie sú
definované nasledovne:
Veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé
(≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (nemožno odhadnúť z dostupných údajov).
Tabuľka 2: Hemoragické a nehemoragické nežiaduce reakcieTrieda orgánovýchsystémov Časté Menej časté Zriedkavé Neznáme
Poruchy krvi
a lymfatického systému

anémia trombocytopénia
trombotická trombocytopenická purpura (TTP) –
pozri časť 4.4
T
rieda orgánových
systémov
Č
asté Menej časté Zriedkavé Neznáme
Poruchy imunitného systému
Hypersenzitivita vrátane angioedému
Poruchy oka krvácanie oka
Poruchy ciev hematóm
Poruchy dýchacej
sústavy, hrudníka a mediastína
epistaxa hemoptýza
retroperitoneálne krvácanie,
Poruchy
gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Poruchy obličiek
gastrointestinálne krvácanie
vyrážka
ekchymóza
rektálne
krvácanie, prítomnosť krvi v stolici,
krvácanie z ďasien
a močových ciest hematúria
C
elkové poruchy
a reakcie v mieste podania
Ú
razy, otravy a komplikácie liečebného postupu
hematóm v mieste vpichu,
krvácanie v mieste
vpichu
pomliaždenina post procedurálne krvácanie
podkožný
hematóm
U pacientov s TIA alebo mozgovou príhodou v anamnéze alebo i bez nich bol výskyt mozgovej
príhody v klinickej štúdii fázy 3 nasledovný (pozri časť 4.4):
TIA alebo mozgová príhoda
v anamnéze
prasugrel klopidogrel

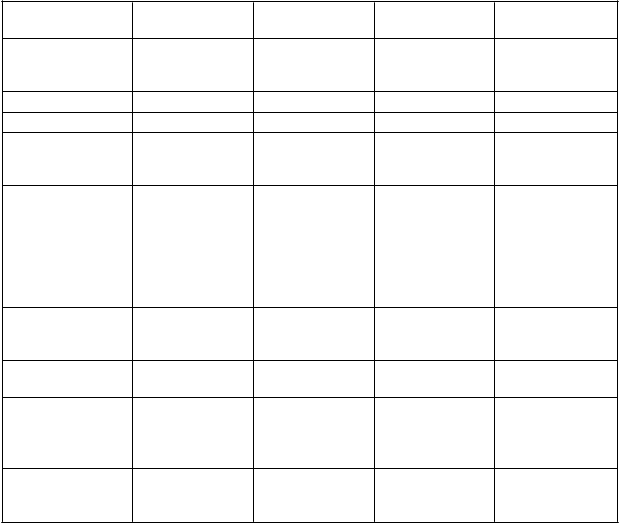
Áno (N = 518) 6,5 % (2,3 % ICH*) 1,2 % (0 % ICH*) Nie (N = 13 090) 0,9 % (0,2 % ICH*) 1,0 % (0,3 % ICH*)
* ICH = intrakraniálna hemorágia.Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePredávkovanie Prasugrelom Mylan môže viesť k predĺženiu času krvácania a následne ku komplikáciám súvisiacim s krvácaním. Nie sú k dispozícii žiadne údaje o zvrate farmakologického účinku prasugrelu; ak sa však vyžaduje rýchla úprava predĺženého času krvácania, je možné zvážiť transfúziu krvných doštičiek a/alebo iných krvných derivátov.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antitrombotiká, antigreganciá trombocytov okrem heparínu, ATC kód: B01AC22
Mechanizmus účinku/Farmakodynamickéúčinky
Prasugrel je inhibítor aktivácie a agregácie krvných doštičiek prostredníctvom ireverzibilnej väzby svojho aktívneho metabolitu na ADP receptory triedy P2Y12 na krvných doštičkách. Keďže sa krvné
doštičky podieľajú na iniciácii a/alebo vývoji trombotických komplikácií aterosklerotického ochorenia,
inhibícia funkcie krvných doštičiek môže viesť k zníženiu výskytu kardiovaskulárnych udalostí, akými
sú úmrtie, infarkt myokardu alebo mozgová príhoda.
Po nasycovacej dávke 60 mg prasugrelu sa inhibícia agregácie krvných doštičiek indukovaná ADP dosiahne po 15 minútach s 5 µmol/l ADP a po 30 minútach s 20 µmol/l ADP. Maximálna inhibícia ADP indukovanej agregácie krvných doštičiek prasugrelom je 83 % s 5 µmol/l ADP a 79 %
s 20 µmol/l ADP, v obidvoch prípadoch 89 % zdravých jedincov a pacientov so stabilnou aterosklerózou dosiahlo minimálne 50 % inhibíciu agregácie krvných doštičiek do 1 hodiny. Inhibícia
agregácie krvných doštičiek sprostredkovaná prasugrelom vykazuje nízku interindividuálnu (9 %)
a intraindividuálnu (12 %) variabilitu v prípade 5 µmol/ aj 20 µmol ADP. Priemerná inhibícia
agregácie krvných doštičiek v rovnovážnom stave bola 74 % (pre 5 µmol/l ADP) a 69 % (pre
20 µmol/l ADP) a dosiahla sa po 3 až 5 dňoch od podania udržiavacej dávky 10 mg prasugrelu, ktorej predchádzala nasycovacia dávka 60 mg. Viac ako 98 % jedincov malo ≥ 20 % inhibíciu agregácie
krvných doštičiek počas udržiavacieho dávkovania.
Agregácia krvných doštičiek sa po liečbe postupne vrátila na pôvodnú úroveň 7 až 9 dní po podaní jednorazovej nasycovacej dávky 60 mg prasugrelu a 5 dní po skončení podávania udržiavacej dávky v rovnovážnom stave.
Údaje o prestavení
Po podaní 75 mg klopidogrelu jedenkrát denne počas 10 dní bolo 40 zdravých jedincov prestavených na prasugrel 10 mg jedenkrát denne s nasycovacou dávkou 60 mg alebo bez nej. Pri prasugrele sa pozorovala rovnaká alebo väčšia inhibícia agregácie krvných doštičiek. Prestavenie priamo na nasycovaciu dávku 60 mg prasugrelu vyvolalo najrýchlejší nástup väčšej inhibície krvných doštičiek. Po podaní nasycovacej dávky 900 mg klopidogrelu (s ASA) bolo 56 jedincov s ACS liečených počas
14 dní buď s prasugrelom 10 mg jedenkrát denne alebo klopidogrelom 150 mg jedenkrát denne
a potom prestavených buď na klopidogrel 150 mg alebo prasugrel 10 mg počas ďalších 14 dní. Väčšia inhibícia agregácie krvných doštičiek sa pozorovala u pacientov prestavených na prasugrel 10 mg
v porovnaní s pacientmi, ktorí boli liečení klopidogrelom 150 mg. V štúdii s 276 ACS pacientmi
podstupujúcimi PCI viedlo prestavenie z pôvodnej nasycovacej 600 mg dávky klopidogrelu alebo
placeba, podaných pri začatí hospitalizácie pred koronárnou angiografiou, na nasycovaciu 60 mg
dávku prasugrelu v čase perkutánnej koronárnej intervencie k podobnému zvýšeniu inhibície agregácie doštičiek počas 72 hodín trvania štúdie.
Klinická účinnosťabezpečnosť
Akútny koronárny syndróm (ACS)
TRITON štúdia fázy 3 porovnávala prasugrel s klopidogrelom, obe liečivá boli podávané súbežne s ASA a inou štandardnou liečbou. TRITON bola multicentrická, medzinárodná, randomizovaná, dvojito zaslepená štúdia s paralelnými skupinami a s 13 608 pacientmi. Pacienti mali ACS so stredným až vysokým rizikom UA, NSTEMI alebo STEMI a boli liečení PCI.
Pacienti s UA/NSTEMI v priebehu 72 hodín od objavenia príznakov alebo pacienti so STEMI
12 hodín až 14 dní od objavenia príznakov boli randomizovaní po vyšetrení koronárnej anatómie.
Pacienti so STEMI v priebehu 12 hodín od objavenia príznakov, u ktorých bola plánovaná primárna
PCI mohli byť randomizovaní bez znalosti koronárnej anatómie. U všetkých pacientov sa mohla
nasycovacia dávka podať kedykoľvek medzi randomizáciou a 1 hodinu po tom, čo pacient opustil katetrizačné laboratórium.
Pacienti randomizovaní na podávanie prasugrelu (nasycovacia dávka 60 mg, po ktorej nasleduje 10 mg jedenkrát denne) alebo klopidogrelu (nasycovacia dávka 300 mg, po ktorej nasleduje 75 mg jedenkrát denne) boli liečení počas 14,5 mesiacov (medián) (maximálne 15 mesiacov s minimálne 6mesačným sledovaním). Pacienti užívali tiež ASA (75 mg až 325 mg jedenkrát denne). Kritérium pre vylúčenie bolo používanie tienopyridínu v priebehu 5 dní pred náborom do štúdie. Podľa uváženia lekára boli podávané iné liečby, ako je heparín a inhibítory GP IIb/IIIa. Približne 40 % pacientov (v každej liečebnej skupine) užívalo inhibítory GP IIb/IIIa na podporu PCI (nie sú k dispozícii žiadne informácie o použitom type inhibítora GP IIb/IIIa). Približne 98 % pacientov (v každej liečebnej skupine) užívalo antitrombíny (heparín, heparín s nízkou molekulovou hmotnosťou, bivalirudín alebo inú látku) priamo na podporu PCI.
Primárnym cieľovým ukazovateľom v štúdii bol čas do prvého výskytu kardiovaskulárneho (KV) úmrtia, nefatálneho infarktu myokardu (IM) alebo nefatálnej mozgovej príhody. Analýza kombinovaného ukazovateľa v populácii so všetkými ACS (kombinované UA/NSTEMI a STEMI skupiny) bola závislá na preukazovaní štatistickej superiority prasugrelu oproti klopidogrelu v skupine UA/NSTEMI (p < 0,05).
Populácia so všetkými ACS
Prasugrel preukázal vyššiu účinnosť v porovnaní s klopidogrelom v znižovaní primárnych kombinovaných cieľových udalostí, rovnako ako vopred špecifikovaných sekundárnych cieľových udalostí, vrátane trombózy stentu (pozri tabuľku 3). Prínos prasugrelu bol zjavný v priebehu prvých
3 dní a pretrvával do konca štúdie. Vyššia účinnosť bola sprevádzaná zvýšením rozsiahleho krvácania
(pozri časti 4.4 a 4.8). Populácia pacientov bola 92 % belochov, 26 % žien a 39 % vo veku ≥ 65 rokov. Prínosy v súvislosti s prasugrelom boli nezávislé od používania iných akútnych a dlhodobých
kardiovaskulárnych terapií, vrátane heparínu/heparínu s nízkou molekulovou hmotnosťou,
bivalirudínu, intravenóznych inhibítorov GP IIb/IIIa, liekov znižujúcich lipidy, beta-blokátorov
a inhibítorov angiotenzín konvertujúceho enzýmu. Účinnosť prasugrelu bola nezávislá od dávky ASA
(75 mg až 325 mg jedenkrát denne). V TRITON štúdii nebolo povolené používanie perorálnych antikoagulancií, iných protidoštičkových liekov a chronických NSAID. V populácii so všetkými ACS
bol prasugrel spájaný so zníženým výskytom KV úmrtia, nefatálneho IM alebo nefatálnej mozgovej
príhody v porovnaní s klopidogrelom, bez ohľadu na východiskové charakteristiky, ako je vek, pohlavie, telesná hmotnosť, geografická oblasť, používanie inhibítorov GP IIb/IIIa a typu stentu. Prínos primárne spočíval vo významnom znížení nefatálneho IM (pozri tabuľku 3). Osoby s diabetom mali významné zníženia primárnych a všetkých sekundárnych kombinovaných ukazovateľov.
Pozorovaný prínos prasugrelu u pacientov vo veku ≥ 75 rokov bol menší ako prínos pozorovaný u pacientov vo veku < 75 rokov. U pacientov vo veku ≥ 75 rokov bolo zvýšené riziko krvácania, vrátane fatálneho (pozri časti 4.2, 4.4 a 4.8). Zjavnejšie priaznivé pôsobenie prasugrelu u pacientov vo veku ≥ 75 rokov bolo pozorované u skupiny pacientov s diabetom, STEMI, zvýšeným rizikom trombózy stentu alebo opakujúcimi sa príhodami.
U pacientov s anamnézou TIA alebo s anamnézou ischemickej mozgovej príhody viac ako 3 mesiace
pred liečbou prasugrelom nedošlo k zníženiu primárneho kombinovaného ukazovateľa.
T
abuľka 3: Pacienti s cieľovými udalosťami v primárnej analýze TRITON
C
i
eľové udalosti prasugrel + ASA klopidogrel + ASA
P
o
m
er rizika
(H
R
) (95 % CI)
p•hodnota
V
šetky ACS (N = 6 813) % (N = 6 795) % Primárne
kombinované
cieľové udalosti
0,812 (0,732;
Kardiovaskulárne (KV) úmrtie, nefatálny IM alebo
nefatálna mozgová príhoda
9,4 11,5
0,902) < 0,001
P
r
i
m
árne individuálne cieľové udalosti
KV úmrtie 2,0 2,2 0,886 (0,701;
1,118)
Nefatálny IM 7,0 9,1 0,757 (0,672;
0,853)
0,307
< 0,001
Nefatálna mozgová
príhoda 0,9 0,9
Primárne kombinované1,016 (0,712;
1,451) 0,930
cieľové udalosti
UA
/
N
STEMI KV úmrtie, nefatálny IM alebo
nefatálna mozgová
príhoda
(N = 5 044) % (N = 5 030) %
9,3 11,2 0,820 (0,726;
0,927)
KV úmrtie 1,8 1,8 0,979 (0,732;
1,309)
Nefatálny IM 7,1 9,2 0,761 (0,663;
0,873)
0,885
< 0,001
Nefatálna mozgová
príhoda 0,8 0,8'
Primárne
0,979 (0,633;
1,513) 0,922
kombinované cieľové udalosti STEMI
KV úmrtie, nefatálny IM alebo nefatálna mozgová príhoda
(N = 1 769) % (N = 1 765) %
9,8 12,2
0,793 (0,649;
0,968) 0,019
KV úmrtie 2,4 3,3 0,738 (0,497;
1,094)
Nefatálny IM 6,7 8,8 0,746 (0,588;
0,948)
0,129
0,016
Nefatálna mozgová
príhoda 1,2 1,1
1,097 (0,590;
2,040) 0,770
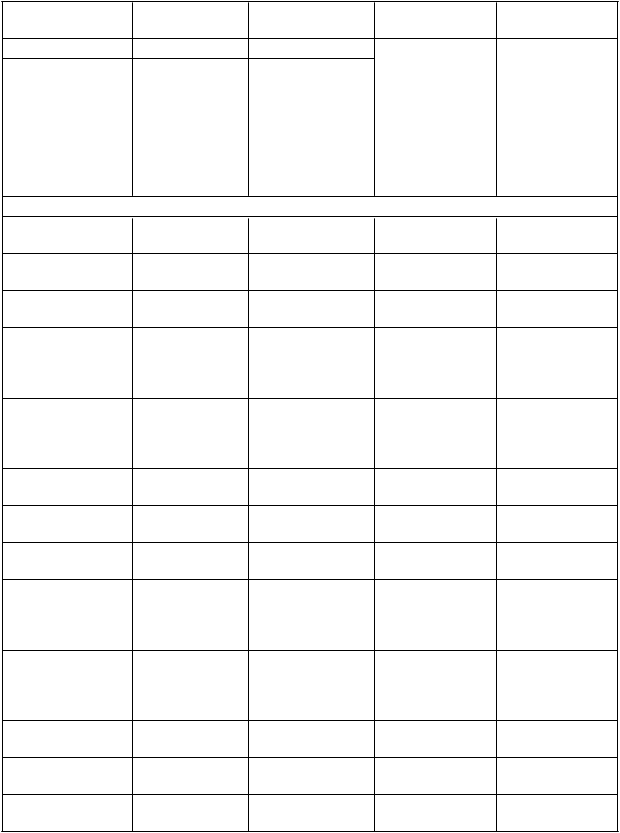
V populácii so všetkými ACS analýza každého sekundárneho cieľového ukazovateľa preukázala
významný prínos (p < 0,001) pre prasugrel oproti klopidogrelu. Tieto ukazovatele zahŕňali jednoznačnú alebo pravdepodobnú trombózu stentu na konci štúdie (0,9 % oproti 1,8 %; HR 0,498; CI
0,364, 0,683); KV úmrtie, nefatálny IM alebo bezodkladnú revaskularizáciu cieľovej cievy v priebehu
30 dní (5,9 % oproti 7,4 %; HR 0,784; CI 0,688; 0,894); úmrtie z akejkoľvek príčiny, nefatálny IM
alebo nefatálnu mozgovú príhodu do konca štúdie (10,2 % oproti 12,1 %; HR 0,831; CI 0,751; 0,919); KV úmrtie, nefatálny IM, nefatálnu mozgovú príhodu alebo opakovanú hospitalizáciu z dôvodu srdcovej ischemickej udalosti do konca štúdie (11,7 % oproti 13,8 %; HR 0,838; CI 0,762; 0,921). Analýza všetkých príčin úmrtí neukázala signifikantné rozdiely medzi prasugrelom a klopidogrelom
v populácii so všetkými ACS (2,76 % oproti 2,9 %), v populácii UA/NSTEMI (2,58 % oproti 2,41 %)
ani v populácii STEMI (3,28 % oproti 4,31 %).
Prasugrel sa spájal s 50 % znížením trombózy stentu v priebehu 15mesačného sledovaného obdobia. Zníženie trombózy stentu pri prasugrele sa pozorovalo na začiatku i po 30 dňoch pri obidvoch typoch stentov, pri neobaľovaných kovových stentoch aj pri stentoch uvoľňujúcich liečivo.
V analýze pacientov, ktorí prežili ischemickú príhodu, sa prasugrel spájal so znížením výskytu následných primárnych cieľových príhod (7,8 % pre prasugrel oproti 11,9 % pre klopidogrel). Hoci sa pri prasugrele výskyt krvácania zvýšil, analýza kombinovaného cieľového ukazovateľa úmrtia
z akejkoľvek príčiny, nefatálneho infarktu myokardu, nefatálnej mozgovej príhody a rozsiahleho
krvácania podľa TIMI, ktoré nesúvisí s CABG, uprednostňovala prasugrel v porovnaní
s klopidogrelom (HR 0,87; 95 % CI, 0,79 až 0,95; p = 0,004). V TRITON štúdii na každých 1 000
pacientov liečených prasugrelom bolo o 22 menej pacientov s infarktom myokardu a o 5 viac
s rozsiahlym krvácaním podľa TIMI, ktoré nesúviselo s CABG, v porovnaní s pacientmi liečenými
klopidogrelom.
Výsledky farmakodynamicko-farmakogenomickej štúdie so 720 ázijskými pacientmi s ACS PCI
preukázali, že vyššie hladiny doštičkovej inhibície sa dosiahli s prasugrelom v porovnaní
s klopidogrelom a že 60 mg nasycovacia dávka a následná 10 mg udržiavacia dávka je vhodnou dávkovacou schémou u Ázijčanov, ktorých telesná hmotnosť je aspoň 60 kg a sú mladší ako 75 rokov (pozri časť 4.2).
V 30mesačnej štúdii (TRILOGY–ACS) s 9326 pacientmi s UA/NSTEMI ACS liečenými konzervatívne bez revaskularizácie (neschválená indikácia), prasugrel v porovnaní s klopidogrelom významne neznižoval frekvenciu kombinovaného cieľového ukazovateľa kardiovaskulárneho úmrtia, infarktu myokardu alebo mozgovej mŕtvice. Výskyt rozsiahleho krvácania TIMI (vrátane život ohrozujúceho, fatálneho a intrakraniálneho) bol podobný u pacientov liečených prasugrelom aj klopidogrelom. Pacienti vo veku ≥ 75 rokov alebo pacienti s telesnou hmotnosťou nižšou ako 60 kg (N = 3022) boli randomizovaní na liečbu 5 mg prasugrelu. Rovnako ako u pacientov vo veku
< 75 rokov alebo pacientov s telesnou hmotnosťou ≥ 60 kg liečených 10 mg prasugrelu nebol rozdiel v kardiovaskulárnych parametroch medzi 5 mg prasugrelu a 75 mg klopidogrelu. Výskyt rozsiahleho
krvácania bol podobný u pacientov liečených 5 mg prasugrelu a pacientov liečených 75 mg klopidogrelu. 5 mg prasugrelu vykazovalo vyšší protidoštičkový účinok oproti 75 mg klopidogrelu.
U pacientov vo veku ≥ 75 rokov a pacientov s telesnou hmotnosťou < 60 kg sa má prasugrel používať so zvýšenou opatrnosťou (pozri časti 4.2, 4.4 a 4.8).
V 30dennej štúdii (ACCOAST) so 4033 NSTEMI pacientmi so zvýšeným troponínom, ktorí mali naplánovanú koronárnu angiografiu a následne PCI od 2 do 48 hodín po randomizácii, pacienti, ktorí dostali 30 mg nasycovaciu dávku prasugrelu v priemere 4 hodiny pred koronárnou angiografiou
a následne 30 mg nasycovaciu dávku počas PCI (n = 2037) mali zvýšené riziko periprocedurálneho
krvácania nesúvisiaceho s CABG v porovnaní s pacientmi, ktorí dostali 60 mg nasycovaciu dávku počas PCI (n = 1996). Konkrétne prasugrel významne neznižoval frekvenciu kombinovaného koncového ukazovateľa kardiovaskulárneho (CV) úmrtia, infarktu myokardu (MI), mozgovej mŕtvice, urgentnej revaskularizácie (UR) alebo užívania inhibítorov glykoproteínu (GP) IIb/IIIa ako záchrannej liečby do 7 dní od randomizácie u subjektov užívajúcich prasugrel pred koronárnou angiografiou
v porovnaní s pacientmi užívajúcimi celú nasycovaciu dávku počas PCI, miera výskytu kľúčového parametra bezpečnosti pre všetky druhy významného krvácania pri TIMI (prípady CABG a non- CABG) počas 7 dní od randomizácie u všetkých liečených pacientov bola podstatne vyššia u tých pacientov, ktorým bol prasugrel podávaný pred koronárnou angiografiou, v porovnaní s pacientmi, ktorí dostali úplnú nasycovaciu dávku prasugrelu počas PCI. Preto u pacientov s UA/NSTEMI, ktorí podstúpia koronárnu angiografiu v priebehu 48 hodín od prijatia, sa má nasycovacia dávka podať počas PCI. (Pozri časti 4.2, 4.4 a 4.8)
Pediatrická populácia
V štúdii TADO sa skúšalo používanie prasugrelu (n = 171) oproti placebu (n = 170) u skupiny pacientov vo veku od 2 do menej ako 18 rokov s kosáčikovitou anémiou na znižovanie vazookluzívnej
krízy v štúdii fázy III. Štúdia nesplnila ani jeden z primárnych či sekundárnych koncových bodov.
V tejto skupine pacientov sa celkovo nezískali žiadne nové bezpečnostné závery v liečbe prasugrelom
ako monoterapiou.
5.2 Farmakokinetické vlastnosti
Prasugrel je proliečivo a rýchlo sa metabolizuje in vivo na aktívny metabolit a inaktívne metabolity.
Expozícia (AUC) aktívneho metabolitu vykazuje strednú až nízku interindividuálnu (27 %)
a intraindividuálnu (19 %) variabilitu. Farmakokinetika prasugrelu je podobná u zdravých jedincov, u pacientov so stabilnou aterosklerózou a u pacientov podstupujúcich perkutánnu koronárnu
intervenciu.
Absorpcia
Absorpcia a metabolizmus prasugrelu sú rýchle, pričom maximálna plazmatická koncentrácia (Cmax)
aktívneho metabolitu sa dosahuje približne o 30 minút. Expozícia (AUC) aktívneho metabolitu sa
zvyšuje úmerne s dávkou v terapeutickom rozmedzí. V štúdii so zdravými dobrovoľníkmi jedlo
s vysokým obsahom tuku a kalórií neovplyvňovalo AUC aktívneho metabolitu, ale Cmax bolo znížené o 49 % a čas do dosiahnutia Cmax (Tmax) bol predĺžený z 0,5 na 1,5 hodiny. V štúdii TRITON sa prasugrel podával bez ohľadu na jedlo. Preto sa prasugrel môže podávať bez ohľadu na jedlo;
podávanie nasycovacej dávky prasugrelu nalačno však môže vyvolať oveľa rýchlejší nástup účinku
(pozri časť 4.2).
Distribúcia
Väzba aktívneho metabolitu na sérový albumín (4 % tlmivý roztok) u ľudí bola 98 %.
Biotransformácia
Prasugrel sa nezistil v plazme po perorálnom podaní. Rýchlo sa hydrolyzuje v čreve na tiolaktón, ktorý
je následne konvertovaný na aktívny metabolit jednoduchým krokom metabolizmu cytochrómu P450, predovšetkým CYP3A4 a CYP2B6 a v menšej miere CYP2C9 a CYP2C19. Aktívny metabolit sa ďalej metabolizuje na dve inaktívne látky Smetyláciou alebo konjugáciou s cysteínom.
U zdravých jedincov, u pacientov so stabilnou aterosklerózou a u pacientov s ACS užívajúcich prasugrel sa nezistil žiadny významný vplyv genetickej zmeny CYP3A5, CYP2B6, CYP2C9 alebo CYP2C19 na farmakokinetiku prasugrelu ani na jeho inhibíciu agregácie krvných doštičiek.
Eliminácia
Približne 68 % dávky prasugrelu sa vylučuje močom a 27 % stolicou vo forme neaktívnych
metabolitov. Aktívny metabolit má polčas eliminácie asi 7,4 hodín (rozmedzie 2 až 15 hodín).
Farmakokinetika u vybraných populácií
Starší pacienti
V štúdii so zdravými jedincami vo vekovom rozmedzí 20 až 80 rokov nemal vek žiadny významný vplyv na farmakokinetiku prasugrelu ani na jeho inhibíciu agregácie doštičiek. V rozsiahlej klinickej
štúdii fázy 3 bola priemerná odhadovaná expozícia (AUC) aktívneho metabolitu o 19 % vyššia
u veľmi starých pacientov (vo veku ≥ 75 rokov) v porovnaní s jedincami vo veku < 75 rokov.
Prasugrel sa má používať s opatrnosťou u pacientov vo veku ≥ 75 rokov vzhľadom na možné riziko krvácania u tejto populácie pacientov (pozri časti 4.2 a 4.4). V štúdii s jedincami so stabilizovanou aterosklerózou bola stredná hodnota AUC aktívneho metabolitu u pacientov vo veku ≥ 75 rokov užívajících 5 mg prasugrelu približne polovičná oproti pacientom vo veku < 65 rokov užívajúcich
10 mg prasugrelu a protidoštičkový účinok 5 mg sa znížil, avšak neinferiórny v porovnaní s 10 mg dávkou.
Porucha funkcie pečene
U pacientov s miernou až stredne závažnou poruchou funkcie pečene (Childova-Pughova trieda A a B) nie je potrebná žiadna úprava dávky. Farmakokinetika prasugrelu a jeho inhibícia agregácie doštičiek bola podobná u jedincov s miernou až stredne závažnou poruchou funkcie pečene ako u zdravých jedincov. Farmakokinetika a farmakodynamika prasugrelu sa neskúmala u pacientov so závažnou poruchou funkcie pečene. Prasugrel sa nesmie používať u pacientov so závažnou poruchou funkcie pečene (pozri časť 4.3).
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek, vrátane pacientov s terminálnym štádiom ochorenia obličiek (ESRD), nie je potrebná žiadna úprava dávky. Farmakokinetika prasugrelu a jeho inhibícia agregácie doštičiek je podobná u pacientov so stredne závažnou poruchou funkcie obličiek (GFR
30 < 50 ml/min/1,73 m²) ako u zdravých jedincov. Inhibícia agregácie krvných doštičiek
sprostredkovaná prasugrelom bola podobná u zdravých jedincov aj u pacientov s ESRD, ktorí
vyžadovali hemodialýzu, hoci Cmax aktívneho metabolitu sa znížilo o 51 % a AUC o 42 % u pacientov s ESRD.
Telesná hmotnosť
Priemerná expozícia (AUC) aktívneho metabolitu prasugrelu je približne o 30 až 40 % vyššia
u zdravých jedincov a u pacientov s telesnou hmotnosťou < 60 kg v porovnaní s pacientmi s telesnou
hmotnosťou ≥ 60 kg. Prasugrel sa má používať s opatrnosťou u pacientov s telesnou hmotnosťou
< 60 kg vzhľadom na možné riziko krvácania u tejto populácie pacientov (pozri časť 4.4). V štúdii
s jedincami so stabilizovanou aterosklerózou bola stredná hodnota AUC aktívneho metabolitu
u pacientov s telesnou hmotnosťou < 60 kg užívajících 5 mg prasugrelu o 38 % nižšia ako u pacientov s telesnou hmotnosťou ≥ 60 kg užívajúcich 10 mg prasugrelu a protidoštičkový účinok bol podobný
u 5 mg aj 10 mg dávky.
Etnická príslušnosť
V klinických farmakologických štúdiách po úprave podľa telesnej hmotnosti bolo AUC aktívneho metabolitu približne o 19 % vyššie u Číňanov, Japoncov a Kórejčanov v porovnaní s AUC u belochov, týka sa to predovšetkým vyššej expozície u Ázijčanov < 60 kg. Neexistuje žiadny rozdiel v expozícii medzi Číňanmi, Japoncami a Kórejčanmi. Expozícia jedincov afrického alebo hispánskeho pôvodu je porovnateľná s expozíciou u belochov. Na základe samotnej etnickej príslušnosti sa neodporúča žiadna úprava dávky.
Pohlavie
U zdravých jedincov a u pacientov je farmakokinetika prasugrelu podobná u mužov i žien.
Pediatrická populácia:
Farmakokinetika a farmakodynamika prasugrelu sa nehodnotila u pediatrickej populácie (pozri
časť 4.2).
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu alebo reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí. Účinky v predklinických štúdiách sa pozorovali iba pri expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie.
Toxikologické štúdie embryofetálneho vývoja u potkanov a králikov nepreukázali žiadny dôkaz
o malformáciách spôsobených prasugrelom. Pri veľmi vysokej dávke (> 240-násobok odporúčanej dennej udržiavacej dávky u ľudí na mg/m²), ktorá vyvoláva účinky na telesnú hmotnosť v tehotenstve
a/alebo konzumáciu jedla, sa pozorovalo malé zníženie telesnej hmotnosti potomstva (v porovnaní
s kontrolami). V prenatálnych a postnatálnych štúdiách u potkanov nemala liečba v tehotenstve žiadny
vplyv na správanie a reprodukčný vývoj potomstva pri dávkach až do expozície, ktorá je
V dvojročnej štúdii s potkanmi sa nepozorovali žiadne tumory súvisiace s týmto liečivom pri expozíciách prasugrelu vyšších ako je 75násobok odporúčaných terapeutických expozícií u ľudí (na základe plazmatických expozícií aktívnych a hlavných cirkulujúcich metabolitov u ľudí). Výskyt tumorov bol zvýšený (hepatocelulárne adenómy) u myší vystavených vysokým dávkam (> 75•násobku expozície u ľudí) po dobu 2 rokov, avšak považovalo sa to za sekundárny účinok indukcie enzýmov navodený prasugrelom. V literatúre je dobre zdokumentovaná súvislosť tumorov pečene a indukcie enzýmov navodenej liečivom, ktorá je špecifická pre hlodavce. Zvýšenie výskytu tumorov pečene pri podávaní prasugrelu u myší sa nepovažuje za významnú hrozbu pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety mikrokryštalická celulóza, manitol,
krospovidón,
koloidný bezvodý oxid kremičitý, stearan horečnatý.
Filmový obal polyvinylalkohol, mastenec,
oxid titaničitý (E171),
glycerolmonokaprylokaprát, laurylsíran sodný,
žltý oxid železitý (E172),
hlinitý lak oranžovej žlte FCF (E110),[iba Prasugrel Mylan 10 mg]
červený oxid železitý (E172), [iba Prasugrel 10 mg]
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov.
6.4 Špeciálne upozornenia na uchovávanie
Prasugrel Mylan 5 mg:
Uchovávajte pri teplote do 30 °C. Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Prasugrel Mylan 10 mg:
HDPE fľaša: Uchovávajte pri teplote do 25 °C. Uchovávajte v pôvodnom obale na ochranu pred
vlhkosťou.
Blistrové balenie:
Uchovávajte pri teplote do 30 °C. Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Prasugrel Mylan 5 mg:
Biela nepriehľadná HDPE fľaša s bielym nepriehľadným polypropylénovým uzáverom s hliníkovou
indukčnou tesniacou vložkou. Jedna fľaša obsahuje vysúšadlo s označením DO NOT EAT (NEJESŤ)
a 28 alebo 30 filmom obalených tabliet.
Jedna škatuľa obsahuje 1 fľašu.
OPA/Hliník/PE/Vysúšadlo/PE - hliníkové blistre obsahujúce 28, 30, 84 alebo 98 filmom obalených tabliet.
Prasugrel Mylan 10 mg:
Biela nepriehľadná HDPE fľaša s bielym nepriehľadným polypropylénovým uzáverom s hliníkovou
indukčnou tesniacou vložkou. Jedna fľaša obsahuje vysúšadlo s označením DO NOT EAT (NEJESŤ)
a 28 alebo 30 filmom obalených tabliet.
Jedna škatuľa obsahuje 1 fľašu.
OPA/Hliník/PE/Vysúšadlo/PE - hliníkové blistre obsahujúce 28, 30, 84 alebo 98 filmom obalených tabliet.
OPA/Hliník/PE/Vysúšadlo/PE - hliníkové blistre s perforáciou umožňujúcou oddelenie jednotlivej
dávky obsahujúce 30 x 1 alebo 90 x 1 filmom obalená tableta.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Mylan S.A.S.
117 Allee des Parcs
69 800 Saint Priest
Francúzsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
Prasugrel Mylan 5 mg:
EU/1/18/1273/001
EU/1/18/1273/003
EU/1/18/1273/005
EU/1/18/1273/006
EU/1/18/1273/007
EU/1/18/1273/008
Prasugrel Mylan 10 mg:
EU/1/18/1273/002
EU/1/18/1273/004
EU/1/18/1273/009
EU/1/18/1273/010
EU/1/18/1273/011
EU/1/18/1273/012
EU/1/18/1273/013
EU/1/18/1273/014
EU/1/18/1273/015
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 16. mája 2018
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskejagentúry pre lieky
http://www.ema.europa.eu.