
lektívnych inhibítorov cyklooxygenázy-2 (COX-2) a dávok kyseliny acetylsalicylovej nad 75 mg denne (pozri časť
4.5).
- Posledný trimester tehotenstva (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
Paracetamol
Riziko predávkovania paracetamolom je vyššie u pacientov s ochorením pečene spôsobeným alkoholom, bez príznakov cirhózy. Pacienti majú byť upozornení, aby súbežne neužívali žiadne iné
lieky obsahujúce paracetamol (pozri časti 4.3 a 4.5). V prípade predávkovania je potrebné vyhľadať okamžitú lekársku pomoc, aj keď sa pacient cíti dobre, kvôli riziku oneskoreného závažného poškodenia pečene (pozri časť 4.9).
Opatrnosť sa odporúča, ak sa paracetamol podáva súbežne s flukloxacilínom kvôli zvýšenému riziku metabolickej acidózy s vysokou aniónovou medzerou (HAGMA, high anion gap metabolic acidosis), najmä u pacientov so závažnou poruchou funkcie obličiek, sepsou, podvýživou a inými zdrojmi nedostatku glutatiónu (napr. chronický alkoholizmus), ako aj u pacientov ktorí užívajú maximálne denné dávky paracetamolu. Odporúča sa starostlivé sledovanie vrátane merania 5-oxoprolínu v moči.
Nežiaduce účinky možno minimalizovať použitím najnižšej účinnej dávky počas najkratšieho obdobia potrebného na kontrolu symptómov (pozri časť 4.2 a gastrointestinálne a kardiovaskulárne účinky nižšie) a užívaním dávky lieku s jedlom (pozri časť 4.2).
Starší pacienti
Starší pacienti majú zvýšenú frekvenciu nežiaducich reakcií na NSAID, najmä gastrointestinálne krvácanie a perforáciu, ktoré môžu byť smrteľné (pozri časť 4.2).
Opatrnosť je potrebná u pacientov s nasledujúcimi stavmi: Poruchy dýchacej sústavy
U pacientov s bronchiálnou astmou alebo alergickým ochorením, alebo s anamnézou bronchiálnej
astmy alebo alergického ochorenia bolo hlásené, že NSAID vyvolávajú bronchospazmus.
SLE a zmiešané ochorenie spojivového tkaniva
U pacientov so systémovým lupus erythematosus (SLE) a zmiešaným ochorením spojivového tkaniva
môže byť zvýšené riziko aseptickej meningitídy (pozri časť 4.8).
Kardiovaskulárne a cerebrovaskulárne účinky
U pacientov s anamnézou hypertenzie a/alebo miernym až stredne závažným kongestívnym zlyhávaním srdca sa vyžaduje primerané monitorovanie a lekárska pomoc, pretože v súvislosti s liečbou NSAID bolo hlásené zadržiavanie tekutín a opuchy.
Klinické štúdie naznačujú, že použitie ibuprofénu, najmä vo vysokej dávke (2 400 mg/deň), môže byť spojené s miernym zvýšením rizika arteriálnych tromboembolických príhod (napr. infarkt myokardu alebo cievna mozgová príhoda). Epidemiologické štúdie celkovo nenaznačujú, že nízka dávka ibuprofénu (napr. ≤ 1 200 mg/deň) je spojená so zvýšeným rizikom arteriálnych tromboembolických príhod.
Pacienti s nekontrolovanou hypertenziou, kongestívnym zlyhávaním srdca (NYHA II-III), so zistenou ischemickou chorobou srdca, ochorením periférnych tepien a/alebo cerebrovaskulárnymi ochoreniami sa majú liečiť ibuprofénom iba po starostlivom zvážení a má sa vyhnúť vysokým dávkam
(2 400 mg/deň).
Starostlivé zváženie je nevyhnutné urobiť pred začatím dlhodobej liečby u pacientov s rizikovými faktormi pre kardiovaskulárne príhody (napr. hypertenzia, hyperlipidémia, diabetes mellitus, fajčenie), najmä ak sú potrebné vysoké dávky ibuprofénu (2 400 mg/deň).
Porucha funkcie obličiek, pečene a kardiovaskulárne poruchy
Podávanie NSAID môže spôsobiť zníženie tvorby prostaglandínov závislé od dávky a vyvolať zlyhávanie obličiek. Pacienti s najväčším rizikom tejto reakcie sú pacienti s poruchou funkcie obličiek,
kardiovaskulárnou poruchou, dysfunkciou pečene, pacienti užívajúci diuretiká a starší pacienti. U týchto pacientov sa má sledovať funkcia obličiek. Liečba sa má ukončiť u tých pacientov, u ktorých sa rozvinie závažné zlyhanie obličiek (pozri časť 4.3).
U pacientov s prejavmi zhoršenia funkcie pečene sa odporúča zníženie dávky. Liečba sa má ukončiť u tých pacientov, u ktorých sa rozvinie závažné zlyhanie pečene (pozri časť 4.3).
Gastrointestinálne účinky
U pacientov s gastrointestinálnymi chorobami v anamnéze (ulcerózna kolitída, Crohnova choroba) sa
majú NSAID používať s opatrnosťou, pretože môže dôjsť k zhoršeniu ich stavu (pozri časť 4.8).
Gastrointestinálne (GI) krvácanie, ulcerácia alebo perforácia, ktoré môžu byť smrteľné, boli hlásené u všetkých NSAID kedykoľvek počas liečby, s varovnými príznakmi alebo bez nich, alebo s predchádzajúcou anamnézou závažných gastrointestinálnych udalostí.
Riziko GI krvácania, ulcerácie alebo perforácie je vyššie so zvyšujúcimi sa dávkami NSAID u pacientov s peptickým vredom v anamnéze, najmä ak je komplikovaný krvácaním alebo perforáciou (pozri časť 4.3) a u starších pacientov. Títo pacienti majú začať liečbu najnižšou dostupnou dávkou. U týchto pacientov, ako aj u pacientov vyžadujúcich súbežnú nízku dávku kyseliny acetylsalicylovej alebo iných liekov, u ktorých je pravdepodobné, že zvyšujú gastrointestinálne riziko (pozri nižšie a časť 4.5), sa má zvážiť kombinovaná liečba s ochrannými látkami (napr. mizoprostolom alebo inhibítormi protónovej pumpy).
Pacienti s anamnézou gastrointestinálnej toxicity, najmä ak sú starší, majú hlásiť akékoľvek nezvyčajné príznaky v oblasti brucha (najmä krvácanie do gastrointestinálneho traktu), najmä v počiatočných štádiách liečby.
Opatrnosť je potrebná u pacientov, ktorí súbežne užívajú lieky, ktoré môžu zvyšovať riziko ulcerácie alebo krvácania, ako sú perorálne kortikosteroidy, antikoagulanciá, ako je warfarín, selektívne inhibítory spätného vychytávania sérotonínu alebo antiagregačné činidlá, ako je kyselina acetylsalicylová (pozri časť 4.5).
Ak sa u pacientov, ktorí užívajú lieky s obsahom ibuprofénu objaví gastrointestinálne krvácanie alebo ulcerácia, liečba sa má ukončiť.
Závažné kožné reakcie
Závažné kožné reakcie, z ktorých niektoré boli smrteľné, vrátane exfoliatívnej dermatitídy,
Stevensovho-Johnsonovho syndrómu a toxickej epidermálnej nekrolýzy, boli veľmi zriedkavo hlásené v súvislosti s užívaním NSAID (pozri časť 4.8). Zdá sa, že u pacientov je najvyššie riziko týchto
reakcií na začiatku liečby, pričom výskyt reakcie sa vyskytuje vo väčšine prípadov v priebehu prvého
mesiaca liečby. V súvislosti s liekmi obsahujúcimi ibuprofén bola hlásená akútna generalizovaná exantematózna pustulóza (AGEP). Použitie tohto lieku sa musí ukončiť pri prvom výskyte prejavov a príznakov závažných kožných reakcií, ako sú vyrážky, slizničné lézie alebo akékoľvek iné prejavy precitlivenosti.
Zhoršená plodnosť žien
Pozri časť 4.6.
Maskovanie príznakov infekcií
Paracetamol/Ibuprofen Zentiva môže maskovať príznaky infekcie, čo môže viesť k oneskorenému
začatiu vhodnej liečby a tým zhoršiť výsledok infekcie. Toto sa pozorovalo pri komunitne získanej pneumónii a bakteriálnych komplikáciách pri ovčích kiahňach. Ak sa Paracetamol/Ibuprofen Zentiva podáva na zníženie horúčky alebo úľavu od bolesti v súvislosti s infekciou, odporúča sa sledovanie infekcie. V podmienkach mimo nemocnice má pacient pri pretrvávajúcich alebo zhoršujúcich sa príznakoch stav konzultovať s lekárom.
Tento liek obsahuje sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej tablete, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Tentoliekjekontraindikovanývkombináciis:
· inými liekmi obsahujúcimi paracetamol - zvýšené riziko závažných nežiaducich účinkov (pozri časť 4.3).
· kyselinou acetylsalicylovou, pokiaľ lekár neodporučil nízke dávky kyseliny acetylsalicylovej (nie viac ako 75 mg denne), pretože to môže zvýšiť riziko nežiaducich reakcií (pozri časti 4.3 a 4.4). Experimentálne údaje naznačujú, že ibuprofén môže kompetitívne inhibovať účinok nízkej dávky
kyseliny acetylsalicylovej na agregáciu trombocytov, keď sa podáva súbežne. Aj keď existujú
nejasnosti týkajúce sa extrapolácie týchto údajov na klinickú situáciu, nemožno vylúčiť možnosť, že pravidelné a dlhodobé používanie ibuprofénu môže znížiť kardioprotektívny účinok nízkej
dávky kyseliny acetylsalicylovej. V prípade príležitostného používania sa žiaden klinicky relevantný účinok nepovažuje za pravdepodobný (pozri časť 5.1).
· inými NSAID vrátane selektívnych inhibítorov cyklooxygenázy-2, pretože tieto môžu zvyšovať riziko nežiaducich účinkov (pozri časť 4.3).
Tento liek sa má kvôliobsahuparacetamolupoužívaťopatrnevkombináciis:
· Chloramfenikolom
Zvýšená koncentrácia chloramfenikolu v plazme.
· Kolestyramínom
Rýchlosť absorpcie paracetamolu sa kolestyramínom znižuje. Preto sa kolestyramín nemá užívať do jednej hodiny, ak je potrebná maximálna analgézia.
· Flukloxacilínom
Pri súbežnom užívaní paracetamolu s flukloxacilínom je potrebná opatrnosť, pretože súbežné užívanie je spojené s metabolickou acidózou s vysokou aniónovou medzerou, najmä u pacientov s rizikovými faktormi (pozri časť 4.4).
· Metoklopramidom a domperidónom
Metoklopramid a domperidón zvyšujú absorpciu paracetamolu. Súbežnému užívaniu sa však nie je potrebné vyhýbať.
· Warfarínom
Antikoagulačný účinok warfarínu a iných kumarínov sa môže dlhodobým a pravidelným užívaním paracetamolu zvýšiť spolu so zvýšeným rizikom krvácania; príležitostné dávky nemajú žiadny významný účinok.
Tento liek sa má kvôli obsahu ibuprofénu používať opatrnevkombináciis:
· Antikoagulanciami
NSAID môžu zosilňovať účinky antikoagulancií, ako je warfarín (pozri časť 4.4).
· Antihypertenzívami (inhibítormi ACE a antagonistami angiotenzínu II) a diuretikami
NSAID môžu znižovať účinky týchto liekov. U niektorých pacientov s poškodenou funkciou obličiek (napr. dehydratovaní pacienti alebo starší pacienti s poškodenou funkciou obličiek) môže súbežné podávanie inhibítora ACE alebo antagonistu angiotenzínu II a látok, ktoré inhibujú cyklooxygenázu, viesť k ďalšiemu zhoršeniu funkcie obličiek, vrátane možného akútneho zlyhania obličiek, ktoré je zvyčajne reverzibilné. Tieto interakcie sa majú zvážiť u pacientov užívajúcich NSAID súbežne s inhibítormi ACE alebo antagonistami angiotenzínu II. Preto sa má kombinácia podávať opatrne, najmä u starších pacientov. Pacienti majú byť primerane hydratovaní a má sa zvážiť sledovanie funkcie obličiek po začatí súbežnej liečby a potom v pravidelných intervaloch. Diuretiká môžu zvýšiť riziko nefrotoxicity NSAID.
· Antiagregačnými látkami a selektívnymi inhibítormi spätného vychytávania sérotonínu (SSRI)
Zvýšené riziko gastrointestinálneho krvácania (pozri časť 4.4).
· Srdcovými glykozidmi
NSAID môžu zhoršovať srdcové zlyhávanie, znižovať GFR a zvyšovať hladiny glykozidov v plazme.
· Cyklosporínom
Zvýšené riziko nefrotoxicity.
· Kortikosteroidmi
Zvýšené riziko gastrointestinálnej ulcerácie alebo krvácania (pozri časť 4.4).
· Lítiom
Znížené vylučovanie lítia.
· Metotrexátom
Znížené vylučovanie metotrexátu.
· Mifepristónom
NSAID sa nemajú používať 8 až 12 dní po podaní mifepristónu, pretože NSAID môžu znižovať účinok mifepristónu.
· Chinolónovými antibiotikami
Údaje zo štúdií na zvieratách naznačujú, že NSAID môžu zvyšovať riziko záchvatov spojených s používaním chinolónových antibiotík. U pacientov užívajúcich NSAID a chinolóny môže byť zvýšené riziko vzniku kŕčov.
· Takrolimom
Možné zvýšené riziko nefrotoxicity, keď sa NSAID podávajú súbežne s takrolimom.
· Zidovudínom
Zvýšené riziko hematologickej toxicity NSAID pri súbežnom užívaní so zidovudínom. Existujú dôkazy o zvýšenom riziku hemartrózy a hematómu u HIV (+) hemofilikov, ktorí sú súbežne liečení zidovudínom a ibuprofénom.
4.6 Fertilita, gravidita a laktácia
Gravidita
S užívaním tohto lieku u ľudí počas tehotenstva nie sú žiadne skúsenosti.
Paracetamol
Veľké množstvo údajov u gravidných žien nepoukazuje na malformácie ani fetálnu/neonatálnu toxicitu. Epidemiologické štúdie týkajúce sa vývinu nervovej sústavy u detí vystavených paracetamolu
in utero poskytujú nepresvedčivé výsledky.
Ibuprofén
Inhibícia syntézy prostaglandínov môže nepriaznivo ovplyvniť graviditu a/alebo vývoj embrya/plodu.
Údaje z epidemiologických štúdií naznačujú zvýšené riziko potratu a srdcovej malformácie a gastroschízy po použití inhibítora syntézy prostaglandínov na začiatku tehotenstva. Absolútne riziko
kardiovaskulárnych malformácií sa zvýšilo z menej ako 1 % na približne 1,5 %. Predpokladá sa, že
riziko sa zvyšuje s dávkou a dĺžkou liečby. U zvierat sa ukázalo, že podávanie inhibítora syntézy prostaglandínov vedie k zvýšeným pre- a postimplantačným stratám a embryofetálnej letalite. Okrem
toho bol hlásený zvýšený výskyt rôznych malformácií, vrátane kardiovaskulárnych, u zvierat, ktorým
bol počas organogenetického obdobia podávaný inhibítor syntézy prostaglandínov.
Od 20. týždňa tehotenstva môže užívanie ibuprofénu spôsobiť oligohydramnión v dôsledku poruchy funkcie obličiek plodu. Táto situácia sa môže objaviť krátko po začatí liečby a po jej ukončení je zvyčajne reverzibilná. Okrem toho boli po liečbe v druhom trimestri hlásené prípady zúženia ductus arteriosus, z ktorých väčšina ustúpila po ukončení liečby. Počas prvého a druhého trimestra gravidity sa preto ibuprofén nemá podávať, pokiaľ to nie je jednoznačne nevyhnutné. Ak ibuprofén užíva žena, ktorá sa pokúša otehotnieť, alebo počas prvého a druhého trimestra gravidity, dávka má byť čo najnižšia a dĺžka liečby čo najkratšia. Po expozícii ibuprofénu počas niekoľkých dní od 20. gestačného týždňa sa má zvážiť predpôrodné monitorovanie zamerané na oligohydramnión a zúženie ductus arteriosus. Ak sa zistí oligohydramnión alebo zúženie ductus arteriosus, liečba ibuprofénom sa má ukončiť.
Počas tretieho trimestra tehotenstva môžu všetky inhibítory syntézy prostaglandínov spôsobiť u
· plodu:
o kardiopulmonálnu toxicitu (predčasné zúženie/uzáver
ductus arteriosus a pulmonálnu hypertenziu),
o renálnu dysfunkciu, ktorá môže progredovať do zlyhania obličiek
s oligohydramniónom (pozri vyššie),
· matky a novorodenca na konci tehotenstva spôsobiť
o možné predĺženie času krvácania, antiagregačný účinok, ktorý sa môže vyskytnúť aj pri veľmi nízkych dávkach,
o inhibíciu kontrakcií maternice, vedúcej k oneskorenému alebo predĺženému pôrodu.
V dôsledku toho je ibuprofén kontraindikovaný počas tretieho trimestra gravidity (pozri časť 4.3). Preto je potrebné vyhnúť sa používaniu tohto lieku počas prvých šiestich mesiacov tehotenstva a je
kontraindikovaný v posledných troch mesiacoch tehotenstva (pozri časť 4.3).
DojčenieIbuprofén a jeho metabolity môžu prenikať do materského mlieka vo veľmi malých množstvách
(0,0008 % dávky podanej matke). U dojčiat nie sú známe žiadne škodlivé účinky.
Paracetamol sa vylučuje do materského mlieka, ale nie v klinicky významnom množstve. Dostupné publikované údaje nekontraindikujú dojčenie.
Pri krátkodobej liečbe v odporúčaných dávkach tohto lieku nie je zvyčajne potrebné prerušenie dojčenia.
FertilitaExistujú obmedzené dôkazy, že liečivá, ktoré inhibujú cyklooxygenázu/syntézu prostaglandínov, môžu ovplyvnením ovulácie spôsobiť zníženie fertility u žien a neodporúčajú sa ženám, ktoré plánujú tehotenstvo. Po ukončení liečby je tento stav reverzibilný. U žien, ktorým sa nedarí otehotnieť, alebo ktoré sú práve vyšetrované kvôli neplodnosti, treba zvážiť ukončenie liečby týmto liekom.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojePo užití NSAID sa môžu vyskytnúť nežiaduce účinky, ako sú závrat, ospalosť, únava a poruchy zraku. Ak sa vyskytnú, pacienti nemajú viesť vozidlo alebo obsluhovať stroje.
4.8 Nežiaduce účinkyKlinické štúdie s týmto liekom nepreukázali žiadne iné nežiaduce účinky okrem účinkov týkajúcich sa samotného ibuprofénu alebo paracetamolu.
Nasledujúca tabuľka uvádza nežiaduce účinky z údajov o farmakovigilancii, ktoré sa vyskytli u pacientov užívajúcich samotný ibuprofén alebo samotný paracetamol pri krátkodobom a dlhodobom užívaní.
Nežiaduce udalosti, ktoré súvisia so samotným ibuprofénom alebo samotným paracetamolom, sú uvedené nižšie v tabuľke podľa tried orgánových systémov a frekvencie. Frekvencie sú definované ako: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových
systémov
| Frekvencia
| Nežiaduce reakcie
|
Poruchy krvi a
lymfatického systému
| veľmi zriedkavé
| poruchy hematopoetického systému1
|
Poruchy imunitného
systému
| veľmi zriedkavé
| reakcie z precitlivenosti, ako sú nešpecifické
reakcie z precitlivenosti a anafylaktické reakcie;
závažné reakcie z precitlivenosti2
|
Psychické poruchy
| veľmi zriedkavé
| zmätenosť, depresia a halucinácie
|
Poruchy nervového systému
menej časté bolesť hlavy a závrat
veľmi zriedkavé parestézia, optická neuritída a somnolencia,
aseptická meningitída3
Poruchy oka veľmi zriedkavé poruchy zraku
Poruchy ucha a labyrintu veľmi zriedkavé tinitus a vertigo
Poruchy ciev veľmi zriedkavé opuch, hypertenzia a srdcové zlyhávanie bolo hlásené po podaní NSAID4
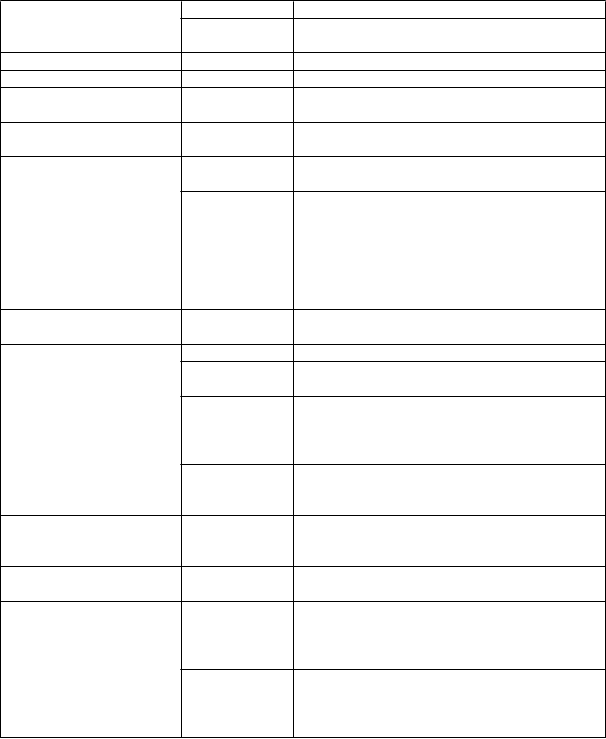
Poruchy dýchacej sústavy, hrudníka a mediastína Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových
ciest
Poruchy kože a podkožného
tkaniva
Poruchy obličiek a
močových ciest
Celkové poruchy a reakcie v mieste podania Laboratórne a funkčné vyšetrenia
veľmi zriedkavé reaktivita dýchacích ciest vrátane astmy,
zhoršenia astmy, bronchospazmu a dýchavičnosti časté bolesť brucha, hnačka, dyspepsia, nevoľnosť,
diskomfort v bruchu a vracanie
menej časté nadúvanie a zápcha, peptický vred, gastrointestinálna perforácia alebo gastrointestinálne krvácanie prejavujúce sa melénou, hematemézou5, vredy v ústnej dutine, exacerbácia ulceróznej kolitídy a Crohnovej choroby (pozri časť 4.4), menej častá gastritída a pankreatitída
veľmi zriedkavé Porucha funkcie pečene, hepatitída alebo žltačka6
časté hyperhidróza
menej časté rôzne typy vyrážok vrátane svrbenia a žihľavky, angioedém a opuch tváre
veľmi zriedkavé purpura a fotocitlivosť, exfoliačná dermatóza, bulózne reakcie vrátane multiformného erytému, Stevensovho-Johnsonovho syndrómu a toxickej epidermálnej nekrolýzy
neznáme reakcia na liek s eozinofíliou a systémovými príznakmi (DRESS syndróm), akútna generalizovaná exantémová pustulóza (AGEP)
veľmi zriedkavé rôzne formy nefrotoxicity vrátane intersticiálnej nefritídy, nefrotického syndrómu a akútneho alebo chronického zlyhania obličiek
veľmi zriedkavé únava a nevoľnosť
časté zvýšená alanínaminotransferáza, zvýšená gama- glutamyltransferáza a abnormálne parametre testu funkcie pečene, zvýšený krvný kreatinín, zvýšená močovina v krvi
menej časté zvýšená aspartátaminotransferáza, zvýšená alkalická fosfatáza v krvi, zvýšená kreatinínfosfokináza v krvi, znížený hemoglobín a zvýšený počet krvných doštičiek
1 Príklady zahŕňajú agranulocytózu, anémiu, aplastickú anémiu, hemolytickú anémiu, leukopéniu,
neutropéniu, pancytopéniu a trombocytopéniu.
Prvé prejavy sú horúčka, bolesť hrdla, povrchové vredy v ústach, príznaky podobné chrípke, silné vyčerpanie, nevysvetliteľné krvácanie a podliatiny a krvácanie z nosa.
2
Príznaky môžu zahŕňať: opuch tváre, jazyka a hrdla, dýchavičnosť, tachykardia, hypotenzia
(anafylaktická reakcia, angioedém alebo závažný šok).
3 Pozorovali sa ojedinelé prípady u pacientov s existujúcimi autoimunitnými poruchami (ako je systémový
lupus erythematosus a zmiešané ochorenie spojivového tkaniva)
s príznakmi ako:
stuhnutý krk, bolesť hlavy, nevoľnosť, vracanie, horúčka alebo dezorientácia (pozri časť 4.4).
4 Údaje z klinických štúdií naznačujú, že užívanie ibuprofénu, najmä vo vysokých dávkach
(2 400 mg/deň), môže byť spojené s miernym zvýšením rizika arteriálnych tromboembolických príhod (napríklad infarktu myokardu alebo cievnej mozgovej príhody) (pozri časť 4.4).
5 Niekedy fatálne, najmä u starších pacientov (pozri časť 4.4).
6 V prípade predávkovania paracetamolom sa môže vyskytnúť zlyhávanie pečene, nekróza pečene a poškodenie pečene (pozri časť 4.9).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieParacetamolK poškodeniu pečene u dospelých môže dôjsť po užití 10 g (čo zodpovedá 20 tabletám) alebo viac
paracetamolu. Ak má pacient jeden alebo viac z nasledujúcich rizikových faktorov, môže užitie 5 g
(čo zodpovedá 10 tabletám) alebo viac paracetamolu viesť k poškodeniu pečene:
- Dlhodobá liečba karbamazepínom, fenobarbitalom, fenytoínom, primidónom, rifampicínom, ľubovníkom bodkovaným alebo inými liekmi, ktoré indukujú pečeňové enzýmy.
- Pravidelná konzumácia alkoholu v množstve presahujúcom odporúčané množstvá.
- Pravdepodobnosť vyčerpania glutatiónu, napr. pri poruchách stravovania, cystickej fibróze, infekcii HIV, hladovaní, kachexii.
PríznakyMedzi príznaky predávkovania paracetamolom v prvých 24 hodinách patrí bledosť, nevoľnosť, vracanie, anorexia a bolesť brucha. Poškodenie pečene sa môže prejaviť 12 až 48 hodín po užití, ak testy funkcie pečene vykazujú hodnoty mimo normu. Môžu sa vyskytnúť abnormality metabolizmu glukózy a metabolická acidóza. Pri ťažkej otrave môže zlyhanie pečene viesť k encefalopatii, krvácaniu, hypoglykémii, opuchu mozgu a smrti. Akútne zlyhanie obličiek s akútnou tubulárnou nekrózou, výrazne sa prejavujúce bolesťou bedier, hematúriou a proteinúriou, sa môže vyvinúť aj bez poškodenia obličiek. Boli hlásené srdcové arytmie a pankreatitída.
LiečbaPri liečbe predávkovania paracetamolom je nevyhnutná okamžitá liečba. Napriek neprítomnosti zjavných skorých príznakov, majú byť pacienti prepravení do nemocnice, aby im bola poskytnutá okamžitá lekárska starostlivosť. Príznaky predávkovania môžu byť obmedzené na nevoľnosť alebo vracanie a nemusia odrážať závažnosť predávkovania alebo riziko poškodenia orgánov. Liečba má prebiehať v súlade so zavedenými odporúčaniami pre liečbu predávkovania.'
Do 1 hodiny po predávkovaní sa má zvážiť podanie aktívneho uhlia. Plazmatická koncentrácia paracetamolu sa má zmerať po 4 hodinách alebo neskôr po požití paracetamolu (predtým namerané koncentrácie sú nespoľahlivé).
Liečba N-acetylcysteínom sa môže použiť do 24 hodín po užití paracetamolu, maximálny ochranný účinok sa však dosiahne do 8 hodín po požití. Účinnosť protilátky po tomto čase výrazne klesá.
Ak je to potrebné, pacient by mal intravenózne dostať N-acetylcysteín v súlade so stanoveným režimom dávkovania. Ak stav nekomplikuje vracanie, perorálne podávanie metionínu môže byť vhodnou alternatívou pre odľahlé oblasti mimo nemocnice.
Pacienti u ktorých sa dlhšie ako po 24 hodinách od požitia prejavuje závažná hepatická dysfunkcia, majú vyhľadať lekársku pomoc u odborníka na otravy a majú sa liečiť v súlade s ustanovenými usmerneniami.
Ibuprofén
U detí môže požitie viac ako 400 mg/kg ibuprofénu vyvolať príznaky. U dospelých je hranica dávky
na vyvolanie odpovede menej jasná.
Polčas pri predávkovaní je 1,5-3 hodiny.
Príznaky
U väčšiny pacientov, ktorí užili klinicky významné množstvo NSAID sa vyvinie len nevoľnosť, vracanie, bolesť v epigastriu alebo zriedkavejšie hnačka. Tinitus, bolesť hlavy a gastrointestinálne krvácanie sú tiež možné. Pri závažnejšej otrave sa prejavuje toxicita v centrálnom nervovom systéme, prejavujúca sa ako ospalosť, príležitostné vzrušenie a dezorientácia alebo kóma. U pacientov sa niekedy vyskytnú kŕče. Pri závažnej otrave sa môže vyskytnúť metabolická acidóza a môže sa predĺžiť protrombínový čas/INR, pravdepodobne kvôli účinku na aktivitu cirkulujúcich faktorov zrážania krvi. Ak je súbežne prítomná dehydratácia, môže dôjsť k akútnemu zlyhaniu obličiek a poškodeniu pečene. U astmatikov je možná exacerbácia astmy.
Liečba
Liečba má byť symptomatická a podporná a má zahŕňať udržiavanie priechodnosti dýchacích ciest a monitorovanie srdcových a vitálnych funkcií, až kým nebudú stabilné. Do 1 hodiny po užití potenciálne toxického množstva sa má zvážiť perorálne podanie aktívneho uhlia. V prípade častých alebo dlhotrvajúcich kŕčov sa má intravenózne podať diazepam alebo lorazepam. Na astmu sa má podať bronchodilatans.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Analgetiká, Iné analgetiká a antipyretiká
ATC kód: N02BE51
Mechanizmusúčinku
Farmakologické účinky ibuprofénu a paracetamolu sa líšia miestom a spôsobom účinku. Tieto komplementárne spôsoby pôsobenia sú synergické, čo znamená, že liek má silnejšie antinociceptívne a antipyretické vlastnosti ako samotné jednotlivé liečivá.
Ibuprofén je nesteroidové protizápalové liečivo (NSAID), ktorého účinnosť inhibície syntézy prostaglandínov bola potvrdená na konvenčných modeloch zápalu u zvierat. Prostaglandíny senzibilizujú nociceptívne aferentné nervové zakončenie na mediátory, ako je bradykinín. Analgetický účinok ibuprofénu je spôsobený periférnou inhibíciou izoenzýmu cyklooxygenázy-2 (COX-2) a následnou redukciou citlivosti nociceptívnych nervových zakončení. Ibuprofén tiež inhibuje migráciu leukocytov do miest zápalu. Ibuprofén má významný vplyv na miechu, čiastočne kvôli jeho
schopnosti inhibovať aktivitu COX. Antipyretický účinok ibuprofénu je spôsobený centrálnou inhibíciou syntézy prostaglandínov v hypotalame. Ibuprofén reverzibilne inhibuje agregáciu krvných doštičiek. U ľudí ibuprofén znižuje bolesť spôsobenú zápalom, opuchom a horúčkou.
Experimentálne údaje naznačujú, že ibuprofén môže kompetitívne inhibovať účinok nízkej dávky kyseliny acetylsalicylovej na agregáciu trombocytov, keď sa podáva súbežne. Niektoré
farmakodynamické štúdie ukazujú, že keď sa jednorazová dávka ibuprofénu (400 mg) užila do 8 hodín pred alebo do 30 minút po užití kyseliny acetylsalicylovej s okamžitým uvoľňovaním (81 mg), došlo k zníženému účinku kyseliny acetylsalicylovej na tvorbu tromboxánu alebo agregáciu trombocytov.
Hoci existujú nejasnosti s ohľadom na extrapoláciu týchto údajov na klinickú situáciu, nedá sa vylúčiť možnosť, že pravidelné, dlhodobé používanie ibuprofénu môže znížiť kardioprotektívny účinok nízkej dávky kyseliny acetylsalicylovej. V prípade príležitostného používania ibuprofénu sa žiaden klinicky relevantný účinok nepovažuje za pravdepodobný (pozri časť 4.5).
Presný mechanizmus účinku paracetamolu stále nie je úplne objasnený, existuje však dostatok dôkazov na podporu hypotézy jeho centrálneho antinociceptívneho účinku. Výsledky rôznych biochemických testov poukazujú na inhibíciu centrálnej aktivity enzýmu COX-2. Paracetamol môže tiež stimulovať aktivitu zostupných 5-hydroxytryptamínových (sérotonínových) dráh, ktoré inhibujú prenos nociceptívneho signálu v mieche. Štúdie ukázali, že paracetamol je veľmi slabým inhibítorom periférnych izoenzýmov COX-1 a COX-2.
Klinickáúčinnosťabezpečnosť
Klinická účinnosť ibuprofénu a paracetamolu sa preukázala pri bolesti spojenej s bolesťou hlavy, bolesťou zubov a dysmenoreou a horúčkou; ďalej sa preukázala účinnosť u pacientov s bolesťou a
horúčkou spojenou s prechladnutím a chrípkou a pri druhoch bolesti, ako sú bolesť hrdla, svalová bolesť alebo poranenie mäkkých tkanív a bolesť chrbta.
Tento liek je zvlášť vhodný na liečbu bolesti, ktorá si vyžaduje silnejšiu úľavu od bolesti ako 400 mg ibuprofénu alebo 1 000 mg paracetamolu použitého samostatne alebo ako analgetikum, ktoré zmierni bolesť rýchlejšie ako ibuprofén.
Súhrn klinických údajov po podaní 2 tabliet
Uskutočnili sa randomizované, dvojito zaslepené štúdie s kombináciou s použitím modelu akútnej
bolesti pooperačnej bolesti zubov. Štúdie ukázali, že:
· Liek poskytuje účinnejšiu úľavu od bolesti ako 1 000 mg paracetamolu (p < 0,0001) a 400 mg
ibuprofénu (p < 0,05).
· Liek má rýchly nástup účinku s „potvrdeným analgetickým účinkom“ dosiahnutým s mediánom
18,3 minúty. Nástup účinku bol významne rýchlejší ako pri 400 mg ibuprofénu (23,8 minút, p =
0,0015). „Významný analgetický účinok“ tohto lieku sa dosiahol s mediánom 44,6 minút (dávka
2 tabliet), čo je výrazne rýchlejšie ako v prípade ibuprofénu 400 mg (70,5 minúty, p = 0,0001).
· Trvanie analgézie bolo u tohto lieku podstatne dlhšie (9,1 hodiny) v porovnaní s 500 mg paracetamolu (4 hodiny) alebo 1 000 mg (5 hodín).
· Globálne hodnotenie skúmaného lieku subjektmi ukázalo vysokú úroveň spokojnosti s 93,2 %
hodnotením lieku ako „dobrý“, „veľmi dobrý“ alebo „výborný“ pri dosahovaní úľavy od bolesti. Liek s fixnou kombináciou mal výrazne lepšie výsledky ako 1 000 mg paracetamolu
(p<0,0001).
S liekom sa uskutočnila randomizovaná, dvojito zaslepená štúdia na liečbu chronickej bolesti kolena. Štúdia preukázala že:
· Liek poskytuje pri krátkodobej liečbe (p < 0,0001) a pri dlhodobej liečbe (p < 0,01) účinnejšiu úľavu od bolesti ako 1 000 mg paracetamolu.
· Globálne hodnotenie lieku subjektmi ukázalo vysokú mieru spokojnosti so 60,2 % hodnotením produktu ako „dobrý“ alebo „výborný“ ako dlhodobá liečba bolesti kolena. Liek mal výrazne
lepšie výsledky ako 1 000 mg paracetamolu (p<0,001).
5.2 Farmakokinetické vlastnosti
Ibuprofén
Absorpcia
Ibuprofén sa z gastrointestinálneho traktu dobre vstrebáva. Plazmatické hladiny ibuprofénu z tohto
lieku sú detegovateľné po 5 minútach s maximálnymi plazmatickými koncentráciami dosiahnutými do
1 - 2 hodín po užití nalačno. Keď sa tento liek užíval s jedlom, najvyššie plazmatické hladiny
ibuprofénu boli nižšie a oneskorené v priemere o 25 minút, ale celkový rozsah absorpcie bol
ekvivalentný.
Distribúcia
Ibuprofén sa vo veľkej miere viaže na plazmatické proteíny. Ibuprofén prechádza do synoviálnej
tekutiny. V limitovaných štúdiách sa ibuprofén vyskytuje v materskom mlieku vo veľmi nízkych koncentráciách.
Biotransformácia
Ibuprofén sa metabolizuje v pečeni na dva hlavné metabolity, ktoré sa spolu so zanedbateľným množstvom nezmeneného ibuprofénu primárne vylučujú obličkami v nezmenenej forme alebo ako
konjugáty.
Eliminácia
Vylučovanie obličkami je rýchle a úplné. Eliminačný polčas je približne 2 hodiny.
U starších sa nepozorovali žiadne významné zmeny vo farmakokinetickom profile ibuprofénu.
Paracetamol
Absorpcia
Paracetamol sa ľahko vstrebáva z gastrointestinálneho traktu. Plazmatické hladiny paracetamolu z
tohto lieku sú detegovateľné po 5 minútach, pričom maximálne plazmatické koncentrácie sa dosahujú
0,5 - 0,67 hodín po užití nalačno. Keď sa tento liek užíval s jedlom, najvyššie plazmatické hladiny paracetamolu boli nižšie a oneskorené v priemere o 55 minút, ale celkový rozsah absorpcie bol ekvivalentný.
Distribúcia
Väzba na plazmatické bielkoviny je pri zvyčajných terapeutických koncentráciách zanedbateľná, avšak závislá od dávky.
Biotransformácia
Paracetamol sa metabolizuje v pečeni.
Menší hydroxylovaný metabolit, ktorý sa zvyčajne produkuje vo veľmi malých množstvách oxidázami so zmiešanou funkciou v pečeni a detoxikuje sa konjugáciou s glutatiónom v pečeni, sa môže akumulovať po predávkovaní paracetamolom a spôsobiť poškodenie pečene.
Eliminácia
Paracetamol sa vylučuje močom, hlavne ako glukuronidové a sulfátové konjugáty, a z tohto približne
10 % ako glutatiónové konjugáty. Menej ako 5 % sa vylučuje ako nezmenený paracetamol. Eliminačný polčas je približne 3 hodiny.
U starších sa nepozorovali žiadne významné zmeny vo farmakokinetickom profile paracetamolu. Biologická dostupnosť a farmakokinetické profily ibuprofénu a paracetamolu užívaných ako
kombinácia v tomto lieku sa pri jednorazovej alebo opakovanej dávke nemenia.
Tento liek je vytvorený pomocou technológie, ktorá uvoľňuje súčasne ibuprofén a paracetamol, takže liečivá poskytujú kombinovaný účinok.
5.3 Predklinické údaje o bezpečnosti
Toxikologický bezpečnostný profil ibuprofénu a paracetamolu bol stanovený pri pokusoch na zvieratách a na základe rozsiahlych klinických skúseností u ľudí. Neexistujú žiadne nové predklinické údaje, ktoré majú význam pre predpisujúceho lekára, a ktoré dopĺňajú údaje už uvedené v tomto súhrne charakteristických vlastností lieku.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
sodná soľ kroskarmelózy hyprolóza mikrokryštalická celulóza
koloidný bezvodý oxid kremičitý kyselina stearová
stearát horečnatý
Filmotvornávrstva:
kopolymér makrogolu a vrúbľovaného polyvinylalkoholu
mastenec
pigment na báze sľudy s oxidom titaničitým (E 555/E 171)
glycerol-monokaprylokaprát
polyvinylalkohol
oxid titaničitý (E 171)
čierny oxid železitý (E 172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Nepriehľadné, biele PVC/PVDC/Alu blistre
Veľkosť balenia: 10, 20, 50 filmom obalených tabliet
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Zentiva, k.s.
U kabelovny 130
102 37 Praha 10 - Dolní Měcholupy
Česká republika
8. REGISTRAČNÉ ČÍSLO
07/0169/22-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 10. júna 2022
10. DÁTUM REVÍZIE TEXTU
12/2022