
Spôsob podávania
Subkutánne použitie. Každá naplnená injekčná striekačka je určená len na jednorazové použitie.
Vzhľadom na možnosť akútnej systémovej reakcie z precitlivenosti je počas indukcie a titrácie (časové obdobie pred dosiahnutím hladín fenylalanínu v krvi vo výške menej ako 600 mikromolov/l pri stabilnej dávke, pozri časť 4.8) potrebná premedikácia pred podaním každej dávky. Pacienti musia byť poučení, aby premedikovali antagonistom receptora H1, antagonistom receptora H2 a antipyretikom. Počas obdobia udržiavacej liečby sa môže použitie premedikácie pre následné injekcie opätovne zvážiť na základe pacientovej znášanlivosti lieku Palynziq.
Počiatočné podávanie injekcie (injekcií) sa musí uskutočniť pod dohľadom zdravotníckeho pracovníka a pacienti musia byť pod dohľadom po dobu najmenej 60 minút po každej z týchto počiatočných injekcií (pozri časti 4.4 a 4.8).
Pred prvou dávkou lieku Palynziq má byť pacient oboznámený o prejavoch a príznakoch akútnej systémovej reakcie z precitlivenosti a poučený o tom, že musí v prípade reakcie okamžite vyhľadať lekársku starostlivosť, a o tom, ako správne použiť zariadenie na injekčné podávanie adrenalínu (autoinjektor alebo naplnená injekčná striekačka/pero).
Pacienti majú byť poučení, aby počas liečby liekom Palynziq mali zariadenie na injekčné podávanie adrenalínu vždy pri sebe.
Počas prinajmenšom prvých 6 mesiacov liečby, keď si pacient podáva injekciu samostatne (t. j. keď sa podávanie nekoná pod dohľadom zdravotníckeho personálu), musí byť po dobu najmenej 60 minút po každom podaní prítomný pozorovateľ. Pozorovateľ je niekto, kto:
· je s pacientom počas a po podaní lieku Palynziq,
· dokáže rozpoznať prejavy a príznaky akútnej systémovej reakcie z precitlivenosti,
· môže v prípade potreby zavolať núdzovú lekársku pomoc a podať adrenalín.
Po 6 mesiacoch liečby liekom Palynziq môže byť nutnosť prítomnosti pozorovateľa opätovne zvážená.
Pred samostatným podávaním injekcie má zdravotnícky pracovník:
· zaškoliť pacienta a posúdiť jeho spôsobilosť podať liek samostatne,
· zaškoliť pozorovateľa, aby rozpoznal prejavy a príznaky akútnej systémovej reakcie z precitlivenosti a v prípade rekcie okamžite vyhľadal lekársku starostlivosť, a aby dokázal správne použiť zariadenie na injekčné podávanie adrenalínu (autoinjektor alebo naplnená
injekčná striekačka/pero).
Opätovné podanie po miernych až stredne závažných akútnych systémových reakciách
z precitlivenosti: Lekár, ktorý liek predpisuje, má zvážiť riziká a prínosy opätovného podávania lieku po vyriešení prvej miernej až stredne závažnej akútnej systémovej reakcie z precitlivenosti (pozri časti 4.3 a 4.4). Opätovné podanie prvej dávky sa musí vykonať pod dohľadom zdravotníckeho pracovníka schopného zvládnuť akútne systémové reakcie z precitlivenosti.
Odporúčané miesta vpichu na tele sú: predná strana stehien v prostriedku a spodná časť brucha okrem okruhu 5 cm okolo pupku. Ak injekciu podáva opatrovateľ, vhodné miesta vpichu sú tiež horná časť zadku a zadná strana hornej časti ramien.
Palynziq sa nesmie podávať do materských znamienok, jaziev, modrín, vyrážok alebo do oblastí, kde je koža stvrdnutá, citlivá, červená, poškodená, spálená, zapálená alebo tetovaná. Je potrebné skontrolovať, či na mieste vpichu nie je sčervenanie, opuch alebo či nie je citlivé na dotyk.
Pacientom alebo opatrovateľom sa odporúča, aby miesta pre subkutánne injekcie striedali. Ak je v rámci jednej dávky potrebné podať viac než jednu injekciu, každé miesto vpichu musí byť od ďalšieho miesta vpichu vzdialené aspoň 5 cm.
Palynziq je číry až mierne opaleskujúci, bezfarebný až svetložltý roztok. Roztok sa nemá používať, ak je sfarbený alebo zakalený, alebo ak sú prítomné viditeľné častice.
4.3 Kontraindikácie
Závažná systémová reakcia z precitlivenosti alebo recidíva miernej až stredne závažnej akútnej systémovej reakcie z precitlivenosti na pegvaliázu, ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo iný PEGylovaný liek (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Reakcie z precitlivenosti
Reakcie z precitlivenosti zahŕňajú skupinu pojmov, ktorá obsahuje akútne systémové reakcie
z precitlivenosti, iné systémové reakcie z precitlivenosti (napr. angioedém a sérová choroba, ktoré môžu mať akútny alebo chronický prejav) a miestne reakcie z precitlivenosti (napr. reakcie v mieste vpichu alebo iné kožné reakcie). U pacientov liečených liekom Palynziq boli hlásené reakcie z precitlivenosti a môžu sa vyskytnúť kedykoľvek počas liečby. Palynziq môže tiež zvýšiť precitlivenosť na iné PEGylované injekčné lieky (pozri Účinok lieku Palynziq na iné PEGylované injekčné lieky). Riziko reakcie z precitlivenosti je 2,6-násobne vyššie v indukčnej/titračnej fáze v porovnaní s udržiavacou fázou.
Riešenie reakcií z precitlivenosti má byť založené na závažnosti reakcie: v klinických štúdiách to zahŕňalo úpravu dávky, prerušenie liečby, ďalšie antihistaminiká, antipyretiká, kortikosteroidy a/alebo kyslík (pozri časti 4.2, Spôsob podávania a 4.8).
Akútne systémové reakcie z precitlivenosti (typ III)
Základným mechanizmom pre vznik akútnych systémových reakcií z precitlivenosti pozorovaných v klinických štúdiách, bola precitlivenosť typu III nesprostredkovaná IgE protilátkami
(sprostredkovaná imunitným komplexom) (pozri časti 4.3 a 4.8).
Prejavy akútnych systémových reakcií z precitlivenosti zahŕňali kombináciu nasledujúcich akútnych prejavov a príznakov: synkopa, hypotenzia, hypoxia, dyspnoe, sipot, nepríjemný pocit na
hrudníku/tlak na hrudníku, tachykardia, angioedém (opuch tváre, pier, očí a jazyka), začervenanie, vyrážka, žihľavka, pruritus a gastrointestinálne príznaky (vracanie, nevoľnosť a hnačka). Akútne systémové reakcie z precitlivenosti sa považovali za závažné na základe prítomnosti cyanózy alebo miery nasýtenia kyslíkom (SpO2) do 92 %, hypotenzie (systolický krvný tlak pod 90 mmHg
u dospelých) alebo synkopy. Štyria zo 16 (1 %, 4/285) pacientov zaznamenali celkovo 5 epizód
akútnych systémových reakcií z precitlivenosti, ktoré boli považované za závažné. Riziko výskytu akútnej systémovej reakcie z precitlivenosti je 6-násobne vyššie v indukčnej/titračnej fáze než v udržiavacej fáze.
Akútne systémové reakcie z precitlivenosti vyžadujú liečbu adrenalínom a okamžitú lekársku starostlivosť. Zariadenie na injekčné podávanie adrenalínu (autoinjektor alebo naplnená injekčná striekačka/pero) má byť predpísané pacientom užívajúcim tento liek. Pacienti majú byť poučení, aby počas liečby liekom Palynziq mali zariadenie na injekčné podávanie adrenalínu vždy pri sebe. Pacienti a pozorovatelia majú byť vyškolení, aby rozpoznali prejavy a príznaky akútnych systémových reakcií
z precitlivenosti, v núdzi vedeli správne použiť zariadenie na injekčné podávanie adrenalínu, a aby vedeli, že musia okamžite vyhľadať lekársku starostlivosť. Pri predpisovaní lieku Palynziq je potrebné znovu zvážiť riziká spojené s užívaním adrenalínu. Úplné informácie sú uvedené v informáciách
o lieku obsahujúcom adrenalín. Pri opakovaní miernej až stredne závažnej akútnej systémovej reakcie z precitlivenosti musia pacienti vyhľadať okamžitú lekársku starostlivosť a Palynziq sa musí natrvalo
vysadiť (pozri časť 4.3).
Vzhľadom na možnosť akútnych systémových reakcií z precitlivenosti je počas indukcie a titrácie potrebná premedikácia pred podaním každej dávky (pozri časť 4.2, Spôsob podávania). Pacienti musia byť poučení, aby premedikovali antagonistom receptora H1, antagonistom receptora H2 a antipyretikom. Počas obdobia udržiavacej liečby sa môže použitie premedikácie pre následné injekcie zvážiť na základe pacientovej znášanlivosti lieku Palynziq. Počas prinajmenšom prvých 6 mesiacov liečby, keď si pacient podáva injekciu samostatne (t. j. keď sa podávanie nekoná pod dohľadom zdravotníckeho personálu), musí byť po dobu najmenej 60 minút po každom podaní prítomný pozorovateľ (pozri časť 4.2, Spôsob podávania).
Iné systémové reakcie z precitlivenosti
Pri iných závažných systémových reakciách z precitlivenosti (napr. závažný angioedém, závažná sérová choroba) musia pacienti vyhľadať okamžitú lekársku starostlivosť a Palynziq sa musí natrvalo vysadiť (pozri časť 4.3).
Opätovné podanie lieku po akútnej systémovej reakcii z precitlivenosti
Predpisujúci lekár má zvážiť riziká a prínosy opätovného použitia lieku po vyriešení prvej miernej až stredne závažnej akútnej systémovej reakcie z precitlivenosti. Pri opätovnom podaní lieku sa musí prvá dávka podať s premedikáciou pod dohľadom zdravotníckeho pracovníka schopného zvládnuť akútne systémové reakcie z precitlivenosti. Predpisujúci lekár má pokračovať v používaní premedikácie alebo jej opätovné používanie zvážiť.
Titrácia dávkyačasnadosiahnutieodpovede
Čas do odpovede (dosiahnutie hladín fenylalanínu v krvi vo výške ≤ 600 mikromolov/l) sa u pacientov
líši. Čas na dosiahnutie odpovede sa pohyboval od 0,5 do 54 mesiacov. Väčšina pacientov (67 %) dosiahla odpoveď do 18 mesiacov celkovej liečby. Ďalších 8 % pacientov dosiahlo odpoveď na Palynziq po 18 mesiacoch liečby. Ak pacient nedosiahne klinicky významnú redukciu fenylalanínu v krvi po 18 mesiacoch liečby, pokračovanie liečby sa má prehodnotiť. Lekár sa môže s pacientom rozhodnúť, že bude pokračovať v liečbe liekom Palynziq u pacientov, u ktorých sa prejavia ďalšie priaznivé účinky (napríklad schopnosť zvýšiť príjem proteínov z bežnej stravy alebo zlepšenie neurokognitívnych príznakov).
Účinok lieku Palynziq na iné PEGylované injekčné lieky
PEGylované proteíny majú potenciál vyvolať imunitnú odpoveď. Pretože sa protilátky viažu na časť
PEG pegvaliázy, existuje možnosť väzby s inými PEGylovanými liečebnými prostriedkami a zvýšenej precitlivenosti na iné PEGylované injekcie. V štúdii, v ktorej bola dospelým pacientom s PKU podaná jednorazová dávka lieku Palynziq, došlo u dvoch pacientov, ktorým bola súčasne podaná injekcia suspenzie medroxyprogesterónacetátu obsahujúca PEG, k reakciám z precitlivenosti. Jeden z dvoch pacientov zaznamenal reakciu z precitlivenosti v 15. deň po jednorazovej dávke lieku
Palynziq, 15 minút po podaní medroxyprogesterónacetátu, a potom následne v 89. deň v priebehu 30 minút po ďalšej dávke injekčnej suspenzie medroxyprogesterónacetátu zaznamenal
akútnu systémovú reakciu z precitlivenosti. Druhý pacient mal reakciu z precitlivenosti v 40. deň po jednorazovej dávke lieku Palynziq v rámci 10 minút po injekčnej suspenzii medroxyprogesterónacetátu. V klinických štúdiách lieku Palynziq sa u väčšiny pacientov po liečbe liekom Palynziq vyvinuli IgM a IgG protilátky proti PEG (pozri časť 4.8). Vplyv protilátok proti PEG
na klinické účinky iných liekov obsahujúcich PEG nie je známy.
Hypofenylalaninémia
V klinických štúdiách sa u 46 % pacientov vyvinula hypofenylalaninémia (hladiny fenylalanínu v krvi
pod 30 mikromolov/l na dvoch po sebe nasledujúcich meraniach). Riziko výskytu hypofenylalaninémie je 2,1-násobne vyššie v udržiavacej fáze v porovnaní s indukčnou/titračnou fázou (pozri časť 4.8).
Hladinu fenylalanínu v krvi sa odporúča monitorovať raz za mesiac. V prípade hypofenylalaninémie je potrebné zvýšiť príjem bielkovín v potrave na príslušné hladiny a potom je v prípade potreby nutné znížiť dávku lieku Palynziq (pozri časť 4.2). U pacientov s hypofenylalaninémiou sa napriek adekvátnemu príjmu proteínu očakáva, že najúčinnejším spôsobom liečby hypofenylalaninémie bude zníženie dávky. Pacientov, u ktorých sa vyvynie hypofenylalaninémia, je potrebné sledovať
každé 2 týždne, až kým nebudú hladiny fenylalanínu v krvi v klinicky prijateľnom rozmedzí. Dlhodobé klinické dôsledky chronickej hypofenylalaninémie nie sú známe.
Na základe štúdií na zvieratách môže byť hypofenylalaninémia u gravidných žien s PKU liečených liekom Palynziq spojená s nežiaducimi účinkami na plod (pozri časti 4.6 a 5.3). Hladiny fenylalanínu v krvi sa majú monitorovať častejšie pred a počas gravidity.
Sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) na naplnenú injekčnú striekačku, t. j. v podstate
zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití lieku Palynziq u gravidných
žien. Štúdie na zvieratách preukázali maternálnu reprodukčnú toxicitu, ktorá bola spojená so zníženými koncentráciami fenylalanínu v krvi pod normálnou hladinou (pozri časť 5.3).
Nekontrolované hladiny fenylalanínu v krvi (hyperfenylalaninémia) pred a počas gravidity sú spojené so zvýšeným rizikom potratu, závažnými vrodenými defektmi (vrátane mikrocefálie a závažných srdcových malformácií), intrauterinnou retardáciou rastu plodu a budúcim intelektuálnym postihnutím s nízkym IQ. V prípade hypofenylalaninémie počas gravidity existuje riziko intrauterinnej retardácie
rastu plodu. Dodatočné riziko pre nenarodené dieťa spôsobené hypofenylalaninémiou nie je stanovené.
Hladiny fenylalanínu v materskej krvi musia byť prísne kontrolované v
rozmedzí 120 až 360 mikromolov/l ako pred, tak aj počas gravidity. Neodporúča sa podávať liek Palynziq počas gravidity, pokiaľ klinický stav ženy nevyžaduje liečbu pegvaliázou a alternatívne stratégie na kontrolu hladín fenylalanínu boli vyčerpané.
Dojčenie
Nie je známe, či sa pegvaliáza vylučuje do ľudského mlieka. Dostupné toxikologické údaje u zvierat
preukázali vylučovanie pegvaliázy do mlieka. U mláďat týchto zvierat nebola detegovaná systémová expozícia pegvaliázy. Riziko u dojčiat nemôže byť vylúčené. Vzhľadom na nedostatok údajov o ľudských subjektoch sa má liek Palynziq podávať dojčiacim ženám len vtedy, ak sa predpokladá, že potenciálny prínos prevažuje nad potenciálnym rizikom pre dojčatá.
Fertilita
K dispozícii nie sú žiadne údaje o ľudských subjektoch. Po podaní lieku Palynziq sa u normálnych
samíc potkanov pozorovali znížené implantácie (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Palynziq má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Reakcie z precitlivenosti, ktoré zahŕňajú príznaky ako je závrat alebo synkopa, môžu ovplyvniť schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Zhrnutie bezpečnostného profilu
V klinických štúdiách sa u väčšiny pacientov vyskytli reakcie v mieste vpichu (93 %), artralgia (86 %)
a reakcie z precitlivenosti (75 %). Medzi klinicky najvýznamnejšie reakcie z precitlivenosti patrí akútna systémová reakcia z precitlivenosti (6 %), angioedém (7 %) a sérová choroba (2 %) (pozri časti 4.3 a 4.4).
V klinických štúdiách sa najviac nežiaducich reakcií vyskytlo vo fázach indukcie a titrácie (čas pred dosiahnutím hladín fenylalanínu v krvi pod 600 mikromolov/l pri podávaní stabilnej dávky), čo sa zhodovalo s obdobím, keď boli titre protilátok IgM a anti-PEG najvyššie. S maturáciou imunitnej odozvy sa hodnoty postupne znižovali (pozri časť Popis vybraných nežiaducich reakcií).
Tabuľka so zoznamom nežiaducich reakcií
Tabuľka 2 poskytuje nežiaduce reakcie u pacientov liečených liekom Palynziq.
Frekvencie sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté
(≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Tabuľka 2: Nežiaduce reakcie u pacientov liečených liekom Palynziq
Trieda orgánových systémov
|
Nežiaduca reakcia
(Nežiaduce reakcie)
|
Indukcia/Titrácia1
|
Udržiavacia liečba
|
Poruchy krvi a lymfatického systému
|
Lymfadenopatia
|
Časté
(9,8 %)
|
Veľmi časté
(16 %)
|
Poruchy imunitného systému
|
Reakcia z precitlivenosti2
|
Veľmi časté
(65 %)
|
Veľmi časté
(60 %)
|
Akútna systémová reakcia z precitlivenosti³
|
Časté
(4,6 %)
|
Časté
(1,7 %)
|
Angioedém³
|
Časté
(5,6 %)
|
Časté
(2,8 %)
|
Sérová choroba³
|
Časté
(2,1 %)
|
Menej časté
(0,6 %)
|
Poruchy nervového systému
|
Bolesť hlavy
|
Veľmi časté
(42 %)
|
Veľmi časté
(47 %)
|
Poruchy dýchacej sústavy,
hrudníka a mediastína
|
Kašeľ2
|
Veľmi časté
(19 %)
|
Veľmi časté
(24 %)
|
Poruchy gastrointestinálneho
traktu
|
Bolesť brucha2,4
|
Veľmi časté
(19 %)
|
Veľmi časté
(30 %)
|
Nevoľnosť
|
Veľmi časté
(25 %)
|
Veľmi časté
(28 %)
|
Vracanie
|
Veľmi časté
(19 %)
|
Veľmi časté
(27 %)
|
Poruchy kože a podkožného
tkaniva
|
Alopécia
|
Časté
(6,7 %)
|
Veľmi časté
(21 %)
|
Urtikária
|
Veľmi časté
(25 %)
|
Veľmi časté
(24 %)
|
Vyrážka
|
Veľmi časté
(33 %)
|
Veľmi časté
(24 %)
|
Svrbenie
|
Veľmi časté
(25 %)
|
Veľmi časté
(23 %)
|
Erytém
|
Veľmi časté
(11 %)
|
Časté
(6,7 %)
|
Exfoliácia kože
|
Menej časté
(0,4 %)
|
Časté
(1,7 %)
|
Makulopapulárna vyrážka
|
Časté
(3,5 %)
|
Časté
(1,79 %)
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
|
Bolesť kĺbov³
|
Veľmi časté
(79 %)
|
Veľmi časté
(67 %)
|
Myalgia
|
Veľmi časté
(11 %)
|
Veľmi časté
(12 %)
|
Opuch kĺbov
|
Časté
(6,0 %)
|
Časté
(3,9 %)
|
Muskuloskeletálne
stuhnutie
|
Časté
(4,2 %)
|
Časté
(5,6 %)
|
Stuhnutosť kĺbov
|
Časté
(6,3 %)
|
Časté
(2,2 %)
|
Celkové poruchy a reakcie v
mieste podania
|
Reakcia v mieste vpichu³
|
Veľmi časté
(93 %)
|
Veľmi časté
(66 %)
|
Trieda orgánových systémov
|
Nežiaduca reakcia
(Nežiaduce reakcie)
|
Indukcia/Titrácia1
|
Udržiavacia liečba
|
Laboratórne a funkčné
vyšetrenia
|
Hypofenylalaninémia
|
Veľmi časté
(15 %)
|
Veľmi časté
(65 %)
|
Znížený faktor
C3 komplementu5
|
Veľmi časté
(66 %)
|
Veľmi časté
(73 %)
|
Znížený faktor
C4 komplementu5
|
Veľmi časté
(64 %)
|
Veľmi časté
(39 %)
|
Zvýšená hladina CRP s vysokou citlivosťou6
|
Veľmi časté
(17 %)
|
Veľmi časté
(13 %)
|
|
|
1 Indukčná a titračná fáza odráža čas pred dosiahnutím hladín fenylalanínu v krvi
pod 600 mikromolov/l za podávania stabilnej dávky. Po dosiahnutí hladín fenylalanínu v krvi pod 600 mikromolov/l za podávania stabilnej dávky bolo možné pacientov považovať za spôsobilých na zaradenie do udržiavacej fázy.
2 Reakcie z precitlivenosti zahŕňajú skupinu pojmov, vrátane akútnych systémových reakcií z precitlivenosti, a môžu sa prejaviť rôznymi príznakmi vrátane angioedému, sérovej choroby, vyrážky a žihľavky.
³ Pozri časť Osobitné upozornenia a opatrenia.
4 Bolesť brucha zahŕňa nasledujúce pojmy: bolesť brucha, bolesť hornej časti brucha a žalúdočné potiaže.
5 Zníženie faktorov C3/C4 komplementu je definované zmenou z normálnej alebo vysokej základnej východiskovej hodnoty komplementu na nízku neskoršiu hodnotu komplementu.
6 Odráža hladiny CRP (hsCRP) s vysokou citlivosťou nad hornou hranicou normálu (viac ako 0,287 mg/dl) počas 6 mesiacov.
Popis vybraných nežiaducich reakciíArtralgia a iné prejavy a príznaky spojené s kĺbmiV klinických štúdiách zaznamenalo 86 % pacientov epizódy konzistentné s artralgiou (vrátane bolesti chrbta, muskuloskeletálnej bolesti, bolesti končatín a bolesti krku). Artralgia sa vyskytla už pri prvej
dávke a môže sa vyskytnúť kedykoľvek počas liečby. Riziko výskytu artralgie je 3,1-násobne vyššie v
indukčnej/titračnej fáze než v udržiavacej fáze.
Závažná artralgia (silná bolesť, ktorá obmedzuje aktivity spojené s osobnou starostlivosťou v každodennom živote) sa vyskytla u 5 % pacientov. Epizódy artralgie sa riešili sprievodnými liekmi (napríklad nesteroidovými protizápalovými liekmi, glukokortikoidmi a/alebo antipyretikom), znížením dávky, prerušením liečby, vysadením liečby a 97 % epizód artralgie sa vyriešilo pred ukončením štúdie.
Pretrvávajúca artralgia (trvajúca najmenej 6 mesiacov) sa vyskytla u 7 % pacientov. Dávka sa nezmenila pri 96 % epizód a všetky epizódy pretrvávajúcej artralgie sa vyriešili bez následkov.
Reakcie v mieste vpichuReakcie v mieste vpichu boli hlásené u 93 % pacientov. Najčastejšie reakcie v mieste vpichu (vyskytujúce sa minimálne u 10 % pacientov) boli reakcia, erytém, podliatina, pruritus, bolesť, opuch, vyrážka, zatvrdnutie a žihľavka. Riziko reakcií v mieste vpichu je 5,2-násobne vyššie v indukčnej/titračnej fáze než v udržiavacej fáze.
Reakcie v mieste vpichu sa vyskytli už pri prvej dávke a môžu sa vyskytnúť kedykoľvek počas liečby. Priemerná dĺžka reakcií v mieste vpichu bola 10 dní a 99 % reakcií v mieste vpichu sa vyriešilo pred ukončením štúdie.
Zaznamenali sa tri reakcie v mieste vpichu, ktoré boli v súlade s granulomatóznymi kožnými léziami (každá reakcia sa vyskytla u jedného pacienta): granulomatózna dermatitída (vyskytla sa 15 mesiacov po liečbe liekom Palynziq a trvala 16 dní), xantogranulóm (vyskytol sa 12 mesiacov po liečbe liekom Palynziq a trval 21 mesiacov) nekrobióza lipoidica diabeticorum (vyskytla sa 9 mesiacov po liečbe liekom Palynziq a trvala 9 mesiacov). Nekrobióza lipoidica diabeticorum bola liečená steroidovými
injekciami a skomplikovala ju Pseudomonasova infekcia. Všetky reakcie v mieste vpichu boli vyriešené. Jeden pacient hlásil infekciu mäkkých tkanív spojenú s mezenterickou pannikulitídou, ktorá viedla k ukončeniu liečby.
Kožné reakcie (nie sú obmedzené na miesto vpichu) s trvaním ≥ 14 dní
V klinických štúdiách malo 47 % pacientov liečených liekom Palynziq kožné reakcie (ktoré sa neobmedzujú len na miesto vpichu) trvajúce najmenej 14 dní. Riziko kožných reakcií trvajúcich najmenej 14 dní je 1,5-násobne vyššie v indukčnej/titračnej fáze než v udržiavacej fáze.
Najčastejšie hlásené kožné reakcie (prinajmenšom 5 % pacientov) boli pruritus, vyrážka, erytém a žihľavka. Ďalšie hlásené reakcie zahŕňali exfoliáciu kože, generalizovanú vyrážku, erytematóznu vyrážku, makulopapulárnu vyrážku a pruritickú vyrážku. Priemerná (ŠO) dĺžka týchto reakcií
bola 63 (76) dní a 86 % týchto reakcií sa vyriešilo pred ukončením štúdie.
Imunogenicita
Všetci pacienti liečení liekom Palynziq vyvinuli trvalú celkovú odpoveď protilátok proti pegvaliáze
(TAb), pričom takmer všetci pacienti sa stali pozitívnymi do 4. týždňa. Priemerné titre TAb sa udržiavali dlhodobou liečbou (viac ako 3 roky po začiatku liečby). U takmer všetkých pacientov sa zistili protilátky triedy IgM proti fenylalanín amoniak-lyáze (PAL) do 2 mesiacov po začiatku liečby, pričom prítomnosť a priemerné titre sa časom postupne znižovali. Protilátky triedy IgM proti PAL sa zistili u takmer všetkých pacientov do 4 mesiacov a priemerné titre boli počas dlhodobej liečby relatívne stabilné. U takmer všetkých pacientov sa zistila odpoveď na protilátky triedy IgM a IgG proti PEG indukované pegvaliázou a priemerné titre dosiahli maximálnu hodnotu 1 až 3 mesiace po
začiatku liečby a u väčšiny pacientov sa vrátili na východiskovú úroveň 6 až 9 mesiacov po začiatku liečby. Neutralizačné protilátky (NAb) schopné inhibovať aktivitu enzýmu PAL sa zistili u väčšiny pacientov jeden rok po začiatku liečby a priemerné titre boli relatívne stabilné dlhodobou liečbou.
Všetci 16 pacienti, u ktorých sa vyskytli akútne systémové reakcie z precitlivenosti, mali počas alebo krátko po epizódach akútnej systémovej reakcie z precitlivenosti negatívne výsledky testov na IgE špecifickú pre pegvaliázu. Tieto reakcie boli v súlade s mechanizmom precitlivenosti III. typu sprostredkovanej imunitným komplexom a najčastejšie sa vyskytovali v počiatočných fázach liečby (počas obdobia indukcie a titrácie), keď v prvotnej imunitnej odpovedi dominovali odpovede na PEG IgM, PEG IgG a PAL IgM, pričom boli hladiny C3/C4 najnižšie. Počet reakcií z precitlivenosti sa počas udržiavacej fázy časom znížil, pretože výskyt týchto protilátok klesol a hladina C3/C4 sa vrátila na východiskovú hodnotu. Prítomnosť titrov protilátok nepredikovala reakcie z precitlivenosti.
V klinických štúdiách bola pozorovaná priama korelácia medzi plazmatickou expozíciou pegvaliázy a redukciou fenylalanínu v krvi. Plazmatická expozícia pegvaliázy bola primárne riadená imunitnou odpoveďou na pegvaliázu. Pacienti s nižšími titrami protilátok pre všetky analytické protilátky vrátane NAb mali vyššie koncentrácie pegvaliázy v dôsledku zníženia imunologicky sprostredkovaného klírensu pegvaliázy. Preto bola u týchto pacientov vyššia pravdepodobnosť vzniku hypofenylalaninémie. Pacienti s vyššími titrami protilátok vyžadovali vyššie dávky na prekonanie klírensu a na zníženie hladiny fenylalanínu v krvi. Avšak vzhľadom na značnú variabilitu titrov protilátok medzi pacientmi nebol žiadny špecifický titer protilátok prediktívny ohľadne dávky pegvaliázy potrebnej na dosiahnutie podstatnej redukcie fenylalanínu v krvi alebo ohľadne vzniku hypofenylalaninémie. Na začiatku liečby (menej ako 6 mesiacov po podaní lieku Palynziq), keď bol imunologicky sprostredkovaný klírens vysoký a dávky boli nízke, dosiahli pacienti s vyššími titrami protilátok menšiu redukciu fenylalanínu v krvi. Po dosiahnutí skorej imunitnej odpovede (viac
ako 6 mesiacov po podaní lieku Palynziq) a úprave dávky na kontrolu hladiny fenylalanínu v krvi pri dlhodobej liečbe pokračoval pokles hladín fenylalanínu v krvi u pacientov, ktorí pokračovali v liečbe (pozri časť 5.1). Titre protilátok boli pri dlhodobej liečbe stabilné a zvyšovanie dávky nebolo spojené so zvýšeným titrom protilátok. Takže priemerné dávkové hladiny sa tiež stabilizovali pomocou dlhodobej liečby s trvalým terapeutickým účinkom.
Pediatrická populáciaK dispozícii nie sú žiadne údaje u pediatrických pacientov mladších ako 16 rokov.
Dvanásť pacientov (11 pacientov zo štúdie 301) vo veku 16 až 18 rokov bolo liečených liekom
Palynziq. Nežiaduce reakcie boli typom a frekvenciou podobné reakciám u dospelých pacientov.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV klinických skúškach sa skúmali dávky pegvaliázy až do 150 mg/deň a po týchto vyšších dávkach sa nezistili žiadne špecifické prejavy alebo príznaky. Nezistili sa žiadne rozdiely v bezpečnostnom profile. Spôsob zvládania nežiaducich reakcií nájdete v častiach 4.4 a 4.8.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné liečivá pre tráviaci trakt a metabolizmus, enzýmy, ATC kód: A16AB19
Pegvaliáza je rAvPAL konjugovaná s lineárnym 20 kDa NHS PEG s pomerom substitúcie 28 až 44 molov polyméru/mol proteínu. Priemerná molekulová hmotnosť je približne 1 000 kDa, z čoho proteínová časť tvorí približne 248 kDa.
Mechanizmus účinkuPegvaliáza je PEGylovaný rekombinantný enzým fenylalanín amoniak-lyázy, ktorý premieňa
fenylalanín na amoniak a
trans-škoricovú kyselinu, ktoré sú primárne eliminované metabolizmom pečene.
Klinická účinnosť a bezpečnosťÚčinky lieku Palynziq na liečbu PKU boli preukázané u pacientov s fenylketonúriou v štúdii 301,
otvorenej štúdii na zahájenie liečby liekom Palynziq a v štúdii 302, doplnkovej štúdii na vyhodnotenie účinnosti.
Štúdia 301: Zahájenie liečby (indukcia a titrácia)Štúdia 301 bola otvorená randomizovaná (1:1) multicentrická štúdia pacientov s PKU s cieľom posúdiť bezpečnosť a znášanlivosť samotného lieku Palynziq v indukčnom/titračnom/udržiavacom dávkovom režime. 261 zaradených pacientov bolo vo veku 16 až 55 rokov (priemer: 29 rokov) s
priemernou východiskovou hladinou fenylalanínu v krvi vo výške 1 233 mikromolov/l. Pri zahájení
liečby bola u 253 (97 %) pacientov nedostatočná kontrola fenylalanínu v krvi (hladiny fenylalanínu v krvi nad 600 mikromolov/l) a 8 pacientov malo hladiny fenylalanínu v krvi do 600 mikromolov/l. Pacienti, ktorí boli predtým liečení sapropterínom museli ukončiť liečbu najmenej 14 dní pred prvou dávkou lieku Palynziq. Na začiatku prijímalo 149 (57 %) pacientov časť celkového proteínu z lekárskych potravín a 41 z 261 (16 %) pacientov bolo na diéte s obmedzeným obsahom fenylalanínu (definované ako príjem viac ako 75 % proteínu z lekárskych potravín). Pacienti zahájili liečbu liekom Palynziq indukčným režimom (2,5 mg raz týždenne počas 4 týždňov) a postupne boli titrovaní (zvýšená dávka a frekvencia) s cieľom dosiahnuť randomizovanú cieľovú dávku 20 mg raz denne alebo 40 mg raz denne. Čas trvania titrácie sa u pacientov líšil a bol založený na znášanlivosti
pacientov (až do 30 týždňov). Pre túto štúdiu bolo udržiavacie obdobie definované ako dávkovanie v randomizovaných dávkach 20 mg alebo 40 mg raz denne po dobu najmenej 3 týždňov.
Z 261 zaradených pacientov dosiahlo 195 (75 %) pacientov randomizovanú udržiavaciu dávku (103 pacientov v ramene s dávkou 20 mg raz denne, 92 pacientov v ramene s dávkou 40 mg raz denne). Stredná hodnota času, za ktorý pacienti v randomizovanom ramene s dávkou 20 mg raz denne dosiahli udržiavaciu dávku bola 10 týždňov (rozsah: 9 až 29 týždňov) a stredná hodnota času, za ktorý pacienti v randomizovanom ramene s dávkou 40 mg raz denne dosiahli udržiavaciu dávku
bola 11 týždňov (rozsah: 10 až 33 týždňov). Z 261 pacientov zaradených do
štúdie 301 pokračovalo 152 pacientov do kvalifikačného štádia zaradenia do štúdie 302 a 51 pacientov prešlo zo štúdie 301 priamo do dlhodobého predĺženého obdobia štúdie 302.
Štúdia 302: Hodnotenie účinnostiŠtúdia 302 bola doplnkovou štúdiou (zo štúdie 301) a zahŕňala: otvorené kvalifikačné obdobie; dvojito zaslepené, placebom kontrolované randomizované skúšobné obdobie vysadenia lieku (RDT) a
dlhodobé otvorené predĺžené obdobie.
Kvalifikačné obdobieCelkovo 164 pacientov, ktorí boli predtým liečení liekom Palynziq (152 pacientov zo
štúdie 301 a 12 pacientov z iných klinických štúdií lieku Palynziq), pokračovalo v liečbe po dobu do 13 týždňov.
Zo 164 pacientov, ktorí vstúpili do kvalifikačného obdobia štúdie 302, spĺňalo 86 pacientov kvalifikačné kritérium (dosiahlo minimálne 20 % priemerné zníženie hladiny fenylalanínu v krvi na základe porovnania východiskových údajov pred liečbou s údajmi po 13 týždňoch randomizovaných dávok) a pokračovalo v RDT, 12 pacientov liečbu vysadilo a 57 pacientov nevstúpilo do RDT a pokračovalo v liečbe liekom Palynziq v dlhodobom predĺženom období štúdie 302, kde im bola umožnené zvýšiť dávku.
Randomizované skúšobné obdobie vysadenia lieku (RDT)V dvojito zaslepenom, placebom kontrolovanom RDT boli pacienti randomizovaní v pomere 2:1, a buď pokračovali v prijímaní randomizovanej dávky (20 mg/deň alebo 40 mg/deň), alebo dostávali zodpovedajúce placebo po dobu 8 týždňov.
Primárnym koncovým ukazovateľom bola zmena hladín fenylalanínu v krvi z východiskovej hodnoty v RDT na hodnotu v 8. týždni RDT. Pacienti liečení liekom Palynziq boli schopní udržať zníženie fenylalanínu v krvi v porovnaní s pacientmi s placebom, ktorých hladiny fenylalanínu v krvi sa
po 8 týždňoch vrátili na východiskové hodnoty pred liečbou (p < 0,0001, pozri tabuľku 3).
Tabuľka 3: Stredná zmena koncentrácie fenylalanínuv krvi (mikromol/l) podľa metódy najmenších štvorcov z východiskovej hodnoty v RDT na hodnotu v 8. týždni RDT u pacientov s PKU (štúdia 302)Randomizova né rameno štúdie
| Koncentrácia fenylalanínu v krvi (mikromol/l) Stredná hodnota (ŠO)
| Stredná zmena podľa metódy najmenších štvorcov od
východiskovej
hodnoty v RDT
v
štúdii 302 do 8. týždňa
(95 % CI)
| Rozdiel medzi
liečbami vyjadrený ako stredná zmena podľa metódy najmenších štvorcov
(95 % CI) P-hodnota2
|
Východiskové hodnoty
pred liečbou1
| Východiskov é hodnoty v RDT
v štúdii 302
| 8. týždeň v RDT v štúdii 302
|
Palynziq 20 m g raz za deň³
| 1 450,2 (310,5)
n = 29
| 596,8 (582,8)
n = 29
| 553,0 (582,4)
n = 26
| −23,3 (−156,2; 109,7)
|
−973,0
(−1 204,2; −741,9)
p < 0,0001
|
Placebo 20 mg raz za deň4
| 1 459,1 (354,7)
n = 14
| 563,9 (504,6)
n = 14
| 1 509,0 (372,6)
n = 13
| 949,8 (760,4; 1 139,1)
|
Randomi
z
ova
né rameno štúdie
|
Koncentrácia fenylalanínu v krvi (mikromol/l) Stredná hodnota (ŠO)
|
Stredná zmena podľa metódy najmenších
štvorcov od
východiskovej
hodnoty v RDT v
štúdii 302 do 8. týždňa
(95 % CI)
|
Rozdiel medzi
liečbami
vyjadrený ako stredná zmena podľa metódy najmenších štvorcov
(95 % CI) P-hodnota
2
|
Východiskové hodnoty
pred liečbou
1
|
Východiskov
é hodnoty v RDT
v štúdii 302
|
8. týždeň v RDT v štúdii 302
|
Palynziq 40 m
g raz za deň³
|
1 185,8 (344,0)
n = 29
|
410,9 (440,0)
n = 29
|
566,3 (567,5)
n = 23
|
76,3
(−60,2; 212,8)
|
−588,5 (−830,1; −346,9) p < 0,0001
|
Placebo 40 mg raz za deň4
|
1 108,9 (266,8)
n = 14
|
508,2 (363,7)
n = 14
|
1 164,4 (343,3)
n = 10
|
664,8
(465,5; 864,1)
|
|
|
1 Hladina fenylalanínu v krvi pred zahájením liečby liekom Palynziq.
2 Založené na zmiešanom modeli s opakovanými meraniami (MMRM), kde sú liečebné rameno, návšteva a interakcia na základe liečebného ramena (časový profil fenylalanínu v krvi sa
posudzuje oddelene pre každé liečebné rameno) faktormi prispôsobujúcimi sa východiskovej koncentrácii fenylalanínu v krvi.
³ Deväť pacientov z liečebných ramien lieku Palynziq (20 mg/deň alebo 40 mg/deň) bolo
vylúčených z analýzy v 8. týždni: 4 pacienti nedokončili RDT kvôli nežiaducim udalostiam (1 pacient ukončil liečbu a 3 pacienti prešli do dlhodobej predĺženej fázy) a 5 pacienti nedokončili hodnotenie fenylalanínu v časovom okne pre 8. týždeň (43. až 56. deň).
4 Päť pacientov zo skupín s placebom (20 mg/deň alebo 40 mg/deň) bolo vylúčených z analýzy v 8. týždni:
1 pacient nedokončil RDT z dôvodu nežiaducej udalosti a prešiel do dlhodobej predĺženej fázy
a 4 pacienti nedokončili hodnotenie fenylalanínu v časovom okne pre 8. týždeň (43. až 56. deň).
Počas tohto obdobia sa tiež hodnotili príznaky nepozornosti a nálady. Počas 8 týždňov nebol pozorovaný žiadny rozdiel medzi nepozornosťou a náladou pacientov randomizovaných do skupiny s placebom a pacientov randomizovaných do skupín s liekom Palynziq.
Dlhodobé predĺžené obdobiePacienti pokračovali v liečbe liekom Palynziq v dlhodobom otvorenom predĺženom období a dávka bola upravená (5, 10, 20, 40 a 60 mg/deň) lekárom, aby sa dosiahlo ďalšie zníženie hladiny fenylalanínu v krvi a aby sa zachovali predtým dosiahnuté hladiny fenylalanínu.
Celková skúsenosť s liečbou zo štúdie 301 a štúdie 302V čase ukončenia štúdií bolo 188 z 261 pacientov liečených najmenej 1 rok, 4 pacienti dokončili liečbu a 69 pacientov ukončilo liečbu v prvom roku. Z týchto 188 pacientov bolo 165 pacientov liečených najmenej 2 roky, 22 pacientov liečbu ukončilo pred druhým rokom liečby a 9 pacientov ju ukončilo po 2 rokoch liečby. Zo 100 pacientov, ktorí liečbu ukončili, ju 40 pacientov ukončilo kvôli nežiaducej udalosti, 29 pacientov kvôli rozhodnutiu pacienta, 10 pacientov kvôli rozhodnutiu lekára
a 21 pacientov liečbu ukončilo z iných dôvodov (napr. pacienti nedostupní pre spätnú väzbu, gravidita
alebo odchýlka od protokolu).
Výsledky účinnosti v priebehu času sú uvedené v tabuľke 4 a na obrázku 1.
Hladiny fenylalanínu v priebehu časuPriemerné hladiny fenylalanínu v krvi sa znížili z východiskovej hodnoty 1 233 mikromolov/l
na 565 mikromolov/l v 12. mesiaci (n = 164) a 333 mikromolov/l v 24. mesiaci (n = 89). Tieto znížené hodnoty priemerných hladín fenylalanínu v krvi sa udržali do 36. mesiaca (371 mikromolov/l; n = 84) (pozri tabuľku 4 a obrázok 1). Priemerná zmena oproti východiskovej hodnote bola
−634 mikromolov/l v 12. mesiaci, −968 mikromolov/l v 24. mesiaci a −895 mikromolov/l v 36. mesiaci.
Nepozornosť spojená s ADHD a zmätenosť meraná pomocou pomocnej škály PKU-POMS v priebehu
času
Príznaky nepozornosti boli hodnotené pomocou doplnkovej stupnice hodnotiacej nepozornosť v rámci hodnotiacej stupnice ADHD (ADHD-RS IV), pomocou ktorej skúšajúci lekár hodnotí stupeň
nepozornosti. Doplnková stupnica hodnotiaca nepozornosť sa pohybuje v rozmedzí od 0 do 27, vyššie skóre znamená vyšší stupeň postihnutia a skóre pod 9 znamená, že pacient je asymptomatický (t. j. má skóre, ktoré je v normatívnom rozmedzí). Výsledky hodnotenia nepozornosti pomocou doplnkovej stupnice hodnotiacej nepozornosť spojenú s ADHD v priebehu času sú uvedené v
tabuľke 4. Priemerné zníženie hodnôt (naznačujúce zlepšenie) oproti východiskovým výsledkom hodnotenia pomocou ADHD RS bolo väčšie než minimálne klinicky významný rozdiel (MCID) u
dospelých s ADHD (definované ako zníženie o najmenej 5,2) v 18. mesiaci (n = 168, zníženie
o 5,3), 24. mesiaci (n = 159, zníženie o 5,9) a 36. mesiaci (n = 142, zníženie o 6,6). U pacientov s východiskovými hodnotami hodnotenia nepozornosti spojenej s ADHD > 9 (čo naznačuje príznaky nepozornosti na začiatku liečby) bolo priemerné zníženie hodnôt (naznačujúce zlepšenie) oproti východiskovým výsledkom hodnotenia pomocou ADHD RS väčšie než minimálne klinicky významný rozdiel (MCID) u dospelých s ADHD v 12. mesiaci (n = 80, zníženie o 7,8), v 18. mesiaci (n = 78, zníženie o 8,9), 24. mesiaci (n = 76, zníženie o 9,6) a 36. mesiaci (n = 66, zníženie o 10,7).
Príznaky nálady (domény zmätku, únavy, depresie, napätia spojeného s úzkosťou, vysokej energie a hnevu) boli hodnotené pomocou nástroja Profile of Mood States (POMS), ktorý bol upravený tak, aby bol špecifický pre PKU (PKU-POMS). Pomocná škála na meranie zmätenosti PKU-POMS (v rozmedzí od 0 do 12 bodov, pričom vyššie skóre označuje vyšší stupeň postihnutia) bola považovaná za najcitlivejšiu na zmeny hladín fenylalanínu v krvi. Výsledky získané pomocou pomocnej škály na meranie zmätenosti PKU-POMS v priebehu času sú uvedené v tabuľke 4. Priemerné zníženie hodnôt (naznačujúce zlepšenie) oproti východiskovým výsledkom hodnotenia pomocou pomocnej škály na meranie zmätenosti PKU-POMS bolo väčšie MCID (definované ako zníženie o aspoň jeden bod)
v 12. mesiaci (n = 130; zníženie o 1,6), 18. mesiaci (n = 123, zníženie o 2), 24. mesiaci (n = 116, zníženie o 2,2) a 36. mesiaci (n = 103, zníženie o 2,2).'
Zmeny v príjme proteínov z bežnej stravy v priebehu časuStredný príjem proteínov z bežnej stravy sa zvýšil do 12. mesiaca (zvýšenie o 4 g oproti východiskovej hodnote), 24. mesiaca (nárast o 14 g oproti východiskovej hodnote) a 36. mesiaca (zvýšenie o 20 g oproti východiskovej hodnote).
Obrázok 1: Stredná hodnota (ŠCH) hladín fenylalanínu v priebehu času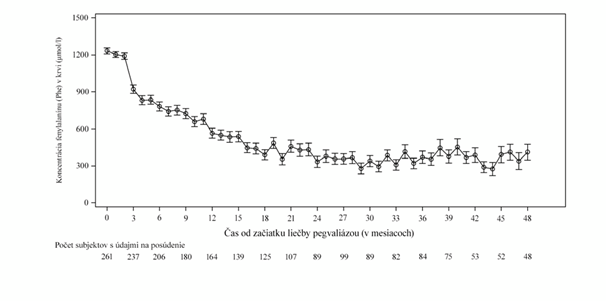
Tabuľka 4: Výsledky účinnosti u pacientov liečených liekom Palynziq v 12. mesiaci, 18. mesiaci, 24. mesiaci a 36. mesiaci
|
Východiskové hodnoty
|
12. mesiac
|
18. mesiac
|
24. mesiac
|
36. mesiac
|
Fenylalanín v krvi
1
|
N
|
261
|
1642
|
1252
|
892
|
842
|
Stredná hodnota (ŠO)
fenylalanínu v krvi
(mikromol/l)
|
1 233 (386)
|
565 (531)
|
390 (469)
|
333 (441)
|
371 (459)
|
Zmena v porovnaní s
východiskovými hodnotami
(mikromol/l)
Stredná hodnota (ŠO) Medián
|
-
|
−662 (588)
−634
|
−883, (565)
−920
|
−882 (563)
−968
|
−911 (563)
−895
|
Nepozornosť spojená s ADHD³, pomocná škála (hodnotenie vykonané skúšajúcim)
|
N
|
253
|
178
|
175
|
166
|
147
|
Stredná hodnota (ŠO)
hodnotenia nepozornosti
|
9,8 (6,1)
|
5 (4,9)
|
4,6 (4,7)
|
4,3 (4,6)
|
3,4 (4,5)
|
Zmena v porovnaní s
východiskovými hodnotami hodnotenia nepozornosti (n)4
Stredná hodnota (ŠO) Medián
|
-
|
n = 172
−4,7 (5,6)
−4
|
n = 168
−5,3 (5,9)
−5
|
n = 159
−5,9 (6,1)
−5
|
n = 142
−6,6 (6,1)
−5
|
Nepozornosť spojená s ADHD³, pomocná škála (hodnotenie vykonané skúšajúcim) s východiskovou hodnotou > 9
|
N
|
116
|
80
|
78
|
76
|
66
|
Stredná hodnota (ŠO)
hodnotenia nepozornosti
|
15,3 (4,1)
|
7,6 (4,9)
|
6,6 (5)
|
5,9 (4,9)
|
4,9 (5,3)
|
Zmena v porovnaní s východiskovými hodnotami hodnotenia nepozornosti (n)4
Stredná hodnota (ŠO) Medián
|
-
|
n = 80
−7,8 (5,5)
−7
|
n = 78
−8,9 (5,8)
−9
|
n = 76
−9,6 (5,9)
−10
|
n = 66
−10,7 (6,0)
−12
|
Z
m
ätenosť meraná pomocou pomocnej škály PKU-POMS³ (samohodnotené)
|
N
|
170
|
181
|
178
|
168
|
152
|
Stredná hodnota (ŠO)
hodnotenia zmätenosti
|
4 (2,7)
|
2,4 (2,1)
|
2,1 (2,2)
|
2 (2,1)
|
1,9 (2,1)
|
Zmena v porovnaní s
východiskovými hodnotami hodnotenia zmätenosti (n)4
Stredná hodnota (ŠO) Medián
|
-
|
n = 130
−1,6 (2,5)
−1
|
n = 123
−2 (2,8)
−2
|
n = 116
−2,2 (2,7)
−2
|
n = 103
−2,2 (3,0)
−2
|
Príjem proteínov z bežnej stravy (g)
|
N
|
250
|
160
|
111
|
83
|
80
|
Stredná hodnota (ŠO)
|
39 (28)
|
47 (29)
|
50 (27)
|
55 (27)
|
66 (27)
|
Zmena v porovnaní s
východiskovými hodnotami príjmu proteínu (n)4
Stredná hodnota (ŠO) Medián
|
-
|
n = 154
9 (25)
4
|
n = 106
12 (25)
9
|
n = 80
16 (27)
14
|
n = 78
24 (31)
20
|
|
|
1 Hodnoty fenylalanínu po východiskovej hodnote boli mapované na najbližšiu mesačnú návštevu (t. j. v rámci mesačného okna).
2 Odráža počet pacientov, ktorí dosiahli časový bod (mesiac 12/mesiac 18/mesiac 24/mesiac 36) v rámci liečby v čase ukončenia zbierania údajov a mali v tomto časovom bode plánované hodnotenie
fenylalanínu.
³ Hodnoty nepozornosti spojenej s ADHD/zmätenosti meranej pomocou pomocnej škály PKU-POMS
boli mapované na najbližšiu trojmesačnú návštevu (t. j. v rámci trojmesačného okna).
4 Zmena oproti východiskovej hodnote bola založená na subjektoch s dostupnými výsledkami meraní v oboch časových bodoch. Nie všetky subjekty mali na začiatku štúdie zaznamenané východiskové
skóre nepozornosti spojenej s ADHD a skóre zmätenosti merané pomocou POMS.
Z 253 pacientov s nedostatočnou kontrolou fenylalanínu v krvi (hladiny fenylalanínu v krvi nad 600 mikromolov/l) na začiatku štúdie 301:
· 54 % pacientov, 69 % pacientov a 72 % pacientov dosiahlo hladinu fenylalanínu v krvi
≤ 600 mikromolov/l o 12 mesiacov, 24 mesiacov a 36 mesiacov;
· 44 % pacientov, 62 % pacientov a 67 % pacientov dosiahlo hladinu fenylalanínu v krvi
≤ 360 mikromolov/l o 12 mesiacov, 24 mesiacov a 36 mesiacov.
Vplyv zníženia hladiny fenylalanínu v krvi na nepozornosť spojenú s ADHD a zmätenosť meraná pomocou pomocnej škály PKU-POMS
Analýza stupníc nepozornosti spojenej s ADHD a zmätenosti meranej pomocou pomocnej škály
PKU-POMS podľa zmeny hladiny fenylalanínu v krvi z východiskových kvartilov ukázali, že pacienti s najväčším znížením hladiny fenylalanínu zaznamenali najväčšie zlepšenie nepozornosti spojenej s ADHD a zmätenosti meranej pomocou pomocnej škály PKU-POMS.
Pediatrická populácia
K dispozícii nie sú žiadne údaje u pediatrických pacientov mladších ako 16 rokov.
Z 261 pacientov v štúdii 301 bolo pri zaraďovaní 11 pacientov vo veku 16 až 18 rokov.
Všetkých 11 pacientov malo na začiatku liečby nedostatočnú kontrolu fenylalanínu v krvi (hladiny fenylalanínu v krvi nad 600 mikromolov/l). Títo pacienti boli v tejto štúdii zaradení do rovnakého režimu indukcie/titrácie/udržiavania ako pacienti vo veku 18 rokov a starší. Priemerná (ŠO) zmena oproti východiskovej hodnote bola 20 (323) mikromolov/l v 12. mesiaci (n = 9), −460 (685) mikromolov/l v 24. mesiaci (n = 5) a −783 (406) mikromolov/l v (n = 5) v 36. mesiaci. Z 11 pacientov úvodne zaradených do štúdie 301 dosiahli 3 pacienti hladiny fenylalanínu v krvi ≤ 600 mikromolov/l do 12 mesiacov, 7 pacientov dosiahlo túto hodnotu do 24 mesiacov a 8 pacientov ju dosiahlo
do 36 mesiacov.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom Palynziq v jednej alebo viacerých podskupinách pediatrickej populácie na liečbu hyperfenylalaninémie (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Pegvaliáza je PEGylovaná rekombinantná fenylalanín amoniak-lyáza (rAvPAL), odvodená od cyanobaktérie Anabaena variabilis exprimovaná v Escherichia coli. Účelom PEGylácie rAvPAL je zníženie imunitného rozpoznania bakteriálneho proteínu rAvPAL a predĺženie biologického polčasu.
Farmakokinetika pegvaliázy vykazuje vysokú variabilitu u rôznych pacientov, ako aj u jedného pacienta v dôsledku heterogénnosti imunitnej odpovede u dospelých pacientov s PKU. Imunitná odpoveď ovplyvňuje klírens a čas na dosiahnutie rovnovážneho stavu. Imunitná odpoveď sa stabilizuje po 6 až 9 mesiacoch celkovej liečby.
Absorpcia
Po podaní jednej subkutánnej dávky (0,01, 0,03 alebo 0,1 mg/kg) sa pegvaliáza pomaly absorbuje s
mediánom tmax 3,5 až 4 dní (individuálny interval 2,5 až 7 dní). Biologická dostupnosť nie je ovplyvnená rôznymi miestami vpichu na tele (pozri časť 4.2). Absolútna biologická dostupnosť u ľudí nie je známa.
Distribúcia
Priemerná hodnota (ŠO) pre zdanlivý distribučný objem (Vz/F) v rovnovážnom stave po
dávkach 20 mg a 40 mg bola 26,4 l (64,8 l) a 22,2 l (19,7 l) v uvedenom poradí.
Biotransformácia
Po bunkovom vychytávaní sa predpokladá, že metabolizmus fenylalanín amoniak-lyázy (PAL) sa
prejaví katabolickými cestami a degraduje sa na malé peptidy a aminokyseliny; molekula PEG je metabolicky stabilná a očakáva sa, že bude oddelená od proteínu PAL a primárne eliminovaná filtráciou obličkami.
Eliminácia
Pegvaliáza sa po opakovanom podávaní primárne vylučuje imunitne sprostredkovanými
mechanizmami. V klinických štúdiách sa protilátky proti PAL, PEG a pegvaliáze identifikovali hlavne ako IgG a IgM. Pozorovali sa tiež pomerne nízke titre IgE. V udržiavacej fáze liečby sa ustálený stav očakáva 4 až 24 týždňov po začiatku podávania udržiavacej dávky. Priemerný biologický polčas (ŠO) pri dávke 20 mg a 40 mg bol 47,3 hodín (41,6 hodín) a 60,2 hodín (44,6 hodín). Jednotlivé hodnoty
pre biologický polčas sa pohybujú od 14 do 132 hodín. Očakáva sa, že molekula PEG bude primárne eliminovaná filtráciou obličkami.
Linearita/nelinearita
Počas zvyšovania dávky z 20 mg/deň na 40 mg/deň a zo 40 mg/deň na 60 mg/deň sa pozorovalo
zvýšenie expozície primerané dávke.
Špecifické populácie
Analýza údajov o koncentrácii pegvaliázy z klinických štúdií ukázala, že telesná hmotnosť, pohlavie a
vek nemali významný vplyv na farmakokinetiku pegvaliázy. Neboli vykonané žiadne klinické štúdie na vyhodnotenie účinku poškodenia obličiek alebo pečene na farmakokinetiku pegvaliázy.
Vplyv expozície
Analýza PK/PD za použitia údajov z fázy III preukázala inverzný vzťah expozície pegvaliázy
a odpovede na fenylalanín, ktorý by mohol byť ovplyvnený príjmom fenylalanínu zo stravy. Pri nižších hladinách plazmatickej koncentrácie Ctrough pegvaliázy < 10 000 ng/ml majú, pacienti s vyšším príjmom fenylalanínu v strave tendenciu mať vyššie hladiny fenylalanínu v krvi v porovnaní s pacientmi s rovnakou koncentráciou Ctrough a nižším príjmom fenylalanínu zo stravy, čo naznačuje saturáciu enzýmu (t. j. rAvPAL). Pri vysokých koncentráciách pegvaliázy Ctrough ≥ 10 000 ng/ml je
väčšina hladín fenylalanínu v krvi (97 %) ≤ 30 mikromolov/l, aj keď je príjem fenylalanínu v strave
vysoký. Z tohto dôvodu sa má zvážiť zníženie dávky pegvaliázy u pacientov, ktorí majú hypofenylalaninémiu napriek zodpovedajúcim hladinám príjmu proteínov (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
V štúdiách toxicity pegvaliázy s jednorazovou a opakovanou dávkou, ako aj v štúdiách vývojovej a reprodukčnej toxicity pegvaliázy sa pozorovalo zníženie prírastku telesnej hmotnosti spôsobené hladinou fenylalanínu v plazme zníženou pod normálnu hladinu u normálnych zvierat (opice, potkany a králiky). Znížený fenylalanín v plazme a znížený prírastok telesnej hmotnosti boli po ukončení liečby reverzibilné.
U opíc cynomolgus (makak javský) bol výskyt a závažnosť arteriálneho zápalu závislý od dávky a bol pozorovaný na širokej škále orgánov a tkanív pri klinicky relevantných expozíciách v štúdiách toxicity po 4 a 39 týždňoch opakovanej dávky. Arteriálny zápal pozorovaný v týchto štúdiách zahŕňal malé tepny a arterioly v širokej škále orgánov a tkanív a v miestach podkožného podania injekcie. Arteritída
bola pripísaná imunitne sprostredkovanej reakcii spojenej s chronickým podávaním cudzorodého proteínu zvieratám. Cievny zápal pozorovaný v týchto štúdiách bol reverzibilný po ukončení liečby.
U potkanov bola pri klinicky relevantných expozíciách v štúdiách toxicity po 4 a 26 týždňoch opakovanej dávky pozorovaná vakuolácia vo viacerých orgánoch a tkanivách závislá od dávky pripisovaná liečbe pegvaliázou, nebola však pozorovaná u opíc cynomolgus. V mozgu sa vakuolácia nepozorovala. Vakuoly vo všetkých tkanivách, s výnimkou obličiek, sa vyriešili alebo zmenšili do konca obdobia zotavovania, čo naznačuje čiastočnú reverzibilitu. Vakuolácia pozorovaná v týchto štúdiách nebola spojená s toxicitou súvisiacou s orgánmi, čo bolo stanovené klinickým chemickým rozborom/analýzou moču a histopatologickou analýzou. Klinický význam týchto zistení a funkčných dôsledkov nie je známy.
Nežiaduce reprodukčné a vývojové účinky pegvaliázy u potkanov a králikov boli závislé od dávky a zahŕňali zníženú rýchlosť implantácie, menšiu veľkosť vrhu, nižšiu hmotnosť plodu a zvýšené množstvo zmien plodu. Ďalšie zistenia u králikov zahŕňali zvýšené potraty, malformácie plodu a úmrtnosť embrya/plodu. Tieto zistenia sa vyskytli v dôsledku materskej toxicity (znížená telesná hmotnosť, znížená hmotnosť vaječníkov a znížená spotreba potravy) a boli spojené s výrazne zníženou hladinou fenylalanínu v krvi matky, nižšou než je normálna hladina u zvierat bez PKU. Vplyv
deplécie fenylalanínu u matky na výskyt embryonálnych vývojových účinkov nebol hodnotený.
V peri/postnatálnej štúdii pegvaliáza znížila hmotnosť mláďat, veľkosť vrhu a schopnosť prežitia mláďat počas laktácie a oneskorené pohlavné dozrievanie mláďat u potkanov pri denných subkutánnych dávkach 20 mg/kg. Účinky u mláďat boli spojené s maternálnou toxicitou.
Dlhodobé štúdie na zvieratách na hodnotenie karcinogénneho potenciálu, či štúdie na hodnotenie mutagénneho potenciálu sa s pegvaliázou neuskutočnili. Na základe mechanizmu účinku sa neočakáva, že pegvaliáza bude mať karcinogénne účinky.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Trometamol
Chlorid trometamolu
Chlorid sodný
trans-škoricová kyselina
Voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
Palynziq sa môže uchovávať v uzavretom zásobníku mimo chladničky (pri teplote do 25 °C) po dobu do 30 dní, pričom musí byť chránený pred zdrojmi tepla. Po vybratí z chladničky tento liek nesmiete do chladničky vrátiť.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C) Neuchovávajte v mrazničke.
Ďalšie informácie o skladovaní mimo chladničky (pri teplote do 25 °C) nájdete v časti 6.3.
6.5 Druh obalu a obsah balenia
1 ml naplnená injekčná striekačka vyrobená z borosilikátového skla typu I vybavená nerezovou ihlou veľkosti 26 G, bezpečnostným chráničom ihly, polypropylénovým piestom a zátkou na injekčnú striekačku z chlórbutylovej gumy s fluórpolymérovým poťahom. Automatický kryt na ihlu sa skladá z polykarbonátového priehľadného krytu na ihlu a pružiny z nehrdzavejúcej ocele vo vnútri krytu na ihlu. Po injekcii sa pružina natiahne, v dôsledku čoho ihlu zakryje kryt ihly.
Naplnenáinjekčnástriekačka2,5mg(bielypiest):Každá škatuľa obsahuje 1 naplnenú injekčnú striekačku.
Naplnenáinjekčnástriekačka10mg(zelenýpiest): Každá škatuľa obsahuje 1 naplnenú injekčnú striekačku.
Naplnenáinjekčnástriekačka20mg(modrýpiest):Každá škatuľa obsahuje 1 naplnenú injekčnú striekačku alebo 10 naplnených injekčných striekačiek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami. Po injekcii sa ihla automaticky zatiahne do krytu ihly, ktorý ju bezpečne zakryje.
Pokyny na prípravu a podanie lieku Palynziq sú uvedené v písomnej informácii pre používateľa.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBioMarin International Limited
Shanbally, Ringaskiddy
County Cork
Írsko
P43 R298
8. REGISTRAČNÉ ČÍSLAEU/1/19/1362/001 1 x 2,5 mg naplnená injekčná striekačka EU/1/19/1362/002 1 x 10 mg naplnená injekčná striekačka EU/1/19/1362/003 1 x 20 mg naplnená injekčná striekačka EU/1/19/1362/004 10 x 20 mg naplnené injekčné striekačky
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 03. mája 2019
10. DÁTUM REVÍZIE TEXTU09/2020
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.