
j sterilnej injekčnej ihly. Pri podaní do deltového svalu sa má použiť injekčná ihla s dĺžkou 2,54 cm so striedaním podávania do jedného alebo druhého deltového svalu. Pri podaní do sedacieho svalu sa má použiť injekčná ihla s dĺžkou 5,08 cm so striedaním podávania do jedného alebo druhého sedacieho svalu.
Prášok lieku OKEDI v naplnenej injekčnej striekačke sa má rekonštituovať vehikulom v pribalenej naplnenej injekčnej striekačke krátko pred podaním injekcie.
Rekonštitúcia sa má vykonať podľa pokynov na použitie, pozri časť 6.6. Nesprávna rekonštitúcia môže ovplyvniť správne dispergovanie prášku a v prípade podania sa počas prvých hodín môže objaviť vyššia hladina risperidónu (predávkovanie) a nižšia AUC celej terapeutickej dávky (poddávkovanie).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
U pacientov, ktorí sa predtým neliečili risperidónom sa pred začatím liečby liekom OKEDI odporúča stanoviť znášanlivosť perorálnym risperidónom (pozri časť 4.2). Pri posudzovaní potreby liečby
a prípadnej potreby ukončenia liečby sa má vziať do úvahy predĺžené uvoľňovanie lieku a dlhý polčas
eliminácie risperidónu.
Starší pacienti s demenciou
Zvýšená mortalita starších osôb s demenciou
Liek OKEDI sa neskúmal u starších pacientov s demenciou, preto sa v tejto skupine pacientov nemá používať. V metaanalýze 17 kontrolovaných skúšaní atypických antipsychotík vrátane risperidónu sa u starších pacientov s demenciou liečených atypickými antipsychotikami vyskytovala zvýšená mortalita v porovnaní s placebom. V placebom kontrolovaných skúšaniach perorálneho risperidónu v tejto populácii bola miera mortality u pacientov liečených risperidónom 4 % v porovnaní s 3,1 %
u pacientov používajúcich placebo. Pomer šancí (95 % presný interval spoľahlivosti) bol 1,21 (0,7;
2,1). Priemerný vek (rozmedzie) pacientov, ktorí zomreli, bol 86 rokov (rozmedzie 67 - 100). Údaje z dvoch rozsiahlych observačných štúdií preukázali, že u starších osôb s demenciou, ktorí sa liečili konvenčnými antipsychotikami, sa vyskytuje aj malé zvýšené riziko úmrtia v porovnaní s pacientmi, ktorí neboli liečení. K dispozícii nie je dostatok údajov na presnejší odhad rozsahu rizika a príčina zvýšeného rizika nie je známa. Rozsah, v akom môžu byť zistenia zvýšenej mortality v observačných štúdiách prisudzované antipsychotiku v porovnaní s niektorými charakteristikami pacientov, nie je jasný.
Súbežné použitie s furosemidom
V placebom kontrolovaných skúšaniach risperidónu u starších pacientov s demenciou bol pozorovaný vyšší výskyt mortality u pacientov liečených furosemidom spolu s risperidónom (7,3 %; priemerný vek 89 rokov, rozmedzie 75 - 97) v porovnaní s pacientmi liečenými samotným risperidónom (3,1 %; priemerný vek 84 rokov, rozmedzie 70 - 96) alebo samotným furosemidom (4,1 %; priemerný vek
80 rokov, rozmedzie 67 - 90). Zvýšenie mortality u pacientov liečených furosemidom spolu
s risperidónom sa pozorovalo v dvoch zo štyroch klinických skúšaní. Súbežné použitie risperidónu
s ďalšími diuretikami (najmä tiazidovými diuretikami používanými v nízkej dávke) sa s podobnými zisteniami nespájalo.
Nebol identifikovaný žiaden patofyziologický mechanizmu na vysvetlenie tohto zistenia a zároveň sa nepozoroval žiaden konzistentný model príčiny pozorovaného úmrtia. Napriek tomu sa má pred rozhodnutím o použití liečby postupovať s opatrnosťou a je potrebné zvážiť riziká a prínos tejto kombinácie alebo súbežnej liečby ďalšími silnými diuretikami. U pacientov užívajúcich iné diuretiká formou súbežnej liečby s risperidónom sa neobjavila žiadna zvýšená miera mortality. Bez ohľadu na liečbu bola celkovým rizikovým faktorom mortality dehydratácia a z tohto dôvodu je potrebné vyhnúť sa jej u starších pacientov s demenciou.
Cerebrovaskulárne nežiaduce reakcie
V randomizovaných, placebom kontrolovaných skúšaniach sa pri niektorých atypických
antipsychotikách v populácii pacientov s demenciou pozorovalo približne 3-násobne zvýšené riziko cerebrovaskulárnych nežiaducich reakcií (cerebrovascular adverse reactions, CVAE). Súhrnné údaje zo šiestich placebom kontrolovaných štúdií s risperidónom najmä u starších pacientov (vo veku
> 65 rokov) s demenciou preukázali, že sa CVAE (závažné aj nezávažné, zmiešané) vyskytli u 3,3 % (33/1 009) pacientov liečených risperidónom a 1,2 % (8/712) pacientov liečených placebom. Pomer šancí (95 % presný interval spoľahlivosti) bol 2,96 (1,34; 7,50). Mechanizmus tohto zvýšeného rizika nie je známy. Pri ostatných antipsychotikách alebo v inej populácii pacientov sa zvýšené riziko nedá vylúčiť.
U pacientov s rizikovými faktormi cievnej mozgovej príhody sa má liek OKEDI používať
s opatrnosťou.
Ortostatická hypotenzia
V dôsledku účinku ako alfablokátor, sa pri risperidóne môže objaviť (ortostatická) hypotenzia.
Niektoré prípady hypotenzie alebo ortostatickej hypotenzie boli hlásené počas klinického vývojového programu lieku OKEDI pri dávkach, ktoré sa pohybovali v rozmedzí 50 mg až 100 mg. Klinicky významná hypotenzia sa pozorovala po uvedení lieku na trh pri súbežnom používaní risperidónu
a antihypertenznej liečby. OKEDI sa má používať s opatrnosťou u pacientov s diagnostikovaným kardiovaskulárnym ochorením (napr. zlyhanie srdca, infarkt myokardu, abnormality vodivosti, dehydratácia, hypovolémia alebo cerebrovaskulárne ochorenie). Ak klinicky významná ortostatická hypotenzia pretrváva, má sa posúdiť riziko a prínos ďalšej liečby liekom OKEDI.
Leukopénia, neutropénia a agranulocytóza
Pri risperidóne boli hlásené príhody leukopénie, neutropénie a agranulocytózy. Počas dohľadu po
uvedení lieku na trh bola veľmi zriedkavo (< 1/10 000 pacientov) hlásená agranulocytóza.
Pacienti s klinicky významným nízkym počtom leukocytov (white blood cell count, WBC)
v anamnéze alebo s leukopéniou/neutropéniou indukovanou liekom musia byť počas prvých niekoľkých mesiacov liečby sledovaní a pri prvom prejave klinicky významného poklesu počtu leukocytov a absencii iných kauzálnych faktorov sa má zvážiť ukončenie liečby liekom OKEDI.
Pacienti s klinicky významnou neutropéniou majú byť pozorne sledovaní pre výskyt horúčky alebo iných príznakov alebo prejavov infekcie a ak sa tieto príznaky objavia, majú sa bezodkladne liečiť. U pacientov so závažnou neutropéniou (absolútny počet neutrofilov < 1 × 109/l) sa má liek OKEDI vysadiť a má sa u nich sledovať WBC až do zotavenia.
Tardívna dyskinéza (TD)/extrapyramidálne príznaky (EPS)
Liečivá s antagonistickými účinkami na dopamínové receptory boli spájané s indukciou tardívnej
dyskinézy (TD) charakterizovanej rytmickými mimovoľnými pohybmi najmä jazyka a/alebo tváre. Výskyt extrapyramídových príznakov (EPS) je rizikovým faktorom TD. Ak sa objavia prejavy a príznaky TD, má sa zvážiť vysadenie všetkých antipsychotík.
U pacientov, ktorí súbežne užívajú psychostimulanciá (napr. metylfenidát) a risperidón, sa odporúča opatrnosť, keďže pri úprave dávok jedného alebo oboch liečiv sa môžu objaviť EPS. Odporúča sa postupné vysadzovanie liečby psychostimulanciami (pozri časť 4.5).
Neuroleptický malígny syndróm (NMS)
Pri užívaní antipsychotík bol hlásený výskyt neuroleptického malígneho syndrómu (NMS), pre ktorý
je typická hypertermia, stuhnutosť svalov, autonómna nestabilita, zmenený stav vedomia a zvýšené
sérové hladiny kreatínfosfokinázy. Ďalšie prejavy môžu zahŕňať myoglobínúriu (rabdomyolýzu)
a akútne zlyhanie obličiek. V tomto prípade sa má liečba liekom OKEDI ukončiť.
Parkinsonova choroba a demencia s Lewyho telieskami
Pri predpisovaní lieku OKEDI pacientom s Parkinsonovou chorobou a demenciou s Lewyho
telieskami majú lekári zvážiť riziká a prínosy liečby. Užívanie risperidónu môže spôsobiť zhoršenie
Parkinsonovej choroby. V oboch skupinách sa môže objaviť zvýšené riziko neuroleptického
malígneho syndrómu ako aj zvýšená citlivosť na antipsychotiká; títo pacienti boli z klinických skúšaní vylúčení. Prejavy tejto zvýšenej citlivosti môžu okrem extrapyramídových príznakov zahŕňať aj zmätenosť, útlm alebo posturálnu nestabilitu s častými pádmi.
Hyperglykémia a diabetes mellitus
Počas liečby risperidónom bol hlásený výskyt hyperglykémie, diabetes mellitus a zhoršenie už
existujúceho diabetu. V niektorých prípadoch sa hlásilo predchádzajúce zvýšenie telesnej hmotnosti,
čo môže byť predisponujúcim faktorom. Súvislosť s ketoacidózou bola hlásená veľmi zriedkavo
a zriedkavo sa hlásila pri diabetickej kóme. Odporúča sa náležité klinické sledovanie v súlade
so zaužívanými usmernenia pre antipsychotiká. Pacientov liečených liekom OKEDI je potrebné sledovať pre výskyt príznakov hyperglykémie (ako je napr. polydipsia, polyúria, polyfágia a slabosť) a pacientov s diabetes mellitus je potrebné pravidelne sledovať pre možné zhoršenie kontroly hladiny glukózy.
Zvýšenie telesnej hmotnosti
Pri užívaní risperidónu bolo hlásené významné zvýšenie telesnej hmotnosti. Telesnú hmotnosť je
potrebné pravidelne sledovať.
Hyperprolaktinémia
Hyperprolaktinémia je častým nežiaducim účinkom liečby risperidónom. U pacientov s dôkazom
možných nežiaducich účinkov súvisiacich s prolaktínom (napr. gynekomastia, poruchy menštruačného cyklu, anovulácia, porucha fertility, znížené libido, erektilná dysfunkcia a galaktorea) sa odporúča vyhodnotenie plazmatickej hladiny prolaktínu.
Štúdie na tkaninových kultúrach naznačujú, že rast buniek v ľudských nádoroch prsníka môže byť stimulovaný prolaktínom. Hoci sa v klinických a epidemiologických štúdiách doteraz nepreukázala jasná súvislosť s podávaním antipsychotík, u pacientov s príslušnou anamnézou sa odporúča opatrnosť. U pacientov s už existujúcou hyperprolaktinémiou a u pacientov s možnými nádormi závislými od prolaktínu sa pri používaní lieku OKEDI vyžaduje opatrnosť.
Predĺženie QT intervalu
Veľmi zriedkavo bolo hlásené predĺženie QT intervalu. U pacientov s diagnostikovaným
kardiovaskulárnym ochorením, predĺžením QT intervalu v rodinnej anamnéze, bradykardiou alebo
poruchami elektrolytov (hypokaliémia, hypomagneziémia) a pri súbežnom používaní s liekmi,
o ktorých je známe, že predlžujú QT interval, sa má pri predpisovaní risperidónu postupovať
s opatrnosťou, pretože to môže zvýšiť riziko arytmogénnych účinkov.
Záchvaty
U pacientov s výskytom záchvatov v anamnéze alebo s inými ochoreniami, ktoré potenciálne znižujú
záchvatový prah, sa má liek OKEDI používať s opatrnosťou.
Priapizmus
Z dôvodu jeho účinku ako alfablokátor, sa pri liečbe liekom OKEDI môže objaviť priapizmus.
Regulácia telesnej teploty
Antipsychotikám sa pripisuje narušenie schopnosti tela znižovať vnútornú telesnú teplotu. Pri
predpisovaní lieku OKEDI pacientom, u ktorých sa vyskytnú stavy prispievajúce k zvýšeniu vnútornej telesnej teploty, napr. namáhavé cvičenie, vystavovanie sa extrémnemu teplu, súbežné užívanie liekov s anticholínergným účinkom alebo stav dehydratácie.
Antiemetický účinok
V predklinických štúdiách s risperidónom sa pozoroval antiemetický účinok. Ak sa objaví, môže
prekrývať prejavy a príznaky predávkovania určitými liečivami alebo ochorenia ako je napr. obštrukcia čriev, Reyov syndróm a nádor mozgu.
Tromboembólia žíl
Pri užívaní antipsychotík sa hlásili prípady tromboembólie žíl (venous thromboembolism, VTE).
Keďže sa u pacientov liečených antipsychotikami často objavujú získané rizikové faktory VTE, majú sa pred liečbou a počas liečby liekom OKEDI identifikovať všetky možné rizikové faktory VTE
a vykonať preventívne opatrenia.
Peroperačný syndróm vlajúcej dúhovky
U pacientov liečených risperidónom sa počas operácie sivého zákalu objavil peroperatívny syndróm
vlajúcej dúhovky (Intraoperative Floppy Iris Syndrome, IFIS) (pozri časť 4.8).
IFIS môže zvýšiť riziko očných komplikácií počas operácie a po nej. Pred operáciou má byť očný chirurg oboznámený so súčasným alebo predchádzajúcim užívaním liekov s antagonistickým účinkom na alfa1a-adrenergné receptory. Prípadný prínos prerušenia liečby blokátormi alfa1a-adrenergných receptorov pred operáciou sivého zákalu nebol stanovený a musí sa zvážiť oproti riziku prerušenia antipsychotickej liečby.
Precitlivenosť
Hoci sa má pred začiatkom liečby u pacientov, ktorí predtým neboli liečení risperidónom, stanoviť
znášanlivosť perorálne podávaného risperidónu, počas skúseností po uvedení lieku na trh boli pri parenterálne podávanom risperidóne u pacientov, ktorí predtým znášali perorálne podávaný risperidón, zriedkavo hlásené anafylaktické reakcie. Ak sa reakcie z precitlivenosti objavia, používanie lieku OKEDI sa má prerušiť a na základe klinickej potreby sa majú prijať všeobecné podporné opatrenia
a pacient má byť sledovaný do odznenia prejavov a príznakov.
Rekonštitúcia a podávanie
V prípade nesprávnej rekonštitúcie môže dôjsť k nedostatočnej účinnosti (pozri časti 4.2 a 6.6).
Je potrebné venovať pozornosť tomu, aby nedošlo k neúmyselnému podaniu lieku OKEDI do krvnej cievy alebo subkutánneho tkaniva. Ak bude podaný intravenózne, v dôsledku vlastnostní lieku OKEDI sa predpokladá, že sa okamžite vytvorí pevná hmota, ktorá zablokuje injekčnú ihlu. Následne sa
v mieste podania injekcie môže objaviť hematóm alebo krvácanie. V prípade subkutánneho podania
môže byť injekcia bolestivejšia a očakáva sa pomalšie uvoľňovanie risperidónu.
Ak dôjde k nesprávnemu podaniu dávky intravenóznou alebo subkutánnou cestou, dávka sa nemá
opakovane podať, pretože je náročné odhadnúť výslednú expozíciu lieku. Pacienta je potrebné
pozorne sledovať a klinicky vhodne liečiť do ďalšej plánovanej injekcie lieku OKEDI každých 28 dní.
4.5 Liekové a iné interakcie
Interakcie lieku OKEDI pri súbežnom podávaní s inými liekmi neboli systematicky posudzované. Údaje o interakciách uvedené v tejto časti sú založené na štúdiách s perorálnym risperidónom.
Interakcie súvisiace s farmakodynamikou
Lieky, o ktorých je známe, že predlžujú QT interval
Pri predpisovaní lieku OKEDI s liekmi, o ktorých je známe, že predlžujú QT interval, ako napr. antiarytmiká (napr. chinidín, dizopyramid, prokaínamid, propafenón, amiodarón, sotalol), tricyklické antidepresíva (napr. amitriptylín), tetracyklické antidepresíva (napr. maprotilín), niektoré antihistaminiká, iné antipsychotiká, niektoré antimalariká (napr. chinín a meflochín) a s liekmi spôsobujúcimi nerovnováhu elektrolytov (hypokaliémia, hypomagneziémia), bradykardiu alebo
s liekmi, ktoré inhibujú metabolizmus risperidónu v pečeni, sa odporúča opatrnosť. Tento zoznam je orientačný a neobsahuje všetky liečivá.
Centrálne účinkujúce lieky a alkohol
OKEDI sa má používať s opatrnosťou v kombinácii s inými centrálne účinkujúcimi látkami, predovšetkým s alkoholom, opiátmi, antihistaminikami a benzodiazepínmi, z dôvodu zvýšeného rizika sedácie.
Levodopa a dopamínové agonisty
OKEDI môže antagonizovať účinok levodopy a iných dopamínových agonistov. Ak sa táto kombinácia považuje za nevyhnutnú, najmä v posledných štádiách Parkinsonovej choroby, má sa predpísať najnižšia účinná dávka každej liečby.
Lieky s hypotenzným účinkom
Po uvedení lieku na trh sa pri súbežnom používaní risperidónu a antihypertenznej liečby pozorovala
klinicky významná hypotenzia.
Psychostimulanciá
Súbežné používanie psychostimulancií (napr. metylfenidát) s liekom OKEDI môže viesť
k extrapyramídovým príznakom po zmene jednej alebo oboch liečob (pozri časť 4.4).
Paliperidón
Súbežné používanie lieku OKEDI s paliperidónom sa neodporúča, pretože paliperidón je aktívnym metabolitom risperidónu a kombinácia týchto dvoch liečiv môže viesť k aditívnej expozícii aktívnej zložke.
Interakcie súvisiace s farmakokinetikou
Liek OKEDI sa metabolizuje najmä prostredníctvom cytochrómu P (CYP) 2D6 a v menšom rozsahu
prostredníctvom CYP3A4. Risperidón ako aj jeho aktívny metabolit 9-hydroxyrisperidón sú substrátmi P-glykoproteínu (P-gp). Látky, ktoré majú vplyv na aktivitu CYP2D6 alebo látky, ktoré silne inhibujú alebo indukujú aktivitu CYP3A4 a/alebo P-gp, môžu ovplyvniť farmakokinetiku aktívnej zložky risperidónu.
Silné inhibítory CYP2D6
Súbežné podávanie lieku OKEDI so silným inhibítorom CYP2D6 môže zvýšiť plazmatické koncentrácie risperidónu, ale v rozsahu menšom ako pri aktívnej zložke. Vyššie dávky silného inhibítora CYP2D6 (napr. paroxetín, pozri nižšie) môžu zvýšiť koncentrácie aktívnej zložky risperidónu. Predpokladá sa, že iné inhibítory CYP2D6, ako je chinidín, môžu podobným spôsobom ovplyvniť plazmatické koncentrácie risperidónu. Pri začatí alebo ukončení súbežnej liečby paroxetínom, chinidínom alebo iným silným inhibítorom CYP2D6, najmä vo vysokých dávkach, má lekár prehodnotiť dávkovanie lieku OKEDI.
Inhibítory CYP3A4 a/alebo P-gp
Súbežné podávanie lieku OKEDI so silným inhibítorom CYP3A4 a/alebo P-gp môže značne zvýšiť plazmatické koncentrácie aktívnej zložky risperidónu. Pri začatí alebo ukončení súbežnej liečby itrakonazolom alebo iným silným inhibítorom CYP3A4 a/alebo P-gp má lekár prehodnotiť dávkovanie OKEDI.
Induktory CYP3A4 a/alebo P-gp
Súbežné podávanie lieku OKEDI so silným inhibítorom CYP3A4 a/alebo P-gp môže značne zvýšiť plazmatické koncentrácie aktívnej zložky risperidónu. Pri začatí alebo ukončení súbežnej liečby karbazemapínom alebo iným silným induktorom CYP3A4 a/alebo P-gp má lekár prehodnotiť dávkovanie OKEDI. Induktory CYP3A4 vykazujú svoj účinok v závislosti od času a po začatí podávania môže trvať minimálne 2 týždne, kým sa dosiahne maximálny účinok. Naproti tomu, pri vysadení môže trvať minimálne 2 týždne, kým indukcia CYP3A4 ustúpi.
Lieky so silnou väzbou na bielkoviny
Pri súbežnom užívaní risperidónu a liekov so silnou väzbou na bielkoviny nedochádza ku klinicky
Pri súbežnom používaní liekov je potrebné prečítať si informácie o spôsobe metabolizmu a možnej
potrebe úpravy dávkovania v príslušných informáciách o lieku.
Príklady
Príklady liečiv, ktoré môžu s risperidónom potenciálne interagovať alebo u ktorých bolo preukázané,
že s risperidónom neinteragujú, sú uvedené nižšie:
Vplyv iných liekov na farmakokinetiku risperidónu
Antibakteriálne liečivá:
• Erytromycín, stredne silný inhibítor CYP3A4 a inhibítor P-gp, nemá vplyv na farmakokinetiku risperidónu a aktívnej zložky.
• Rifampicín, silný induktor CYP3A4 a induktor P-gp, znižuje plazmatické koncentrácie aktívnej zložky.
Anticholínesterázy:
• Donepezil a galantamín, substráty CYP2D6 a CYP3A4, nevykazujú klinicky významný vplyv na farmakokinetiku risperidónu a jeho aktívnej zložky.
Antiepileptiká:
• Preukázalo sa, že karbamazepín, silný induktor CYP3A4 a induktor P-gp, znižuje plazmatické koncentrácie aktívnej zložky. Podobné účinky sa môžu objaviť napr. s fenytoínom
a fenobarbitalom, ktoré tiež indukujú pečeňový enzým CYP3A4 ako aj P-glykoproteín.
• Topiramát mierne znižoval biologickú dostupnosť risperidónu, ale nie aktívnej zložky. Preto je nepravdepodobné, že by táto interakcia bola klinicky významná.
Antimykotiká:
• Itrakonazol, silný inhibítor CYP3A4 a inhibítor P-gp, pri dávkovaní 200 mg/deň znížil plazmatické koncentrácie aktívnej zložky o približne 70 % pri dávkach risperidónu 2 až
8 mg/deň.
• Ketokonazol, silný inhibítor CYP3A4 a inhibítor P-gp, pri dávkovaní 200 mg/deň zvýšil
plazmatické koncentrácie risperidónu a znížil plazmatické koncentrácie 9-hydroxyrisperidónu. Antipsychotiká:
• Fenotiazíny môžu zvyšovať plazmatické koncentrácie risperidónu, ale nie aktívnej zložky.
Antivirotiká:
• Inhibítory proteázy: K dispozícii nie sú žiadne údaje z formálnej štúdie; keďže je však ritonavir silným inhibítorom CYP3A4 a slabým inhibítorom CYP2D6, ritonavir a inhibítory proteázy posilnené ritonavirom potenciálne zvyšujú koncentrácie aktívnej zložky risperidónu.
Betablokátory:
• Niektoré betablokátory môžu zvyšovať plazmatické koncentrácie risperidónu, ale nie aktívnej
zložky.
Blokátory kalciového kanála:
• Verapamil, stredne silný inhibítor CYP3A4 a inhibítor P-gp, zvyšuje plazmatické koncentrácie
risperidónu a aktívnej zložky.
Liečivá s účinkom na gastrointestinálny trakt:
• Antagonisty H2-receptoru: Cimetidín a ranitidín, slabé inhibítory CYP2D6 a CYP3A4, zvýšili biologickú dostupnosť risperidónu, ale len nepatrne biologickú dostupnosť aktívnej zložky.
SSRI a tricyklické antidepresíva:
• Fluoxetín, silný inhibítor CYP2D6, zvyšuje plazmatické koncentrácie risperidónu, ale v menšom rozsahu koncentrácie aktívnej zložky.
• Paroxetín, silný inhibítor CYP2D6, zvyšuje plazmatické koncentrácie risperidónu, ale
v dávkach do 20 mg/deň v menšom rozsahu koncentrácie aktívnej zložky. Vyššie dávky paroxetínu však môžu zvyšovať koncentrácie aktívnej zložky risperidónu.
• Tricyklické antidepresíva môžu zvyšovať plazmatické koncentrácie risperidónu, ale nie aktívnej zložky. Amitryptilín nemá vplyv na farmakokinetiku risperidónu ani aktívnej antipsychotickej zložky.
• Sertralín, slabý inhibítor CYP2D6, a fluvoxamín, slabý inhibítor CYP3A4, v dávkach do
100 mg/deň neboli spojené s klinicky významnými zmenami koncentrácií aktívnej zložky
risperidónu. Dávky sertralínu alebo fluvoxamíu vyššie ako 100 mg/deň však môžu zvýšiť
koncentrácie aktívnej zložky risperidónu.
Vplyv risperidónu na farmakokinetiku iných liekov
Antiepileptiká:
• Risperidón nevykazuje klinicky významný vplyv na farmakokinetiku valproátu alebo topiramátu.
Antipsychotiká:
• Aripiprazol, substrát CYP2D6 a CYP3A4: Tablety ani injekcie s obsahom risperidónu nemali vplyv na farmakokinetiku aripiprazolu a jeho aktívneho metabolitu dehydroaripiprazolu.
Digitálisové glykozidy:
• Risperidón nevykazuje žiaden klinicky významný vplyv na farmakokinetiku digoxínu.
Lítium:
• Risperidón nevykazuje žiaden klinicky významný vplyv na farmakokinetiku lítia.
Súbežné používanie risperidónu s furosemidom
Informácie o zvýšenej mortalite u starších pacientov s demenciou, ktorí súbežne užívajú furosemid,
pozri časť 4.4.
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii nie sú žiadne alebo len obmedzené údaje o používaní risperidónu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3).
U novorodencov vystavených účinku antipsychotík (vrátane risperidónu) počas tretieho trimestra gravidity sa vyskytuje riziko nežiaducich reakcií vrátane extrapyramídových príznakov a/alebo príznakov z vysadenia, ktorých závažnosť a trvanie po pôrode môže byť rôzna. Objavili sa hlásenia agitácie, hypertónie, hypotónie, trasu, somnolencie, respiračnej tiesne alebo poruchy kŕmenia. Z tohto dôvodu je potrebné novorodencov starostlivo sledovať.
OKEDI sa nemá používať počas gravidity, pokiaľ to nie je jednoznačne nevyhnutné. Dojčenie
Fyzikálno-chemické údaje naznačujú, že sa risperidón/metabolity vylučujú do materského mlieka.
Riziko u dojčeného dieťaťa nemôže byť vylúčené.
Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu liekom OKEDI sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Risperidón zvyšuje hladinu prolaktínu. Hyperprolaktinémia môže potlačovať hypotalamický GnRH,
čo môže mať za následok zníženú sekréciu gonadotropínu štítnou žľazou. To môže naopak spôsobiť inhibíciu reprodukčnej funkcie narušením steroidogenézy v gonadálnych bunkách u žien a aj mužov.
V predklinických štúdiách sa nezaznamenali žiadne významné účinky.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
OKEDI má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje kvôli možným účinkom na nervový systém a zrak (pozri časť 4.8). Pacienti majú byť preto poučení, aby neviedli vozidlá ani neobsluhovali stroje, pokiaľ nepoznajú svoju individuálnu citlivosť.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profiluNajčastejšie hlásené nežiaduce reakcie, ktoré sa hlásili v klinickom skúšaní fázy 3, sú: zvýšená hladina
prolaktínu v krvi (11,7 %), hyperprolaktinémia (7,2 %), akatízia (5,5 %), bolesť hlavy (4,8 %), somnolencia (4,1 %), zvýšenie telesnej hmotnosti (3,8 %), bolesť v mieste podania injekcie (3,1 %) a závrat (3,1 %).
Tabuľkový zoznam nežiaducich reakciíNasledujúce nežiaduce reakcie boli všetky hlásené pri risperidóne v klinických skúšaniach a počas
skúseností po uvedení lieku na trh s kategóriou frekvencie odhadnutou z klinických skúšaní
s risperidónom.
Použitá terminológia a frekvencie sú nasledujúce: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10);
menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000) a veľmi zriedkavé
(< 1/10 000).
V rámci každej skupiny frekvencie sú nežiaduce účinky zoradené v poradí klesajúcej závažnosti.
Trieda orgánových systémov
| Nežiaduca lieková reakcia
|
Frekvencia
|
Veľmi časté
|
Časté
|
Menej časté
|
Zriedkavé
| Veľmi
zriedkavé
|
Infekcie
a nákazy
|
| pneumónia, bronchitída, infekcia horných dýchacích ciest, sinusitída, infekcia močových ciest, infekcia ucha, chrípka
| infekcia dýchacích ciest, cystitída, infekcia oka, tonzilitída, onychomykóza, lokalizovaný infekčný zápal kože a podkožného tkaniva, vírusová infekcia, akrodermatitída
| infekcia
|
|
Poruchy krvi a lymfatické
ho systému
|
|
| neutropénia,
znížený počet leukocytov, trombocytopénia, anémia, znížené hodnoty hematokritu,
zvýšený počet
eozinofilov
| agranulocytózac
|
|
Poruchy imunitného systému
|
|
| precitlivenosť
| anafylaktická reakciac
|
|
Poruchy endokrinnéh o systému
|
| hyperprolaktiném iaa
|
| neprimeraná sekrécia antidiuretického
hormónu, glykozúria
|
|
Trieda orgánových systémov
|
Nežiaduca lieková reakcia
|
Frekvencia
|
Veľmi časté
|
Časté
|
Menej časté
|
Zriedkavé
|
Veľm
i
zriedkavé
|
Poruchy metabolizmu a výživy
|
|
zvýšenie telesnej hmotnosti, zvýšená chuť do
jedla, znížená chuť do jedla
|
diabetes mellitus, hyperglykémia, polydipsia,
zníženie telesnej
hmotnosti, anorexia, zvýšenie cholesterolu
v krvi, zvýšenie hladiny triglyceridov
v krvi
|
nadmerná hydratáciac, hypoglykémia, hyperinzulinémiac,
|
diabetická ketoacidóza
|
Psychické poruchy
|
nespavosťd
|
poruchy spánku, agitovanosť, depresia, úzkosť
|
mánia, stav zmätenosti, zníženie libida, nervozita, nočné mory
|
katatónia, somnambulizmus, poruchy príjmu potravy súvisiace so spánkom, emocionálna otupenosť, anorgazmia
|
|
Poruchy nervového systému
|
parkinsonizmu sd, bolesť
hlavy
|
sedácia/somnolen cia, akatíziad, dystóniad, závrat, dyskinéziad, tras
|
tardívna dyskinéza, mozgová ischémia, strata
vedomia,
kŕčed, synkopa, psychomotorická hyperaktivita, porucha rovnováhy, ťažkosti
s koordináciou,
posturálny závrat, porucha pozornosti, dysartria, dysgeúzia, hypoestézia, parestézia
|
neuroleptický malígny syndróm, cerebrovaskulárna porucha, diabetická
kóma, kolísanie hlavy, strata
odpovede na stimuly, znížená úroveň vedomia
|
|
Poruchy oka
|
|
rozmazané videnie, konjunktivitída
|
svetloplachosť, syndróm suchého oka, zvýšené slzenie, očná
hyperémia
|
glaukóm, porucha pohybu očí, gúľanie očí, tvorba chrást na okraji
očného viečka,
syndróm vlajúcej dúhovky (peroperatívny)c
|
|
Poruchy ucha
a labyrintu
|
|
|
vertigo, tinitus,
bolesť ucha
|
|
|
Trieda orgánových systémov
|
Nežiaduca lieková reakcia
|
Frekvencia
|
Veľmi časté
|
Časté
|
Menej časté
|
Zriedkavé
|
Veľm
i
zriedkavé
|
Poruchy srdca
a srdcovej
činnosti
|
|
tachykardia
|
fibrilácia predsiení, atrioventrikulárny
blok, porucha vodivosti,
elektrokardiogra
m s predĺženým QT intervalom, bradykardia, abnormálny elektrokardiogra m, palpitácie
|
sínusová arytmia
|
|
Poruchy ciev
|
|
hypertenzia
|
hypotenzia, ortostatická hypotenzia, nával horúčavy
|
pľúcna embólia, trombóza žíl
|
|
Poruchy dýchacej sústavy, hrudníka
a mediastína
|
|
dyspnoe, faryngolaryngeál na bolesť, kašeľ, kongescia nosu
|
kongescia dýchacích ciest, sipot, epistaxa
|
syndróm spánkového apnoe, hyperventilácia, šelest, aspiračná
pneumónia,
kongescia pľúc, dysfónia, porucha dýchania
|
|
Poruchy gastrointesti nálneho
traktu
|
|
bolesť brucha, abdominálny diskomfort,
vracanie,
nevoľnosť, zápcha, hnačka, dyspepsia, sucho v ústach, bolesť zubov
|
inkontinencia stolice, fekalóma, gastroenteritída,
dysfágia,
flatulencia
|
pankreatitída, obštrukcia čriev, opuch jazyka,
cheilitída
|
ileus
|
Poruchy
pečene
a žlčových
ciest
|
|
|
zvýšená hladina
transamináz, zvýšená hladina gamaglutamyltra nsferázy, zvýšená hladina pečeňových
enzýmov
|
žltačka
|
|
Poruchy
kože
a podkožnéh
o tkaniva
|
|
vyrážka, erytém
|
urtikária, pruritus, alopécia hyperkeratóza, ekzém, suchá koža, zmena
farby kože, akné, seboroickác dermatitída, poruchy kože, kožné lézie
|
lieková erupcia, lupiny
|
angioedém
|
Trieda orgánových systémov
|
Nežiaduca lieková reakcia
|
Frekvencia
|
Veľmi časté
|
Časté
|
Menej časté
|
Zriedkavé
|
Veľm
i
zriedkavé
|
Poruchy kostrovej a svalovej
sústavy
a spojivovéh o tkaniva
|
|
svalové kŕče, muskuloskeletáln a bolesť, bolesť
chrbta, artralgia
|
zvýšená hladina kreatínfosfokináz y v krvi,
abnormálny
postoj, stuhnutosť kĺbov, opuch kĺbov, svalová slabosť, bolesť
šije
|
rabdomyolýza
|
|
Poruchy
obličiek
a močových
ciest
|
|
inkontinencia
moču
|
polakizúria, retencia moču, dyzúria
|
|
|
Stavy
v gravidite,
v šestonedelí a perinatáln om období
|
|
|
|
syndróm z vysadenia lieku u novorodencovc
|
|
Poruchy reprodukčné ho systému
a prsníkov
|
|
|
erektilná dysfunkcia, porucha ejakulácie,
amenorea,
porucha menštruácied, gynekomastia, galaktorea, sexuálna dysfunkcia, bolesť pŕs, nepríjemný pocit v prsiach, vaginálny výtok
|
priapizmusc, oneskorená menštruácia, bolestivý opuch
pŕs, zväčšenie pŕs,
výtok z pŕs
|
|
Celkové poruchy
a reakcie v mieste podania
|
|
opuchd, pyrexia,
bolesť na hrudníku, asténia, únava, bolesť
|
opuch tváre,
zimnica, zvýšená telesná teplota, abnormálna chôdza, smäd, nepríjemný pocit v hrudníku,
malátnosť,
nezvyčajný pocit,
diskomfort
|
hypotermia,
znížená telesná teplota, pocit chladu v končatinách, príznaky
z vysadenia lieku, zdureninac
|
|
Úrazy, otravy
a komplikáci
e liečebného
postupu
|
|
pád, bolesť
v mieste podania injekcie, opuch
v mieste podania injekcie
|
bolesť spojená
s podaním lieku, diskomfort
v mieste podania injekcie, erytém
v mieste podania injekcie
|
|
|
a Hyperprolaktinémia može v niektorých prípadoch viesť ku gynekomastii, poruchám menštruácie, amenoree, anovulácii, galaktoree, poruchám fertility, zníženému libidu, erektilnej dysfunkcii.
|
Trieda orgánových systémov
|
Nežiaduca lieková reakcia
|
Frekvencia
|
Veľmi časté
|
Časté
|
Menej časté
|
Zriedkavé
|
Veľm
i
zriedkavé
|
b V placebom kontrolovaných štúdiách bol diabetes mellitus hlásený u 0,18 % účastníkov liečených risperidónom v porovnaní s podielom 0,11 % v skupine s placebom. Celková miera výskytu vo všetkých klinických skúšaniach bola 0,43 % u všetkých účasntíkov liečených risperidónom.
c Nebolo pozorované v klinických štúdiách s risperidónom, ale bolo pozorované po uvedení risperidónu na trh.
d Môže sa objaviť extrapyramidálna porucha: Parkinsonizmus (hypersekrécia slín, muskuloskeletálna
stuhnutosť, parkinsonizmus, slintanie, svalová stuhnutosť, bradykinéza, hypokinéza, maskovitý výraz tváre, svalové napätie, akinéza, stuhnutie šije, stuhnutie svalov, parkinsonovský postoj, abnormálny glabelárny reflex, parkinsonovský pokojový tras), Akatízia (akatízia, nepokoj, hyperkinéza, syndróm nepokojných nôh), tras, Dyskinéza (dyskinéza, svalové zášklby, choreoatetóza, atetóza a myoklonus), dystónia. Dystónia zahŕňa dystóniu, hypertóniu, tortikolis, mimovoľné svalové kontrakcie, svalové kontrakcie, blefarospazmus, okulogyráciu, paralýzu jazyka, kŕče v tvári, laryngospazmus, myotóniu, opistotonus, orofaryngeálny spazmus, pleurototonus, spazmus jazyka a trizmus. Je potrebné poznamenať, že je uvedené širšie spektrum príznakov, ktoré nevyhnutne nemusia mať extrapyramidálny pôvod. Insomnia zahŕňa úvodnú nespavosť, strednú nespavosť. Kŕče zahŕňajú kŕče typu grand mal. Porucha menštruačného cyklu zahŕňa nepravidelnú menštruáciu, oligomenoreu. Opuch zahŕňa generalizovaný opuch, periférny opuch, jamkový opuch.
|
Opis
vybraných
n
ežiaducich
reakcií
Reakcie v mieste podania injekcie
Najčastejšie hlásenou reakciou v mieste podania injekcie bola bolesť V štúdii fázy 3 nahlásilo
14 z 386 pacientov (3,6 %) 18 udalostí bolestivej reakcie na podanie injekcie po celkovo 2 827 podaniach injekcie (0,6 %) lieku OKEDI. Závažnosť väčšiny týchto reakcií bola hlásená ako mierne až stredná. Frekvencia a intenzita bolesti v mieste podania injekcie hodnotená účastníkmi mala tendenciu sa postupom času zmierňovať.
Poruchy srdca a srdcovej činnostiSyndróm posturálnej ortostatickej tachykardie.
Skupinové účinkyPo uvedení risperidónu na trh boli hlásené veľmi zriedkavé prípady ventrikulárnej arytmie sprevádzané predĺžením QT intervalu (ventrikulárne fibrilácie, ventrikulárna tachykardia), náhle úmrtie, zástava srdca a
torsade de pointes.
Tromboembólia žílPri antipsychotikách boli hlásené prípady tromboembólie žíl vrátane pľúcnej embólie a prípadov
hlbokej žilnej trombózy (s neznámou frekvenciou).
Zmeny telesnej hmotnostiÚdaje z 12-týždňového dvojito zaslepeného, placebom kontrolovaného skúšania naznačili, že bolo priemerné zvýšenie telesnej hmotnosti oproti východiskovej hodnote 1,4 (-8 až 18) kg po liečbe liekom OKEDI 75 mg, 0,8 (-8 až 47) kg po liečbe liekom OKEDI 100 mg a 0,2 (-12 až 18) kg po liečbe placebom.
Ďalšie informácie o osobitných skupinách pacientovPediatrickí pacientiO účinnosti a bezpečnosti lieku OKEDI u detí nie sú k dispozícii žiadne informácie.
Starší pacienti
O účinnosti a bezpečnosti lieku OKEDI u starších pacientov so schizofréniou alebo demenciou sú
k dispozícii len obmedzené informácie. V klinických štúdiách perorálneho risperidónu sa u starších pacientov s demenciou hlásil prechodný ischemický záchvat s frekvenciou výskytu 1,4 % a cievna mozgová príhoda s frekvenciou výskytu 1,5 % v porovnaní s ostatnými dospelými. Okrem toho boli hlásené nasledujúce nežiaduce liekové reakcie s frekvenciou výskytu ≥ 5 % u starších pacientov
s demenciou a najmenej dvojnásobne vyššou frekvenciou pozorovanou v populáciách ostatných dospelých: infekcia močových ciest, periférny opuch, letargia a kašeľ.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.'
4.9 PredávkovaniePríznakyVo všeobecnosti sa hlásili prejavy a príznaky, ktoré boli dôsledkom zhoršenia známych
farmakologických účinkov risperidónu. Tieto zahŕňajú ospalosť a sedáciu, tachykardiu a hypotenziu a extrapyramídové príznaky. V prípade predávkovania bolo hlásené predĺženie QT intervalu a kŕče. V súvislosti s predávkovaním risperidónom a paroxetínom bolo hlásené
torsade de pointes.
V prípade akútneho predávkovania sa má vzať do úvahy možnosť vplyvu viacerých liekov.
LiečbaMá sa zaistiť a udržať priechodnosť dýchacích ciest a adekvátne okysličenie a ventilácia. Ihneď sa má
začať so sledovaním kardiovaskulárnych funkcií a má zahŕňať nepretržité elektrokardiografické sledovanie na zistenie možných arytmií.
Nie je známe špecifické antidotum proti lieku OKEDI. Preto je potrebné začať s príslušnými podpornými opatreniami. Hypotenziu a kolaps obehovej sústavy je potrebné liečiť primeranými opatreniami ako je napr. intravenózne podanie tekutín a/alebo sympatomimetík. V prípade závažných extrapyramidálnych príznakov sa má podať anticholínergikum. V pozornom dohľade lekára a sledovaní sa má pokračovať do zotavenia pacienta.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Psycholeptiká, iné antipsychotiká, ATC kód: N05AX08.
Mechanizmus účinkuRisperidón je selektívny monoaminergný antagonista s jedinečnými vlastnosťami. Má vysokú afinitu
voči sérotoninergným 5-HT2 a dopaminergným D2 receptorom. Risperidón sa zároveň viaže na alfa1- adrenergné receptory a s nižšou afinitou na H1-histaminergné a alfa-2-adrenergné receptory. Risperidón nemá afinitu voči cholínergným receptorom. Hoci je risperidón silným antagonistom D2
receptorov, na základe čoho sa predpokladá zlepšenie pozitívnych príznakov schizofrénie, v porovnaní
s klasickými antipsychotikami spôsobuje menší pokles motorickej aktivity a indukcie katalepsie. Vyvážený antagonizmus sérotonínu a dopamínu v centrálnej nervovej sústave môže znížiť náchylnosť k extrapyramídovým nežiaducim účinkom a rozšíriť terapeutický účinok na negatívne a afektívne príznaky schizofrénie.
Farmakodynamické účinkyKlinická účinnosťÚčinnosť lieku OKEDI (75 mg a 100 mg) pri liečbe schizofrénie u dospelých bola stanovená v multicentrickej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii fázy 3
s paralelnými skupinami. Štúdie sa zúčastnili pacienti s akútnym zhoršením alebo relapsom schizofrénie (kritériá DSM-5), ktorí mali na začiatku štúdie skóre na stupnici pozitívnych alebo negatívnych príznakov (Positive and Negative Syndrome Scale, PANSS) v rozmedzí 80 až 120. Počas skríningovej návštevy bol všetkým pacientom, ktorí sa predtým neliečili, perorálne podávaný risperidón v dávke 2 mg/deň počas 3 dní s cieľom zaistiť minimálny výskyt reakcií z precitlivenosti pred skúšaním. Pacienti s liečbou risperidónom v anamnéze v čase skríningu nedostali perorálny risperidón a po randomizácii začali používať priamo liek OKEDI (75 mg a 100 mg) alebo placebom. Štyristotridsaťosem (438) pacientov bolo randomizovaných na podanie 3 intramuskulárnych dávok lieku OKEDI (75 mg alebo 100 mg) alebo placeba každých 28 dní. Priemerný vek pacientov bol
42,0 (SD: 11,02) rokov. Neboli zahrnutí žiadni pacienti vo veku < 18 rokov ani 65 > rokov. Demografické a ďalšie východiskové charakteristiky boli v každej liečebnej skupine podobné. Počas štúdie nebolo dovolené žiadne doplnkové podávanie perorálneho risperidónu.
Primárnym koncovým ukazovateľom bola zmena celkového skóre PANSS na konci štúdie (85. deň) od začiatku štúdie. Pri obidvoch dávkach lieku OKEDI 75 mg a 100 mg sa preukázalo štatisticky významné zlepšenie v porovnaní s placebom na základe primárneho koncového ukazovateľa (tabuľka 1 a obrázok 1). Tieto výsledky podporujú účinnosť počas celého trvania liečby a zlepšenie PANSS a výsledky pozorovali sa už od 4. dňa s významným oddelením sa od placeba v skupinách
s dávkou 100 mg na 8. deň a 75 mg na 15. deň. Podobne ako celkové skóre PANSS, aj pri skóre troch podstupníc pozitívneho, negatívneho a celkového PANSS sa preukázalo postupné zlepšenie (zníženie) od začiatku štúdie.
| Placebo n = 132
| OKEDI 75 mg n = 129
| OKEDI 100 mg n = 129
| Celkové skóre PANSS(a)
| Priemerné východiskové skóre (SD)
| 96,4 (7,21)
| 96,3 (8,47)
| 96,1 (8,42)
|
Priemerná zmena LS, 95 % IS (a)
| -11,0,
-14,1 až -8,0
rokov
| -24,6,
-27,5 až -21,6 rokov
| -24,7,
-27,7 až -21,6 rokov
|
Rozdiel liečby, 95 % IS (b)
|
| -13,0,
-17,3 až -8,8 rokov
| -13,3,
-17,6 až -8,9 rokov
| Hodnota p
|
| < 0,0001
| < 0,0001
| Celkové skóre CGI-S(c)
| Priemerné skóre na začiatku štúdie
(SD)
| 4,9 (0,52)
| 5,0 (0,65)
| 4,9 (0,48)
|
Priemerná zmena LS, 95 % IS (a)
| -0,6,
-0,8 až -0,4 rokov
| 1,3,
-1,5 až -1,2 rokov
| -1,3,
-1,5 až -1,2 rokov
|
Rozdiel liečby, 95 % IS (b)
|
| -0,7,
-1,0 až -0,5 rokov
| -0,7,
-1,0 až -0,5 rokov
| Hodnota p
|
| < 0,0001
| < 0,0001
|
|
|
Tabuľka 1: Priemerná zmena celkového skóre PANSS a CGI-S na konci štúdie (85. deň) od začiatku štúdie (populácia mITT)a Údaje boli analyzované pomocou zmiešaného modelu opakovaných meraní (mixed model repeated measures,
MMRM)
b Rozdiel (OKEDI mínus placebo) v priemernej zmene stanovenej metódou najmenších štvorcov od začiatku štúdie upravený podľa metódy Lawrenca a Hunga.
c Otázka pre lekára v rámci stupnice skóre celkového klinického dojmu a závažnosti (CGI-S): „Pri zvážení vašich celkových klinických skúseností v tejto špecifickej populácii, ako by ste posúdili stav duševného ochorenia pacienta teraz?“ na nasledujúcej stupnici so siedmimi bodmi: 1 = normálny stav, vôbec nie je chorý; 2
= na hranici duševného ochorenia; 3 = mierny stav ochorenia; 4 = stredne závažný stav ochorenia; 5 = výrazný
stav ochorenia; 6 = závažný stav ochorenia; 7 = stav extrémne chorých pacientov.
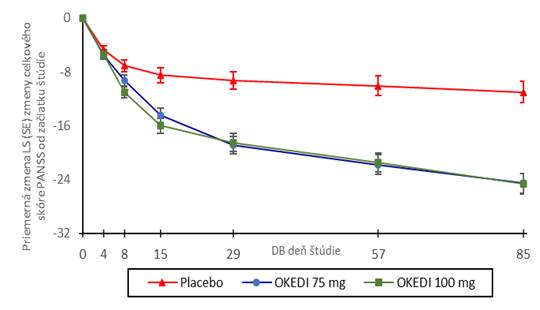
vs. Placebo
OKEDI
75 mg
*** **** **** ****
OKEDI
100 mg
** **** **** **** ****
** p<0,01, *** p<0,001, **** p<0,0001.
Obrázok 1: Zmena celkového skóre PANSS od začiatku štúdie v každom časovom bode dvojito
zaslepenej fázy (populácia mITT)
Kľúčový sekundárny koncový ukazovateľ účinnosti bol definovaný ako priemerná zmena skóre celkového klinického dojmu a závažnosti v 85. dni od začiatku štúdie (CGI-S). V obidvoch liečebných skupinách s liekom OKEDI sa v porovnaní s placebom preukázalo štatisticky významne lepšie skóre CGI-S od 8. dňa (zníženie skóre od začiatku štúdie -0,4 (0,05) pri 75 mg a -0,6 (0,05) pri 100 mg).
Celková miera odpovede (zníženie celkového skóre PANSS o > 30 % a/alebo CGI-I o 2 „výrazné zlepšenie“ alebo 1 „veľmi výrazné zlepšenie“) v koncovom ukazovateli pri lieku OKEDI bola 56 % a štatisticky významná od 8. dňa a 15. dňa pri oboch dávkach v porovnaní s placebom.
Dlhodobá (12 mesiacov) účinnosť lieku OKEDI sa hodnotila v otvorenom predĺžení hlavnej štúdie u
215 pacientov so schizofréniou. Do predĺženej štúdie bolo možné zaradiť pacientov z fázy dvojitého zaslepenia (pacienti prichádzajúci z predchádzajúcej štúdie) a stabilizovaných pacientov, ktorí predtým neboli do štúdie zaradení (noví pacienti). Noví pacienti prešli z perorálneho risperidónu na
liek OKEDI 75 mg alebo 100 mg. Účinnosť sa v priebehu času udržala s mierou relapsu 10,7 % (95 % IS, 6,9 % až 15,6 %) a mierou ústupu ochorenia 61,0 % (95 % IS, 53,7 % až 68,4 %).
5.2 Farmakokinetické vlastnosti
Risperidón sa metabolizuje na 9-hydroxyrisperidón, ktorý má podobný farmakologický účinok ako
risperidón (pozri Biotransformácia a Eliminácia).
Absorpcia
OKEDI obsahuje risperidón v liekovej forme suspenzie, ktorá vykazuje kombinovaný proces
absorpcie. Po intramuskulárnej injekcii sa v okamihu podania injekcie okamžite uvoľní malé množstvo lieku, ktoré je zodpovedné okamžité plazmatické hladiny. Po dosiahnutí prvej maximálnej koncentrácie, priemerné plazmatické koncentrácie trvalo klesli do 14. dňa a následne sa opäť zvýšili, aby sa dosiahla druhá maximálna koncentrácia medzi 21. a 24. dňom. Po druhej maximálnej koncentrácii plazmatické koncentrácie postupne v priebehu času klesali. Suspenzia tvorí zásobu poskytujúcu trvalé terapeutické plazmatické koncentrácie, ktoré sa udržiavajú počas 28-dňového intervalu.
Po jednorazovej i.m. injekcii boli 2 hodiny po podaní priemerné koncentrácie aktívnej zložky 13 ±
9 ng/ml pri lieku OKEDI 75 mg a 29 ± 13 ng/ml pri lieku OKEDI 100 mg. Plazmatické koncentrácie aktívnej zložky po jednom mesiaci po podaní sú 17 ± 8 ng/ml pri lieku OKEDI 75 mg a 21 ± 17 ng/ml pri lieku OKEDI 100 mg a pri väčšine pacientov sa liek úplne vylúči 75 dní po podaní, pričom
hodnoty aktívnej zložky sú nižšie ako 1 ng/ml.
Priemerné najnižšie plazmatické koncentrácie (Cmin) a priemerné maximálne plazmatické koncentrácie
(Cmax) aktívnej zložky po opakovanom intramuskulárnom podaní injekcií OKEDI sú uvedené v
tabuľke 2.
Tabuľka 2: Cmin a Cmax aktívnej zložky zložky po opakovanom podaní intramuskulárnychinjekcií lieku OKEDI
Dávka
| Cmin (SD)
ng/ml
| Cmax (SD)
ng/ml
|
75 mg(a)
| 17,6
| 35,9
|
100 mg(b)
| 28,9 (13,7)
| 69,7 (27,8)
|
a a Súhrnné simulované odhady farmakokinetických (FK) parametrov po 3. dávke lieku OKEDI
75 mg s použitím modelu populačnej (pop) FK
b Súhrnná štatistika FK parametrov po 4. dávke lieku OKEDI 100 mg z klinického skúšania
s viacnásobnou dávkou
SD: štandardná odchýlka
Koncentrácie v ustálenom stave pri typickom účastníkovi boli dosiahnuté po prvej dávke.
Priemerná expozícia v ustálenom stave bola pri miestach podania injekcie do deltového a aj sedacieho svalu podobná.
DistribúciaDistribúcia risperidónu je rýchla. Distribučný objem je 1 - 2 l/kg. Risperidón sa v plazme viaže na
albumín a kyslý alfa1-glykoproteín. Väzba risperidónu na plazmatické bielkoviny je 90 % z toho 77 %
je 9-hydroxyrisperidón.
Biotransformácia a elimináciaRisperidón sa metabolizuje prostredníctvom CYP2D6 na 9-hydroxyrisperidón, ktorý má podobný
farmakologický účinok ako risperidón. Risperidón a 9-hydroxyrisperidón tvoria aktívnu zložku.
CYP2D6 podlieha genetického polymorfizmu. U extenzívnych metabolizérov CYP2D6 dochádza
k rýchlej premene risperidónu na 9-hydroxyrisperidón, zatiaľ čo u slabých metabolizérov CYP2D6 dochádza k jeho premene oveľa pomalšie. Hoci sa u extenzívnych metabolizérov dosahujú nižšie koncentrácie risperidónu a vyššie koncentrácie 9-hydroxyrisperidónu ako u slabých metabolizérov, je farmakokinetika risperidónu a 9-hydroxyrisperidónu spolu (t. j. aktívnej zložky) po jednorazovom a viacnásobnom podaní u extenzívnych a slabých metabolizérov CYP2D6 podobná.
Ďalšou metabolickou cestou risperidónu je N-dealkylácia. V štúdii na mikrozómoch ľudskej pečene in vitro sa preukázalo, že risperidón v klinicky významnej koncentrácii podstatne neinhibuje metabolizmus liečiv metabolizovaných izozýmami cytochrómu P450 vrátane CYP1A2, CYP2A6, CYP2C8/9/19, CYP2D6, CYP2E1, CYP3A4 a CYP3A5. Jeden týždeň po podaní sa 70 % dávky vylúčilo močom a 14 % stolicou. V moči predstavuje risperidón a 9-hydroxyrisperidón 35 - 45 % dávky. Zvyšok tvoria neaktívne metabolity. Po perorálnom podaní pacientom so psychózou sa risperidón eliminuje s biologickým polčasom približne 3 hodiny. Polčas eliminácie 9- hydroxyrisperidónu a aktívnej zložky je 24 hodín.
Aktívna zložka sa eliminuje 75 dní po podaní lieku OKEDI, s hodnotami aktívnej zložky nižšími ako
1 ng/ml pri väčšine pacientov.
Injekcia lieku OKEDI verzus perorálny risperidón
Počiatočné plazmatické hladiny pri lieku OKEDI boli v rozmedzí expozície pozorovanej pri
perorálnom podávaní 3 - 4 mg risperidónu. Expozícia v ustálenom stave po podaní 100 mg OKEDI v porovnaní so 4 mg perorálneho risperidónu bola o 39 % vyššia pre AUC, o 32 % pre Cmax a bola podobná pre Cmin. V simuláciách založených na modelovaní populačnej farmakokinetiky sa preukazuje, že expozícia lieku OKEDI 75 mg je podobná expozícii 3 mg perorálneho risperidónu
v ustálenom stave.
Pri prechode z perorálneho risperidónu na liek OKEDI sú predpovedané expozície aktívnej zložky v podobných rozsahoch vrátane maximálnych koncentrácií.
Linearita/nelinearita
Zistilo sa, že liek OKEDI vykazuje lineárnu a dávke úmernú farmakokinetiku pri dávkach 75 mg a
100 mg.
Starší pacienti
OKEDI nebol u starších pacientov systematicky skúmaný (pozri časť 4.2).
Porucha funkcie obličiek
OKEDI sa u pacientov s poruchou funkcie obličiek systematicky neskúmal. U pacientov s miernou
poruchou funkcie obličiek (klírens kreatinínu 60 až 89 ml/min), ktorí používali liek OKEDI, sa preukázala podobná expozícia aktívnej zložke ako u pacientov s normálnou funkciou obličiek.
Pri stredne závažnom alebo závažnom ochorení obličiek nie sú k dispozícii žiadne údaje. Poruchafunkciepečene
OKEDI sa u pacientov s poruchou funkcie pečene systematicky neskúmal.
Index telesnej hmoty (Body mass index, BMI)
V simuláciách populačnej farmakokinetiky sa preukázali možné zvýšenia plazmatických koncentrácií
lieku OKEDI u obéznych alebo morbídne obéznych žien v porovnaní s pacientkami s normálnou
telesnou hmotnosťou, bez významného klinického vplyvu.
Pohlavie, rasa a fajčiarskenávyky
V analýze pop FK sa neodhalil žiaden zjavný vplyv pohlavia, rasy alebo fajčiarskych návykov na
farmakokinetiku risperidónu alebo aktívnej zložky.
5.3 Predklinické údaje o bezpečnosti
Na zvieracích modeloch in vitro a in vivo sa preukazuje, že pri vysokých dávkach môže risperidón spôsobiť predĺženie QT intervalu, čo bolo u pacientov spájané s teoreticky zvýšeným rizikom torsade de pointes.
V štúdiách (subchronickej) chronickej perorálnej toxicity, v ktorých sa dávka začala podávať u pohlavne nedozretých potkanov a psov, sa u samcov a samíc objavili od dávky závislé účinky na pohlavné orgány a mliečnu žľazu. Tieto účinky súviseli so zvýšenou sérovou hladinou prolaktínu, ktorá bola spôsobená blokujúcim účinkom risperidónu na dopamínovom D2 receptore. Okrem toho, štúdie na tkanivových kultúrach naznačujú, že rast buniek v ľudskom nádore prsníka môže byť stimulovaný prolaktínom.
Hlavné účinky liečby liekom OKEDI pozorované po štúdiách chronickej (12 mesiacov intramuskulárneho podávania) toxicity u psov a králikov boli v súlade so zisteniami po perorálnej distribúcii risperidónu u potkanov a psov a súviseli s farmakologickými účinkami risperidónu.
Po intramuskulárnom podaní lieku OKEDI sa v 12-cyklových štúdiách toxicity u psov a králikov pozorovali lokálne zmeny a uzlíky v mieste vpichu. Pozostávali zo svalového granulomatózneho zápalu cudzieho telesa, ktorý sa pripisuje prirodzenej reakcii organizmu na prítomnosť cudzej látky. Ďalšie lokálne zmeny pozorované u králikov pri dávke 15 mg/kg (risperidón) súviseli s obsahom dimetylsulfoxidu (DMSO). Všetky tieto zmeny boli výlučne lokálne a preukázala sa ich reverzibilita. U psov sa bezprostredne po podaní pozorovala prechodná bolesť spojená s obsahom DMSO.
Ani v prípade risperidónu, ani v prípade lieku OKEDI sa nepreukázal genotoxický potenciál.
V štúdiách karcinogenity risperidónu po perorálnom podaní u potkanov a myší sa pozoroval nárast adenómov hypofýzy (myš), adenómov endokrinného pankreasu (potkan) a adenómov mliečnej žľazy (oba druhy). Tieto nádory môžu súvisieť s dlhodobým antagonizmom na dopamínovom D2 receptore
a s hyperprolaktinémiou. Význam zistení týkajúcich sa nádorov u hlodavcov z hľadiska rizika pre ľudí
nie je známy.
Risperidón nebol teratogénny u potkanov a králikov. V reprodukčných štúdiách s risperidónom na potkanoch sa pozorovali nežiaduce účinky na správanie rodičov pri párení a na pôrodnú hmotnosť a prežívanie mláďat. U potkanov bola intrauterinná expozícia risperidónu spojená s kognitívnymi deficitmi v dospelosti. Iné antagonisty dopamínu pri podávaní gravidným zvieratám vyvolali negatívne účinky na učenie a motorický vývoj mláďat.
V štúdii toxicity na mláďatách potkanov sa pozorovala zvýšená úmrtnosť mláďat a oneskorenie fyzického vývoja. V 40-týždňovej štúdii na mladých psoch bolo pohlavné dozrievanie oneskorené. Na základe plochy pod krivkou (AUC) nebol rast dlhých kostí u dospievajúcich psov ovplyvnený pri
3,6-násobku maximálnej expozície u ľudí (1,5 mg/deň), pričom účinky na dlhé kosti a pohlavné
dozrievanie u dospievajúcich psov sa pozorovali pri 15-násobku maximálnej expozície u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Naplnená injekčná striekačka s práškom
poly(D,L-laktid-ko-glykolid)
Naplnená injekčná striekačka s vehikulom
Dimetylsulfoxid
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
2 roky
OKEDI sa má použiť ihneď po rekonštitúcii.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30 °C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Naplnená injekčná striekačka s práškom
Injekčná striekačka z polyméru z cyklického olefínu s krytom trysky a piestovým uzáverom
pozostávajúcim z chlórbutylovej gumy pokrytej polytetrafluóretylénom.
Naplnená injekčná striekačka s vehikulom
Injekčná striekačka z polyméru z cyklického olefínu s chlórbutylovým gumeným krytom hrotu a
brómbutylovým gumeným piestovým uzáverom pokrytým etyléntetrafluóretylénovým kopolymérom. Dávky sú odlíšené podľa farby použitej na prstovej prírube naplnenej injekčnej striekačky s vehikulom: 100 mg (modrá) a 75 mg (červená).
Každá súprava lieku OKEDI obsahuje:
• Vrecko z hliníkovej fólie s jednou naplnenou injekčnou striekačkou obsahujúcou prášok a vrecko so silikagélovým vysušovadlom.
• Vrecko z hliníkovej fólie s jednou naplnenou injekčnou striekačkou obsahujúcou vehikulum a vrecko so silikagélovým vysušovadlom.
• Jednu sterilnú 2-palcovú (0,90 x 51 mm [20G]) injekčnú ihla s bezpečnostným krytom používanú na podanie do sedacieho svalu.
• Jednu sterilnú 1-palcovú (0,80 x 25 mm [21G]) injekčnú ihlu s bezpečnostným krytom používanu na podanie do deltového svalu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
DÔLEŽITÉ INFORMÁCIE
• Len na intramuskulárne použitie.
• Pacientovi sa má injekcia podať ihneď po rekonštitúcii.
• Súčasťou sú dve sterilné injekčné ihly s bezpečnostným krytom na podanie injekcie do
sedacieho a deltového svalu Pred podaním lieku si jednu z nich vyberiete.
• Pred použitím si prečítajte všetky pokyny. Všetky pokyny na použitie a zaobchádzanie s liekom OKEDI sú uvedené v písomnej informácii pre používateľa (pozri Pokyny pre zdravotníckych pracovníkov).
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7
. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Laboratorios Farmacéuticos Rovi, S.A. Julián Camarillo, 35
28037 Madrid.
Španielsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)OKEDI 75 mg prášok a vehikulumnainjekčnúsuspenziuspredĺženýmuvoľňovanímEU/1/21/1621/001
OKEDI 100 mg prášok a vehikulumnainjekčnúsuspenziuspredĺženýmuvoľňovanímEU/1/21/1621/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.