
.
5.2 Farmakokinetické vlastnostiVšetky farmakokinetické štúdie s turoktokogom alfa boli uskutočnené u pacientov so závažnou hemofíliou A (FVIII ≤1 %), ktorí boli už predtým liečení. Analýza vzoriek plazmy sa vykonala pomocou jednostupňového koagulačného testu a chromogénnej metódy.
V medzinárodnej štúdii zahŕňajúcej 36 laboratórií bol stanovený obsah NovoEight ako FVIII C, bol vyhodnotený a porovnaný s liekom dostupným na trhu obsahujúcim rekombinantný faktor VIII s celou dĺžkou reťazca. Štúdia preukázala porovnateľné a konzistentné výsledky pre obidva lieky a tiež to, že NovoEight môže byť spoľahlivo v plazme stanovený bez toho, aby bol potrebný špeciálny štandard
pre NovoEight.
Farmakokinetické parametre jednorazovej dávky lieku NovoEight sú uvedené v Tabuľke 4 pre koagulačný test a v Tabuľke 5 pre chromogénnu metódu.
Tabuľka 4 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou hemofíliou A (FVIII ≤1%), koagulačná metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=33
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,018 (0,007)
| 0,020 (0,004)
| 0,022 (0,004)
|
AUC ((IU*h)/ml)
| 9,92 (4,11)
| 11,09 (3,74)
| 15,26 (5,77)
|
CL (ml/h/kg)
| 6,21 (3,66)
| 5,02 (1,68)
| 3,63 (1,09)
|
t½ (h)
| 7,65 (1,84)
| 8,02 (1,89)
| 11,00 (4,65)
|
Vss (ml/kg)
| 56,68 (26,43)
| 46,82 (10,63)
| 47,40 (9,21)
|
Cmax (IU/ml)
| 1,00 (0,58)
| 1,07 (0,35)
| 1,226 (0,41)
|
Priemerný čas
zotrvania (h)
| 9,63 (2,50)
| 9,91 (2,57)
| 14,19 5,08)
|
Tabuľka 5 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou
hemofíliou A (FVIII ≤1%), chromogénna metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=48
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,022 (0,006)
| 0,025 (0.006)
| 0,029 (0,006)
|
AUC ((IU*h)/ml)
| 12,23 (4,36)
| 14,37 (3.48)
| 19,63 (7,73)
|
CL (ml/h/kg)
| 4,59 (1,73)
| 3,70 (1.00)
| 2,86 (0,94)
|
t½ (h)
| 9,99 (1,71)
| 9,42 (1.52)
| 11,22 (6,86)
|
Vss (ml/kg)
|
55,46 (23,53)
|
41,23 (6.00)
|
38,18 (10,24)
|
Cmax (IU/ml)
|
1,12 (0,31)
|
1,25 (0.27)
|
1,63 (0,50)
|
Priemerný čas
zotrvania (h)
|
12,06 (1,90)
|
11,61 (2.32)
|
14,54 (5,77)
|
Farmakokinetické parametre boli porovnateľné medzi pediatrickými pacientmi vo veku do 6 rokov
a pediatrickými pacientmi od 6 do 12 rokov. Niektoré odchýlky boli pozorované vo farmakokinetických parametroch lieku NovoEight medzi pediatrickými a dospelými pacientmi. Vyššie
hodnoty CL a kratší t½ sa zistil u pediatrických pacientov v porovnaní s dospelými pacientmi
s hemofíliou A, čo môže byť čiastočne spôsobené známym vyšším plazmatickým objemom na
kilogram telesnej hmotnosti u mladších pacientov.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe konvenčných farmakologických štúdií bezpečnosti a toxicity po opakovanom podaní neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokPrášok: Chlorid sodný L-histidín Sacharóza Polysorbát 80
L-metionín
Dihydrát chloridu vápenatého
Hydroxid sodný
Kyselina chlorovodíková
Rozpúšťadlo: Chlorid sodný Voda na injekciu
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnostiPredotvorením:2 roky
Počas času použiteľnosti môže byť liek uchovávaný nepretržite pri izbovej teplote ≤30°C počas obdobia nepresahujúceho 6 mesiacov. Ak bol liek už raz vybratý z chladničky, nesmie sa už do chladničky vrátiť. Zaznačte si prosím na krabičke dátum, kedy ste začali liek uchovávať pri izbovej teplote.
Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom.
Po rekonštitúcii:Chemická a fyzikálna stabilita po rekonštitúcii bola dokázaná počas 24 hodín pri 2°C – 8°C a počas
4 hodín pri uchovávaní pri ≤30°C. Z mikrobiologického hľadiska sa má tento liek použiť ihneď po rekonštitúcii. Ak sa nepoužije ihneď, čas a podmienky uchovávania lieku po rekonštitúcii a pred
použitím je zodpovednosť používateľa a zvyčajne nemá byť čas dlhší ako 4 hodiny pri uchovávaní pri
≤30°C alebo 24 hodín pri 2°C - 8°C, ak rekonštitúcia prebehla za kontrolovaných a validovaných aseptických podmienok.
Všetok nepoužitý liek, ktorý bol uchovávaný pri izbovej teplote dlhšie ako 4 hodiny má byť zlikvidovaný.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke (2ºC - 8ºC). Chráňte pred mrazom.
Uchovávanie pri izbovej teplote a podmienky uchovávania lieku po rekonštitúcii, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaKaždé balenie lieku NovoEight 250 IU prášok a rozpúšťadlo na injekčný roztok obsahuje:
– 1 sklenenú injekčnú liekovku (typ I) s práškom a chlórobutylovou gumenou zátkou
– 1 sterilný adaptér injekčnej liekovky na rekonštitúciu
– 1 naplnenú injekčnú striekačku so 4 ml rozpúšťadla s záverom spätného chodu (polypropylén), gumeným piestom (brómbutyl) a uzáverom so zátkou (brómbutyl)
– 1 nástavec piesta (polypropylén).
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanieNovoEight je určený na intravenózne podanie po rekonštitúcii prášku s rozpúšťadlom, ktoré je dodávané v injekčnej striekačke. Po rekonštitúcii je roztok číry alebo mierne opalizujúci. Roztok nepoužite, ak je zakalený alebo obsahuje usadeniny.
Budete potrebovať aj infúznu súpravu (hadičku a motýlikovú ihlu), sterilné alkoholové tampóny, gázové tampóny a náplasti. Tieto pomôcky nie je súčasťou balenia lieku NovoEight.
Vždy dodržujte aseptickú techniku.
Rekonštitúcia:A)
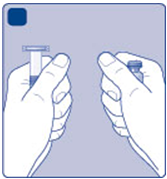
Vyberte injekčnú liekovku, adaptér injekčnej
Aliekovky a naplnenú injekčnú striekačku z krabičky.
Nástavec piesta nechajte v krabičke. Nechajte injekčnú liekovku a naplnenú injekčnú striekačku
dosiahnuť izbovú teplotu. Môžete to urobiť ich podržaním v rukách, až kým necítite, že sú také teplé
ako vaše ruky. Nezohrievajte injekčnú liekovku a naplnenú injekčnú striekačku iným spôsobom.
B)

Odstráňte plastové viečko z injekčnej liekovky. Ak je
Bplastové viečko uvoľnené, alebo chýba, injekčnú
liekovku nepoužite
. Očistite gumovú zátku na injekčnej liekovke sterilným alkoholovým tampónom
a nechajte ju pred použitím pár sekúnd schnúť na vzduchu.
C)

Odstráňte ochranný papier z adaptéra injekčnej
Cliekovky. Ak ochranný papier nie je úplne uzavretý
alebo je roztrhnutý, nepoužite adaptér injekčnej liekovky.
Nevyberajte prstami adaptér injekčnej liekovky
z ochranného krytu.
D)
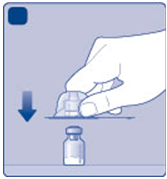
Otočte ochranný kryt a zatlačte adaptér na injekčnú
Dliekovku. Neodstraňujte adaptér z injekčnej liekovky,
keď je už pripevnený.
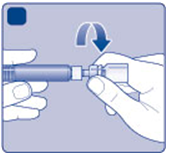
E)
Jemne pritlačte ochranný kryt palcom a ukazovákom ako je znázornené. Odstráňte ochranný kryt z
adaptéra injekčnej liekovky.
 E
EF)

Pevne uchopte nástavec piesta za širší koniec a ihneď
Fho pripojte k injekčnej striekačke otáčaním v smere
hodinových ručičiek vnútri naplnenej injekčnej striekačky, až kým nepocítite odpor.
G)
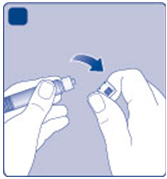
Odstráňte kryt injekčnej striekačky z naplnenej
Ginjekčnej striekačky ohnutím dole, až kým sa
nezlomí perforácia. Nedotýkajte sa špičky injekčnej striekačky pod krytom injekčnej striekačky.
H)

Naskrutkujte naplnenú injekčnú striekačku bezpečne
Hna adaptér, až kým nepocítite odpor.
I)
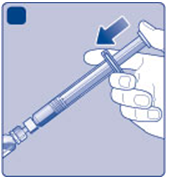
Držte naplnenú injekčnú striekačku s injekčnou
Iliekovkou naklonenou smerom dole. Tlačte nástavec
piesta, aby ste vstrekli všetko rozpúšťadlo do injekčnej liekovky.
J)
Držte nástavec piesta stlačený dole a jemne krúžte s
Jinjekčnou liekovkou, až sa rozpustí všetok prášok.
Netraste injekčnou liekovkou, lebo to môže spôsobiť spenenie.
Odporúča sa použiť NovoEight ihneď po rekonštitúcii. Podmienky uchovávania rekonštituovaného
lieku, pozri časť 6.3.
Ak je potrebná väčšia dávka, opakujte kroky A až J s ďalšími injekčnými liekovkami, adaptérmi
injekčnej liekovky a naplnenými injekčnými striekačkami.
Podanierekonštituovanéhoroztoku:
K)
Držte nástavec piesta stlačený na doraz. Otočte injekčnú striekačku s injekčnou liekovkou hore dnom. Prestaňte tlačiť nástavec piesta a nechajte ho pohnúť sa samovoľne naspäť, kým rekonštituovaný roztok naplní injekčnú striekačku. Ťahajte nástavec piesta jemne smerom dole, aby ste natiahli rekonštituovaný roztok do injekčnej striekačky.
V prípade, že potrebujete len časť z injekčnej liekovky, použite stupnicu na injekčnej striekačke, aby ste videli koľko rekonštituovaného roztoku ste odobrali, ako vám povedal lekár alebo zdravotná sestra.
Kým držíte injekčnú liekovku hore dnom, klepkajte jemne na injekčnú striekačku, aby všetky bubliny vystúpili nahor. Tlačte nástavec piesta pomaly, až kým všetky vzduchové bubliny nevytlačíte.
|
K
|
L)
Odskrutkujte adaptér s injekčnou liekovkou.
NovoEight je teraz pripravený na injekčné podanie. Vyberte si vhodné miesto a pomaly si podajte injekciu lieku NovoEight do žily počas 2-5 minút.
|
L
|
Likvidácia:
Po podaní injekcie, bezpečne zlikvidujte všetok nepoužitý roztok lieku NovoEight, injekčnú
striekačku s infúznou súpravou, injekčnú liekovku s adaptérom injekčnej liekovky, a ostatný odpadový materiál ako vám povedal lekárnik.
Nevyhadzujte ho s bežným domovým odpadom.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovo Nordisk A/S Novo Allé
DK-2880 Bagsværd
Dánsko
8. REGISTRAČNÉ ČÍSLA
EU/1/13/888/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUNovoEight 500 IU prášok a rozpúšťadlo na injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá injekčná liekovka s práškom obsahuje 500 IU ľudského koagulačného faktora VIII (rDNA), turoktokog alfa.
Po rekonštitúcii obsahuje NovoEight približne 125 IU/ml ľudského koagulačného faktora VIII (rDNA), turoktokog alfa.
Účinnosť (IU) sa stanovuje podľa Európskeho liekopisu chromogénnym testom. Špecifická aktivita
NovoEight je približne 8 300 IU/mg bielkoviny.
Turoktokog alfa (ľudský koagulačný faktor VIII (rDNA)) je purifikovaná bielkovina, ktorá obsahuje
1 445 aminokyselín s molekulovou hmotnosťou približne 166 kDA. Vyrába sa technológiou rekombinantnej DNA z buniek ovária čínskeho škrečka (CHO), a vyrába sa bez pridania akýchkoľvek
ľudských alebo živočíšnych derivovaných bielkovín pri spracovaní bunkových kultúr, čistení alebo
koncovej úprave.
Turoktokog alfa je rekombinantný ľudský koagulačný faktor VIII so skrátenou B-doménou (B- doména pozostáva z 21 aminokyselín prirodzenej B-domény) bez akýchkoľvek modifikácií v poradí aminokyselín.
Pomocnálátkasoznámymúčinkom:0,31 mmol sodíka (7 mg) na 1 ml rekonštituovaného roztoku.
Úplný zoznam pomocných látok, pozri bod 6.1.
3. LIEKOVÁ FORMAPrášok a rozpúšťadlo na injekčný roztok.
Biely alebo jemne žltý prášok alebo drobivá hmota. Číry a bezfarebný injekčný roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieLiečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII). NovoEight môžu užívať všetky vekové skupiny.
4.2 Dávkovanie a spôsob podaniaLiečba sa má začať pod dohľadom lekára so skúsenosťami s liečbou hemofílie.
D
oteraz
neliečení
pacienti
Bezpečnosť a účinnosť lieku NovoEight u doteraz neliečených pacientov nebola zatiaľ stanovená. Nie
sú k dispozícii žiadne údaje.
Dávkovanie
Dávkovanie a trvanie substitučnej liečby závisí od závažnosti deficitu faktora VIII, mieste a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII je vyjadrený v medzinárodných jednotkách (IU), ktoré zodpovedajú súčasnému WHO štandardu pre lieky obsahujúce faktor VIII. Aktivita faktora VIII v plazme je vyjadrená buď v percentách (porovnaním k normálnej ľudskej plazme), alebo v medzinárodných jednotkách (porovnaním k medzinárodnému štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba v prípade potreby
Výpočet požadovanej dávky faktora VIII vychádza z empirického zistenia, že 1 medzinárodná jednotka (IU) faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o
2 IU/dl. Požadovaná dávka sa určí použitím nasledujúceho vzorca:
Požadovaný počet jednotiek = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) (IU/dl) x
0,5 (IU/kg na IU/dl)
Množstvo, ktoré sa má podať a frekvencia podania sa majú vždy riadiť podľa klinickej účinnosti u jednotlivého pacienta.
V nasledujúcich prípadoch krvácania počas zodpovedajúceho obdobia nemá aktivita faktora VIII klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Nasledujúcu tabuľku možno použiť ako návod na dávkovanie pri epizódach krvácania a pri chirurgických zákrokoch:
Tabuľka 1 Návod na dávkovanie pri epizódach krvácania a operáciách

Stupeň krvácania/Typ chirurgického zákroku
Požadovaná hladina faktora VIII (%) (IU/dl)
Frekvencia dávok (hodiny)/Trvanie liečby (dni)
Kr
v
ácanie
Začínajúca hemartróza, krvácanie do
svalov alebo do ústnej dutiny
20-40 Opakovať každých 12 až 24 hodín,
najmenej 1 deň, až kým sa krvácanie indikované bolesťou
nezastaví alebo do zahojenia.
Rozsiahlejšia hemartróza, krvácanie
do svalov alebo hematóm
30-60 Opakovať infúziu každých 12-
24 hodín počas 3-4 alebo viac dní, kým bolesť a akútna slabosť neustúpi

Život ohrozujúce krvácanie 60-100 Opakovať infúziu každých 8 až
24 hodín až do stavu mimo ohrozenia života
C
hirurgický
zákrok
M
enší chirurgický zákrok, vrátane extrakcie zubov
30-60 Každých 24 hodín, najmenej 1 deň, až do zahojenia

Stupeň krvácania/Typ chirurgického zákroku
Požadovaná hladina faktora VIII (%) (IU/dl)
Frekvencia dávok (hodiny)/Trvanie liečby (dni)
Veľký chirurgický zákrok 80-100
(pred a po operácii)
Opakovať infúziu každých 8-
24 hodín až do adekvátneho zahojenia rany, potom pokračovať
v liečbe najmenej ďalších 7 dní na
udržanie faktora VIII na 30% až
60% (IU/dl)
 Profylaxia
Profylaxia
Na dlhodobú prevenciu krvácania u pacientov so závažnou hemofíliou A. Obvyklé odporučené dávky sú 20-40 IU faktora VIII na kg telesnej hmotnosti každý druhý deň alebo 20-50 IU faktora VIII na kg
telesnej hmotnosti 3-krát týždenne. V niektorých prípadoch, zvlášť u mladých pacientov môžu byť potrebné kratšie intervaly v dávkovaní alebo vyššie dávky.
Monitorovanie liečbyPočas liečby sa odporúča robiť príslušné stanovenie hladín faktora VIII, aby sa určila veľkosť dávky, ktorá sa má podať a frekvencia podania injekcií. V prípade veľkých chirurgických zákrokov je
nevyhnutné presné monitorovanie substitučnej liečby pomocou koagulačnej analýzy (aktivita faktora
VIII v plazme). Jednotliví pacienti môžu rozdielne reagovať na faktor VIII, môžu dosiahnuť rôzne úrovne stabilizácie in vivo a môžu sa prejaviť rôznym biologickým polčasom.
Chirurgický zákrokNie sú žiadne skúsenosti s chirurgickými zákrokmi u pediatrických pacientov.
Starší ľudiaNie sú žiadne skúsenosti s pacientmi
> 65 rokov.
Pediatrická populáciaNa dlhodobú profylaxiu krvácania pacientov mladších ako 12 rokov sa odporúčajú dávky 25-50 IU faktora VIII na kg telesnej hmotnosti každý druhý deň, alebo 25-60 IU faktora VIII na kg telesnej hmotnosti 3-krát týždenne. Pre pediatrických pacientov starších ako 12 rokov sú odporúčania dávkovania rovnaké ako pre dospelých.
SpôsobpodávaniaIntravenózne použitie.
Odporúčaná rýchlosť infúzie pre NovoEight je 1-2 ml/min. Rýchlosť sa má určiť tak, aby vyhovovala pacientovi.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo ktorúkoľvek z pomocných látok uvedených v časti 6.1. Známa alergická reakcia na škrečiu bielkovinu.
4.4 Osobitné upozornenia a opatrenia pri používaníHypersenzitivitaPri užívaní NovoEight sa môžu vyskytnúť hypersenzitívne reakcie alergického typu. Produkt obsahuje stopy škrečích bielkovín, ktoré môžu u niektorých pacientov vyvolávať alergické reakcie. Ak sa objavia príznaky precitlivenosti, pacienti majú byť poučení, aby ihneď prerušili liečbu týmto liekom a
obrátili sa na svojho lekára. Pacienti majú byť informovaní o počiatočných príznakoch hypersenzitívnych reakcií, vrátane žihľavky, generalizovanej urtikárie, zvierania na hrudníku, sipotu, hypotenzie a anafylaxie.
V prípade šoku sa má dodržať štandardná medicínska liečba pri šoku. Inhibítory
Známou komplikáciou liečby v jednotlivých prípadoch hemofílie A je tvorba neutralizujúcich
protilátok (inhibítorov) k faktoru VIII. Tieto inhibítory sú obyčajne IgG imunoglobulíny pôsobiace proti koagulačnej aktivite faktora VIII, ktorá je kvantifikovaná Bethesda jednotkami (BU) na ml plazmy pri použití modifikovanej metódy. Riziko tvorby inhibítorov koreluje s expozíciou faktora VIII, toto riziko býva najvyššie počas prvých 20 dní expozície. Zriedkavo sa môžu inhibítory tvoriť aj počas prvých 100 dňoch expozície.
Pacienti, ktorí boli už predtým liečení s expozíciou viac ako 100 dní a mali už v predošlej anamnéze tvorbu inhibítorov, pri zmene liečby z niektorého lieku obsahujúceho faktor VIII na iný, došlo
v niektorých prípadoch opäť k tvorbe inhibítorov (nízky titer). Preto sa u všetkých pacientov odporúča vždy pri zmene liečby na iný liek, pozorne monitorovať vznik inhibítorov.
Všeobecne u všetkých pacientov liečených liekmi s koagulačným faktorom VIII sa má pozorne sledovať tvorba inhibítorov vhodným klinickým pozorovaním a laboratórnymi testami. Ak sa nedosiahne očakávaná hladina aktivity faktora VIII v plazme, alebo ak sa krvácanie nezvládne príslušnou dávkou, má sa robiť testovanie na prítomnosť inhibítora faktora VIII. U pacientov
s vysokou hladinou inhibítora, môže byť liečba faktorom VIII neúčinná a má sa uvažovať o iných možnostiach liečby. Liečbu takýchto pacientov má viesť lekár so skúsenosťami s liečbou hemofílie a s inhibítormi faktora VIII.
Dôrazne sa odporúča, aby sa vždy pri podaní lieku NovoEight pacientovi, zaznamenal názov a číslo šarže lieku, aby bolo možné spätne priradiť číslo šarže lieku k pacientovi.
Pomocnélátky,ktorétrebavziaťdoúvahy
Po rekonštitúcii obsahuje tento liek 0,31 mmol sodíka (7 mg) na 1 ml rekonštituovaného roztoku. To je potrebné vziať do úvahy u pacientov so sodíkovou diétou.
Pediatrickápopulácia
Uvedené varovania a upozornenia platia pre dospelých aj deti.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s liekom NovoEight.
4.6 Fertilita, gravidita, a laktácia
Neuskutočnili sa žiadne reprodukčné štúdie na zvieratách s liekom NovoEight. Vzhľadom na vzácny výskyt hemofílie A u žien, nie sú skúsenosti s použitím faktora VIII počas tehotenstva a laktácie. Preto sa má faktor VIII použiť počas tehotenstva alebo laktácie, len ak je jednoznačná indikácia.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
NovoEight nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Zriedkavo boli hlásené hypersenzitivita alebo alergická reakcia (ktoré môžu zahŕňať angioedém, pálenie a štípanie v mieste podania infúzie, triašku, začervenanie, generalizovanú urtikáriu, bolesť
hlavy, vyrážku, hypotenziu, letargiu, nauzeu, nevoľnosť, tachykardiu, zvieranie na hrudníku, brnenie, vracanie, sipot) a v niektorých prípadoch môžu viesť k závažnej anafylaxii (vrátane šoku).
Veľmi zriedkavo bola hlásená tvorba protilátok na škrečie bielkoviny spojené s hypersenzitívnymi reakciami.
U pacientov s hemofíliou A sa môžu tvoriť neutralizujúce protilátky (inhibítory) proti faktoru VIII. Ak sa objavia takéto inhibítory, stav sa bude prejavovať ako nedostatočná klinická odpoveď. V týchto prípadoch sa odporúča obrátiť sa špecializované centrum pre liečbu hemofílie.
TabuľkovýzoznamnežiaducichreakciíTabuľka dolu je v súlade s klasifikáciou podľa tried orgánových systémov MedDRA (SOC and
Preferred Term Level).
Frekvencia výskytu je hodnotená podľa nasledujúcej konvencie: veľmi časté (≥1/10), časté (≥1/100 až
<1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé
(<1/10 000), neznáma (z dostupných údajov sa nedá určiť).
V každej skupine frekvencie, sú nežiaduce reakcie uvedené podľa klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich reakcií lieku v klinických štúdiách
Trieda orgánových systémov
| Frekvencia*
| Nežiaduca reakcia
|
Psychické poruchy
| Menej časté
| Nespavosť
|
Poruchy nervového systému
| Menej časté
| Bolesť hlavy, závrat
|
Poruchy srdca a srdcovej činnosti
| Menej časté
| Sínusová tachykardia
|
Poruchy ciev
| Menej časté
| Hypertenzia, lymfedém
|
Poruchy pečene a žlčových ciest
| Časté
| Zvýšenie pečeňových enzýmov**
|
Poruchy kože a podkožného tkaniva
| Menej časté
| Vyrážka
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
| Menej časté
| Muskuloskeletálna stuhnutosť,
artropatia, bolesti končatín, muskuloskeletálna bolesť
|
Celkové poruchy a reakcie v mieste
podania
| Časté
| Reakcie v mieste podania
injekcie***
|
Menej časté
| Únava, návaly tepla, periférny
edém, pyrexia
|
Laboratórne a funkčné vyšetrenia
| Menej časté
| Zrýchlená srdcová frekvencia
|
Úrazy, otravy a komplikácie
liečebného postupu
| Menej časté
| Kontúzia
|
* Výpočet založený na celkovom počte jednotlivých pacientov vo všetkých klinických štúdiách
(214)
** Zvýšenie pečeňových enzýmov sa týka alanín aminotransferázy, aspartát aminotransferázy, gama-glutamyltransferázy a bilirubínu
*** Reakcie v mieste podania injekcie zahŕňajú erytém v mieste podania injekcie, opuch v mieste
podania injekcie a svrbenie v mieste podania injekcie
PopisvybranýchnežiaducichreakciíPočas všetkých klinických štúdií s liekom NovoEight bolo celkovo hlásených 30 nežiaducich reakcií a to u 19 z 214 pacientov liečených liekom NovoEight. Najčastejšou hlásenou nežiaducou reakciou
bola reakcia v mieste podania injekcie a zvýšenie pečeňových enzýmov. Z 30 nežiaducich reakcií, 2
boli hlásené u 1 z 31 pacientov do 6 rokov, žiadna u pacientov od 6 do 18 rokov a 28 bolo hlásených u 18 zo 127 dospelých.
PediatrickápopuláciaV klinickej štúdii zahŕňajúcej 63 pediatrických pacientov vo veku medzi 0 a 12 rokov a 24 dospievajúcich vo veku medzi 12 a 18 rokov so závažnou hemofíliou A, neboli pozorované žiadne rozdiely v bezpečnostnom profile lieku NovoEight medzi pediatrickými pacientmi a dospelými.
Hláseniepodozrenínanežiaducereakcie Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieŽiadne príznaky predávkovania rekombinantným koagulačným faktorom VIII neboli hlásené.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antihemoragiká, krvný koagulačný faktor VIII, ATC kód: zatiaľ
nepridelený
MechanizmusúčinkuNovoEight obsahuje turoktokog alfa, ľudský koagulačný faktor VIII (rDNA), so skrátenou B- doménou. Tento glykoproteín má zhodnú štruktúru s aktivovaným ľudským faktorom VIII. Posttranslačné modifikácie sú podobné posttranslačným modifikáciám molekuly získanej z plazmy. Sulfatačné tyrozínové miesto je Tyr1680 (prirodzená úplná dĺžka), ktoré je dôležité pre väzbu na von Willebrandov faktor, je v molekule turoktokogu alfa plne sulfátované. Po podaní infúzie pacientovi
s hemofíliou sa faktor VIII viaže na endogénny von Willebrandov faktor v krvnom obehu pacienta. Komplex faktora VIII/von Willebrandov faktor sa skladá z dvoch molekúl (faktor VIII a von Willebrandov faktor) s rôznymi fyziologickými funkciami. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný faktor X konvertuje protrombín na trombín. Trombín potom konvertuje fibrinogén na fibrín a môže sa tvoriť zrazenina. Hemofília je vrodená porucha krvnej zrážanlivosti viazaná na pohlavie zapríčinená zníženou hladinou faktora VIIIC a dôsledkom je profúzne krvácanie do kĺbov,
svalov alebo vnútorných orgánov, buď spontánne alebo ako dôsledok úrazu alebo chirurgickej traumy. Pri substitučnej liečbe sa plazmatické hladiny faktora VIII zvýšia, tým sa dočasne upraví deficit
faktora a tým sa upraví tendencia ku krvácaniu.
KlinickáúčinnosťVykonali sa tri multicentrické, otvorené, nekontrolované štúdie, s cieľom hodnotenia bezpečnosti a účinnosti lieku NovoEight v profylaxii a liečbe krvácania u pacientov s už liečenou závažnou hemofíliou A (FVIII aktivita ≤1%). Štúdie zahŕňali 213 liečených pacientov; 150 dospievajúcich alebo dospelých pacientov bez inhibítorov vo veku od 12 rokov (≥150 dní liečby) a 63 pediatrických pacientov bez inhibítorov vo veku do 12 rokov (≥50 dní liečby). 187 z 213 pacientov pokračovalo
v rozšírenej bezpečnostnej štúdii. Liečba liekom NovoEight sa ukázala ako bezpečná a mala predpokladaný hemostatický a preventívny účinok. Počas akumulovanej liečby viac ako 54 000 dní (čo zodpovedá 342 paciento/rokov) nebola pozorovaná vo fáze 3a klinickej štúdie, u pacientov už predtým liečených, žiadna tvorba inhibítorov proti faktoru VIII. Z 1 377 hlásených krvácaní pozorovaných u 177 pacientov z 213, bolo 1 244 (90,3%) krvácaní zastavených 1-2 infúziami lieku NovoEight.
Tabuľka 3 Spotreba turoktokogu alfa a celková miera úspešnosti
| Mladšie deti
(0<6 rokov)
| Staršie deti
(6<12 rokov)
| Dospievajúci
(12<18
rokov)
| Dospelí
(≥18 rokov)
| Celkovo
|
Počet pacientov
| 31
| 32
| 24
| 126
| 213
|
Dávka použitá na
prevenciu
na pacienta (IU/kg
BW)
Priemer (SD)
|
40.1 (8.5)
|
36.6 (9.0)
|
27.0 (7.6)
|
26.9 (6.9)
|
30.3 (9.2)
|
Min ; Max
|
26.5 ; 57.3
|
24.9 ; 57.9
|
20.5 ; 46.9
|
20.0 ; 50.8
|
20.0 ; 57.9
|
Dávka použitá na
liečbu krvácania
(IU/kg BW)
Priemer (SD) Min ; Max
|
44.4 (17.9)
25.9 ; 193.8
|
40.0 (10.4)
25.5 ; 65.5
|
28.2 (10.2)
12.4 ; 76.8
|
33.8 (11.9)
9.3 ; 104.0
|
34.5 (12.6)
9.3 ; 193.8
|
Miera úspešnosti* %
|
92.9%
|
88.9%
|
79.7%
|
85.6%
|
85.9%
|
BW: Telesná hmotnosť, SD: Štandardná odchýlka
*Úspešnosť je definovaná buď ako „Výborná“ alebo „Dobrá“.
Celkovo sa uskutočnilo 14 chirurgických zákrokov u 14 pacientov, z ktorých 13 bolo veľkých chirurgických zákrokov a 1 bol malý. Hemostáza bola úspešná u všetkých chirurgických zákrokoch a nebolo hlásené žiadne zlyhanie liečby.
5.2 Farmakokinetické vlastnostiVšetky farmakokinetické štúdie s turoktokogom alfa boli uskutočnené u pacientov so závažnou hemofíliou A (FVIII ≤1 %), ktorí boli už predtým liečení. Analýza vzoriek plazmy sa vykonala pomocou jednostupňového koagulačného testu a chromogénnej metódy.
V medzinárodnej štúdii zahŕňajúcej 36 laboratórií bol stanovený obsah NovoEight ako FVIII C, bol vyhodnotený a porovnaný s liekom dostupným na trhu obsahujúcim rekombinantný faktor VIII s celou dĺžkou reťazca. Štúdia preukázala porovnateľné a konzistentné výsledky pre obidva lieky a tiež to, že NovoEight môže byť spoľahlivo v plazme stanovený bez toho, aby bol potrebný špeciálny štandard
pre NovoEight.
Farmakokinetické parametre jednorazovej dávky lieku NovoEight sú uvedené v Tabuľke 4 pre koagulačný test a v Tabuľke 5 pre chromogénnu metódu.
Tabuľka 4 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou hemofíliou A (FVIII ≤1%), koagulačná metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=33
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,018 (0,007)
| 0,020 (0,004)
| 0,022 (0,004)
|
AUC ((IU*h)/ml)
| 9,92 (4,11)
| 11,09 (3,74)
| 15,26 (5,77)
|
CL (ml/h/kg)
| 6,21 (3,66)
| 5,02 (1,68)
| 3,63 (1,09)
|
t½ (h)
| 7,65 (1,84)
| 8,02 (1,89)
| 11,00 (4,65)
|
Vss (ml/kg)
| 56,68 (26,43)
| 46,82 (10,63)
| 47,40 (9,21)
|
Cmax (IU/ml)
| 1,00 (0,58)
| 1,07 (0,35)
| 1,226 (0,41)
|
Priemerný čas
zotrvania (h)
| 9,63 (2,50)
| 9,91 (2,57)
| 14,19 5,08)
|
Tabuľka 5 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou
hemofíliou A (FVIII ≤1%), chromogénna metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=48
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,022 (0,006)
| 0,025 (0.006)
| 0,029 (0,006)
|
AUC ((IU*h)/ml)
| 12,23 (4,36)
| 14,37 (3.48)
| 19,63 (7,73)
|
CL (ml/h/kg)
| 4,59 (1,73)
| 3,70 (1.00)
| 2,86 (0,94)
|
t½ (h)
| 9,99 (1,71)
| 9,42 (1.52)
| 11,22 (6,86)
|
Vss (ml/kg)
|
55,46 (23,53)
|
41,23 (6.00)
|
38,18 (10,24)
|
Cmax (IU/ml)
|
1,12 (0,31)
|
1,25 (0.27)
|
1,63 (0,50)
|
Priemerný čas
zotrvania (h)
|
12,06 (1,90)
|
11,61 (2.32)
|
14,54 (5,77)
|
Farmakokinetické parametre boli porovnateľné medzi pediatrickými pacientmi vo veku do 6 rokov
a pediatrickými pacientmi od 6 do 12 rokov. Niektoré odchýlky boli pozorované vo farmakokinetických parametroch lieku NovoEight medzi pediatrickými a dospelými pacientmi. Vyššie
hodnoty CL a kratší t½ sa zistil u pediatrických pacientov v porovnaní s dospelými pacientmi
s hemofíliou A, čo môže byť čiastočne spôsobené známym vyšším plazmatickým objemom na
kilogram telesnej hmotnosti u mladších pacientov.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe konvenčných farmakologických štúdií bezpečnosti a toxicity po opakovanom podaní neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokPrášok: Chlorid sodný L-histidín Sacharóza Polysorbát 80
L-metionín
Dihydrát chloridu vápenatého
Hydroxid sodný
Kyselina chlorovodíková
Rozpúšťadlo: Chlorid sodný Voda na injekciu
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnostiPredotvorením:2 roky
Počas času použiteľnosti môže byť liek uchovávaný nepretržite pri izbovej teplote ≤30°C počas obdobia nepresahujúceho 6 mesiacov. Ak bol liek už raz vybratý z chladničky, nesmie sa už do chladničky vrátiť. Zaznačte si prosím na krabičke dátum, kedy ste začali liek uchovávať pri izbovej teplote.
Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom.
Po rekonštitúcii:Chemická a fyzikálna stabilita po rekonštitúcii bola dokázaná počas 24 hodín pri 2°C – 8°C a počas
4 hodín pri uchovávaní pri ≤30°C. Z mikrobiologického hľadiska sa má tento liek použiť ihneď po rekonštitúcii. Ak sa nepoužije ihneď, čas a podmienky uchovávania lieku po rekonštitúcii a pred
použitím je zodpovednosť používateľa a zvyčajne nemá byť čas dlhší ako 4 hodiny pri uchovávaní pri
≤30°C alebo 24 hodín pri 2°C - 8°C, ak rekonštitúcia prebehla za kontrolovaných a validovaných aseptických podmienok.
Všetok nepoužitý liek, ktorý bol uchovávaný pri izbovej teplote dlhšie ako 4 hodiny má byť zlikvidovaný.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke (2ºC - 8ºC). Chráňte pred mrazom.
Uchovávanie pri izbovej teplote a podmienky uchovávania lieku po rekonštitúcii, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaKaždé balenie lieku NovoEight 500 IU prášok a rozpúšťadlo na injekčný roztok obsahuje:
– 1 sklenenú injekčnú liekovku (typ I) s práškom a chlórobutylovou gumenou zátkou
– 1 sterilný adaptér injekčnej liekovky na rekonštitúciu
– 1 naplnenú injekčnú striekačku so 4 ml rozpúšťadla s záverom spätného chodu (polypropylén), gumeným piestom (brómbutyl) a uzáverom so zátkou (brómbutyl)
– 1 nástavec piesta (polypropylén).
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanieNovoEight je určený na intravenózne podanie po rekonštitúcii prášku s rozpúšťadlom, ktoré je dodávané v injekčnej striekačke. Po rekonštitúcii je roztok číry alebo mierne opalizujúci. Roztok nepoužite, ak je zakalený alebo obsahuje usadeniny.
Budete potrebovať aj infúznu súpravu (hadičku a motýlikovú ihlu), sterilné alkoholové tampóny, gázové tampóny a náplasti. Tieto pomôcky nie je súčasťou balenia lieku NovoEight.
Vždy dodržujte aseptickú techniku.
Rekonštitúcia:A)

Vyberte injekčnú liekovku, adaptér injekčnej
Aliekovky a naplnenú injekčnú striekačku
z krabičky. Nástavec piesta nechajte v krabičke. Nechajte injekčnú liekovku a naplnenú injekčnú
striekačku dosiahnuť izbovú teplotu. Môžete to urobiť ich podržaním v rukách, až kým necítite,
že sú také teplé ako vaše ruky. Nezohrievajte injekčnú liekovku a naplnenú injekčnú striekačku iným spôsobom.
B)

Odstráňte plastové viečko z injekčnej liekovky.
BAk je plastové viečko uvoľnené, alebo chýba,
injekčnú liekovku nepoužite
. Očistite gumovú zátku na injekčnej liekovke sterilným
alkoholovým tampónom a nechajte ju pred použitím pár sekúnd schnúť na vzduchu.
C)
Odstráňte ochranný papier z adaptéra injekčnej
Cliekovky. Ak ochranný papier nie je úplne
uzavretý alebo je roztrhnutý, nepoužite adaptér injekčnej liekovky.
Nevyberajte prstami adaptér injekčnej liekovky
z ochranného krytu.
D)
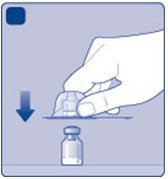
Otočte ochranný kryt a zatlačte adaptér na
Dinjekčnú liekovku. Neodstraňujte adaptér z
injekčnej liekovky, keď je už pripevnený.
E)
Jemne pritlačte ochranný kryt palcom a ukazovákom ako je znázornené. Odstráňte
ochranný kryt z adaptéra injekčnej liekovky.
 E
EF)
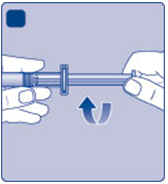
Pevne uchopte nástavec piesta za širší koniec
Fa ihneď ho pripojte k injekčnej striekačke otáčaním
v smere hodinových ručičiek vnútri naplnenej injekčnej striekačky, až kým nepocítite odpor.
G)

Odstráňte kryt injekčnej striekačky z naplnenej
Ginjekčnej striekačky ohnutím dole, až kým sa
nezlomí perforácia. Nedotýkajte sa špičky injekčnej striekačky pod krytom injekčnej
striekačky.
H)
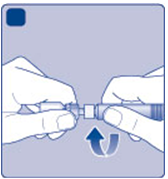
Naskrutkujte naplnenú injekčnú striekačku
Hbezpečne na adaptér, až kým nepocítite odpor.
I)
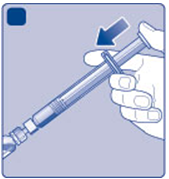
Držte naplnenú injekčnú striekačku s injekčnou
Iliekovkou naklonenou smerom dole. Tlačte
nástavec piesta, aby ste vstrekli všetko rozpúšťadlo do injekčnej liekovky.
J)

Držte nástavec piesta stlačený dole a jemne
Jkrúžte s injekčnou liekovkou, až sa rozpustí
všetok prášok. Netraste injekčnou liekovkou, lebo to môže spôsobiť spenenie.
Odporúča sa použiť NovoEight ihneď po rekonštitúcii. Podmienky uchovávania rekonštituovaného
lieku, pozri časť 6.3.
Ak je potrebná väčšia dávka, opakujte kroky A až J s ďalšími injekčnými liekovkami, adaptérmi
injekčnej liekovky a naplnenými injekčnými striekačkami.
Podanierekonštituovanéhoroztoku:
K)
Držte nástavec piesta stlačený na doraz. Otočte injekčnú striekačku s injekčnou liekovkou hore dnom. Prestaňte tlačiť nástavec piesta a nechajte ho pohnúť sa samovoľne naspäť, kým rekonštituovaný roztok naplní injekčnú striekačku. Ťahajte nástavec piesta jemne smerom dole, aby ste natiahli rekonštituovaný roztok do injekčnej striekačky.
V prípade, že potrebujete len časť z injekčnej liekovky, použite stupnicu na injekčnej striekačke, aby ste videli koľko rekonštituovaného roztoku ste odobrali, ako vám povedal lekár alebo zdravotná sestra.
Kým držíte injekčnú liekovku hore dnom, klepkajte jemne na injekčnú striekačku, aby všetky bubliny vystúpili nahor. Tlačte nástavec piesta pomaly, až kým všetky vzduchové bubliny nevytlačíte.
|
K
|
L)
Odskrutkujte adaptér s injekčnou liekovkou.
NovoEight je teraz pripravený na injekčné podanie. Vyberte si vhodné miesto a pomaly si podajte injekciu lieku NovoEight do žily počas 2-5 minút.
|
L
|
Likvidácia:

Po podaní injekcie, bezpečne zlikvidujte všetok nepoužitý roztok lieku NovoEight, injekčnú
striekačku s infúznou súpravou, injekčnú liekovku s adaptérom injekčnej liekovky, a ostatný odpadový materiál ako vám povedal lekárnik.
Nevyhadzujte ho s bežným domovým odpadom.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovo Nordisk A/S Novo Allé
DK-2880 Bagsværd
Dánsko
8. REGISTRAČNÉ ČÍSLA
EU/1/13/888/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUNovoEight 1000 IU prášok a rozpúšťadlo na injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá injekčná liekovka s práškom obsahuje 1000 IU ľudského koagulačného faktora VIII (rDNA), turoktokog alfa.
Po rekonštitúcii obsahuje NovoEight približne 250 IU/ml ľudského koagulačného faktora VIII (rDNA), turoktokog alfa.
Účinnosť (IU) sa stanovuje podľa Európskeho liekopisu chromogénnym testom. Špecifická aktivita
NovoEight je približne 8 300 IU/mg bielkoviny.
Turoktokog alfa (ľudský koagulačný faktor VIII (rDNA)) je purifikovaná bielkovina, ktorá obsahuje
1 445 aminokyselín s molekulovou hmotnosťou približne 166 kDA. Vyrába sa technológiou rekombinantnej DNA z buniek ovária čínskeho škrečka (CHO), a vyrába sa bez pridania akýchkoľvek
ľudských alebo živočíšnych derivovaných bielkovín pri spracovaní bunkových kultúr, čistení alebo
koncovej úprave.
Turoktokog alfa je rekombinantný ľudský koagulačný faktor VIII so skrátenou B-doménou (B- doména pozostáva z 21 aminokyselín prirodzenej B-domény) bez akýchkoľvek modifikácií v poradí aminokyselín.
Pomocnálátkasoznámymúčinkom:0,31 mmol sodíka (7 mg) na 1 ml rekonštituovaného roztoku.
Úplný zoznam pomocných látok, pozri bod 6.1.
3. LIEKOVÁ FORMAPrášok a rozpúšťadlo na injekčný roztok.
Biely alebo jemne žltý prášok alebo drobivá hmota. Číry a bezfarebný injekčný roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieLiečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII). NovoEight môžu užívať všetky vekové skupiny.
4.2 Dávkovanie a spôsob podaniaLiečba sa má začať pod dohľadom lekára so skúsenosťami s liečbou hemofílie.
D
oteraz
neliečení
pacienti
Bezpečnosť a účinnosť lieku NovoEight u doteraz neliečených pacientov nebola zatiaľ stanovená. Nie sú k dispozícii žiadne údaje.
Dávkovanie
Dávkovanie a trvanie substitučnej liečby závisí od závažnosti deficitu faktora VIII, mieste a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII je vyjadrený v medzinárodných jednotkách (IU), ktoré zodpovedajú súčasnému WHO štandardu pre lieky obsahujúce faktor VIII. Aktivita faktora VIII v plazme je vyjadrená buď v percentách (porovnaním k normálnej ľudskej plazme), alebo v medzinárodných jednotkách (porovnaním k medzinárodnému štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba v prípade potreby
Výpočet požadovanej dávky faktora VIII vychádza z empirického zistenia, že 1 medzinárodná jednotka (IU) faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o
2 IU/dl. Požadovaná dávka sa určí použitím nasledujúceho vzorca:
Požadovaný počet jednotiek = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) (IU/dl) x
0,5 (IU/kg na IU/dl)
Množstvo, ktoré sa má podať a frekvencia podania sa majú vždy riadiť podľa klinickej účinnosti u jednotlivého pacienta.
V nasledujúcich prípadoch krvácania počas zodpovedajúceho obdobia nemá aktivita faktora VIII klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Nasledujúcu tabuľku možno použiť ako návod na dávkovanie pri epizódach krvácania a pri chirurgických zákrokoch:
Tabuľka 1 Návod na dávkovanie pri epizódach krvácania a operáciách

Stupeň krvácania/Typ chirurgického zákroku
Požadovaná hladina faktora VIII (%) (IU/dl)
Frekvencia dávok (hodiny)/Trvanie liečby (dni)
Kr
v
ácanie
Začínajúca hemartróza, krvácanie do
svalov alebo do ústnej dutiny
20-40 Opakovať každých 12 až 24 hodín,
najmenej 1 deň, až kým sa krvácanie indikované bolesťou
nezastaví alebo do zahojenia.
Rozsiahlejšia hemartróza, krvácanie
do svalov alebo hematóm
30-60 Opakovať infúziu každých 12-
24 hodín počas 3-4 alebo viac dní, kým bolesť a akútna slabosť neustúpi

Život ohrozujúce krvácanie 60-100 Opakovať infúziu každých 8 až
24 hodín až do stavu mimo ohrozenia života
C
hirurgický
zákrok
M
enší chirurgický zákrok, vrátane extrakcie zubov
30-60 Každých 24 hodín, najmenej 1 deň, až do zahojenia

Stupeň krvácania/Typ chirurgického zákroku
Požadovaná hladina faktora VIII (%) (IU/dl)
Frekvencia dávok (hodiny)/Trvanie liečby (dni)
Veľký chirurgický zákrok 80-100
(pred a po operácii)
Opakovať infúziu každých 8-
24 hodín až do adekvátneho zahojenia rany, potom pokračovať
v liečbe najmenej ďalších 7 dní na
udržanie faktora VIII na 30% až
60% (IU/dl)
 Profylaxia
Profylaxia
Na dlhodobú prevenciu krvácania u pacientov so závažnou hemofíliou A. Obvyklé odporučené dávky sú 20-40 IU faktora VIII na kg telesnej hmotnosti každý druhý deň alebo 20-50 IU faktora VIII na kg
telesnej hmotnosti 3-krát týždenne. V niektorých prípadoch, zvlášť u mladých pacientov môžu byť potrebné kratšie intervaly v dávkovaní alebo vyššie dávky.
Monitorovanie liečbyPočas liečby sa odporúča robiť príslušné stanovenie hladín faktora VIII, aby sa určila veľkosť dávky, ktorá sa má podať a frekvencia podania injekcií. V prípade veľkých chirurgických zákrokov je
nevyhnutné presné monitorovanie substitučnej liečby pomocou koagulačnej analýzy (aktivita faktora
VIII v plazme). Jednotliví pacienti môžu rozdielne reagovať na faktor VIII, môžu dosiahnuť rôzne úrovne stabilizácie in vivo a môžu sa prejaviť rôznym biologickým polčasom.
Chirurgický zákrokNie sú žiadne skúsenosti s chirurgickými zákrokmi u pediatrických pacientov.
Starší ľudiaNie sú žiadne skúsenosti s pacientmi
> 65 rokov.
Pediatrická populáciaNa dlhodobú profylaxiu krvácania pacientov mladších ako 12 rokov sa odporúčajú dávky 25-50 IU faktora VIII na kg telesnej hmotnosti každý druhý deň, alebo 25-60 IU faktora VIII na kg telesnej hmotnosti 3-krát týždenne. Pre pediatrických pacientov starších ako 12 rokov sú odporúčania dávkovania rovnaké ako pre dospelých.
SpôsobpodávaniaIntravenózne použitie.
Odporúčaná rýchlosť infúzie pre NovoEight je 1-2 ml/min. Rýchlosť sa má určiť tak, aby vyhovovala pacientovi.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo ktorúkoľvek z pomocných látok uvedených v časti 6.1. Známa alergická reakcia na škrečiu bielkovinu.
4.4 Osobitné upozornenia a opatrenia pri používaníHypersenzitivitaPri užívaní NovoEight sa môžu vyskytnúť hypersenzitívne reakcie alergického typu. Produkt obsahuje stopy škrečích bielkovín, ktoré môžu u niektorých pacientov vyvolávať alergické reakcie. Ak sa objavia príznaky precitlivenosti, pacienti majú byť poučení, aby ihneď prerušili liečbu týmto liekom a
obrátili sa na svojho lekára. Pacienti majú byť informovaní o počiatočných príznakoch hypersenzitívnych reakcií, vrátane žihľavky, generalizovanej urtikárie, zvierania na hrudníku, sipotu, hypotenzie a anafylaxie.
V prípade šoku sa má dodržať štandardná medicínska liečba pri šoku. Inhibítory
Známou komplikáciou liečby v jednotlivých prípadoch hemofílie A je tvorba neutralizujúcich
protilátok (inhibítorov) k faktoru VIII. Tieto inhibítory sú obyčajne IgG imunoglobulíny pôsobiace proti koagulačnej aktivite faktora VIII, ktorá je kvantifikovaná Bethesda jednotkami (BU) na ml plazmy pri použití modifikovanej metódy. Riziko tvorby inhibítorov koreluje s expozíciou faktora VIII, toto riziko býva najvyššie počas prvých 20 dní expozície. Zriedkavo sa môžu inhibítory tvoriť aj počas prvých 100 dňoch expozície.
Pacienti, ktorí boli už predtým liečení s expozíciou viac ako 100 dní a mali už v predošlej anamnéze tvorbu inhibítorov, pri zmene liečby z niektorého lieku obsahujúceho faktor VIII na iný, došlo
v niektorých prípadoch opäť k tvorbe inhibítorov (nízky titer). Preto sa u všetkých pacientov odporúča vždy pri zmene liečby na iný liek, pozorne monitorovať vznik inhibítorov.
Všeobecne u všetkých pacientov liečených liekmi s koagulačným faktorom VIII sa má pozorne sledovať tvorba inhibítorov vhodným klinickým pozorovaním a laboratórnymi testami. Ak sa nedosiahne očakávaná hladina aktivity faktora VIII v plazme, alebo ak sa krvácanie nezvládne príslušnou dávkou, má sa robiť testovanie na prítomnosť inhibítora faktora VIII. U pacientov
s vysokou hladinou inhibítora, môže byť liečba faktorom VIII neúčinná a má sa uvažovať o iných možnostiach liečby. Liečbu takýchto pacientov má viesť lekár so skúsenosťami s liečbou hemofílie a s inhibítormi faktora VIII.
Dôrazne sa odporúča, aby sa vždy pri podaní lieku NovoEight pacientovi, zaznamenal názov a číslo šarže lieku, aby bolo možné spätne priradiť číslo šarže lieku k pacientovi.
Pomocnélátky,ktorétrebavziaťdoúvahy
Po rekonštitúcii obsahuje tento liek 0,31 mmol sodíka (7 mg) na 1 ml rekonštituovaného roztoku. To je potrebné vziať do úvahy u pacientov so sodíkovou diétou.
Pediatrickápopulácia
Uvedené varovania a upozornenia platia pre dospelých aj deti.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s liekom NovoEight.
4.6 Fertilita, gravidita, a laktácia
Neuskutočnili sa žiadne reprodukčné štúdie na zvieratách s liekom NovoEight. Vzhľadom na vzácny výskyt hemofílie A u žien, nie sú skúsenosti s použitím faktora VIII počas tehotenstva a laktácie. Preto sa má faktor VIII použiť počas tehotenstva alebo laktácie, len ak je jednoznačná indikácia.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
NovoEight nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Zriedkavo boli hlásené hypersenzitivita alebo alergická reakcia (ktoré môžu zahŕňať angioedém, pálenie a štípanie v mieste podania infúzie, triašku, začervenanie, generalizovanú urtikáriu, bolesť
hlavy, vyrážku, hypotenziu, letargiu, nauzeu, nevoľnosť, tachykardiu, zvieranie na hrudníku, brnenie, vracanie, sipot) a v niektorých prípadoch môžu viesť k závažnej anafylaxii (vrátane šoku).
Veľmi zriedkavo bola hlásená tvorba protilátok na škrečie bielkoviny spojené s hypersenzitívnymi reakciami.
U pacientov s hemofíliou A sa môžu tvoriť neutralizujúce protilátky (inhibítory) proti faktoru VIII. Ak sa objavia takéto inhibítory, stav sa bude prejavovať ako nedostatočná klinická odpoveď. V týchto prípadoch sa odporúča obrátiť sa špecializované centrum pre liečbu hemofílie.
TabuľkovýzoznamnežiaducichreakciíTabuľka dolu je v súlade s klasifikáciou podľa tried orgánových systémov MedDRA (SOC and
Preferred Term Level).
Frekvencia výskytu je hodnotená podľa nasledujúcej konvencie: veľmi časté (≥1/10), časté (≥1/100 až
<1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé
(<1/10 000), neznáma (z dostupných údajov sa nedá určiť).
V každej skupine frekvencie, sú nežiaduce reakcie uvedené podľa klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich reakcií lieku v klinických štúdiách
Trieda orgánových systémov
| Frekvencia*
| Nežiaduca reakcia
|
Psychické poruchy
| Menej časté
| Nespavosť
|
Poruchy nervového systému
| Menej časté
| Bolesť hlavy, závrat
|
Poruchy srdca a srdcovej činnosti
| Menej časté
| Sínusová tachykardia
|
Poruchy ciev
| Menej časté
| Hypertenzia, lymfedém
|
Poruchy pečene a žlčových ciest
| Časté
| Zvýšenie pečeňových enzýmov**
|
Poruchy kože a podkožného tkaniva
| Menej časté
| Vyrážka
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
| Menej časté
| Muskuloskeletálna stuhnutosť,
artropatia, bolesti končatín, muskuloskeletálna bolesť
|
Celkové poruchy a reakcie v mieste
podania
| Časté
| Reakcie v mieste podania
injekcie***
|
Menej časté
| Únava, návaly tepla, periférny
edém, pyrexia
|
Laboratórne a funkčné vyšetrenia
| Menej časté
| Zrýchlená srdcová frekvencia
|
Úrazy, otravy a komplikácie
liečebného postupu
| Menej časté
| Kontúzia
|
* Výpočet založený na celkovom počte jednotlivých pacientov vo všetkých klinických štúdiách
(214)
** Zvýšenie pečeňových enzýmov sa týka alanín aminotransferázy, aspartát aminotransferázy, gama-glutamyltransferázy a bilirubínu
*** Reakcie v mieste podania injekcie zahŕňajú erytém v mieste podania injekcie, opuch v mieste
podania injekcie a svrbenie v mieste podania injekcie
PopisvybranýchnežiaducichreakciíPočas všetkých klinických štúdií s liekom NovoEight bolo celkovo hlásených 30 nežiaducich reakcií a to u 19 z 214 pacientov liečených liekom NovoEight. Najčastejšou hlásenou nežiaducou reakciou
bola reakcia v mieste podania injekcie a zvýšenie pečeňových enzýmov. Z 30 nežiaducich reakcií, 2
boli hlásené u 1 z 31 pacientov do 6 rokov, žiadna u pacientov od 6 do 18 rokov a 28 bolo hlásených u 18 zo 127 dospelých.
PediatrickápopuláciaV klinickej štúdii zahŕňajúcej 63 pediatrických pacientov vo veku medzi 0 a 12 rokov a 24 dospievajúcich vo veku medzi 12 a 18 rokov so závažnou hemofíliou A, neboli pozorované žiadne rozdiely v bezpečnostnom profile lieku NovoEight medzi pediatrickými pacientmi a dospelými.
Hláseniepodozrenínanežiaducereakcie Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieŽiadne príznaky predávkovania rekombinantným koagulačným faktorom VIII neboli hlásené.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antihemoragiká, krvný koagulačný faktor VIII, ATC kód: zatiaľ
nepridelený
MechanizmusúčinkuNovoEight obsahuje turoktokog alfa, ľudský koagulačný faktor VIII (rDNA), so skrátenou B- doménou. Tento glykoproteín má zhodnú štruktúru s aktivovaným ľudským faktorom VIII. Posttranslačné modifikácie sú podobné posttranslačným modifikáciám molekuly získanej z plazmy. Sulfatačné tyrozínové miesto je Tyr1680 (prirodzená úplná dĺžka), ktoré je dôležité pre väzbu na von Willebrandov faktor, je v molekule turoktokogu alfa plne sulfátované. Po podaní infúzie pacientovi
s hemofíliou sa faktor VIII viaže na endogénny von Willebrandov faktor v krvnom obehu pacienta. Komplex faktora VIII/von Willebrandov faktor sa skladá z dvoch molekúl (faktor VIII a von Willebrandov faktor) s rôznymi fyziologickými funkciami. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný faktor X konvertuje protrombín na trombín. Trombín potom konvertuje fibrinogén na fibrín a môže sa tvoriť zrazenina. Hemofília je vrodená porucha krvnej zrážanlivosti viazaná na pohlavie zapríčinená zníženou hladinou faktora VIIIC a dôsledkom je profúzne krvácanie do kĺbov,
svalov alebo vnútorných orgánov, buď spontánne alebo ako dôsledok úrazu alebo chirurgickej traumy. Pri substitučnej liečbe sa plazmatické hladiny faktora VIII zvýšia, tým sa dočasne upraví deficit
faktora a tým sa upraví tendencia ku krvácaniu.
KlinickáúčinnosťVykonali sa tri multicentrické, otvorené, nekontrolované štúdie, s cieľom hodnotenia bezpečnosti a účinnosti lieku NovoEight v profylaxii a liečbe krvácania u pacientov s už liečenou závažnou hemofíliou A (FVIII aktivita ≤1%). Štúdie zahŕňali 213 liečených pacientov; 150 dospievajúcich alebo dospelých pacientov bez inhibítorov vo veku od 12 rokov (≥150 dní liečby) a 63 pediatrických pacientov bez inhibítorov vo veku do 12 rokov (≥50 dní liečby). 187 z 213 pacientov pokračovalo
v rozšírenej bezpečnostnej štúdii. Liečba liekom NovoEight sa ukázala ako bezpečná a mala predpokladaný hemostatický a preventívny účinok. Počas akumulovanej liečby viac ako 54 000 dní (čo zodpovedá 342 paciento/rokov) nebola pozorovaná vo fáze 3a klinickej štúdie, u pacientov už predtým liečených, žiadna tvorba inhibítorov proti faktoru VIII. Z 1 377 hlásených krvácaní pozorovaných u 177 pacientov z 213, bolo 1 244 (90,3%) krvácaní zastavených 1-2 infúziami lieku NovoEight.
Tabuľka 3 Spotreba turoktokogu alfa a celková miera úspešnosti
| Mladšie deti
(0<6 rokov)
| Staršie deti
(6<12 rokov)
| Dospievajúci
(12<18
rokov)
| Dospelí
(≥18 rokov)
| Celkovo
|
Počet pacientov
| 31
| 32
| 24
| 126
| 213
|
Dávka použitá na
prevenciu
na pacienta (IU/kg
BW)
Priemer (SD)
|
40.1 (8.5)
|
36.6 (9.0)
|
27.0 (7.6)
|
26.9 (6.9)
|
30.3 (9.2)
|
Min ; Max
|
26.5 ; 57.3
|
24.9 ; 57.9
|
20.5 ; 46.9
|
20.0 ; 50.8
|
20.0 ; 57.9
|
Dávka použitá na
liečbu krvácania
(IU/kg BW) Priemer (SD)
Min ; Max
|
44.4 (17.9)
25.9 ; 193.8
|
40.0 (10.4)
25.5 ; 65.5
|
28.2 (10.2)
12.4 ; 76.8
|
33.8 (11.9)
9.3 ; 104.0
|
34.5 (12.6)
9.3 ; 193.8
|
Miera úspešnosti* %
|
92.9%
|
88.9%
|
79.7%
|
85.6%
|
85.9%
|
BW: Telesná hmotnosť, SD: Štandardná odchýlka
*Úspešnosť je definovaná buď ako „Výborná“ alebo „Dobrá“.
Celkovo sa uskutočnilo 14 chirurgických zákrokov u 14 pacientov, z ktorých 13 bolo veľkých chirurgických zákrokov a 1 bol malý. Hemostáza bola úspešná u všetkých chirurgických zákrokoch a nebolo hlásené žiadne zlyhanie liečby.
5.2 Farmakokinetické vlastnostiVšetky farmakokinetické štúdie s turoktokogom alfa boli uskutočnené u pacientov so závažnou hemofíliou A (FVIII ≤1 %), ktorí boli už predtým liečení. Analýza vzoriek plazmy sa vykonala pomocou jednostupňového koagulačného testu a chromogénnej metódy.
V medzinárodnej štúdii zahŕňajúcej 36 laboratórií bol stanovený obsah NovoEight ako FVIII C, bol vyhodnotený a porovnaný s liekom dostupným na trhu obsahujúcim rekombinantný faktor VIII s celou dĺžkou reťazca. Štúdia preukázala porovnateľné a konzistentné výsledky pre obidva lieky a tiež to, že NovoEight môže byť spoľahlivo v plazme stanovený bez toho, aby bol potrebný špeciálny štandard
pre NovoEight.
Farmakokinetické parametre jednorazovej dávky lieku NovoEight sú uvedené v Tabuľke 4 pre koagulačný test a v Tabuľke 5 pre chromogénnu metódu.
Tabuľka 4 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou hemofíliou A (FVIII ≤1%), koagulačná metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=33
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,018 (0,007)
| 0,020 (0,004)
| 0,022 (0,004)
|
AUC ((IU*h)/ml)
| 9,92 (4,11)
| 11,09 (3,74)
| 15,26 (5,77)
|
CL (ml/h/kg)
| 6,21 (3,66)
| 5,02 (1,68)
| 3,63 (1,09)
|
t½ (h)
| 7,65 (1,84)
| 8,02 (1,89)
| 11,00 (4,65)
|
Vss (ml/kg)
| 56,68 (26,43)
| 46,82 (10,63)
| 47,40 (9,21)
|
Cmax (IU/ml)
| 1,00 (0,58)
| 1,07 (0,35)
| 1,226 (0,41)
|
Priemerný čas
zotrvania (h)
| 9,63 (2,50)
| 9,91 (2,57)
| 14,19 5,08)
|
Tabuľka 5 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou
hemofíliou A (FVIII ≤1%), chromogénna metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=48
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,022 (0,006)
| 0,025 (0.006)
| 0,029 (0,006)
|
AUC ((IU*h)/ml)
| 12,23 (4,36)
| 14,37 (3.48)
| 19,63 (7,73)
|
CL (ml/h/kg)
| 4,59 (1,73)
| 3,70 (1.00)
| 2,86 (0,94)
|
t½ (h)
| 9,99 (1,71)
| 9,42 (1.52)
| 11,22 (6,86)
|
Vss (ml/kg)
|
55,46 (23,53)
|
41,23 (6.00)
|
38,18 (10,24)
|
Cmax (IU/ml)
|
1,12 (0,31)
|
1,25 (0.27)
|
1,63 (0,50)
|
Priemerný čas
zotrvania (h)
|
12,06 (1,90)
|
11,61 (2.32)
|
14,54 (5,77)
|
Farmakokinetické parametre boli porovnateľné medzi pediatrickými pacientmi vo veku do 6 rokov
a pediatrickými pacientmi od 6 do 12 rokov. Niektoré odchýlky boli pozorované vo farmakokinetických parametroch lieku NovoEight medzi pediatrickými a dospelými pacientmi. Vyššie
hodnoty CL a kratší t½ sa zistil u pediatrických pacientov v porovnaní s dospelými pacientmi
s hemofíliou A, čo môže byť čiastočne spôsobené známym vyšším plazmatickým objemom na
kilogram telesnej hmotnosti u mladších pacientov.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe konvenčných farmakologických štúdií bezpečnosti a toxicity po opakovanom podaní neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokPrášok: Chlorid sodný L-histidín Sacharóza Polysorbát 80
L-metionín
Dihydrát chloridu vápenatého
Hydroxid sodný
Kyselina chlorovodíková
Rozpúšťadlo: Chlorid sodný Voda na injekciu
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnostiPredotvorením:2 roky
Počas času použiteľnosti môže byť liek uchovávaný nepretržite pri izbovej teplote ≤30°C počas obdobia nepresahujúceho 6 mesiacov. Ak bol liek už raz vybratý z chladničky, nesmie sa už do chladničky vrátiť. Zaznačte si prosím na krabičke dátum, kedy ste začali liek uchovávať pri izbovej teplote.
Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom.
Po rekonštitúcii:Chemická a fyzikálna stabilita po rekonštitúcii bola dokázaná počas 24 hodín pri 2°C – 8°C a počas
4 hodín pri uchovávaní pri ≤30°C. Z mikrobiologického hľadiska sa má tento liek použiť ihneď po rekonštitúcii. Ak sa nepoužije ihneď, čas a podmienky uchovávania lieku po rekonštitúcii a pred
použitím je zodpovednosť používateľa a zvyčajne nemá byť čas dlhší ako 4 hodiny pri uchovávaní pri
≤30°C alebo 24 hodín pri 2°C - 8°C, ak rekonštitúcia prebehla za kontrolovaných a validovaných aseptických podmienok.
Všetok nepoužitý liek, ktorý bol uchovávaný pri izbovej teplote dlhšie ako 4 hodiny má byť zlikvidovaný.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke (2ºC - 8ºC). Chráňte pred mrazom.
Uchovávanie pri izbovej teplote a podmienky uchovávania lieku po rekonštitúcii, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaKaždé balenie lieku NovoEight 1000 IU prášok a rozpúšťadlo na injekčný roztok obsahuje:
– 1 sklenenú injekčnú liekovku (typ I) s práškom a chlórobutylovou gumenou zátkou
– 1 sterilný adaptér injekčnej liekovky na rekonštitúciu
– 1 naplnenú injekčnú striekačku so 4 ml rozpúšťadla s záverom spätného chodu (polypropylén), gumeným piestom (brómbutyl) a uzáverom so zátkou (brómbutyl)
– 1 nástavec piesta (polypropylén).
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanieNovoEight je určený na intravenózne podanie po rekonštitúcii prášku s rozpúšťadlom, ktoré je dodávané v injekčnej striekačke. Po rekonštitúcii je roztok číry alebo mierne opalizujúci. Roztok nepoužite, ak je zakalený alebo obsahuje usadeniny.
Budete potrebovať aj infúznu súpravu (hadičku a motýlikovú ihlu), sterilné alkoholové tampóny, gázové tampóny a náplasti. Tieto pomôcky nie je súčasťou balenia lieku NovoEight.
Vždy dodržujte aseptickú techniku.
Rekonštitúcia:A)

Vyberte injekčnú liekovku, adaptér injekčnej
Aliekovky a naplnenú injekčnú striekačku
z krabičky. Nástavec piesta nechajte v krabičke. Nechajte injekčnú liekovku a naplnenú injekčnú
striekačku dosiahnuť izbovú teplotu. Môžete to
urobiť ich podržaním v rukách, až kým necítite, že sú také teplé ako vaše ruky. Nezohrievajte
injekčnú liekovku a naplnenú injekčnú
striekačku iným spôsobom.
B)

Odstráňte plastové viečko z injekčnej liekovky.
BAk je plastové viečko uvoľnené, alebo chýba,
injekčnú liekovku nepoužite
. Očistite gumovú zátku na injekčnej liekovke sterilným
alkoholovým tampónom a nechajte ju pred použitím pár sekúnd schnúť na vzduchu.
C)

Odstráňte ochranný papier z adaptéra injekčnej
Cliekovky. Ak ochranný papier nie je úplne
uzavretý alebo je roztrhnutý, nepoužite adaptér injekčnej liekovky.
Nevyberajte prstami adaptér injekčnej liekovky
z ochranného krytu.
D)

Otočte ochranný kryt a zatlačte adaptér na
Dinjekčnú liekovku. Neodstraňujte adaptér z
injekčnej liekovky, keď je už pripevnený.
E)
Jemne pritlačte ochranný kryt palcom a ukazovákom ako je znázornené. Odstráňte
ochranný kryt z adaptéra injekčnej liekovky.
 E
EF)

Pevne uchopte nástavec piesta za širší koniec
Fa ihneď ho pripojte k injekčnej striekačke
otáčaním v smere hodinových ručičiek vnútri naplnenej injekčnej striekačky, až kým
nepocítite odpor.
G)

Odstráňte kryt injekčnej striekačky z naplnenej
Ginjekčnej striekačky ohnutím dole, až kým sa
nezlomí perforácia. Nedotýkajte sa špičky injekčnej striekačky pod krytom injekčnej
striekačky.
H)

Naskrutkujte naplnenú injekčnú striekačku
Hbezpečne na adaptér, až kým nepocítite odpor.
I)

Držte naplnenú injekčnú striekačku s injekčnou
Iliekovkou naklonenou smerom dole. Tlačte
nástavec piesta, aby ste vstrekli všetko rozpúšťadlo do injekčnej liekovky.
J)

Držte nástavec piesta stlačený dole a jemne
Jkrúžte s injekčnou liekovkou, až sa rozpustí
všetok prášok. Netraste injekčnou liekovkou, lebo to môže spôsobiť spenenie.
Odporúča sa použiť NovoEight ihneď po rekonštitúcii. Podmienky uchovávania rekonštituovaného
lieku, pozri časť 6.3.
Ak je potrebná väčšia dávka, opakujte kroky A až J s ďalšími injekčnými liekovkami, adaptérmi
injekčnej liekovky a naplnenými injekčnými striekačkami.
Podanierekonštituovanéhoroztoku:
K)
Držte nástavec piesta stlačený na doraz. Otočte injekčnú striekačku s injekčnou liekovkou hore dnom. Prestaňte tlačiť nástavec piesta a nechajte ho pohnúť sa samovoľne naspäť, kým rekonštituovaný roztok naplní injekčnú striekačku. Ťahajte nástavec piesta jemne smerom dole, aby ste natiahli rekonštituovaný roztok do injekčnej striekačky.
V prípade, že potrebujete len časť z injekčnej liekovky, použite stupnicu na injekčnej striekačke, aby ste videli koľko rekonštituovaného roztoku ste odobrali, ako vám povedal lekár alebo zdravotná sestra.
Kým držíte injekčnú liekovku hore dnom, klepkajte jemne na injekčnú striekačku, aby všetky bubliny vystúpili nahor. Tlačte nástavec piesta pomaly, až kým všetky vzduchové bubliny nevytlačíte.
|
K
|
L)
Odskrutkujte adaptér s injekčnou liekovkou.
NovoEight je teraz pripravený na injekčné podanie. Vyberte si vhodné miesto a pomaly si podajte injekciu lieku NovoEight do žily počas 2-5 minút.
|
L
|
Likvidácia:


Po podaní injekcie, bezpečne zlikvidujte všetok nepoužitý roztok lieku NovoEight, injekčnú
striekačku s infúznou súpravou, injekčnú liekovku s adaptérom injekčnej liekovky, a ostatný odpadový materiál ako vám povedal lekárnik.
Nevyhadzujte ho s bežným domovým odpadom.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovo Nordisk A/S Novo Allé
DK-2880 Bagsværd
Dánsko
8. REGISTRAČNÉ ČÍSLA
EU/1/13/888/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUNovoEight 1500 IU prášok a rozpúšťadlo na injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá injekčná liekovka s práškom obsahuje 1500 IU ľudského koagulačného faktora VIII (rDNA), turoktokog alfa.
Po rekonštitúcii obsahuje NovoEight približne 375 IU/ml ľudského koagulačného faktora VIII (rDNA), turoktokog alfa.
Účinnosť (IU) sa stanovuje podľa Európskeho liekopisu chromogénnym testom. Špecifická aktivita
NovoEight je približne 8 300 IU/mg bielkoviny.
Turoktokog alfa (ľudský koagulačný faktor VIII (rDNA)) je purifikovaná bielkovina, ktorá obsahuje
1 445 aminokyselín s molekulovou hmotnosťou približne 166 kDA. Vyrába sa technológiou rekombinantnej DNA z buniek ovária čínskeho škrečka (CHO), a vyrába sa bez pridania akýchkoľvek
ľudských alebo živočíšnych derivovaných bielkovín pri spracovaní bunkových kultúr, čistení alebo
koncovej úprave.
Turoktokog alfa je rekombinantný ľudský koagulačný faktor VIII so skrátenou B-doménou (B- doména pozostáva z 21 aminokyselín prirodzenej B-domény) bez akýchkoľvek modifikácií v poradí aminokyselín.
Pomocnálátkasoznámymúčinkom:0,31 mmol sodíka (7 mg) na 1 ml rekonštituovaného roztoku.
Úplný zoznam pomocných látok, pozri bod 6.1.
3. LIEKOVÁ FORMAPrášok a rozpúšťadlo na injekčný roztok.
Biely alebo jemne žltý prášok alebo drobivá hmota. Číry a bezfarebný injekčný roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieLiečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII). NovoEight môžu užívať všetky vekové skupiny.
4.2 Dávkovanie a spôsob podaniaLiečba sa má začať pod dohľadom lekára so skúsenosťami s liečbou hemofílie.
D
oteraz
neliečení
pacienti
Bezpečnosť a účinnosť lieku NovoEight u doteraz neliečených pacientov nebola zatiaľ stanovená. Nie sú k dispozícii žiadne údaje.
Dávkovanie
Dávkovanie a trvanie substitučnej liečby závisí od závažnosti deficitu faktora VIII, mieste a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII je vyjadrený v medzinárodných jednotkách (IU), ktoré zodpovedajú súčasnému WHO štandardu pre lieky obsahujúce faktor VIII. Aktivita faktora VIII v plazme je vyjadrená buď v percentách (porovnaním k normálnej ľudskej plazme), alebo v medzinárodných jednotkách (porovnaním k medzinárodnému štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba v prípade potreby
Výpočet požadovanej dávky faktora VIII vychádza z empirického zistenia, že 1 medzinárodná jednotka (IU) faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o
2 IU/dl. Požadovaná dávka sa určí použitím nasledujúceho vzorca:
Požadovaný počet jednotiek = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) (IU/dl) x
0,5 (IU/kg na IU/dl)
Množstvo, ktoré sa má podať a frekvencia podania sa majú vždy riadiť podľa klinickej účinnosti u jednotlivého pacienta.
V nasledujúcich prípadoch krvácania počas zodpovedajúceho obdobia nemá aktivita faktora VIII klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Nasledujúcu tabuľku možno použiť ako návod na dávkovanie pri epizódach krvácania a pri chirurgických zákrokoch:
Tabuľka 1 Návod na dávkovanie pri epizódach krvácania a operáciách

Stupeň krvácania/Typ chirurgického zákroku
Požadovaná hladina faktora VIII (%) (IU/dl)
Frekvencia dávok (hodiny)/Trvanie liečby (dni)
Kr
v
ácanie
Začínajúca hemartróza, krvácanie do
svalov alebo do ústnej dutiny
20-40 Opakovať každých 12 až 24 hodín,
najmenej 1 deň, až kým sa krvácanie indikované bolesťou
nezastaví alebo do zahojenia.
Rozsiahlejšia hemartróza, krvácanie
do svalov alebo hematóm
30-60 Opakovať infúziu každých 12-
24 hodín počas 3-4 alebo viac dní, kým bolesť a akútna slabosť neustúpi

Život ohrozujúce krvácanie 60-100 Opakovať infúziu každých 8 až
24 hodín až do stavu mimo ohrozenia života
C
hirurgický
zákrok
M
enší chirurgický zákrok, vrátane extrakcie zubov
30-60 Každých 24 hodín, najmenej 1 deň, až do zahojenia

Stupeň krvácania/Typ chirurgického zákroku
Požadovaná hladina faktora VIII (%) (IU/dl)
Frekvencia dávok (hodiny)/Trvanie liečby (dni)
Veľký chirurgický zákrok 80-100
(pred a po operácii)
Opakovať infúziu každých 8-
24 hodín až do adekvátneho zahojenia rany, potom pokračovať
v liečbe najmenej ďalších 7 dní na
udržanie faktora VIII na 30% až
60% (IU/dl)
 Profylaxia
Profylaxia
Na dlhodobú prevenciu krvácania u pacientov so závažnou hemofíliou A. Obvyklé odporučené dávky sú 20-40 IU faktora VIII na kg telesnej hmotnosti každý druhý deň alebo 20-50 IU faktora VIII na kg
telesnej hmotnosti 3-krát týždenne. V niektorých prípadoch, zvlášť u mladých pacientov môžu byť potrebné kratšie intervaly v dávkovaní alebo vyššie dávky.
Monitorovanie liečbyPočas liečby sa odporúča robiť príslušné stanovenie hladín faktora VIII, aby sa určila veľkosť dávky, ktorá sa má podať a frekvencia podania injekcií. V prípade veľkých chirurgických zákrokov je
nevyhnutné presné monitorovanie substitučnej liečby pomocou koagulačnej analýzy (aktivita faktora
VIII v plazme). Jednotliví pacienti môžu rozdielne reagovať na faktor VIII, môžu dosiahnuť rôzne úrovne stabilizácie in vivo a môžu sa prejaviť rôznym biologickým polčasom.
Chirurgický zákrokNie sú žiadne skúsenosti s chirurgickými zákrokmi u pediatrických pacientov.
Starší ľudiaNie sú žiadne skúsenosti s pacientmi
> 65 rokov.
Pediatrická populáciaNa dlhodobú profylaxiu krvácania pacientov mladších ako 12 rokov sa odporúčajú dávky 25-50 IU faktora VIII na kg telesnej hmotnosti každý druhý deň, alebo 25-60 IU faktora VIII na kg telesnej hmotnosti 3-krát týždenne. Pre pediatrických pacientov starších ako 12 rokov sú odporúčania dávkovania rovnaké ako pre dospelých.
SpôsobpodávaniaIntravenózne použitie.
Odporúčaná rýchlosť infúzie pre NovoEight je 1-2 ml/min. Rýchlosť sa má určiť tak, aby vyhovovala pacientovi.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo ktorúkoľvek z pomocných látok uvedených v časti 6.1. Známa alergická reakcia na škrečiu bielkovinu.
4.4 Osobitné upozornenia a opatrenia pri používaníHypersenzitivitaPri užívaní NovoEight sa môžu vyskytnúť hypersenzitívne reakcie alergického typu. Produkt obsahuje stopy škrečích bielkovín, ktoré môžu u niektorých pacientov vyvolávať alergické reakcie. Ak sa objavia príznaky precitlivenosti, pacienti majú byť poučení, aby ihneď prerušili liečbu týmto liekom a
obrátili sa na svojho lekára. Pacienti majú byť informovaní o počiatočných príznakoch hypersenzitívnych reakcií, vrátane žihľavky, generalizovanej urtikárie, zvierania na hrudníku, sipotu, hypotenzie a anafylaxie.
V prípade šoku sa má dodržať štandardná medicínska liečba pri šoku. Inhibítory
Známou komplikáciou liečby v jednotlivých prípadoch hemofílie A je tvorba neutralizujúcich
protilátok (inhibítorov) k faktoru VIII. Tieto inhibítory sú obyčajne IgG imunoglobulíny pôsobiace proti koagulačnej aktivite faktora VIII, ktorá je kvantifikovaná Bethesda jednotkami (BU) na ml plazmy pri použití modifikovanej metódy. Riziko tvorby inhibítorov koreluje s expozíciou faktora VIII, toto riziko býva najvyššie počas prvých 20 dní expozície. Zriedkavo sa môžu inhibítory tvoriť aj počas prvých 100 dňoch expozície.
Pacienti, ktorí boli už predtým liečení s expozíciou viac ako 100 dní a mali už v predošlej anamnéze tvorbu inhibítorov, pri zmene liečby z niektorého lieku obsahujúceho faktor VIII na iný, došlo
v niektorých prípadoch opäť k tvorbe inhibítorov (nízky titer). Preto sa u všetkých pacientov odporúča vždy pri zmene liečby na iný liek, pozorne monitorovať vznik inhibítorov.
Všeobecne u všetkých pacientov liečených liekmi s koagulačným faktorom VIII sa má pozorne sledovať tvorba inhibítorov vhodným klinickým pozorovaním a laboratórnymi testami. Ak sa nedosiahne očakávaná hladina aktivity faktora VIII v plazme, alebo ak sa krvácanie nezvládne príslušnou dávkou, má sa robiť testovanie na prítomnosť inhibítora faktora VIII. U pacientov
s vysokou hladinou inhibítora, môže byť liečba faktorom VIII neúčinná a má sa uvažovať o iných možnostiach liečby. Liečbu takýchto pacientov má viesť lekár so skúsenosťami s liečbou hemofílie a s inhibítormi faktora VIII.
Dôrazne sa odporúča, aby sa vždy pri podaní lieku NovoEight pacientovi, zaznamenal názov a číslo šarže lieku, aby bolo možné spätne priradiť číslo šarže lieku k pacientovi.
Pomocnélátky,ktorétrebavziaťdoúvahy
Po rekonštitúcii obsahuje tento liek 0,31 mmol sodíka (7 mg) na 1 ml rekonštituovaného roztoku. To je potrebné vziať do úvahy u pacientov so sodíkovou diétou.
Pediatrickápopulácia
Uvedené varovania a upozornenia platia pre dospelých aj deti.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s liekom NovoEight.
4.6 Fertilita, gravidita, a laktácia
Neuskutočnili sa žiadne reprodukčné štúdie na zvieratách s liekom NovoEight. Vzhľadom na vzácny výskyt hemofílie A u žien, nie sú skúsenosti s použitím faktora VIII počas tehotenstva a laktácie. Preto sa má faktor VIII použiť počas tehotenstva alebo laktácie, len ak je jednoznačná indikácia.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
NovoEight nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Zriedkavo boli hlásené hypersenzitivita alebo alergická reakcia (ktoré môžu zahŕňať angioedém, pálenie a štípanie v mieste podania infúzie, triašku, začervenanie, generalizovanú urtikáriu, bolesť
hlavy, vyrážku, hypotenziu, letargiu, nauzeu, nevoľnosť, tachykardiu, zvieranie na hrudníku, brnenie, vracanie, sipot) a v niektorých prípadoch môžu viesť k závažnej anafylaxii (vrátane šoku).
Veľmi zriedkavo bola hlásená tvorba protilátok na škrečie bielkoviny spojené s hypersenzitívnymi reakciami.
U pacientov s hemofíliou A sa môžu tvoriť neutralizujúce protilátky (inhibítory) proti faktoru VIII. Ak sa objavia takéto inhibítory, stav sa bude prejavovať ako nedostatočná klinická odpoveď. V týchto prípadoch sa odporúča obrátiť sa špecializované centrum pre liečbu hemofílie.
TabuľkovýzoznamnežiaducichreakciíTabuľka dolu je v súlade s klasifikáciou podľa tried orgánových systémov MedDRA (SOC and
Preferred Term Level).
Frekvencia výskytu je hodnotená podľa nasledujúcej konvencie: veľmi časté (≥1/10), časté (≥1/100 až
<1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé
(<1/10 000), neznáma (z dostupných údajov sa nedá určiť).
V každej skupine frekvencie, sú nežiaduce reakcie uvedené podľa klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich reakcií lieku v klinických štúdiách
Trieda orgánových systémov
| Frekvencia*
| Nežiaduca reakcia
|
Psychické poruchy
| Menej časté
| Nespavosť
|
Poruchy nervového systému
| Menej časté
| Bolesť hlavy, závrat
|
Poruchy srdca a srdcovej činnosti
| Menej časté
| Sínusová tachykardia
|
Poruchy ciev
| Menej časté
| Hypertenzia, lymfedém
|
Poruchy pečene a žlčových ciest
| Časté
| Zvýšenie pečeňových enzýmov**
|
Poruchy kože a podkožného tkaniva
| Menej časté
| Vyrážka
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
| Menej časté
| Muskuloskeletálna stuhnutosť,
artropatia, bolesti končatín, muskuloskeletálna bolesť
|
Celkové poruchy a reakcie v mieste
podania
| Časté
| Reakcie v mieste podania
injekcie***
|
Menej časté
| Únava, návaly tepla, periférny
edém, pyrexia
|
Laboratórne a funkčné vyšetrenia
| Menej časté
| Zrýchlená srdcová frekvencia
|
Úrazy, otravy a komplikácie
liečebného postupu
| Menej časté
| Kontúzia
|
* Výpočet založený na celkovom počte jednotlivých pacientov vo všetkých klinických štúdiách
(214)
** Zvýšenie pečeňových enzýmov sa týka alanín aminotransferázy, aspartát aminotransferázy, gama-glutamyltransferázy a bilirubínu
*** Reakcie v mieste podania injekcie zahŕňajú erytém v mieste podania injekcie, opuch v mieste
podania injekcie a svrbenie v mieste podania injekcie
PopisvybranýchnežiaducichreakciíPočas všetkých klinických štúdií s liekom NovoEight bolo celkovo hlásených 30 nežiaducich reakcií a to u 19 z 214 pacientov liečených liekom NovoEight. Najčastejšou hlásenou nežiaducou reakciou
bola reakcia v mieste podania injekcie a zvýšenie pečeňových enzýmov. Z 30 nežiaducich reakcií, 2
boli hlásené u 1 z 31 pacientov do 6 rokov, žiadna u pacientov od 6 do 18 rokov a 28 bolo hlásených u 18 zo 127 dospelých.
PediatrickápopuláciaV klinickej štúdii zahŕňajúcej 63 pediatrických pacientov vo veku medzi 0 a 12 rokov a 24 dospievajúcich vo veku medzi 12 a 18 rokov so závažnou hemofíliou A, neboli pozorované žiadne rozdiely v bezpečnostnom profile lieku NovoEight medzi pediatrickými pacientmi a dospelými.
Hláseniepodozrenínanežiaducereakcie Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieŽiadne príznaky predávkovania rekombinantným koagulačným faktorom VIII neboli hlásené.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antihemoragiká, krvný koagulačný faktor VIII, ATC kód: zatiaľ
nepridelený
MechanizmusúčinkuNovoEight obsahuje turoktokog alfa, ľudský koagulačný faktor VIII (rDNA), so skrátenou B- doménou. Tento glykoproteín má zhodnú štruktúru s aktivovaným ľudským faktorom VIII. Posttranslačné modifikácie sú podobné posttranslačným modifikáciám molekuly získanej z plazmy. Sulfatačné tyrozínové miesto je Tyr1680 (prirodzená úplná dĺžka), ktoré je dôležité pre väzbu na von Willebrandov faktor, je v molekule turoktokogu alfa plne sulfátované. Po podaní infúzie pacientovi
s hemofíliou sa faktor VIII viaže na endogénny von Willebrandov faktor v krvnom obehu pacienta. Komplex faktora VIII/von Willebrandov faktor sa skladá z dvoch molekúl (faktor VIII a von Willebrandov faktor) s rôznymi fyziologickými funkciami. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný faktor X konvertuje protrombín na trombín. Trombín potom konvertuje fibrinogén na fibrín a môže sa tvoriť zrazenina. Hemofília je vrodená porucha krvnej zrážanlivosti viazaná na pohlavie zapríčinená zníženou hladinou faktora VIIIC a dôsledkom je profúzne krvácanie do kĺbov,
svalov alebo vnútorných orgánov, buď spontánne alebo ako dôsledok úrazu alebo chirurgickej traumy. Pri substitučnej liečbe sa plazmatické hladiny faktora VIII zvýšia, tým sa dočasne upraví deficit
faktora a tým sa upraví tendencia ku krvácaniu.
KlinickáúčinnosťVykonali sa tri multicentrické, otvorené, nekontrolované štúdie, s cieľom hodnotenia bezpečnosti a účinnosti lieku NovoEight v profylaxii a liečbe krvácania u pacientov s už liečenou závažnou hemofíliou A (FVIII aktivita ≤1%). Štúdie zahŕňali 213 liečených pacientov; 150 dospievajúcich alebo dospelých pacientov bez inhibítorov vo veku od 12 rokov (≥150 dní liečby) a 63 pediatrických pacientov bez inhibítorov vo veku do 12 rokov (≥50 dní liečby). 187 z 213 pacientov pokračovalo
v rozšírenej bezpečnostnej štúdii. Liečba liekom NovoEight sa ukázala ako bezpečná a mala predpokladaný hemostatický a preventívny účinok. Počas akumulovanej liečby viac ako 54 000 dní (čo zodpovedá 342 paciento/rokov) nebola pozorovaná vo fáze 3a klinickej štúdie, u pacientov už predtým liečených, žiadna tvorba inhibítorov proti faktoru VIII. Z 1 377 hlásených krvácaní pozorovaných u 177 pacientov z 213, bolo 1 244 (90,3%) krvácaní zastavených 1-2 infúziami lieku NovoEight.
Tabuľka 3 Spotreba turoktokogu alfa a celková miera úspešnosti
| Mladšie deti
(0<6 rokov)
| Staršie deti
(6<12 rokov)
| Dospievajúci
(12<18
rokov)
| Dospelí
(≥18 rokov)
| Celkovo
|
Počet pacientov
| 31
| 32
| 24
| 126
| 213
|
Dávka použitá na
prevenciu
na pacienta (IU/kg
BW)
Priemer (SD)
|
40.1 (8.5)
|
36.6 (9.0)
|
27.0 (7.6)
|
26.9 (6.9)
|
30.3 (9.2)
|
Min ; Max
|
26.5 ; 57.3
|
24.9 ; 57.9
|
20.5 ; 46.9
|
20.0 ; 50.8
|
20.0 ; 57.9
|
Dávka použitá na
liečbu krvácania
(IU/kg BW) Priemer (SD)
Min ; Max
|
44.4 (17.9)
25.9 ; 193.8
|
40.0 (10.4)
25.5 ; 65.5
|
28.2 (10.2)
12.4 ; 76.8
|
33.8 (11.9)
9.3 ; 104.0
|
34.5 (12.6)
9.3 ; 193.8
|
Miera úspešnosti* %
|
92.9%
|
88.9%
|
79.7%
|
85.6%
|
85.9%
|
BW: Telesná hmotnosť, SD: Štandardná odchýlka
*Úspešnosť je definovaná buď ako „Výborná“ alebo „Dobrá“.
Celkovo sa uskutočnilo 14 chirurgických zákrokov u 14 pacientov, z ktorých 13 bolo veľkých chirurgických zákrokov a 1 bol malý. Hemostáza bola úspešná u všetkých chirurgických zákrokoch a nebolo hlásené žiadne zlyhanie liečby.
5.2 Farmakokinetické vlastnostiVšetky farmakokinetické štúdie s turoktokogom alfa boli uskutočnené u pacientov so závažnou hemofíliou A (FVIII ≤1 %), ktorí boli už predtým liečení. Analýza vzoriek plazmy sa vykonala pomocou jednostupňového koagulačného testu a chromogénnej metódy.
V medzinárodnej štúdii zahŕňajúcej 36 laboratórií bol stanovený obsah NovoEight ako FVIII C, bol vyhodnotený a porovnaný s liekom dostupným na trhu obsahujúcim rekombinantný faktor VIII s celou dĺžkou reťazca. Štúdia preukázala porovnateľné a konzistentné výsledky pre obidva lieky a tiež to, že NovoEight môže byť spoľahlivo v plazme stanovený bez toho, aby bol potrebný špeciálny štandard
pre NovoEight.
Farmakokinetické parametre jednorazovej dávky lieku NovoEight sú uvedené v Tabuľke 4 pre koagulačný test a v Tabuľke 5 pre chromogénnu metódu.
Tabuľka 4 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou hemofíliou A (FVIII ≤1%), koagulačná metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=33
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,018 (0,007)
| 0,020 (0,004)
| 0,022 (0,004)
|
AUC ((IU*h)/ml)
| 9,92 (4,11)
| 11,09 (3,74)
| 15,26 (5,77)
|
CL (ml/h/kg)
| 6,21 (3,66)
| 5,02 (1,68)
| 3,63 (1,09)
|
t½ (h)
| 7,65 (1,84)
| 8,02 (1,89)
| 11,00 (4,65)
|
Vss (ml/kg)
| 56,68 (26,43)
| 46,82 (10,63)
| 47,40 (9,21)
|
Cmax (IU/ml)
| 1,00 (0,58)
| 1,07 (0,35)
| 1,226 (0,41)
|
Priemerný čas
zotrvania (h)
| 9,63 (2,50)
| 9,91 (2,57)
| 14,19 5,08)
|
Tabuľka 5 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou
hemofíliou A (FVIII ≤1%), chromogénna metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=48
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,022 (0,006)
| 0,025 (0.006)
| 0,029 (0,006)
|
AUC ((IU*h)/ml)
| 12,23 (4,36)
| 14,37 (3.48)
| 19,63 (7,73)
|
CL (ml/h/kg)
| 4,59 (1,73)
| 3,70 (1.00)
| 2,86 (0,94)
|
t½ (h)
| 9,99 (1,71)
| 9,42 (1.52)
| 11,22 (6,86)
|
Vss (ml/kg)
|
55,46 (23,53)
|
41,23 (6.00)
|
38,18 (10,24)
|
Cmax (IU/ml)
|
1,12 (0,31)
|
1,25 (0.27)
|
1,63 (0,50)
|
Priemerný čas
zotrvania (h)
|
12,06 (1,90)
|
11,61 (2.32)
|
14,54 (5,77)
|
Farmakokinetické parametre boli porovnateľné medzi pediatrickými pacientmi vo veku do 6 rokov
a pediatrickými pacientmi od 6 do 12 rokov. Niektoré odchýlky boli pozorované vo farmakokinetických parametroch lieku NovoEight medzi pediatrickými a dospelými pacientmi. Vyššie
hodnoty CL a kratší t½ sa zistil u pediatrických pacientov v porovnaní s dospelými pacientmi
s hemofíliou A, čo môže byť čiastočne spôsobené známym vyšším plazmatickým objemom na
kilogram telesnej hmotnosti u mladších pacientov.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe konvenčných farmakologických štúdií bezpečnosti a toxicity po opakovanom podaní neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokPrášok: Chlorid sodný L-histidín Sacharóza Polysorbát 80
L-metionín
Dihydrát chloridu vápenatého
Hydroxid sodný
Kyselina chlorovodíková
Rozpúšťadlo: Chlorid sodný Voda na injekciu
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnostiPredotvorením:2 roky
Počas času použiteľnosti môže byť liek uchovávaný nepretržite pri izbovej teplote ≤30°C počas obdobia nepresahujúceho 6 mesiacov. Ak bol liek už raz vybratý z chladničky, nesmie sa už do chladničky vrátiť. Zaznačte si prosím na krabičke dátum, kedy ste začali liek uchovávať pri izbovej teplote.
Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom.
Po rekonštitúcii:Chemická a fyzikálna stabilita po rekonštitúcii bola dokázaná počas 24 hodín pri 2°C – 8°C a počas
4 hodín pri uchovávaní pri ≤30°C. Z mikrobiologického hľadiska sa má tento liek použiť ihneď po
rekonštitúcii. Ak sa nepoužije ihneď, čas a podmienky uchovávania lieku po rekonštitúcii a pred
použitím je zodpovednosť používateľa a zvyčajne nemá byť čas dlhší ako 4 hodiny pri uchovávaní pri
≤30°C alebo 24 hodín pri 2°C - 8°C, ak rekonštitúcia prebehla za kontrolovaných a validovaných aseptických podmienok.
Všetok nepoužitý liek, ktorý bol uchovávaný pri izbovej teplote dlhšie ako 4 hodiny má byť zlikvidovaný.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke (2ºC - 8ºC). Chráňte pred mrazom.
Uchovávanie pri izbovej teplote a podmienky uchovávania lieku po rekonštitúcii, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaKaždé balenie lieku NovoEight 1500 IU prášok a rozpúšťadlo na injekčný roztok obsahuje:
– 1 sklenenú injekčnú liekovku (typ I) s práškom a chlórobutylovou gumenou zátkou
– 1 sterilný adaptér injekčnej liekovky na rekonštitúciu
– 1 naplnenú injekčnú striekačku so 4 ml rozpúšťadla s záverom spätného chodu (polypropylén), gumeným piestom (brómbutyl) a uzáverom so zátkou (brómbutyl)
– 1 nástavec piesta (polypropylén).
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanieNovoEight je určený na intravenózne podanie po rekonštitúcii prášku s rozpúšťadlom, ktoré je dodávané v injekčnej striekačke. Po rekonštitúcii je roztok číry alebo mierne opalizujúci. Roztok nepoužite, ak je zakalený alebo obsahuje usadeniny.
Budete potrebovať aj infúznu súpravu (hadičku a motýlikovú ihlu), sterilné alkoholové tampóny, gázové tampóny a náplasti. Tieto pomôcky nie je súčasťou balenia lieku NovoEight.
Vždy dodržujte aseptickú techniku.
Rekonštitúcia:A)

Vyberte injekčnú liekovku, adaptér injekčnej
Aliekovky a naplnenú injekčnú striekačku
z krabičky. Nástavec piesta nechajte v krabičke. Nechajte injekčnú liekovku a naplnenú injekčnú
striekačku dosiahnuť izbovú teplotu. Môžete to urobiť ich podržaním v rukách, až kým necítite,
že sú také teplé ako vaše ruky. Nezohrievajte injekčnú liekovku a naplnenú injekčnú striekačku iným spôsobom.
B)

Odstráňte plastové viečko z injekčnej liekovky.
BAk je plastové viečko uvoľnené, alebo chýba,
injekčnú liekovku nepoužite
. Očistite gumovú zátku na injekčnej liekovke sterilným
alkoholovým tampónom a nechajte ju pred použitím pár sekúnd schnúť na vzduchu.
C)

Odstráňte ochranný papier z adaptéra injekčnej
Cliekovky. Ak ochranný papier nie je úplne
uzavretý alebo je roztrhnutý, nepoužite adaptér injekčnej liekovky.
Nevyberajte prstami adaptér injekčnej liekovky
z ochranného krytu.
D)

Otočte ochranný kryt a zatlačte adaptér na
Dinjekčnú liekovku. Neodstraňujte adaptér z
injekčnej liekovky, keď je už pripevnený.
E)
Jemne pritlačte ochranný kryt palcom a ukazovákom ako je znázornené. Odstráňte
ochranný kryt z adaptéra injekčnej liekovky.
 E
EF)

Pevne uchopte nástavec piesta za širší koniec
Fa ihneď ho pripojte k injekčnej striekačke
otáčaním v smere hodinových ručičiek vnútri naplnenej injekčnej striekačky, až kým
nepocítite odpor.
G)

Odstráňte kryt injekčnej striekačky z naplnenej
Ginjekčnej striekačky ohnutím dole, až kým sa
nezlomí perforácia. Nedotýkajte sa špičky injekčnej striekačky pod krytom injekčnej
striekačky.
H)

Naskrutkujte naplnenú injekčnú striekačku
Hbezpečne na adaptér, až kým nepocítite odpor.
I)

Držte naplnenú injekčnú striekačku s injekčnou
Iliekovkou naklonenou smerom dole. Tlačte
nástavec piesta, aby ste vstrekli všetko rozpúšťadlo do injekčnej liekovky.
J)

Držte nástavec piesta stlačený dole a jemne
Jkrúžte s injekčnou liekovkou, až sa rozpustí
všetok prášok. Netraste injekčnou liekovkou, lebo to môže spôsobiť spenenie.
Odporúča sa použiť NovoEight ihneď po rekonštitúcii. Podmienky uchovávania rekonštituovaného
lieku, pozri časť 6.3.
Ak je potrebná väčšia dávka, opakujte kroky A až J s ďalšími injekčnými liekovkami, adaptérmi
injekčnej liekovky a naplnenými injekčnými striekačkami.
Podanierekonštituovanéhoroztoku:
K)
Držte nástavec piesta stlačený na doraz. Otočte injekčnú striekačku s injekčnou liekovkou hore dnom. Prestaňte tlačiť nástavec piesta a nechajte ho pohnúť sa samovoľne naspäť, kým rekonštituovaný roztok naplní injekčnú striekačku. Ťahajte nástavec piesta jemne smerom dole, aby ste natiahli rekonštituovaný roztok do injekčnej striekačky.
V prípade, že potrebujete len časť z injekčnej liekovky, použite stupnicu na injekčnej striekačke, aby ste videli koľko rekonštituovaného roztoku ste odobrali, ako vám povedal lekár alebo zdravotná sestra.
Kým držíte injekčnú liekovku hore dnom, klepkajte jemne na injekčnú striekačku, aby všetky bubliny vystúpili nahor. Tlačte nástavec piesta pomaly, až kým všetky vzduchové bubliny nevytlačíte.
|
K
|
L)
Odskrutkujte adaptér s injekčnou liekovkou.
NovoEight je teraz pripravený na injekčné podanie. Vyberte si vhodné miesto a pomaly si podajte injekciu lieku NovoEight do žily počas 2-5 minút.
|
L
|
Likvidácia:


Po podaní injekcie, bezpečne zlikvidujte všetok nepoužitý roztok lieku NovoEight, injekčnú
striekačku s infúznou súpravou, injekčnú liekovku s adaptérom injekčnej liekovky, a ostatný odpadový materiál ako vám povedal lekárnik.
Nevyhadzujte ho s bežným domovým odpadom.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovo Nordisk A/S Novo Allé
DK-2880 Bagsværd
Dánsko
8. REGISTRAČNÉ ČÍSLA
EU/1/13/888/004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUNovoEight 2000 IU prášok a rozpúšťadlo na injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá injekčná liekovka s práškom obsahuje 2000 IU ľudského koagulačného faktora VIII (rDNA), turoktokog alfa.
Po rekonštitúcii obsahuje NovoEight približne 500 IU/ml ľudského koagulačného faktora VIII (rDNA), turoktokog alfa.
Účinnosť (IU) sa stanovuje podľa Európskeho liekopisu chromogénnym testom. Špecifická aktivita
NovoEight je približne 8 300 IU/mg bielkoviny.
Turoktokog alfa (ľudský koagulačný faktor VIII (rDNA)) je purifikovaná bielkovina, ktorá obsahuje
1 445 aminokyselín s molekulovou hmotnosťou približne 166 kDA. Vyrába sa technológiou rekombinantnej DNA z buniek ovária čínskeho škrečka (CHO), a vyrába sa bez pridania akýchkoľvek
ľudských alebo živočíšnych derivovaných bielkovín pri spracovaní bunkových kultúr, čistení alebo
koncovej úprave.
Turoktokog alfa je rekombinantný ľudský koagulačný faktor VIII so skrátenou B-doménou (B- doména pozostáva z 21 aminokyselín prirodzenej B-domény) bez akýchkoľvek modifikácií v poradí aminokyselín.
Pomocnálátkasoznámymúčinkom:0,31 mmol sodíka (7 mg) na 1 ml rekonštituovaného roztoku.
Úplný zoznam pomocných látok, pozri bod 6.1.
3. LIEKOVÁ FORMAPrášok a rozpúšťadlo na injekčný roztok.
Biely alebo jemne žltý prášok alebo drobivá hmota. Číry a bezfarebný injekčný roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieLiečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII). NovoEight môžu užívať všetky vekové skupiny.
4.2 Dávkovanie a spôsob podaniaLiečba sa má začať pod dohľadom lekára so skúsenosťami s liečbou hemofílie.
D
oteraz
neliečení
pacienti
Bezpečnosť a účinnosť lieku NovoEight u doteraz neliečených pacientov nebola zatiaľ stanovená. Nie sú k dispozícii žiadne údaje.
Dávkovanie
Dávkovanie a trvanie substitučnej liečby závisí od závažnosti deficitu faktora VIII, mieste a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII je vyjadrený v medzinárodných jednotkách (IU), ktoré zodpovedajú súčasnému WHO štandardu pre lieky obsahujúce faktor VIII. Aktivita faktora VIII v plazme je vyjadrená buď v percentách (porovnaním k normálnej ľudskej plazme), alebo v medzinárodných jednotkách (porovnaním k medzinárodnému štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba v prípade potreby
Výpočet požadovanej dávky faktora VIII vychádza z empirického zistenia, že 1 medzinárodná jednotka (IU) faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o
2 IU/dl. Požadovaná dávka sa určí použitím nasledujúceho vzorca:
Požadovaný počet jednotiek = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) (IU/dl) x
0,5 (IU/kg na IU/dl)
Množstvo, ktoré sa má podať a frekvencia podania sa majú vždy riadiť podľa klinickej účinnosti u jednotlivého pacienta.
V nasledujúcich prípadoch krvácania počas zodpovedajúceho obdobia nemá aktivita faktora VIII klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Nasledujúcu tabuľku možno použiť ako návod na dávkovanie pri epizódach krvácania a pri chirurgických zákrokoch:
Tabuľka 1 Návod na dávkovanie pri epizódach krvácania a operáciách

Stupeň krvácania/Typ chirurgického zákroku
Požadovaná hladina faktora VIII (%) (IU/dl)
Frekvencia dávok (hodiny)/Trvanie liečby (dni)
Kr
v
ácanie
Začínajúca hemartróza, krvácanie do
svalov alebo do ústnej dutiny
20-40 Opakovať každých 12 až 24 hodín,
najmenej 1 deň, až kým sa krvácanie indikované bolesťou
nezastaví alebo do zahojenia.
Rozsiahlejšia hemartróza, krvácanie
do svalov alebo hematóm
30-60 Opakovať infúziu každých 12-
24 hodín počas 3-4 alebo viac dní, kým bolesť a akútna slabosť neustúpi

Život ohrozujúce krvácanie 60-100 Opakovať infúziu každých 8 až
24 hodín až do stavu mimo ohrozenia života
C
hirurgický
zákrok
M
enší chirurgický zákrok, vrátane extrakcie zubov
30-60 Každých 24 hodín, najmenej 1 deň, až do zahojenia

Stupeň krvácania/Typ chirurgického zákroku
Požadovaná hladina faktora VIII (%) (IU/dl)
Frekvencia dávok (hodiny)/Trvanie liečby (dni)
Veľký chirurgický zákrok 80-100
(pred a po operácii)
Opakovať infúziu každých 8-
24 hodín až do adekvátneho zahojenia rany, potom pokračovať
v liečbe najmenej ďalších 7 dní na
udržanie faktora VIII na 30% až
60% (IU/dl)
 Profylaxia
Profylaxia
Na dlhodobú prevenciu krvácania u pacientov so závažnou hemofíliou A. Obvyklé odporučené dávky sú 20-40 IU faktora VIII na kg telesnej hmotnosti každý druhý deň alebo 20-50 IU faktora VIII na kg
telesnej hmotnosti 3-krát týždenne. V niektorých prípadoch, zvlášť u mladých pacientov môžu byť potrebné kratšie intervaly v dávkovaní alebo vyššie dávky.
Monitorovanie liečbyPočas liečby sa odporúča robiť príslušné stanovenie hladín faktora VIII, aby sa určila veľkosť dávky, ktorá sa má podať a frekvencia podania injekcií. V prípade veľkých chirurgických zákrokov je
nevyhnutné presné monitorovanie substitučnej liečby pomocou koagulačnej analýzy (aktivita faktora
VIII v plazme). Jednotliví pacienti môžu rozdielne reagovať na faktor VIII, môžu dosiahnuť rôzne úrovne stabilizácie in vivo a môžu sa prejaviť rôznym biologickým polčasom.
Chirurgický zákrokNie sú žiadne skúsenosti s chirurgickými zákrokmi u pediatrických pacientov.
Starší ľudiaNie sú žiadne skúsenosti s pacientmi
> 65 rokov.
Pediatrická populáciaNa dlhodobú profylaxiu krvácania pacientov mladších ako 12 rokov sa odporúčajú dávky 25-50 IU faktora VIII na kg telesnej hmotnosti každý druhý deň, alebo 25-60 IU faktora VIII na kg telesnej hmotnosti 3-krát týždenne. Pre pediatrických pacientov starších ako 12 rokov sú odporúčania dávkovania rovnaké ako pre dospelých.'
SpôsobpodávaniaIntravenózne použitie.
Odporúčaná rýchlosť infúzie pre NovoEight je 1-2 ml/min. Rýchlosť sa má určiť tak, aby vyhovovala pacientovi.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo ktorúkoľvek z pomocných látok uvedených v časti 6.1. Známa alergická reakcia na škrečiu bielkovinu.
4.4 Osobitné upozornenia a opatrenia pri používaníHypersenzitivitaPri užívaní NovoEight sa môžu vyskytnúť hypersenzitívne reakcie alergického typu. Produkt obsahuje stopy škrečích bielkovín, ktoré môžu u niektorých pacientov vyvolávať alergické reakcie. Ak sa objavia príznaky precitlivenosti, pacienti majú byť poučení, aby ihneď prerušili liečbu týmto liekom a
obrátili sa na svojho lekára. Pacienti majú byť informovaní o počiatočných príznakoch hypersenzitívnych reakcií, vrátane žihľavky, generalizovanej urtikárie, zvierania na hrudníku, sipotu, hypotenzie a anafylaxie.
V prípade šoku sa má dodržať štandardná medicínska liečba pri šoku. Inhibítory
Známou komplikáciou liečby v jednotlivých prípadoch hemofílie A je tvorba neutralizujúcich
protilátok (inhibítorov) k faktoru VIII. Tieto inhibítory sú obyčajne IgG imunoglobulíny pôsobiace proti koagulačnej aktivite faktora VIII, ktorá je kvantifikovaná Bethesda jednotkami (BU) na ml plazmy pri použití modifikovanej metódy. Riziko tvorby inhibítorov koreluje s expozíciou faktora VIII, toto riziko býva najvyššie počas prvých 20 dní expozície. Zriedkavo sa môžu inhibítory tvoriť aj počas prvých 100 dňoch expozície.
Pacienti, ktorí boli už predtým liečení s expozíciou viac ako 100 dní a mali už v predošlej anamnéze tvorbu inhibítorov, pri zmene liečby z niektorého lieku obsahujúceho faktor VIII na iný, došlo
v niektorých prípadoch opäť k tvorbe inhibítorov (nízky titer). Preto sa u všetkých pacientov odporúča vždy pri zmene liečby na iný liek, pozorne monitorovať vznik inhibítorov.
Všeobecne u všetkých pacientov liečených liekmi s koagulačným faktorom VIII sa má pozorne sledovať tvorba inhibítorov vhodným klinickým pozorovaním a laboratórnymi testami. Ak sa nedosiahne očakávaná hladina aktivity faktora VIII v plazme, alebo ak sa krvácanie nezvládne príslušnou dávkou, má sa robiť testovanie na prítomnosť inhibítora faktora VIII. U pacientov
s vysokou hladinou inhibítora, môže byť liečba faktorom VIII neúčinná a má sa uvažovať o iných možnostiach liečby. Liečbu takýchto pacientov má viesť lekár so skúsenosťami s liečbou hemofílie a s inhibítormi faktora VIII.
Dôrazne sa odporúča, aby sa vždy pri podaní lieku NovoEight pacientovi, zaznamenal názov a číslo šarže lieku, aby bolo možné spätne priradiť číslo šarže lieku k pacientovi.
Pomocnélátky,ktorétrebavziaťdoúvahy
Po rekonštitúcii obsahuje tento liek 0,31 mmol sodíka (7 mg) na 1 ml rekonštituovaného roztoku. To je potrebné vziať do úvahy u pacientov so sodíkovou diétou.
Pediatrickápopulácia
Uvedené varovania a upozornenia platia pre dospelých aj deti.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s liekom NovoEight.
4.6 Fertilita, gravidita, a laktácia
Neuskutočnili sa žiadne reprodukčné štúdie na zvieratách s liekom NovoEight. Vzhľadom na vzácny výskyt hemofílie A u žien, nie sú skúsenosti s použitím faktora VIII počas tehotenstva a laktácie. Preto sa má faktor VIII použiť počas tehotenstva alebo laktácie, len ak je jednoznačná indikácia.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
NovoEight nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Zriedkavo boli hlásené hypersenzitivita alebo alergická reakcia (ktoré môžu zahŕňať angioedém, pálenie a štípanie v mieste podania infúzie, triašku, začervenanie, generalizovanú urtikáriu, bolesť
hlavy, vyrážku, hypotenziu, letargiu, nauzeu, nevoľnosť, tachykardiu, zvieranie na hrudníku, brnenie, vracanie, sipot) a v niektorých prípadoch môžu viesť k závažnej anafylaxii (vrátane šoku).
Veľmi zriedkavo bola hlásená tvorba protilátok na škrečie bielkoviny spojené s hypersenzitívnymi reakciami.
U pacientov s hemofíliou A sa môžu tvoriť neutralizujúce protilátky (inhibítory) proti faktoru VIII. Ak sa objavia takéto inhibítory, stav sa bude prejavovať ako nedostatočná klinická odpoveď. V týchto prípadoch sa odporúča obrátiť sa špecializované centrum pre liečbu hemofílie.
TabuľkovýzoznamnežiaducichreakciíTabuľka dolu je v súlade s klasifikáciou podľa tried orgánových systémov MedDRA (SOC and
Preferred Term Level).
Frekvencia výskytu je hodnotená podľa nasledujúcej konvencie: veľmi časté (≥1/10), časté (≥1/100 až
<1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé
(<1/10 000), neznáma (z dostupných údajov sa nedá určiť).
V každej skupine frekvencie, sú nežiaduce reakcie uvedené podľa klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich reakcií lieku v klinických štúdiách
Trieda orgánových systémov
| Frekvencia*
| Nežiaduca reakcia
|
Psychické poruchy
| Menej časté
| Nespavosť
|
Poruchy nervového systému
| Menej časté
| Bolesť hlavy, závrat
|
Poruchy srdca a srdcovej činnosti
| Menej časté
| Sínusová tachykardia
|
Poruchy ciev
| Menej časté
| Hypertenzia, lymfedém
|
Poruchy pečene a žlčových ciest
| Časté
| Zvýšenie pečeňových enzýmov**
|
Poruchy kože a podkožného tkaniva
| Menej časté
| Vyrážka
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
| Menej časté
| Muskuloskeletálna stuhnutosť,
artropatia, bolesti končatín, muskuloskeletálna bolesť
|
Celkové poruchy a reakcie v mieste
podania
| Časté
| Reakcie v mieste podania
injekcie***
|
Menej časté
| Únava, návaly tepla, periférny
edém, pyrexia
|
Laboratórne a funkčné vyšetrenia
| Menej časté
| Zrýchlená srdcová frekvencia
|
Úrazy, otravy a komplikácie
liečebného postupu
| Menej časté
| Kontúzia
|
* Výpočet založený na celkovom počte jednotlivých pacientov vo všetkých klinických štúdiách
(214)
** Zvýšenie pečeňových enzýmov sa týka alanín aminotransferázy, aspartát aminotransferázy, gama-glutamyltransferázy a bilirubínu
*** Reakcie v mieste podania injekcie zahŕňajú erytém v mieste podania injekcie, opuch v mieste
podania injekcie a svrbenie v mieste podania injekcie
PopisvybranýchnežiaducichreakciíPočas všetkých klinických štúdií s liekom NovoEight bolo celkovo hlásených 30 nežiaducich reakcií a to u 19 z 214 pacientov liečených liekom NovoEight. Najčastejšou hlásenou nežiaducou reakciou
bola reakcia v mieste podania injekcie a zvýšenie pečeňových enzýmov. Z 30 nežiaducich reakcií, 2
boli hlásené u 1 z 31 pacientov do 6 rokov, žiadna u pacientov od 6 do 18 rokov a 28 bolo hlásených u 18 zo 127 dospelých.
PediatrickápopuláciaV klinickej štúdii zahŕňajúcej 63 pediatrických pacientov vo veku medzi 0 a 12 rokov a 24 dospievajúcich vo veku medzi 12 a 18 rokov so závažnou hemofíliou A, neboli pozorované žiadne rozdiely v bezpečnostnom profile lieku NovoEight medzi pediatrickými pacientmi a dospelými.
Hláseniepodozrenínanežiaducereakcie Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieŽiadne príznaky predávkovania rekombinantným koagulačným faktorom VIII neboli hlásené.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antihemoragiká, krvný koagulačný faktor VIII, ATC kód: zatiaľ
nepridelený
MechanizmusúčinkuNovoEight obsahuje turoktokog alfa, ľudský koagulačný faktor VIII (rDNA), so skrátenou B- doménou. Tento glykoproteín má zhodnú štruktúru s aktivovaným ľudským faktorom VIII. Posttranslačné modifikácie sú podobné posttranslačným modifikáciám molekuly získanej z plazmy. Sulfatačné tyrozínové miesto je Tyr1680 (prirodzená úplná dĺžka), ktoré je dôležité pre väzbu na von Willebrandov faktor, je v molekule turoktokogu alfa plne sulfátované. Po podaní infúzie pacientovi
s hemofíliou sa faktor VIII viaže na endogénny von Willebrandov faktor v krvnom obehu pacienta. Komplex faktora VIII/von Willebrandov faktor sa skladá z dvoch molekúl (faktor VIII a von Willebrandov faktor) s rôznymi fyziologickými funkciami. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný faktor X konvertuje protrombín na trombín. Trombín potom konvertuje fibrinogén na fibrín a môže sa tvoriť zrazenina. Hemofília je vrodená porucha krvnej zrážanlivosti viazaná na pohlavie zapríčinená zníženou hladinou faktora VIIIC a dôsledkom je profúzne krvácanie do kĺbov,
svalov alebo vnútorných orgánov, buď spontánne alebo ako dôsledok úrazu alebo chirurgickej traumy. Pri substitučnej liečbe sa plazmatické hladiny faktora VIII zvýšia, tým sa dočasne upraví deficit
faktora a tým sa upraví tendencia ku krvácaniu.
KlinickáúčinnosťVykonali sa tri multicentrické, otvorené, nekontrolované štúdie, s cieľom hodnotenia bezpečnosti a účinnosti lieku NovoEight v profylaxii a liečbe krvácania u pacientov s už liečenou závažnou hemofíliou A (FVIII aktivita ≤1%). Štúdie zahŕňali 213 liečených pacientov; 150 dospievajúcich alebo dospelých pacientov bez inhibítorov vo veku od 12 rokov (≥150 dní liečby) a 63 pediatrických pacientov bez inhibítorov vo veku do 12 rokov (≥50 dní liečby). 187 z 213 pacientov pokračovalo
v rozšírenej bezpečnostnej štúdii. Liečba liekom NovoEight sa ukázala ako bezpečná a mala predpokladaný hemostatický a preventívny účinok. Počas akumulovanej liečby viac ako 54 000 dní (čo zodpovedá 342 paciento/rokov) nebola pozorovaná vo fáze 3a klinickej štúdie, u pacientov už predtým liečených, žiadna tvorba inhibítorov proti faktoru VIII. Z 1 377 hlásených krvácaní pozorovaných u 177 pacientov z 213, bolo 1 244 (90,3%) krvácaní zastavených 1-2 infúziami lieku NovoEight.
Tabuľka 3 Spotreba turoktokogu alfa a celková miera úspešnosti
| Mladšie deti
(0<6 rokov)
| Staršie deti
(6<12 rokov)
| Dospievajúci
(12<18
rokov)
| Dospelí
(≥18 rokov)
| Celkovo
|
Počet pacientov
| 31
| 32
| 24
| 126
| 213
|
Dávka použitá na
prevenciu
na pacienta (IU/kg
BW)
Priemer (SD)
|
40.1 (8.5)
|
36.6 (9.0)
|
27.0 (7.6)
|
26.9 (6.9)
|
30.3 (9.2)
|
Min ; Max
|
26.5 ; 57.3
|
24.9 ; 57.9
|
20.5 ; 46.9
|
20.0 ; 50.8
|
20.0 ; 57.9
|
Dávka použitá na
liečbu krvácania
(IU/kg BW) Priemer (SD)
Min ; Max
|
44.4 (17.9)
25.9 ; 193.8
|
40.0 (10.4)
25.5 ; 65.5
|
28.2 (10.2)
12.4 ; 76.8
|
33.8 (11.9)
9.3 ; 104.0
|
34.5 (12.6)
9.3 ; 193.8
|
Miera úspešnosti* %
|
92.9%
|
88.9%
|
79.7%
|
85.6%
|
85.9%
|
BW: Telesná hmotnosť, SD: Štandardná odchýlka
*Úspešnosť je definovaná buď ako „Výborná“ alebo „Dobrá“.
Celkovo sa uskutočnilo 14 chirurgických zákrokov u 14 pacientov, z ktorých 13 bolo veľkých chirurgických zákrokov a 1 bol malý. Hemostáza bola úspešná u všetkých chirurgických zákrokoch a nebolo hlásené žiadne zlyhanie liečby.
5.2 Farmakokinetické vlastnostiVšetky farmakokinetické štúdie s turoktokogom alfa boli uskutočnené u pacientov so závažnou hemofíliou A (FVIII ≤1 %), ktorí boli už predtým liečení. Analýza vzoriek plazmy sa vykonala pomocou jednostupňového koagulačného testu a chromogénnej metódy.
V medzinárodnej štúdii zahŕňajúcej 36 laboratórií bol stanovený obsah NovoEight ako FVIII C, bol vyhodnotený a porovnaný s liekom dostupným na trhu obsahujúcim rekombinantný faktor VIII s celou dĺžkou reťazca. Štúdia preukázala porovnateľné a konzistentné výsledky pre obidva lieky a tiež to, že NovoEight môže byť spoľahlivo v plazme stanovený bez toho, aby bol potrebný špeciálny štandard
pre NovoEight.
Farmakokinetické parametre jednorazovej dávky lieku NovoEight sú uvedené v Tabuľke 4 pre koagulačný test a v Tabuľke 5 pre chromogénnu metódu.
Tabuľka 4 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou hemofíliou A (FVIII ≤1%), koagulačná metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=33
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,018 (0,007)
| 0,020 (0,004)
| 0,022 (0,004)
|
AUC ((IU*h)/ml)
| 9,92 (4,11)
| 11,09 (3,74)
| 15,26 (5,77)
|
CL (ml/h/kg)
| 6,21 (3,66)
| 5,02 (1,68)
| 3,63 (1,09)
|
t½ (h)
| 7,65 (1,84)
| 8,02 (1,89)
| 11,00 (4,65)
|
Vss (ml/kg)
| 56,68 (26,43)
| 46,82 (10,63)
| 47,40 (9,21)
|
Cmax (IU/ml)
| 1,00 (0,58)
| 1,07 (0,35)
| 1,226 (0,41)
|
Priemerný čas
zotrvania (h)
| 9,63 (2,50)
| 9,91 (2,57)
| 14,19 5,08)
|
Tabuľka 5 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou
hemofíliou A (FVIII ≤1%), chromogénna metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=48
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,022 (0,006)
| 0,025 (0.006)
| 0,029 (0,006)
|
AUC ((IU*h)/ml)
| 12,23 (4,36)
| 14,37 (3.48)
| 19,63 (7,73)
|
CL (ml/h/kg)
| 4,59 (1,73)
| 3,70 (1.00)
| 2,86 (0,94)
|
t½ (h)
| 9,99 (1,71)
| 9,42 (1.52)
| 11,22 (6,86)
|
Vss (ml/kg)
|
55,46 (23,53)
|
41,23 (6.00)
|
38,18 (10,24)
|
Cmax (IU/ml)
|
1,12 (0,31)
|
1,25 (0.27)
|
1,63 (0,50)
|
Priemerný čas
zotrvania (h)
|
12,06 (1,90)
|
11,61 (2.32)
|
14,54 (5,77)
|
Farmakokinetické parametre boli porovnateľné medzi pediatrickými pacientmi vo veku do 6 rokov
a pediatrickými pacientmi od 6 do 12 rokov. Niektoré odchýlky boli pozorované vo farmakokinetických parametroch lieku NovoEight medzi pediatrickými a dospelými pacientmi. Vyššie
hodnoty CL a kratší t½ sa zistil u pediatrických pacientov v porovnaní s dospelými pacientmi
s hemofíliou A, čo môže byť čiastočne spôsobené známym vyšším plazmatickým objemom na
kilogram telesnej hmotnosti u mladších pacientov.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe konvenčných farmakologických štúdií bezpečnosti a toxicity po opakovanom podaní neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokPrášok: Chlorid sodný L-histidín Sacharóza Polysorbát 80
L-metionín
Dihydrát chloridu vápenatého
Hydroxid sodný
Kyselina chlorovodíková
Rozpúšťadlo: Chlorid sodný Voda na injekciu
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnostiPredotvorením:2 roky
Počas času použiteľnosti môže byť liek uchovávaný nepretržite pri izbovej teplote ≤30°C počas obdobia nepresahujúceho 6 mesiacov. Ak bol liek už raz vybratý z chladničky, nesmie sa už do chladničky vrátiť. Zaznačte si prosím na krabičke dátum, kedy ste začali liek uchovávať pri izbovej teplote.
Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom.
Po rekonštitúcii:Chemická a fyzikálna stabilita po rekonštitúcii bola dokázaná počas 24 hodín pri 2°C – 8°C a počas
4 hodín pri uchovávaní pri ≤30°C. Z mikrobiologického hľadiska sa má tento liek použiť ihneď po rekonštitúcii. Ak sa nepoužije ihneď, čas a podmienky uchovávania lieku po rekonštitúcii a pred
použitím je zodpovednosť používateľa a zvyčajne nemá byť čas dlhší ako 4 hodiny pri uchovávaní pri
≤30°C alebo 24 hodín pri 2°C - 8°C, ak rekonštitúcia prebehla za kontrolovaných a validovaných aseptických podmienok.
Všetok nepoužitý liek, ktorý bol uchovávaný pri izbovej teplote dlhšie ako 4 hodiny má byť zlikvidovaný.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke (2ºC - 8ºC). Chráňte pred mrazom.
Uchovávanie pri izbovej teplote a podmienky uchovávania lieku po rekonštitúcii, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaKaždé balenie lieku NovoEight 2000 IU prášok a rozpúšťadlo na injekčný roztok obsahuje:
– 1 sklenenú injekčnú liekovku (typ I) s práškom a chlórobutylovou gumenou zátkou
– 1 sterilný adaptér injekčnej liekovky na rekonštitúciu
– 1 naplnenú injekčnú striekačku so 4 ml rozpúšťadla s záverom spätného chodu (polypropylén), gumeným piestom (brómbutyl) a uzáverom so zátkou (brómbutyl)
– 1 nástavec piesta (polypropylén).
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanieNovoEight je určený na intravenózne podanie po rekonštitúcii prášku s rozpúšťadlom, ktoré je dodávané v injekčnej striekačke. Po rekonštitúcii je roztok číry alebo mierne opalizujúci. Roztok nepoužite, ak je zakalený alebo obsahuje usadeniny.
Budete potrebovať aj infúznu súpravu (hadičku a motýlikovú ihlu), sterilné alkoholové tampóny, gázové tampóny a náplasti. Tieto pomôcky nie je súčasťou balenia lieku NovoEight.
Vždy dodržujte aseptickú techniku.
 R
Rekonštitúcia:
A)

Vyberte injekčnú liekovku, adaptér injekčnej
Aliekovky a naplnenú injekčnú striekačku
z krabičky. Nástavec piesta nechajte v krabičke. Nechajte injekčnú liekovku a naplnenú injekčnú
striekačku dosiahnuť izbovú teplotu. Môžete to urobiť ich podržaním v rukách, až kým necítite,
že sú také teplé ako vaše ruky. Nezohrievajte injekčnú liekovku a naplnenú injekčnú striekačku iným spôsobom.
B)

Odstráňte plastové viečko z injekčnej liekovky.
BAk je plastové viečko uvoľnené, alebo chýba,
injekčnú liekovku nepoužite
. Očistite gumovú zátku na injekčnej liekovke sterilným
alkoholovým tampónom a nechajte ju pred použitím pár sekúnd schnúť na vzduchu.
C)

Odstráňte ochranný papier z adaptéra injekčnej
Cliekovky. Ak ochranný papier nie je úplne
uzavretý alebo je roztrhnutý, nepoužite adaptér injekčnej liekovky.
Nevyberajte prstami adaptér injekčnej liekovky
z ochranného krytu.
D)

Otočte ochranný kryt a zatlačte adaptér na
Dinjekčnú liekovku. Neodstraňujte adaptér z
injekčnej liekovky, keď je už pripevnený.
E)
Jemne pritlačte ochranný kryt palcom a ukazovákom ako je znázornené. Odstráňte
ochranný kryt z adaptéra injekčnej liekovky.
 E
EF)

Pevne uchopte nástavec piesta za širší koniec
Fa ihneď ho pripojte k injekčnej striekačke
otáčaním v smere hodinových ručičiek vnútri naplnenej injekčnej striekačky, až kým
nepocítite odpor.
G)

Odstráňte kryt injekčnej striekačky z naplnenej
Ginjekčnej striekačky ohnutím dole, až kým sa
nezlomí perforácia. Nedotýkajte sa špičky
injekčnej striekačky pod krytom injekčnej striekačky.
H)
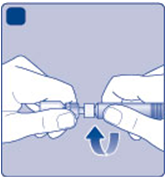
Naskrutkujte naplnenú injekčnú striekačku
Hbezpečne na adaptér, až kým nepocítite odpor.
I)

Držte naplnenú injekčnú striekačku s injekčnou
Iliekovkou naklonenou smerom dole. Tlačte
nástavec piesta, aby ste vstrekli všetko rozpúšťadlo do injekčnej liekovky.
J)

Držte nástavec piesta stlačený dole a jemne
Jkrúžte s injekčnou liekovkou, až sa rozpustí
všetok prášok. Netraste injekčnou liekovkou, lebo to môže spôsobiť spenenie.
Odporúča sa použiť NovoEight ihneď po rekonštitúcii. Podmienky uchovávania rekonštituovaného
lieku, pozri časť 6.3.
Ak je potrebná väčšia dávka, opakujte kroky A až J s ďalšími injekčnými liekovkami, adaptérmi
injekčnej liekovky a naplnenými injekčnými striekačkami.
Podanierekonštituovanéhoroztoku:
K)
Držte nástavec piesta stlačený na doraz. Otočte injekčnú striekačku s injekčnou liekovkou hore dnom. Prestaňte tlačiť nástavec piesta a nechajte ho pohnúť sa samovoľne naspäť, kým rekonštituovaný roztok naplní injekčnú striekačku. Ťahajte nástavec piesta jemne smerom dole, aby ste natiahli rekonštituovaný roztok do injekčnej striekačky.
V prípade, že potrebujete len časť z injekčnej liekovky, použite stupnicu na injekčnej striekačke, aby ste videli koľko rekonštituovaného roztoku ste odobrali, ako vám povedal lekár alebo zdravotná sestra.
Kým držíte injekčnú liekovku hore dnom, klepkajte jemne na injekčnú striekačku, aby všetky bubliny vystúpili nahor. Tlačte nástavec piesta pomaly, až kým všetky vzduchové bubliny nevytlačíte.
|
K
|
L)
Odskrutkujte adaptér s injekčnou liekovkou.
NovoEight je teraz pripravený na injekčné podanie. Vyberte si vhodné miesto a pomaly si podajte injekciu lieku NovoEight do žily počas 2-5 minút.
|
L
|
Likvidácia:


Po podaní injekcie, bezpečne zlikvidujte všetok nepoužitý roztok lieku NovoEight, injekčnú
striekačku s infúznou súpravou, injekčnú liekovku s adaptérom injekčnej liekovky, a ostatný odpadový materiál ako vám povedal lekárnik.
Nevyhadzujte ho s bežným domovým odpadom.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovo Nordisk A/S Novo Allé
DK-2880 Bagsværd
Dánsko
8. REGISTRAČNÉ ČÍSLA
EU/1/13/888/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na
nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUNovoEight 3000 IU prášok a rozpúšťadlo na injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá injekčná liekovka s práškom obsahuje 3000 IU ľudského koagulačného faktora VIII (rDNA), turoktokog alfa.
Po rekonštitúcii obsahuje NovoEight približne 750 IU/ml ľudského koagulačného faktora VIII (rDNA), turoktokog alfa.
Účinnosť (IU) sa stanovuje podľa Európskeho liekopisu chromogénnym testom. Špecifická aktivita
NovoEight je približne 8 300 IU/mg bielkoviny.
Turoktokog alfa (ľudský koagulačný faktor VIII (rDNA)) je purifikovaná bielkovina, ktorá obsahuje
1 445 aminokyselín s molekulovou hmotnosťou približne 166 kDA. Vyrába sa technológiou
rekombinantnej DNA z buniek ovária čínskeho škrečka (CHO), a vyrába sa bez pridania akýchkoľvek ľudských alebo živočíšnych derivovaných bielkovín pri spracovaní bunkových kultúr, čistení alebo koncovej úprave.
Turoktokog alfa je rekombinantný ľudský koagulačný faktor VIII so skrátenou B-doménou (B- doména pozostáva z 21 aminokyselín prirodzenej B-domény) bez akýchkoľvek modifikácií v poradí aminokyselín.
Pomocnálátkasoznámymúčinkom:0,31 mmol sodíka (7 mg) na 1 ml rekonštituovaného roztoku.
Úplný zoznam pomocných látok, pozri bod 6.1.
3. LIEKOVÁ FORMAPrášok a rozpúšťadlo na injekčný roztok.
Biely alebo jemne žltý prášok alebo drobivá hmota. Číry a bezfarebný injekčný roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieLiečba a profylaxia krvácania u pacientov s hemofíliou A (vrodený deficit faktora VIII). NovoEight môžu užívať všetky vekové skupiny.
4.2 Dávkovanie a spôsob podaniaLiečba sa má začať pod dohľadom lekára so skúsenosťami s liečbou hemofílie.
D
oteraz
neliečení
pacienti
Bezpečnosť a účinnosť lieku NovoEight u doteraz neliečených pacientov nebola zatiaľ stanovená. Nie sú k dispozícii žiadne údaje.
Dávkovanie
Dávkovanie a trvanie substitučnej liečby závisí od závažnosti deficitu faktora VIII, mieste a rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek faktora VIII je vyjadrený v medzinárodných jednotkách (IU), ktoré zodpovedajú súčasnému WHO štandardu pre lieky obsahujúce faktor VIII. Aktivita faktora VIII v plazme je vyjadrená buď v percentách (porovnaním k normálnej ľudskej plazme), alebo v medzinárodných jednotkách (porovnaním k medzinárodnému štandardu pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII v jednom ml normálnej ľudskej plazmy.
Liečba v prípade potreby
Výpočet požadovanej dávky faktora VIII vychádza z empirického zistenia, že 1 medzinárodná jednotka (IU) faktora VIII na kg telesnej hmotnosti zvýši aktivitu plazmatického faktora VIII o
2 IU/dl. Požadovaná dávka sa určí použitím nasledujúceho vzorca:
Požadovaný počet jednotiek = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (%) (IU/dl) x
0,5 (IU/kg na IU/dl)
Množstvo, ktoré sa má podať a frekvencia podania sa majú vždy riadiť podľa klinickej účinnosti u jednotlivého pacienta.
V nasledujúcich prípadoch krvácania počas zodpovedajúceho obdobia nemá aktivita faktora VIII klesnúť pod danú hladinu aktivity v plazme (v % normálu alebo IU/dl). Nasledujúcu tabuľku možno použiť ako návod na dávkovanie pri epizódach krvácania a pri chirurgických zákrokoch:
Tabuľka 1 Návod na dávkovanie pri epizódach krvácania a operáciách

Stupeň krvácania/Typ chirurgického zákroku
Požadovaná hladina faktora VIII (%) (IU/dl)
Frekvencia dávok (hodiny)/Trvanie liečby (dni)
Kr
v
ácanie
Začínajúca hemartróza, krvácanie do
svalov alebo do ústnej dutiny
20-40 Opakovať každých 12 až 24 hodín,
najmenej 1 deň, až kým sa krvácanie indikované bolesťou
nezastaví alebo do zahojenia.
Rozsiahlejšia hemartróza, krvácanie
do svalov alebo hematóm
30-60 Opakovať infúziu každých 12-
24 hodín počas 3-4 alebo viac dní, kým bolesť a akútna slabosť neustúpi

Život ohrozujúce krvácanie 60-100 Opakovať infúziu každých 8 až
24 hodín až do stavu mimo ohrozenia života
C
hirurgický
zákrok
M
enší chirurgický zákrok, vrátane extrakcie zubov
30-60 Každých 24 hodín, najmenej 1 deň, až do zahojenia

Stupeň krvácania/Typ chirurgického zákroku
Požadovaná hladina faktora VIII (%) (IU/dl)
Frekvencia dávok (hodiny)/Trvanie liečby (dni)
Veľký chirurgický zákrok 80-100
(pred a po operácii)
Opakovať infúziu každých 8-
24 hodín až do adekvátneho zahojenia rany, potom pokračovať
v liečbe najmenej ďalších 7 dní na
udržanie faktora VIII na 30% až
60% (IU/dl)
 Profylaxia
Profylaxia
Na dlhodobú prevenciu krvácania u pacientov so závažnou hemofíliou A. Obvyklé odporučené dávky sú 20-40 IU faktora VIII na kg telesnej hmotnosti každý druhý deň alebo 20-50 IU faktora VIII na kg
telesnej hmotnosti 3-krát týždenne. V niektorých prípadoch, zvlášť u mladých pacientov môžu byť potrebné kratšie intervaly v dávkovaní alebo vyššie dávky.
Monitorovanie liečbyPočas liečby sa odporúča robiť príslušné stanovenie hladín faktora VIII, aby sa určila veľkosť dávky, ktorá sa má podať a frekvencia podania injekcií. V prípade veľkých chirurgických zákrokov je
nevyhnutné presné monitorovanie substitučnej liečby pomocou koagulačnej analýzy (aktivita faktora
VIII v plazme). Jednotliví pacienti môžu rozdielne reagovať na faktor VIII, môžu dosiahnuť rôzne úrovne stabilizácie in vivo a môžu sa prejaviť rôznym biologickým polčasom.
Chirurgický zákrokNie sú žiadne skúsenosti s chirurgickými zákrokmi u pediatrických pacientov.
Starší ľudiaNie sú žiadne skúsenosti s pacientmi
> 65 rokov.
Pediatrická populáciaNa dlhodobú profylaxiu krvácania pacientov mladších ako 12 rokov sa odporúčajú dávky 25-50 IU faktora VIII na kg telesnej hmotnosti každý druhý deň, alebo 25-60 IU faktora VIII na kg telesnej hmotnosti 3-krát týždenne. Pre pediatrických pacientov starších ako 12 rokov sú odporúčania dávkovania rovnaké ako pre dospelých.
SpôsobpodávaniaIntravenózne použitie.
Odporúčaná rýchlosť infúzie pre NovoEight je 1-2 ml/min. Rýchlosť sa má určiť tak, aby vyhovovala
pacientovi.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo ktorúkoľvek z pomocných látok uvedených v časti 6.1. Známa alergická reakcia na škrečiu bielkovinu.
4.4 Osobitné upozornenia a opatrenia pri používaníHypersenzitivitaPri užívaní NovoEight sa môžu vyskytnúť hypersenzitívne reakcie alergického typu. Produkt obsahuje stopy škrečích bielkovín, ktoré môžu u niektorých pacientov vyvolávať alergické reakcie. Ak sa objavia príznaky precitlivenosti, pacienti majú byť poučení, aby ihneď prerušili liečbu týmto liekom a
obrátili sa na svojho lekára. Pacienti majú byť informovaní o počiatočných príznakoch hypersenzitívnych reakcií, vrátane žihľavky, generalizovanej urtikárie, zvierania na hrudníku, sipotu, hypotenzie a anafylaxie.
V prípade šoku sa má dodržať štandardná medicínska liečba pri šoku. Inhibítory
Známou komplikáciou liečby v jednotlivých prípadoch hemofílie A je tvorba neutralizujúcich
protilátok (inhibítorov) k faktoru VIII. Tieto inhibítory sú obyčajne IgG imunoglobulíny pôsobiace proti koagulačnej aktivite faktora VIII, ktorá je kvantifikovaná Bethesda jednotkami (BU) na ml plazmy pri použití modifikovanej metódy. Riziko tvorby inhibítorov koreluje s expozíciou faktora VIII, toto riziko býva najvyššie počas prvých 20 dní expozície. Zriedkavo sa môžu inhibítory tvoriť aj počas prvých 100 dňoch expozície.
Pacienti, ktorí boli už predtým liečení s expozíciou viac ako 100 dní a mali už v predošlej anamnéze tvorbu inhibítorov, pri zmene liečby z niektorého lieku obsahujúceho faktor VIII na iný, došlo
v niektorých prípadoch opäť k tvorbe inhibítorov (nízky titer). Preto sa u všetkých pacientov odporúča vždy pri zmene liečby na iný liek, pozorne monitorovať vznik inhibítorov.
Všeobecne u všetkých pacientov liečených liekmi s koagulačným faktorom VIII sa má pozorne sledovať tvorba inhibítorov vhodným klinickým pozorovaním a laboratórnymi testami. Ak sa nedosiahne očakávaná hladina aktivity faktora VIII v plazme, alebo ak sa krvácanie nezvládne príslušnou dávkou, má sa robiť testovanie na prítomnosť inhibítora faktora VIII. U pacientov
s vysokou hladinou inhibítora, môže byť liečba faktorom VIII neúčinná a má sa uvažovať o iných možnostiach liečby. Liečbu takýchto pacientov má viesť lekár so skúsenosťami s liečbou hemofílie a s inhibítormi faktora VIII.
Dôrazne sa odporúča, aby sa vždy pri podaní lieku NovoEight pacientovi, zaznamenal názov a číslo šarže lieku, aby bolo možné spätne priradiť číslo šarže lieku k pacientovi.
Pomocnélátky,ktorétrebavziaťdoúvahy
Po rekonštitúcii obsahuje tento liek 0,31 mmol sodíka (7 mg) na 1 ml rekonštituovaného roztoku. To je potrebné vziať do úvahy u pacientov so sodíkovou diétou.
Pediatrickápopulácia
Uvedené varovania a upozornenia platia pre dospelých aj deti.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s liekom NovoEight.
4.6 Fertilita, gravidita, a laktácia
Neuskutočnili sa žiadne reprodukčné štúdie na zvieratách s liekom NovoEight. Vzhľadom na vzácny výskyt hemofílie A u žien, nie sú skúsenosti s použitím faktora VIII počas tehotenstva a laktácie. Preto sa má faktor VIII použiť počas tehotenstva alebo laktácie, len ak je jednoznačná indikácia.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
NovoEight nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Zriedkavo boli hlásené hypersenzitivita alebo alergická reakcia (ktoré môžu zahŕňať angioedém, pálenie a štípanie v mieste podania infúzie, triašku, začervenanie, generalizovanú urtikáriu, bolesť
hlavy, vyrážku, hypotenziu, letargiu, nauzeu, nevoľnosť, tachykardiu, zvieranie na hrudníku, brnenie, vracanie, sipot) a v niektorých prípadoch môžu viesť k závažnej anafylaxii (vrátane šoku).
Veľmi zriedkavo bola hlásená tvorba protilátok na škrečie bielkoviny spojené s hypersenzitívnymi reakciami.
U pacientov s hemofíliou A sa môžu tvoriť neutralizujúce protilátky (inhibítory) proti faktoru VIII. Ak sa objavia takéto inhibítory, stav sa bude prejavovať ako nedostatočná klinická odpoveď. V týchto prípadoch sa odporúča obrátiť sa špecializované centrum pre liečbu hemofílie.
TabuľkovýzoznamnežiaducichreakciíTabuľka dolu je v súlade s klasifikáciou podľa tried orgánových systémov MedDRA (SOC and
Preferred Term Level).
Frekvencia výskytu je hodnotená podľa nasledujúcej konvencie: veľmi časté (≥1/10), časté (≥1/100 až
<1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé
(<1/10 000), neznáma (z dostupných údajov sa nedá určiť).
V každej skupine frekvencie, sú nežiaduce reakcie uvedené podľa klesajúcej závažnosti.
Tabuľka 2 Frekvencia nežiaducich reakcií lieku v klinických štúdiách
Trieda orgánových systémov
| Frekvencia*
| Nežiaduca reakcia
|
Psychické poruchy
| Menej časté
| Nespavosť
|
Poruchy nervového systému
| Menej časté
| Bolesť hlavy, závrat
|
Poruchy srdca a srdcovej činnosti
| Menej časté
| Sínusová tachykardia
|
Poruchy ciev
| Menej časté
| Hypertenzia, lymfedém
|
Poruchy pečene a žlčových ciest
| Časté
| Zvýšenie pečeňových enzýmov**
|
Poruchy kože a podkožného tkaniva
| Menej časté
| Vyrážka
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
| Menej časté
| Muskuloskeletálna stuhnutosť,
artropatia, bolesti končatín, muskuloskeletálna bolesť
|
Celkové poruchy a reakcie v mieste
podania
| Časté
| Reakcie v mieste podania
injekcie***
|
Menej časté
| Únava, návaly tepla, periférny
edém, pyrexia
|
Laboratórne a funkčné vyšetrenia
| Menej časté
| Zrýchlená srdcová frekvencia
|
Úrazy, otravy a komplikácie
liečebného postupu
| Menej časté
| Kontúzia
|
* Výpočet založený na celkovom počte jednotlivých pacientov vo všetkých klinických štúdiách
(214)
** Zvýšenie pečeňových enzýmov sa týka alanín aminotransferázy, aspartát aminotransferázy, gama-glutamyltransferázy a bilirubínu
*** Reakcie v mieste podania injekcie zahŕňajú erytém v mieste podania injekcie, opuch v mieste
podania injekcie a svrbenie v mieste podania injekcie
PopisvybranýchnežiaducichreakciíPočas všetkých klinických štúdií s liekom NovoEight bolo celkovo hlásených 30 nežiaducich reakcií a to u 19 z 214 pacientov liečených liekom NovoEight. Najčastejšou hlásenou nežiaducou reakciou
bola reakcia v mieste podania injekcie a zvýšenie pečeňových enzýmov. Z 30 nežiaducich reakcií, 2
boli hlásené u 1 z 31 pacientov do 6 rokov, žiadna u pacientov od 6 do 18 rokov a 28 bolo hlásených u 18 zo 127 dospelých.
PediatrickápopuláciaV klinickej štúdii zahŕňajúcej 63 pediatrických pacientov vo veku medzi 0 a 12 rokov a 24 dospievajúcich vo veku medzi 12 a 18 rokov so závažnou hemofíliou A, neboli pozorované žiadne rozdiely v bezpečnostnom profile lieku NovoEight medzi pediatrickými pacientmi a dospelými.
Hláseniepodozrenínanežiaducereakcie Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieŽiadne príznaky predávkovania rekombinantným koagulačným faktorom VIII neboli hlásené.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antihemoragiká, krvný koagulačný faktor VIII, ATC kód: zatiaľ
nepridelený
MechanizmusúčinkuNovoEight obsahuje turoktokog alfa, ľudský koagulačný faktor VIII (rDNA), so skrátenou B- doménou. Tento glykoproteín má zhodnú štruktúru s aktivovaným ľudským faktorom VIII. Posttranslačné modifikácie sú podobné posttranslačným modifikáciám molekuly získanej z plazmy. Sulfatačné tyrozínové miesto je Tyr1680 (prirodzená úplná dĺžka), ktoré je dôležité pre väzbu na von Willebrandov faktor, je v molekule turoktokogu alfa plne sulfátované. Po podaní infúzie pacientovi
s hemofíliou sa faktor VIII viaže na endogénny von Willebrandov faktor v krvnom obehu pacienta. Komplex faktora VIII/von Willebrandov faktor sa skladá z dvoch molekúl (faktor VIII a von Willebrandov faktor) s rôznymi fyziologickými funkciami. Aktivovaný faktor VIII pôsobí ako kofaktor pre aktivovaný faktor IX, urýchľujúci konverziu faktora X na aktivovaný faktor X. Aktivovaný faktor X konvertuje protrombín na trombín. Trombín potom konvertuje fibrinogén na fibrín a môže sa tvoriť zrazenina. Hemofília je vrodená porucha krvnej zrážanlivosti viazaná na pohlavie zapríčinená zníženou hladinou faktora VIIIC a dôsledkom je profúzne krvácanie do kĺbov,
svalov alebo vnútorných orgánov, buď spontánne alebo ako dôsledok úrazu alebo chirurgickej traumy. Pri substitučnej liečbe sa plazmatické hladiny faktora VIII zvýšia, tým sa dočasne upraví deficit
faktora a tým sa upraví tendencia ku krvácaniu.
KlinickáúčinnosťVykonali sa tri multicentrické, otvorené, nekontrolované štúdie, s cieľom hodnotenia bezpečnosti a účinnosti lieku NovoEight v profylaxii a liečbe krvácania u pacientov s už liečenou závažnou hemofíliou A (FVIII aktivita ≤1%). Štúdie zahŕňali 213 liečených pacientov; 150 dospievajúcich alebo dospelých pacientov bez inhibítorov vo veku od 12 rokov (≥150 dní liečby) a 63 pediatrických pacientov bez inhibítorov vo veku do 12 rokov (≥50 dní liečby). 187 z 213 pacientov pokračovalo
v rozšírenej bezpečnostnej štúdii. Liečba liekom NovoEight sa ukázala ako bezpečná a mala predpokladaný hemostatický a preventívny účinok. Počas akumulovanej liečby viac ako 54 000 dní (čo zodpovedá 342 paciento/rokov) nebola pozorovaná vo fáze 3a klinickej štúdie, u pacientov už predtým liečených, žiadna tvorba inhibítorov proti faktoru VIII. Z 1 377 hlásených krvácaní pozorovaných u 177 pacientov z 213, bolo 1 244 (90,3%) krvácaní zastavených 1-2 infúziami lieku NovoEight.
Tabuľka 3 Spotreba turoktokogu alfa a celková miera úspešnosti
| Mladšie deti
(0<6 rokov)
| Staršie deti
(6<12 rokov)
| Dospievajúci
(12<18
rokov)
| Dospelí
(≥18 rokov)
| Celkovo
|
Počet pacientov
| 31
| 32
| 24
| 126
| 213
|
Dávka použitá na
prevenciu
na pacienta (IU/kg
BW)
Priemer (SD)
|
40.1 (8.5)
|
36.6 (9.0)
|
27.0 (7.6)
|
26.9 (6.9)
|
30.3 (9.2)
|
Min ; Max
|
26.5 ; 57.3
|
24.9 ; 57.9
|
20.5 ; 46.9
|
20.0 ; 50.8
|
20.0 ; 57.9
|
Dávka použitá na
liečbu krvácania
(IU/kg BW) Priemer (SD)
Min ; Max
|
44.4 (17.9)
25.9 ; 193.8
|
40.0 (10.4)
25.5 ; 65.5
|
28.2 (10.2)
12.4 ; 76.8
|
33.8 (11.9)
9.3 ; 104.0
|
34.5 (12.6)
9.3 ; 193.8
|
Miera úspešnosti* %
|
92.9%
|
88.9%
|
79.7%
|
85.6%
|
85.9%
|
BW: Telesná hmotnosť, SD: Štandardná odchýlka
*Úspešnosť je definovaná buď ako „Výborná“ alebo „Dobrá“.
Celkovo sa uskutočnilo 14 chirurgických zákrokov u 14 pacientov, z ktorých 13 bolo veľkých chirurgických zákrokov a 1 bol malý. Hemostáza bola úspešná u všetkých chirurgických zákrokoch a nebolo hlásené žiadne zlyhanie liečby.
5.2 Farmakokinetické vlastnostiVšetky farmakokinetické štúdie s turoktokogom alfa boli uskutočnené u pacientov so závažnou hemofíliou A (FVIII ≤1 %), ktorí boli už predtým liečení. Analýza vzoriek plazmy sa vykonala pomocou jednostupňového koagulačného testu a chromogénnej metódy.
V medzinárodnej štúdii zahŕňajúcej 36 laboratórií bol stanovený obsah NovoEight ako FVIII C, bol vyhodnotený a porovnaný s liekom dostupným na trhu obsahujúcim rekombinantný faktor VIII s celou dĺžkou reťazca. Štúdia preukázala porovnateľné a konzistentné výsledky pre obidva lieky a tiež to, že NovoEight môže byť spoľahlivo v plazme stanovený bez toho, aby bol potrebný špeciálny štandard
pre NovoEight.
Farmakokinetické parametre jednorazovej dávky lieku NovoEight sú uvedené v Tabuľke 4 pre koagulačný test a v Tabuľke 5 pre chromogénnu metódu.
Tabuľka 4 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou hemofíliou A (FVIII ≤1%), koagulačná metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=33
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,018 (0,007)
| 0,020 (0,004)
| 0,022 (0,004)
|
AUC ((IU*h)/ml)
| 9,92 (4,11)
| 11,09 (3,74)
| 15,26 (5,77)
|
CL (ml/h/kg)
| 6,21 (3,66)
| 5,02 (1,68)
| 3,63 (1,09)
|
t½ (h)
| 7,65 (1,84)
| 8,02 (1,89)
| 11,00 (4,65)
|
Vss (ml/kg)
| 56,68 (26,43)
| 46,82 (10,63)
| 47,40 (9,21)
|
Cmax (IU/ml)
| 1,00 (0,58)
| 1,07 (0,35)
| 1,226 (0,41)
|
Priemerný čas
zotrvania (h)
| 9,63 (2,50)
| 9,91 (2,57)
| 14,19 5,08)
|
Tabuľka 5 Farmakokinetika pre jednorazovú dávku turoktokogu alfa u pacientov so závažnou
hemofíliou A (FVIII ≤1%), chromogénna metóda
Parameter
| 0−<6 rokov
| 6−<12 rokov
| ≥12 rokov
|
n=14
| n=14
| n=48
|
Priemer (SD)
| Priemer (SD)
| Priemer (SD)
|
Zastavenie krvácania
(IU/ml)/(IU/kg)
| 0,022 (0,006)
| 0,025 (0.006)
| 0,029 (0,006)
|
AUC ((IU*h)/ml)
| 12,23 (4,36)
| 14,37 (3.48)
| 19,63 (7,73)
|
CL (ml/h/kg)
| 4,59 (1,73)
| 3,70 (1.00)
| 2,86 (0,94)
|
t½ (h)
| 9,99 (1,71)
| 9,42 (1.52)
| 11,22 (6,86)
|
Vss (ml/kg)
|
55,46 (23,53)
|
41,23 (6.00)
|
38,18 (10,24)
|
Cmax (IU/ml)
|
1,12 (0,31)
|
1,25 (0.27)
|
1,63 (0,50)
|
Priemerný čas
zotrvania (h)
|
12,06 (1,90)
|
11,61 (2.32)
|
14,54 (5,77)
|
Farmakokinetické parametre boli porovnateľné medzi pediatrickými pacientmi vo veku do 6 rokov
a pediatrickými pacientmi od 6 do 12 rokov. Niektoré odchýlky boli pozorované vo farmakokinetických parametroch lieku NovoEight medzi pediatrickými a dospelými pacientmi. Vyššie
hodnoty CL a kratší t½ sa zistil u pediatrických pacientov v porovnaní s dospelými pacientmi
s hemofíliou A, čo môže byť čiastočne spôsobené známym vyšším plazmatickým objemom na
kilogram telesnej hmotnosti u mladších pacientov.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe konvenčných farmakologických štúdií bezpečnosti a toxicity po opakovanom podaní neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokPrášok: Chlorid sodný L-histidín Sacharóza Polysorbát 80
L-metionín
Dihydrát chloridu vápenatého
Hydroxid sodný
Kyselina chlorovodíková
Rozpúšťadlo: Chlorid sodný Voda na injekciu
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnostiPredotvorením:2 roky
Počas času použiteľnosti môže byť liek uchovávaný nepretržite pri izbovej teplote ≤30°C počas obdobia nepresahujúceho 6 mesiacov. Ak bol liek už raz vybratý z chladničky, nesmie sa už do chladničky vrátiť. Zaznačte si prosím na krabičke dátum, kedy ste začali liek uchovávať pri izbovej teplote.
Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom.
Po rekonštitúcii:Chemická a fyzikálna stabilita po rekonštitúcii bola dokázaná počas 24 hodín pri 2°C – 8°C a počas
4 hodín pri uchovávaní pri ≤30°C. Z mikrobiologického hľadiska sa má tento liek použiť ihneď po rekonštitúcii. Ak sa nepoužije ihneď, čas a podmienky uchovávania lieku po rekonštitúcii a pred
použitím je zodpovednosť používateľa a zvyčajne nemá byť čas dlhší ako 4 hodiny pri uchovávaní pri
≤30°C alebo 24 hodín pri 2°C - 8°C, ak rekonštitúcia prebehla za kontrolovaných a validovaných aseptických podmienok.
Všetok nepoužitý liek, ktorý bol uchovávaný pri izbovej teplote dlhšie ako 4 hodiny má byť zlikvidovaný.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke (2ºC - 8ºC). Chráňte pred mrazom.
Uchovávanie pri izbovej teplote a podmienky uchovávania lieku po rekonštitúcii, pozri časť 6.3.
6.5 Druh obalu a obsah baleniaKaždé balenie lieku NovoEight 3000 IU prášok a rozpúšťadlo na injekčný roztok obsahuje:
– 1 sklenenú injekčnú liekovku (typ I) s práškom a chlórobutylovou gumenou zátkou
– 1 sterilný adaptér injekčnej liekovky na rekonštitúciu
– 1 naplnenú injekčnú striekačku so 4 ml rozpúšťadla s záverom spätného chodu (polypropylén), gumeným piestom (brómbutyl) a uzáverom so zátkou (brómbutyl)
– 1 nástavec piesta (polypropylén).
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanieNovoEight je určený na intravenózne podanie po rekonštitúcii prášku s rozpúšťadlom, ktoré je dodávané v injekčnej striekačke. Po rekonštitúcii je roztok číry alebo mierne opalizujúci. Roztok nepoužite, ak je zakalený alebo obsahuje usadeniny.
Budete potrebovať aj infúznu súpravu (hadičku a motýlikovú ihlu), sterilné alkoholové tampóny, gázové tampóny a náplasti. Tieto pomôcky nie je súčasťou balenia lieku NovoEight.
Vždy dodržujte aseptickú techniku.
 R
Rekonštitúcia:
A)

Vyberte injekčnú liekovku, adaptér injekčnej
Aliekovky a naplnenú injekčnú striekačku
z krabičky. Nástavec piesta nechajte v krabičke. Nechajte injekčnú liekovku a naplnenú injekčnú
striekačku dosiahnuť izbovú teplotu. Môžete to urobiť ich podržaním v rukách, až kým necítite,
že sú také teplé ako vaše ruky. Nezohrievajte injekčnú liekovku a naplnenú injekčnú striekačku iným spôsobom.
B)

Odstráňte plastové viečko z injekčnej liekovky.
BAk je plastové viečko uvoľnené, alebo chýba,
injekčnú liekovku nepoužite
. Očistite gumovú zátku na injekčnej liekovke sterilným
alkoholovým tampónom a nechajte ju pred použitím pár sekúnd schnúť na vzduchu.
C)

Odstráňte ochranný papier z adaptéra injekčnej
Cliekovky. Ak ochranný papier nie je úplne
uzavretý alebo je roztrhnutý, nepoužite adaptér injekčnej liekovky.
Nevyberajte prstami adaptér injekčnej liekovky
z ochranného krytu.
D)

Otočte ochranný kryt a zatlačte adaptér na
Dinjekčnú liekovku. Neodstraňujte adaptér z
injekčnej liekovky, keď je už pripevnený.
E)
Jemne pritlačte ochranný kryt palcom a ukazovákom ako je znázornené. Odstráňte
ochranný kryt z adaptéra injekčnej liekovky.
 E
EF)

Pevne uchopte nástavec piesta za širší koniec
Fa ihneď ho pripojte k injekčnej striekačke
otáčaním v smere hodinových ručičiek vnútri naplnenej injekčnej striekačky, až kým
nepocítite odpor.
G)

Odstráňte kryt injekčnej striekačky z naplnenej
Ginjekčnej striekačky ohnutím dole, až kým sa
nezlomí perforácia. Nedotýkajte sa špičky injekčnej striekačky pod krytom injekčnej
striekačky.
H)

Naskrutkujte naplnenú injekčnú striekačku
Hbezpečne na adaptér, až kým nepocítite odpor.
I)

Držte naplnenú injekčnú striekačku s injekčnou
Iliekovkou naklonenou smerom dole. Tlačte
nástavec piesta, aby ste vstrekli všetko rozpúšťadlo do injekčnej liekovky.
J)

Držte nástavec piesta stlačený dole a jemne
Jkrúžte s injekčnou liekovkou, až sa rozpustí
všetok prášok. Netraste injekčnou liekovkou, lebo to môže spôsobiť spenenie.
Odporúča sa použiť NovoEight ihneď po rekonštitúcii. Podmienky uchovávania rekonštituovaného
lieku, pozri časť 6.3.
Ak je potrebná väčšia dávka, opakujte kroky A až J s ďalšími injekčnými liekovkami, adaptérmi
injekčnej liekovky a naplnenými injekčnými striekačkami.
Podanierekonštituovanéhoroztoku:
K)
Držte nástavec piesta stlačený na doraz. Otočte injekčnú striekačku s injekčnou liekovkou hore dnom. Prestaňte tlačiť nástavec piesta a nechajte ho pohnúť sa samovoľne naspäť, kým rekonštituovaný roztok naplní injekčnú striekačku. Ťahajte nástavec piesta jemne smerom dole, aby ste natiahli rekonštituovaný roztok do injekčnej striekačky.
V prípade, že potrebujete len časť z injekčnej liekovky, použite stupnicu na injekčnej striekačke, aby ste videli koľko rekonštituovaného roztoku ste odobrali, ako vám povedal lekár alebo zdravotná sestra.
Kým držíte injekčnú liekovku hore dnom, klepkajte jemne na injekčnú striekačku, aby všetky bubliny vystúpili nahor. Tlačte nástavec piesta pomaly, až kým všetky vzduchové bubliny nevytlačíte.
|
K
|
L)
Odskrutkujte adaptér s injekčnou liekovkou.
NovoEight je teraz pripravený na injekčné podanie. Vyberte si vhodné miesto a pomaly si podajte injekciu lieku NovoEight do žily počas 2-5 minút.
|
L
|
Likvidácia:


Po podaní injekcie, bezpečne zlikvidujte všetok nepoužitý roztok lieku NovoEight, injekčnú
striekačku s infúznou súpravou, injekčnú liekovku s adaptérom injekčnej liekovky, a ostatný odpadový materiál ako vám povedal lekárnik.
Nevyhadzujte ho s bežným domovým odpadom.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovo Nordisk A/S Novo Allé
DK-2880 Bagsværd
Dánsko
8. REGISTRAČNÉ ČÍSLA
EU/1/13/888/006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http//www.ema.europa.eu.