
u takýchto pacientov neodporúča.
Skúsenosti s pacientmi s neproliferatívnou diabetickou retinopatiou, závažným úrazom oka alebo uveitídou v anamnéze (vrátane aktívneho závažného zápalu) sú obmedzené. Pri liečbe takýchto pacientov sa má postupovať obozretne.
Iné
Možnosť subluxácie šošovky alebo fakodonézy sa nemôže vylúčiť. Ak sa vyskytne takáto udalosť, má sa liečiť podľa štandardnej lekárskej praxe. Pacienti majú byť náležite monitorovaní (pozri časť 4.8
a 5.3).
U pacientov s epiretinálnou membránou (ERM) alebo s priemerom VMA > 1500 mikrónov je účinok okriplazmínu (najmä vo vyvolaní odpuchnutia vitreomakulárnej adhézie alebo docielenia celkového odlúčenia zadnej plochy sklovca [posterior vitreous detachment, PVD]) znížený (pozri časť 5.1).
Vzhľadom na možné zvýšenie trakčnej sily existuje riziko výskytu nových alebo zväčšených dier makuly. Pacienti majú byť náležite monitorovaní (pozri časť 4.8).
Počas prvého týždňa po injekcii existuje riziko signifikantnej, ale prechodnej straty zrakovej ostrosti. Pacienti sa majú primerane sledovať (pozri časť 4.8).
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne formálne interakčné štúdie.
Okriplazmín je proteolytický enzým s aktivitou serínovej proteázy, ktorý môže byť prítomný v oku po dobu niekoľkých dní po podaní intravitreálnej injekcie (pozri časť 5.2). Podávanie s inými liekmi do rovnakého oka s krátkym časovým odstupom môže ovplyvniť aktivitu oboch liekov, a preto sa neodporúča.
Nie sú k dispozícii žiadne klinické údaje o súbežnom použití okriplazmínu s inhibítormi VEGF (vaskulárny endoteliálny rastový faktor).
Nepredpokladajú sa žiadne systémové interakcie.
4.6 Fertilita, gravidita a laktácia
Gravidita

Neexistujú žiadne údaje o použití lieku JETREA u gravidných žien. Neuskutočnili sa žiadne štúdie reprodukčnej toxikológie. Po podaní intravitreálnej injekcie sa predpokladá veľmi nízka systémová expozícia lieku JETREA. JETREA sa má použiť počas tehotenstva iba vtedy, ak klinický prínos preváži potenciálne riziká.
LaktáciaNie je známe, či sa JETREA vylučuje do ľudského materského mlieka. JETREA sa má použiť počas dojčenia iba vtedy, ak klinický prínos preváži potenciálne riziká.
FertilitaNeexistujú žiadne údaje o účinkoch lieku JETREA na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojePo podaní intravitreálnej injekcie lieku JETREA sa môžu vyskytnúť prechodné poruchy zraku (pozri časť 4.8). V takýchto prípadoch pacienti nemajú viesť vozidlá ani obsluhovať stroje, až kým neustúpia poruchy zraku.
4.8 Nežiaduce účinkySúhrnbezpečnostnéhoprofiluIntravitreálnou injekciou lieku JETREA sa liečilo viac ako 800 pacientov v klinických štúdiách,
pričom viac ako 570 pacientov sa liečilo odporúčanou dávkou 0,125 mg.
Všetky nežiaduce reakcie boli očné. Medzi najčastejšie hlásené patrili zákaly sklovca, bolesť očí
a fotopsia, ako aj krvácanie spojiviek v dôsledku podania injekcie. Väčšina nežiaducich reakcií sa vyskytovala počas prvého týždňa po podaní injekcie. Väčšina z týchto reakcií mala nezávažnú povahu, miernu intenzitu a ustúpila do 2 až 3 týždňov.
Miera výskytu závažných nežiaducich reakcií, ktoré sa vyskytli vo všetkých klinických štúdiách,
bola 2,2 % u pacientov liečených liekom JETREA a 2,4 % u pacientov v kontrolnej skupine.
TabuľkovýzoznamnežiaducichreakciíNasledujúca tabuľka obsahuje súhrn nežiaducich reakcií, ktoré sa vyskytli v klinických štúdiách
s primeranou možnosťou kauzality na podanie injekcie alebo liek JETREA.
Nežiaduce reakcie sú uvedené podľa triedy orgánových systémov MedDRA a frekvencie výskytu s
použitím nasledujúcej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté
(≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme
(nemožno určiť z dostupných údajov). V rámci každej skupiny frekvencie výskytu sú nežiaduce
reakcie uvedené v zostupnom poradí podľa závažnosti.
Poruchy oka Veľmi časté
Zákaly sklovca, bolesť očí, krvácanie spojiviek
Časté
Znížená zraková ostrosť*, zhoršenie zraku, rozmazané videnie, krvácanie sietnice,
krvácanie do sklovca, trhlina v sietnici*, odlupovanie sietnice*, zvýšený vnútroočný tlak, diera makuly*, makulárna degenerácia, degenerácia sietnice,
makulárny edém, edém sietnice, epitelopatia pigmentu sietnice, metamorfopsia, adhézia sklovca*, edém spojiviek, edém očného viečka, vitritída, bunky v prednej očnej komore, odlesk v prednej komore, iritída, fotopsia, hyperémia spojiviek, očná hyperémia, odlupovanie sklovca, abnormálny retinogram*, podráždenie oka, suché oko, pocit cudzieho telieska v oku, svrbenie oka, nepríjemný pocit v oku, fotofóbia, chromatopsia*
Menej časté

Prechodná slepota, subluxácia šošovky*, skotóm, porucha zorného poľa, diplópia, hyféma, mióza, nerovnaké zreničky, abrázia rohovky, zápal prednej očnej
komory, zápal oka, podráždenie spojiviek
* pozri časť “Popis vybraných nežiaducich reakcií“
Popisvybranýchnežiaducich reakciíZnížená zraková ostrosťV placebom kontrolovaných pivotných štúdiách fázy III malo 7,7 % pacientov liečených liekom JETREA a 1,6 % pacientov, ktorí dostávali placebo, akútnu prechodnú ≥ 2-riadkovú (≥ 10 písmen ETDRS) stratu najlepšie korigovanej zrakovej ostrosti (BCVA) v priebehu prvého týždňa po injekcii bez iného vysvetlenia pre zmenu. Zhoršenie zrakovej ostrosti bolo všeobecne zvratné do 2 týždňov bez akéhokoľvek zásahu. Odporúčania pre sledovanie, pozri časť 4.4.
ChromatopsiaU pacientov, ktorým bol injekčne podaný liek JETREA, bola hlásená dyschromatopsia (vo všeobecnosti sa popisuje ako videnie so žltkastým nádychom) ako častá nežiaduca reakcia. Väčšina udalostí bola nezávažná, mierna a zvyčajne sa vyriešili spontánne. Medián času do vyriešenia bol
3 mesiace.
Abnormálny retinogramU pacientov, ktorým sa injekčne podal liek JETREA, boli hlásené zmeny na elektroretinografe (ERG) (pokles amplitúd vĺn a aj b) ako častá nežiaduca reakcia; vo väčšine prípadov bola hlásená aj
dyschromatopsia. U približne polovice prípadov sa zmeny ERG vyriešili v čase poslednej kontroly. Medián času do vyriešenia bol 6 mesiacov. Zmeny ERG nenaznačovali prognózu negatívnych
výsledkov v zmysle zrakovej ostrosti.
Porušenia sietnice (trhliny a odlupovanie)V placebom kontrolovaných kľúčových štúdiách fázy III boli porušenia sietnice (trhliny
a odlupovanie) hlásené u 1,9 % pacientov, ktorým bol injekčne podaný liek JETREA, v porovnaní so
4,3 % pacientov, ktorým bolo injekčne podané placebo. Väčšina z týchto udalostí sa vyskytla v oboch
skupinách počas vitrektómie alebo po nej. Miera výskytu odlupovaní sietnice pred vitrektómiou bola
v skupine s liekom JETREA na úrovni 0,4 % a v skupine s placebom nebola žiadna, kým výskyt trhlín
sietnice (bez odlupovania) pred vitrektómiou bol v skupine s liekom JETREA na úrovni 0,2 %
a v skupine s placebom 0,5 %.
Diera makulyV placebom kontrolovaných pivotných štúdiách fázy III boli hlásené prípady vzniku novej diery makuly alebo zhoršenia diery makuly u 6,7 % zo všetkých pacientov, ktorým bol injekčne podaný liek JETREA, v porovnaní so 9,6 % pacientov, ktorým bolo injekčne podané placebo. Aj keď v placebom kontrolovaných pivotných štúdiách fázy III preukázal liek JETREA prínos pri vyvolaní uzavretia dier makuly, ktoré bolo spojené s vitreomakulárnou trakciou, v niektorých prípadoch sa pozorovala
zvýšená trakcia s následnou progresiou alebo vznikom novej diery makuly. Vývoj týchto udalostí je súčasťou prirodzeného priebehu ochorenia; avšak príspevok okriplazmínu sa v niektorých prípadoch javí ako pravdepodobný na základe jeho mechanizmu účinku.
Adhézie sklovcaV placebom kontrolovaných pivotných štúdiách fázy III boli hlásené prípady zhoršenia vitreomakulárnej adhézie/vitreomakulárnej trakcie u 1,5 % zo všetkých pacientov, ktorým bol injekčne podaný liek JETREA, v porovnaní s 1,1 % pacientov, ktorým bolo injekčne podané placebo. Vývoj týchto udalostí je súčasťou prirodzeného priebehu ochorenia; avšak príspevok okriplazmínu sa v niektorých prípadoch javí ako pravdepodobný na základe jeho mechanizmu účinku.
Subluxácia šošovky/fakodonézaV klinických štúdiách u dospelých bol hlásený jeden prípad subluxácie šošovky/fakodonézy a zdá sa,
že pravdepodobne súvisí s liečbou liekom JETREA. V pediatrickej štúdii vyhodnocujúcej liek JETREA ako doplnkovú liečbu k vitrektómii bol hlásený jeden prípad subluxácie u predčasne narodeného dieťaťa, ktoré dostalo jednorazovú intravitreálnu injekčnú dávku 0,175 mg lieku JETREA.
Subluxácia šošovky bola pozorovaná u 3 živočíšnych druhov pri koncentráciách okriplazmínu nad
stanovenou klinickou koncentráciou (pozri časť 5.3).
Na základe proteolytickej aktivity okriplazmínu z predklinických a klinických nálezov sa nedá vylúčiť možnosť subluxácie šošovky alebo fakodonézy. Ak sa vyskytne takýto prípad, musí sa liečiť v súlade so štandardnou lekárskou praxou.
Odporúčania týkajúce sa sledovania, pozri časť 4.4. Vo všetkých vyššie uvedených situáciách sa odporúča pravidelné sledovanie.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieKlinické údaje o účinkoch predávkovania liekom JETREA sú obmedzené. Hlásený bol jeden prípad náhodného predávkovania 0,250 mg okriplazmínu (dvojnásobok odporúčanej dávky). Pacient mal zníženú BCVA o 21 písmen ETDRS od základnej hodnoty, ktorá sa na konci štúdie vrátila na
9 písmen od základnej hodnoty. U pacienta sa tiež rozvinuli mierna hyperémia spojiviek, zápal oka
a mióza, ktoré sa vyliečili pomocou kortikosteroidových očných kvapiek.
V prípade predávkovania sa odporúča dôkladné sledovanie. V prípade výskytu nežiaducej reakcie sa
postupuje v súlade so štandardnou lekárskou praxou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Oftalmologiká, Iné oftalmologiká, ATC kód: S01XA22.
SpôsobúčinkuOkriplazmín vykazuje proteolytickú aktivitu voči proteínovým zložkám tela sklovca
a vitreoretinálnemu rozhraniu (VRI) (napr. laminín, fibronektín a kolagén) a snaží sa rozpustiť
proteínovú matricu, ktorá je zodpovedná za abnormálnu vitreomakulárnu adhéziu (VMA). Tesná väzba proteínových zložiek v rámci makulárnej oblasti VRI prispieva k vitreomakulárnej trakcii (VMT), čo vedie k zhoršeniu zraku alebo k vytvoreniu dier makuly.
KlinickáúčinnosťabezpečnosťÚčinnosť lieku JETREA bola preukázaná v 2 multicentrických, randomizovaných, dvojito maskovaných, placebom kontrolovaných 6-mesačných štúdiách u pacientov s VMT. Spolu bolo randomizovaných do týchto dvoch štúdií (TG-MV-006 a TG-MV-007) 652 pacientov (JETREA 464, placebo 188).
V oboch kľúčových štúdiách bol podiel pacientov, u ktorých sa dosiahlo zlepšenie VMA na 28. deň
(primárny ukazovateľ), výrazne (p ≤ 0,003) vyšší v skupine s liekom JETREA než v skupine
s placebom. Rozdiel bol naďalej štatisticky významný v 6. mesiaci v každej štúdii (p ≤ 0,024). V integrovaných údajoch sa dosiahlo vyliečenie VMA na 28. deň u 26,5 % pacientov v skupine
s liekom JETREA v porovnaní s 10,1 % pacientov v skupine s placebom (p < 0,001). Rozdiel sa
zachoval od 7. dňa až do 6. mesiaca
(obrázok 1).
O
b
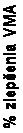
20%
KombinovanáJETREA
10%
5%
0%
7 14 28 90 180Počet dní po podaní injekcieTG-MV-007PlaceboKombinovanéPlacebo

|
rázok 1: Podiel pacientov so zlepšením VMA do 180. dňa (6. mesiac) (TG-MV-006, TG-MV-007 a integrované údaje)
|
|
Počas všetkých dní po injekcii: p ≤ 0,024 v TG-MV-006, p ≤ 0,009 v TG-MV-007,
p < 0,001 v integrovaných údajoch
U pacientov, ktorí vo východiskovom stave nemali ERM, bolo dosiahnutie zlepšenia VMA na 28. deň pravdepodobnejšie v porovnaní s pacientmi, ktorí mali vo východiskovom stave ERM.
V integrovaných údajoch bola rýchlosť zlepšenia VMA na 28. deň vyššia u pacientov liečených
liekom JETREA v porovnaní s placebom v oboch podskupinách bez ERM (37,4 % v porovnaní so
14,3 %, p < 0,001) aj s ERM (8,7 % v porovnaní s 1,5 %, p = 0,046).
U pacientov, ktorí mali vo východiskovom stave menší priemer VMA (≤ 1 500 mikrónov) bolo
dosiahnutie zlepšenia VMA na 28. deň pravdepodobnejšie v porovnaní s pacientmi, ktorí mali priemer
> 1 500 mikrónov. V integrovaných údajoch bola rýchlosť zlepšenia VMA na 28. deň vyššia u pacientov liečených liekom JETREA v porovnaní s placebom v oboch podskupinách vo východiskovom stave s VMA ≤ 1 500 mikrónov (34,7 % v porovnaní so 14,6 %, p < 0,001) aj vo východiskovom stave s VMA > 1 500 mikrónov (5,9 % v porovnaní s 0 %, p = 0,113)
V integrovaných údajoch malo pred liečbou dieru makuly plnej hrúbky sietnice (FTMH) 106 (22,8 %) pacientov v skupine s liekom JETREA a 47 (25 %) pacientov s placebom. Z týchto bol podiel pacientov, ktorí dosiahli zacelenie FTMH bez vitrektómie na 28. deň, vyšší v skupine s liekom JETREA než v skupine s placebom (40,6 % v porovnaní s 10,6 %, v uvedenom poradí; p < 0,001). Rozdiel sa zachoval až do konca štúdií (6. mesiac).
Výrazne vyšší percentuálny podiel pacientov liečených liekom JETREA dosiahol celkové PVD na 28. deň v porovnaní s pacientmi liečenými placebom (integrované údaje: 13,4 % v porovnaní s 3,7 %,
v uvedenom poradí; p < 0,001).
Počas štúdií sa môže vykonať vitrektómia podľa uváženia skúšajúceho lekára. U pacientov liečených liekom JETREA bola menšia pravdepodobnosť vitrektómie na konci štúdie (6. mesiac) v porovnaní
s pacientmi liečenými placebom (integrované údaje: 17,7 % v porovnaní s 26,6 %, v uvedenom poradí; p = 0,016).
Vyšší podiel pacientov liečených liekom JETREA dosiahol zlepšenie BCVA o ≥ 2 alebo ≥ 3 riadky
(bez ohľadu na vitrektómiu) v 6. mesiaci (28,0 % a 12,3 %, v uvedenom poradí) v porovnaní
s pacientmi liečenými placebom (17,1 % a 6,4 %) (p = 0,003 a p = 0,024, v uvedenom poradí). Okrem toho podiel pacientov dosiahol zlepšenie BCVA o ≥ 2 alebo ≥ 3 riadky bez vitrektómie v prospech lieku JETREA v 6. mesiaci (23,7 % v porovnaní s 11,2 %, p < 0,001 pre dosiahnutie zlepšenia
o ≥ 2 riadky a 9,7 % v porovnaní s 3,7 %, p = 0,008 pre dosiahnutie zlepšenia o ≥ 3 riadky).
Integrovaná analýza dotazníka č. 25 o zrakových funkciách (VFQ-25) podľa Národného oftalmologického inštitútu National Eye Institute preukázala numerický prospech lieku JETREA
v porovnaní s placebom na každej podstupnici aj zlepšenia kombinovaného skóre. Rozdiel v prípade
zlepšenia skóre na podstupnici všeobecného hodnotenia zrakovej ostrosti bol štatisticky signifikantný
(6,1 JETREA v porovnaní s 2,1 v prípade placeba, p = 0,024).
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdii pre liek JETREA
vo všetkých vekových podskupinách detí a dospievajúcich pri liečbe vitreomakulárnej trakcie (VMT)
vrátane prípadov, kedy je spojená s dierou makuly s priemerom menším ako alebo rovným
400 mikrónov (pre informácie o použití u detí a dospievajúcich, pozri časť 4.2).
Bezpečnosť a účinnosť okriplazmínu u pediatrických pacientov s plánovanou vitrektómiou bola skúmaná v štúdií TG-MV-009. Jedna intravitreálna injekcia o dávke 0,175 mg (nad hranicou odporúčanej dávky), alebo placeba, bola injikovaná do stredu sklovca 24 očí u detí vo veku od 0 do 16 rokov, 30 až 60 minút pred plánovaným začiatkom vitrektómie. Hlavnými dôvodmi pre podstúpenie vitrektómie boli odlúpenie sietnice a retinopatia nedonosených detí. Liečba okriplazmínom nepreukázala vplyv na mieru odlúčenia zadnej plochy sklovca, stupeň skvapalnenia sklovca, mieru okamžitého pooperačného prichytenia sietnice, vývoj proliferatívnej vitreoretinopatie alebo stupeň retinopatie nedonosených detí. Bezpečnostné nálezy získané zo štúdie TG-MV-009 boli v súlade so známym bezpečnostným profilom lieku JETREA. Na základe výsledkov z danej štúdie sa neodporúča použitie lieku JETREA ako doplnok vitrektómie u detí na uľahčenie oddelenia a odstránenia sklovca.
Etnicita
V skupinách inej než bielej rasy sú skúsenosti obmedzené.
5.2 Farmakokinetické vlastnosti
Hladiny okriplazmínu v sklovci po intravitreálnom podaní rýchlo klesajú. V klinickej štúdii
u pacientov, u ktorých sa plánuje vykonať vitrektómia a ktorí dostali dávku 0,125 mg lieku JETREA
(čo zodpovedá teoretickej počiatočnej koncentrácii 29 µg/ml v sklovci), dosahovala stredná aktivita okriplazmínu 2–4 hodiny po podaní injekcie 9 % z teoretickej počiatočnej koncentrácie a po 7. dňoch bola pod dolnou kvantifikačnou úrovňou.
Z dôvodu malej podanej dávky (0,125 mg) sa po intravitreálnom injekčnom podaní neočakávajú detekovateľné hladiny okriplazmínu v systémovom obehu.
Ak sa okriplazmín podá intravenózne, prechádza do endogénnej dráhy proteínového katabolizmu, počas ktorej sa rýchlo deaktivuje prostredníctvom jeho interakcií s inhibítormi proteázy α2- antiplazmínom alebo α2-makroglobulínom. Neaktívny komplex okriplazmínu/ α2-antiplazmínu sa eliminuje z obehu s polčasom (t1/2) niekoľkých hodín.
Poškodenie obličiek
Neuskutočnili sa žiadne štúdie na preskúmanie farmakokinetických vlastností okriplazmínu
u pacientov s poškodením obličiek, keďže po intravitreálnom podaní sa predpokladá veľmi nízka
systémová expozícia.
Poškodenie pečene
Neuskutočnili sa žiadne štúdie na preskúmanie farmakokinetických vlastností okriplazmínu
u pacientov s poškodením pečene, keďže po intravitreálnom podaní sa predpokladá veľmi nízka
systémová expozícia.
5.3 Predklinické údaje o bezpečnosti
Intravitreálna toxicita okriplazmínu sa vyhodnocovala u králikov, opíc a malých ošípaných. Okriplazmín vyvolával vznik zápalovej reakcie a prechodných zmien ERG u králikov a opíc, zatiaľ čo u malých ošípaných sa nepozoroval žiadny zápal ani zmeny ERG. U králikov a opíc mal výskyt
bunkových infiltrátov sklovca tendenciu postupom času vymiznúť. U opíc po podaní 125 µg do jedného oka (koncentrácia 68 µg/ml v sklovci) sa ERG úplne obnovil do 55. dňa. Subluxácia šošovky sa pozorovala u 3 druhov pri koncentráciách okriplazmínu v sklovci na úrovni 41 µg/ml alebo vyššej, čo je koncentrácia nad plánovanou klinickou koncentráciou 29 µg/ml. Tento účinok sa zdá byť závislý od dávky a bol pozorovaný u všetkých zvierat, ktorým sa okriplazmín podal intravitreálne viac ako jeden raz. U králikov a opíc sa pozorovali patologické zmeny súvisiace s vnútroočným krvácaním. Zostáva nejasné, či toto krvácanie súvisí so samotným podaním injekcie alebo s podaním okriplazmínu. Po intravitreálnom podaní okriplazmínu sa nepozorovala žiadna systémová toxicita.
Systémová toxicita okriplazmínu sa vyhodnocovala u potkanov aj psov. Intravenózne podanie dávky
10 mg/kg bolo vo všeobecnosti dobre znášané u potkanov aj psov, bez ohľadu na to, či išlo
o jednorazovú dávku alebo opakovanú dávku.
Nie sú k dispozícii žiadne údaje o karcinogénnosti, mutagénnosti ani reprodukčnej a vývojovej toxicite.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol
Kyselina citrónová
Hydroxid sodný (NaOH) (na úpravu pH) Voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi okrem sterilného, rozpúšťadlom nepufrovaného injekčného roztoku chloridu sodného s koncentráciou 9 mg/ml (0,9 %) bez konzervačných látok.
6.3 Čas použiteľnosti
3 roky pri uchovávaní v mrazničke (-20 ˚C ±5 °C). Po rozmrazení
Liek sa má zriediť a použiť okamžite. Avšak chemická a fyzikálna stabilita neotvoreného lieku,
uchovávaného v pôvodnom obale na ochranu pred svetlom sa preukázala do 8 hodín, keď bol liek uchovávaný pri teplote neprevyšujúcej 25 °C. Injekčnú liekovku neuchovávajte v mrazničke, ak už
bola raz rozmrazená.
Po otvorení/zriedení
Z mikrobiologického hľadiska sa tento liek musí použiť okamžite po otvorení/zriedení.
Injekčná liekovka a nespotrebovaná časť zriedeného roztoku sa musia po jednorazovom použití zlikvidovať.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v mrazničke (-20 °C ± 5 °C).
Podmienky na uchovávanie po rozmrazení a otvorení/zriedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
0,2 ml roztoku v injekčnej liekovke (sklenená, typ I) uzavretej chlórbutylovou gumenou zátkou a oranžovým polypropylénovým odklápacím viečkom. Balenie obsahujúce 1 injekčnú liekovku.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Injekčné liekovky sú určené iba na jedno použitie.
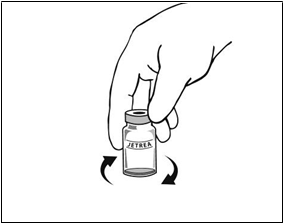
Pri príprave lieku JETREA na intravitreálnu injekciu postupujte podľa nasledujúcich pokynov:
1. Vyberte injekčnú liekovku z mrazničky a nechajte ju rozmraziť pri izbovej teplote (trvá to približne 2 minúty).
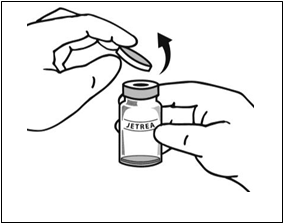
2. Po úplnom rozmrazení odstráňte z injekčnej liekovky oranžové polypropylénové odklápacie viečko.
JETREA 0,5 mg/0,2 ml
injekčný koncentrát
3. Vydezinfikujte vrchnú časť injekčnej liekovky pomocou
tampónu navlhčeného v alkohole.
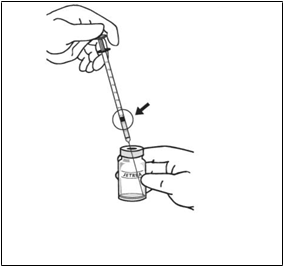
4. Pomocou aseptickej techniky vykonajte zriedenie pridaním 0,2 ml injekčného roztoku chloridu sodného s koncentráciou 9 mg/ml (0,9 %) (sterilný, bez
konzervačných látok, nepufrovaný) do injekčnej liekovky s liekom JETREA a jemným krúžením injekčnou liekovkou premiešajte roztoky. Riediaci roztok sa musí natiahnuť z neotvorenej nádoby, ktorá sa smie použiť len raz. Zvyšný injekčný roztok chloridu sodného
s koncentráciou 9 mg/ml (0,9 %) sa má zlikvidovať. Zriedený roztok sa má ihneď použiť.
JETREA 0,5 mg/0,2 ml
injekčný koncentrát
0,2 ml injekčného roztoku chloridu sodného s koncentráciou
9 mg/ml
JETREA 0,5 mg/0,2 ml
injekčný koncentrát
JETREA 0,5 mg/0,2 ml
injekčný koncentrát
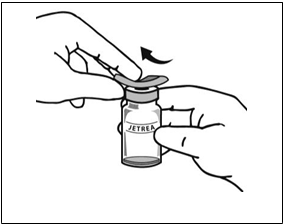
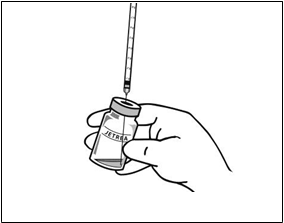
5. Vizuálne skontrolujte injekčnú liekovku, či neobsahuje pevné častice. Použiť sa má len číry, bezfarebný roztok bez viditeľných častíc.
6. Pomocou aseptickej techniky natiahnite všetok zriedený roztok cez vhodnú sterilnú ihlu (injekčnú liekovku mierne nakloňte, aby sa uľahčilo natiahnutie jej obsahu) a ihlu po natiahnutí obsahu injekčnej liekovky zlikvidujte. Túto
ihlu nepoužite na podanie intravitreálnej injekcie.
JETREA 0,5 mg/0,2 ml
injekčný koncentrát
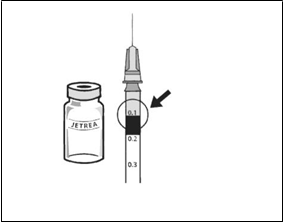
7. Ihlu vymeňte za vhodnú sterilnú ihlu, opatrne vytlačte
nadmerný objem z injekčnej striekačky pomalým stláčaním piestu tak, aby bol hrot piestu nastavený na
značku 0,1 ml na injekčnej striekačke (čo zodpovedá
0,125 mg okriplazmínu).
0,1 ml zriedeného lieku JETREA
JETREA 0,5 mg/0,2 ml
injekčný koncentrát
8. Ihneď vstreknite do stredu sklovca 0,1 ml zriedeného roztoku.
9. Injekčnú liekovku aj nespotrebovanú časť roztoku po jednorazovom použití zlikvidujte.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIThromboGenics NV Gaston Geenslaan 1
B-3001 Leuven
Belgicko
8. REGISTRAČNÉ ČÍSLO(A)EU/1/13/819/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 13. marec 2013
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.

Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUJETREA 0,375 mg/0,3 ml injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá injekčná liekovka obsahuje 0,375 mg okriplazmínu* v 0,3 ml roztoku
(1,25 mg/ml). To poskytuje použiteľné množstvo na jednu dávku 0,1 ml obsahujúcu 0,125 mg okriplazmínu.
*Okriplazmín je skrátená forma ľudského plazmínu vyrobená technológiou rekombinantnej DNA
v exprimačnom systéme
Pichia pastoris.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAInjekčný roztok (injekcia).
Číry a bezfarebný roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieJETREA je liek indikovaný u dospelých na liečbu vitreomakulárnej trakcie (VMT) vrátane prípadov, keď je spojená s dierou makuly s priemerom menším ako alebo rovným 400 mikrónov (pozri
časť 5.1).
4.2 Dávkovanie a spôsob podávaniaJETREA sa môže podávať iba kvalifikovaným očným lekárom, ktorý má skúsenosti s intravitreálnymi injekciami. Diagnóza vitreomakulárnej trakcie (VMT) má zahŕňať úplný klinický obraz vrátane anamnézy pacienta, klinického vyšetrenia a vyšetrenia pomocou v súčasnosti schválených diagnostických nástrojov, ako je optická koherentná tomografia (OKT).
DávkovanieJETREA 0,375 mg/0,3 ml injekčný roztok je pripravený na použitie a ďalšie riedenie nie je potrebné. Odporúčaná dávka je 0,125 mg v 0,1 ml roztoku, ktorá sa podáva prostredníctvom intravitreálnej injekcie do postihnutého oka jednorazovo ako jedna dávka. Každá injekčná liekovka sa má použiť iba raz a na liečbu iba jedného oka. Liečba liekom JETREA v druhom oku sa neodporúča súbežne alebo
v priebehu 7 dní od počiatočnej injekcie kvôli sledovaniu liečby po injekcii vrátane možného zhoršeného videnia okom, do ktorého sa podala injekcia. Opakované podávanie do rovnakého oka sa
neodporúča (pozri časť 4.4).
Pokyny na sledovanie po podaní injekcie, pozri časť 4.4.
O
sobitné skupiny pacientov
Poškodenie obličiek
U pacientov s poškodením obličiek sa nevykonali žiadne formálne štúdie s liekom JETREA.
U pacientov s poškodením obličiek sa nepredpokladá žiadna úprava dávky ani žiadne osobitné zváženia (pozri časť 5.2).
Poškodenie pečene
U pacientov s poškodením pečene sa nevykonali žiadne formálne štúdie s liekom JETREA.
U pacientov s poškodením pečene sa nepredpokladá žiadna úprava dávky ani žiadne osobitné úvahy
(pozri časť 5.2).
Staršie osoby
Staršie osoby sa skúmali v klinických štúdiách. Nie je potrebná žiadna úprava dávky.
Pediatrická populácia
Nepredpokladá sa význam pri použití lieku JETREA u detí mladších ako 18 rokov s vitreomakulárnou trakciou (VMT) vrátane prípadov, kedy je spojená s dierou makuly s priemerom menším ako alebo rovným 400 mikrónov. V súčasnosti dostupné údaje o použití u pediatrickej populácie sú opísané
v časti 5.1.
Spôsob podávania
Jednorazová injekčná liekovka iba na intravitreálne použitie.
Podľa uváženia ošetrujúceho očného lekára sa môžu podať predoperačné antibiotické kvapky.
Opatrenia pred zaobchádzaním alebo podaním lieku
Podanie intravitreálnej injekcie sa má vykonať v kontrolovaných aseptických podmienkach, čo zahŕňa použitie chirurgickej dezinfekcie rúk, sterilných rukavíc, sterilného rúška, sterilného rozvierača
očného viečka (alebo jeho ekvivalentu) a dostupnosť sterilnej paracentézy (ak sa vyžaduje). Pred podaním injekcie sa má dezinfikovať koža v okolí oka, očné viečko a povrch oka a má sa podať
náležitá anestézia a širokospektrálny lokálny mikrobicídny prostriedok v súlade so štandardnou
lekárskou praxou.
Podať sa má len 0,1 ml z celkového objemu 0,3 ml roztoku v injekčnej liekovke. Nadbytočný objem sa má pred podaním injekcie vytlačiť, aby bola podaná jedna dávka 0,1 ml obsahujúca 0,125 mg okriplazmínu. Informácie o zaobchádzaní s liekom, pozri časť 6.6.
Injekčná ihla sa má vpichnúť 3,5 – 4,0 mm posteriórne vzhľadom na limbus smerom k stredu dutiny sklovca tak, aby ste sa vyhli horizontálnemu meridiánu. Injekčný objem 0,1 ml sa potom vstrekne do stredu sklovca.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Aktívne alebo predpokladané očné alebo periokulárne infekcie.
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovanie po podaní injekcie
JETREA sa podáva iba prostredníctvom intravitreálnej injekcie. Intravitreálne injekcie sa používajú pri vnútroočnom zápale/infekcii, vnútroočnom krvácaní a zvýšenom vnútroočnom tlaku (IOP). Vždy
je nutné použiť vhodné aseptické techniky podania injekcie. Po podaní intravitreálnej injekcie treba
pacientov sledovať, či sa u nich nevyskytnú nejaké vedľajšie účinky, ako napríklad (okrem iného) vnútroočný zápal/infekcia a zvýšenie IOP. Do 60 minút po injekčnom podaní lieku JETREA sa pozorovali dočasné zvýšenia IOP vrátane prechodnej slepoty a nedostatočnej perfúzie zrakového nervu. Sledovanie zvýšení IOP môže pozostávať z kontroly perfúzie hlavy zrakového nervu hneď po podaní injekcie a tonometrie do 30 minút po podaní injekcie. Vnútroočný zápal/infekciu možno
vyhodnotiť pomocou biomikroskopie od 2 do 7 dní po podaní injekcie. Pacientov treba poučiť, aby okamžite hlásili príznaky naznačujúce vnútroočný zápal/infekciu alebo akékoľvek iné zrakové alebo očné príznaky. Ak sa vyskytnú ktorékoľvek z vyššie uvedených udalostí, pacienta treba liečiť v súlade so štandardnou lekárskou praxou.
Bilaterálnaliečba
Bezpečnosť a účinnosť lieku JETREA podaného do oboch očí naraz sa neskúmali. Preto sa podanie do oboch očí naraz neodporúča.
Opakované podávanie
Opakované podávanie lieku JETREA do toho istého oka nebolo dostatočne preskúmané, a preto sa
neodporúča.
Populáciasožiadnymialebos obmedzenými údajmi
Liek JETREA sa neskúmal u pacientov s dierami makuly s veľkým priemerom (> 400 mikrónov), s vysokou myopiou (sférická korekcia > 8 dioptrií alebo axiálna dĺžka > 28 mm), u pacientov bez
očnej šošovky (afakia), s regmatogénnym odlupovaním sietnice v anamnéze, s nestabilnou zonulou
šošovky, s nedávno vykonaným očným chirurgickým zákrokom alebo podaním vnútroočnej injekcie
(vrátane laserovej liečby), s proliferatívnou diabetickou retinopatiou, ischemickými retinopatiami, retinálnymi žilovými oklúziami, exsudatívnou vekom podmienenou degeneráciou makuly (AMD) a krvácaním do sklovca. Liečba sa u takýchto pacientov neodporúča.
Skúsenosti s pacientmi s neproliferatívnou diabetickou retinopatiou, závažným úrazom oka alebo uveitídou v anamnéze (vrátane aktívneho závažného zápalu) sú obmedzené. Pri liečbe takýchto pacientov sa má postupovať obozretne.
Iné
Možnosť subluxácie šošovky alebo fakodonézy sa nemôže vylúčiť. Ak sa vyskytne takáto udalosť, má sa liečiť podľa štandardnej lekárskej praxe. Pacienti majú byť náležite monitorovaní (pozri časť 4.8
a 5.3).
U pacientov s epiretinálnou membránou (ERM) alebo s priemerom VMA > 1500 mikrónov je účinok okriplazmínu (najmä vo vyvolaní odpuchnutia vitreomakulárnej adhézie alebo docielenia celkového odlúčenia zadnej plochy sklovca [posterior vitreous detachment, PVD]) znížený (pozri časť 5.1).
Vzhľadom na možné zvýšenie trakčnej sily existuje riziko výskytu nových alebo zväčšených dier
makuly. Pacienti majú byť náležite monitorovaní (pozri časť 4.8).
Počas prvého týždňa po injekcii existuje riziko signifikantnej, ale prechodnej straty zrakovej ostrosti. Pacienti sa majú primerane sledovať (pozri časť 4.8).
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne formálne interakčné štúdie.
Okriplazmín je proteolytický enzým s aktivitou serínovej proteázy, ktorý môže byť prítomný v oku po dobu niekoľkých dní po podaní intravitreálnej injekcie (pozri časť 5.2). Podávanie s inými liekmi do rovnakého oka s krátkym časovým odstupom môže ovplyvniť aktivitu oboch liekov, a preto sa neodporúča.
Nie sú k dispozícii žiadne klinické údaje o súbežnom používaní okriplazmínu s inhibítormi VEGF (vaskulárny endoteliálny rastový faktor).
Nepredpokladajú sa žiadne systémové interakcie.
4.6 Fertilita, gravidita a laktácia
 G
r
avidita
G
r
avidita
Neexistujú žiadne údaje o použití lieku JETREA u gravidných žien. Neuskutočnili sa žiadne štúdie reprodukčnej toxikológie. Po podaní intravitreálnej injekcie sa predpokladá veľmi nízka systémová
expozícia lieku JETREA. JETREA sa má použiť počas tehotenstva iba vtedy, ak klinický prínos
preváži potenciálne riziká.
LaktáciaNie je známe, či sa JETREA vylučuje do ľudského materského mlieka. JETREA sa má použiť počas dojčenia iba vtedy, ak klinický prínos preváži potenciálne riziká.
FertilitaNeexistujú žiadne údaje o účinkoch lieku JETREA na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojePo podaní intravitreálnej injekcie lieku JETREA sa môžu vyskytnúť prechodné poruchy zraku (pozri časť 4.8). V takýchto prípadoch pacienti nemajú viesť vozidlá ani obsluhovať stroje, až kým neustúpia poruchy zraku.
4.8 Nežiaduce účinkySúhrnbezpečnostnéhoprofiluIntravitreálnou injekciou lieku JETREA sa liečilo viac ako 800 pacientov v klinických štúdiách,
pričom viac ako 570 pacientov sa liečilo odporúčanou dávkou 0,125 mg.
Všetky nežiaduce reakcie boli očné. Medzi najčastejšie hlásené patrili zákaly sklovca, bolesť očí
a fotopsia, ako aj krvácanie spojiviek v dôsledku podania injekcie. Väčšina nežiaducich reakcií sa vyskytovala počas prvého týždňa po podaní injekcie. Väčšina z týchto reakcií mala nezávažnú povahu, miernu intenzitu a ustúpila do 2 až 3 týždňov.
Miera výskytu závažných nežiaducich reakcií, ktoré sa vyskytli vo všetkých klinických štúdiách,
bola 2,2 % u pacientov liečených liekom JETREA a 2,4 % u pacientov v kontrolnej skupine.
TabuľkovýzoznamnežiaducichreakciíNasledujúca tabuľka obsahuje súhrn nežiaducich reakcií, ktoré sa vyskytli v klinických štúdiách
s primeranou možnosťou kauzality na podanie injekcie alebo liek JETREA.
Nežiaduce reakcie sú uvedené podľa triedy orgánových systémov MedDRA a frekvencie výskytu s
použitím nasledujúcej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté
(≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (nemožno určiť z dostupných údajov). V rámci každej skupiny frekvencie výskytu sú nežiaduce reakcie uvedené v zostupnom poradí podľa závažnosti.
Poruchy oka Veľmi časté
Zákaly sklovca, bolesť očí, krvácanie spojiviek
Časté
Znížená zraková ostrosť*, zhoršenie zraku, rozmazané videnie, krvácanie sietnice,
krvácanie do sklovca, trhlina v sietnici*, odlupovanie sietnice*, zvýšený vnútroočný tlak, diera makuly*, makulárna degenerácia, degenerácia sietnice, makulárny edém, edém sietnice, epitelopatia pigmentu sietnice, metamorfopsia,
adhézia sklovca*, edém spojiviek, edém očného viečka, vitritída, bunky v prednej
očnej komore, odlesk v prednej komore, iritída, fotopsia, hyperémia spojiviek, očná hyperémia, odlupovanie sklovca, abnormálny retinogram*, podráždenie oka, suché oko, pocit cudzieho telieska v oku, svrbenie oka, nepríjemný pocit v oku, fotofóbia, chromatopsia*

Menej časté
Prechodná slepota, subluxácia šošovky*, skotóm, porucha zorného poľa, diplópia, hyféma, mióza, nerovnaké zreničky, abrázia rohovky, zápal prednej očnej
komory, zápal oka, podráždenie spojiviek
* pozri časť “Popis vybraných nežiaducich reakcií“
PopisvybranýchnežiaducichreakciíZnížená zraková ostrosťV placebom kontrolovaných pivotných štúdiách fázy III malo 7,7 % pacientov liečených liekom JETREA a 1,6 % pacientov, ktorí dostávali placebo, akútnu prechodnú ≥ 2-riadkovú (≥ 10 písmen ETDRS) stratu najlepšie korigovanej zrakovej ostrosti (BCVA) v priebehu prvého týždňa po injekcii bez iného vysvetlenia pre zmenu. Zhoršenie zrakovej ostrosti bolo všeobecne zvratné do 2 týždňov bez akéhokoľvek zásahu. Odporúčania pre sledovanie, pozri časť 4.4.
ChromatopsiaU pacientov, ktorým bol injekčne podaný liek JETREA, bola hlásená dyschromatopsia (vo
všeobecnosti sa popisuje ako videnie so žltkastým nádychom) ako častá nežiaduca reakcia. Väčšina
udalostí bola nezávažná, mierna a zvyčajne sa vyriešili spontánne. Medián času do vyriešenia bol
3 mesiace.
Abnormálny retinogramU pacientov, ktorým sa injekčne podal liek JETREA, boli hlásené zmeny na elektroretinografe (ERG) (pokles amplitúd vĺn a aj b) ako častá nežiaduca reakcia; vo väčšine prípadov bola hlásená aj dyschromatopsia. U približne polovice prípadov sa zmeny ERG vyriešili v čase poslednej kontroly. Medián času do vyriešenia bol 6 mesiacov. Zmeny ERG nenaznačovali prognózu negatívnych výsledkov v zmysle zrakovej ostrosti.
Porušenia sietnice (trhliny a odlupovanie)V placebom kontrolovaných kľúčových štúdiách fázy III boli porušenia sietnice (trhliny
a odlupovanie) hlásené u 1,9 % pacientov, ktorým bol injekčne podaný liek JETREA, v porovnaní so
4,3 % pacientov, ktorým bolo injekčne podané placebo. Väčšina z týchto udalostí sa vyskytla v oboch
skupinách počas vitrektómie alebo po nej. Miera výskytu odlupovaní sietnice pred vitrektómiou bola
v skupine s liekom JETREA na úrovni 0,4 % a v skupine s placebom nebola žiadna, kým výskyt trhlín'
sietnice (bez odlupovania) pred vitrektómiou bol v skupine s liekom JETREA na úrovni 0,2 %
a v skupine s placebom 0,5 %.
Diera makulyV placebom kontrolovaných pivotných štúdiách fázy III boli hlásené prípady vzniku novej diery makuly alebo zhoršenia diery makuly u 6,7 % zo všetkých pacientov, ktorým bol injekčne podaný liek
JETREA, v porovnaní so 9,6 % pacientov, ktorým bolo injekčne podané placebo. Aj keď v placebom
kontrolovaných pivotných štúdiách fázy III preukázal liek JETREA prínos pri vyvolaní uzavretia dier makuly, ktoré bolo spojené s vitreomakulárnou trakciou, v niektorých prípadoch sa pozorovala zvýšená trakcia s následnou progresiou alebo vznikom novej diery makuly. Vývoj týchto udalostí je súčasťou prirodzeného priebehu ochorenia; avšak príspevok okriplazmínu sa v niektorých prípadoch javí ako pravdepodobný na základe jeho mechanizmu účinku.
Adhézie sklovcaV placebom kontrolovaných pivotných štúdiách fázy III boli hlásené prípady zhoršenia
vitreomakulárnej adhézie/vitreomakulárnej trakcie u 1,5 % zo všetkých pacientov, ktorým bol injekčne podaný liek JETREA, v porovnaní s 1,1 % pacientov, ktorým bolo injekčne podané placebo. Vývoj týchto udalostí je súčasťou prirodzeného priebehu ochorenia; avšak príspevok okriplazmínu sa v niektorých prípadoch javí ako pravdepodobný na základe jeho mechanizmu účinku.
Subluxácia šošovky/fakodonézaV klinických štúdiách u dospelých bol hlásený jeden prípad subluxácie šošovky/fakodonézy a zdá sa,
že pravdepodobne súvisí s liečbou liekom JETREA. V pediatrickej štúdii vyhodnocujúcej liek
JETREA ako doplnkovú liečbu k vitrektómii bol hlásený jeden prípad subluxácie u predčasne narodeného dieťaťa, ktoré dostalo jednorazovú intravitreálnu injekčnú dávku 0,175 mg lieku JETREA. Subluxácia šošovky bola pozorovaná u 3 živočíšnych druhov pri koncentráciách okriplazmínu nad stanovenou klinickou koncentráciou (pozri časť 5.3).
Na základe proteolytickej aktivity okriplazmínu z predklinických a klinických nálezov sa nedá vylúčiť možnosť subluxácie šošovky alebo fakodonézy. Ak sa vyskytne takýto prípad, musí sa liečiť v súlade so štandardnou lekárskou praxou.
Odporúčania týkajúce sa sledovania, pozri časť 4.4. Vo všetkých vyššie uvedených situáciách sa odporúča pravidelné sledovanie.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieKlinické údaje o účinkoch predávkovania liekom JETREA sú obmedzené. Hlásený bol jeden prípad náhodného predávkovania 0,250 mg okriplazmínu (dvojnásobok odporúčanej dávky). Pacient mal zníženú BCVA o 21 písmen ETDRS od základnej hodnoty, ktorá sa na konci štúdie vrátila na
9 písmen od základnej hodnoty. U pacienta sa tiež rozvinuli mierna hyperémia spojiviek, zápal oka
a mióza, ktoré sa vyliečili pomocou kortikosteroidových očných kvapiek.
V prípade predávkovania sa odporúča dôkladné sledovanie. V prípade výskytu nežiaducej reakcie sa
postupuje v súlade so štandardnou lekárskou praxou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Oftalmologiká, Iné oftalmologiká, ATC kód: S01XA22.
SpôsobúčinkuOkriplazmín vykazuje proteolytickú aktivitu voči proteínovým zložkám tela sklovca
a vitreoretinálnemu rozhraniu (VRI) (napr. laminín, fibronektín a kolagén) a snaží sa rozpustiť
proteínovú matricu, ktorá je zodpovedná za abnormálnu vitreomakulárnu adhéziu (VMA). Tesná
väzba proteínových zložiek v rámci makulárnej oblasti VRI prispieva k vitreomakulárnej trakcii
(VMT), čo vedie k zhoršeniu zraku alebo k vytvoreniu dier makuly.
KlinickáúčinnosťabezpečnosťÚčinnosť lieku JETREA bola preukázaná v 2 multicentrických, randomizovaných, dvojito maskovaných, placebom kontrolovaných 6-mesačných štúdiách u pacientov s VMT. Spolu bolo
randomizovaných do týchto dvoch štúdií (TG-MV-006 a TG-MV-007) 652 pacientov (JETREA 464,
placebo 188).
V oboch kľúčových štúdiách bol podiel pacientov, u ktorých sa dosiahlo zlepšenie VMA na 28. deň
(primárny ukazovateľ), výrazne (p ≤ 0,003) vyšší v skupine s liekom JETREA než v skupine
s placebom. Rozdiel bol naďalej štatisticky významný v 6. mesiaci v každej štúdii (p ≤ 0,024). V integrovaných údajoch sa dosiahlo vyliečenie VMA na 28. deň u 26,5 % pacientov v skupine
s liekom JETREA v porovnaní s 10,1 % pacientov v skupine s placebom (p < 0,001). Rozdiel sa
zachoval od 7. dňa až do 6. mesiaca
(obrázok 1).
O
b
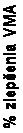
20%
KombinovanáJETREA
10%
5%
0%
7 14 28 90 180Počet dní po podaní injekcieTG-MV-007PlaceboKombinovanéPlacebo

|
rázok 1: Podiel pacientov so zlepšením VMA do 180. dňa (6. mesiac) (TG-MV-006, TG-MV-007 a integrované údaje)
|
|
Počas všetkých dní po injekcii: p ≤ 0,024 v TG-MV-006, p ≤ 0,009 v TG-MV-007,
p < 0,001 v integrovaných údajoch
U pacientov, ktorí vo východiskovom stave nemali ERM, bolo dosiahnutie zlepšenia VMA na 28. deň pravdepodobnejšie v porovnaní s pacientmi, ktorí mali vo východiskovom stave ERM.
V integrovaných údajoch bola rýchlosť zlepšenia VMA na 28. deň vyššia u pacientov liečených
liekom JETREA v porovnaní s placebom v oboch podskupinách bez ERM (37,4 % v porovnaní so
14,3 %, p < 0,001) aj s ERM (8,7 % v porovnaní s 1,5 %, p = 0,046).
U pacientov, ktorí mali vo východiskovom stave menší priemer VMA (≤ 1 500 mikrónov) bolo dosiahnutie zlepšenia VMA na 28. deň pravdepodobnejšie v porovnaní s pacientmi, ktorí mali priemer
> 1 500 mikrónov. V integrovaných údajoch bola rýchlosť zlepšenia VMA na 28. deň vyššia
u pacientov liečených liekom JETREA v porovnaní s placebom v oboch podskupinách vo východiskovom stave s VMA ≤ 1 500 mikrónov (34,7 % v porovnaní so 14,6 %, p < 0,001) aj
vo východiskovom stave s VMA > 1 500 mikrónov (5,9 % v porovnaní s 0 %, p = 0,113)
V integrovaných údajoch malo pred liečbou dieru makuly plnej hrúbky sietnice (FTMH) 106 (22,8 %) pacientov v skupine s liekom JETREA a 47 (25 %) pacientov s placebom. Z týchto bol podiel pacientov, ktorí dosiahli zacelenie FTMH bez vitrektómie na 28. deň, vyšší v skupine s liekom JETREA než v skupine s placebom (40,6 % v porovnaní s 10,6 %, v uvedenom poradí; p < 0,001). Rozdiel sa zachoval až do konca štúdií (6. mesiac).
Výrazne vyšší percentuálny podiel pacientov liečených liekom JETREA dosiahol celkové PVD na 28. deň v porovnaní s pacientmi liečenými placebom (integrované údaje: 13,4 % v porovnaní s 3,7 %,
v uvedenom poradí; p < 0,001).
Počas štúdií sa môže vykonať vitrektómia podľa uváženia skúšajúceho lekára. U pacientov liečených liekom JETREA bola menšia pravdepodobnosť vitrektómie na konci štúdie (6. mesiac) v porovnaní
s pacientmi liečenými placebom (integrované údaje: 17,7 % v porovnaní s 26,6 %, v uvedenom poradí; p = 0,016).
Vyšší podiel pacientov liečených liekom JETREA dosiahol zlepšenie BCVA o ≥ 2 alebo ≥ 3 riadky
(bez ohľadu na vitrektómiu) v 6. mesiaci (28,0 % a 12,3 %, v uvedenom poradí) v porovnaní
s pacientmi liečenými placebom (17,1 % a 6,4 %) (p = 0,003 a p = 0,024, v uvedenom poradí). Okrem toho podiel pacientov dosiahol zlepšenie BCVA o ≥ 2 alebo ≥ 3 riadky bez vitrektómie v prospech lieku JETREA v 6. mesiaci (23,7 % v porovnaní s 11,2 %, p < 0,001 pre dosiahnutie zlepšenia
o ≥ 2 riadky a 9,7 % v porovnaní s 3,7 %, p = 0,008 pre dosiahnutie zlepšenia o ≥ 3 riadky).
Integrovaná analýza dotazníka č. 25 o zrakových funkciách (VFQ-25) podľa Národného oftalmologického inštitútu National Eye Institute preukázala numerický prospech lieku JETREA
v porovnaní s placebom na každej podstupnici aj zlepšenia kombinovaného skóre. Rozdiel v prípade
zlepšenia skóre na podstupnici všeobecného hodnotenia zrakovej ostrosti bol štatisticky signifikantný
(6,1 JETREA v porovnaní s 2,1 v prípade placeba, p = 0,024).
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdii pre liek JETREA
vo všetkých vekových podskupinách detí a dospievajúcich pri liečbe vitreomakulárnej trakcie (VMT)
vrátane prípadov, kedy je spojená s dierou makuly s priemerom menším ako alebo rovným
400 mikrónov (pre informácie o použití u detí a dospievajúcich, pozri časť 4.2).
Bezpečnosť a účinnosť okriplazmínu u pediatrických pacientov s plánovanou vitrektómiou bola skúmaná v štúdií TG-MV-009. Jedna intravitreálna injekcia o dávke 0,175 mg (nad hranicou odporúčanej dávky), alebo placeba, bola injikovaná do stredu sklovca 24 očí u detí vo veku od 0 do 16 rokov, 30 až 60 minút pred plánovaným začiatkom vitrektómie. Hlavnými dôvodmi pre podstúpenie vitrektómie boli odlúpenie sietnice a retinopatia nedonosených detí. Liečba okriplazmínom nepreukázala vplyv na mieru odlúčenia zadnej plochy sklovca, stupeň skvapalnenia sklovca, mieru okamžitého pooperačného prichytenia sietnice, vývoj proliferatívnej vitreoretinopatie alebo stupeň retinopatie nedonosených detí. Bezpečnostné nálezy získané zo štúdie TG-MV-009 boli v súlade so známym bezpečnostným profilom lieku JETREA. Na základe výsledkov z danej štúdie sa neodporúča použitie lieku JETREA ako doplnok vitrektómie u detí na uľahčenie oddelenia a odstránenia sklovca.
Etnicita
V skupinách inej než bielej rasy sú skúsenosti obmedzené.
5.2 Farmakokinetické vlastnosti
Hladiny okriplazmínu v sklovci po intravitreálnom podaní rýchlo klesajú. V klinickej štúdii
u pacientov, u ktorých sa plánuje vykonať vitrektómia a ktorí dostali dávku 0,125 mg lieku JETREA
(čo zodpovedá teoretickej počiatočnej koncentrácii 29 µg/ml v sklovci), dosahovala stredná aktivita okriplazmínu 2–4 hodiny po podaní injekcie 9 % z teoretickej počiatočnej koncentrácie a po 7. dňoch bola pod dolnou kvantifikačnou úrovňou.
Z dôvodu malej podanej dávky (0,125 mg) sa po intravitreálnom injekčnom podaní neočakávajú detekovateľné hladiny okriplazmínu v systémovom obehu.
Ak sa okriplazmín podá intravenózne, prechádza do endogénnej dráhy proteínového katabolizmu, počas ktorej sa rýchlo deaktivuje prostredníctvom jeho interakcií s inhibítormi proteázy α2- antiplazmínom alebo α2-makroglobulínom. Neaktívny komplex okriplazmínu/ α2-antiplazmínu sa eliminuje z obehu s polčasom (t1/2) niekoľkých hodín.
Poškodenie obličiek
Neuskutočnili sa žiadne štúdie na preskúmanie farmakokinetických vlastností okriplazmínu
u pacientov s poškodením obličiek, keďže po intravitreálnom podaní sa predpokladá veľmi nízka
systémová expozícia.
Poškodenie pečene
Neuskutočnili sa žiadne štúdie na preskúmanie farmakokinetických vlastností okriplazmínu
u pacientov s poškodením pečene, keďže po intravitreálnom podaní sa predpokladá veľmi nízka
systémová expozícia.
5.3 Predklinické údaje o bezpečnosti
Intravitreálna toxicita okriplazmínu sa vyhodnocovala u králikov, opíc a malých ošípaných. Okriplazmín vyvolával vznik zápalovej reakcie a prechodných zmien ERG u králikov a opíc, zatiaľ čo u malých ošípaných sa nepozoroval žiadny zápal ani zmeny ERG. U králikov a opíc mal výskyt
bunkových infiltrátov sklovca tendenciu postupom času vymiznúť. U opíc po podaní 125 µg do jedného oka (koncentrácia 68 µg/ml v sklovci) sa ERG úplne obnovil do 55. dňa. Subluxácia šošovky sa pozorovala u 3 druhov pri koncentráciách okriplazmínu v sklovci na úrovni 41 µg/ml alebo vyššej, čo je koncentrácia nad plánovanou klinickou koncentráciou 29 µg/ml. Tento účinok sa zdá byť závislý od dávky a bol pozorovaný u všetkých zvierat, ktorým sa okriplazmín podal intravitreálne viac ako jeden raz. U králikov a opíc sa pozorovali patologické zmeny súvisiace s vnútroočným krvácaním. Zostáva nejasné, či toto krvácanie súvisí so samotným podaním injekcie alebo s podaním okriplazmínu. Po intravitreálnom podaní okriplazmínu sa nepozorovala žiadna systémová toxicita.
Systémová toxicita okriplazmínu sa vyhodnocovala u potkanov aj psov. Intravenózne podanie dávky
10 mg/kg bolo vo všeobecnosti dobre znášané u potkanov aj psov, bez ohľadu na to, či išlo
o jednorazovú dávku alebo opakovanú dávku.
Nie sú k dispozícii žiadne údaje o karcinogénnosti, mutagénnosti ani reprodukčnej a vývojovej toxicite.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Chlorid sodný (NaCl) Manitol
Kyselina citrónová
Hydroxid sodný (NaOH) (na úpravu pH) Kyselina chlorovodíková (HCl) (na úpravu pH)
Voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky pri uchovávaní v mrazničke (-20 ˚C ±5 °C). Po rozmrazení
Neotvorená injekčná liekovka v pôvodnom obale na ochranu pred svetlom sa môže uchovávať
v chladničke (2 °C až 8 °C) až 1 týždeň. Je potrebné vypočítať nový dátum exspirácie pri použití,
ktorý má byť zaznamenaný na obale pred umiestnením do chladničky.
Keď je liek vybraný z mrazničky alebo chladničky, môže sa uchovávať pri teplote neprevyšujúcej 25
°C až 8 hodín. Na konci tohto obdobia sa liek musí použiť alebo zlikvidovať. Injekčnú liekovku neuchovávajte v mrazničke, ak už bola raz rozmrazená.
Po otvorení
Z mikrobiologického hľadiska sa tento liek musí použiť okamžite po otvorení.
Injekčná liekovka a nespotrebovaná časť roztoku sa musia po jednorazovom použití zlikvidovať.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v mrazničke (-20 °C ± 5 °C).
Podmienky na uchovávanie po rozmrazení/otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
0,3 ml roztoku v injekčnej liekovke (sklenená, typ I) uzavretej chlórbutylovou gumenou zátkou a modrým polypropylénovým odklápacím viečkom. Balenie obsahujúce 1 injekčnú liekovku.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomInjekčné liekovky sú určené iba na jedno použitie.
JETREA 0,375 mg/0,3 ml injekčný roztok je pripravený na použitie a ďalšie riedenie nie je potrebné. Podať sa má len 0,1 ml z celkového objemu 0,3 ml roztoku v injekčnej liekovke. Nadbytočný objem sa má pred podaním injekcie vytlačiť, aby bola podaná jedna dávka 0,1 ml obsahujúca 0,125 mg okriplazmínu.
Pokyny na použitie1. Vyberte injekčnú liekovku z mrazničky a nechajte ju rozmraziť pri izbovej teplote (trvá to
približne 2 minúty).
2. Po úplnom rozmrazení odstráňte z injekčnej liekovky
modré polypropylénové odklápacie viečko.
JETREA 0,375 mg/0,3 ml injekčný roztok
3. Vydezinfikujte vrchnú časť injekčnej liekovky pomocou
tampónu navlhčeného v alkohole.
JETREA 0,375 mg/0,3 ml injekčný roztok

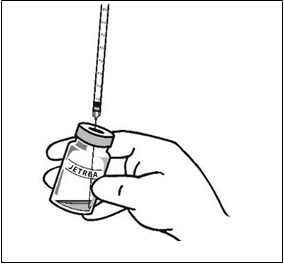


4. Vizuálne skontrolujte injekčnú liekovku, či neobsahuje pevné častice. Použiť sa má len číry,
bezfarebný roztok bez viditeľných častíc.
5. Pomocou aseptickej techniky natiahnite všetok zriedený
roztok cez vhodnú sterilnú ihlu (injekčnú liekovku mierne nakloňte, aby sa uľahčilo natiahnutie jej obsahu) a ihlu po
natiahnutí obsahu injekčnej liekovky zlikvidujte. Túto ihlu nepoužite na podanie intravitreálnej injekcie.
JETREA 0,375 mg/0,3 ml injekčný roztok
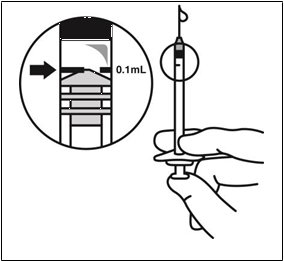
6. Ihlu vymeňte za vhodnú sterilnú ihlu, opatrne vytlačte nadmerný objem z injekčnej striekačky pomalým stláčaním piestu tak, aby hrot piestu bol nastavený na značku 0,1 ml na injekčnej striekačke (čo zodpovedá
0,125 mg okriplazmínu).
JETREA 0,375 mg/0,3 ml injekčný roztok
7. Ihneď vstreknite do stredu sklovca 0,1 ml roztoku.
8. Injekčnú liekovku aj nespotrebovanú časť roztoku po jednorazovom použití zlikvidujte.
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIThromboGenics NV Gaston Geenslaan 1
B-3001 Leuven
Belgicko
8. REGISTRAČNÉ ČÍSLO(A)EU/1/13/819/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
vom použití zlikvidovať.