
viac ako 1 mg za týždeň. Dávka sa má upravovať individuálne podľa toho, ako pacient na liečbu reaguje a ako ju znáša.
Podľa odpovedi pacienta na liečbu a znášanlivosti Intunivu sa odporúča udržiavacia dávka v rozmedzí
0,05-0,12 mg/kg/deň. Spôsob titrácie dávky u detí a dospievajúcich je uvedený nižšie (pozri tabuľku
1 a 2). Úprava dávky (zvýšenie alebo zníženie) na maximálne tolerovanú dávku v optimálnom
odporúčanom rozmedzí, prispôsobená hmotnosti na základe klinického zhodnotenia odpovede a znášanlivosti, sa môže uskutočniť v týždňovom intervale po začiatočnej dávke.
Monitorovanie počas titrácie
Počas titrácie dávky je u pacientov potrebné každý týždeň sledovať príznaky a symptómy somnolencie a sedácie, hypotenzie a bradykardie.
Priebežné sledovanie
Počas prvého roku liečby majú byť u pacienta aspoň každé 3 mesiace hodnotené:
• Príznaky a symptómy:
o somnolencie a sedácie
o hypotenzie
o bradykardie
• prírastok hmotnosti/riziko obezity
Počas tohto obdobia sa odporúča aj klinické hodnotenie. Potom má nasledovať sledovanie každých
6 mesiacov s častejším sledovaním pri akejkoľvek úprave dávky (pozri časť 4.4).
Tabuľka 1Plán titrácie dávky u detí vo veku 6-12 rokov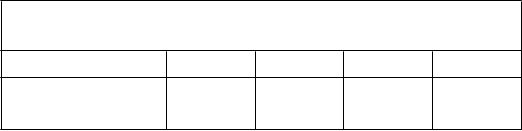
Hmotnostná skupina Týždeň 1 Týždeň 2 Týždeň 3 Týždeň 4
25 kg a viac
Max. dávka = 4 mg
Tabuľka 2
1 mg 2 mg 3 mg 4 mg
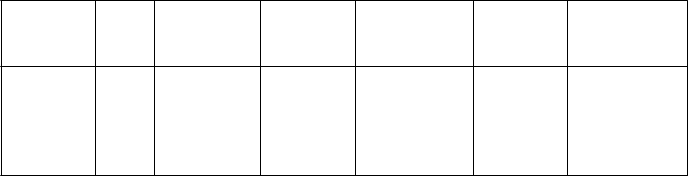
P
lán titrácie dávky u dospievajúcich (vo veku 13-17 rokov)
Hmotnostná skupinaa Týždeň 1 Týždeň 2 Týždeň 3 Týždeň 4 Týždeň 5 Týždeň 6 Týždeň 7
34-41,4 kg
Max. dávka = 4 mg
1 mg 2 mg 3 mg 4 mg
41,5-49,4 kg
Max. dávka = 5 mg
1 mg 2 mg 3 mg 4 mg 5 mg
49,5-58,4 kg
Max. dávka = 6 mg
1 mg 2 mg 3 mg 4 mg 5 mg 6 mg
58,5 kg a viac
Max. dávka = 7 mg
1 mg 2 mg 3 mg 4 mg 5 mg 6 mg 7 mgb

a Dospievajúci pacienti musia mať hmotnosť aspoň 34 kg.
b U dospievajúcich s hmotnosťou 58,5 kg a viac sa môže dávka titrovať až do 7 mg/deň po ukončení minimálne 1 ýždňa liečby s dávkou
6 mg/deň a po tom, čo lekár dôkladne preskúmal znášanlivosť a účinnosť u pacienta.
Lekár, ktorý sa rozhodne používať guanfacín dlhšie obdobie (viac ako 12 mesiacov), má priebežne
prehodnocovať prínos liečby guanfacínom každé 3 mesiace počas prvého roka a potom aspoň jedenkrát ročne na základe klinického hodnotenia (pozri časť 4.4), a zvážiť skúšobné obdobia bez liečby za účelom zhodnotenia funkčného stavu pacienta bez farmakoterapie, najlepšie v období školských prázdnin.
Znižovanie dávky a ukončenie liečbyPacientov/opatrovateľov je potrebné upozorniť, že liečba guanfacínom sa nemá ukončiť bez
konzultácie s lekárom.
Po vysadení guanfacínu sa môže zvýšiť tlak krvi a pulz. Po vysadení Intunivu sa pozorovalo priemerné zvýšenie systolického a diastolického tlaku o približne 3 mmHg a 1 mmHg, v uvedenom poradí, oproti počiatočnému tlaku.
U jednotlivcov môže dôjsť k väčšiemu nárastu hodnôt ako ukazujú priemerné zmeny. Preto sa odporúča, aby sa tlak krvi a pulz sledovali u všetkých pacientov počas znižovania dávky (s úbytkom nie viac ako 1 mg každých 3 až 7 dní) a naďalej po ukončení liečby guanfacínom
Aby sa minimalizovali prípadné nežiaduce účinky z vysadenia, odporúča sa počas vysadzovania
postupné znižovanie dávkovania Intunivu.
V
ynechanie dávky
V prípade vynechania dávky sa môže obnoviť užívanie Intunivu ďalší deň. Ak dôjde k vynechaniu dvoch alebo viacerých po sebe nasledujúcich dávok, odporúča sa opätovná titrácia dávky podľa toho, ako pacient guanfacín znášal.
Prechod z iných foriem guanfacínu
Tablety guanfacínu s okamžitým uvolňovaním sa nemajú nahrádzať na princípe mg/mg, pretože majú
rozdielne farmakokinetické profily.
Osobitné skupiny pacientov
Dospelí a starší pacienti
Bezpečnosť a účinnosť guanfacínu u dospelých a starších pacientov s ADHD nebola stanovená a preto sa guanfacín v tejto skupine pacientov nemá používať.
Porucha funkcie pečene
Gaunfacín sa vylučuje pečeňou aj obličkami, pečeňou sa uskutočňuje najmenej 50 % klírensu guanfacínu. U pacientov s rôznymi stupňami poruchy funkcie pečene môže byť potrebné zníženie
dávky.
Vplyv poruchy funkcie pečene na farmakokinetiku guanfacínu nebol u pediatrických pacientov (deti a dospievajúci vo veku 6-17 rokov) stanovený.
Porucha funkcie obličiek
Gaunfacín sa vylučuje pečeňou aj obličkami, pričom približne 30 % nezmeneného lieku sa vylučuje močom. U pacientov s ťažkou poruchou funkcie obličiek (GFR 29-15 ml/min) a v terminálnom štádiu ochorenia obličiek (GFR<15 ml/min alebo potreba dialýzy) môže byť požadované zníženie dávky. Vplyv poruchy funkcie obličiek na farmakokinetiku guanfacínu sa u pediatrických pacientov (deti
a dospievajúci vo veku 6-17 rokov) nestanovil.
Deti mladšie ako 6 rokov
Intuniv sa nemá používať u detí mladších ako 6 rokov, pretože účinnosť a bezpečnosť sa v tejto populácii pacientov neskúmali.
Pacienti liečení inhibítormi/induktormi CYP3A4 a CYP3A5
Inhibítory CYP3A4/5 preukázali významný vplyv na farmakokinetiku guanfacínu, ak sa podávajú súbežne. Pri súbežnom použití stredne silných/silných inhibítorov CYP3A4/5 (napr. ketokonazol,
grapefruitová šťava) alebo silných induktorov CYP3A4 (napr. karbamazepín), sa odporúča úprava
dávky (pozri časť 4.5). V prípade súbežného použitia silných alebo stredne silných inhibítorov CYP3A sa odporúča 50% redukcia dávky guanfacínu. V dôsledku variability interakčného účinku môže byť potrebná ďalšia titrácia dávky (pozri vyššie). Ak sa guanfacín kombinuje so silnými induktormi enzýmov, môže sa v prípade potreby zvážiť retitrácia dávky až na maximálnu dennú dávku 7 mg
(pozri časť 4.2). Po ukončení indukčnej liečby sa počas nasledujúcich týždňov odporúča retitrácia na zníženie dávky guanfacínu (pozri časť 4.5).
Spôsob podávania
Perorálne použitie.
Intuniv sa užíva jedenkrát denne buď ráno alebo večer. Intuniv sa nemá drviť, žuť alebo deliť pred prehltnutím, pretože sa tým zvyšuje rýchlosť uvoľňovania guanfacínu
Liečba sa odporúča len u detí, ktoré sú bez problémov schopné prehltnúť celú tabletu.
Intuniv sa môže podávať s jedlom alebo bez jedla, ale nemá sa podávať s veľmi mastnými jedlami, vzhľadom k zvýšenej expozícii (pozri časť 5.2).
Intuniv sa nemá podávať spolu s grapefruitovou šťavou (pozri časť 4.5).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Hypotenzia, bradykardia a synkopa
Intuniv môže spôsobiť synkopu, hypotenziu a bradykardiu. Synkopa môže so sebou niesť riziko pádu
alebo úrazu, čo môže viesť k vážnemu poraneniu (pozri časti 4.8 a 4.7).
Pred začatím liečby sa má zhodnotiť pacientov kardiovaskulárny stav vrátane pulzovej frekvencie a tlaku krvi, rodinná anamnéza náhlej kardiálnej/nevysvetlenej smrti, za účelom identifikácie pacientov so zvýšeným rizikom hypotenzie, bradykardie a predĺženia QT intervalu/rizika vzniku arytmie. Sledovanie parametrov pulzovej frekvencie a tlaku krvi má pokračovať na týždennej báze počas obdobia titrácie a stabilizácie dávky a aspoň každé 3 mesiace počas prvého roka s ohľadom na klinické hodnotenie. Potom by malo nasledovať sledovanie každých 6 mesiacov s častejším sledovaním pri každej úprave dávky.
U pacientov, ktorí majú anamnézu hypotenzie, srdcovej blokády, bradykardie alebo kardivaskulárneho ochorenia, alebo pacientov s anamnézou synkopy, prípadne stavu, ktorý môže predisponovať
k synkope, ako sú hypotenzia, ortostatická hypotenzia, bradykardia alebo dehydratácia, sa pri liečbe
Intunivom odporúča opatrnosť. Opatrnosť pri liečbe Intunivom sa odporúča aj u pacientov, ktorí sú
súbežne liečení antihypertenzívami alebo inými liekmi, ktoré môžu znižovať krvný tlak alebo pulzovú frekvenciu, alebo zvyšovať riziko synkopy. Pacienti majú byť poučení, aby pili dostatok tekutín.
QTc interval
Vo fáze II-III randomizovaných, dvojito zaslepených štúdiách s monoterapiou jednotlivé nárasty
v predĺžení QTc intervalu, ktoré prekročili zmenu od počiatočnej hodnoty o viac > 60 ms korekcie
podľa Fridericia a korekcie podľa Bazetta boli 0 (0,0 %) a 2 (0,3 %) u pacientov na placebe
a 1 (0,1 %) a 1 (0,1 %) u pacientov na Intunive. Klinický význam tohto nálezu je nejasný.
Guanfacín sa má predpisovať s opatrnosťou pacientom, u ktorých je známa anamnéza predĺženia
QT intervalu, s rizikovými faktormi pre vznik torsade de pointes (napr. srdcová blokáda, bradykardia, hypokalémia) alebo pacientom, ktorí užívajú lieky známe predĺžovaním QT intervalu. Na základe klinického hodnotenia majú títo pacienti absolvovať ďalšie kardiologické vyšetrenia (pozri časť 4.8).
Sedácia a somnolencia
Intuniv môže spôsobiť somnolenciu a sedáciu hlavne na začiatku liečby a v typickom prípade môže
trvať 2-3 týždne, v niektorých prípadoch dlhšie. Preto sa odporúča, aby boli pacienti dôkladne
sledovaní v týždennom intervale počas titrácie a stabilizácie dávky (pozri časť 4.2) a každé 3 mesiace
počas prvého roku, s ohľadom na klinické hodnotenie. Skôr než sa začne Intuniv užívať spolu
s akýmikoľvek inými centrálne aktívnymi tlmiacimi látkami (ako alkohol, sedatíva, fenotiazíny, barbituráty alebo benzodiazepíny) je potrebné zvážiť možný aditívny efekt. Počas užívania Intunivu pacienti nemajú požívať alkohol. Pacientom sa odporúča, aby neobsluhovali ťažké zariadenia, neviedli vozidlá alebo nebicyklovali, kým nezistia, ako reagujú na liečbu Intunivom (pozri cast 4.7).
Samovražedné predstavy
Pacienti, u ktorých vzniknú počas liečby ADHD samovražedé myšlienky alebo správanie, majú byť
okamžite vyšetrení psychiatrom. Môže byť potrebná liečba základného psychiatrického ochorenia a zváženie prípadnej zmeny v liečebnom programme ADHD.
Ú
činok na výšku, hmotnosťaBodyMassindex(BMI)
U deti a dospievajúcich môže dôjsť k nárastu BMI. Preto sa má sledovať výška, hmotnosť a BMI pred
začatím liečby a potom každé 3 mesiace počas prvého roka, berúc do úvahy klinické hodnotenie. Potom má pokračovať sledovanie každých 6 mesiacov s častejším sledovaním pri každej úprave dávky.
Pomocné látky
Intuniv obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie,
laponského deficitu laktázy alebo glukózo-galaktózovej malabsorbcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Pri používaní Intunivu súbežne s inhibítormi a induktormi CYP3A4/5, plazmatické koncentrácie guanfacínu sa môžu zvýšiť alebo znížiť, čím sa prípadne môže ovplyvniť účinnosť a bezpečnosť Intunivu. Intuniv môže zvýšiť plazmatické koncentrácie súbežne podávaných liekov, ktoré sa metabolizujú prostredníctvom CYP3A4/5 (pozri časť 4.2, 4.4 a 5.2).
Farmakodynamický účinok Intunivu môže mať prídavný efekt, keď sa užíva s inými látkami,
o ktorých je známe, že spôsobujú sedáciu, hypotenziu alebo predĺženie QT intervalu (pozri časť 4.4).
Všetky interakčné štúdie liek-liek sa uskutočnili u dospelých, avšak predpokladá sa, že výsledok by bol podobný aj u detí v indikovanom vekovom rozmedzí.
Lieky predlžujúce QT interval
Intuniv spôsobuje zníženie srdcovej frekvencie. Vzhľadom na účinok Intunivu na srdcovú frekvenciu
sa súbežné užívanie Intunivu s liekmi predĺžujúcimi QT interval všeobecne neodporúča (pozri
časť 4.4).
Inhiítory CYP3A4 a CYP3A5
Pri podávaní Intunivu pacientom, ktorí užívajú ketokonazol a iné stredne silné a silné inhibítory
CYP3A4/5, je potrebná zvýšenú opatrnosť a navrhuje sa zníženie dávky Intunivu v odporúčanom
dávkovacom rozmedzí (pozri časť 4.2). Súbežné podávanie Intunivu so stredne silnými a silnými inhibítormi CYP3A4/5 zvyšuje plazmatickú koncentráciu guanfacínu a zvyšuje riziko nežiaducich účinkov, ako sú hypotenzia, bradykardia a sedácia. Pri podávaní guanfacínu spolu s ketokonazolom sa zaznamenala výrazne zvýšená miera a rozsah expozície guanfacínu; maximálna plazmatická koncentrácia guanfacínu (Cmax) a expozícia (AUC) sa zvýšili 2- a 3-krát, v tomto poradí. Iné inhibitory CYP3A4/5 môžu mať porovnateľný účinok. Zoznam príkladov stredne silných a silných inhibítorov CYP3A4/5 pozri v tabuľke 3, pričom zoznam nie je konečný.
Induktory CYP3A4
Pri súbežnom užívaní Intunivu s induktormi CYP3A4, sa navrhuje zvýšenie dávky Intunivu
v odporúčanom dávkovacom rozmedzí (pozri časť 4.2). Pri podávaní guanfacínu spolu s rifampínom, induktorom CYP3A4, sa zaznamenal významný pokles hodnoty a rozsahu expozície guanfacínu.
Maximálna plazmatická koncentrácia guanfacínu (Cmax) a expozícia (AUC) sa znížili o 54 % a 70 %,
v tomto poradí. Iné CYP3A4 induktory môžu mať porovnateľný účinok. Zoznam príkladov induktorov
CYP3A4/5 pozri v tabuľke 3, pričom zoznam nie je konečný.
Tabuľka 3
Stredne silné inhibítory
CY
P
3A4/5
Silné inhibítory CYP3A4/5 Induktory CYP3A4
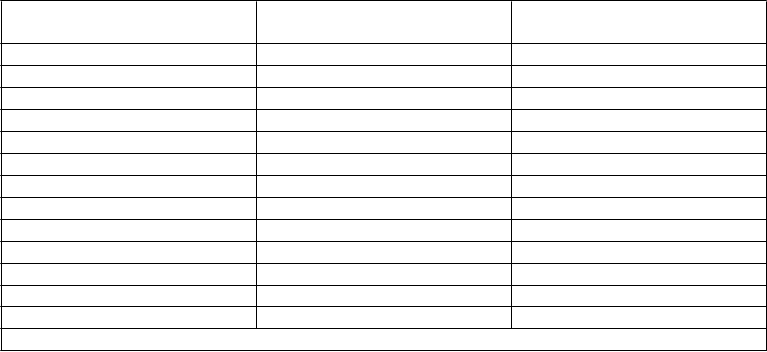
Aprepitant Boceprevir Bosentan Atazanavir Chloramfenikol Karbamazepín Ciprofloxacín Klaritromycín Efavirenz Krizotinib Indinavir Etravirín Diltiazem Itrakonazol Modafinil Erytromycín Ketokonazol Nevirapín Flukonazol Posakonazol Oxkarbazepín Fosamprenavir Ritonavir Fenobarbital Imatinib Sachinavir Fenytoín Verapamil Suboxone Primidón Grapefruitová šťava Telaprevir Rifabutín
Telitromycín Rifampicín
Ľubovník bodkovaný
Ďalšie odporúčania ohľadom dávkovania pozri časť 4.2Kyselina valproováSúbežné podávanie Intunivu a kyseliny valproovej môže spôsobiť zvýšené koncentrácie kyseliny
valproovej. Mechanizmus tejto interakcie nie je známy, hoci guanfacín aj kyselina valproová sa
metabolizujú glukuronidáciou, čo môže spôsobovať kompetitívnu inhibíciu. V prípade, že pacienti súbežne užívajú Intuniv a kyselinu valproovú, je potrebné u nich sledovať prípadné prídavné účinky na centrálny nervový system (CNS) a do úvahy prichádza sledovanie sérových koncentrácií kyseliny valproovej. Pri súbežnom podávaní môže byť indikovaná úprava dávky kyseliny valproovej aj Intunivu.
AntihypertenzívaPri súbežnom podávaní Intunivu a antihypertenzív je vhodná opatrnosť kvôli prípadným prídavným
farmakodynamickým účinkom, ako sú hypotenzia a synkopa.
Lieky tlmiace CNSPri súbežnom podávaní Intunivu s liekmi, ktoré utlmujú CNS (napr. alkohol, sedatíva, hypnotiká,
benzodiazepíny, barbituráry a antipsychotiká), je potrebná opatrnosť vzhľadom na potenciálne
prídavné farmakodynamické účinky ako sú sedácia a somnolencia.
Perorálny metylfenidátV liekovej interakčnej štúdii ani Intuniv ani OROS
(Osmotic Release Oral System) metylfenidátu HCl
s predĺženým uvolňovaním neovplyvnili farmakokinetiku iných liekov pri užívaní v kombinácii.
Lisdexamfetamín dimesylátV liekovej interakčnej štúdii podanie Intunivu v kombinácii s dimesylátom lisdexamfetamínu
indukovalo 19 % zvýšenie plazmatickej koncentrácie guanfacínu, zatiaľ čo expozícia (AUC) sa zvýšila o 7 %. Neočakáva sa, že tieto malé zmeny budú klinicky významné. V tejto štúdii sa nepozoroval žiaden účinok na expozíciu d-amfetamínu pri kombinácii Intunivu a dimesylátu lisdexamfetamínu.
I
nterakcie s jedlom
Intuniv sa nemá podávať s veľmi mastnými jedlami vzhľadom na zvýšenú expozíciu, keďže bolo
preukázané, že veľmi mastné jedlá majú významný účinok na vstrebávanie guanfacínu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití guanfacínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3).
Intuniv sa neodporúča užívať počas gravidity a u žien vo fertilnom veku nepoužívajúcich antikoncepciu.
Dojčenie
Nie je známe, či sa guanfacín a jeho metabolity vylučujú do ľudského mlieka.
Dostupné farmakodynamické a toxikologické údaje u zvierat preukázali vylučovanie guanfacínu
a jeho metabolitov do mlieka (pozri časť 5.3). Z toho dôvodu nie je možné vylúčiť riziko u dojčiat.
Rozhodnutie, či ukončiť dojčenie alebo ukončiť a/alebo prerušiť liečbu Intunivu sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o účinku guanfacínu na fertilitu.
Štúdie na zvieratách poukazujú na účinok na mužskú fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Intuniv môže spôsobovať závrat a somnolenciu. Tieto účinky sa objavujú prevažne na začiatku liečby a menej často sa môžu objaviť počas trvania liečby. Pozorovala sa aj synkopa. Môže to mať stredne závažný až závažný vplyv na schopnosť viesť vozidlá a obsluhovať stroje alebo bicyklovať. Pacientov je potrebné upozorniťna tieto možné účinky a poučiť ich, že v prípade ich objavenia sa majú vyhýbať týmto aktivitám (pozri časť 4.4).
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
V súbore dát z kontrolovaných, dvojito zaslepených a otvorených klinických štúdií s Intunivom,
najčastejšie hlásené nežiaduce reakcie (veľmi časté) zahŕňali somnolenciu (40,6 %), bolesť hlavy
(27,4 %), únavu (18,1 %), bolesti nadbruška (12,0 %) a sedáciu (10,2 %). Často hlásené závažné
nežiaduce reakcie zahŕňali hypotenziu (3,2 %), nárast hmotnosti (2,9 %), bradykardiu (1,5 %)
a synkopu (menej časté) (0,7 %). Nežiaduce reakcie somnolencia a sedácia sa objavili hlavne na
začiatku liečby a môžu zvyčajne trvať 2-3 týždne a v niektorých prípadoch dlhšie.
Tabuľkový zoznamnežiaducichúčinkov
Nasledujúca tabuľka uvádza všetky nežiaduce reakcie zhromaždené z klinických štúdií a spontánnych
hlásení. Všetky nežiaduce účinky zaznamenané zo skúseností po uvedení lieku na trh sú uvedené
kurzívou.
Pre terminológiu frekvencie použitej nižšie platia nasledujúce definície: Veľmi časté (≥ 1/10);
Časté (≥ 1/100 až < 1/10);
Menej časté (≥ 1/1 000 až < 1/100); Zriedkavé (≥ 1/10 000 až <1/1 000); Veľmi zriedkavé (<1/10 000); Neznáme (z dostupných údajov).
Tabuľka 4. Nežiaduce liekové reakcie hlásené s Intunivom
T
rieda orgánových systémov Nežiaduca lieková reakcia Poruchy imunitného systému
Kategória frekvencie
Hypersenzitivita Menej časté
Poruchy metabolizmu a výživyZnížená chuť do jedla Časté
Psychické poruchyDepresia Časté Úzkosť Časté Afektívna labilita Časté Nespavosť Časté Stredne ťažká nespavosť Časté Nočná mora Časté Agitovanosť Menej časté Halucinácie Menej časté
 Poruchy nervového systému
Poruchy nervového systémuSomnolencia Veľmi časté Bolesť hlavy Veľmi časté Sedácia Časté Závrat Časté Letargia Časté Kŕče Menej časté Synkopa/strata vedomia Menej časté Posturálny závrat Menej časté Hypersomnia Zriedkavé
Poruchy srdca a srdcovej činnostiBradykardia Časté Atrioventrikulárny blok prvého stupňa Menej časté
Tachykardia Menej časté Sínusová arytmia Menej časté
Poruchy cievHypotenzia Časté Ortostatická hypotenzia Časté Bledosť Menej časté Hypertenzia Zriedkavé
Poruchy dýchacej sústavy, hrudníka a mediastínaAstma Menej časté
T
abuľka 4. Nežiaduce liekové reakcie hlásené s Intunivom
T
rieda orgánových systémov
Nežiaduca lieková reakcia
Poruchy gastrointestinálneho traktu
Kategória frekvencie
Bolesti brucha Veľmi časté Vracanie Časté Hnačka Časté Nevoľnosť Časté Zápcha Časté Abdominálny/žalúdočný dyskomfort Časté Sucho v ústach Časté Dyspepsia Menej časté
Poruchy kože a podkožného tkanivaVyrážka ČastéPruritis Menej časté Poruchy obličiek a močových ciest
Poruchy obličiek a močových ciestNočné pomočovanie Časté
Polakizúria Menej časté
Celkové poruchyÚnava Veľmi časté Podráždenosť Časté Asténia Menej časté Bolesť na hrudníku Menej časté Nepokoj Zriedkavé
Laboratórne a funkčné vyšetreniaZnížený tlak krvi Časté Zvýšená hmotnosť Časté Zvýšený tlak krvi Menej časté Znížená srdcová frekvencia Menej časté Zvýšená hladina alanínaminotransferázy Menej časté
Opis vybraných nežiaducich reakciíSomnolencia /sedácia, hypotenzia, bradykardia a synkopaV celkovom súbore pacientov liečených guanfacínom sa somnolencia objavila u 40,6 % a sedácia u 10,2 % pacientov liečených guanfacínom. Bradykardia sa objavila u 1,5 %, hypotenzia u 3,2 %
a synkopa sa objavila u 0,7 % všetkých pacientov liečených guanfacínom. Výskyt
somnolencie/sedácie a hypotenzie bol najnápadnejší v prvých týždňoch liečby a potom postupne vymizol.
Účinky na výšku, hmotnosť a Body Mass Index (BMI)Starostlivé sledovanie hmotnosti naznačuje, že deti a dospievajúci, ktorí užívali Intuniv v štúdii (t.j. liečba 7 dní v týždni počas roka), vykazovali priemernú zmenu od počiatočnej hodnoty normalizovanú podľa veku a pohlavia, v percentile BMI 4,3 počas 1 roka (priemerný počiatočný percentil a percentil po 12 mesiacoch boli 68,3 a 73,1, v tomto poradí). Preto majú byť merania výšky, hmotnosti a BMI súčasťou rutinného sledovania na začiatku liečby a každé 3 mesiace počas prvého roka, potom každých 6 mesiacov, berúc do úvahy klinické hodnotenie so zachovávaním rastového grafu.
Podrobná QT/QTc štúdiaÚčinok 2 dávok guanfacínu s okamžitým uvoľňovaním (4 mg a 8 mg) na QT interval sa hodnotil
v dvojito zaslepenej, randomizovanej, placebom a aktívnym komparátorom kontrolovanej, prekríženej
štúdie u zdravých dospelých. Pri oboch dávkach sa pozoroval zjavný nárast v priemernom QTc. Klinický význam tohto nálezu nie je známy.
Vo fáze II-III randomizovaných, dvojito zaslepených štúdiách s monoterapiou jednotlivé nárasty
v predĺžení QTc intervalu, ktoré prekročili zmenu od počiatočnej hodnoty o viac ako 60 ms korekcie
podľa Fridericia a korekcie podľa Bazetta, boli 0 (0,0 %) a 2 (0,3 %) u pacientov na placebe
a 1 (0,1 %) a 1 (0,1 %) u pacientov na Intunive. Klinický význam tohto nálezu je nejasný.
Dospelí pacientiIntuniv sa neskúmal u dospelých s ADHD.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovaniePrejavy a príznaky predávkovania zahŕňajú hypotenziu, počiatočnú hypertenziu, bradykardiu, letargiu a útlm dýchania. Hemodynamická nestabilita bola tiež spájaná s predávkovaním 3-násobnou odporúčanou dávkou guanfacínu. Opatrenia pri predávkovaní Intunivom zahŕňajú sledovanie a liečbu prejavov a príznakov.
Pediatrickí pacienti (deti a dospievajúci vo veku 6-17 rokov, vrátane), u ktorých sa vyvinula letargia, sa majú sledovať až 24 hodín pre možný rozvoj závažnejšej toxicity vrátane kómy, bradykardie
a hypotenzie, kvôli možnosti oneskoreného nástupu týchto symptómov.
Liečba predávkovania môže zahŕňať výplach žalúdka, ak sa uskutoční včas po požití. Tiež môže byť vhodné podanie aktívneho uhlia na obmedzenie absorbcie. Guanfacín nie je dialyzovateľný v klinicky významnom množstve (2,4 %).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihypertenzíva, antiadrenergické liečivá s centrálnym účinkom, ATC kód: C02AC02.
Mechanizmus účinkuGuanfacín je selektívny alfa2A-agonista adrenergných receptorov, pretože má 15-20-krát vyššiu afinitu
k tomuto subtypu receptora ako k subtypu alfa2B alebo alfa2C. Guanfacín nie je stimulujúci. Spôsob
účinku guanfacínu pri ADHD nie je celkom stanovený. Predklinický výskum naznačuje, že guanfacín
moduluje signalizáciu v prefrontálnom kortexe a v bazálnych gangliách priamou modifikáciou synaptického noradrenalínového prenosu na alfa 2-adrenergných receptoroch.
Farmakodynamické účinkyGuanfacín je známy ako antihypertenzívum. Stimuláciou alfa 2A-adrenergných receptorov redukuje
sympatikové nervové impulzy z vazomotorického centra do srdca a krvných ciev. V dôsledku toho dochádza k poklesu periférnej cievnej rezistencie a krvného tlaku a k zníženiu srdcovej frekvencie.
K
l
i
n
i
cká účinnosť a bezpečnosť
Účinok guanfacínu v liečbe ADHD sa skúmal v 5 kontrolovaných štúdiách u detí a dospievajúcich
(6 až 17 rokov), v 3 krátkodobých kontrolovaných klinických štúdiách u detí a dospievajúcich vo veku
6 až 17 rokov, v 1 krátkodobej kontolovanej štúdii u dospievajúcich vo veku 13 až 17 rokov
a 1 randomizovanej štúdii s vysadzovaním lieku u detí a dospievajúcich vo veku 6-17, ktorí splnili
DSM-IV-TR kritériá pre ADHD. U väčšiny pacientov sa dosiahla optimalizovaná dávka medzi
0,05-0,12 mg/kg/deň.
Tristotridsaťsedem pacientov vo veku 6-17 rokov sa hodnotilo v pivotnej štúdii fázy 3 SPD 503-316
s cieľom zhodnotiť bezpečnosť a účinnosť dávkovania jedenkrát denne (deti: 1-4 mg/deň, dospievajúci
1-7 mg/deň). V tejto 12 týždňovej (6-12 rokov) alebo 15 týždňovej (13-17 rokov), randomizovanej, dvojito zaslepenej štúdii s paralelnými skupinami, s placebom alebo aktívnou referenčnou látkou (atomoxetín), s titráciou dávky, guanfacín na základe hodnotenia investigátorov pomocou ADHD hodnotiacej škály (ADHD Rating Scale, ADHD-RS) preukázal významne vyššiu účinnosť na symptómy ADHD ako placebo. ADHD hodnotiaca škála je meradlom pre základné symptómy ADHD. Výsledky týkajúce sa primárneho koncového ukazovateľa štúdie sú uvedené v tabuľke 5.
Tabuľka 5 Súhrn primárnej účinnosti pre štúdiu SPD503-316: ADHD-RS-IV
Li
e
če
bn
é
'
s
k
up
i
ny
N Počiatočná
AD
HD-RS-IV (SD)
Z
m
e
n
a od
p
oč
i
a
t
oč
n
ýc
h
h
o
dn
ô
t (SD)
R
oz
di
e
l oproti
p
la
c
e
b
u
(
95%CI)
V
e
ľkosť účinku
M
ie
ra
o
dp
o
v
e
d
e
R
oz
di
e
l oproti
p
la
c
e
b
u (95%CI)
Guanfacín
Atomoxetín
Placebo
114
112
111
43,1 (5,5)
43,7 (5,9)
43,2 (5,6)
-23,9 (12,4)
-18,6 (11,9)
-15,0 (13,1)
8,9 (11,9, -5,8)
 0,8
0,83,8 (6,8, -0,7)
0,3NA
64,3 %
55,4 %
42,3 %
21,9 % (9,2; 34,7)
13,0 % (0,0; 26,0) NA
Výsledky sekundárnych koncových ukazovateľov boli v súlade s výsledkami primárneho koncového
ukazovateľa. Percento pacientov, ktorí dosiahli kritériá odpovede po titrácii dávky (≥30% redukcia oproti východiskovému stavu v celkovom skóre ADHD-RS-IV a hodnoty 1 a 2 v CGI-I) bolo 64,3 % pre guanfacín, 55,4 % pre atomoxetín a 42,3 % pre placebo. Guanfacín preukázal významné zlepšenie v učení, fungovaní v škole a rodine podľa merania v skóre WFIRS-P.
Navyše sa realizovala 15 týždňová, dvojito zaslepená, randomizovaná, placebom kontrolovaná štúdia na optimalizácii dávky (SPD505-312) u dospievajúcich vo veku 13-17 rokov (n=314) na potvrdenie účinnosti, bezpečnosti a znášanlivosti guanfacínu (1-7 mg/deň) pri liečbe ADHD. Guanfacín preukázalo významne väčšie zlepšenie v celkovom skóre ADHD-RS-IV v porovnaní s pacientmi užívajúcimi placebo. Pacienti liečení guanfacínom boli v porovnaní s pacientmi liečenými placebom
v štatisticky významne lepšom stave vo výsledku fungovania, na základe celkového klinického dojmu
závažnosti (CGI-S) na záver. Superiorita (štatistická významnosť) nad placebom v rodine a škole, a v oblastiach učenia pomocou skóre WFIRS-P nebola v tejto štúdii stanovená.
Štúdia (SPD503-315) trvajúca 41 týždňov na dlhodobé udržanie účinnosti štúdie, ktorá zahŕňala otvorenú fázu (až do 13 týždňov) nasledovanú dvojito zaslepenou, placebom kontrolovanou, randomizovanou fázou s vysadzovaním lieku (až do 26 týždňov), sa realizovala u pediatrických pacientov (deti a dospievajúci vo veku 6-17 rokov vrátane) (n=526 v otvorenej fáze a n=315 v dvojito zaslepenej, randomizovanej faze s vysadzovaním lieku), pri ktorej sa hodnotila účinnosť, bezpečnosť
a znášanlivosť jednej dávky guanfacínu denne (deti: 1-4 mg/deň, dospievajúci: 1-7 mg/deň) v liečbe
ADHD. Guanfacín vykázal superioritu nad placebom pri dlhodobo udržaní liečby u detí
a dospievajúcich s ADHD, pričom sa meralo kumulatívne zlyhanie liečby (49,3 % u Intunivu a 64,9 % u placeba, p=0,006). Zlyhanie liečby bolo definované ako ≥50 % zvýšenie v celkovom skóre ADHD- RS-IV a ≥ 2 bodový nárast v skóre CGI-S v porovnaní s príslušnými skóre pri dvojito zaslepenej počiatočnej návšteve. Na konci dvojito zaslepenej liečby bol podiel pacientov normálnych alebo
hranične mentálne chorých v porovnaní so skupinou s placebom významne väčší v skupine
s guanfacínom , na základe celkového klinického dojmu závažnosti (CGI-S), ktorý zahŕňa hodnotenie fungovania. Superiorita (štatistická významnosť) nad placebom v rodine a škole, a v oblastiach učenia pomocou skóre WFIRS-P nebola v tejto štúdii dôsledne stanovená.
Podobné výsledky účinnosti guanfacínu v liečbe ADHD sa stanovili v 2 randmizovaných, dvojito zaslepených, placebom kontrolovaných štúdiách s fixnou dávkou monoterapie (rozsah 1-4 mg/deň) u pediatrických pacientov (deti a dospievajúci 6-17 rokov, vrátane). Štúdie SPD503-301 a SPD503-
304, ktoré trvali 8 a 9 týždňov, v tomto poradí, sa uskutočnili v USA. Guanfacín preukázal významne
väčšie zlepšenie v porovnaní s placebom pri hodnotení zmeny medzi počiatočnou hodnotou
a hodnotou pri ukončení liečby v skóre hodnotiacej škály ADHD (ADHD-RS-IV) v oboch štúdiách (k placebu upravená redukcia v priemernom rozmedzí podľa metódy najmenších štvorcov (least squares, LS) od 5,4 do 10,0; p<0,02).
Štúdia SPD503-314 sa uskutočnila u detí vo veku 6-12 rokov na hodnotenie účinnosti jednej dávky guanfacínu denne (1-4 mg), ktorá sa podávala ráno alebo večer. Bola to dvojito zaslepená, randomizovaná, placebom kontrolovaná štúdia na optimalizáciu dávky, ktorá trvala 9 týždňov
a uskutočnila sa v USA a Kanade. Symptómy ADHD sa hodnotili ako zmena medzi počiatočnou
hodnotou a hodnotou v 8. týždni (hodnotenie na konci liečby) v celkovom skóre ADHD hodnotiacej škály (ADHD-RS-IV). Guanfacín preukázal významne väčšie zlepšenie v porovnaní s placebom bez ohľadu na čas podania (dopoludnie alebo popoludnie) (k placebu upravený priemerný rozdiel podľa LS -9,4 pre dávkovanie dopoludnia a -9,8 pre dávkovanie popoludní, p<0,001).
Súbežné podávanie so psychostimulanciami
Účinok súbežného podávania psychostimulancií sa testoval v prídavnej štúdii u pacientov, ktorí odpovedali na psychostimulanciá len čiastočne. Štúdia bola dvojito zaslepená, randomizovaná, placebom kontrolovaná, multicentrická, na optimalizáciu dávky, v trvaní 9 týždňov. Bola navrhnutá s cieľom hodnotenia účinnosti a bezpečnosti guanfacínu (1, 2, 3 a 4 mg/deň) pri súbežnom podávaní s dlhodobo pôsobiacimi psychostimulanciami (amfetamín, lisdexamfetamín, metylfenidát,
dexmetylfenidát) u detí a dospievajúcich vo veku 6-17 rokov s diagnózou ADHD a so suboptimálnou, čiastočnou odpoveďou na psychostimulanciá. Suboptimálna odpoveď bola definovaná ako celkové skóre ≥24 v ADHD-RS-IV a skóre ≥3 v CGI-S pri skríningu a na počiatku. Primárna účinnosť sa hodnotila ako celkové skóre v ADHD-RS-IV.
Výsledky ukázali, že u pacientov liečených pridaným guanfacínom bolo zlepšenie v ADHD-RS-IV
väčšie ako u pacientov liečených pridaným placebom (20,7 (12,6) bodov oproti 15,9 (11,8); rozdiel
4,9 95% CI 2,6; 7,2)). Žiadny vekový rozdiel sa nepozoroval vo vzťahu k odpovedi na ADHD-RS-IV.
Štúdia pri ADHD so symptómami opozičného vzdoru
Štúdia SPD503-307 bola 9 týždňová, dvojito zaslepená, randomizovaná, placebom kontrolovaná, na optimalizáciu dávky guanfacínu (1-4 mg/deň) uskutočnená u detí vo veku 6-12 rokov s ADHD a so symptómami opozičného vzdoru (n=217). Symptómy opozičného vzdoru sa hodnotili pomocou skóre v Connersovej Rodičovskej hodnotiacej škále – subškála odporu – revidovanom dlhom formulári (CPRS-R:L) ako zmena od počiatočných hodnôt po finálne/záverečné hodnoty Výsledky preukázali štatisticky významne (p≤ 0,05) zväčšené priemerné zníženie v skóre subškály odporu CPRS-R:L
v závere oproti počiatku (naznačujúc zlepšenie) v skupine s guanfacínom v porovnaní s placebom
(10,9 bodov oproti 6,8 pre guanfacín oproti placebu, v tomto poradí) a veľkosť účinku bola 0,6
(p< 0,001). Tieto zníženia znamenajú percentuálne zníženie 56 % oproti 33 % pre guanfacín oproti placebu, v tomto poradí.
5.2 Farmakokinetické vlastnosti
Absorpcia
Guanfacín sa ľahko absorbuje s dosiahnutím maximálnej plazmatickej koncentrácie približne 5 hodín
po perorálnom podaní u pediatrických pacientov (detí a dospievajúci vo veku 6-17 rokov, vrátane).
U dospelých sa priemerná expozícia guanfacínu zvýšila (Cmax ~ 75 % a AUC ~ 40 %) pri užití
Intunivu spolu s veľmi mastnými jedlami, v porovnaní s užitím nalačno (pozri casť 4.2).
Distribúcia
Guanfacín sa mierne viaže na plazmatické bielkoviny (približne 70 %) nezávisle od koncentrácie
lieku.
Biotransformácia
Guanfacín sa metabolizuje oxidáciou sprostredkovanou CYP3A4/5 s následnými reakciami II fázy
sulfatáciou a glukuronidáciou. Hlavným cirkulujúcim metabolitom je 3-OH-guanfacín-sulfát. Guanfacín je substrátom CYP3A4/5 a CYP3A5 a jeho expozícia je ovplyvnená induktormi
a inhibítormi CYP3A4 a CYP3A5. V ľudských pečeňových mikrozómoch guanfacín neinhibuje
aktivity iných hlavných izoenzýmov cytochrómu P450 (CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4 alebo CYP3A5).
Eliminácia
Guanfacín sa vylučuje filtráciou a aktívnou sekréciou obličkami a pečeňou. Aktívna renálna sekrécia
je mediovaná prostredníctvom prenášača OCT2. Obličková exkrécia je hlavná vylučovacia cesta
(80 %), pričom pôvodný liek tvorí 30 % rádioaktivity v moči. Hlavné močové metabolity boli
3-hydroxyguanfacín glukuronid, guanfacín dihydrodiol, 3-hydroxyguanfacín sulfát. Polčas eliminácie
guanfacínu je približne 18 hodín.
Farmakokinetika guanfacínu je podobná u detských (vo veku 6 až 12 rokov) a dospievajúcich (vo veku 13 až 17 rokov) pacientov s ADHD, a u zdravých dospelých dobrovoľníkov.
Osobitné skupiny
U detí s ADHD mladších ako 6 rokov sa neuskutočnili žiadne štúdie s Intunivom.
Systémová expozícia guanfacínu je podobná u mužov a žien, ktorí dostávajú rovnakú dávku v mg/kg. Formálne farmakokinetické štúdie s ohľadom na etnickú príslušnosť sa neuskutočnili. Neexistuje
žiadny dôkaz akéhokoľvek vplyvu ethnicity na farmakokinetiku Intunivu.
5.3 Predklinické údaje o bezpečnosti
V štúdiách na myšiach s dávkami až do 10 mg/kg/deň sa počas 78 týždňov nepozorovali žiadne karcinogénne účinky. U samcov potkanov, ale nie u samíc, sa pri dávke 5 mg/kg/deň počas
102 týždňov pozoroval významne vyšší výskyt adenómov pankreatických ostrovčekov. Klinický
význam nie je známy.
Guanfacín nebol genotoxický v žiadnom z rôznych modelov, vrátane Amesovho testu a in vitro testu chromozómovej aberácie.
Všeobecná toxicita, ktorá sa pozorovala u zvierat (potkany, psy) pri liečbe guanfacínom zahŕňala predĺženie nekorigovaného QT intervalu (srdce), atrofickú slezinu a pokles počtu bielych krviniek, postihnutie pečene - vrátane zvýšeného bilirubínu a hodnôt ALT, podráždené a zapálené črevá, zvýšené hladiny kreatinínu a močovinového dusíka v krvi (obličky), zákal rohovky (oko)-len
u potkanov a myší, alveolárne makrofágové infiltrácie a pneumonitída a znížená spermatogenéza.
V štúdii fertility u samíc potkanov pri dávkach až 22-krát vyšších ako je maximálna odporúčaná dávka u ľudí na báze mg/ m2 sa nepozorovali žiadne vedľajšie účinky.
Samčia plodnosť bola ovplyvnená pri 8 mg/kg/deň, najnižšej testovanej dávke, ktorá je ekvivalentná
10,8-násobku maximálnej odporúčanej dávke u ľudí – 0,12 mg/kg na báze mg/m2. Kvôli nedostatku vhodných toxikokinetických údajov nebolo možné porovnanie s klinickou expozíciou u ľudí.
Pri guanfacíne sa preukázala embryofetálna vývojová toxicita u myší a potkanov (NOAEL
0,5 mg/kg/deň) a u králikov (NOAEL 3,0 mg/kg/deň), spolu s toxicitou u matky. Kvôli nedostatku vhodných toxikokinetických údajov nebolo možné porovnanie s klinickou expozíciou u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
hypromelóza 2208
kopolymér kyseliny metakrylovej-etylakrylátu monohydrát laktózy
povidón
krospovidón typu A mikrokryštalická celulóza koloidný oxid kremičitý bezvodý nátriumlaurylsulfát
polysorbát 80
kyselina fumarová dibehenát glycerolu
3 mg a 4 mg tablety navyše obsahujú hlinitý lak indigokarmínu E 132
žltý oxid železitý E 172
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
4 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Pretlačovacie pásové balenie je zložené z 2 vrstiev, čírej teplom formovateľnej pevnej vrstvy, ktorá je navrstvená s PCTFE na PVC podklade, na ktorom je pripevnená pretlačovacia hliníková fólia. Blistre sa uchovávajú v kartónových škatuliach.
Intuniv 1 mg veľkosti balenia: 7 alebo 28 tabliet. Intuniv 2 mg veľkosti balenia: 7, 28 alebo 84 tabliet. Intuniv 3 mg veľkosti balenia: 28 alebo 84 tabliet. Intuniv 4 mg veľkosti balenia: 28 alebo 84 tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Shire Pharmaceuticals Ireland Limited
5 Riverwalk,
Citywest Business Campus, Dublin 24,
ÍRSKO
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)Tableta Intuniv 1 mgEU/1/15/1040/001-002
Tableta Intuniv 2 mgEU/1/15/1040/003-005
Tableta Intuniv 3 mgEU/1/15/1040/006-007
Tableta Intuniv 4 mgEU/1/15/1040/008-009
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.