
cia
u interných
pacientov
menej časté:
trombocytopénia
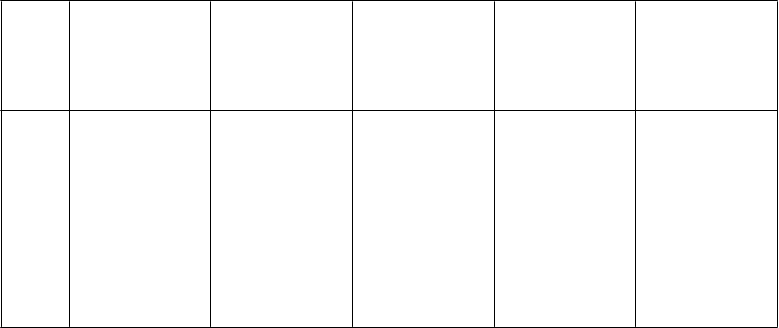
Liečba pacientov s DVT s PE alebo bez nej
veľmi časté:
trombocytóza β
časté:
trombocytopénia
Liečba pacientov s nestabilnou angínou a non-Q infarktom myokardu
menej časté:
trombocytopénia
Liečba pacientov
s akútnym
STEMI
časté: trombocytózaβ trombocytopénia veľmi zriedkavé: imuno-alergická trombocytopénia
 β
β: zvýšenie počtu krvných doštičiek > 400 x 109/l
Pediatrická populáciaBezpečnosť a účinnosť enoxaparínu sodného u detí nebola stanovená (pozri časť 4.2).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
PríloheV.
4.9 PredávkovaniePrejavy apríznakyNáhodné predávkovanie enoxaparínom sodným po subkutánnom, mimotelovom alebo intravenóznom podaní môže viesť ku krvácavým komplikáciám. Po perorálnom podaní, dokonca aj vysokých dávok, nie je pravdepodobné, že sa enoxaparín sodný absorbuje.
LiečbaAntikoagulačný účinok enoxaparínu možno do veľkej miery neutralizovať pomalým intravenóznym podaním protamínu. Dávka protamínu závisí od dávky podaného enoxaparínu sodného; 1 mg protamínu neutralizuje antikoagulačný účinok 100 IU (1 mg) enoxaparínu sodného, ak bol enoxaparín podaný v priebehu posledných 8 hodín. Ak bol enoxaparín podaný pred viac ako 8 hodinami alebo ak je potrebná druhá dávka protamínu, môže sa podať infúzia protamínu v dávke 0,5 mg protamínu na
100 IU (1 mg) podaného enoxaparínu sodného. 12 hodín po podaní enoxaparínu nemusí byť podanie protamínu potrebné. Avšak anti-Xa aktivita enoxaparínu sodného sa nikdy (ani pri vysokých dávkach protamínu) nezneutralizuje úplne (najviac asi 60 %) (pozri Súhrn charakteristických vlastností solí protamínu).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antitrombotikum, skupina heparínov. ATC kód: B01AB05
Inhixa je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.euFarmakodynamickéúčinky
Enoxaparín je nízkomolekulový heparín so strednou molekulovou hmotnosťou približne
4500 daltonov, v ktorom sú oddelené antitrombotická a antikoagulačná aktivita štandardného heparínu. Liečivo je sodná soľ.
V in-vitro purifikovanom systéme má enoxaparín sodný vysokú anti-Xa aktivitu (približne 100 IU/mg) a nízku anti-IIa alebo antitrombínovú aktivitu (približne 28 IU/mg) s pomerom 3,6. Tieto antikoagulačné aktivity sú sprostredkované antitrombínom (ATIII), čo má za následok antitrombotické účinky u ľudí.
Okrem anti-Xa/IIa aktivity boli identifikované u zdravých ľudí a u pacientov, ako aj na predklinických modeloch, ďalšie antitrombotické a protizápalové vlastnosti enoxaparínu. Patrí sem ATIII- dependentná inhibícia ďalších koagulačných faktorov ako je faktor VIIa, indukcia uvoľňovania endogénneho inhibítora cesty tkanivového faktora (Tissue Factor Pathway Inhibitor (TFPI)) a znížené uvoľňovanie von Willebrandovho faktora (vWF) z vaskulárneho endotelu do krvného obehu. O týchto faktoroch je známe, že prispievajú k celkovému antitrombotickému účinku enoxaparínu.
Keď sa enoxaparín sodný používa ako profylaktická liečba, nemá významný vplyv na aPTT. Keď sa používa ako kuratívna liečba, aPTT sa môže predĺžiť o 1,5-2,2-násobok kontrolného času pri maxime účinku.
Klinická účinnosťabezpečnosť
Prevencia venóznej tromboembolickej choroby spojená s operáciou
· Predĺžená profylaxia VTE po ortopedickej operácii
V dvojito zaslepenej štúdii predĺženej profylaxie u pacientov podstupujúcich náhradu bedrového kĺbu,
179 pacientov, ktorí nemali tromboembolickú chorobu a predtým počas hospitalizácie dostávali
4000 IU (40 mg) enoxaparínu sodného, boli po prepustení randomizovaní na buď 4000 IU (40 mg) (n=90) jedenkrát denne subkutánne, alebo placebo ( n=89) na 3 týždne. Výskyt DVT počas predĺženej
profylaxie bol štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom,
nebola hlásená žiadna PE. Nevyskytlo sa žiadne veľké krvácanie. Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo jedenkrát denne s.c. n (%)
Všetci pacienti liečení predĺženou
profylaxiou
90 (100) 89 (100)
celkovo VTE 6 (6,6) 18 (20,2)
· celkovo DVT (%) 6 (6,6)* 18 (20,2)
· proximálna DVT (%) 5 (5,6)# 7 (8,8)
*p hodnota oproti placebu =0,008
#p hodnota oproti placebu =0,537
V druhej dvojito zaslepenej štúdii bolo 262 pacientov bez VTE ochoreniapodstupujúcich operáciu s
náhradou bedrového kĺbu a predtým počas hospitalizácie liečených enoxaparínom sodným 4 000 IU (40 mg) s.c, . bolo randomizovaných po prepustení na buď enoxaparín sodný 4 000 IU (40 mg) (n=131) jedenkrát denne s.c., alebo placebo (n=131) počas 3 týždňov. Podobne ako v prvej štúdii bol výskyt VTE počas predĺženej profylaxie štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, a to aj pre VTE celkovo (enoxaparín sodný 21 [16 %] oproti placebu 45
[34,4 %]; p=0,001) aj pre proximálnu DVT (enoxaparín sodný 8 [6,1%] oproti placebu 28 [21,4 %];
p=<0,001). Pokiaľ ide o veľké krvácanie, nezistil sa žiadny rozdiel medzi skupinami s enoxaparínom sodným a placebom.
· Predĺžená profylaxia DVT po onkologickej operácii
Dvojito zaslepená, multicentrická klinická štúdia, porovnávala bezpečnosť a účinnosť štvortýždňového a jednotýždňového režimu profylaktického podávania enoxaparínu sodného
u 332 pacientov, ktorí sa podrobili elektívnej operácii z dôvodu rakoviny v brušnej alebo panvovej
oblasti. Pacienti dostávali enoxaparín sodný (4 000 IU (40 mg) s.c.) denne počas 6 až 10 dní a boli náhodne zaradení na liečbu enoxaparínom sodným alebo placebom počas ďalších 21 dní. Bilaterálna venografia sa realizovala medzi 21. a 31. dňom alebo skôr, ak sa vyskytli príznaky venózneho tromboembolizmu. Pacienti boli potom 3 mesiace sledovaní. Profylaxia enoxaparínom sodným počas
4 týždňov po operácii z dôvodu rakoviny v oblasti brucha alebo panvy štatisticky významne znížila výskyt venograficky preukázanej trombózy v porovnaní s profylaxiou enoxaparínom sodným počas jedného týždňa. Výskyt venózneho tromboembolizmu na konci dvojito zaslepenej fázy bol 12,0 % (n=20) v skupine s placebom a 4,8 % (n=8) v skupine s enoxaparínom sodným; p=0,02. Tento rozdiel pretrvával tri mesiace [13,8 % vs. 5,5 % (n=23 vs 9), p=0,01]. Neboli rozdiely vo výskyte krvácania alebo iných komplikácií počas dvojito zaslepenej alebo sledovacej fázy.
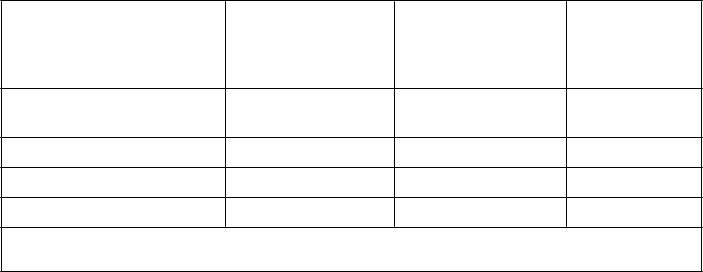
Prevencia venóznej tromboembolickej choroby u interných pacientov s akútnymi ochoreniami, kde sa
očakáva obmedzenie mobility
V dvojito zaslepenej, multicentrickej štúdii s paralelnými skupinami sa provnával enoxaparín sodný
2 000 IU (20 mg) alebo 4 000 IU (40 mg) jedenkrát denne s.c. s placebom v prevencii DVT
u interných pacientov s ťažkým obmedzením mobility počas akútneho ochorenia (definované ako prejdená vzdialenosť <10 metrov za ≤3 dni). Táto štúdia zahŕňala pacientov so srdcovým zlyhaním (NYHA trieda III alebo IV); akútnym respiračným zlyhaním alebo komplikovanou chronicku respiračnou insuficienciou a akútnou infekciou alebo akútnou reumou; ak boli spojené aspoň s jedným VTE rizikovým faktorom (vek ≥75 rokov, rakovina, predchádzajúca VTE, obezita, varikózne vény, hormonálna liečba a chronické srdcové alebo respiračné zlyhanie).
Celkovo bolo v štúdii zaradených 1102 pacientov a 1073 pacientov bolo liečených. Liečba
pokračovala počas 6 až 14 dní (priemerné trvanie liečby 7 dní). Pri podávaní dávky 4 000 IU (40 mg)
jedenkrát denne s.c. enoxaparín sodný štatisticky významne znížil výskyt VTE v porovnaní
s placebom. Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
2 000 IU (20 mg) jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo
n (%)
enoxaparín sodný
2 000 IU (20 mg) jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo
n (%)
v
š
etci liečení interní pacienti
počas akútneho ochorenia
287 (100) 291(100) 288 (100)
celkovo VTE (%) 43 (15,0) 16 (5,5)* 43 (14,9)
· celkovo DVT (%) 43 (15,0) 16 (5,5) 40 (13,9)
· proximálna DVT (%) 13 (4,5) 5 (1,7) 14 (4,9)
VTE = venózne tromboembolické udalosti, ktoré zahŕňali DVT, PE a smrť z dôvodu tromboembólie
* p hodnota oproti placebu = 0,0002
Približne 3 mesiace po zaradení zostával výskyt VTE štatisticky významne nižší v skupine liečenej
enoxaparínom sodným 4 000 IU (40 mg) v porovnaní so skupinou liečenou placebom.
Výskyt krvácania celkovo bol 8,6 % a výskyt veľkého krvácania 1,1 % v skupine s placebom, 11,7 %
a 0,3 % v skupine s enoxaparínom sodným 2 000 IU (20 mg) a 12,6 % a 1,7 % v skupine s enoxaparínom sodným 4 000 IU (40 mg).
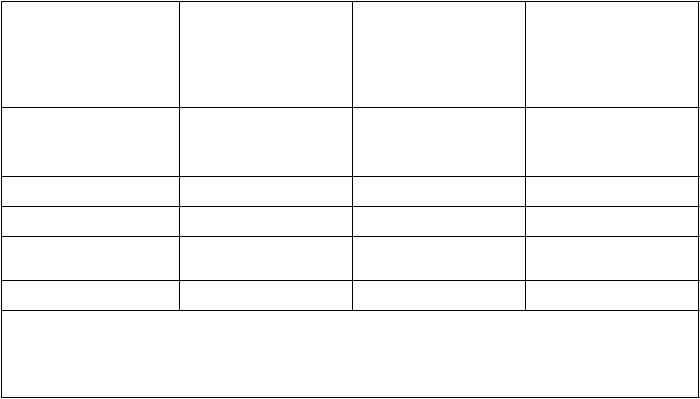
Liečba hlbokej žilovej trombózy s pľúcnou embóliou alebo bez nej
V multicentrickej štúdii s paralelnými skupinami bolo 900 pacientov s akútnou DVT dolnej končatiny s pľúcnou embóliou alebo bez nej randomizovaných na hospitalizačnú liečbu buď (i) enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát denne s.c., (ii) enoxaparínom sodným 100 IU/kg (1 mg/kg) každých 12 hodín s.c. alebo (iii) i.v. bolusom heparínu (5 000 IU), po ktorom nasledovala kontinuálna infúzia (podávaná s cieľom dosiahnuť aPTT 55 až 85 sekúnd). Celkovo bolo v štúdii
randomizovaných 900 pacientov a všetci pacienti boli liečení. Všetci pacienti dostávali aj liečbu
warfarínom sodným (dávka bola upravená podľa protrombínového času s cieľom dosiahnuť INR 2,0 až 3,0) so začiatkom v priebehu 72 hodín od začatia liečby enoxaparínom sodným alebo štandardnej liečby heparínom a pokračovaním počas 90 dní. Enoxaparín sodný alebo štandardná liečba heparínom sa podávala minimálne 5 dní a dovtedy, kým sa nedosiahol cieľový INR warfarínu sodného. Obidva režimy s enoxaparínom sodným boli rovnocenné ako štandardná heparínová liečba, pokiaľ ide
o zníženie rizika rekurencie venózneho tromboembolizmu (DVT a/alebo PE). Údaje týkajúce sa
účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
15
0 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
enoxaparín sodný
10
0 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
heparín
i.v. liečba upravovaná podľa aPTT
n (%)
enoxaparín sodný
15
0 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
enoxaparín sodný
10
0 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
heparín
i.v. liečba upravovaná podľa aPTT
n (%)
v
š
etci liečení pacienti s DVT s PE alebo bez nej
298 (100) 312 (100) 290 (100)
celkovo VTE (%) 13 (4,4)* 9 (2,9)* 12 (4,1)
· iba DVT (%) 11 (3,7) 7 (2,2) 8 (2,8)
· proximálna DVT (%)
9 (3,0) 6 (1,9) 7 (2,4)
· PE (%) 2 (0,7) 2 (0,6) 4 (1,4)
VTE = venózna tromboembolická udalosť (DVT a/alebo PE)
*interval spoľahlivosti 95 % pre rozdiely v liečbe celkovej VTE boli:
- enoxaparín sodný jedenkrát denne oproti heparínu (-3,0 až 3,5)
- enoxaparín sodný každých 12 hodín oproti heparínu (-4,2 až 1,7).
Veľké krvácanie bolo 1,7 % v skupine s enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát
denne, 1,3 % v skupine s enoxaparínom sodným 100 IU/kg (1 mg/kg) dvakrát denne a 2,1 % v skupine s heparínom.
Liečba nestabilnej angíny a infarktu myokardu bez elevácie ST
V rozsiahlej multicentrickej štúdii 3171 pacientov zaradených v akútnej faze nestabilnej anginy
pectoris alebo non-Q infarktu myokardu bolo randomizovaných do dvoch skupín tak, že pacienti
v jednej skupine dostávali spolu s kyselinou acetylsalicylovou (100 až 325 mg jedenkrát denne) buď s.c. injekciu enoxaparínu sodného v dávke 100 IU/kg (1 mg/kg) každých 12 hodín alebo i.v. nefrakcionovaný heparín upravený podľa aPTT. Pacienti museli byť hospitalizovaní minimálne 2 dni a maximálne 8 dní, až do klinickej stabilizácie, revaskularizačnej procedúry alebo prepustenia z
nemocnice. Pacienti museli byť sledovaní po dobu 30 dní. Enoxaparín sodný v porovnaní s heparínom štatisticky významne znížil kombinovaný výskyt anginy pectoris, infarktu myokardu a smrti s poklesom 19,8 až 16,6 % (redukcia relatívneho rizika 16,2 %) v deň 14. Táto redukcia v kombinovanom výskyte pretrvávala po 30 dňoch (od 23,3 do 19,8 %; redukcia relatívneho rizika
15 %).
Pokiaľ ide o veľké krvácanie, neboli zistené žiadne rozdiely, aj keď krvácanie v mieste podania s.c.
injekcie bolo častejšie.
Liečba akútneho infarktu myokardu s eleváciou ST-segmentu
V rozsiahlej multicentrickej štúdii bolo 20 479 pacientov so STEMI vhodných na fibrinolytickú liečbu randomizovaných do dvoch skupín; v jednej skupine dostali enoxaparín sodný ako jednu bolusovú i.v. dávku 3000 IU (30 mg) plus subkutánnu injekciu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg) a následne každých 12 hodín subkutánnu injekiu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg) a v druhej skupine dostávali intravenózne nefrakcionovaný heparín upravený podľa aPTT po dobu
48 hodín. Všetci pacienti boli taktiež liečení kyselinou acetylsalicylovou po dobu minimálne 30 dní. Stratégia dávkovania enoxaparínu bola prispôsobená pre pacientov so závažne zhoršenou funkciou
obličiek a pre starších pacientov vo veku 75 a viac rokov. Subkutánne injekcie enoxaparínu sa podávali dovtedy, kým pacient nebol prepustený z nemocnice alebo po dobu maximálne 8 dní (podľa toho, čo nastalo skôr).
4716 pacientov sa podrobilo perkutánnej koronárnej intervencii, pričom dostávali antitrombotickú
podpornú liečbu zaslepenými liekmi štúdie. Preto pre pacientov liečených enoxaparínom musela byť vykonaná PCI s enoxaparínom (žiadna zmena), pričom bol použitý režim stanovený
v predchádzajúcich štúdiách t.j. žiadne ďalšie dávkovanie, ak od posledného subkutánneho podania do insuflácie balónu uplynulo menej ako 8 hodín; i.v. bolus 30 IU/kg (0,3 mg/kg) enoxaparínu, ak od posledného subkutánneho podania do insuflácie balónu uplynulo viac ako 8 hodín.
Enoxaparín sodný v porovnaní s nefrakcionovaným heparínom štatisticky významne znížil výskyt
primárneho endpointu - smrti z akejkoľvek príčiny alebo re-infarktu myokardu v prvých 30 dňoch po randomizácii [9,9 percenta v skupine s enoxaparínom v porovnaní s 12,0 percentami v skupine
s nefrakcionovaným heparínom] pri redukcii relatívneho rizika 17 % (p<0,001).
Benefity liečby enoxaparínom (zjavné vo viacerých ukazovateľoch účinnosti) sa objavili už za 48 hodín, kedy redukcia relatívneho rizika re-infarktu myokardu bola 35 % v porovnaní s liečbou nefrakcionovaným heparínom (p<0,001).
Benefit enoxaparínu v primárnom ukazovateli bol konzistentný v rámci kľúčových podskupín vrátane veku, pohlavia, lokácie infarktu, anamnézy diabetu, anamnézy predchádzajúceho infarktu myokardu, typu použitého fibrinolytika a času do liečby študijným liekom.
Zistil sa štatisticky významný benefit liečby enoxaparínom v porovnaní s nefrakcionovaným heparínom u pacientov, ktorí sa podrobili perkutánnej koronárnej intervencii v priebehu 30 dní po randomizácii (23 % redukcia relatívneho rizika) alebo ktorí boli liečení konzervatívne (farmakologicky) (15 % redukcia relatívneho rizika, p = 0,27 pre interakciu).
Výskyt združeného ukazovateľa, ktorým bolo úmrtie, re-infarkt alebo intrakraniálne hemoragie na
30.deň (merané ako čistý klinický benefit) bol štatisticky významne nižší (p<0,0001) v skupine s enoxaparínom (10,1 %) v porovnaní so skupinou s heparínom (12,2 %), čo predstavuje 17 % redukciu relatívneho rizika v prínos liečby enoxaparínom sodným.
Výskyt veľkého krvácania po 30 dňoch bol štatisticky významne vyšší (p<0,0001) v skupine
s enoxaparínom sodným (2,1 %) oproti skupine s heparínom (1,4 %). Vyšší výskyt gastrointestinálneho krvácania bol v skupine s enoxaparínom sodným (0,5 %) oproti skupine s heparínom (0,1 %), zatiaľ čo výskyt intrakraniálneho krvácania bol podobný v obidvoch skupinách (0,8 % s enoxaparínom sodným oproti 0,7 % s heparínom).
Prospešný účinok enoxaparínu na primárny endpoint pozorovaný počas prvých 30 dní sa zachoval
počas 12 mesiacov sledovania.
Porucha funkcie pečene
Podľa lietrárnych údajov sa používanie enoxaparínu v dávke 4 000 IU (40 mg) u pacientov s cirhózou (Child-Pugh trieda B-C) zdá byť bezpečné a účinné v prevencii trombózy portálnej vény. Treba poznamenať, že literárne štúdie môžu mať určité obmedzenia. U pacientov s poruchou pečene je
potrebná opatrnosť, pretože títo pacienti majú vyšší potenciál krvácania (pozri časť 4.4) a u pacientov s cirhózou (Child-Pugh trieda A,B, C) sa žiadne štúdie týkajúce sa formálneho stanovenia dávky
neuskutočnili.
5.2 Farmakokinetické vlastnosti
Všeobecnácharakteristika
Farmakokinetické parametre enoxaparínu sodného sa sledovali najmä vo vzťahu k časovému priebehu plazmatickej anti-Xa aktivity a tiež anti-IIa aktivity v odporúčaných dávkach a to po jednorazovom a opakovanom subkutánnom podaní a po jednorazovom i.v. podaní.
Kvantitatívne hodnotenie anti-Xa a anti-IIa farmakokinetických aktivít sa robilo validovanými
amidolytickými metódami.
Absorpcia
Absolútna biologická dostupnosť enoxaparínu sodného po s.c. injekcii vychádzajúca z anti-Xa aktivity
je približne 100 %.
Môžu sa použiť rôzne dávky, formy a dávkovacie režimy.
Priemernú maximálnu plazmatickú anti-Xa aktivitu možno pozorovať 3 až 5 hodín po subkutánnej
injekcii a dosahuje približne 0,2, 0,4 a 1,0 a 1,3 IU/ml po jednorazovej s.c. aplikácii 2000 IU, 4000 IU,
100 IU/kg a 150 IU/kg (20 mg, 40 mg, 1 mg/kg a 1,5 mg/kg) v uvedenom poradí.
Intravenózna bolusová dávka 3000 IU (30 mg), po ktorej bezprostredne nasleduje dávka 100 IU/kg (1 mg/kg) podaná subkutánne každých 12 hodín, poskytuje počiatočný vrchol hladiny faktoru anti- Xa 1,16 IU/ml (n=16) a priemerná expozícia zodpovedá 88 % hladiny v stabilizovanom stave. Stabilizovaný stav sa dosahuje na druhý deň liečby.
Po opakovanom subkutánnom podaní dávky 4000 IU (40 mg) raz denne a dávky 150 IU/kg
(1,5 mg/kg) raz denne zdravým dobrovoľníkom, sa dosiahne ustálený stav na 2.deň a priemerná miera expozície je asi o 15 % vyššia ako po jednorazovom podaní. Po opakovanom subkutánnom podaní
dávky 100 anti-Xa IU/kg dvakrát denne sa ustálený stav dosiahne od 3. po 4.deň a má priemernú expozíciu asi o 65 % vyššiu ako po jednorazovom podaní, maximálnu priemernú hodnotu 1,2 IU/ml
a minimálnu hodnotu 0,52 IU/ml.
Injekčný objem a koncentrácia dávky v rozmedzí 100-200 mg/ml nemá vplyv na farmakokinetické parametre u zdravých dobrovoľníkov.
Farmakokinetika enoxaparínu po podaní dávok vyšších ako sú odporúčané dávky je lineárna.
Premenlivosť v rámci organizmu alebo medzi viacerými pacientami je nízka. Po opakovanom s.c.
podávaní sa akumulácia nezistila.
Plazmatická anti-IIa aktivita enoxaparínu je po subkutánnom podaní približne 10-krát nižšia ako anti- Xa aktivita. Priemerná maximálna anti-IIa aktivita sa pozoruje približne 3 - 4 hodiny a dosahuje po subkutánnom podaní 100 IU/kg dvakrát denne 0,13 IU/ml a po subkutánnom podaní 150 IU/kg
(1,5 mg/kg) jedenkrát denne 0,19 IU/ml.
Distribúcia
Distribučný objem anti-Xa aktivity enoxaparínu sodného je asi 4,3 litrov a je blízky krvnému objemu.
Biotransformácia
Enoxaparín sodný sa primárne metabolizuje v pečeni desulfatizáciou a/alebo depolymerizáciou na zložky s nižšou molekulovou hmotnosťou s omnoho nižšou biologickou účinnosťou.
Eliminácia
Enoxaparín sodný je liek s nízkym klírens s priemerným klírensom plazmatickej anti-Xa aktivity po
podaní dávky 150 IU/kg (1,5 mg/kg) 6-hodinovou i.v. infúziou 0,74 l/hod.
Eliminácia sa javí byť jednofázová a eliminačný polčas anti-Xa aktivity je približne 5 hodín po jednorazovom subkutánnom podaní až približne 7 hodín po opakovanom podaní enoxaparínu sodného. Renálny klírens aktívnych fragmentov predstavuje približne 10 % podanej dávky a celková renálna exkrécia aktívnych a neaktívnych fragmentov je 40 % dávky.
Špeciálneskupinypacientov
Starší ľudia
Na základe výsledkov farmakokinetickej analýzy sa zistilo, že pokiaľ je zachovaná normálna funkcia obličiek, kinetický profil enoxaparínu sodného sa u starších osôb v porovnaní s mladšími nelíši. Avšak
je známe, že funkcia obličiek sa s vekom znižuje a teda eliminácia enoxaparínu sodného u starších
pacientov môže byť znížená (pozri časti 4.2 a 4.4).
Porucha funkcie pečene
V štúdii, ktorá sa robila u pacientov s pokročilou cirhózou liečených enoxaparínom sodným 4 000 IU (40 mg) jedenkrát denne bol pokles v maxime anti-Xa aktivity spojený s vzostupom závažnosti poškodenia pečene (hodnotené podľa Child-Pugh kategórií). Tento pokles bol pripisovaný hlavne poklesu hladiny ATIII, sekundárne zníženej syntéze ATIII u pacientov s poruchou funkcie pečene.
Porucha funkcie obličiek
Medzi klírensom plazmatickej anti-Xa aktivity a klírensom kreatinínu bol v ustálenom stave pozorovaný lineárny vzťah, čo naznačuje zníženie klírensu enoxaparínu sodného u pacientov s poruchou funkcie obličiek. Po opakovanej subkutánnej dávke 4000 IU raz denne je expozícia anti-Xa aktivity, vyjadrená AUC v ustálenom stave, pri mierne (klírens kreatinínu 50-80 ml/min) a pri stredne ťažkej (klírens kreatnínu 30-50 ml/min) poruche funkcie obličiek okrajovo zvýšená. U pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu <30 ml/min) je AUC v ustálenom stave, po opakovaných subkutánnych dávkach 4000 IU raz denne, významne zvýšená (priemerne o 65 %) (pozri časti 4.2 a 4.4).
Hemodialýza
Po jednorazovom i.v. podaní enoxaparínu sodného v dávke 25 IU, 50 IU alebo 100 IU/kg (0,25, 0,50 alebo 1,0 mg/kg) bola jeho farmakokinetika podobná ako u kontrolovanej populácie, avšak AUC bola dvakrát vyššia ako u kontrolovanej populácie.
Telesná hmotnosť
Po opakovaných s.c. dávkach 150 IU/kg (1,5 mg/kg) jedenkrát denne je priemerná AUC anti-Xa aktivity v ustálenom stave u obéznych zdravých dobrovoľníkov (BMI index 30-48 kg/m2) v porovnaní s osobami s normálnou hmotnosťou okrajovo zvýšená, zatiaľ čo maximálna plazmatická hladina anti-Xa aktivity zvýšená nie je. U obéznych pacientov je po subkutánnom podaní nižší hmotnosťou ovplyvnený klírens.
Po jednorazovom subkutánnom podaní enoxaparínu sodného v dávke 4000 IU (dávka nebola upravená na základe hmotnosti pacienta) ženám (<45 kg) a mužom (<57 kg) s nízkou hmotnosťou bolo zistené, že expozícia anti-Xa aktivity je v porovnaní s osobami s normálnou hmotnosťou u žien o 52 %
a u mužov o 27 % vyššia (pozri časť 4.4).
Farmakokinetickéinterakcie
Pri súbežnom podaní enoxaparínu a trombolytika sa nepozorovali žiadne farmakokinetické interakcie.
5.3 Predklinické údaje o bezpečnosti
V 13-týždňových štúdiach toxicity, kde sa podával s.c. enoxaparín potkanom a psom v dávke
15 mg/kg/deň a v 26 týždňových štúdiach toxicity, kde sa podával enoxaparín s.c. a i.v. potkanom
a opiciam v dávke 10 mg/kg/deň sa iné nežiaduce účinky enoxaparínu okrem antikoagulačného účinku nedokázali.
Nasledujúce testy nepreukázali mutagénne účinky enoxaparínu: Amesov test in-vitro, progresívny mutačný test na bunkách myšacích lymfómov in-vitro, humánny lymfocytový test chromozomálnych aberácií in-vitro a in-vivo test chromozomálnych aberácií na kostnej dreni potkanov.
Štúdie vykonané u gravidných samíc potkanov a králikov s dávkami enoxaparínu sodného do
30 mg/kg/deň nepreukázali žiadne teratogénne účinky ani fetotoxicitu. Po s.c. podaní dávky nižšej ako
20 mg/kg/deň nemal enoxaparín vplyv na fertilitu ani na reprodukčné schopnosti potkaních samcov
a samíc.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
voda na injekciu
6.2 InkompatibilitySubkutánnainjekciaInhixa sa nesmie miešať so žiadnymi inými injekciami alebo infúziou.
Intravenózna injekcia (bolus) ibapreakútnuindikáciuSTEMI.Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnostiNaplnenástriekačka3 roky
Zriedenýlieks injekčnýmroztokomchloridusodného9 mg/ml (0,9 %)alebo5%glukózyvovode8 hodín
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25 ° C. Neuchovávajte v mrazničke.
6.5 Druh obalu a obsah balenia0,2 ml roztoku v:
- sklenenej striekačke z číreho bezfarebného neutrálneho skla typu I s pevnou ihlou a krytom ihly
uzavretým chlórbutylovou gumovou zátkou a s modrým polypropylénovým piestom. Injekčné striekačky môžu byť dodatočne vybavené poistným prvkom, ktorý chráni proti pichnutiu ihlou po vykonaní injekcie; alebo
- sklenenej striekačke z číreho bezfarebného neutrálneho skla typu I s pevnou ihlou a krytom ihly
uzavretým chlórbutylovou gumovou zátkou a s bielym polykarbonátovým piestom. Injekčné striekačky môžu byť dodatočne vybavené poistným UltraSafe Passive prvkom, ktorý chráni
proti pichnutiu ihlou po vykonaní injekcie.
Balenia s:
- 1 naplnená injekčná striekačka a 2, 6, 10 naplnenými striekačkami
- 2, 6, 10 a 20 naplnenými striekačkami s ochranným krytom ihly
- 2 a 6 naplnenými striekačkami s UltraSafe Passive ochranným krytom ihly
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomNÁVOD NA POUŽÍVANIE: NAPLNENÁ INJEKČNÁ STRIEKAČKAAko máte podávať injekciu Inhixa sám sebe
Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak si nie
ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa
- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.
- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej
sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená

vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
 Pamätajte:
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto
podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená

a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e . 6)
6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný
záhyb držíte počas celého podávania injekcie.
8) Rovným ťahom ihlu vytiahnite.
 A
by ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
9)
A
by ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
9) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré

predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.Ako máte podávať injekciu Inhixa sám sebe
Naplnená injekčná striekačka môže mať priložený ochranný kryt ihly, ktorý chráni pred poranením ihlou. Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to

máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak
si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.
- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte
miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
 2)
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená

a pripravená na použitie.

Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .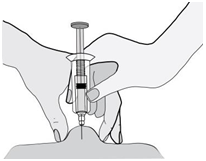 6)
6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný
záhyb držíte počas celého podávania injekcie.
 8)
8) Rovným ťahom ihlu vytiahnite. Neprestávajte stláčať piest!
Aby ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.9) Stlačte silno piest striekačky. Poistný prvok ihly, ktorý má podobu plastového cylindra, sa
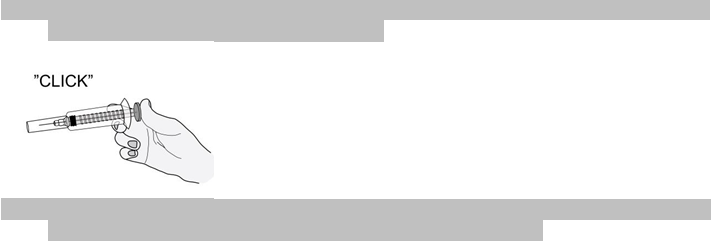
automaticky nasunie na ihlu a celú ju zakryje.
10) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré
predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Ako máte podávať injekciu Inhixa sám sebe
Naplnená injekčná striekačka môže mať priložený UltraSafe Passive ochranný kryt ihly, ktorý chráni pred poranením ihlou. Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.
- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte
miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
 2)
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená
a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.
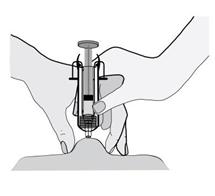 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný
záhyb držíte počas celého podávania injekcie.
 8)
8) Rovným ťahom ihlu vytiahnite. Neprestávajte stláčať piest!
Aby ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.9) Uvoľnite piest a nechajte injekčnú striekačku vysunúť, pokiaľ nie je celá ihla chránená a kryt

nezapadne na miesto.
10) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré
predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITechdow Europe AB
Kåbovägen 32
75236 Uppsala
Švédsko
8. REGISTRAČNÉ ČÍSLO
EU/1/16/1132/001
EU/1/16/1132/002
EU/1/16/1132/011
EU/1/16/1132/012
EU/1/16/1132/021
EU/1/16/1132/023
EU/1/16/1132/033
EU/1/16/1132/034
EU/1/16/1132/053
EU/1/16/1132/054
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 15/09/2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUInhixa 4 000 IU (40 mg) /0,4 ml injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE10 000 IU/ml (100 mg/ml) injekčný roztokKaždá naplnená injekčná striekačka obsahuje enoxaparín sodný 4 000 IU anti-Xa aktivity (čo
zodpovedá 40 mg) v 0,4 ml vody na injekciu.
Úplný zoznam pomocných látok, pozri časť 6.1
Enoxaparín sodný je biologické liečivo získané alkalickou depolymerizáciou benzylesteru heparínu derivovaného z prasacej črevnej sliznice.
3. LIEKOVÁ FORMAInjekčný roztok v naplnenej injekčnej striekačke. Číry, bezfarebný až svetložltý roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieInhixa je indikovaný u dospelých:
· Prevencia venóznej tromboembolickej choroby v chirurgii u pacientov so stredným a vysokým rizikom, najmä v ortopedickej alebo všeobecnej chirurgii vrátane onkologickej chirurgie.
· Prevencia venóznej tromboembolickej choroby u interných pacientov s akútnymi ochoreniami
(ako je akútna srdcová nedostatočnosť, respiračné zlyhanie, ťažké infekcie alebo reumatické ochorenia) a zníženou mobilitou so zvýšeným rizikom vzniku venóznej tromboembolickej choroby.
· Liečba hlbokej žilovej trombózy (DVT) a pľúcnej embolizácie (PE) okrem PE, ktorá by mohla
vyžadovať trombolytickú liečbu alebo operáciu.
· Prevencia tvorby trombov v mimotelovom obehu počas dialýzy.
· Akútny koronárny syndróm:
- Liečba nestabilnej angíny a infarktu myokardu bez elevácie ST-segmentu (NSTEMI) v
kombinácii s kyselinou acetylsalicylovou, ktorá sa užíva perorálne.
- Liečba akútneho infarktu myokardu s eleváciou ST-segmentu (STEMI) vrátane pacientov, u ktorých sa plánuje konzervatívna (farmakologická) liečba alebo pacientov s následnou perkutánnou koronárnou intervenciou (PCI).
4.2 Dávkovanie a spôsob podávaniaDávkovaniePrevencia venóznej tromboembolickej choroby v chirurgii u pacientov so stredným a vysokýmrizikom
Individuálne riziko tromboembólie u pacientov možno odhadnúť pomocou validovaného modelu stratifikácie rizika.
· U pacientov so stredným rizikom vzniku tromboembólie je odporúčaná dávka 2 000 IU (20 mg)
enoxaparínu sodného jedenkrát denne subkutánnou (s.c.) injekciou. Pri chirurgických výkonoch so stredným rizikom sa ukázalo ako účinné a bezpečné začať podávať enoxaparín sodný 2 000 IU
(20 mg) pred operáciou (2 hodiny pred operáciou).
U pacientov so stredným rizikom je potrebné pokračovať v profylaxii enoxaparínom sodným minimálne 7-10 dní bez ohľadu na to, ako sa pacient zotavuje (napr. mobilita), až kým sa pacient nezotaví z výrazne zníženej mobility.
· U pacientov s vysokým rizikom tromboembólie je odporúčaná dávka 4 000 IU (40 mg)
enoxaparínu sodného jedenkrát denne subkutánnou (s.c.) injekciou so začatím prednostne
12 hodín pred operáciou. Ak je potrebné začať profylaxiu skôr ako 12 hodín pred operáciou (napr. pacient s vysokým rizikom čakajúci na odloženú ortopedickú operáciu), posledná injekcia sa nemá podať neskôr ako 12 hodín pred operáciou a pokračovať 12 hodín po operácii.
o U pacientov podrobujúcich sa veľkej ortopedickej operácii sa odporúča predĺžiť
tromboprofylaxiu až do 5 týždňov.
o U pacientov s vysokým rizikom venóznej tromboembólie (VTE) podrobujúcich sa brušnej alebo panvovej operácii kvôli nádorovému ochoreniu sa odporúča predĺžiť tromboprofylaxiu až do 4 týždňov.
Profylaxia venóznej tromboembólie u interných pacientov
Odporúčaná dávka enoxaparínu sodného je 4 000 IU (40 mg) jedenkrát denne s.c. injekciou.
Liečba enoxaparínom sodným sa predpisuje najmenej na 6 až 14 dní bez ohľadu na to, ako sa pacient
zotavuje (napr. mobilita). Prínos liečby trvajúcej viac ako 14 dní sa nepotvrdil.
Liečba hlbokej žilovej trombózy (DVT) a pľúcnej embolizácie (PE)
Enoxaparín sodný sa môže podávať s.c. injekciou buď jedenkrát denne 150 IU/kg (1,5 mg/kg), alebo
dvakrát denne 100 IU/kg (1 mg/kg).
Režim musí zvoliť lekár na základe individuálneho posúdenia a vyhodnotenia rizika tromboembólie a rizika krvácania. Dávkovací režim 150 IU/kg (1,5 mg/kg) jedenkrát denne sa má použiť u nekomplikovaných pacientov s nízkym rizikom rekurencie VTE. U všetkých ostatných pacientov, ako sú pacienti s obezitou, symptomatickou PE, onkologickým ochorením, rekurentnou VTE alebo proximálnou trombózou (vena iliaca) sa má použiť dávkovací režim 100 IU/kg (1 mg/kg) dvakrát denne.
Liečba enoxaparínom sodným sa predpisuje priemerne na 10 dní. Liečbu perorálnymi antikoagulanciami treba začať, keď je to vhodné (pozri “Prechod medzi enoxaparínom sodným a perorálnymi antikoagulaciami” na konci časti 4.2).
Prevencia tvorby trombov v mimotelovom obehu počas dialýzy
Odporúčaná dávka je 100 IU/kg (1 mg/kg) enoxaparínu sodného.
U pacientov s vysokým rizikom krvácania sa má dávka znížiť na 50 IU/kg (0,5 mg/kg) pri dvojitom
cievnom prístupe alebo na 75 IU/kg (0,75 mg/kg) pri jednoduchom cievnom prístupe.
Počas dialýzy sa má enoxaparín sodný zaviesť do arteriálnej linky na začiatku dialýzy. Účinok tejto dávky je zvyčajne dostatočný pre 4-hodinovú dialýzu, ak sa však zistí prítomnosť fibrínových prstencov, napríklad pri dialýze trvajúcej dlhšie ako je bežné, môže sa podať ďalšia dávka 50 IU až
100 IU/kg (0,5 až 1 mg/kg).
Nie sú k dispozícii žiadne údaje týkajúce sa pacientov používajúcich enoxaparín sodný na profylaxiu alebo na liečbu v priebehu podávania dialýzy.
Akútny koronárny syndróm: liečba nestabilnej angíny a infarktu myokardu bez elevácie ST-segmentu
(NSTEMI) a akútneho infarktu myokardu s eleváciou ST-segmentu (STEMI)
· Na liečbu nestabilnej angíny a NSTEMI je odporúčaná dávka enoxaparínu sodného 100 IU/kg
(1 mg/kg) každých 12 hodín subkutánnou injekciou podávanou v kombinácii s antiagregačnou
liečbou. V liečbe treba pokračovať minimálne 2 dni a potom až do klinickej stabilizácie. Zvyčajná dĺžka liečby je 2 až 8 dní.
Všetkým pacientom sa odporúča podávať kyselinu acetylsalicylovú, ak nie je kontraindikovaná, so
začiatočnou perorálnou dávkou 150–300 mg (u pacientov bez predchádzajúcej liečby kyselinou acetylsalicylovou) a udržiavaciou dávkou 75–325 mg/deň, ktorá sa podáva dlhodobo bez ohľadu na stratégiu liečby.
· Na liečbu akútneho infarktu myokardu s eleváciou ST-segmentu STEMI je odporúčaná dávka enoxaparínu sodného jedna bolusová dávka 3000 IU (30 mg) podaná intravenózne (i.v.) plus dávka 100 IU/kg (1 mg/kg) podaná subkutánne (s.c.). Následne sa podáva dávka 100 IU/kg
(1 mg/kg) s.c. každých 12 hodín (s obmedzením na maximálne 10 000 IU (100 mg) na každú

z prvých dvoch dávok podaných s.c.). Súbežne sa má podávať vhodná antiagregačná liečba, ako je perorálne podávanie kyseliny acetylsalicylovej (75 mg až 325 mg jedenkrát denne), ak nie je kontraindikovaná. Odporúča sa, aby liečba enoxaparínom sodným trvala 8 dní alebo dovtedy, kým pacient neprejde do ambulantnej liečby, podľa toho, čo nastane skôr. Ak sa enoxaparín sodný podáva s trombolytikom (fibrín špecifickým alebo fibrín nešpecifickým), musí sa enoxaparín sodný podať v časovom rozmedzí 15 minút pred a 30 minút po začiatku fibrinolytickej liečby.
o Dávkovanie u pacientov vo veku ≥ 75 rokov je uvedené v časti “Starší ľudia”.
o U pacientov liečených perkutánnou koronárnou intervenciou (PCI) nie je potrebná
žiadna dodatočná dávka, ak bol enoxaparín sodný naposledy podaný subkutánne pred
menej ako ôsmimi hodinami pred insufláciou balónu. Ak bol enoxaparín sodný naposledy podaný subkutánne pred viac ako ôsmimi hodinami pred insufláciou
balónu, musí sa podať dávka 30 IU/kg (0,3 mg/kg) enoxaparínu sodného ako i.v.
bolusová dávka.
Pediatrická populáciaBezpečnosť a účinnosť enoxaparínu nebola u pediatrickej populácie stanovená.
Starší ľudiaPre všetky indikácie okrem STEMI u starších pacientov nie je potrebná úprava dávky, s výnimkou prípadov s poruchou funkcie obličiek (pozri časti “Porucha funkcie obličiek” a časť 4.4).
Na liečbu akútneho STEMI u pacientov vo veku 75 a viac rokov, sa počiatočná intravenózna
bolusová dávka nesmie použiť. Začnite dávkovanie subkutánnou dávkou 75 IU/kg (0,75 mg/kg)
každých 12 hodín (s obmedzením na maximum 7 500 IU (75 mg) len pre každú z prvých dvoch dávok podaných subkutánne, potom pre zostávajúce ďalšie dávky je odporúčané dávkovanie 75 IU/kg
(0,75 mg/kg) subkutánne). Dávkovanie u starších pacientov s poruchou funkcie obličiek je uvedené
nižšie v časti “Porucha funkcie obličiek” a v časti 4.4.
Porucha funkcie pečeneU pacientov s poruchou funkcie pečene sú k dispozícii len obmedzené údaje (pozri časti 5.1 a 5.2) a treba u nich postupovať s opatrnosťou (pozri časť 4.4).
Porucha funkcie obličiek (pozri časti 4.4 a 5.2)· Závažná porucha funkcie obličiek
Enoxaparín sodný sa neodporúča u pacientov v terminálnom štádiu ochorenia obličiek (klírens kreatinínu <15 ml/min) pre nedostatok údajov v tejto populácii, okrem prevencie tvorby trombov v mimotelovom obehu počas hemodialýzy.
Tabuľka s dávkovaním pre pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu [15-
30] ml/min):
Indikácia Dávkovanie
Prevencia venóznej tromboembolickej choroby 2 000 IU (20 mg) s.c. jedenkrát denne
Liečba DVT a PE 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. jedenkrát
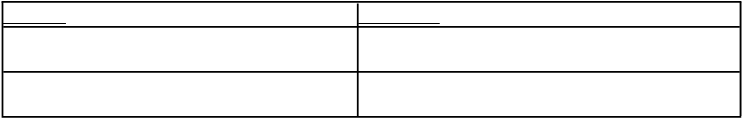
denne
Liečba angíny a NSTEMI 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. jedenkrát
denne
Liečba akútneho STEMI (pacienti vo veku do
75 rokov)
Liečba akútneho STEMI (pacienti vo veku nad
75 rokov)
1 x 3 000 IU (30 mg) IV bolus plus 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. a potom 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. každých 24 hodín
Bez i.v. úvodného bolusu, 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. a potom 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. každých 24 hodín
Úprava odporúčaného dávkovania sa nevzťahuje na indikáciu týkajúcu sa hemodialýzy.
· Stredne ťažká a mierna porucha funkcie obličiek
Aj keď pacientom so stredne ťažkou (klírens kreatinínu 30-50 ml/min) alebo miernou (klírens
kreatinínu 50-80 ml/min) poruchou funkcie obličiek nie je nutné dávku upravovať, odporúča sa dôsledné klinické sledovanie.
Spôsobpodávania
Inhixa sa nemá podávať intramuskulárne.
Na profylaxiu venóznej tromboembolickej choroby po chirurgickom zákroku, na liečbu DVT a PE, na liečbu nestabilnej angíny a NSTEMI sa enoxaparín sodný má podávať s.c. injekciou.
· Pri akútnom STEMI sa liečba začína jednou i.v. bolusovou injekciou, po ktorej ihneď nasleduje
s.c. injekcia.
· Na prevenciu tvorby trombov v mimotelovom obehu počas dialýzy sa podáva do arteriálnej linky dialyzačného obvodu.
Naplnená injekčná striekačka je pripravená na okamžité použitie.
Pri používaní ampuliek alebo viacdávkových injekčných liekoviek sa odporúča použiť tuberkulínovú injekčnú striekačku alebo ekvivalent, aby sa tým zabezpečilo, že bude do injekčnej striekačky natiahnutý správny objem lieku.
· s.c. injekčná technika:
Injekcia enoxaparínu sodného sa má podávať pacientovi prednostne v ležiacej polohe hlbokou s.c.
injekciou.
Ak používate naplnenú injekčnú striekačku, pred podaním injekcie z nej neodstrekujte vzduchovú bublinu, aby sa zabránilo stratám lieku. Ak je potrebné upraviť množstvo lieku, ktoré sa má podať, podľa telesnej hmotnosti pacienta, použite na dosiahnutie požadovaného množstva kalibrovanú injekčnú striekačku a prebytočné množstvo zlikvidujte. Uvedomte si, že v niektorých prípadoch nie je možné dosiahnuť presnú dávku kvôli kalibrácii (dielikom) na injekčnej striekačke, vtedy treba objem zaokrúhliť na najbližšiu hodnotu (najbližší dielik).
Injekcia sa má podávať do ľavej a pravej anterolaterálnej alebo posterolaterálnej časti brušnej steny.
Celá dĺžka ihly sa zavedie kolmo do kožného záhybu vytvoreného medzi palcom a ukazovákom. Kožný záhyb sa nemá uvoľniť dovtedy, kým injekcia nie je podaná celá. Po podaní injekcie miesto podania nemasírujte.
Poznámka pre naplnené injekčné striekačky s automatickým bezpečnostným systémom: bezpečnostný systém sa aktivuje na konci injekcie (pozri pokyny v časti 6.6).
Ak si bude pacient podávať subkutánnu injekciu sám, pacienta treba upozorniť, aby si veľmi pozorne prečítal pokyny v písomnej informácii pre používateľa, ktorá je súčasťou balenia lieku.
i.v. (bolus) injekcia (len pre indikáciu STEMI):
Pri akútnom STEMI sa liečba začína jednou i.v. bolusovou injekciou, za ktorou ihneď nasleduje s.c.
injekcia.
Pri i.v. injekcii sa môže použiť buď viacdávková injekčná liekovka alebo naplnená injekčná striekačka.
Enoxaparín sodný sa má podať do i.v. linky. Nemá sa miešať ani podávať spolu s inými liekmi. Na zabránenie možnosti zmiešania enoxaparínu sodného s inými liekmi sa musí vybraný intravenózny prístup pred a aj po intravenóznej aplikácii enoxaparínu sodného premyť dostatočným množstvom soľného roztoku alebo roztoku dextrózy na vyčistenie prístupu pre liek. Enoxaparín sodný sa môže bezpečne podať spolu s normálnym roztokom chloridu sodného (soľný roztok) (0,9 %) alebo s 5 %- ným vodným roztokom dextrózy.
oÚvodný bolus 3 000 IU (30 mg)
Pomocou kalibrovanej naplnenej injekčnej striekačky odstreknite nadbytočný objem tak, aby injekčná
striekačka obsahovala len 3000 IU (30 mg, 0,3 ml) enoxaparínu sodného. Dávka 3000 IU (30 mg) sa
potom podáva priamo do intravenóznej linky.
oDodatočný bolus pri PCI v prípade, že sa posledné s.c. podanie uskutočnilo pred viac ako
8 hodinami pred insufláciou balónu
Pre pacientov liečených PCI sa má podať dodatočný i.v. bolus 30 IU/kg (0,3 mg/kg) a to vtedy, keď bol enoxaparín sodný naposledy podaný subkutánne pred viac ako 8 hodinami pred insufláciou balónu.
Na zabezpečenie presného odmerania malého objemu injekcie sa odporúča nariediť liek na 300 IU/ml (3 mg/ml). Na dosiahnutie koncentrácie 300 IU/ml (3 mg/ml) s použitím naplnených injekčných striekačiek obsahujúcich 6000 IU (60 mg) enoxaparínu sodného sa odporúča použiť infúzny vak
s objemom 50 ml (napr. použiť fyziologický roztok (0,9 %) alebo 5 %-ný vodný roztok dextrózy)
nasledujúcim spôsobom:
Injekčnou striekačkou odoberte z infúzneho vaku 30 ml roztoku a tento odobraný roztok odstráňte. Celý obsah naplnenej injekčnej striekačky obsahujúcej 6000 IU (60 mg) enoxaparínu sodného vstreknite do vaku k zostávajúcim 20 ml roztoku. Obsah vaku jemne premiešajte. Naberte požadovaný objem nariedeného roztoku do injekčnej striekačky určenej na podanie roztoku do intravenóznej linky.
Po ukončení riedenia sa dá vypočítať potrebný objem, ktorý je potrebný na podanie v injekcii, pomocou tohto vzorca: [objem nariedeného roztoku (ml) = hmotnosť pacienta (kg) x 0,1] alebo podľa nižšie uvedenej tabuľky. Riedenie roztoku sa odporúča robiť bezprostredne pred použitím.
Objem roztoku, ktorý má byť po nariedení podaný do i.v. linky v koncentrácii 300 IU (3 mg) /ml.
h
m
o
t
nosť požadovaná dávka
3
0 IU/kg (0,3 mg/kg)
o
bjem, ktorý má byť
podaný po nariedení na konečnú koncentráciu
30
0 IU (3 mg) / ml
[
k
g
] IU [mg] [ml]
45 1350 13,5 4,5
50 1500 15 5
55 1650 16,5 5,5
60 1800 18 6
65 1950 19,5 6,5
70 2100 21 7
75 2250 22,5 7,5
80 2400 24 8
85 2550 25.5 8.5
90 2700 27 9
95 2850 28,5 9,5
100 3000 30 10
105 3150 31,5 10,5
110 3300 33 11
115 3450 34.5 11.5
120 3600 36 12
125 3750 37,5 12,5
130 3900 39 13
135 4050 40,5 13,5
140 4200 42 14
145 4350 43,5 14,5
150 4500 45 15
· Injekcia do arteriálnej linky:
Podáva sa do arteriálnej linky dialyzačného obvodu na prevenciu tvorby trombov v mimotelovom
obehu počas hemodialýzy.
Prechodmedzienoxaparínomsodnýmaantikoagulanciami
· Prechod medzi enoxaparínom sodným a antagonistami vitamínu K (VKA)
Je nutné zintenzívniť klinické monitorovanie a laboratórne testy [protrombínový čas vyjadrený ako
International Normalized Ratio (INR)] s cieľom sledovať účinok VKA.
Nakoľko je tu časový interval, kým VKA dosiahne svoj maximálny účinok, liečba enoxaparínom sodným musí pokračovať v konštantnej dávke tak dlho, ako je to nutné na udržanie INR
v požadovanom terapeutickom rozsahu v danej indikácii v dvoch po sebe nasledujúcich testoch. U pacientov liečených VKA je potrebné liečbu VKA ukončiť a prvú dávku enoxaparínu sodného podať vtedy, keď INR poklesne pod terapeutický rozsah.
· Prechod medzi enoxaparínom sodným a priamymi perorálnymi antikoagulanciami (DOAC) U pacientov, ktorí dostávajú v súčasnosti enoxaparín sodný, je potrebné ukončiť túto liečbu a začať s užívaním DOAC od 0 do 2 hodín pred časom určeným pôvodne na podanie ďalšej dávky enoxaparínu sodného, dávkovanie DOAC sa má použiť tak, ako je uvedené v jeho SPC.
U pacientov, ktorí užívajú v súčasnosti DOAC, sa má prvá dávka enoxaparínu sodného podať v čase,
kedy sa pôvodne mala užiť ďalšia dávka DOAC.
Podanieprispinálnej/epidurálnejanestéziialebolumbálnejpunkcii
Ak sa lekár rozhodne podať antikoagulačnú liečbu v súvislosti s epidurálnou alebo spinálnou anestéziou/analgéziou alebo lumbálnou punkciou, odporúča sa dôsledné neurologické monitorovanie kvôli riziku neuraxiálnych hematómov (pozri časť 4.4).
- Pri dávkach používaných na prevenciu
Medzi poslednou injekciou enoxaparínu sodného pri profylaktických dávkach a zavedením ihly alebo katétra sa musí zachovať časový interval bez punkcie najmenej 12 hodín.
Pri kontinuálnych technikách sa má zachovať podobný posun najmenej 12 hodín pred odstránením katétra.
Pre pacientov s klírensom kreatinínu [15-30] ml/min treba uvažovať so zdvojnásobením časového intervalu punkcia/zavedenie katétra alebo odstránenie katétra na najmenej 24 hodín. Začatie liečby enoxaparínom sodným v dávke 2 000 IU (20 mg) 2 hodiny pred operáciou nie je kompatibilné s neuraxiálnou anestéziou.
- Pri dávkach používaných na liečbu
Medzi poslednou injekciou enoxaparínu sodného pri kuratívnych dávkach a zavedením ihly alebo katétra sa musí zachovať časový interval bez punkcie najmenej 24 hodín (pozri aj časť
4.3).
Pri kontinuálnych technikách sa má zachovať podobný posun najmenej 24 hodín pred odstránením katétra.
Pre pacientov s klírensom kreatinínu [15-30] ml/min treba uvažovať so zdvojnásobením časového intervalu punkcia/zavedenie katétra alebo odstránenie katétra na najmenej 48 hodín. Pacienti dostávajúci dávky dvakrát denne (t.j. 75 IU/kg (0,75 mg/kg) dvakrát denne alebo
100 IU/kg (1 mg/kg) dvakrát denne) majú vynechaťdruhú dávku enoxaparínu kvôli umožneniu dostatočného časového posunu pre zavedenie alebo odstránenie katétra.
Hladina anti-Xa je v týchto časových bodoch stále ešte detekovateľná a toto posunutie negarantuje, že
sa zabráni vytvoreniu neuraxiálneho hematómu.
Rovnako treba zvážiť posunutie času podania enoxaparínu sodného o najmenej 4 hodiny po spinálnej/epidurálnej punkcii alebo po odstránení katétra. Tento časový posun musí vychádať
z vyhodnotenia pomeru prínos - riziko berúc do úvahy aj riziko trombózy aj riziko krvácania
v kontexte liečby a rizikových faktorov konkrétneho pacienta.
4.3 Kontraindikácie
Enoxaparín sodný je kontraindikovaný u pacientov:
· s precitlivenosťou na enoxaparín sodný, heparín alebo jeho deriváty vrátane iných nízkomolekulových heparínov (LMWH) alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1;
· s anamnézou heparínom indukovanej trombocytopénie (HIT) sprostredkovanej imunitou za posledných 100 dní alebo s prítomnosťou cirkulujúcich protilátok (pozri aj časť 4.4);
· s aktívnym klinicky signifikantným krvácaním a stavmi s vysokým rizikom krvácania, vrátane nedávnej mozgovej príhody s krvácaním, so žalúdočnočrevným vredom, s prítomnosťou
malígnej neoplazmy s vysokým rizikom krvácania, nedávnou operáciou mozgu, chrbtice alebo oka, so známymi alebo suspektnými varixami ezofágu, s arteriovenóznymi malformáciami,
s vaskulárnou aneuryzmou alebo s veľkými intraspinálnymi alebo intracerebrálnymi vaskulárnymi abnormalitami;
· pri spinálnej alebo epidurálnej anestézii alebo lokálno-regionálnej anestézii, ak sa enoxaparín sodný použil v predchádzajúcich 24 hodinách (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
· Všeobecné
Enoxaparín sodný nemožno zamieňať (jednotku za jednotku) s inými nízkomolekulovými heparínmi (LMWHs). Tieto lieky sa líšia svojím výrobným postupom, molekulovou hmotnosťou, špecifickou anti-Xa a anti-IIa aktivitou, jednotkami, dávkovaním a klinickou účinnosťou a bezpečnosťou. Následkom toho majú rozdielnu farmakokinetiku a biologickú aktivitu (napr. antitrombínovú aktivitu a interakciu s krvnými doštičkami). Preto treba venovať osobitnú pozornosť špecifickým pokynom na používanie pre každý z týchto liekov a dodržiavať ich.
· Anamnéza HIT (>100 dní)
Používanie enoxaparínu sodného u pacientov s anamnézou imunitne sprostredkovanej HIT za posledných 100 dní alebo pri prítomnosti cirkulujúcich protilátok je kontraindikované (pozri časť 4.3). Cirkulujúce protilátky môžu pretrvávať niekoľko rokov.
U pacientov s anamnézou (>100 dní) heparínom indukovanej trombocytopénie bez prítomnosti
cirkulujúcich protilátok sa má enoxaparín sodný používať s mimoriadnou opatrnosťou. V takomto prípade možno urobiť rozhodnutie o použití enoxaparínu sodného len po starostlivom vyhodnotení pomeru prínos-riziko a po zvážení možnosti neheparínovej alternatívnej liečby (napr. danaparoid sodný alebo lepirudín).
· Monitorovanie počtu krvných doštičiek
Pri nízkomolekulových heparínoch existuje aj riziko vzniku heparínom indukovanej trombocytopénie
sprostredkovanej protilátkami. Ak sa vyskytne trombocytopénia, zvyčajne sa objaví medzi 5. až
21.dňom od začiatku liečby enoxaparínom.
Riziko HIT je vyššie u pacientov po operácii a najmä po operácii srdca a u onkologických pacientov. Preto sa odporúča zmerať počet krvných doštičiek na začiatku liečby enoxaparínom sodným a potom merať pravidelne počas liečby.
Ak existujú klinické príznaky pripomínajúce HIT (nová epizóda arteriálneho a/alebo venózneho
tromboembolizmu, bolestivé kožné lézie v mieste injekcie, alergické alebo anafylaktoidné reakcie na liečbu), je potrebné zmerať počet krvných doštičiek. Pacienti musia byť upovedomení, že takéto príznaky sa môžu objaviť a ak sa to stane, musia informovať svojho lekára.
V praxi, ak sa potvrdí signifikantný pokles počtu krvných doštičiek (30 až 50 % z východiskovej hodnoty), liečba enoxaparínom sodným sa musí okamžite ukončiť a pacient musí prejsť na inú alternatívnu neheparínovú antikoagulačnú liečbu.
· Krvácanie
Rovnako ako pri iných antikoagulanciách, môže sa vyskytnúť v ktoromkoľvek mieste krvácanie.
Ak sa vyskytne, je nutné vyšetriť pôvod krvácania a začať vhodnú liečbu.
Rovnako ako pri inej antikoagulačnej liečbe, enoxaparín sodný sa má použiť s opatrnosťou v stavoch so zvýšeným potenciálom pre krvácanie, ako je napríklad:
· porucha hemostázy,
· peptický vred v anamnéze,
· nedávno prekonaná ischemická mozgová príhoda,
· ťažká arteriálna hypertenzia,
· nedávna diabetická retinopatia,
· neurologický alebo oftalmologický chirurgický výkon,
· súbežné podávanie liekov ovplyvňujúcich hemostázu (pozri časť 4.5).
· Laboratórne vyšetrenia
Enoxaparín sodný podávaný v dávkach za účelom profylaxie venóznej tromboembólie významne neovplyvňuje dobu krvácania a celkové koagulačné testy, nemá vplyv na agregáciu krvných doštičiek alebo na väzbu fibrinogénu na krvné doštičky.
Pri vyšších dávkach enoxaparínu sa môže zvýšiť aktivovaný parciálny tromboplastínový čas (aPTT) a
aktivovaný čas koagulácie (ACT). Predĺženia aPTT a ACT a zvýšený antitrombotický účinok enoxaparínu sodného nie sú v lineárnom vzťahu, a preto tieto hodnoty nie sú pre sledovanie účinku enoxaparínu sodného vhodné ani spoľahlivé.
· Spinálna/Epidurálna anestézia alebo lumbálna punkcia
Spinálna/epidurálna anestézia alebo lumbálna punkcia sa nesmie robiť v priebehu 24 hodín od podania
enoxaparínu sodného v terapeutických dávkach (pozri tiež časť4.3).
Pri súbežnom použití enoxaparínu a spinálnej / epidurálnej anestézie alebo spinálnej punkcii boli hlásené prípady neuraxiálnych hematómov, ktoré mali za následok dlhodobú alebo trvalú paralýzu. Pri
dávkovacom režime 4000 IU (40 mg) jedenkrát denne a nižšom sú tieto prípady zriedkavé. Riziko je
vyššie pri vyšších dávkovacích režimoch enoxaparínu sodného, pri použití pooperačných epidurálnych
katétrov, pri súbežnom užívaní ďalších liekov ovplyvňujúcich hemostázu ako sú nesteroidné protizápalové lieky (NSAID), pri traumatickej alebo opakovanej epidurálnej alebo spinálnej punkcii alebo u pacientov s operáciou chrbtice v anamnéze alebo deformáciou chrbtice v anamnéze.
Pri súbežnom použití enoxaparínu a epidurálnej alebo spinálnej anestézie / analgézie alebo spinálnej punkcii je potrebné na zníženie rizika vzniku krvácania vziať do úvahy farmakokinetický profil enoxaparínu sodného (pozri časť 5.2). Zavedenie alebo odstraňovanie epidurálneho katétra alebo lumbálnej punkcie je najlepšie robiť vtedy, keď je antikoagulačný účinok enoxaparínu nízky; avšak presný čas, kedy sa dosiahne dostatočne nízky antikoagulačný účinok u konkrétneho pacienta, nie je známy. U pacientov s klírensom kreatinínu [15 -30 ml/minúta] je potrebné zvažovať aj ďalšie okolnosti, pretože eliminácia enoxaparínu trvá dlhšie (pozri časť 4.2).
Ak sa lekár rozhodne podať antikoagulačnú liečbu v súvislosti s epidurálnou alebo spinálnou anestéziou/analgéziou alebo lumbálnou punkciou, je potrebné často monitorovať akékoľvek prejavy a príznaky neurologického poškodenia, ako je bolesť pozdĺž chrbtice, zmyslové a motorické ťažkosti (necitlivosť alebo slabosť dolných končatín), poruchy činnosti hrubého čreva a/alebo močového mechúra. Pacienta je potrebné poučiť, že má ihneď informovať lekára, ak spozoruje niektorý z vyššie uvedených prejavov alebo príznakov. Pri podozrení na prejavy alebo príznaky spinálneho hematómu
je potrebná urgentná diagnostika a okamžitá liečba, vrátane zváženia dekompresie miechy, aj keď táto liečba nemusí zabrániť alebo zvrátiť neurologické následky.
· Nekróza kože / kožná vaskulitída
Pri LMWH bola hlásená nekróza kože a kožná vaskulitída, v takých prípadoch treba okamžite liečbu ukončiť.
· Perkutánne koronárne revaskularizačné výkony
Aby sa minimalizovalo riziko krvácania pri cievnych inštrumentálnych výkonoch uskutočňovaných počas liečby nestabilnej angíny pectoris, NSTEMI a akútneho STEMI, dôsledne dodržiavajte intervaly
odporúčané medzi dávkami enoxaparínu sodného. Je to dôležité preto, aby sa dosiahla hemostáza v mieste punkcie po PCI. V prípade, že sa použije uzatváracia pomôcka, púzdro cievneho vodiča (sheat) možno odstrániť okamžite. Ak sa použije metóda manuálnej kompresie, púzdro cievneho
vodiča (sheat) sa má odstrániť po 6 hodinách po poslednej i.v./s.c. injekcii enoxaparínu sodného. Ak má liečba enoxaparínom sodným pokračovať, ďalšia plánovaná dávka enoxaparínu sa má podať
najskôr 6-8 hodín po odstránení puzdra. Má sa sledovať, či sa v mieste výkonu nevyskytnú príznaky
krvácania alebo hematóm.
· Akútna infekčná endokarditída
U pacientov s akútnou infekčnou endokarditídou sa používanie heparínu obvykle neodporúča kvôli
riziku krvácania do mozgu. Ak sa jeho použitie považuje za absolútne nebyhnutné, rozhodnutie treba
urobiť len po starostlivom individuálnom posúdení pomeru prínos-riziko.
· Umelá mechanická srdcová chlopňa
Používanie enoxaparínu sodného u pacientov s umelou mechanickou srdcovou chlopňou za účelom
tromboprofylaxie nebolo dostatočne preskúmané. U pacientov s umelou mechanickou srdcovou chlopňou, ktorým bol podávaný enoxaparín za účelom tromboprofylaxie, sa zaznamenali ojedinelé prípady trombózy umelej srdcovej chlopne. Nejasné okolnosti, vrátane základného ochorenia
a nedostatočných klinických údajov, obmedzujú zhodnotenie týchto prípadov. Niektoré z týchto prípadov boli gravidné ženy, u ktorých trombóza spôsobila smrť matky a plodu.
· Gravidné ženy s umelou mechanickou srdcovou chlopňou
Používanie enoxaparínu sodného u gravidných žien s umelou mechanickou srdcovou chlopňou
za účelom tromboprofylaxie nebolo dostatočne preskúmané. V klinickej štúdii s gravidnými ženami s umelou mechanickou srdcovou chlopňou, kde sa podával enoxaparín v dávke 100 IU/kg (1 mg/kg) dvakrát denne za účelom zníženia rizika tromboembólie, došlo u 2 z 8 žien k tvorbe krvných zrazenín, ktoré zablokovali chlopňu a spôsobili smrť matky a plodu. Po uvedení lieku na trh sa u gravidných
žien s umelou mechanickou srdcovou chlopňou, ktorým sa podával profylakticky enoxaparín,
zaznamenali ojedinelé prípady chlopňovej trombózy. Gravidné ženy s umelou mechanickou srdcovou
chlopňou môžu byť vystavené vyššiemu riziku tromboembólie.
· Starší ľudia
Pri podávaní profylaktických dávok enoxaparínu starším pacientom sa nepozorovala zvýšená
tendencia ku krvácaniu.
Starší pacienti (hlavne 80-roční a starší) môžu byť pri podávaní terapeutických dávok enoxaparínu vystavení vyššiemu riziku komplikácií s krvácaním. Odporúča sa preto starostlivé klinické sledovanie a u pacientov starších ako 75 rokov liečených na STEMI možno zvážiť zníženie dávky (pozri časti 4.2 a 5.2).
· Porucha funkcie obličiek
Pacienti s poruchou funkcie obličiek sú vystavení vyššiemu účinku enoxaparínu sodného, čím sa zvyšuje riziko krvácania. U týchto pacientov sa odporúča starostlivé klinické monitorovanie a možno zvážiť aj biologické monitorovanie meraním anti-Xa aktivity(pozri časti 4.2 a 5.2).
Enoxaparín sodný sa neodporúča u pacientov v terminálnom štádiu ochorenia obličiek (klírens
kreatinínu <15 ml/min) pre nedostatok údajov v tejto populácii okrem prevencie tvorby trombov
v mimotelovom obehu počas dialýzy.
Pacienti so závažnou poruchou funkcie obličiek (klírens kreatinínu 15-30 ml/min ) sú vystavení výrazne vyššiemu účinku enoxaparínu sodného, preto sa odporúča úprava terapeutických
a profylaktických dávkovacích režimov (pozri časť 4.2).
Pacientom so stredne ťažkou (klírens kreatinínu 30-50 ml/min) a miernou (klírens kreatinínu 50-
80 ml/min) poruchou funkcie obličiek nie je nutné upraviť dávku.
· Porucha funkcie pečene
U pacientov s poruchou funkcie pečene je potrebná opatrnosť pri používaní enoxaparínu sodného
kvôli zvýšenému potenciálu krvácania. Úprava dávky na základe monitorovania hladiny anti-Xa nie je
spoľahlivá u pacientov s cirhózou pečene a neodporúča sa (pozri časť 5.2).
· Nízka hmotnosť
Pacienti s nízkou hmotnosťou (ženy < 45 kg, muži < 57 kg) sú pri podávaní profylaktických dávok enoxaparínu sodného (neupravených podľa hmotnosti pacienta) vystavení vyššiemu účinku lieku, čo
môže viesť k vyššiemu riziku krvácania. Preto sa odporúča starostlivé klinické sledovanie takýchto pacientov (pozri časť 5.2).
· Obézni pacienti
Obézni pacienti majú vyššie riziko trombembolizmu. Bezpečnosť a účinnosť profylaktických dávok
u obéznych pacientov (BMI >30 kg/m2) nebola úplne stanovená a neexistuje konsenzus, pokiaľ ide
o úpravu dávok. U týchto pacientov je potrebné starostlivo sledovať prejavy a príznaky
tromboembolizmu.
· Hyperkaliémia
Heparíny môžu potláčať sekréciu aldosterónu v nadobličkách, čo spôsobuje hyperkaliémiu (pozri časť
4.8), najmä u pacientov s diabetom mellitus, chronickým zlyhaním obličiek, preexistujúcou
metabolickou acidózou, pacientov užívajúcich lieky, o ktorých je známe, že zvyšujú hladinu draslíka (pozri časť 4.5). Je potrebné pravidelne monitorovať plazmatické hladiny draslíka, najmä u rizikových pacientov.
· Sledovateľnosť lieku
Nízkomolekulové heparíny (LMWHs) sú biologické liečivá. Zdravotníckym pracovníkom sa odporúča zaznamenať obchodný názov a číslo šarže podaného lieku do zdravotného záznamu pacienta s cieľom zlepšiť sledovateľnosť LMWH.
Obsahsodíka
Tento liek obsahuje menej než 1 mmol sodíka (23 mg) na dávku, t.j. obsahuje v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Súbežné
používanie
sa
neodporúča:
· Lieky ovplyvňujúce hemostázu (pozri časť 4.4)
Pred začiatkom terapie enoxaparínom sa odporúča prerušiť liečbu niektorými liekmi ovplyvňujúcimi hemostázu, pokiaľ nie sú striktne indikované. Ak je kombinované používanie indikované, je potrebné pri používaní enoxaparínu sodného starostlivé príslušné klinické a laboratórne monitorovanie. K takýmto liekom patria:
- systémové salicyláty, kyselina acetylsalicylová a nesteroidné antiflogistiká (NSAID)
vrátane ketorolaku,
- iné trombolytiká (napr. altepláza, retepláza, streptokináza, tenektepláza, urokináza) a antikoagulanciá (pozri časť 4.2).
Súbežnépoužívaniesaodporúčasopatrnosťou:
Tieto lieky je možné podávať súbežne s enoxaparínom sodným s opatrnosťou:
· Iné lieky ovplyvňujúce hemostázu, ako sú:
- inhibítory zhlukovania krvných doštičiek vrátane kyseliny acetylsalicylovej používanej
ako antiagregačný liek (v dávke na kardioprotekciu), klopidogrel, tiklopidín a antagonisty
glykoproteínu IIb/IIIa indikované pri akútnom koronárnom syndróme, kvôli riziku krvácania,
- dextran 40,
- systémové glukokortikoidy.
· Lieky zvyšujúce hladinu draslíka:
Lieky zvyšujúce sérovú hladinu draslíka sa môžu podávať súbežne s enoxaparínom sodným pri starostlivom klinickom a laboratórnom monitorovaní (pozri časti 4.4 a 4.8).
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí nie sú žiadne dôkazy o prechode enoxaparínu placentárnou bariérou v druhom a treťom trimestri gravidity. O prvom trimestri nie sú k dispozícii žiadne informácie.
Štúdie na zvieratách nepreukázali žiadne známky fetálnej toxicity alebo teratogenity (pozri časť 5.3). Na údajoch o zvieratách sa preukázalo, že prechod enoxaparínu cez placentu je minimálny. Enoxaparín možno používať počas gravidity len ak lekár potvrdí jednoznačnú potrebu jeho použitia.
Ženy, ktoré dostávajú enoxaparín sodný počas gravidity, treba starostlivo monitorovať, pokiaľ ide o prejavy krvácania alebo výraznej antikoagulácie a upozorniť ich na riziko krvácania. Podľa celkových údajov u tehotných žien neexistuje dôkaz zvýšeného rizika krvácania, trombocytopénie alebo osteoporózy v porovnaní s rizikom pozorovaným u žien, ktoré nie sú gravidné, okrem rizika, ktoré sa pozorovalo u tehotných žien s umelou srdcovou chlopňou (pozri časť 4.4).
Ak sa plánuje epidurálna anestézia, odporúča sa predtým ukončiť liečbu enoxaparínom sodným (pozri časť 4.4).
Dojčenie
Nie je známe, či sa nezmenený enoxaparín vylučuje do ľudského materského mlieka. U dojčiacich potkanov je prechod enoxaparínu alebo jeho metabolitov do mlieka veľmi nízky. Perorálna absorpcia
enoxaparínu je nepravdepodobná. Inhixa sa môže používať počas dojčenia.
Fertilita
Nie sú žiadne klinické údaje súvisiace s enoxaparínom sodným týkajúce sa fertility. Štúdie na zvieratách nepreukázali žiadny vplyv na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Enoxaparín sodný nemá žiadny alebo má len zanedbateľný vplyv na schopnosť riadiť motorové vozidlo a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Enoxaparín sa vyhodnocoval u viac ako 15 000 pacientov, ktorí dostávali enoxaparín v klinickom skúšaní. Z toho 1776 pacientov s rizikom tromboembolických komplikácií dostávalo enoxaparín ako prevenciu hlbokej žilovej trombózy po ortopedickej alebo abdominálnej operácii, 1169 pacientov
s akútnym interným ochorením s ťažkým obmedzením mobility dostávalo enoxaparín ako prevenciu
hlbokej žilovej trombózy, 559 pacientov s pľúcnou embóliou alebo bez nej dostávalo enoxaparín na liečbu hlbokej žilovej trombózy, 1578 pacientov na liečbu nestabilnej angíny a non-Q-infarktu myokardu a 10 176 pacientov na liečbu akútneho STEMI.
Režim podávania enoxaparínu sodného v klinickom skúšaní sa menil v závislosti od indikácií. Pri prevencii hlbokej žilovej trombózy po operácii alebo u pacientov s akútnym interným ochorením
s ťažkým obmedzením mobility bola dávka enoxaparínu sodného 4 000 IU (40 mg) subkutánne jedenkrát denne. Pri liečbe hlbokej žilovej trombózy (DVT) s pľúcnou embóliou (PE) alebo bez nej dostávali pacienti dávku buď 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín alebo dávku
150 IU/kg (1,5 mg/kg) subkutánne jedenkrát denne. V klinických štúdiách na liečbu nestabilnej angíny
a non-Q-infarktu myokardu boli dávky 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín
a v klinickej štúdii na liečbu akútneho STEMI sa podával enoxaparín sodný v dávke 3 000 IU (30 mg)
intravenózne ako bolus a potom nasledovala dávka 100 IU/kg (1 mg/kg) subkutánne každých
12 hodín.
V klinických štúdiách boli najčastejšími hlásenými reakciami krvácanie, trombocytopénia a trombóza
(pozri časť 4.4 a 'Opis vybraných nežiaducich reakcií' nižšie).
Zoznam nežiaducich reakcií v tabuľkovom formáte
Ďalšie nežiaduce reakcie, ktoré sa pozorovali v klinických štúdiách a ktoré boli hlásené po uvedení
lieku na trh (* znamená reakcie zo skúseností po uvedení lieku na trh) sú podrobnejšie uvedené nižšie. Frekvencie výskytu sú definované takto: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) alebo neznáme (z dostupných údajov). V rámci každej triedy orgánového systému sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Poruchy krvi a lymfatického systému
· časté: krvácanie, hemoragická anémia*, trombocytopénia, trombocytóza
· zriedkavé: eozinofília*
· zriedkavé: prípady imunoalergickej trombocytopénie s trombózou, u niektorých bola trombóza komplikovaná orgánovým infarktom alebo ischémiou končatiny (pozri časť 4.4).
Poruchy imunitného systému
· časté: alergická reakcia
· zriedkavé: anafylaktické/anafylaktoidné reakcie vrátane šoku*
Poruchy nervového systému
· časté: bolesť hlavy*
Poruchy ciev
· zriedkavé: spinálny hematóm* (alebo neuraxiálny hematóm). Tieto reakcie majú za následok rôzne stupne neurologického poškodenia vrátane dlhodobej alebo permanentnej paralýzy (pozri
časť 4.4)
Poruchy pečene a žlčových ciest
· veľmi časté: zvýšenie pečeňových enzýmov (najmä transamináz > 3-násobok hornej hranice normálu)
· menej časté: hepatocelulárne poškodenie pečene *,
· zriedkavé: cholestatické poškodenie pečene*
Poruchy kože a podkožného tkaniva
· časté: urtikária, pruritus, erytém
· menej časté: bulózna dermatitída
· zriedkavé: alopécia*
· zriedkavé: kožná vaskulitída*, kožná nekróza* obvykle sa vyskytuje v mieste vpichu injekcie
(predchádza jej zvyčajne purpura alebo erytematózne plaky, infiltrované a bolestivé).
Uzlíky v mieste vpichu injekcie * (zapálené uzlíky, ktoré neboli cystickým obalom enoxaparínu).
Vymiznú v priebehu niekoľkých dní a nie je potrebné kvôli tomu ukončiť liečbu.
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
· zriedkavé: osteoporóza* po dlhodobej liečbe (viac ako 3 mesiace).
Celkové poruchy a reakcie v mieste podania
· časté: hematóm v mieste vpichu injekcie, bolesť v mieste vpichu injekcie, iné reakcie v mieste vpichu injekcie (ako je opuch, krvácanie, hypersenzitivita, zápal, zhrubnutie, bolesť alebo reakcia)
· menej časté: lokálne podráždenie, kožná nekróza v mieste vpichu injekcie
Laboratórne a funkčné vyšetrenia
· zriedkavé : hyperkaliémia*(pozri časti 4.4 a 4.5)
Opisvybranýchnežiaducichreakcií
Krvácanie
Patrilo sem veľké krvácanie, zaznamenalo sa u viac ako u 4,2 % pacientov (chirurgickí pacienti). Niektoré z týchto prípadov boli fatálne. U chirurgických pacientov sa za veľké krvácanie považovalo (1) to, ktoré spôsobilo závažnú klinickú udalosť alebo (2) to, pri ktorom bol pokles hemoglobínu
≥ 2 g/dl alebo ktoré si vyžiadalo transfúziu 2 alebo viac jednotiek krvných prípravkov. Retroperitoneálne a intrakraniálne krvácanie za vždy považovalo za veľké.
Podobne ako pri podávaní iných antikoagulancií, sa môže v prítomnosti pridružených rizikových faktorov ako sú organické poškodenia s tendenciou ku krvácaniu, invazívne zákroky alebo používanie liekov ovplyvňujúcich hemostázu, vyskytnúť krvácanie (pozri časti 4.4 a 4.5).
Trieda
orgánového systému
Poruchy krvi a lymfatickéh o systému
Prevencia
u chirurgických
pacientov
veľmi časté:
krvácanie α
zriedkavé: retroperitoneáln e krvácanie
Prevencia
u internýc h pacientov
časté:
krvácanie α
Liečba pacientov
s DVT s PE alebo bez nej
veľmi časté:
krvácanie α
menej časté: intrakraniálne krvácanie, retroperitoneáln e krvácanie
Liečba pacientov
s nestabilnou angínou a non-Q infarktom myokardu
časté:
krvácanie α
zriedkavé: retroperitoneáln e krvácanie
Liečba pacientov
s akútnym STEMI
časté:
krvácanie α
menej časté: intrakraniálne krvácanie, retroperitoneáln e krvácanie
 α
α: napríklad: hematóm, ekchymóza iná ako v mieste vpichu injekcie, hematóm v rane, hematúria, epistaxa
a gastrointestinálne krvácanie.
Trombocytopénia a trombocytóza
Trieda orgán ového systé mu Poruch y krvi
a lymfati ckého systém u
Prevencia
u chirurgických
pacientov
veľmi časté:
trombocytózaβ
časté:
trombocytopénia
Prevencia
u interných
pacientov
menej časté:
trombocytopénia
Liečba pacientov s DVT s PE alebo bez nej
veľmi časté:
trombocytóza β
časté:
trombocytopénia
Liečba pacientov s nestabilnou angínou a non-Q infarktom myokardu
menej časté:
trombocytopénia
Liečba pacientov
s akútnym
STEMI
časté: trombocytózaβ trombocytopénia veľmi zriedkavé: imuno-alergická trombocytopénia
 β
β: zvýšenie počtu krvných doštičiek > 400 x 109/l
Pediatrická populáciaBezpečnosť a účinnosť enoxaparínu sodného u detí nebola stanovená (pozri časť 4.2).
Viac dávk ové inj ekč né li ek ovk y obsahuj úce benzylalkohol:Podávanie lieku obsahujúceho benzylalkohol ako konzervačnú látku novorodencom sa spája
s fatálnym syndrómom dychovej tiesne (“gasping” syndróm) (pozri časť 4.3). Benzylalkohol môže spôsobiť aj toxické reakcie a anafylaktoidné reakcie u dojčiat a detí do 3 rokov (pozri časť 4.4).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.
4.9 PredávkovaniePrejavyapríznakyNáhodné predávkovanie enoxaparínom sodným po subkutánnom, mimotelovom alebo intravenóznom podaní môže viesť ku krvácavým komplikáciám. Po perorálnom podaní, dokonca aj vysokých dávok, nie je pravdepodobné, že sa enoxaparín sodný absorbuje.
LiečbaAntikoagulačný účinok enoxaparínu možno do veľkej miery neutralizovať pomalým intravenóznym podaním protamínu. Dávka protamínu závisí od dávky podaného enoxaparínu sodného; 1 mg protamínu neutralizuje antikoagulačný účinok 100 IU (1 mg) enoxaparínu sodného, ak bol enoxaparín podaný v priebehu posledných 8 hodín. Ak bol enoxaparín podaný pred viac ako 8 hodinami alebo ak je potrebná druhá dávka protamínu, môže sa podať infúzia protamínu v dávke 0,5 mg protamínu na
100 IU (1 mg) podaného enoxaparínu sodného. 12 hodín po podaní enoxaparínu nemusí byť podanie protamínu potrebné. Avšak anti-Xa aktivita enoxaparínu sodného sa nikdy (ani pri vysokých dávkach protamínu) nezneutralizuje úplne (najviac asi 60 %) (pozri Súhrn charakteristických vlastností solí protamínu).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antitrombotikum, skupina heparínov. ATC kód: B01A B05
Inhixa je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.euFarmakodynamickéúčinkyEnoxaparín je nízkomolekulový heparín so strednou molekulovou hmotnosťou približne
4500 daltonov, v ktorom sú oddelené antitrombotická a antikoagulačná aktivita štandardného heparínu. Liečivo je sodná soľ.
V
in-vitro purifikovanom systéme má enoxaparín sodný vysokú anti-Xa aktivitu (približne 100 IU/mg) a nízku anti-IIa alebo antitrombínovú aktivitu (približne 28 IU/mg) s pomerom 3,6. Tieto antikoagulačné aktivity sú sprostredkované antitrombínom (ATIII), čo má za následok antitrombotické účinky u ľudí.
Okrem anti-Xa/IIa aktivity boli identifikované u zdravých ľudí a u pacientov, ako aj na predklinických modeloch, ďalšie antitrombotické a protizápalové vlastnosti enoxaparínu. Patrí sem ATIII- dependentná inhibícia ďalších koagulačných faktorov ako je faktor VIIa, indukcia uvoľňovania endogénneho inhibítora cesty tkanivového faktora (Tissue Factor Pathway Inhibitor (TFPI)) a znížené uvoľňovanie von Willebrandovho faktora (vWF) z vaskulárneho endotelu do krvného obehu. O týchto faktoroch je známe, že prispievajú k celkovému antitrombotickému účinku enoxaparínu.
Keď sa enoxaparín sodný používa ako profylaktická liečba, nemá významný vplyv na aPTT. Keď sa
používa ako kuratívna liečba, aPTT sa môže predĺžiť o 1,5-2,2-násobok kontrolného času pri maxime účinku.
Klinická účinnosťabezpečnosťPrevencia venóznej tromboembolickej choroby spojená s operáciou· Predĺžená profylaxia VTE po ortopedickej operácii
V dvojito zaslepenej štúdii predĺženej profylaxie u pacientov podstupujúcich náhradu bedrového kĺbu,
179 pacientov, ktorí nemali tromboembolickú chorobu a predtým počas hospitalizácie dostávali
4000 IU (40 mg) enoxaparínu sodného, boli po prepustení randomizovaní na buď 4000 IU (40 mg) (n=90) jedenkrát denne subkutánne, alebo placebo ( n=89) na 3 týždne. Výskyt DVT počas predĺženej
profylaxie bol štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, nebola hlásená žiadna PE. Nevyskytlo sa žiadne veľké krvácanie.
Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
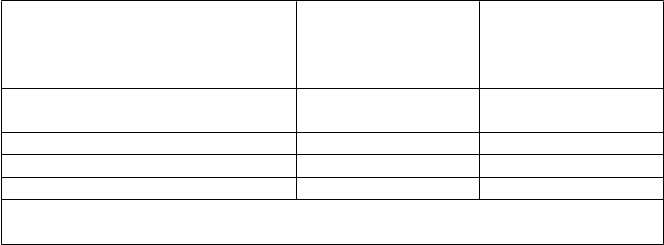 enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo jedenkrát denne s.c. n (%)
Všetci pacienti liečení predĺženou
profylaxiou
90 (100) 89 (100)
celkovo VTE 6 (6,6) 18 (20,2)
· celkovo DVT (%) 6 (6,6)* 18 (20,2)
· proximálna DVT (%) 5 (5,6)# 7 (8,8)
*p hodnota oproti placebu =0,008
#p hodnota oproti placebu =0,537
V druhej dvojito zaslepenej štúdii bolo 262 pacientov bez VTE ochoreniapodstupujúcich operáciu s
náhradou bedrového kĺbu a predtým počas hospitalizácie liečených enoxaparínom sodným 4 000 IU (40 mg) s.c, . bolo randomizovaných po prepustení na buď enoxaparín sodný 4 000 IU (40 mg) (n=131) jedenkrát denne s.c., alebo placebo (n=131) počas 3 týždňov. Podobne ako v prvej štúdii bol výskyt VTE počas predĺženej profylaxie štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, a to aj pre VTE celkovo (enoxaparín sodný 21 [16 %] oproti placebu 45
[34,4 %]; p=0,001) aj pre proximálnu DVT (enoxaparín sodný 8 [6,1%] oproti placebu 28 [21,4 %];
p=<0,001). Pokiaľ ide o veľké krvácanie, nezistil sa žiadny rozdiel medzi skupinami s enoxaparínom sodným a placebom.
· Predĺžená profylaxia DVT po onkologickej operácii
Dvojito zaslepená, multicentrická klinická štúdia, porovnávala bezpečnosť a účinnosť štvortýždňového a jednotýždňového režimu profylaktického podávania enoxaparínu sodného
u 332 pacientov, ktorí sa podrobili elektívnej operácii z dôvodu rakoviny v brušnej alebo panvovej oblasti. Pacienti dostávali enoxaparín sodný (4 000 IU (40 mg) s.c.) denne počas 6 až 10 dní a boli náhodne zaradení na liečbu enoxaparínom sodným alebo placebom počas ďalších 21 dní. Bilaterálna venografia sa realizovala medzi 21. a 31. dňom alebo skôr, ak sa vyskytli príznaky venózneho tromboembolizmu. Pacienti boli potom 3 mesiace sledovaní. Profylaxia enoxaparínom sodným počas
4 týždňov po operácii z dôvodu rakoviny v oblasti brucha alebo panvy štatisticky významne znížila
výskyt venograficky preukázanej trombózy v porovnaní s profylaxiou enoxaparínom sodným počas jedného týždňa. Výskyt venózneho tromboembolizmu na konci dvojito zaslepenej fázy bol 12,0 % (n=20) v skupine s placebom a 4,8 % (n=8) v skupine s enoxaparínom sodným; p=0,02. Tento rozdiel pretrvával tri mesiace [13,8 % vs. 5,5 % (n=23 vs 9), p=0,01]. Neboli rozdiely vo výskyte krvácania alebo iných komplikácií počas dvojito zaslepenej alebo sledovacej fázy.
Prevencia venóznej tromboembolickej choroby u interných pacientov s akútnymi ochoreniami, kde sa očakáva obmedzenie mobility
V dvojito zaslepenej, multicentrickej štúdii s paralelnými skupinami sa provnával enoxaparín sodný
2 000 IU (20 mg) alebo 4 000 IU (40 mg) jedenkrát denne s.c. s placebom v prevencii DVT
u interných pacientov s ťažkým obmedzením mobility počas akútneho ochorenia (definované ako prejdená vzdialenosť <10 metrov za ≤3 dni). Táto štúdia zahŕňala pacientov so srdcovým zlyhaním (NYHA trieda III alebo IV); akútnym respiračným zlyhaním alebo komplikovanou chronicku respiračnou insuficienciou a akútnou infekciou alebo akútnou reumou; ak boli spojené aspoň s jedným VTE rizikovým faktorom (vek ≥75 rokov, rakovina, predchádzajúca VTE, obezita, varikózne vény, hormonálna liečba a chronické srdcové alebo respiračné zlyhanie).
Celkovo bolo v štúdii zaradených 1102 pacientov a 1073 pacientov bolo liečených. Liečba pokračovala počas 6 až 14 dní (priemerné trvanie liečby 7 dní). Pri podávaní dávky 4 000 IU (40 mg) jedenkrát denne s.c. enoxaparín sodný štatisticky významne znížil výskyt VTE v porovnaní
s placebom. Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
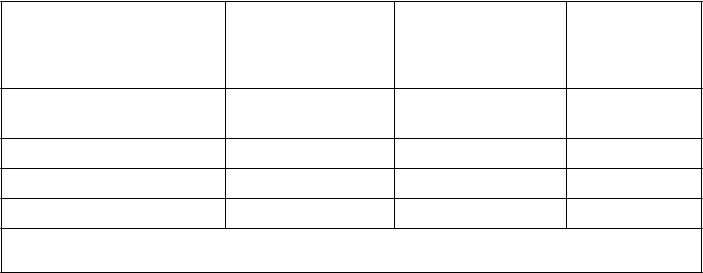 enoxaparín sodný
2 000 IU (20 mg) jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo
n (%)
enoxaparín sodný
2 000 IU (20 mg) jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo
n (%)
v
š
etci liečení interní pacienti počas akútneho ochorenia
287 (100) 291(100) 288 (100)
celkovo VTE (%) 43 (15,0) 16 (5,5)* 43 (14,9)
· celkovo DVT (%) 43 (15,0) 16 (5,5) 40 (13,9)
· proximálna DVT (%) 13 (4,5) 5 (1,7) 14 (4,9)
VTE = venózne tromboembolické udalosti, ktoré zahŕňali DVT, PE a smrť z dôvodu tromboembólie
* p hodnota oproti placebu = 0,0002
Približne 3 mesiace po zaradení zostával výskyt VTE štatisticky významne nižší v skupine liečenej
enoxaparínom sodným 4 000 IU (40 mg) v porovnaní so skupinou liečenou placebom.
Výskyt krvácania celkovo bol 8,6 % a výskyt veľkého krvácania 1,1 % v skupine s placebom, 11,7 %
a 0,3 % v skupine s enoxaparínom sodným 2 000 IU (20 mg) a 12,6 % a 1,7 % v skupine s enoxaparínom sodným 4 000 IU (40 mg).
Liečba hlbokej žilovej trombózy s pľúcnou embóliou alebo bez nej
V multicentrickej štúdii s paralelnými skupinami bolo 900 pacientov s akútnou DVT dolnej končatiny s pľúcnou embóliou alebo bez nej randomizovaných na hospitalizačnú liečbu buď (i) enoxaparínom
sodným 150 IU/kg (1,5 mg/kg) jedenkrát denne s.c., (ii) enoxaparínom sodným 100 IU/kg (1 mg/kg) každých 12 hodín s.c. alebo (iii) i.v. bolusom heparínu (5 000 IU), po ktorom nasledovala kontinuálna infúzia (podávaná s cieľom dosiahnuť aPTT 55 až 85 sekúnd). Celkovo bolo v štúdii randomizovaných 900 pacientov a všetci pacienti boli liečení. Všetci pacienti dostávali aj liečbu warfarínom sodným (dávka bola upravená podľa protrombínového času s cieľom dosiahnuť INR 2,0 až 3,0) so začiatkom v priebehu 72 hodín od začatia liečby enoxaparínom sodným alebo štandardnej liečby heparínom a pokračovaním počas 90 dní. Enoxaparín sodný alebo štandardná liečba heparínom sa podávala minimálne 5 dní a dovtedy, kým sa nedosiahol cieľový INR warfarínu sodného. Obidva režimy s enoxaparínom sodným boli rovnocenné ako štandardná heparínová liečba, pokiaľ ide
o zníženie rizika rekurencie venózneho tromboembolizmu (DVT a/alebo PE). Údaje týkajúce sa
účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
15
0 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
enoxaparín sodný
10
0 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
heparín
i.v. liečba upravovaná podľa aPTT
n (%)
enoxaparín sodný
15
0 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
enoxaparín sodný
10
0 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
heparín
i.v. liečba upravovaná podľa aPTT
n (%)
v
š
etci liečení pacienti s DVT s PE alebo bez nej
298 (100) 312 (100) 290 (100)
celkovo VTE (%) 13 (4,4)* 9 (2,9)* 12 (4,1)
· iba DVT (%) 11 (3,7) 7 (2,2) 8 (2,8)
· proximálna DVT (%)
9 (3,0) 6 (1,9) 7 (2,4)
· PE (%) 2 (0,7) 2 (0,6) 4 (1,4)
VTE = venózna tromboembolická udalosť (DVT a/alebo PE)
*interval spoľahlivosti 95 % pre rozdiely v liečbe celkovej VTE boli:
- enoxaparín sodný jedenkrát denne oproti heparínu (-3,0 až 3,5)
- enoxaparín sodný každých 12 hodín oproti heparínu (-4,2 až 1,7).
Veľké krvácanie bolo 1,7 % v skupine s enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát
denne, 1,3 % v skupine s enoxaparínom sodným 100 IU/kg (1 mg/kg) dvakrát denne a 2,1 % v skupine s heparínom.
Liečba nestabilnej angíny a infarktu myokardu bez elevácie ST
V rozsiahlej multicentrickej štúdii 3171 pacientov zaradených v akútnej faze nestabilnej anginy
pectoris alebo non-Q infarktu myokardu bolo randomizovaných do dvoch skupín tak, že pacienti
v jednej skupine dostávali spolu s kyselinou acetylsalicylovou (100 až 325 mg jedenkrát denne) buď s.c. injekciu enoxaparínu sodného v dávke 100 IU/kg (1 mg/kg) každých 12 hodín alebo i.v. nefrakcionovaný heparín upravený podľa aPTT. Pacienti museli byť hospitalizovaní minimálne 2 dni a maximálne 8 dní, až do klinickej stabilizácie, revaskularizačnej procedúry alebo prepustenia z
nemocnice. Pacienti museli byť sledovaní po dobu 30 dní. Enoxaparín sodný v porovnaní s heparínom
štatisticky významne znížil kombinovaný výskyt anginy pectoris, infarktu myokardu a smrti s poklesom 19,8 až 16,6 % (redukcia relatívneho rizika 16,2 %) v deň 14. Táto redukcia v kombinovanom výskyte pretrvávala po 30 dňoch (od 23,3 do 19,8 %; redukcia relatívneho rizika
15 %).
Pokiaľ ide o veľké krvácanie, neboli zistené žiadne rozdiely, aj keď krvácanie v mieste podania s.c.
injekcie bolo častejšie.
Liečba akútneho infarktu myokardu s eleváciou ST-segmentu
V rozsiahlej multicentrickej štúdii bolo 20 479 pacientov so STEMI vhodných na fibrinolytickú liečbu randomizovaných do dvoch skupín; v jednej skupine dostali enoxaparín sodný ako jednu bolusovú i.v. dávku 3000 IU (30 mg) plus subkutánnu injekciu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg)
a následne každých 12 hodín subkutánnu injekiu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg)
a v druhej skupine dostávali intravenózne nefrakcionovaný heparín upravený podľa aPTT po dobu
48 hodín. Všetci pacienti boli taktiež liečení kyselinou acetylsalicylovou po dobu minimálne 30 dní. Stratégia dávkovania enoxaparínu bola prispôsobená pre pacientov so závažne zhoršenou funkciou obličiek a pre starších pacientov vo veku 75 a viac rokov. Subkutánne injekcie enoxaparínu sa podávali dovtedy, kým pacient nebol prepustený z nemocnice alebo po dobu maximálne 8 dní (podľa toho, čo nastalo skôr).
4716 pacientov sa podrobilo perkutánnej koronárnej intervencii, pričom dostávali antitrombotickú podpornú liečbu zaslepenými liekmi štúdie. Preto pre pacientov liečených enoxaparínom musela byť vykonaná PCI s enoxaparínom (žiadna zmena), pričom bol použitý režim stanovený
v predchádzajúcich štúdiách t.j. žiadne ďalšie dávkovanie, ak od posledného subkutánneho podania do insuflácie balónu uplynulo menej ako 8 hodín; i.v. bolus 30 IU/kg (0,3 mg/kg) enoxaparínu, ak od posledného subkutánneho podania do insuflácie balónu uplynulo viac ako 8 hodín.
Enoxaparín sodný v porovnaní s nefrakcionovaným heparínom štatisticky významne znížil výskyt primárneho endpointu - smrti z akejkoľvek príčiny alebo re-infarktu myokardu v prvých 30 dňoch po randomizácii [9,9 percenta v skupine s enoxaparínom v porovnaní s 12,0 percentami v skupine
s nefrakcionovaným heparínom] pri redukcii relatívneho rizika 17 % (p<0,001).
Benefity liečby enoxaparínom (zjavné vo viacerých ukazovateľoch účinnosti) sa objavili už za 48 hodín, kedy redukcia relatívneho rizika re-infarktu myokardu bola 35 % v porovnaní s liečbou nefrakcionovaným heparínom (p<0,001).
Benefit enoxaparínu v primárnom ukazovateli bol konzistentný v rámci kľúčových podskupín vrátane
veku, pohlavia, lokácie infarktu, anamnézy diabetu, anamnézy predchádzajúceho infarktu myokardu,
typu použitého fibrinolytika a času do liečby študijným liekom.
Zistil sa štatisticky významný benefit liečby enoxaparínom v porovnaní s nefrakcionovaným heparínom u pacientov, ktorí sa podrobili perkutánnej koronárnej intervencii v priebehu 30 dní po randomizácii (23 % redukcia relatívneho rizika) alebo ktorí boli liečení konzervatívne (farmakologicky) (15 % redukcia relatívneho rizika, p = 0,27 pre interakciu).
Výskyt združeného ukazovateľa, ktorým bolo úmrtie, re-infarkt alebo intrakraniálne hemoragie na
30.deň (merané ako čistý klinický benefit) bol štatisticky významne nižší (p<0,0001) v skupine s enoxaparínom (10,1 %) v porovnaní so skupinou s heparínom (12,2 %), čo predstavuje 17 % redukciu relatívneho rizika v prínos liečby enoxaparínom sodným.
Výskyt veľkého krvácania po 30 dňoch bol štatisticky významne vyšší (p<0,0001) v skupine s enoxaparínom sodným (2,1 %) oproti skupine s heparínom (1,4 %). Vyšší výskyt gastrointestinálneho krvácania bol v skupine s enoxaparínom sodným (0,5 %) oproti skupine s heparínom (0,1 %), zatiaľ čo výskyt intrakraniálneho krvácania bol podobný v obidvoch skupinách (0,8 % s enoxaparínom sodným oproti 0,7 % s heparínom).
Prospešný účinok enoxaparínu na primárny endpoint pozorovaný počas prvých 30 dní sa zachoval
počas 12 mesiacov sledovania.
Porucha funkcie pečene
Podľa lietrárnych údajov sa používanie enoxaparínu v dávke 4 000 IU (40 mg) u pacientov s cirhózou
(Child-Pugh trieda B-C) zdá byť bezpečné a účinné v prevencii trombózy portálnej vény. Treba poznamenať, že literárne štúdie môžu mať určité obmedzenia. U pacientov s poruchou pečene je
potrebná opatrnosť, pretože títo pacienti majú vyšší potenciál krvácania (pozri časť 4.4) a u pacientov
s cirhózou (Child-Pugh trieda A,B, C) sa žiadne štúdie týkajúce sa formálneho stanovenia dávky neuskutočnili.
5.2 Farmakokinetické vlastnosti
Všeobecnácharakteristika
Farmakokinetické parametre enoxaparínu sodného sa sledovali najmä vo vzťahu k časovému priebehu plazmatickej anti-Xa aktivity a tiež anti-IIa aktivity v odporúčaných dávkach a to po jednorazovom a opakovanom subkutánnom podaní a po jednorazovom i.v. podaní.
Kvantitatívne hodnotenie anti-Xa a anti-IIa farmakokinetických aktivít sa robilo validovanými
amidolytickými metódami.
A
bsorpcia
Absolútna biologická dostupnosť enoxaparínu sodného po s.c. injekcii vychádzajúca z anti-Xa aktivity
je približne 100 %.
Môžu sa použiť rôzne dávky, formy a dávkovacie režimy.
Priemernú maximálnu plazmatickú anti-Xa aktivitu možno pozorovať 3 až 5 hodín po subkutánnej
injekcii a dosahuje približne 0,2, 0,4 a 1,0 a 1,3 IU/ml po jednorazovej s.c. aplikácii 2000 IU, 4000 IU,
100 IU/kg a 150 IU/kg (20 mg, 40 mg, 1 mg/kg a 1,5 mg/kg) v uvedenom poradí.
Intravenózna bolusová dávka 3000 IU (30 mg), po ktorej bezprostredne nasleduje dávka 100 IU/kg (1 mg/kg) podaná subkutánne každých 12 hodín, poskytuje počiatočný vrchol hladiny faktoru anti- Xa 1,16 IU/ml (n=16) a priemerná expozícia zodpovedá 88 % hladiny v stabilizovanom stave. Stabilizovaný stav sa dosahuje na druhý deň liečby.
Po opakovanom subkutánnom podaní dávky 4000 IU (40 mg) raz denne a dávky 150 IU/kg
(1,5 mg/kg) raz denne zdravým dobrovoľníkom, sa dosiahne ustálený stav na 2.deň a priemerná miera expozície je asi o 15 % vyššia ako po jednorazovom podaní. Po opakovanom subkutánnom podaní dávky 100 anti-Xa IU/kg dvakrát denne sa ustálený stav dosiahne od 3. po 4.deň a má priemernú expozíciu asi o 65 % vyššiu ako po jednorazovom podaní, maximálnu priemernú hodnotu 1,2 IU/ml
a minimálnu hodnotu 0,52 IU/ml.
Injekčný objem a koncentrácia dávky v rozmedzí 100-200 mg/ml nemá vplyv na farmakokinetické parametre u zdravých dobrovoľníkov.
Farmakokinetika enoxaparínu po podaní dávok vyšších ako sú odporúčané dávky je lineárna. Premenlivosť v rámci organizmu alebo medzi viacerými pacientami je nízka. Po opakovanom s.c. podávaní sa akumulácia nezistila.
Plazmatická anti-IIa aktivita enoxaparínu je po subkutánnom podaní približne 10-krát nižšia ako anti- Xa aktivita. Priemerná maximálna anti-IIa aktivita sa pozoruje približne 3 - 4 hodiny a dosahuje po subkutánnom podaní 100 IU/kg dvakrát denne 0,13 IU/ml a po subkutánnom podaní 150 IU/kg
(1,5 mg/kg) jedenkrát denne 0,19 IU/ml.
Distribúcia
Distribučný objem anti-Xa aktivity enoxaparínu sodného je asi 4,3 litrov a je blízky krvnému objemu.
Biotransformácia
Enoxaparín sodný sa primárne metabolizuje v pečeni desulfatizáciou a/alebo depolymerizáciou na zložky s nižšou molekulovou hmotnosťou s omnoho nižšou biologickou účinnosťou.
Eliminácia
Enoxaparín sodný je liek s nízkym klírens s priemerným klírensom plazmatickej anti-Xa aktivity po
podaní dávky 150 IU/kg (1,5 mg/kg) 6-hodinovou i.v. infúziou 0,74 l/hod.
Eliminácia sa javí byť jednofázová a eliminačný polčas anti-Xa aktivity je približne 5 hodín po jednorazovom subkutánnom podaní až približne 7 hodín po opakovanom podaní enoxaparínu sodného.
Renálny klírens aktívnych fragmentov predstavuje približne 10 % podanej dávky a celková renálna
exkrécia aktívnych a neaktívnych fragmentov je 40 % dávky.
Špeciálneskupinypacientov
Starší ľudia
Na základe výsledkov farmakokinetickej analýzy sa zistilo, že pokiaľ je zachovaná normálna funkcia obličiek, kinetický profil enoxaparínu sodného sa u starších osôb v porovnaní s mladšími nelíši. Avšak
je známe, že funkcia obličiek sa s vekom znižuje a teda eliminácia enoxaparínu sodného u starších
pacientov môže byť znížená (pozri časti 4.2 a 4.4).
Porucha funkcie pečene
V štúdii, ktorá sa robila u pacientov s pokročilou cirhózou liečených enoxaparínom sodným 4 000 IU (40 mg) jedenkrát denne bol pokles v maxime anti-Xa aktivity spojený s vzostupom závažnosti
poškodenia pečene (hodnotené podľa Child-Pugh kategórií). Tento pokles bol pripisovaný hlavne poklesu hladiny ATIII, sekundárne zníženej syntéze ATIII u pacientov s poruchou funkcie pečene.
Porucha funkcie obličiek
Medzi klírensom plazmatickej anti-Xa aktivity a klírensom kreatinínu bol v ustálenom stave pozorovaný lineárny vzťah, čo naznačuje zníženie klírensu enoxaparínu sodného u pacientov s
poruchou funkcie obličiek. Po opakovanej subkutánnej dávke 4000 IU raz denne je expozícia anti-Xa
aktivity, vyjadrená AUC v ustálenom stave, pri mierne (klírens kreatinínu 50-80 ml/min) a pri stredne
ťažkej (klírens kreatnínu 30-50 ml/min) poruche funkcie obličiek okrajovo zvýšená. U pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu <30 ml/min) je AUC v ustálenom stave, po opakovaných subkutánnych dávkach 4000 IU raz denne, významne zvýšená (priemerne o 65 %) (pozri časti 4.2 a 4.4).
Hemodialýza
Po jednorazovom i.v. podaní enoxaparínu sodného v dávke 25 IU, 50 IU alebo 100 IU/kg (0,25, 0,50
alebo 1,0 mg/kg) bola jeho farmakokinetika podobná ako u kontrolovanej populácie, avšak AUC bola
dvakrát vyššia ako u kontrolovanej populácie.
Telesná hmotnosť
Po opakovaných s.c. dávkach 150 IU/kg (1,5 mg/kg) jedenkrát denne je priemerná AUC anti-Xa aktivity v ustálenom stave u obéznych zdravých dobrovoľníkov (BMI index 30-48 kg/m2) v porovnaní s osobami s normálnou hmotnosťou okrajovo zvýšená, zatiaľ čo maximálna plazmatická hladina anti-Xa aktivity zvýšená nie je. U obéznych pacientov je po subkutánnom podaní nižší hmotnosťou ovplyvnený klírens.
Po jednorazovom subkutánnom podaní enoxaparínu sodného v dávke 4000 IU (dávka nebola upravená na základe hmotnosti pacienta) ženám (<45 kg) a mužom (<57 kg) s nízkou hmotnosťou bolo zistené, že expozícia anti-Xa aktivity je v porovnaní s osobami s normálnou hmotnosťou u žien o 52 %
a u mužov o 27 % vyššia (pozri časť 4.4).
Farmakokinetickéinterakcie
Pri súbežnom podaní enoxaparínu a trombolytika sa nepozorovali žiadne farmakokinetické interakcie.
5.3 Predklinické údaje o bezpečnosti
V 13-týždňových štúdiach toxicity, kde sa podával s.c. enoxaparín potkanom a psom v dávke
15 mg/kg/deň a v 26 týždňových štúdiach toxicity, kde sa podával enoxaparín s.c. a i.v. potkanom
a opiciam v dávke 10 mg/kg/deň sa iné nežiaduce účinky enoxaparínu okrem antikoagulačného účinku nedokázali.
Nasledujúce testy nepreukázali mutagénne účinky enoxaparínu: Amesov test in-vitro, progresívny mutačný test na bunkách myšacích lymfómov in-vitro, humánny lymfocytový test chromozomálnych aberácií in-vitro a in-vivo test chromozomálnych aberácií na kostnej dreni potkanov.
Štúdie vykonané u gravidných samíc potkanov a králikov s dávkami enoxaparínu sodného do
30 mg/kg/deň nepreukázali žiadne teratogénne účinky ani fetotoxicitu. Po s.c. podaní dávky nižšej ako
20 mg/kg/deň nemal enoxaparín vplyv na fertilitu ani na reprodukčné schopnosti potkaních samcov
a samíc.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Voda na injekciu
6.2 Inkompatibility
Subkutánna
i
n
j
ekcia
Inhixa sa nesmie miešať so žiadnymi inými injekciami alebo infúziou.
Intravenóznainjekcia(bolus)ibapreakútnuindikáciuSTEMI.Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnostiNaplnenástriekačka3 roky
Zriedenýlieksinjekčnýmroztokomchloridusodného9 mg/ml (0,9 %)alebo5%glukózyvovode8 hodín
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25 ° C. Neuchovávajte v mrazničke.
6.5 Druh obalu a obsah balenia0,4 ml roztoku v:
- sklenenej striekačke z číreho bezfarebného neutrálneho skla typu I s pevnou ihlou a krytom ihly
uzavretým chlórbutylovou gumovou zátkou a s žltým polypropylénovým piestom. Injekčné striekačky môžu byť dodatočne vybavené poistným prvkom, ktorý chráni proti pichnutiu ihlou po vykonaní injekcie; alebo
- sklenenej striekačke z číreho bezfarebného neutrálneho skla typu I s pevnou ihlou a krytom ihly
uzavretým chlórbutylovou gumovou zátkou a s bielym polykarbonátovým piestom. Injekčné striekačky môžu byť dodatočne vybavené poistným UltraSafe Passive prvkom, ktorý chráni proti pichnutiu ihlou po vykonaní injekcie.
Balenia s:
- 2, 6, 10 a 30 naplnenými striekačkami
- 2, 6, 10, 20, 30 a 50 naplnenými striekačkami s ochranným krytom ihly
- 2 a 6 naplnenými striekačkami s UltraSafe Passive ochranným krytom ihly
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom NÁVO D NA P O UŽÍVANIE: NAP LNENÁ INJEKČNÁ STRIEKAČK A Ako máte podávať injekciu Inhixa sám sebe

Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak si nie
ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.

- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej
sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte
miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod

kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa
1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená

vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
 Pamätajte:
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto
podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená

a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .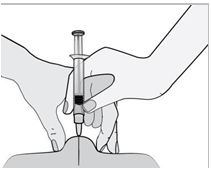 6)
6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný
záhyb držíte počas celého podávania injekcie.
 8)
8) Rovným ťahom ihlu vytiahnite.
Aby ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
 9)
9) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Ako máte podávať injekciu Inhixa sám sebe
Naplnená injekčná striekačka môže mať priložený ochranný kryt ihly, ktorý chráni pred poranením ihlou. Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.
- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej
sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte
miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená

vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená
a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .

 6)
6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného záhybu vpichnite celú dĺžku ihly.
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný

záhyb držíte počas celého podávania injekcie.
 8)
8) Rovným ťahom ihlu vytiahnite. Neprestávajte stláčať piest!
Aby ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.9) Stlačte silno piest striekačky. Poistný prvok ihly, ktorý má podobu plastového cylindra, sa

automaticky nasunie na ihlu a celú ju zakryje.
10) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré
predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.Ako máte podávať injekciu Inhixa sám sebe
Naplnená injekčná striekačka môže mať priložený UltraSafe Passive ochranný kryt ihly, ktorý chráni pred poranením ihlou. Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám
ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom
poučený/á. Ak si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou
sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.

- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.
- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej

sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
 2)
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená
a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e.6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.
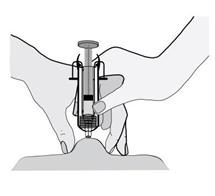
 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný záhyb držíte počas celého podávania injekcie.
8) Rovným ťahom ihlu vytiahnite. Neprestávajte stláčať piest!
 A
by ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
9)
A
by ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
9) Uvoľnite piest a nechajte injekčnú striekačku vysunúť, pokiaľ nie je celá ihla chránená a kryt

nezapadne na miesto.
10) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré
predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITechdow Europe AB
Kåbovägen 32
75236 Uppsala
Švédsko
8. REGISTRAČNÉ ČÍSLOEU/1/16/1132/003
EU/1/16/1132/004
EU/1/16/1132/013
EU/1/16/1132/014
EU/1/16/1132/024
EU/1/16/1132/025
EU/1/16/1132/035
EU/1/16/1132/036
EU/1/16/1132/043
EU/1/16/1132/044
EU/1/16/1132/055
EU/1/16/1132/056
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 15/09/2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUInhixa 6 000 IU (60 mg)/0,6 ml injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE10 000 IU/ml (100 mg/ml) injekčný roztokKaždá naplnená injekčná striekačka obsahuje enoxaparín sodný 6 000 IU anti-Xa aktivity (čo
zodpovedá 60 mg) v 0,6 ml vody na injekciu.
Úplný zoznam pomocných látok, pozri časť 6.1
Enoxaparín sodný je biologické liečivo získané alkalickou depolymerizáciou benzylesteru heparínu derivovaného z prasacej črevnej sliznice.
3. LIEKOVÁ FORMAInjekčný roztok v naplnenej injekčnej striekačke. Číry, bezfarebný až svetložltý roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieInhixa je indikovaný u dospelých:
· Prevencia venóznej tromboembolickej choroby v chirurgii u pacientov so stredným a vysokým rizikom, najmä v ortopedickej alebo všeobecnej chirurgii vrátane onkologickej chirurgie.
· Prevencia venóznej tromboembolickej choroby u interných pacientov s akútnymi ochoreniami
(ako je akútna srdcová nedostatočnosť, respiračné zlyhanie, ťažké infekcie alebo reumatické ochorenia) a zníženou mobilitou so zvýšeným rizikom vzniku venóznej tromboembolickej choroby.
· Liečba hlbokej žilovej trombózy (DVT) a pľúcnej embolizácie (PE) okrem PE, ktorá by mohla vyžadovať trombolytickú liečbu alebo operáciu.
· Prevencia tvorby trombov v mimotelovom obehu počas dialýzy.
· Akútny koronárny syndróm:
- Liečba nestabilnej angíny a infarktu myokardu bez elevácie ST-segmentu (NSTEMI) v
kombinácii s kyselinou acetylsalicylovou, ktorá sa užíva perorálne.
- Liečba akútneho infarktu myokardu s eleváciou ST-segmentu (STEMI) vrátane pacientov, u ktorých sa plánuje konzervatívna (farmakologická) liečba alebo pacientov s následnou perkutánnou koronárnou intervenciou (PCI).
4.2 Dávkovanie a spôsob podávaniaDávkovaniePrevencia venóznej tromboembolickej choroby v chirurgii u pacientov so stredným a vysokýmrizikom
Individuálne riziko tromboembólie u pacientov možno odhadnúť pomocou validovaného modelu stratifikácie rizika.
· U pacientov so stredným rizikom vzniku tromboembólie je odporúčaná dávka 2 000 IU (20 mg)
enoxaparínu sodného jedenkrát denne subkutánnou (s.c.) injekciou. Pri chirurgických výkonoch so stredným rizikom sa ukázalo ako účinné a bezpečné začať podávať enoxaparín sodný 2 000 IU
(20 mg) pred operáciou (2 hodiny pred operáciou).
U pacientov so stredným rizikom je potrebné pokračovať v profylaxii enoxaparínom sodným minimálne 7-10 dní bez ohľadu na to, ako sa pacient zotavuje (napr. mobilita), až kým sa pacient nezotaví z výrazne zníženej mobility.
· U pacientov s vysokým rizikom tromboembólie je odporúčaná dávka 4 000 IU (40 mg)
enoxaparínu sodného jedenkrát denne subkutánnou (s.c.) injekciou so začatím prednostne
12 hodín pred operáciou. Ak je potrebné začať profylaxiu skôr ako 12 hodín pred operáciou (napr. pacient s vysokým rizikom čakajúci na odloženú ortopedickú operáciu), posledná injekcia sa nemá podať neskôr ako 12 hodín pred operáciou a pokračovať 12 hodín po operácii.
o U pacientov podrobujúcich sa veľkej ortopedickej operácii sa odporúča predĺžiť tromboprofylaxiu až do 5 týždňov.
o U pacientov s vysokým rizikom venóznej tromboembólie (VTE) podrobujúcich sa brušnej alebo panvovej operácii kvôli nádorovému ochoreniu sa odporúča predĺžiť tromboprofylaxiu až do 4 týždňov.
Profylaxia venóznej tromboembólie u interných pacientov
Odporúčaná dávka enoxaparínu sodného je 4 000 IU (40 mg) jedenkrát denne s.c. injekciou.
Liečba enoxaparínom sodným sa predpisuje najmenej na 6 až 14 dní bez ohľadu na to, ako sa pacient
zotavuje (napr. mobilita). Prínos liečby trvajúcej viac ako 14 dní sa nepotvrdil.
Liečba hlbokej žilovej trombózy (DVT) a pľúcnej embolizácie (PE)
Enoxaparín sodný sa môže podávať s.c. injekciou buď jedenkrát denne 150 IU/kg (1,5 mg/kg), alebo
dvakrát denne 100 IU/kg (1 mg/kg).
Režim musí zvoliť lekár na základe individuálneho posúdenia a vyhodnotenia rizika tromboembólie a rizika krvácania. Dávkovací režim 150 IU/kg (1,5 mg/kg) jedenkrát denne sa má použiť u nekomplikovaných pacientov s nízkym rizikom rekurencie VTE. U všetkých ostatných pacientov, ako sú pacienti s obezitou, symptomatickou PE, onkologickým ochorením, rekurentnou VTE alebo proximálnou trombózou (vena iliaca) sa má použiť dávkovací režim 100 IU/kg (1 mg/kg) dvakrát denne.
Liečba enoxaparínom sodným sa predpisuje priemerne na 10 dní. Liečbu perorálnymi antikoagulanciami treba začať, keď je to vhodné (pozri “Prechod medzi enoxaparínom sodným a perorálnymi antikoagulaciami” na konci časti 4.2).
Prevencia tvorby trombov v mimotelovom obehu počas dialýzy
Odporúčaná dávka je 100 IU/kg (1 mg/kg) enoxaparínu sodného.
U pacientov s vysokým rizikom krvácania sa má dávka znížiť na 50 IU/kg (0,5 mg/kg) pri dvojitom
cievnom prístupe alebo na 75 IU/kg (0,75 mg/kg) pri jednoduchom cievnom prístupe.
Počas dialýzy sa má enoxaparín sodný zaviesť do arteriálnej linky na začiatku dialýzy. Účinok tejto dávky je zvyčajne dostatočný pre 4-hodinovú dialýzu, ak sa však zistí prítomnosť fibrínových prstencov, napríklad pri dialýze trvajúcej dlhšie ako je bežné, môže sa podať ďalšia dávka 50 IU až
100 IU/kg (0,5 až 1 mg/kg).
Nie sú k dispozícii žiadne údaje týkajúce sa pacientov používajúcich enoxaparín sodný na profylaxiu alebo na liečbu v priebehu podávania dialýzy.
Akútny koronárny syndróm: liečba nestabilnej angíny a infarktu myokardu bez elevácie ST-segmentu
(NSTEMI) a akútneho infarktu myokardu s eleváciou ST-segmentu (STEMI)
· Na liečbu nestabilnej angíny a NSTEMI je odporúčaná dávka enoxaparínu sodného 100 IU/kg
(1 mg/kg) každých 12 hodín subkutánnou injekciou podávanou v kombinácii s antiagregačnou
liečbou. V liečbe treba pokračovať minimálne 2 dni a potom až do klinickej stabilizácie. Zvyčajná dĺžka liečby je 2 až 8 dní.
Všetkým pacientom sa odporúča podávať kyselinu acetylsalicylovú, ak nie je kontraindikovaná, so
začiatočnou perorálnou dávkou 150–300 mg (u pacientov bez predchádzajúcej liečby kyselinou acetylsalicylovou) a udržiavaciou dávkou 75–325 mg/deň, ktorá sa podáva dlhodobo bez ohľadu na stratégiu liečby.
· Na liečbu akútneho infarktu myokardu s eleváciou ST-segmentu STEMI je odporúčaná dávka enoxaparínu sodného jedna bolusová dávka 3000 IU (30 mg) podaná intravenózne (i.v.) plus dávka 100 IU/kg (1 mg/kg) podaná subkutánne (s.c.). Následne sa podáva dávka 100 IU/kg
(1 mg/kg) s.c. každých 12 hodín (s obmedzením na maximálne 10 000 IU (100 mg) na každú

z prvých dvoch dávok podaných s.c.). Súbežne sa má podávať vhodná antiagregačná liečba, ako je perorálne podávanie kyseliny acetylsalicylovej (75 mg až 325 mg jedenkrát denne), ak nie je kontraindikovaná. Odporúča sa, aby liečba enoxaparínom sodným trvala 8 dní alebo dovtedy, kým pacient neprejde do ambulantnej liečby, podľa toho, čo nastane skôr. Ak sa enoxaparín sodný podáva s trombolytikom (fibrín špecifickým alebo fibrín nešpecifickým), musí sa enoxaparín sodný podať v časovom rozmedzí 15 minút pred a 30 minút po začiatku fibrinolytickej liečby.
o Dávkovanie u pacientov vo veku ≥ 75 rokov je uvedené v časti “Starší ľudia”.
o U pacientov liečených perkutánnou koronárnou intervenciou (PCI) nie je potrebná
žiadna dodatočná dávka, ak bol enoxaparín sodný naposledy podaný subkutánne pred
menej ako ôsmimi hodinami pred insufláciou balónu. Ak bol enoxaparín sodný naposledy podaný subkutánne pred viac ako ôsmimi hodinami pred insufláciou
balónu, musí sa podať dávka 30 IU/kg (0,3 mg/kg) enoxaparínu sodného ako i.v.
bolusová dávka.
Starší ľudiaPre všetky indikácie okrem STEMI u starších pacientov nie je potrebná úprava dávky, s výnimkou prípadov s poruchou funkcie obličiek (pozri časti “Porucha funkcie obličiek” a časť 4.4).
Na liečbu akútneho STEMI u pacientov vo veku 75 a viac rokov, sa počiatočná intravenózna
bolusová dávka nesmie použiť. Začnite dávkovanie subkutánnou dávkou 75 IU/kg (0,75 mg/kg)
každých 12 hodín (s obmedzením na maximum 7 500 IU (75 mg) len pre každú z prvých dvoch dávok podaných subkutánne, potom pre zostávajúce ďalšie dávky je odporúčané dávkovanie 75 IU/kg
(0,75 mg/kg) subkutánne). Dávkovanie u starších pacientov s poruchou funkcie obličiek je uvedené
nižšie v časti “Porucha funkcie obličiek” a v časti 4.4.
Porucha funkcie pečeneU pacientov s poruchou funkcie pečene sú k dispozícii len obmedzené údaje (pozri časti 5.1 a 5.2) a treba u nich postupovať s opatrnosťou (pozri časť 4.4).
Porucha funkcie obličiek (pozri časti 4.4 a 5.2)· Závažná porucha funkcie obličiek
Enoxaparín sodný sa neodporúča u pacientov v terminálnom štádiu ochorenia obličiek (klírens kreatinínu <15 ml/min) pre nedostatok údajov v tejto populácii, okrem prevencie tvorby trombov v mimotelovom obehu počas hemodialýzy.
Tabuľka s dávkovaním pre pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu [15-
30] ml/min):
Indikácia Dávkovanie
Prevencia venóznej tromboembolickej choroby 2 000 IU (20 mg) s.c. jedenkrát denne
Liečba DVT a PE 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. jedenkrát
denne
Liečba angíny a NSTEMI 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. jedenkrát
denne
Liečba akútneho STEMI (pacienti vo veku do

75 rokov)
Liečba akútneho STEMI (pacienti vo veku nad
75 rokov)
1 x 3 000 IU (30 mg) IV bolus plus 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. a potom 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. každých 24 hodín
Bez i.v. úvodného bolusu, 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. a potom 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. každých 24 hodín
Úprava odporúčaného dávkovania sa nevzťahuje na indikáciu týkajúcu sa hemodialýzy.
· Stredne ťažká a mierna porucha funkcie obličiek
Aj keď pacientom so stredne ťažkou (klírens kreatinínu 30-50 ml/min) alebo miernou (klírens
kreatinínu 50-80 ml/min) poruchou funkcie obličiek nie je nutné dávku upravovať, odporúča sa dôsledné klinické sledovanie.
Spôsobpodávania
Inhixa sa nemá podávať intramuskulárne.
Na profylaxiu venóznej tromboembolickej choroby po chirurgickom zákroku, na liečbu DVT a PE, na liečbu nestabilnej angíny a NSTEMI sa enoxaparín sodný má podávať s.c. injekciou.
· Pri akútnom STEMI sa liečba začína jednou i.v. bolusovou injekciou, po ktorej ihneď nasleduje
s.c. injekcia.
· Na prevenciu tvorby trombov v mimotelovom obehu počas dialýzy sa podáva do arteriálnej linky dialyzačného obvodu.
Naplnená injekčná striekačka je pripravená na okamžité použitie.
Pri používaní ampuliek alebo viacdávkových injekčných liekoviek sa odporúča použiť tuberkulínovú injekčnú striekačku alebo ekvivalent, aby sa tým zabezpečilo, že bude do injekčnej striekačky natiahnutý správny objem lieku.
· s.c. injekčná technika:
Injekcia enoxaparínu sodného sa má podávať pacientovi prednostne v ležiacej polohe hlbokou s.c.
injekciou.
Ak používate naplnenú injekčnú striekačku, pred podaním injekcie z nej neodstrekujte vzduchovú bublinu, aby sa zabránilo stratám lieku. Ak je potrebné upraviť množstvo lieku, ktoré sa má podať, podľa telesnej hmotnosti pacienta, použite na dosiahnutie požadovaného množstva kalibrovanú injekčnú striekačku a prebytočné množstvo zlikvidujte. Uvedomte si, že v niektorých prípadoch nie je možné dosiahnuť presnú dávku kvôli kalibrácii (dielikom) na injekčnej striekačke, vtedy treba objem zaokrúhliť na najbližšiu hodnotu (najbližší dielik).
Injekcia sa má podávať do ľavej a pravej anterolaterálnej alebo posterolaterálnej časti brušnej steny.
Celá dĺžka ihly sa zavedie kolmo do kožného záhybu vytvoreného medzi palcom a ukazovákom. Kožný záhyb sa nemá uvoľniť dovtedy, kým injekcia nie je podaná celá. Po podaní injekcie miesto podania nemasírujte.
Poznámka pre naplnené injekčné striekačky s automatickým bezpečnostným systémom: bezpečnostný systém sa aktivuje na konci injekcie (pozri pokyny v časti 6.6).
Ak si bude pacient podávať subkutánnu injekciu sám, pacienta treba upozorniť, aby si veľmi pozorne prečítal pokyny v písomnej informácii pre používateľa, ktorá je súčasťou balenia lieku.
i.v. (bolus) injekcia (len pre indikáciu STEMI):
Pri akútnom STEMI sa liečba začína jednou i.v. bolusovou injekciou, za ktorou ihneď nasleduje s.c.
injekcia.
Pri i.v. injekcii sa môže použiť buď viacdávková injekčná liekovka alebo naplnená injekčná striekačka.
Enoxaparín sodný sa má podať do i.v. linky. Nemá sa miešať ani podávať spolu s inými liekmi. Na
zabránenie možnosti zmiešania enoxaparínu sodného s inými liekmi sa musí vybraný intravenózny prístup pred a aj po intravenóznej aplikácii enoxaparínu sodného premyť dostatočným množstvom soľného roztoku alebo roztoku dextrózy na vyčistenie prístupu pre liek. Enoxaparín sodný sa môže bezpečne podať spolu s normálnym roztokom chloridu sodného (soľný roztok) (0,9 %) alebo s 5 %- ným vodným roztokom dextrózy.
oÚvodný bolus 3 000 IU (30 mg)
Pomocou kalibrovanej naplnenej injekčnej striekačky odstreknite nadbytočný objem tak, aby injekčná
striekačka obsahovala len 3000 IU (30 mg, 0,3 ml) enoxaparínu sodného. Dávka 3000 IU (30 mg) sa
potom podáva priamo do intravenóznej linky.
oDodatočný bolus pri PCI v prípade, že sa posledné s.c. podanie uskutočnilo pred viac ako
8 hodinami pred insufláciou balónu
Pre pacientov liečených PCI sa má podať dodatočný i.v. bolus 30 IU/kg (0,3 mg/kg) a to vtedy, keď bol enoxaparín sodný naposledy podaný subkutánne pred viac ako 8 hodinami pred insufláciou balónu.
Na zabezpečenie presného odmerania malého objemu injekcie sa odporúča nariediť liek na 300 IU/ml (3 mg/ml). Na dosiahnutie koncentrácie 300 IU/ml (3 mg/ml) s použitím naplnených injekčných striekačiek obsahujúcich 6000 IU (60 mg) enoxaparínu sodného sa odporúča použiť infúzny vak
s objemom 50 ml (napr. použiť fyziologický roztok (0,9 %) alebo 5 %-ný vodný roztok dextrózy)
nasledujúcim spôsobom:
Injekčnou striekačkou odoberte z infúzneho vaku 30 ml roztoku a tento odobraný roztok odstráňte. Celý obsah naplnenej injekčnej striekačky obsahujúcej 6000 IU (60 mg) enoxaparínu sodného vstreknite do vaku k zostávajúcim 20 ml roztoku. Obsah vaku jemne premiešajte. Naberte požadovaný objem nariedeného roztoku do injekčnej striekačky určenej na podanie roztoku do intravenóznej linky.
Po ukončení riedenia sa dá vypočítať potrebný objem, ktorý je potrebný na podanie v injekcii, pomocou tohto vzorca: [objem nariedeného roztoku (ml) = hmotnosť pacienta (kg) x 0,1] alebo podľa nižšie uvedenej tabuľky. Riedenie roztoku sa odporúča robiť bezprostredne pred použitím.
Objem roztoku, ktorý má byť po nariedení podaný do i.v. linky v koncentrácii 300 IU (3 mg) /ml.
h
m
o
t
nosť požadovaná dávka
3
0 IU/kg (0,3 mg/kg)
o
bjem, ktorý má byť
podaný po nariedení na konečnú koncentráciu
30
0 IU (3 mg) / ml
[
k
g
] IU [mg] [ml]
45 1350 13,5 4,5
50 1500 15 5
55 1650 16,5 5,5
60 1800 18 6
65 1950 19,5 6,5
70 2100 21 7
75 2250 22,5 7,5
80 2400 24 8
85 2550 25.5 8.5
90 2700 27 9
95 2850 28,5 9,5
100 3000 30 10
105 3150 31,5 10,5
110 3300 33 11
115 3450 34.5 11.5
120 3600 36 12
125 3750 37,5 12,5
130 3900 39 13
135 4050 40,5 13,5
140 4200 42 14
145 4350 43,5 14,5
150 4500 45 15
· Injekcia do arteriálnej linky:
Podáva sa do arteriálnej linky dialyzačného obvodu na prevenciu tvorby trombov v mimotelovom
obehu počas hemodialýzy.
Prechodmedzienoxaparínomsodnýmaantikoagulanciami
· Prechod medzi enoxaparínom sodným a antagonistami vitamínu K (VKA)
Je nutné zintenzívniť klinické monitorovanie a laboratórne testy [protrombínový čas vyjadrený ako
International Normalized Ratio (INR)] s cieľom sledovať účinok VKA.
Nakoľko je tu časový interval, kým VKA dosiahne svoj maximálny účinok, liečba enoxaparínom sodným musí pokračovať v konštantnej dávke tak dlho, ako je to nutné na udržanie INR
v požadovanom terapeutickom rozsahu v danej indikácii v dvoch po sebe nasledujúcich testoch. U pacientov liečených VKA je potrebné liečbu VKA ukončiť a prvú dávku enoxaparínu sodného podať vtedy, keď INR poklesne pod terapeutický rozsah.
· Prechod medzi enoxaparínom sodným a priamymi perorálnymi antikoagulanciami (DOAC) U pacientov, ktorí dostávajú v súčasnosti enoxaparín sodný, je potrebné ukončiť túto liečbu a začať s užívaním DOAC od 0 do 2 hodín pred časom určeným pôvodne na podanie ďalšej dávky enoxaparínu sodného, dávkovanie DOAC sa má použiť tak, ako je uvedené v jeho SPC.
U pacientov, ktorí užívajú v súčasnosti DOAC, sa má prvá dávka enoxaparínu sodného podať v čase,
kedy sa pôvodne mala užiť ďalšia dávka DOAC.
Podanieprispinálnej/epidurálnejanestéziialebolumbálnejpunkcii
Ak sa lekár rozhodne podať antikoagulačnú liečbu v súvislosti s epidurálnou alebo spinálnou anestéziou/analgéziou alebo lumbálnou punkciou, odporúča sa dôsledné neurologické monitorovanie kvôli riziku neuraxiálnych hematómov (pozri časť 4.4).
- Pri dávkach používaných na prevenciu
Medzi poslednou injekciou enoxaparínu sodného pri profylaktických dávkach a zavedením ihly alebo katétra sa musí zachovať časový interval bez punkcie najmenej 12 hodín.
Pri kontinuálnych technikách sa má zachovať podobný posun najmenej 12 hodín pred odstránením katétra.
Pre pacientov s klírensom kreatinínu [15-30] ml/min treba uvažovať so zdvojnásobením časového intervalu punkcia/zavedenie katétra alebo odstránenie katétra na najmenej 24 hodín. Začatie liečby enoxaparínom sodným v dávke 2 000 IU (20 mg) 2 hodiny pred operáciou nie je kompatibilné s neuraxiálnou anestéziou.
- Pri dávkach používaných na liečbu
Medzi poslednou injekciou enoxaparínu sodného pri kuratívnych dávkach a zavedením ihly alebo katétra sa musí zachovať časový interval bez punkcie najmenej 24 hodín (pozri aj časť
4.3).
Pri kontinuálnych technikách sa má zachovať podobný posun najmenej 24 hodín pred odstránením katétra.
Pre pacientov s klírensom kreatinínu [15-30] ml/min treba uvažovať so zdvojnásobením časového intervalu punkcia/zavedenie katétra alebo odstránenie katétra na najmenej 48 hodín. Pacienti dostávajúci dávky dvakrát denne (t.j. 75 IU/kg (0,75 mg/kg) dvakrát denne alebo
100 IU/kg (1 mg/kg) dvakrát denne) majú vynechaťdruhú dávku enoxaparínu kvôli umožneniu dostatočného časového posunu pre zavedenie alebo odstránenie katétra.
Hladina anti-Xa je v týchto časových bodoch stále ešte detekovateľná a toto posunutie negarantuje, že
sa zabráni vytvoreniu neuraxiálneho hematómu.
Rovnako treba zvážiť posunutie času podania enoxaparínu sodného o najmenej 4 hodiny po spinálnej/epidurálnej punkcii alebo po odstránení katétra. Tento časový posun musí vychádať
z vyhodnotenia pomeru prínos - riziko berúc do úvahy aj riziko trombózy aj riziko krvácania
v kontexte liečby a rizikových faktorov konkrétneho pacienta.
4.3 Kontraindikácie
Enoxaparín sodný je kontraindikovaný u pacientov:
· s precitlivenosťou na enoxaparín sodný, heparín alebo jeho deriváty vrátane iných nízkomolekulových heparínov (LMWH) alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1;
· s anamnézou heparínom indukovanej trombocytopénie (HIT) sprostredkovanej imunitou za posledných 100 dní alebo s prítomnosťou cirkulujúcich protilátok (pozri aj časť 4.4);
· s aktívnym klinicky signifikantným krvácaním a stavmi s vysokým rizikom krvácania, vrátane nedávnej mozgovej príhody s krvácaním, so žalúdočnočrevným vredom, s prítomnosťou
malígnej neoplazmy s vysokým rizikom krvácania, nedávnou operáciou mozgu, chrbtice alebo oka, so známymi alebo suspektnými varixami ezofágu, s arteriovenóznymi malformáciami,
s vaskulárnou aneuryzmou alebo s veľkými intraspinálnymi alebo intracerebrálnymi vaskulárnymi abnormalitami;
· pri spinálnej alebo epidurálnej anestézii alebo lokálno-regionálnej anestézii, ak sa enoxaparín sodný použil v predchádzajúcich 24 hodinách (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
· Všeobecné
Enoxaparín sodný nemožno zamieňať (jednotku za jednotku) s inými nízkomolekulovými heparínmi (LMWHs). Tieto lieky sa líšia svojím výrobným postupom, molekulovou hmotnosťou, špecifickou anti-Xa a anti-IIa aktivitou, jednotkami, dávkovaním a klinickou účinnosťou a bezpečnosťou. Následkom toho majú rozdielnu farmakokinetiku a biologickú aktivitu (napr. antitrombínovú aktivitu a interakciu s krvnými doštičkami). Preto treba venovať osobitnú pozornosť špecifickým pokynom na používanie pre každý z týchto liekov a dodržiavať ich.
· Anamnéza HIT (>100 dní)
Používanie enoxaparínu sodného u pacientov s anamnézou imunitne sprostredkovanej HIT za posledných 100 dní alebo pri prítomnosti cirkulujúcich protilátok je kontraindikované (pozri časť 4.3). Cirkulujúce protilátky môžu pretrvávať niekoľko rokov.
U pacientov s anamnézou (>100 dní) heparínom indukovanej trombocytopénie bez prítomnosti
cirkulujúcich protilátok sa má enoxaparín sodný používať s mimoriadnou opatrnosťou. V takomto prípade možno urobiť rozhodnutie o použití enoxaparínu sodného len po starostlivom vyhodnotení pomeru prínos-riziko a po zvážení možnosti neheparínovej alternatívnej liečby (napr. danaparoid sodný alebo lepirudín).
· Monitorovanie počtu krvných doštičiek
Pri nízkomolekulových heparínoch existuje aj riziko vzniku heparínom indukovanej trombocytopénie
sprostredkovanej protilátkami. Ak sa vyskytne trombocytopénia, zvyčajne sa objaví medzi 5. až
21.dňom od začiatku liečby enoxaparínom.
Riziko HIT je vyššie u pacientov po operácii a najmä po operácii srdca a u onkologických pacientov. Preto sa odporúča zmerať počet krvných doštičiek na začiatku liečby enoxaparínom sodným a potom merať pravidelne počas liečby.
Ak existujú klinické príznaky pripomínajúce HIT (nová epizóda arteriálneho a/alebo venózneho
tromboembolizmu, bolestivé kožné lézie v mieste injekcie, alergické alebo anafylaktoidné reakcie na liečbu), je potrebné zmerať počet krvných doštičiek. Pacienti musia byť upovedomení, že takéto príznaky sa môžu objaviť a ak sa to stane, musia informovať svojho lekára.
V praxi, ak sa potvrdí signifikantný pokles počtu krvných doštičiek (30 až 50 % z východiskovej hodnoty), liečba enoxaparínom sodným sa musí okamžite ukončiť a pacient musí prejsť na inú alternatívnu neheparínovú antikoagulačnú liečbu.
· Krvácanie
Rovnako ako pri iných antikoagulanciách, môže sa vyskytnúť v ktoromkoľvek mieste krvácanie.
Ak sa vyskytne, je nutné vyšetriť pôvod krvácania a začať vhodnú liečbu.
Rovnako ako pri inej antikoagulačnej liečbe, enoxaparín sodný sa má použiť s opatrnosťou v stavoch so zvýšeným potenciálom pre krvácanie, ako je napríklad:
· porucha hemostázy,
· peptický vred v anamnéze,
· nedávno prekonaná ischemická mozgová príhoda,
· ťažká arteriálna hypertenzia,
· nedávna diabetická retinopatia,
· neurologický alebo oftalmologický chirurgický výkon,
· súbežné podávanie liekov ovplyvňujúcich hemostázu (pozri časť 4.5).
· Laboratórne vyšetrenia
Enoxaparín sodný podávaný v dávkach za účelom profylaxie venóznej tromboembólie významne neovplyvňuje dobu krvácania a celkové koagulačné testy, nemá vplyv na agregáciu krvných doštičiek alebo na väzbu fibrinogénu na krvné doštičky.
Pri vyšších dávkach enoxaparínu sa môže zvýšiť aktivovaný parciálny tromboplastínový čas (aPTT) a
aktivovaný čas koagulácie (ACT). Predĺženia aPTT a ACT a zvýšený antitrombotický účinok enoxaparínu sodného nie sú v lineárnom vzťahu, a preto tieto hodnoty nie sú pre sledovanie účinku enoxaparínu sodného vhodné ani spoľahlivé.
· Spinálna/Epidurálna anestézia alebo lumbálna punkcia
Spinálna/epidurálna anestézia alebo lumbálna punkcia sa nesmie robiť v priebehu 24 hodín od podania
enoxaparínu sodného v terapeutických dávkach (pozri tiež časť4.3).
Pri súbežnom použití enoxaparínu a spinálnej / epidurálnej anestézie alebo spinálnej punkcii boli hlásené prípady neuraxiálnych hematómov, ktoré mali za následok dlhodobú alebo trvalú paralýzu. Pri
dávkovacom režime 4000 IU (40 mg) jedenkrát denne a nižšom sú tieto prípady zriedkavé. Riziko je
vyššie pri vyšších dávkovacích režimoch enoxaparínu sodného, pri použití pooperačných epidurálnych
katétrov, pri súbežnom užívaní ďalších liekov ovplyvňujúcich hemostázu ako sú nesteroidné protizápalové lieky (NSAID), pri traumatickej alebo opakovanej epidurálnej alebo spinálnej punkcii alebo u pacientov s operáciou chrbtice v anamnéze alebo deformáciou chrbtice v anamnéze.
Pri súbežnom použití enoxaparínu a epidurálnej alebo spinálnej anestézie / analgézie alebo spinálnej punkcii je potrebné na zníženie rizika vzniku krvácania vziať do úvahy farmakokinetický profil enoxaparínu sodného (pozri časť 5.2). Zavedenie alebo odstraňovanie epidurálneho katétra alebo lumbálnej punkcie je najlepšie robiť vtedy, keď je antikoagulačný účinok enoxaparínu nízky; avšak presný čas, kedy sa dosiahne dostatočne nízky antikoagulačný účinok u konkrétneho pacienta, nie je známy. U pacientov s klírensom kreatinínu [15 -30 ml/minúta] je potrebné zvažovať aj ďalšie okolnosti, pretože eliminácia enoxaparínu trvá dlhšie (pozri časť 4.2).
Ak sa lekár rozhodne podať antikoagulačnú liečbu v súvislosti s epidurálnou alebo spinálnou anestéziou/analgéziou alebo lumbálnou punkciou, je potrebné často monitorovať akékoľvek prejavy a príznaky neurologického poškodenia, ako je bolesť pozdĺž chrbtice, zmyslové a motorické ťažkosti (necitlivosť alebo slabosť dolných končatín), poruchy činnosti hrubého čreva a/alebo močového mechúra. Pacienta je potrebné poučiť, že má ihneď informovať lekára, ak spozoruje niektorý z vyššie uvedených prejavov alebo príznakov. Pri podozrení na prejavy alebo príznaky spinálneho hematómu
je potrebná urgentná diagnostika a okamžitá liečba, vrátane zváženia dekompresie miechy, aj keď táto liečba nemusí zabrániť alebo zvrátiť neurologické následky.
· Nekróza kože / kožná vaskulitída
Pri LMWH bola hlásená nekróza kože a kožná vaskulitída, v takých prípadoch treba okamžite liečbu ukončiť.
· Perkutánne koronárne revaskularizačné výkony
Aby sa minimalizovalo riziko krvácania pri cievnych inštrumentálnych výkonoch uskutočňovaných počas liečby nestabilnej angíny pectoris, NSTEMI a akútneho STEMI, dôsledne dodržiavajte intervaly
odporúčané medzi dávkami enoxaparínu sodného. Je to dôležité preto, aby sa dosiahla hemostáza v mieste punkcie po PCI. V prípade, že sa použije uzatváracia pomôcka, púzdro cievneho vodiča (sheat) možno odstrániť okamžite. Ak sa použije metóda manuálnej kompresie, púzdro cievneho
vodiča (sheat) sa má odstrániť po 6 hodinách po poslednej i.v./s.c. injekcii enoxaparínu sodného. Ak má liečba enoxaparínom sodným pokračovať, ďalšia plánovaná dávka enoxaparínu sa má podať
najskôr 6-8 hodín po odstránení puzdra. Má sa sledovať, či sa v mieste výkonu nevyskytnú príznaky
krvácania alebo hematóm.
· Akútna infekčná endokarditída
U pacientov s akútnou infekčnou endokarditídou sa používanie heparínu obvykle neodporúča kvôli
riziku krvácania do mozgu. Ak sa jeho použitie považuje za absolútne nebyhnutné, rozhodnutie treba
urobiť len po starostlivom individuálnom posúdení pomeru prínos-riziko.
· Umelá mechanická srdcová chlopňa
Používanie enoxaparínu sodného u pacientov s umelou mechanickou srdcovou chlopňou za účelom
tromboprofylaxie nebolo dostatočne preskúmané. U pacientov s umelou mechanickou srdcovou chlopňou, ktorým bol podávaný enoxaparín za účelom tromboprofylaxie, sa zaznamenali ojedinelé prípady trombózy umelej srdcovej chlopne. Nejasné okolnosti, vrátane základného ochorenia
a nedostatočných klinických údajov, obmedzujú zhodnotenie týchto prípadov. Niektoré z týchto prípadov boli gravidné ženy, u ktorých trombóza spôsobila smrť matky a plodu.
· Gravidné ženy s umelou mechanickou srdcovou chlopňou
Používanie enoxaparínu sodného u gravidných žien s umelou mechanickou srdcovou chlopňou
za účelom tromboprofylaxie nebolo dostatočne preskúmané. V klinickej štúdii s gravidnými ženami s umelou mechanickou srdcovou chlopňou, kde sa podával enoxaparín v dávke 100 IU/kg (1 mg/kg) dvakrát denne za účelom zníženia rizika tromboembólie, došlo u 2 z 8 žien k tvorbe krvných zrazenín, ktoré zablokovali chlopňu a spôsobili smrť matky a plodu. Po uvedení lieku na trh sa u gravidných
žien s umelou mechanickou srdcovou chlopňou, ktorým sa podával profylakticky enoxaparín,
zaznamenali ojedinelé prípady chlopňovej trombózy. Gravidné ženy s umelou mechanickou srdcovou
chlopňou môžu byť vystavené vyššiemu riziku tromboembólie.
· Starší ľudia
Pri podávaní profylaktických dávok enoxaparínu starším pacientom sa nepozorovala zvýšená
tendencia ku krvácaniu.
Starší pacienti (hlavne 80-roční a starší) môžu byť pri podávaní terapeutických dávok enoxaparínu vystavení vyššiemu riziku komplikácií s krvácaním. Odporúča sa preto starostlivé klinické sledovanie a u pacientov starších ako 75 rokov liečených na STEMI možno zvážiť zníženie dávky (pozri časti 4.2 a 5.2).
· Porucha funkcie obličiek
Pacienti s poruchou funkcie obličiek sú vystavení vyššiemu účinku enoxaparínu sodného, čím sa zvyšuje riziko krvácania. U týchto pacientov sa odporúča starostlivé klinické monitorovanie a možno zvážiť aj biologické monitorovanie meraním anti-Xa aktivity(pozri časti 4.2 a 5.2).
Enoxaparín sodný sa neodporúča u pacientov v terminálnom štádiu ochorenia obličiek (klírens
kreatinínu <15 ml/min) pre nedostatok údajov v tejto populácii okrem prevencie tvorby trombov
v mimotelovom obehu počas dialýzy.
Pacienti so závažnou poruchou funkcie obličiek (klírens kreatinínu 15-30 ml/min ) sú vystavení výrazne vyššiemu účinku enoxaparínu sodného, preto sa odporúča úprava terapeutických
a profylaktických dávkovacích režimov (pozri časť 4.2).
Pacientom so stredne ťažkou (klírens kreatinínu 30-50 ml/min) a miernou (klírens kreatinínu 50-
80 ml/min) poruchou funkcie obličiek nie je nutné upraviť dávku.
· Porucha funkcie pečene
U pacientov s poruchou funkcie pečene je potrebná opatrnosť pri používaní enoxaparínu sodného
kvôli zvýšenému potenciálu krvácania. Úprava dávky na základe monitorovania hladiny anti-Xa nie je
spoľahlivá u pacientov s cirhózou pečene a neodporúča sa (pozri časť 5.2).
· Nízka hmotnosť
Pacienti s nízkou hmotnosťou (ženy < 45 kg, muži < 57 kg) sú pri podávaní profylaktických dávok enoxaparínu sodného (neupravených podľa hmotnosti pacienta) vystavení vyššiemu účinku lieku, čo
môže viesť k vyššiemu riziku krvácania. Preto sa odporúča starostlivé klinické sledovanie takýchto pacientov (pozri časť 5.2).
· Obézni pacienti
Obézni pacienti majú vyššie riziko trombembolizmu. Bezpečnosť a účinnosť profylaktických dávok
u obéznych pacientov (BMI >30 kg/m2) nebola úplne stanovená a neexistuje konsenzus, pokiaľ ide
o úpravu dávok. U týchto pacientov je potrebné starostlivo sledovať prejavy a príznaky
tromboembolizmu.
· Hyperkaliémia
Heparíny môžu potláčať sekréciu aldosterónu v nadobličkách, čo spôsobuje hyperkaliémiu (pozri časť
4.8), najmä u pacientov s diabetom mellitus, chronickým zlyhaním obličiek, preexistujúcou
metabolickou acidózou, pacientov užívajúcich lieky, o ktorých je známe, že zvyšujú hladinu draslíka (pozri časť 4.5). Je potrebné pravidelne monitorovať plazmatické hladiny draslíka, najmä u rizikových pacientov.
· Sledovateľnosť lieku
Nízkomolekulové heparíny (LMWHs) sú biologické liečivá. Zdravotníckym pracovníkom sa odporúča zaznamenať obchodný názov a číslo šarže podaného lieku do zdravotného záznamu pacienta s cieľom zlepšiť sledovateľnosť LMWH.
Obsahsodíka
Tento liek obsahuje menej než 1 mmol sodíka (23 mg) na dávku, t.j. obsahuje v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Súbežné
používanie
sa
neodporúča:
· Lieky ovplyvňujúce hemostázu (pozri časť 4.4)
Pred začiatkom terapie enoxaparínom sa odporúča prerušiť liečbu niektorými liekmi ovplyvňujúcimi hemostázu, pokiaľ nie sú striktne indikované. Ak je kombinované používanie indikované, je potrebné pri používaní enoxaparínu sodného starostlivé príslušné klinické a laboratórne monitorovanie. K takýmto liekom patria:
- systémové salicyláty, kyselina acetylsalicylová a nesteroidné antiflogistiká (NSAID)
vrátane ketorolaku,
- iné trombolytiká (napr. altepláza, retepláza, streptokináza, tenektepláza, urokináza) a antikoagulanciá (pozri časť 4.2).
Súbežnépoužívaniesaodporúčasopatrnosťou:
Tieto lieky je možné podávať súbežne s enoxaparínom sodným s opatrnosťou:
· Iné lieky ovplyvňujúce hemostázu, ako sú:
- inhibítory zhlukovania krvných doštičiek vrátane kyseliny acetylsalicylovej používanej
ako antiagregačný liek (v dávke na kardioprotekciu), klopidogrel, tiklopidín a antagonisty
glykoproteínu IIb/IIIa indikované pri akútnom koronárnom syndróme, kvôli riziku krvácania,
- dextran 40,
- systémové glukokortikoidy.
· Lieky zvyšujúce hladinu draslíka:
Lieky zvyšujúce sérovú hladinu draslíka sa môžu podávať súbežne s enoxaparínom sodným pri starostlivom klinickom a laboratórnom monitorovaní (pozri časti 4.4 a 4.8).
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí nie sú žiadne dôkazy o prechode enoxaparínu placentárnou bariérou v druhom a treťom trimestri gravidity. O prvom trimestri nie sú k dispozícii žiadne informácie.
Štúdie na zvieratách nepreukázali žiadne známky fetálnej toxicity alebo teratogenity (pozri časť 5.3). Na údajoch o zvieratách sa preukázalo, že prechod enoxaparínu cez placentu je minimálny. Enoxaparín možno používať počas gravidity len ak lekár potvrdí jednoznačnú potrebu jeho použitia.
Ženy, ktoré dostávajú enoxaparín sodný počas gravidity, treba starostlivo monitorovať, pokiaľ ide o prejavy krvácania alebo výraznej antikoagulácie a upozorniť ich na riziko krvácania. Podľa celkových údajov u tehotných žien neexistuje dôkaz zvýšeného rizika krvácania, trombocytopénie alebo osteoporózy v porovnaní s rizikom pozorovaným u žien, ktoré nie sú gravidné, okrem rizika, ktoré sa pozorovalo u tehotných žien s umelou srdcovou chlopňou (pozri časť 4.4).
Ak sa plánuje epidurálna anestézia, odporúča sa predtým ukončiť liečbu enoxaparínom sodným (pozri časť 4.4).
Dojčenie
Nie je známe, či sa nezmenený enoxaparín vylučuje do ľudského materského mlieka. U dojčiacich potkanov je prechod enoxaparínu alebo jeho metabolitov do mlieka veľmi nízky. Perorálna absorpcia
enoxaparínu je nepravdepodobná. Inhixa sa môže používať počas dojčenia.
Fertilita
Nie sú žiadne klinické údaje súvisiace s enoxaparínom sodným týkajúce sa fertility. Štúdie na zvieratách nepreukázali žiadny vplyv na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Enoxaparín sodný nemá žiadny alebo má len zanedbateľný vplyv na schopnosť riadiť motorové vozidlo a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Enoxaparín sa vyhodnocoval u viac ako 15 000 pacientov, ktorí dostávali enoxaparín v klinickom skúšaní. Z toho 1776 pacientov s rizikom tromboembolických komplikácií dostávalo enoxaparín ako prevenciu hlbokej žilovej trombózy po ortopedickej alebo abdominálnej operácii, 1169 pacientov
s akútnym interným ochorením s ťažkým obmedzením mobility dostávalo enoxaparín ako prevenciu
hlbokej žilovej trombózy, 559 pacientov s pľúcnou embóliou alebo bez nej dostávalo enoxaparín na liečbu hlbokej žilovej trombózy, 1578 pacientov na liečbu nestabilnej angíny a non-Q-infarktu myokardu a 10 176 pacientov na liečbu akútneho STEMI.
Režim podávania enoxaparínu sodného v klinickom skúšaní sa menil v závislosti od indikácií. Pri prevencii hlbokej žilovej trombózy po operácii alebo u pacientov s akútnym interným ochorením
s ťažkým obmedzením mobility bola dávka enoxaparínu sodného 4 000 IU (40 mg) subkutánne jedenkrát denne. Pri liečbe hlbokej žilovej trombózy (DVT) s pľúcnou embóliou (PE) alebo bez nej dostávali pacienti dávku buď 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín alebo dávku
150 IU/kg (1,5 mg/kg) subkutánne jedenkrát denne. V klinických štúdiách na liečbu nestabilnej angíny
a non-Q-infarktu myokardu boli dávky 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín
a v klinickej štúdii na liečbu akútneho STEMI sa podával enoxaparín sodný v dávke 3 000 IU (30 mg)
intravenózne ako bolus a potom nasledovala dávka 100 IU/kg (1 mg/kg) subkutánne každých
12 hodín.
V klinických štúdiách boli najčastejšími hlásenými reakciami krvácanie, trombocytopénia a trombóza
(pozri časť 4.4 a 'Opis vybraných nežiaducich reakcií' nižšie).
Zoznam nežiaducich reakcií v tabuľkovom formáte
Ďalšie nežiaduce reakcie, ktoré sa pozorovali v klinických štúdiách a ktoré boli hlásené po uvedení
lieku na trh (* znamená reakcie zo skúseností po uvedení lieku na trh) sú podrobnejšie uvedené nižšie. Frekvencie výskytu sú definované takto: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) alebo neznáme (z dostupných údajov). V rámci každej triedy orgánového systému sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Poruchy krvi a lymfatického systému
· časté: krvácanie, hemoragická anémia*, trombocytopénia, trombocytóza
· zriedkavé: eozinofília*
· zriedkavé: prípady imunoalergickej trombocytopénie s trombózou, u niektorých bola trombóza komplikovaná orgánovým infarktom alebo ischémiou končatiny (pozri časť 4.4).
Poruchy imunitného systému
· časté: alergická reakcia
· zriedkavé: anafylaktické/anafylaktoidné reakcie vrátane šoku*
Poruchy nervového systému
· časté: bolesť hlavy*
Poruchy ciev
· zriedkavé: spinálny hematóm* (alebo neuraxiálny hematóm). Tieto reakcie majú za následok rôzne stupne neurologického poškodenia vrátane dlhodobej alebo permanentnej paralýzy (pozri
časť 4.4)
Poruchy pečene a žlčových ciest
· veľmi časté: zvýšenie pečeňových enzýmov (najmä transamináz > 3-násobok hornej hranice normálu)
· menej časté: hepatocelulárne poškodenie pečene *,
· zriedkavé: cholestatické poškodenie pečene*
Poruchy kože a podkožného tkaniva
· časté: urtikária, pruritus, erytém
· menej časté: bulózna dermatitída
· zriedkavé: alopécia*
· zriedkavé: kožná vaskulitída*, kožná nekróza* obvykle sa vyskytuje v mieste vpichu injekcie
(predchádza jej zvyčajne purpura alebo erytematózne plaky, infiltrované a bolestivé).
Uzlíky v mieste vpichu injekcie * (zapálené uzlíky, ktoré neboli cystickým obalom enoxaparínu).
Vymiznú v priebehu niekoľkých dní a nie je potrebné kvôli tomu ukončiť liečbu.
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
· zriedkavé: osteoporóza* po dlhodobej liečbe (viac ako 3 mesiace).
Celkové poruchy a reakcie v mieste podania
· časté: hematóm v mieste vpichu injekcie, bolesť v mieste vpichu injekcie, iné reakcie v mieste vpichu injekcie (ako je opuch, krvácanie, hypersenzitivita, zápal, zhrubnutie, bolesť alebo reakcia)
· menej časté: lokálne podráždenie, kožná nekróza v mieste vpichu injekcie
Laboratórne a funkčné vyšetrenia
· zriedkavé : hyperkaliémia*(pozri časti 4.4 a 4.5)
Opisvybranýchnežiaducichreakcií
Krvácanie
Patrilo sem veľké krvácanie, zaznamenalo sa u viac ako u 4,2 % pacientov (chirurgickí pacienti). Niektoré z týchto prípadov boli fatálne. U chirurgických pacientov sa za veľké krvácanie považovalo (1) to, ktoré spôsobilo závažnú klinickú udalosť alebo (2) to, pri ktorom bol pokles hemoglobínu
≥ 2 g/dl alebo ktoré si vyžiadalo transfúziu 2 alebo viac jednotiek krvných prípravkov. Retroperitoneálne a intrakraniálne krvácanie za vždy považovalo za veľké.
Podobne ako pri podávaní iných antikoagulancií, sa môže v prítomnosti pridružených rizikových faktorov ako sú organické poškodenia s tendenciou ku krvácaniu, invazívne zákroky alebo používanie liekov ovplyvňujúcich hemostázu, vyskytnúť krvácanie (pozri časti 4.4 a 4.5).
Trieda
orgánového systému
Poruchy krvi a lymfatickéh o systému
Prevencia
u chirurgických
pacientov
veľmi časté:
krvácanie α
zriedkavé: retroperitoneáln e krvácanie
Prevencia
u internýc h pacientov
časté:
krvácanie α
Liečba pacientov
s DVT s PE alebo bez nej
veľmi časté:
krvácanie α
menej časté: intrakraniálne krvácanie, retroperitoneáln e krvácanie
Liečba pacientov
s nestabilnou angínou a non-Q infarktom myokardu
časté:
krvácanie α
zriedkavé: retroperitoneáln e krvácanie
Liečba pacientov
s akútnym STEMI
časté:
krvácanie α
menej časté: intrakraniálne krvácanie, retroperitoneáln e krvácanie
 α
α: napríklad: hematóm, ekchymóza iná ako v mieste vpichu injekcie, hematóm v rane, hematúria, epistaxa
a gastrointestinálne krvácanie.
Trombocytopénia a trombocytóza
Trieda orgán ového systé mu Poruch y krvi
a lymfati ckého systém u
Prevencia
u chirurgických
pacientov
veľmi časté:
trombocytózaβ
časté:
trombocytopénia
Prevencia
u interných
pacientov
menej časté:
trombocytopénia
Liečba pacientov s DVT s PE alebo bez nej
veľmi časté:
trombocytóza β
časté:
trombocytopénia
Liečba pacientov s nestabilnou angínou a non-Q infarktom myokardu
menej časté:
trombocytopénia
Liečba pacientov
s akútnym
STEMI
časté: trombocytózaβ trombocytopénia veľmi zriedkavé: imuno-alergická trombocytopénia
 β
β: zvýšenie počtu krvných doštičiek > 400 x 109/l
Pediatrická populáciaBezpečnosť a účinnosť enoxaparínu sodného u detí nebola stanovená (pozri časť 4.2).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.
4.9 PredávkovaniePrejavyapríznakyNáhodné predávkovanie enoxaparínom sodným po subkutánnom, mimotelovom alebo intravenóznom podaní môže viesť ku krvácavým komplikáciám. Po perorálnom podaní, dokonca aj vysokých dávok,
nie je pravdepodobné, že sa enoxaparín sodný absorbuje.
LiečbaAntikoagulačný účinok enoxaparínu možno do veľkej miery neutralizovať pomalým intravenóznym podaním protamínu. Dávka protamínu závisí od dávky podaného enoxaparínu sodného; 1 mg
protamínu neutralizuje antikoagulačný účinok 100 IU (1 mg) enoxaparínu sodného, ak bol enoxaparín
podaný v priebehu posledných 8 hodín. Ak bol enoxaparín podaný pred viac ako 8 hodinami alebo ak je potrebná druhá dávka protamínu, môže sa podať infúzia protamínu v dávke 0,5 mg protamínu na
100 IU (1 mg) podaného enoxaparínu sodného. 12 hodín po podaní enoxaparínu nemusí byť podanie
protamínu potrebné. Avšak anti-Xa aktivita enoxaparínu sodného sa nikdy (ani pri vysokých dávkach protamínu) nezneutralizuje úplne (najviac asi 60 %) (pozri Súhrn charakteristických vlastností solí protamínu).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antitrombotikum, skupina heparínov. ATC kód: B01A B05
Inhixa je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.euFarmakodynamickéúčinky
Enoxaparín je nízkomolekulový heparín so strednou molekulovou hmotnosťou približne
4500 daltonov, v ktorom sú oddelené antitrombotická a antikoagulačná aktivita štandardného heparínu. Liečivo je sodná soľ.
V in-vitro purifikovanom systéme má enoxaparín sodný vysokú anti-Xa aktivitu (približne 100 IU/mg) a nízku anti-IIa alebo antitrombínovú aktivitu (približne 28 IU/mg) s pomerom 3,6. Tieto antikoagulačné aktivity sú sprostredkované antitrombínom (ATIII), čo má za následok antitrombotické účinky u ľudí.
Okrem anti-Xa/IIa aktivity boli identifikované u zdravých ľudí a u pacientov, ako aj na predklinických modeloch, ďalšie antitrombotické a protizápalové vlastnosti enoxaparínu. Patrí sem ATIII- dependentná inhibícia ďalších koagulačných faktorov ako je faktor VIIa, indukcia uvoľňovania endogénneho inhibítora cesty tkanivového faktora (Tissue Factor Pathway Inhibitor (TFPI)) a znížené uvoľňovanie von Willebrandovho faktora (vWF) z vaskulárneho endotelu do krvného obehu. O týchto faktoroch je známe, že prispievajú k celkovému antitrombotickému účinku enoxaparínu.
Keď sa enoxaparín sodný používa ako profylaktická liečba, nemá významný vplyv na aPTT. Keď sa používa ako kuratívna liečba, aPTT sa môže predĺžiť o 1,5-2,2-násobok kontrolného času pri maxime účinku.
Klinická účinnosťabezpečnosť
Prevencia venóznej tromboembolickej choroby spojená s operáciou
Predĺžená profylaxia VTE po ortopedickej operácii
V dvojito zaslepenej štúdii predĺženej profylaxie u pacientov podstupujúcich náhradu bedrového kĺbu,
179 pacientov, ktorí nemali tromboembolickú chorobu a predtým počas hospitalizácie dostávali
4000 IU (40 mg) enoxaparínu sodného, boli po prepustení randomizovaní na buď 4000 IU (40 mg) (n=90) jedenkrát denne subkutánne, alebo placebo ( n=89) na 3 týždne. Výskyt DVT počas predĺženej profylaxie bol štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, nebola hlásená žiadna PE. Nevyskytlo sa žiadne veľké krvácanie.
Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo jedenkrát denne s.c. n (%)
Všetci pacienti liečení predĺženou
profylaxiou
90 (100) 89 (100)
celkovo VTE 6 (6,6) 18 (20,2) celkovo DVT (%) 6 (6,6)* 18 (20,2) proximálna DVT (%) 5 (5,6)# 7 (8,8)
*p hodnota oproti placebu =0,008
#p hodnota oproti placebu =0,537
V druhej dvojito zaslepenej štúdii bolo 262 pacientov bez VTE ochoreniapodstupujúcich operáciu s
náhradou bedrového kĺbu a predtým počas hospitalizácie liečených enoxaparínom sodným 4 000 IU (40 mg) s.c, . bolo randomizovaných po prepustení na buď enoxaparín sodný 4 000 IU (40 mg) (n=131) jedenkrát denne s.c., alebo placebo (n=131) počas 3 týždňov. Podobne ako v prvej štúdii bol výskyt VTE počas predĺženej profylaxie štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, a to aj pre VTE celkovo (enoxaparín sodný 21 [16 %] oproti placebu 45
[34,4 %]; p=0,001) aj pre proximálnu DVT (enoxaparín sodný 8 [6,1%] oproti placebu 28 [21,4 %]; p=<0,001). Pokiaľ ide o veľké krvácanie, nezistil sa žiadny rozdiel medzi skupinami s enoxaparínom sodným a placebom.
Predĺžená profylaxia DVT po onkologickej operácii
Dvojito zaslepená, multicentrická klinická štúdia, porovnávala bezpečnosť a účinnosť štvortýždňového a jednotýždňového režimu profylaktického podávania enoxaparínu sodného
u 332 pacientov, ktorí sa podrobili elektívnej operácii z dôvodu rakoviny v brušnej alebo panvovej
oblasti. Pacienti dostávali enoxaparín sodný (4 000 IU (40 mg) s.c.) denne počas 6 až 10 dní a boli náhodne zaradení na liečbu enoxaparínom sodným alebo placebom počas ďalších 21 dní. Bilaterálna venografia sa realizovala medzi 21. a 31. dňom alebo skôr, ak sa vyskytli príznaky venózneho tromboembolizmu. Pacienti boli potom 3 mesiace sledovaní. Profylaxia enoxaparínom sodným počas
4 týždňov po operácii z dôvodu rakoviny v oblasti brucha alebo panvy štatisticky významne znížila výskyt venograficky preukázanej trombózy v porovnaní s profylaxiou enoxaparínom sodným počas jedného týždňa. Výskyt venózneho tromboembolizmu na konci dvojito zaslepenej fázy bol 12,0 % (n=20) v skupine s placebom a 4,8 % (n=8) v skupine s enoxaparínom sodným; p=0,02. Tento rozdiel pretrvával tri mesiace [13,8 % vs. 5,5 % (n=23 vs 9), p=0,01]. Neboli rozdiely vo výskyte krvácania alebo iných komplikácií počas dvojito zaslepenej alebo sledovacej fázy.
Prevencia venóznej tromboembolickej choroby u interných pacientov s akútnymi ochoreniami, kde sa
očakáva obmedzenie mobility
V dvojito zaslepenej, multicentrickej štúdii s paralelnými skupinami sa provnával enoxaparín sodný
2 000 IU (20 mg) alebo 4 000 IU (40 mg) jedenkrát denne s.c. s placebom v prevencii DVT
u interných pacientov s ťažkým obmedzením mobility počas akútneho ochorenia (definované ako prejdená vzdialenosť <10 metrov za ≤3 dni). Táto štúdia zahŕňala pacientov so srdcovým zlyhaním (NYHA trieda III alebo IV); akútnym respiračným zlyhaním alebo komplikovanou chronicku respiračnou insuficienciou a akútnou infekciou alebo akútnou reumou; ak boli spojené aspoň s jedným VTE rizikovým faktorom (vek ≥75 rokov, rakovina, predchádzajúca VTE, obezita, varikózne vény, hormonálna liečba a chronické srdcové alebo respiračné zlyhanie).
Celkovo bolo v štúdii zaradených 1102 pacientov a 1073 pacientov bolo liečených. Liečba
pokračovala počas 6 až 14 dní (priemerné trvanie liečby 7 dní). Pri podávaní dávky 4 000 IU (40 mg)
jedenkrát denne s.c. enoxaparín sodný štatisticky významne znížil výskyt VTE v porovnaní
s placebom. Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
2 000 IU (20 mg) jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo
n (%)
enoxaparín sodný
2 000 IU (20 mg) jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo
n (%)
v
š
etci liečení interní pacienti
počas akútneho ochorenia
287 (100) 291(100) 288 (100)
celkovo VTE (%) 43 (15,0) 16 (5,5)* 43 (14,9) celkovo DVT (%) 43 (15,0) 16 (5,5) 40 (13,9) proximálna DVT (%) 13 (4,5) 5 (1,7) 14 (4,9) VTE = venózne tromboembolické udalosti, ktoré zahŕňali DVT, PE a smrť z dôvodu tromboembólie
* p hodnota oproti placebu = 0,0002
Približne 3 mesiace po zaradení zostával výskyt VTE štatisticky významne nižší v skupine liečenej
enoxaparínom sodným 4 000 IU (40 mg) v porovnaní so skupinou liečenou placebom.
Výskyt krvácania celkovo bol 8,6 % a výskyt veľkého krvácania 1,1 % v skupine s placebom, 11,7 %
a 0,3 % v skupine s enoxaparínom sodným 2 000 IU (20 mg) a 12,6 % a 1,7 % v skupine s enoxaparínom sodným 4 000 IU (40 mg).
Liečba hlbokej žilovej trombózy s pľúcnou embóliou alebo bez nej
V multicentrickej štúdii s paralelnými skupinami bolo 900 pacientov s akútnou DVT dolnej končatiny s pľúcnou embóliou alebo bez nej randomizovaných na hospitalizačnú liečbu buď (i) enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát denne s.c., (ii) enoxaparínom sodným 100 IU/kg (1 mg/kg) každých 12 hodín s.c. alebo (iii) i.v. bolusom heparínu (5 000 IU), po ktorom nasledovala kontinuálna infúzia (podávaná s cieľom dosiahnuť aPTT 55 až 85 sekúnd). Celkovo bolo v štúdii
randomizovaných 900 pacientov a všetci pacienti boli liečení. Všetci pacienti dostávali aj liečbu
warfarínom sodným (dávka bola upravená podľa protrombínového času s cieľom dosiahnuť INR 2,0 až 3,0) so začiatkom v priebehu 72 hodín od začatia liečby enoxaparínom sodným alebo štandardnej liečby heparínom a pokračovaním počas 90 dní. Enoxaparín sodný alebo štandardná liečba heparínom sa podávala minimálne 5 dní a dovtedy, kým sa nedosiahol cieľový INR warfarínu sodného. Obidva režimy s enoxaparínom sodným boli rovnocenné ako štandardná heparínová liečba, pokiaľ ide
o zníženie rizika rekurencie venózneho tromboembolizmu (DVT a/alebo PE). Údaje týkajúce sa
účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
15
0 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
enoxaparín sodný
10
0 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
heparín
i.v. liečba upravovaná podľa aPTT
n (%)
enoxaparín sodný
15
0 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
enoxaparín sodný
10
0 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
heparín
i.v. liečba upravovaná podľa aPTT
n (%)
v
š
etci liečení pacienti s DVT s PE alebo bez nej
298 (100) 312 (100) 290 (100)
celkovo VTE (%) 13 (4,4)* 9 (2,9)* 12 (4,1) iba DVT (%) 11 (3,7) 7 (2,2) 8 (2,8) proximálna DVT (%) 9 (3,0) 6 (1,9) 7 (2,4) PE (%) 2 (0,7) 2 (0,6) 4 (1,4) VTE = venózna tromboembolická udalosť (DVT a/alebo PE)
*interval spoľahlivosti 95 % pre rozdiely v liečbe celkovej VTE boli:
- enoxaparín sodný jedenkrát denne oproti heparínu (-3,0 až 3,5)
- enoxaparín sodný každých 12 hodín oproti heparínu (-4,2 až 1,7).
Veľké krvácanie bolo 1,7 % v skupine s enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát
denne, 1,3 % v skupine s enoxaparínom sodným 100 IU/kg (1 mg/kg) dvakrát denne a 2,1 % v skupine s heparínom.
Liečba nestabilnej angíny a infarktu myokardu bez elevácie ST
V rozsiahlej multicentrickej štúdii 3171 pacientov zaradených v akútnej faze nestabilnej anginy
pectoris alebo non-Q infarktu myokardu bolo randomizovaných do dvoch skupín tak, že pacienti
v jednej skupine dostávali spolu s kyselinou acetylsalicylovou (100 až 325 mg jedenkrát denne) buď s.c. injekciu enoxaparínu sodného v dávke 100 IU/kg (1 mg/kg) každých 12 hodín alebo i.v. nefrakcionovaný heparín upravený podľa aPTT. Pacienti museli byť hospitalizovaní minimálne 2 dni a maximálne 8 dní, až do klinickej stabilizácie, revaskularizačnej procedúry alebo prepustenia z
nemocnice. Pacienti museli byť sledovaní po dobu 30 dní. Enoxaparín sodný v porovnaní s heparínom
štatisticky významne znížil kombinovaný výskyt anginy pectoris, infarktu myokardu a smrti s poklesom 19,8 až 16,6 % (redukcia relatívneho rizika 16,2 %) v deň 14. Táto redukcia v kombinovanom výskyte pretrvávala po 30 dňoch (od 23,3 do 19,8 %; redukcia relatívneho rizika
15 %).
Pokiaľ ide o veľké krvácanie, neboli zistené žiadne rozdiely, aj keď krvácanie v mieste podania s.c.
injekcie bolo častejšie.
Liečba akútneho infarktu myokardu s eleváciou ST-segmentu
V rozsiahlej multicentrickej štúdii bolo 20 479 pacientov so STEMI vhodných na fibrinolytickú liečbu randomizovaných do dvoch skupín; v jednej skupine dostali enoxaparín sodný ako jednu bolusovú i.v. dávku 3000 IU (30 mg) plus subkutánnu injekciu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg) a následne každých 12 hodín subkutánnu injekiu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg) a v druhej skupine dostávali intravenózne nefrakcionovaný heparín upravený podľa aPTT po dobu
48 hodín. Všetci pacienti boli taktiež liečení kyselinou acetylsalicylovou po dobu minimálne 30 dní.
Stratégia dávkovania enoxaparínu bola prispôsobená pre pacientov so závažne zhoršenou funkciou
obličiek a pre starších pacientov vo veku 75 a viac rokov. Subkutánne injekcie enoxaparínu sa
podávali dovtedy, kým pacient nebol prepustený z nemocnice alebo po dobu maximálne 8 dní (podľa toho, čo nastalo skôr).
4716 pacientov sa podrobilo perkutánnej koronárnej intervencii, pričom dostávali antitrombotickú
podpornú liečbu zaslepenými liekmi štúdie. Preto pre pacientov liečených enoxaparínom musela byť vykonaná PCI s enoxaparínom (žiadna zmena), pričom bol použitý režim stanovený
v predchádzajúcich štúdiách t.j. žiadne ďalšie dávkovanie, ak od posledného subkutánneho podania do
insuflácie balónu uplynulo menej ako 8 hodín; i.v. bolus 30 IU/kg (0,3 mg/kg) enoxaparínu, ak od posledného subkutánneho podania do insuflácie balónu uplynulo viac ako 8 hodín.
Enoxaparín sodný v porovnaní s nefrakcionovaným heparínom štatisticky významne znížil výskyt
primárneho endpointu - smrti z akejkoľvek príčiny alebo re-infarktu myokardu v prvých 30 dňoch po randomizácii [9,9 percenta v skupine s enoxaparínom v porovnaní s 12,0 percentami v skupine
s nefrakcionovaným heparínom] pri redukcii relatívneho rizika 17 % (p<0,001).
Benefity liečby enoxaparínom (zjavné vo viacerých ukazovateľoch účinnosti) sa objavili už za 48 hodín, kedy redukcia relatívneho rizika re-infarktu myokardu bola 35 % v porovnaní s liečbou nefrakcionovaným heparínom (p<0,001).
Benefit enoxaparínu v primárnom ukazovateli bol konzistentný v rámci kľúčových podskupín vrátane
veku, pohlavia, lokácie infarktu, anamnézy diabetu, anamnézy predchádzajúceho infarktu myokardu,
typu použitého fibrinolytika a času do liečby študijným liekom.
Zistil sa štatisticky významný benefit liečby enoxaparínom v porovnaní s nefrakcionovaným heparínom u pacientov, ktorí sa podrobili perkutánnej koronárnej intervencii v priebehu 30 dní po randomizácii (23 % redukcia relatívneho rizika) alebo ktorí boli liečení konzervatívne (farmakologicky) (15 % redukcia relatívneho rizika, p = 0,27 pre interakciu).
Výskyt združeného ukazovateľa, ktorým bolo úmrtie, re-infarkt alebo intrakraniálne hemoragie na
30.deň (merané ako čistý klinický benefit) bol štatisticky významne nižší (p<0,0001) v skupine s enoxaparínom (10,1 %) v porovnaní so skupinou s heparínom (12,2 %), čo predstavuje 17 % redukciu relatívneho rizika v prínos liečby enoxaparínom sodným.
Výskyt veľkého krvácania po 30 dňoch bol štatisticky významne vyšší (p<0,0001) v skupine
s enoxaparínom sodným (2,1 %) oproti skupine s heparínom (1,4 %). Vyšší výskyt gastrointestinálneho krvácania bol v skupine s enoxaparínom sodným (0,5 %) oproti skupine s heparínom (0,1 %), zatiaľ čo výskyt intrakraniálneho krvácania bol podobný v obidvoch skupinách (0,8 % s enoxaparínom sodným oproti 0,7 % s heparínom).
Prospešný účinok enoxaparínu na primárny endpoint pozorovaný počas prvých 30 dní sa zachoval
počas 12 mesiacov sledovania.
Porucha funkcie pečene
Podľa lietrárnych údajov sa používanie enoxaparínu v dávke 4 000 IU (40 mg) u pacientov s cirhózou
(Child-Pugh trieda B-C) zdá byť bezpečné a účinné v prevencii trombózy portálnej vény. Treba poznamenať, že literárne štúdie môžu mať určité obmedzenia. U pacientov s poruchou pečene je potrebná opatrnosť, pretože títo pacienti majú vyšší potenciál krvácania (pozri časť 4.4) a u pacientov s cirhózou (Child-Pugh trieda A,B, C) sa žiadne štúdie týkajúce sa formálneho stanovenia dávky neuskutočnili.
5.2 Farmakokinetické vlastnosti
Všeobecnácharakteristika
Farmakokinetické parametre enoxaparínu sodného sa sledovali najmä vo vzťahu k časovému priebehu plazmatickej anti-Xa aktivity a tiež anti-IIa aktivity v odporúčaných dávkach a to po jednorazovom a opakovanom subkutánnom podaní a po jednorazovom i.v. podaní.
Kvantitatívne hodnotenie anti-Xa a anti-IIa farmakokinetických aktivít sa robilo validovanými
amidolytickými metódami.
Absorpcia
Absolútna biologická dostupnosť enoxaparínu sodného po s.c. injekcii vychádzajúca z anti-Xa aktivity
je približne 100 %.
Môžu sa použiť rôzne dávky, formy a dávkovacie režimy.
Priemernú maximálnu plazmatickú anti-Xa aktivitu možno pozorovať 3 až 5 hodín po subkutánnej
injekcii a dosahuje približne 0,2, 0,4 a 1,0 a 1,3 IU/ml po jednorazovej s.c. aplikácii 2000 IU, 4000 IU,
100 IU/kg a 150 IU/kg (20 mg, 40 mg, 1 mg/kg a 1,5 mg/kg) v uvedenom poradí.
Intravenózna bolusová dávka 3000 IU (30 mg), po ktorej bezprostredne nasleduje dávka 100 IU/kg (1 mg/kg) podaná subkutánne každých 12 hodín, poskytuje počiatočný vrchol hladiny faktoru anti- Xa 1,16 IU/ml (n=16) a priemerná expozícia zodpovedá 88 % hladiny v stabilizovanom stave. Stabilizovaný stav sa dosahuje na druhý deň liečby.
Po opakovanom subkutánnom podaní dávky 4000 IU (40 mg) raz denne a dávky 150 IU/kg
(1,5 mg/kg) raz denne zdravým dobrovoľníkom, sa dosiahne ustálený stav na 2.deň a priemerná miera expozície je asi o 15 % vyššia ako po jednorazovom podaní. Po opakovanom subkutánnom podaní dávky 100 anti-Xa IU/kg dvakrát denne sa ustálený stav dosiahne od 3. po 4.deň a má priemernú expozíciu asi o 65 % vyššiu ako po jednorazovom podaní, maximálnu priemernú hodnotu 1,2 IU/ml
a minimálnu hodnotu 0,52 IU/ml.
Injekčný objem a koncentrácia dávky v rozmedzí 100-200 mg/ml nemá vplyv na farmakokinetické parametre u zdravých dobrovoľníkov.
Farmakokinetika enoxaparínu po podaní dávok vyšších ako sú odporúčané dávky je lineárna. Premenlivosť v rámci organizmu alebo medzi viacerými pacientami je nízka. Po opakovanom s.c. podávaní sa akumulácia nezistila.
Plazmatická anti-IIa aktivita enoxaparínu je po subkutánnom podaní približne 10-krát nižšia ako anti- Xa aktivita. Priemerná maximálna anti-IIa aktivita sa pozoruje približne 3 - 4 hodiny a dosahuje po subkutánnom podaní 100 IU/kg dvakrát denne 0,13 IU/ml a po subkutánnom podaní 150 IU/kg
(1,5 mg/kg) jedenkrát denne 0,19 IU/ml.
Distribúcia
Distribučný objem anti-Xa aktivity enoxaparínu sodného je asi 4,3 litrov a je blízky krvnému objemu.
Biotransformácia
Enoxaparín sodný sa primárne metabolizuje v pečeni desulfatizáciou a/alebo depolymerizáciou na zložky s nižšou molekulovou hmotnosťou s omnoho nižšou biologickou účinnosťou.
Eliminácia
Enoxaparín sodný je liek s nízkym klírens s priemerným klírensom plazmatickej anti-Xa aktivity po
podaní dávky 150 IU/kg (1,5 mg/kg) 6-hodinovou i.v. infúziou 0,74 l/hod.
Eliminácia sa javí byť jednofázová a eliminačný polčas anti-Xa aktivity je približne 5 hodín po jednorazovom subkutánnom podaní až približne 7 hodín po opakovanom podaní enoxaparínu sodného.
Renálny klírens aktívnych fragmentov predstavuje približne 10 % podanej dávky a celková renálna
exkrécia aktívnych a neaktívnych fragmentov je 40 % dávky.
Špeciálneskupinypacientov
Starší ľudia
Na základe výsledkov farmakokinetickej analýzy sa zistilo, že pokiaľ je zachovaná normálna funkcia obličiek, kinetický profil enoxaparínu sodného sa u starších osôb v porovnaní s mladšími nelíši. Avšak
je známe, že funkcia obličiek sa s vekom znižuje a teda eliminácia enoxaparínu sodného u starších pacientov môže byť znížená (pozri časti 4.2 a 4.4).
Porucha funkcie pečene
V štúdii, ktorá sa robila u pacientov s pokročilou cirhózou liečených enoxaparínom sodným 4 000 IU (40 mg) jedenkrát denne bol pokles v maxime anti-Xa aktivity spojený s vzostupom závažnosti poškodenia pečene (hodnotené podľa Child-Pugh kategórií). Tento pokles bol pripisovaný hlavne poklesu hladiny ATIII, sekundárne zníženej syntéze ATIII u pacientov s poruchou funkcie pečene.
Porucha funkcie obličiek
Medzi klírensom plazmatickej anti-Xa aktivity a klírensom kreatinínu bol v ustálenom stave pozorovaný lineárny vzťah, čo naznačuje zníženie klírensu enoxaparínu sodného u pacientov s poruchou funkcie obličiek. Po opakovanej subkutánnej dávke 4000 IU raz denne je expozícia anti-Xa aktivity, vyjadrená AUC v ustálenom stave, pri mierne (klírens kreatinínu 50-80 ml/min) a pri stredne ťažkej (klírens kreatnínu 30-50 ml/min) poruche funkcie obličiek okrajovo zvýšená. U pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu <30 ml/min) je AUC v ustálenom stave, po opakovaných subkutánnych dávkach 4000 IU raz denne, významne zvýšená (priemerne o 65 %) (pozri časti 4.2 a 4.4).
Hemodialýza
Po jednorazovom i.v. podaní enoxaparínu sodného v dávke 25 IU, 50 IU alebo 100 IU/kg (0,25, 0,50 alebo 1,0 mg/kg) bola jeho farmakokinetika podobná ako u kontrolovanej populácie, avšak AUC bola dvakrát vyššia ako u kontrolovanej populácie.
Telesná hmotnosť
Po opakovaných s.c. dávkach 150 IU/kg (1,5 mg/kg) jedenkrát denne je priemerná AUC anti-Xa aktivity v ustálenom stave u obéznych zdravých dobrovoľníkov (BMI index 30-48 kg/m2) v porovnaní s osobami s normálnou hmotnosťou okrajovo zvýšená, zatiaľ čo maximálna plazmatická hladina anti-Xa aktivity zvýšená nie je. U obéznych pacientov je po subkutánnom podaní nižší hmotnosťou ovplyvnený klírens.
Po jednorazovom subkutánnom podaní enoxaparínu sodného v dávke 4000 IU (dávka nebola upravená na základe hmotnosti pacienta) ženám (<45 kg) a mužom (<57 kg) s nízkou hmotnosťou bolo zistené, že expozícia anti-Xa aktivity je v porovnaní s osobami s normálnou hmotnosťou u žien o 52 %
a u mužov o 27 % vyššia (pozri časť 4.4).
Farmakokinetickéinterakcie
Pri súbežnom podaní enoxaparínu a trombolytika sa nepozorovali žiadne farmakokinetické interakcie.
5.3 Predklinické údaje o bezpečnosti
V 13-týždňových štúdiach toxicity, kde sa podával s.c. enoxaparín potkanom a psom v dávke
15 mg/kg/deň a v 26 týždňových štúdiach toxicity, kde sa podával enoxaparín s.c. a i.v. potkanom
a opiciam v dávke 10 mg/kg/deň sa iné nežiaduce účinky enoxaparínu okrem antikoagulačného účinku nedokázali.
Nasledujúce testy nepreukázali mutagénne účinky enoxaparínu: Amesov test in-vitro, progresívny mutačný test na bunkách myšacích lymfómov in-vitro, humánny lymfocytový test chromozomálnych aberácií in-vitro a in-vivo test chromozomálnych aberácií na kostnej dreni potkanov.
Štúdie vykonané u gravidných samíc potkanov a králikov s dávkami enoxaparínu sodného do
30 mg/kg/deň nepreukázali žiadne teratogénne účinky ani fetotoxicitu. Po s.c. podaní dávky nižšej ako
20 mg/kg/deň nemal enoxaparín vplyv na fertilitu ani na reprodukčné schopnosti potkaních samcov
a samíc.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Voda na injekciu
6.2 Inkompatibility
Subkutánnainjekcia
Inhixa sa nesmie miešať so žiadnymi inými injekciami alebo infúziou.
I
ntravenózna
injekcia
(bolus)
iba
pre
akútnu
indikáciu
STEMI.
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnostiNaplnenástriekačka3 roky
Zriedenýlieksinjekčnýmroztokomchloridusodného9 mg/ml (0,9 %)alebo5%glukózyvovode8 hodín
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25 ° C. Neuchovávajte v mrazničke.
6.5 Druh obalu a obsah balenia0,6 ml roztoku v:
- sklenenej striekačke s označenej mierkou z číreho bezfarebného neutrálneho skla typu I
s pevnou ihlou a krytom ihly uzavretým chlórbutylovou gumovou zátkou a s oranžovým polypropylénovým piestom. Injekčné striekačky môžu byť dodatočne vybavené poistným
prvkom, ktorý chráni proti pichnutiu ihlou po vykonaní injekcie; alebo
- sklenenej striekačke s označenej mierkou z číreho bezfarebného neutrálneho skla typu I
s pevnou ihlou a krytom ihly uzavretým chlórbutylovou gumovou zátkou a s bielym polykarbonátovým piestom. Injekčné striekačky môžu byť dodatočne vybavené poistným UltraSafe Passive prvkom, ktorý chráni proti pichnutiu ihlou po vykonaní injekcie.
Balenia s:
- 2, 6 a, 10 naplnenými striekačkami
- 2, 6, 10, 12, 20 a 24 naplnenými striekačkami s ochranným krytom ihly
- 2 a 10 naplnenými striekačkami s UltraSafe Passive ochranným krytom ihly
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom NÁVO D NA P O UŽÍVANIE: NAP LNENÁ INJEKČNÁ STRIEKAČK A Ako máte podávať injekciu Inhixa sám sebe

Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak si nie
ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je,
použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.
- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej
sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa
1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená

vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená
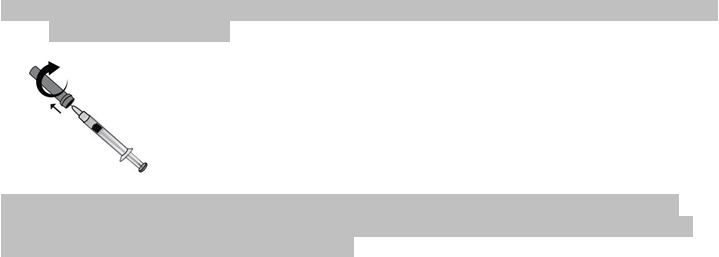
a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.
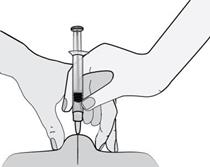
 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný záhyb držíte počas celého podávania injekcie.
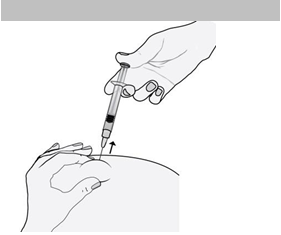 8)
8) Rovným ťahom ihlu vytiahnite.
Aby ste sa vyhli podli ati ne, mi est o vpi chu si po podaní i nj ekci e sami nem así rujt e.
 9)
9) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Ako máte podávať injekciu Inhixa sám sebe
Naplnená injekčná striekačka môže mať priložený ochranný kryt ihly, ktorý chráni pred poranením ihlou. Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.
- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch,
mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej
sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte
miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená

vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená

a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .
 6)
6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného záhybu vpichnite celú dĺžku ihly.
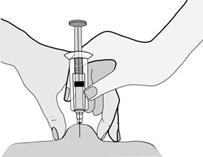
 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný záhyb držíte počas celého podávania injekcie.
 8)
8) Rovným ťahom ihlu vytiahnite. Neprestávajte stláčať piest!
Aby ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.9) Stlačte silno piest striekačky. Poistný prvok ihly, ktorý má podobu plastového cylindra, sa
automaticky nasunie na ihlu a celú ju zakryje.
10) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré
predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.Ako máte podávať injekciu Inhixa sám sebe

Naplnená injekčná striekačka môže mať priložený UltraSafe Passive ochranný kryt ihly, ktorý chráni pred poranením ihlou. Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám
ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom
poučený/á. Ak si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou
sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.
- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej
sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).

- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená

vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená
a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.

 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný záhyb držíte počas celého podávania injekcie.
8) Rovným ťahom ihlu vytiahnite. Neprestávajte stláčať piest!
 A
by ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
9)
A
by ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
9) Uvoľnite piest a nechajte injekčnú striekačku vysunúť, pokiaľ nie je celá ihla chránená a kryt

nezapadne na miesto.
10) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré
predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITechdow Europe AB
Kåbovägen 32
75236 Uppsala
Švédsko
8. REGISTRAČNÉ ČÍSLOEU/1/16/1132/005
EU/1/16/1132/006
EU/1/16/1132/015
EU/1/16/1132/016
EU/1/16/1132/026
EU/1/16/1132/027
EU/1/16/1132/028
EU/1/16/1132/037
EU/1/16/1132/038
EU/1/16/1132/057
EU/1/16/1132/058
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 15/09/2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUInhixa 8 000 IU (80 mg/ml)/0,8 ml injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE10 000 IU/ml (100 mg/ml) injekčný roztokKaždá naplnená injekčná striekačka obsahuje enoxaparín sodný 8 000 IU anti-Xa aktivity (čo
zodpovedá 80 mg) v 0,8 ml vody na injekciu.
Úplný zoznam pomocných látok, pozri časť 6.1
Enoxaparín sodný je biologické liečivo získané alkalickou depolymerizáciou benzylesteru heparínu derivovaného z prasacej črevnej sliznice.
3. LIEKOVÁ FORMAInjekčný roztok v naplnenej injekčnej striekačke. Číry, bezfarebný až svetložltý roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieInhixa je indikovaný u dospelých:
· Prevencia venóznej tromboembolickej choroby v chirurgii u pacientov so stredným a vysokým rizikom, najmä v ortopedickej alebo všeobecnej chirurgii vrátane onkologickej chirurgie.
· Prevencia venóznej tromboembolickej choroby u interných pacientov s akútnymi ochoreniami
(ako je akútna srdcová nedostatočnosť, respiračné zlyhanie, ťažké infekcie alebo reumatické ochorenia) a zníženou mobilitou so zvýšeným rizikom vzniku venóznej tromboembolickej choroby.
· Liečba hlbokej žilovej trombózy (DVT) a pľúcnej embolizácie (PE) okrem PE, ktorá by mohla
vyžadovať trombolytickú liečbu alebo operáciu.
· Prevencia tvorby trombov v mimotelovom obehu počas dialýzy.
· Akútny koronárny syndróm:
- Liečba nestabilnej angíny a infarktu myokardu bez elevácie ST-segmentu (NSTEMI) v
kombinácii s kyselinou acetylsalicylovou, ktorá sa užíva perorálne.
- Liečba akútneho infarktu myokardu s eleváciou ST-segmentu (STEMI) vrátane pacientov, u ktorých sa plánuje konzervatívna (farmakologická) liečba alebo pacientov s následnou perkutánnou koronárnou intervenciou (PCI).
4.2 Dávkovanie a spôsob podávaniaDávkovaniePrevencia venóznej tromboembolickej choroby v chirurgii u pacientov so stredným a vysokýmrizikom
Individuálne riziko tromboembólie u pacientov možno odhadnúť pomocou validovaného modelu stratifikácie rizika.
· U pacientov so stredným rizikom vzniku tromboembólie je odporúčaná dávka 2 000 IU (20 mg)
enoxaparínu sodného jedenkrát denne subkutánnou (s.c.) injekciou. Pri chirurgických výkonoch so stredným rizikom sa ukázalo ako účinné a bezpečné začať podávať enoxaparín sodný 2 000 IU
(20 mg) pred operáciou (2 hodiny pred operáciou).
U pacientov so stredným rizikom je potrebné pokračovať v profylaxii enoxaparínom sodným minimálne 7-10 dní bez ohľadu na to, ako sa pacient zotavuje (napr. mobilita), až kým sa pacient nezotaví z výrazne zníženej mobility.
· U pacientov s vysokým rizikom tromboembólie je odporúčaná dávka 4 000 IU (40 mg)
enoxaparínu sodného jedenkrát denne subkutánnou (s.c.) injekciou so začatím prednostne
12 hodín pred operáciou. Ak je potrebné začať profylaxiu skôr ako 12 hodín pred operáciou (napr. pacient s vysokým rizikom čakajúci na odloženú ortopedickú operáciu), posledná injekcia sa nemá podať neskôr ako 12 hodín pred operáciou a pokračovať 12 hodín po operácii.
o U pacientov podrobujúcich sa veľkej ortopedickej operácii sa odporúča predĺžiť tromboprofylaxiu až do 5 týždňov.
o U pacientov s vysokým rizikom venóznej tromboembólie (VTE) podrobujúcich sa brušnej alebo panvovej operácii kvôli nádorovému ochoreniu sa odporúča predĺžiť tromboprofylaxiu až do 4 týždňov.
Profylaxia venóznej tromboembólie u interných pacientov
Odporúčaná dávka enoxaparínu sodného je 4 000 IU (40 mg) jedenkrát denne s.c. injekciou.
Liečba enoxaparínom sodným sa predpisuje najmenej na 6 až 14 dní bez ohľadu na to, ako sa pacient
zotavuje (napr. mobilita). Prínos liečby trvajúcej viac ako 14 dní sa nepotvrdil.
Liečba hlbokej žilovej trombózy (DVT) a pľúcnej embolizácie (PE)
Enoxaparín sodný sa môže podávať s.c. injekciou buď jedenkrát denne 150 IU/kg (1,5 mg/kg), alebo
dvakrát denne 100 IU/kg (1 mg/kg).
Režim musí zvoliť lekár na základe individuálneho posúdenia a vyhodnotenia rizika tromboembólie a rizika krvácania. Dávkovací režim 150 IU/kg (1,5 mg/kg) jedenkrát denne sa má použiť u nekomplikovaných pacientov s nízkym rizikom rekurencie VTE. U všetkých ostatných pacientov, ako sú pacienti s obezitou, symptomatickou PE, onkologickým ochorením, rekurentnou VTE alebo proximálnou trombózou (vena iliaca) sa má použiť dávkovací režim 100 IU/kg (1 mg/kg) dvakrát denne.
Liečba enoxaparínom sodným sa predpisuje priemerne na 10 dní. Liečbu perorálnymi antikoagulanciami treba začať, keď je to vhodné (pozri “Prechod medzi enoxaparínom sodným a perorálnymi antikoagulaciami” na konci časti 4.2).
Prevencia tvorby trombov v mimotelovom obehu počas dialýzy
Odporúčaná dávka je 100 IU/kg (1 mg/kg) enoxaparínu sodného.
U pacientov s vysokým rizikom krvácania sa má dávka znížiť na 50 IU/kg (0,5 mg/kg) pri dvojitom
cievnom prístupe alebo na 75 IU/kg (0,75 mg/kg) pri jednoduchom cievnom prístupe.
Počas dialýzy sa má enoxaparín sodný zaviesť do arteriálnej linky na začiatku dialýzy. Účinok tejto dávky je zvyčajne dostatočný pre 4-hodinovú dialýzu, ak sa však zistí prítomnosť fibrínových prstencov, napríklad pri dialýze trvajúcej dlhšie ako je bežné, môže sa podať ďalšia dávka 50 IU až
100 IU/kg (0,5 až 1 mg/kg).
Nie sú k dispozícii žiadne údaje týkajúce sa pacientov používajúcich enoxaparín sodný na profylaxiu alebo na liečbu v priebehu podávania dialýzy.
Akútny koronárny syndróm: liečba nestabilnej angíny a infarktu myokardu bez elevácie ST-segmentu
(NSTEMI) a akútneho infarktu myokardu s eleváciou ST-segmentu (STEMI)
· Na liečbu nestabilnej angíny a NSTEMI je odporúčaná dávka enoxaparínu sodného 100 IU/kg
(1 mg/kg) každých 12 hodín subkutánnou injekciou podávanou v kombinácii s antiagregačnou
liečbou. V liečbe treba pokračovať minimálne 2 dni a potom až do klinickej stabilizácie. Zvyčajná dĺžka liečby je 2 až 8 dní.
Všetkým pacientom sa odporúča podávať kyselinu acetylsalicylovú, ak nie je kontraindikovaná, so
začiatočnou perorálnou dávkou 150–300 mg (u pacientov bez predchádzajúcej liečby kyselinou acetylsalicylovou) a udržiavaciou dávkou 75–325 mg/deň, ktorá sa podáva dlhodobo bez ohľadu na stratégiu liečby.
· Na liečbu akútneho infarktu myokardu s eleváciou ST-segmentu STEMI je odporúčaná dávka enoxaparínu sodného jedna bolusová dávka 3000 IU (30 mg) podaná intravenózne (i.v.) plus dávka 100 IU/kg (1 mg/kg) podaná subkutánne (s.c.). Následne sa podáva dávka 100 IU/kg
(1 mg/kg) s.c. každých 12 hodín (s obmedzením na maximálne 10 000 IU (100 mg) na každú

z prvých dvoch dávok podaných s.c.). Súbežne sa má podávať vhodná antiagregačná liečba, ako je perorálne podávanie kyseliny acetylsalicylovej (75 mg až 325 mg jedenkrát denne), ak nie je kontraindikovaná. Odporúča sa, aby liečba enoxaparínom sodným trvala 8 dní alebo dovtedy, kým pacient neprejde do ambulantnej liečby, podľa toho, čo nastane skôr. Ak sa enoxaparín sodný podáva s trombolytikom (fibrín špecifickým alebo fibrín nešpecifickým), musí sa enoxaparín sodný podať v časovom rozmedzí 15 minút pred a 30 minút po začiatku fibrinolytickej liečby.
o Dávkovanie u pacientov vo veku ≥ 75 rokov je uvedené v časti “Starší ľudia”.
o U pacientov liečených perkutánnou koronárnou intervenciou (PCI) nie je potrebná
žiadna dodatočná dávka, ak bol enoxaparín sodný naposledy podaný subkutánne pred
menej ako ôsmimi hodinami pred insufláciou balónu. Ak bol enoxaparín sodný naposledy podaný subkutánne pred viac ako ôsmimi hodinami pred insufláciou
balónu, musí sa podať dávka 30 IU/kg (0,3 mg/kg) enoxaparínu sodného ako i.v.
bolusová dávka.
Pediatrická populáciaBezpečnosť a účinnosť enoxaparínu nebola u pediatrickej populácie stanovená.
Starší ľudiaPre všetky indikácie okrem STEMI u starších pacientov nie je potrebná úprava dávky, s výnimkou prípadov s poruchou funkcie obličiek (pozri časti “Porucha funkcie obličiek” a časť 4.4).
Na liečbu akútneho STEMI u pacientov vo veku 75 a viac rokov, sa počiatočná intravenózna
bolusová dávka nesmie použiť. Začnite dávkovanie subkutánnou dávkou 75 IU/kg (0,75 mg/kg)
každých 12 hodín (s obmedzením na maximum 7 500 IU (75 mg) len pre každú z prvých dvoch dávok podaných subkutánne, potom pre zostávajúce ďalšie dávky je odporúčané dávkovanie 75 IU/kg
(0,75 mg/kg) subkutánne). Dávkovanie u starších pacientov s poruchou funkcie obličiek je uvedené nižšie v časti “Porucha funkcie obličiek” a v časti 4.4.
Porucha funkcie pečeneU pacientov s poruchou funkcie pečene sú k dispozícii len obmedzené údaje (pozri časti 5.1 a 5.2) a treba u nich postupovať s opatrnosťou (pozri časť 4.4).
Porucha funkcie obličiek (pozri časti 4.4 a 5.2)Závažná porucha funkcie obličiek
Enoxaparín sodný sa neodporúča u pacientov v terminálnom štádiu ochorenia obličiek (klírens kreatinínu <15 ml/min) pre nedostatok údajov v tejto populácii, okrem prevencie tvorby trombov v mimotelovom obehu počas hemodialýzy.
Tabuľka s dávkovaním pre pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu [15-
30] ml/min):
Indikácia Dávkovanie
Prevencia venóznej tromboembolickej choroby 2 000 IU (20 mg) s.c. jedenkrát denne
Liečba DVT a PE 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. jedenkrát
denne
Liečba angíny a NSTEMI 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. jedenkrát

denne
Liečba akútneho STEMI (pacienti vo veku do
75 rokov)
Liečba akútneho STEMI (pacienti vo veku nad
75 rokov)
1 x 3 000 IU (30 mg) IV bolus plus 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. a potom 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. každých 24 hodín
Bez i.v. úvodného bolusu, 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. a potom 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. každých 24 hodín
Úprava odporúčaného dávkovania sa nevzťahuje na indikáciu týkajúcu sa hemodialýzy.
Stredne ťažká a mierna porucha funkcie obličiek
Aj keď pacientom so stredne ťažkou (klírens kreatinínu 30-50 ml/min) alebo miernou (klírens
kreatinínu 50-80 ml/min) poruchou funkcie obličiek nie je nutné dávku upravovať, odporúča sa dôsledné klinické sledovanie.
Spôsobpodávania
Inhixa sa nemá podávať intramuskulárne.
Na profylaxiu venóznej tromboembolickej choroby po chirurgickom zákroku, na liečbu DVT a PE, na liečbu nestabilnej angíny a NSTEMI sa enoxaparín sodný má podávať s.c. injekciou.
Pri akútnom STEMI sa liečba začína jednou i.v. bolusovou injekciou, po ktorej ihneď nasleduje s.c.
injekcia.
Na prevenciu tvorby trombov v mimotelovom obehu počas dialýzy sa podáva do arteriálnej linky dialyzačného obvodu.
Naplnená injekčná striekačka je pripravená na okamžité použitie.
Pri používaní ampuliek alebo viacdávkových injekčných liekoviek sa odporúča použiť tuberkulínovú injekčnú striekačku alebo ekvivalent, aby sa tým zabezpečilo, že bude do injekčnej striekačky natiahnutý správny objem lieku.
s.c. injekčná technika:
Injekcia enoxaparínu sodného sa má podávať pacientovi prednostne v ležiacej polohe hlbokou s.c.
injekciou.
Ak používate naplnenú injekčnú striekačku, pred podaním injekcie z nej neodstrekujte vzduchovú bublinu, aby sa zabránilo stratám lieku. Ak je potrebné upraviť množstvo lieku, ktoré sa má podať, podľa telesnej hmotnosti pacienta, použite na dosiahnutie požadovaného množstva kalibrovanú injekčnú striekačku a prebytočné množstvo zlikvidujte. Uvedomte si, že v niektorých prípadoch nie je možné dosiahnuť presnú dávku kvôli kalibrácii (dielikom) na injekčnej striekačke, vtedy treba objem zaokrúhliť na najbližšiu hodnotu (najbližší dielik).
Injekcia sa má podávať do ľavej a pravej anterolaterálnej alebo posterolaterálnej časti brušnej steny. Celá dĺžka ihly sa zavedie kolmo do kožného záhybu vytvoreného medzi palcom a ukazovákom.
Kožný záhyb sa nemá uvoľniť dovtedy, kým injekcia nie je podaná celá. Po podaní injekcie miesto
podania nemasírujte.
Poznámka pre naplnené injekčné striekačky s automatickým bezpečnostným systémom: bezpečnostný systém sa aktivuje na konci injekcie (pozri pokyny v časti 6.6).
Ak si bude pacient podávať subkutánnu injekciu sám, pacienta treba upozorniť, aby si veľmi pozorne prečítal pokyny v písomnej informácii pre používateľa, ktorá je súčasťou balenia lieku.
i.v. (bolus) injekcia (len pre indikáciu STEMI):
Pri akútnom STEMI sa liečba začína jednou i.v. bolusovou injekciou, za ktorou ihneď nasleduje s.c.
injekcia.
Pri i.v. injekcii sa môže použiť buď viacdávková injekčná liekovka alebo naplnená injekčná striekačka.
Enoxaparín sodný sa má podať do i.v. linky. Nemá sa miešať ani podávať spolu s inými liekmi. Na zabránenie možnosti zmiešania enoxaparínu sodného s inými liekmi sa musí vybraný intravenózny prístup pred a aj po intravenóznej aplikácii enoxaparínu sodného premyť dostatočným množstvom soľného roztoku alebo roztoku dextrózy na vyčistenie prístupu pre liek. Enoxaparín sodný sa môže bezpečne podať spolu s normálnym roztokom chloridu sodného (soľný roztok) (0,9 %) alebo s 5 %- ným vodným roztokom dextrózy.
oÚvodný bolus 3 000 IU (30 mg)
Pomocou kalibrovanej naplnenej injekčnej striekačky odstreknite nadbytočný objem tak, aby injekčná
striekačka obsahovala len 3000 IU (30 mg, 0,3 ml) enoxaparínu sodného. Dávka 3000 IU (30 mg) sa
potom podáva priamo do intravenóznej linky.
oDodatočný bolus pri PCI v prípade, že sa posledné s.c. podanie uskutočnilo pred viac ako
8 hodinami pred insufláciou balónu
Pre pacientov liečených PCI sa má podať dodatočný i.v. bolus 30 IU/kg (0,3 mg/kg) a to vtedy, keď bol enoxaparín sodný naposledy podaný subkutánne pred viac ako 8 hodinami pred insufláciou balónu.
Na zabezpečenie presného odmerania malého objemu injekcie sa odporúča nariediť liek na 300 IU/ml (3 mg/ml). Na dosiahnutie koncentrácie 300 IU/ml (3 mg/ml) s použitím naplnených injekčných striekačiek obsahujúcich 6000 IU (60 mg) enoxaparínu sodného sa odporúča použiť infúzny vak
s objemom 50 ml (napr. použiť fyziologický roztok (0,9 %) alebo 5 %-ný vodný roztok dextrózy)
nasledujúcim spôsobom:
Injekčnou striekačkou odoberte z infúzneho vaku 30 ml roztoku a tento odobraný roztok odstráňte. Celý obsah naplnenej injekčnej striekačky obsahujúcej 6000 IU (60 mg) enoxaparínu sodného vstreknite do vaku k zostávajúcim 20 ml roztoku. Obsah vaku jemne premiešajte. Naberte požadovaný objem nariedeného roztoku do injekčnej striekačky určenej na podanie roztoku do intravenóznej linky.
Po ukončení riedenia sa dá vypočítať potrebný objem, ktorý je potrebný na podanie v injekcii, pomocou tohto vzorca: [objem nariedeného roztoku (ml) = hmotnosť pacienta (kg) x 0,1] alebo podľa nižšie uvedenej tabuľky. Riedenie roztoku sa odporúča robiť bezprostredne pred použitím.
Objem roztoku, ktorý má byť po nariedení podaný do i.v. linky v koncentrácii 300 IU (3 mg) /ml.
h
m
o
t
nosť požadovaná dávka
3
0 IU/kg (0,3 mg/kg)
o
bjem, ktorý má byť
podaný po nariedení na konečnú koncentráciu
30
0 IU (3 mg) / ml
[
k
g
] IU [mg] [ml]
45 1350 13,5 4,5
50 1500 15 5
55 1650 16,5 5,5
60 1800 18 6
65 1950 19,5 6,5
70 2100 21 7
75 2250 22,5 7,5
80 2400 24 8
85 2550 25.5 8.5
90 2700 27 9
95 2850 28,5 9,5
100 3000 30 10
105 3150 31,5 10,5
110 3300 33 11
115 3450 34.5 11.5
120 3600 36 12
125 3750 37,5 12,5
130 3900 39 13
135 4050 40,5 13,5
140 4200 42 14
145 4350 43,5 14,5
150 4500 45 15
Injekcia do arteriálnej linky:
Podáva sa do arteriálnej linky dialyzačného obvodu na prevenciu tvorby trombov v mimotelovom
obehu počas hemodialýzy.
Prechodmedzienoxaparínomsodnýmaantikoagulanciami
· Prechod medzi enoxaparínom sodným a antagonistami vitamínu K (VKA)
Je nutné zintenzívniť klinické monitorovanie a laboratórne testy [protrombínový čas vyjadrený ako
International Normalized Ratio (INR)] s cieľom sledovať účinok VKA.
Nakoľko je tu časový interval, kým VKA dosiahne svoj maximálny účinok, liečba enoxaparínom sodným musí pokračovať v konštantnej dávke tak dlho, ako je to nutné na udržanie INR
v požadovanom terapeutickom rozsahu v danej indikácii v dvoch po sebe nasledujúcich testoch. U pacientov liečených VKA je potrebné liečbu VKA ukončiť a prvú dávku enoxaparínu sodného podať vtedy, keď INR poklesne pod terapeutický rozsah.
· Prechod medzi enoxaparínom sodným a priamymi perorálnymi antikoagulanciami (DOAC) U pacientov, ktorí dostávajú v súčasnosti enoxaparín sodný, je potrebné ukončiť túto liečbu a začať s užívaním DOAC od 0 do 2 hodín pred časom určeným pôvodne na podanie ďalšej dávky enoxaparínu sodného, dávkovanie DOAC sa má použiť tak, ako je uvedené v jeho SPC.
U pacientov, ktorí užívajú v súčasnosti DOAC, sa má prvá dávka enoxaparínu sodného podať v čase,
kedy sa pôvodne mala užiť ďalšia dávka DOAC.
Podanieprispinálnej/epidurálnejanestéziialebolumbálnejpunkcii
Ak sa lekár rozhodne podať antikoagulačnú liečbu v súvislosti s epidurálnou alebo spinálnou anestéziou/analgéziou alebo lumbálnou punkciou, odporúča sa dôsledné neurologické monitorovanie kvôli riziku neuraxiálnych hematómov (pozri časť 4.4).
- Pri dávkach používaných na prevenciu
Medzi poslednou injekciou enoxaparínu sodného pri profylaktických dávkach a zavedením ihly alebo katétra sa musí zachovať časový interval bez punkcie najmenej 12 hodín.
Pri kontinuálnych technikách sa má zachovať podobný posun najmenej 12 hodín pred odstránením katétra.
Pre pacientov s klírensom kreatinínu [15-30] ml/min treba uvažovať so zdvojnásobením časového intervalu punkcia/zavedenie katétra alebo odstránenie katétra na najmenej 24 hodín. Začatie liečby enoxaparínom sodným v dávke 2 000 IU (20 mg) 2 hodiny pred operáciou nie je kompatibilné s neuraxiálnou anestéziou.
- Pri dávkach používaných na liečbu
Medzi poslednou injekciou enoxaparínu sodného pri kuratívnych dávkach a zavedením ihly alebo katétra sa musí zachovať časový interval bez punkcie najmenej 24 hodín (pozri aj časť
4.3).
Pri kontinuálnych technikách sa má zachovať podobný posun najmenej 24 hodín pred odstránením katétra.
Pre pacientov s klírensom kreatinínu [15-30] ml/min treba uvažovať so zdvojnásobením časového intervalu punkcia/zavedenie katétra alebo odstránenie katétra na najmenej 48 hodín. Pacienti dostávajúci dávky dvakrát denne (t.j. 75 IU/kg (0,75 mg/kg) dvakrát denne alebo
100 IU/kg (1 mg/kg) dvakrát denne) majú vynechaťdruhú dávku enoxaparínu kvôli umožneniu dostatočného časového posunu pre zavedenie alebo odstránenie katétra.
Hladina anti-Xa je v týchto časových bodoch stále ešte detekovateľná a toto posunutie negarantuje, že sa zabráni vytvoreniu neuraxiálneho hematómu.
Rovnako treba zvážiť posunutie času podania enoxaparínu sodného o najmenej 4 hodiny po
spinálnej/epidurálnej punkcii alebo po odstránení katétra. Tento časový posun musí vychádať
z vyhodnotenia pomeru prínos - riziko berúc do úvahy aj riziko trombózy aj riziko krvácania
v kontexte liečby a rizikových faktorov konkrétneho pacienta.
4.3 Kontraindikácie
Enoxaparín sodný je kontraindikovaný u pacientov:
· s precitlivenosťou na enoxaparín sodný, heparín alebo jeho deriváty vrátane iných nízkomolekulových heparínov (LMWH) alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1;
· s anamnézou heparínom indukovanej trombocytopénie (HIT) sprostredkovanej imunitou za posledných 100 dní alebo s prítomnosťou cirkulujúcich protilátok (pozri aj časť 4.4);
· s aktívnym klinicky signifikantným krvácaním a stavmi s vysokým rizikom krvácania, vrátane nedávnej mozgovej príhody s krvácaním, so žalúdočnočrevným vredom, s prítomnosťou
malígnej neoplazmy s vysokým rizikom krvácania, nedávnou operáciou mozgu, chrbtice alebo
oka, so známymi alebo suspektnými varixami ezofágu, s arteriovenóznymi malformáciami, s vaskulárnou aneuryzmou alebo s veľkými intraspinálnymi alebo intracerebrálnymi vaskulárnymi abnormalitami;
· pri spinálnej alebo epidurálnej anestézii alebo lokálno-regionálnej anestézii, ak sa enoxaparín sodný použil v predchádzajúcich 24 hodinách (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
· Všeobecné
Enoxaparín sodný nemožno zamieňať (jednotku za jednotku) s inými nízkomolekulovými heparínmi (LMWHs). Tieto lieky sa líšia svojím výrobným postupom, molekulovou hmotnosťou, špecifickou anti-Xa a anti-IIa aktivitou, jednotkami, dávkovaním a klinickou účinnosťou a bezpečnosťou. Následkom toho majú rozdielnu farmakokinetiku a biologickú aktivitu (napr. antitrombínovú aktivitu a interakciu s krvnými doštičkami). Preto treba venovať osobitnú pozornosť špecifickým pokynom na používanie pre každý z týchto liekov a dodržiavať ich.
· Anamnéza HIT (>100 dní)
Používanie enoxaparínu sodného u pacientov s anamnézou imunitne sprostredkovanej HIT za posledných 100 dní alebo pri prítomnosti cirkulujúcich protilátok je kontraindikované (pozri časť 4.3). Cirkulujúce protilátky môžu pretrvávať niekoľko rokov.
U pacientov s anamnézou (>100 dní) heparínom indukovanej trombocytopénie bez prítomnosti
cirkulujúcich protilátok sa má enoxaparín sodný používať s mimoriadnou opatrnosťou. V takomto prípade možno urobiť rozhodnutie o použití enoxaparínu sodného len po starostlivom vyhodnotení pomeru prínos-riziko a po zvážení možnosti neheparínovej alternatívnej liečby (napr. danaparoid sodný alebo lepirudín).
· Monitorovanie počtu krvných doštičiek
Pri nízkomolekulových heparínoch existuje aj riziko vzniku heparínom indukovanej trombocytopénie
sprostredkovanej protilátkami. Ak sa vyskytne trombocytopénia, zvyčajne sa objaví medzi 5. až
21.dňom od začiatku liečby enoxaparínom.
Riziko HIT je vyššie u pacientov po operácii a najmä po operácii srdca a u onkologických pacientov. Preto sa odporúča zmerať počet krvných doštičiek na začiatku liečby enoxaparínom sodným a potom merať pravidelne počas liečby.
Ak existujú klinické príznaky pripomínajúce HIT (nová epizóda arteriálneho a/alebo venózneho
tromboembolizmu, bolestivé kožné lézie v mieste injekcie, alergické alebo anafylaktoidné reakcie na liečbu), je potrebné zmerať počet krvných doštičiek. Pacienti musia byť upovedomení, že takéto príznaky sa môžu objaviť a ak sa to stane, musia informovať svojho lekára.
V praxi, ak sa potvrdí signifikantný pokles počtu krvných doštičiek (30 až 50 % z východiskovej
hodnoty), liečba enoxaparínom sodným sa musí okamžite ukončiť a pacient musí prejsť na inú alternatívnu neheparínovú antikoagulačnú liečbu.
· Krvácanie
Rovnako ako pri iných antikoagulanciách, môže sa vyskytnúť v ktoromkoľvek mieste krvácanie.
Ak sa vyskytne, je nutné vyšetriť pôvod krvácania a začať vhodnú liečbu.
Rovnako ako pri inej antikoagulačnej liečbe, enoxaparín sodný sa má použiť s opatrnosťou v stavoch so zvýšeným potenciálom pre krvácanie, ako je napríklad:
· porucha hemostázy,
· peptický vred v anamnéze,
· nedávno prekonaná ischemická mozgová príhoda,
· ťažká arteriálna hypertenzia,
· nedávna diabetická retinopatia,
· neurologický alebo oftalmologický chirurgický výkon,
· súbežné podávanie liekov ovplyvňujúcich hemostázu (pozri časť 4.5).
· Laboratórne vyšetrenia
Enoxaparín sodný podávaný v dávkach za účelom profylaxie venóznej tromboembólie významne neovplyvňuje dobu krvácania a celkové koagulačné testy, nemá vplyv na agregáciu krvných doštičiek alebo na väzbu fibrinogénu na krvné doštičky.
Pri vyšších dávkach enoxaparínu sa môže zvýšiť aktivovaný parciálny tromboplastínový čas (aPTT) a
aktivovaný čas koagulácie (ACT). Predĺženia aPTT a ACT a zvýšený antitrombotický účinok enoxaparínu sodného nie sú v lineárnom vzťahu, a preto tieto hodnoty nie sú pre sledovanie účinku
enoxaparínu sodného vhodné ani spoľahlivé.
· Spinálna/Epidurálna anestézia alebo lumbálna punkcia
Spinálna/epidurálna anestézia alebo lumbálna punkcia sa nesmie robiť v priebehu 24 hodín od podania
enoxaparínu sodného v terapeutických dávkach (pozri tiež časť4.3).
Pri súbežnom použití enoxaparínu a spinálnej / epidurálnej anestézie alebo spinálnej punkcii boli hlásené prípady neuraxiálnych hematómov, ktoré mali za následok dlhodobú alebo trvalú paralýzu. Pri dávkovacom režime 4000 IU (40 mg) jedenkrát denne a nižšom sú tieto prípady zriedkavé. Riziko je vyššie pri vyšších dávkovacích režimoch enoxaparínu sodného, pri použití pooperačných epidurálnych katétrov, pri súbežnom užívaní ďalších liekov ovplyvňujúcich hemostázu ako sú nesteroidné
protizápalové lieky (NSAID), pri traumatickej alebo opakovanej epidurálnej alebo spinálnej punkcii
alebo u pacientov s operáciou chrbtice v anamnéze alebo deformáciou chrbtice v anamnéze.
Pri súbežnom použití enoxaparínu a epidurálnej alebo spinálnej anestézie / analgézie alebo spinálnej punkcii je potrebné na zníženie rizika vzniku krvácania vziať do úvahy farmakokinetický profil enoxaparínu sodného (pozri časť 5.2). Zavedenie alebo odstraňovanie epidurálneho katétra alebo lumbálnej punkcie je najlepšie robiť vtedy, keď je antikoagulačný účinok enoxaparínu nízky; avšak presný čas, kedy sa dosiahne dostatočne nízky antikoagulačný účinok u konkrétneho pacienta, nie je známy. U pacientov s klírensom kreatinínu [15 -30 ml/minúta] je potrebné zvažovať aj ďalšie okolnosti, pretože eliminácia enoxaparínu trvá dlhšie (pozri časť 4.2).
Ak sa lekár rozhodne podať antikoagulačnú liečbu v súvislosti s epidurálnou alebo spinálnou anestéziou/analgéziou alebo lumbálnou punkciou, je potrebné často monitorovať akékoľvek prejavy a príznaky neurologického poškodenia, ako je bolesť pozdĺž chrbtice, zmyslové a motorické ťažkosti (necitlivosť alebo slabosť dolných končatín), poruchy činnosti hrubého čreva a/alebo močového mechúra. Pacienta je potrebné poučiť, že má ihneď informovať lekára, ak spozoruje niektorý z vyššie uvedených prejavov alebo príznakov. Pri podozrení na prejavy alebo príznaky spinálneho hematómu
je potrebná urgentná diagnostika a okamžitá liečba, vrátane zváženia dekompresie miechy, aj keď táto liečba nemusí zabrániť alebo zvrátiť neurologické následky.
· Nekróza kože / kožná vaskulitída
Pri LMWH bola hlásená nekróza kože a kožná vaskulitída, v takých prípadoch treba okamžite liečbu ukončiť.
· Perkutánne koronárne revaskularizačné výkony
Aby sa minimalizovalo riziko krvácania pri cievnych inštrumentálnych výkonoch uskutočňovaných
počas liečby nestabilnej angíny pectoris, NSTEMI a akútneho STEMI, dôsledne dodržiavajte intervaly odporúčané medzi dávkami enoxaparínu sodného. Je to dôležité preto, aby sa dosiahla hemostáza
v mieste punkcie po PCI. V prípade, že sa použije uzatváracia pomôcka, púzdro cievneho vodiča (sheat) možno odstrániť okamžite. Ak sa použije metóda manuálnej kompresie, púzdro cievneho vodiča (sheat) sa má odstrániť po 6 hodinách po poslednej i.v./s.c. injekcii enoxaparínu sodného. Ak
má liečba enoxaparínom sodným pokračovať, ďalšia plánovaná dávka enoxaparínu sa má podať najskôr 6-8 hodín po odstránení puzdra. Má sa sledovať, či sa v mieste výkonu nevyskytnú príznaky
krvácania alebo hematóm.
· Akútna infekčná endokarditída
U pacientov s akútnou infekčnou endokarditídou sa používanie heparínu obvykle neodporúča kvôli riziku krvácania do mozgu. Ak sa jeho použitie považuje za absolútne nebyhnutné, rozhodnutie treba
urobiť len po starostlivom individuálnom posúdení pomeru prínos-riziko.
· Umelá mechanická srdcová chlopňa
Používanie enoxaparínu sodného u pacientov s umelou mechanickou srdcovou chlopňou za účelom
tromboprofylaxie nebolo dostatočne preskúmané. U pacientov s umelou mechanickou srdcovou
chlopňou, ktorým bol podávaný enoxaparín za účelom tromboprofylaxie, sa zaznamenali ojedinelé prípady trombózy umelej srdcovej chlopne. Nejasné okolnosti, vrátane základného ochorenia
a nedostatočných klinických údajov, obmedzujú zhodnotenie týchto prípadov. Niektoré z týchto
prípadov boli gravidné ženy, u ktorých trombóza spôsobila smrť matky a plodu.
· Gravidné ženy s umelou mechanickou srdcovou chlopňou
Používanie enoxaparínu sodného u gravidných žien s umelou mechanickou srdcovou chlopňou
za účelom tromboprofylaxie nebolo dostatočne preskúmané. V klinickej štúdii s gravidnými ženami
s umelou mechanickou srdcovou chlopňou, kde sa podával enoxaparín v dávke 100 IU/kg (1 mg/kg) dvakrát denne za účelom zníženia rizika tromboembólie, došlo u 2 z 8 žien k tvorbe krvných zrazenín, ktoré zablokovali chlopňu a spôsobili smrť matky a plodu. Po uvedení lieku na trh sa u gravidných
žien s umelou mechanickou srdcovou chlopňou, ktorým sa podával profylakticky enoxaparín,
zaznamenali ojedinelé prípady chlopňovej trombózy. Gravidné ženy s umelou mechanickou srdcovou
chlopňou môžu byť vystavené vyššiemu riziku tromboembólie.
· Starší ľudia
Pri podávaní profylaktických dávok enoxaparínu starším pacientom sa nepozorovala zvýšená
tendencia ku krvácaniu.
Starší pacienti (hlavne 80-roční a starší) môžu byť pri podávaní terapeutických dávok enoxaparínu vystavení vyššiemu riziku komplikácií s krvácaním. Odporúča sa preto starostlivé klinické sledovanie
a u pacientov starších ako 75 rokov liečených na STEMI možno zvážiť zníženie dávky (pozri časti 4.2
a 5.2).
· Porucha funkcie obličiek
Pacienti s poruchou funkcie obličiek sú vystavení vyššiemu účinku enoxaparínu sodného, čím sa zvyšuje riziko krvácania. U týchto pacientov sa odporúča starostlivé klinické monitorovanie a možno zvážiť aj biologické monitorovanie meraním anti-Xa aktivity(pozri časti 4.2 a 5.2).
Enoxaparín sodný sa neodporúča u pacientov v terminálnom štádiu ochorenia obličiek (klírens kreatinínu <15 ml/min) pre nedostatok údajov v tejto populácii okrem prevencie tvorby trombov v mimotelovom obehu počas dialýzy.
Pacienti so závažnou poruchou funkcie obličiek (klírens kreatinínu 15-30 ml/min ) sú vystavení
výrazne vyššiemu účinku enoxaparínu sodného, preto sa odporúča úprava terapeutických
a profylaktických dávkovacích režimov (pozri časť 4.2).
Pacientom so stredne ťažkou (klírens kreatinínu 30-50 ml/min) a miernou (klírens kreatinínu 50-
80 ml/min) poruchou funkcie obličiek nie je nutné upraviť dávku.
· Porucha funkcie pečene
U pacientov s poruchou funkcie pečene je potrebná opatrnosť pri používaní enoxaparínu sodného
kvôli zvýšenému potenciálu krvácania. Úprava dávky na základe monitorovania hladiny anti-Xa nie je
spoľahlivá u pacientov s cirhózou pečene a neodporúča sa (pozri časť 5.2).
· Nízka hmotnosť
Pacienti s nízkou hmotnosťou (ženy < 45 kg, muži < 57 kg) sú pri podávaní profylaktických dávok
enoxaparínu sodného (neupravených podľa hmotnosti pacienta) vystavení vyššiemu účinku lieku, čo môže viesť k vyššiemu riziku krvácania. Preto sa odporúča starostlivé klinické sledovanie takýchto pacientov (pozri časť 5.2).
· Obézni pacienti
Obézni pacienti majú vyššie riziko trombembolizmu. Bezpečnosť a účinnosť profylaktických dávok
u obéznych pacientov (BMI >30 kg/m2) nebola úplne stanovená a neexistuje konsenzus, pokiaľ ide
o úpravu dávok. U týchto pacientov je potrebné starostlivo sledovať prejavy a príznaky
tromboembolizmu.
· Hyperkaliémia
Heparíny môžu potláčať sekréciu aldosterónu v nadobličkách, čo spôsobuje hyperkaliémiu (pozri časť
4.8), najmä u pacientov s diabetom mellitus, chronickým zlyhaním obličiek, preexistujúcou metabolickou acidózou, pacientov užívajúcich lieky, o ktorých je známe, že zvyšujú hladinu draslíka (pozri časť 4.5). Je potrebné pravidelne monitorovať plazmatické hladiny draslíka, najmä u rizikových pacientov.
· Sledovateľnosť lieku
Nízkomolekulové heparíny (LMWHs) sú biologické liečivá. Zdravotníckym pracovníkom sa odporúča zaznamenať obchodný názov a číslo šarže podaného lieku do zdravotného záznamu pacienta s cieľom zlepšiť sledovateľnosť LMWH.
Obsahsodíka
Tento liek obsahuje menej než 1 mmol sodíka (23 mg) na dávku, t.j. obsahuje v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcie
Súbežné
používanie
sa
neodporúča:
· Lieky ovplyvňujúce hemostázu (pozri časť 4.4)
Pred začiatkom terapie enoxaparínom sa odporúča prerušiť liečbu niektorými liekmi ovplyvňujúcimi hemostázu, pokiaľ nie sú striktne indikované. Ak je kombinované používanie indikované, je potrebné pri používaní enoxaparínu sodného starostlivé príslušné klinické a laboratórne monitorovanie. K takýmto liekom patria:
- systémové salicyláty, kyselina acetylsalicylová a nesteroidné antiflogistiká (NSAID)
vrátane ketorolaku,
- iné trombolytiká (napr. altepláza, retepláza, streptokináza, tenektepláza, urokináza) a antikoagulanciá (pozri časť 4.2).
Súbežnépoužívaniesaodporúčasopatrnosťou:
Tieto lieky je možné podávať súbežne s enoxaparínom sodným s opatrnosťou:
· Iné lieky ovplyvňujúce hemostázu, ako sú:
- inhibítory zhlukovania krvných doštičiek vrátane kyseliny acetylsalicylovej používanej
ako antiagregačný liek (v dávke na kardioprotekciu), klopidogrel, tiklopidín a antagonisty
glykoproteínu IIb/IIIa indikované pri akútnom koronárnom syndróme, kvôli riziku krvácania,
- dextran 40,
- systémové glukokortikoidy.
· Lieky zvyšujúce hladinu draslíka:
Lieky zvyšujúce sérovú hladinu draslíka sa môžu podávať súbežne s enoxaparínom sodným pri starostlivom klinickom a laboratórnom monitorovaní (pozri časti 4.4 a 4.8).
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí nie sú žiadne dôkazy o prechode enoxaparínu placentárnou bariérou v druhom a treťom trimestri gravidity. O prvom trimestri nie sú k dispozícii žiadne informácie.
Štúdie na zvieratách nepreukázali žiadne známky fetálnej toxicity alebo teratogenity (pozri časť 5.3). Na údajoch o zvieratách sa preukázalo, že prechod enoxaparínu cez placentu je minimálny. Enoxaparín možno používať počas gravidity len ak lekár potvrdí jednoznačnú potrebu jeho použitia.
Ženy, ktoré dostávajú enoxaparín sodný počas gravidity, treba starostlivo monitorovať, pokiaľ ide o prejavy krvácania alebo výraznej antikoagulácie a upozorniť ich na riziko krvácania. Podľa celkových údajov u tehotných žien neexistuje dôkaz zvýšeného rizika krvácania, trombocytopénie alebo osteoporózy v porovnaní s rizikom pozorovaným u žien, ktoré nie sú gravidné, okrem rizika, ktoré sa pozorovalo u tehotných žien s umelou srdcovou chlopňou (pozri časť 4.4).
Ak sa plánuje epidurálna anestézia, odporúča sa predtým ukončiť liečbu enoxaparínom sodným (pozri časť 4.4).
Dojčenie
Nie je známe, či sa nezmenený enoxaparín vylučuje do ľudského materského mlieka. U dojčiacich potkanov je prechod enoxaparínu alebo jeho metabolitov do mlieka veľmi nízky. Perorálna absorpcia enoxaparínu je nepravdepodobná. Inhixa sa môže používať počas dojčenia.
Fertilita
Nie sú žiadne klinické údaje súvisiace s enoxaparínom sodným týkajúce sa fertility. Štúdie na zvieratách nepreukázali žiadny vplyv na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Enoxaparín sodný nemá žiadny alebo má len zanedbateľný vplyv na schopnosť riadiť motorové vozidlo a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Enoxaparín sa vyhodnocoval u viac ako 15 000 pacientov, ktorí dostávali enoxaparín v klinickom skúšaní. Z toho 1776 pacientov s rizikom tromboembolických komplikácií dostávalo enoxaparín ako prevenciu hlbokej žilovej trombózy po ortopedickej alebo abdominálnej operácii, 1169 pacientov
s akútnym interným ochorením s ťažkým obmedzením mobility dostávalo enoxaparín ako prevenciu
hlbokej žilovej trombózy, 559 pacientov s pľúcnou embóliou alebo bez nej dostávalo enoxaparín na liečbu hlbokej žilovej trombózy, 1578 pacientov na liečbu nestabilnej angíny a non-Q-infarktu myokardu a 10 176 pacientov na liečbu akútneho STEMI.
Režim podávania enoxaparínu sodného v klinickom skúšaní sa menil v závislosti od indikácií. Pri prevencii hlbokej žilovej trombózy po operácii alebo u pacientov s akútnym interným ochorením
s ťažkým obmedzením mobility bola dávka enoxaparínu sodného 4 000 IU (40 mg) subkutánne
jedenkrát denne. Pri liečbe hlbokej žilovej trombózy (DVT) s pľúcnou embóliou (PE) alebo bez nej dostávali pacienti dávku buď 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín alebo dávku
150 IU/kg (1,5 mg/kg) subkutánne jedenkrát denne. V klinických štúdiách na liečbu nestabilnej angíny
a non-Q-infarktu myokardu boli dávky 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín
a v klinickej štúdii na liečbu akútneho STEMI sa podával enoxaparín sodný v dávke 3 000 IU (30 mg)
intravenózne ako bolus a potom nasledovala dávka 100 IU/kg (1 mg/kg) subkutánne každých
12 hodín.
V klinických štúdiách boli najčastejšími hlásenými reakciami krvácanie, trombocytopénia a trombóza
(pozri časť 4.4 a 'Opis vybraných nežiaducich reakcií' nižšie).
Zoznam nežiaducich reakcií v tabuľkovom formáte
Ďalšie nežiaduce reakcie, ktoré sa pozorovali v klinických štúdiách a ktoré boli hlásené po uvedení
lieku na trh (* znamená reakcie zo skúseností po uvedení lieku na trh) sú podrobnejšie uvedené nižšie. Frekvencie výskytu sú definované takto: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) alebo neznáme (z dostupných údajov). V rámci každej triedy orgánového systému sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Poruchy krvi a lymfatického systému
· časté: krvácanie, hemoragická anémia*, trombocytopénia, trombocytóza
· zriedkavé: eozinofília*
· zriedkavé: prípady imunoalergickej trombocytopénie s trombózou, u niektorých bola trombóza komplikovaná orgánovým infarktom alebo ischémiou končatiny (pozri časť 4.4).
Poruchy imunitného systému
· časté: alergická reakcia
· zriedkavé: anafylaktické/anafylaktoidné reakcie vrátane šoku*
Poruchy nervového systému
· časté: bolesť hlavy*
Poruchy ciev
· zriedkavé: spinálny hematóm* (alebo neuraxiálny hematóm). Tieto reakcie majú za následok rôzne stupne neurologického poškodenia vrátane dlhodobej alebo permanentnej paralýzy (pozri
časť 4.4)
Poruchy pečene a žlčových ciest
· veľmi časté: zvýšenie pečeňových enzýmov (najmä transamináz > 3-násobok hornej hranice normálu)
· menej časté: hepatocelulárne poškodenie pečene *,
· zriedkavé: cholestatické poškodenie pečene*
Poruchy kože a podkožného tkaniva
· časté: urtikária, pruritus, erytém
· menej časté: bulózna dermatitída
· zriedkavé: alopécia*
· zriedkavé: kožná vaskulitída*, kožná nekróza* obvykle sa vyskytuje v mieste vpichu injekcie
(predchádza jej zvyčajne purpura alebo erytematózne plaky, infiltrované a bolestivé).
Uzlíky v mieste vpichu injekcie * (zapálené uzlíky, ktoré neboli cystickým obalom enoxaparínu).
Vymiznú v priebehu niekoľkých dní a nie je potrebné kvôli tomu ukončiť liečbu.
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
· zriedkavé: osteoporóza* po dlhodobej liečbe (viac ako 3 mesiace).
Celkové poruchy a reakcie v mieste podania
· časté: hematóm v mieste vpichu injekcie, bolesť v mieste vpichu injekcie, iné reakcie v mieste vpichu injekcie (ako je opuch, krvácanie, hypersenzitivita, zápal, zhrubnutie, bolesť alebo reakcia)
· menej časté: lokálne podráždenie, kožná nekróza v mieste vpichu injekcie
Laboratórne a funkčné vyšetrenia
· zriedkavé : hyperkaliémia*(pozri časti 4.4 a 4.5)
Opisvybranýchnežiaducichreakcií
Krvácanie
Patrilo sem veľké krvácanie, zaznamenalo sa u viac ako u 4,2 % pacientov (chirurgickí pacienti). Niektoré z týchto prípadov boli fatálne. U chirurgických pacientov sa za veľké krvácanie považovalo (1) to, ktoré spôsobilo závažnú klinickú udalosť alebo (2) to, pri ktorom bol pokles hemoglobínu
≥ 2 g/dl alebo ktoré si vyžiadalo transfúziu 2 alebo viac jednotiek krvných prípravkov.
Retroperitoneálne a intrakraniálne krvácanie za vždy považovalo za veľké.
Podobne ako pri podávaní iných antikoagulancií, sa môže v prítomnosti pridružených rizikových faktorov ako sú organické poškodenia s tendenciou ku krvácaniu, invazívne zákroky alebo používanie liekov ovplyvňujúcich hemostázu, vyskytnúť krvácanie (pozri časti 4.4 a 4.5).
Trieda
orgánového systému
Poruchy krvi a lymfatického systému
Prevencia
u chirurgických
pacientov
veľmi časté:
krvácanie α
zriedkavé: retroperitoneálne krvácanie
Prevencia
u interných pacientov
časté:
krvácanie α
Liečba pacientov
s DVT s PE alebo bez nej
veľmi časté:
krvácanie α
menej časté: intrakraniálne krvácanie, retroperitoneálne krvácanie
Liečba pacientov
s nestabilnou angínou a non-Q infarktom myokardu
časté:
krvácanie α
zriedkavé: retroperitoneálne krvácanie'
Liečba pacientov
s akútnym STEMI
časté:
krvácanie α
menej časté: intrakraniálne krvácanie, retroperitoneálne krvácanie
 α
α: napríklad: hematóm, ekchymóza iná ako v mieste vpichu injekcie, hematóm v rane, hematúria, epistaxa
a gastrointestinálne krvácanie.
Trombocytopénia a trombocytóza
Trieda orgáno vého systém u Poruch y krvi
a
lymfati ckého systém u
Prevencia
u chirurgických
pacientov
veľmi časté:
trombocytózaβ
časté:
trombocytopénia
Prevencia
u interných
pacientov
menej časté:
trombocytopénia
Liečba pacientov
s DVT s PE alebo bez nej
veľmi časté:
trombocytóza β
časté:
trombocytopénia
Liečba pacientov s nestabilnou angínou a non-Q infarktom myokardu
menej časté:
trombocytopénia
Liečba pacientov
s akútnym STEMI
časté: trombocytózaβ trombocytopénia veľmi zriedkavé: imuno-alergická trombocytopénia
 β
β: zvýšenie počtu krvných doštičiek > 400 x 109/l
PediatrickápopuláciaBezpečnosť a účinnosť enoxaparínu sodného u detí nebola stanovená (pozri časť 4.2).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.
4.9 PredávkovaniePrejavyapríznakyNáhodné predávkovanie enoxaparínom sodným po subkutánnom, mimotelovom alebo intravenóznom podaní môže viesť ku krvácavým komplikáciám. Po perorálnom podaní, dokonca aj vysokých dávok,
nie je pravdepodobné, že sa enoxaparín sodný absorbuje.
LiečbaAntikoagulačný účinok enoxaparínu možno do veľkej miery neutralizovať pomalým intravenóznym podaním protamínu. Dávka protamínu závisí od dávky podaného enoxaparínu sodného; 1 mg
protamínu neutralizuje antikoagulačný účinok 100 IU (1 mg) enoxaparínu sodného, ak bol enoxaparín
podaný v priebehu posledných 8 hodín. Ak bol enoxaparín podaný pred viac ako 8 hodinami alebo ak je potrebná druhá dávka protamínu, môže sa podať infúzia protamínu v dávke 0,5 mg protamínu na
100 IU (1 mg) podaného enoxaparínu sodného. 12 hodín po podaní enoxaparínu nemusí byť podanie
protamínu potrebné. Avšak anti-Xa aktivita enoxaparínu sodného sa nikdy (ani pri vysokých dávkach protamínu) nezneutralizuje úplne (najviac asi 60 %) (pozri Súhrn charakteristických vlastností solí protamínu).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antitrombotikum, skupina heparínov. ATC kód: B01A B05
Inhixa je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.euFarmakodynamickéúčinky
Enoxaparín je nízkomolekulový heparín so strednou molekulovou hmotnosťou približne
4500 daltonov, v ktorom sú oddelené antitrombotická a antikoagulačná aktivita štandardného heparínu. Liečivo je sodná soľ.
V in-vitro purifikovanom systéme má enoxaparín sodný vysokú anti-Xa aktivitu (približne 100 IU/mg) a nízku anti-IIa alebo antitrombínovú aktivitu (približne 28 IU/mg) s pomerom 3,6. Tieto antikoagulačné aktivity sú sprostredkované antitrombínom (ATIII), čo má za následok antitrombotické účinky u ľudí.
Okrem anti-Xa/IIa aktivity boli identifikované u zdravých ľudí a u pacientov, ako aj na predklinických modeloch, ďalšie antitrombotické a protizápalové vlastnosti enoxaparínu. Patrí sem ATIII- dependentná inhibícia ďalších koagulačných faktorov ako je faktor VIIa, indukcia uvoľňovania endogénneho inhibítora cesty tkanivového faktora (Tissue Factor Pathway Inhibitor (TFPI)) a znížené uvoľňovanie von Willebrandovho faktora (vWF) z vaskulárneho endotelu do krvného obehu. O týchto faktoroch je známe, že prispievajú k celkovému antitrombotickému účinku enoxaparínu.
Keď sa enoxaparín sodný používa ako profylaktická liečba, nemá významný vplyv na aPTT. Keď sa používa ako kuratívna liečba, aPTT sa môže predĺžiť o 1,5-2,2-násobok kontrolného času pri maxime účinku.
Klinická účinnosťabezpečnosť
Prevencia venóznej tromboembolickej choroby spojená s operáciou
Predĺžená profylaxia VTE po ortopedickej operácii
V dvojito zaslepenej štúdii predĺženej profylaxie u pacientov podstupujúcich náhradu bedrového kĺbu,
179 pacientov, ktorí nemali tromboembolickú chorobu a predtým počas hospitalizácie dostávali
4000 IU (40 mg) enoxaparínu sodného, boli po prepustení randomizovaní na buď 4000 IU (40 mg) (n=90) jedenkrát denne subkutánne, alebo placebo ( n=89) na 3 týždne. Výskyt DVT počas predĺženej profylaxie bol štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, nebola hlásená žiadna PE. Nevyskytlo sa žiadne veľké krvácanie.
Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo jedenkrát denne s.c. n (%)
Všetci pacienti liečení predĺženou
profylaxiou
90 (100) 89 (100)
celkovo VTE 6 (6,6) 18 (20,2) celkovo DVT (%) 6 (6,6)* 18 (20,2) proximálna DVT (%) 5 (5,6)# 7 (8,8)
*p hodnota oproti placebu =0,008
#p hodnota oproti placebu =0,537
V druhej dvojito zaslepenej štúdii bolo 262 pacientov bez VTE ochoreniapodstupujúcich operáciu s
náhradou bedrového kĺbu a predtým počas hospitalizácie liečených enoxaparínom sodným 4 000 IU (40 mg) s.c, . bolo randomizovaných po prepustení na buď enoxaparín sodný 4 000 IU (40 mg) (n=131) jedenkrát denne s.c., alebo placebo (n=131) počas 3 týždňov. Podobne ako v prvej štúdii bol výskyt VTE počas predĺženej profylaxie štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, a to aj pre VTE celkovo (enoxaparín sodný 21 [16 %] oproti placebu 45
[34,4 %]; p=0,001) aj pre proximálnu DVT (enoxaparín sodný 8 [6,1%] oproti placebu 28 [21,4 %]; p=<0,001). Pokiaľ ide o veľké krvácanie, nezistil sa žiadny rozdiel medzi skupinami s enoxaparínom sodným a placebom.
Predĺžená profylaxia DVT po onkologickej operácii
Dvojito zaslepená, multicentrická klinická štúdia, porovnávala bezpečnosť a účinnosť štvortýždňového a jednotýždňového režimu profylaktického podávania enoxaparínu sodného
u 332 pacientov, ktorí sa podrobili elektívnej operácii z dôvodu rakoviny v brušnej alebo panvovej
oblasti. Pacienti dostávali enoxaparín sodný (4 000 IU (40 mg) s.c.) denne počas 6 až 10 dní a boli náhodne zaradení na liečbu enoxaparínom sodným alebo placebom počas ďalších 21 dní. Bilaterálna venografia sa realizovala medzi 21. a 31. dňom alebo skôr, ak sa vyskytli príznaky venózneho tromboembolizmu. Pacienti boli potom 3 mesiace sledovaní. Profylaxia enoxaparínom sodným počas
4 týždňov po operácii z dôvodu rakoviny v oblasti brucha alebo panvy štatisticky významne znížila výskyt venograficky preukázanej trombózy v porovnaní s profylaxiou enoxaparínom sodným počas jedného týždňa. Výskyt venózneho tromboembolizmu na konci dvojito zaslepenej fázy bol 12,0 % (n=20) v skupine s placebom a 4,8 % (n=8) v skupine s enoxaparínom sodným; p=0,02. Tento rozdiel pretrvával tri mesiace [13,8 % vs. 5,5 % (n=23 vs 9), p=0,01]. Neboli rozdiely vo výskyte krvácania alebo iných komplikácií počas dvojito zaslepenej alebo sledovacej fázy.
Prevencia venóznej tromboembolickej choroby u interných pacientov s akútnymi ochoreniami, kde sa očakáva obmedzenie mobility
V dvojito zaslepenej, multicentrickej štúdii s paralelnými skupinami sa provnával enoxaparín sodný
2 000 IU (20 mg) alebo 4 000 IU (40 mg) jedenkrát denne s.c. s placebom v prevencii DVT
u interných pacientov s ťažkým obmedzením mobility počas akútneho ochorenia (definované ako prejdená vzdialenosť <10 metrov za ≤3 dni). Táto štúdia zahŕňala pacientov so srdcovým zlyhaním (NYHA trieda III alebo IV); akútnym respiračným zlyhaním alebo komplikovanou chronicku respiračnou insuficienciou a akútnou infekciou alebo akútnou reumou; ak boli spojené aspoň s jedným VTE rizikovým faktorom (vek ≥75 rokov, rakovina, predchádzajúca VTE, obezita, varikózne vény, hormonálna liečba a chronické srdcové alebo respiračné zlyhanie).
Celkovo bolo v štúdii zaradených 1102 pacientov a 1073 pacientov bolo liečených. Liečba
pokračovala počas 6 až 14 dní (priemerné trvanie liečby 7 dní). Pri podávaní dávky 4 000 IU (40 mg)
jedenkrát denne s.c. enoxaparín sodný štatisticky významne znížil výskyt VTE v porovnaní
s placebom. Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
2 000 IU (20 mg) jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo
n (%)
enoxaparín sodný
2 000 IU (20 mg) jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo
n (%)
v
š
etci liečení interní pacienti počas akútneho ochorenia
287 (100) 291(100) 288 (100)
celkovo VTE (%) 43 (15,0) 16 (5,5)* 43 (14,9) celkovo DVT (%) 43 (15,0) 16 (5,5) 40 (13,9) proximálna DVT (%) 13 (4,5) 5 (1,7) 14 (4,9) VTE = venózne tromboembolické udalosti, ktoré zahŕňali DVT, PE a smrť z dôvodu tromboembólie
* p hodnota oproti placebu = 0,0002
Približne 3 mesiace po zaradení zostával výskyt VTE štatisticky významne nižší v skupine liečenej
enoxaparínom sodným 4 000 IU (40 mg) v porovnaní so skupinou liečenou placebom.
Výskyt krvácania celkovo bol 8,6 % a výskyt veľkého krvácania 1,1 % v skupine s placebom, 11,7 %
a 0,3 % v skupine s enoxaparínom sodným 2 000 IU (20 mg) a 12,6 % a 1,7 % v skupine s enoxaparínom sodným 4 000 IU (40 mg).
Liečba hlbokej žilovej trombózy s pľúcnou embóliou alebo bez nej
V multicentrickej štúdii s paralelnými skupinami bolo 900 pacientov s akútnou DVT dolnej končatiny s pľúcnou embóliou alebo bez nej randomizovaných na hospitalizačnú liečbu buď (i) enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát denne s.c., (ii) enoxaparínom sodným 100 IU/kg (1 mg/kg) každých 12 hodín s.c. alebo (iii) i.v. bolusom heparínu (5 000 IU), po ktorom nasledovala kontinuálna infúzia (podávaná s cieľom dosiahnuť aPTT 55 až 85 sekúnd). Celkovo bolo v štúdii randomizovaných 900 pacientov a všetci pacienti boli liečení. Všetci pacienti dostávali aj liečbu
warfarínom sodným (dávka bola upravená podľa protrombínového času s cieľom dosiahnuť INR 2,0 až 3,0) so začiatkom v priebehu 72 hodín od začatia liečby enoxaparínom sodným alebo štandardnej liečby heparínom a pokračovaním počas 90 dní. Enoxaparín sodný alebo štandardná liečba heparínom sa podávala minimálne 5 dní a dovtedy, kým sa nedosiahol cieľový INR warfarínu sodného. Obidva režimy s enoxaparínom sodným boli rovnocenné ako štandardná heparínová liečba, pokiaľ ide
o zníženie rizika rekurencie venózneho tromboembolizmu (DVT a/alebo PE). Údaje týkajúce sa
účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
15
0 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
enoxaparín sodný
10
0 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
heparín
i.v. liečba upravovaná podľa aPTT
n (%)
enoxaparín sodný
15
0 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
enoxaparín sodný
10
0 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
heparín
i.v. liečba upravovaná podľa aPTT
n (%)
v
š
etci liečení pacienti s DVT s PE alebo bez nej
298 (100) 312 (100) 290 (100)
celkovo VTE (%) 13 (4,4)* 9 (2,9)* 12 (4,1) iba DVT (%) 11 (3,7) 7 (2,2) 8 (2,8) proximálna DVT (%) 9 (3,0) 6 (1,9) 7 (2,4) PE (%) 2 (0,7) 2 (0,6) 4 (1,4) VTE = venózna tromboembolická udalosť (DVT a/alebo PE)
*interval spoľahlivosti 95 % pre rozdiely v liečbe celkovej VTE boli:
- enoxaparín sodný jedenkrát denne oproti heparínu (-3,0 až 3,5)
- enoxaparín sodný každých 12 hodín oproti heparínu (-4,2 až 1,7).
Veľké krvácanie bolo 1,7 % v skupine s enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát
denne, 1,3 % v skupine s enoxaparínom sodným 100 IU/kg (1 mg/kg) dvakrát denne a 2,1 % v skupine s heparínom.
Liečba nestabilnej angíny a infarktu myokardu bez elevácie ST
V rozsiahlej multicentrickej štúdii 3171 pacientov zaradených v akútnej faze nestabilnej anginy
pectoris alebo non-Q infarktu myokardu bolo randomizovaných do dvoch skupín tak, že pacienti
v jednej skupine dostávali spolu s kyselinou acetylsalicylovou (100 až 325 mg jedenkrát denne) buď s.c. injekciu enoxaparínu sodného v dávke 100 IU/kg (1 mg/kg) každých 12 hodín alebo i.v. nefrakcionovaný heparín upravený podľa aPTT. Pacienti museli byť hospitalizovaní minimálne 2 dni a maximálne 8 dní, až do klinickej stabilizácie, revaskularizačnej procedúry alebo prepustenia z
nemocnice. Pacienti museli byť sledovaní po dobu 30 dní. Enoxaparín sodný v porovnaní s heparínom
štatisticky významne znížil kombinovaný výskyt anginy pectoris, infarktu myokardu a smrti s poklesom 19,8 až 16,6 % (redukcia relatívneho rizika 16,2 %) v deň 14. Táto redukcia v kombinovanom výskyte pretrvávala po 30 dňoch (od 23,3 do 19,8 %; redukcia relatívneho rizika
15 %).
Pokiaľ ide o veľké krvácanie, neboli zistené žiadne rozdiely, aj keď krvácanie v mieste podania s.c.
injekcie bolo častejšie.
Liečba akútneho infarktu myokardu s eleváciou ST-segmentu
V rozsiahlej multicentrickej štúdii bolo 20 479 pacientov so STEMI vhodných na fibrinolytickú liečbu randomizovaných do dvoch skupín; v jednej skupine dostali enoxaparín sodný ako jednu bolusovú i.v. dávku 3000 IU (30 mg) plus subkutánnu injekciu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg) a následne každých 12 hodín subkutánnu injekiu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg) a v druhej skupine dostávali intravenózne nefrakcionovaný heparín upravený podľa aPTT po dobu
48 hodín. Všetci pacienti boli taktiež liečení kyselinou acetylsalicylovou po dobu minimálne 30 dní.
Stratégia dávkovania enoxaparínu bola prispôsobená pre pacientov so závažne zhoršenou funkciou obličiek a pre starších pacientov vo veku 75 a viac rokov. Subkutánne injekcie enoxaparínu sa
podávali dovtedy, kým pacient nebol prepustený z nemocnice alebo po dobu maximálne 8 dní (podľa toho, čo nastalo skôr).
4716 pacientov sa podrobilo perkutánnej koronárnej intervencii, pričom dostávali antitrombotickú
podpornú liečbu zaslepenými liekmi štúdie. Preto pre pacientov liečených enoxaparínom musela byť vykonaná PCI s enoxaparínom (žiadna zmena), pričom bol použitý režim stanovený
v predchádzajúcich štúdiách t.j. žiadne ďalšie dávkovanie, ak od posledného subkutánneho podania do
insuflácie balónu uplynulo menej ako 8 hodín; i.v. bolus 30 IU/kg (0,3 mg/kg) enoxaparínu, ak od posledného subkutánneho podania do insuflácie balónu uplynulo viac ako 8 hodín.
Enoxaparín sodný v porovnaní s nefrakcionovaným heparínom štatisticky významne znížil výskyt
primárneho endpointu - smrti z akejkoľvek príčiny alebo re-infarktu myokardu v prvých 30 dňoch po randomizácii [9,9 percenta v skupine s enoxaparínom v porovnaní s 12,0 percentami v skupine
s nefrakcionovaným heparínom] pri redukcii relatívneho rizika 17 % (p<0,001).
Benefity liečby enoxaparínom (zjavné vo viacerých ukazovateľoch účinnosti) sa objavili už za 48 hodín, kedy redukcia relatívneho rizika re-infarktu myokardu bola 35 % v porovnaní s liečbou nefrakcionovaným heparínom (p<0,001).
Benefit enoxaparínu v primárnom ukazovateli bol konzistentný v rámci kľúčových podskupín vrátane
veku, pohlavia, lokácie infarktu, anamnézy diabetu, anamnézy predchádzajúceho infarktu myokardu, typu použitého fibrinolytika a času do liečby študijným liekom.
Zistil sa štatisticky významný benefit liečby enoxaparínom v porovnaní s nefrakcionovaným heparínom u pacientov, ktorí sa podrobili perkutánnej koronárnej intervencii v priebehu 30 dní po randomizácii (23 % redukcia relatívneho rizika) alebo ktorí boli liečení konzervatívne (farmakologicky) (15 % redukcia relatívneho rizika, p = 0,27 pre interakciu).
Výskyt združeného ukazovateľa, ktorým bolo úmrtie, re-infarkt alebo intrakraniálne hemoragie na
30.deň (merané ako čistý klinický benefit) bol štatisticky významne nižší (p<0,0001) v skupine s enoxaparínom (10,1 %) v porovnaní so skupinou s heparínom (12,2 %), čo predstavuje 17 % redukciu relatívneho rizika v prínos liečby enoxaparínom sodným.
Výskyt veľkého krvácania po 30 dňoch bol štatisticky významne vyšší (p<0,0001) v skupine
s enoxaparínom sodným (2,1 %) oproti skupine s heparínom (1,4 %). Vyšší výskyt gastrointestinálneho krvácania bol v skupine s enoxaparínom sodným (0,5 %) oproti skupine s heparínom (0,1 %), zatiaľ čo výskyt intrakraniálneho krvácania bol podobný v obidvoch skupinách (0,8 % s enoxaparínom sodným oproti 0,7 % s heparínom).
Prospešný účinok enoxaparínu na primárny endpoint pozorovaný počas prvých 30 dní sa zachoval počas 12 mesiacov sledovania.
Porucha funkcie pečene
Podľa lietrárnych údajov sa používanie enoxaparínu v dávke 4 000 IU (40 mg) u pacientov s cirhózou
(Child-Pugh trieda B-C) zdá byť bezpečné a účinné v prevencii trombózy portálnej vény. Treba poznamenať, že literárne štúdie môžu mať určité obmedzenia. U pacientov s poruchou pečene je potrebná opatrnosť, pretože títo pacienti majú vyšší potenciál krvácania (pozri časť 4.4) a u pacientov s cirhózou (Child-Pugh trieda A,B, C) sa žiadne štúdie týkajúce sa formálneho stanovenia dávky neuskutočnili.
5.2 Farmakokinetické vlastnosti
Všeobecnácharakteristika
Farmakokinetické parametre enoxaparínu sodného sa sledovali najmä vo vzťahu k časovému priebehu plazmatickej anti-Xa aktivity a tiež anti-IIa aktivity v odporúčaných dávkach a to po jednorazovom a opakovanom subkutánnom podaní a po jednorazovom i.v. podaní.
Kvantitatívne hodnotenie anti-Xa a anti-IIa farmakokinetických aktivít sa robilo validovanými
amidolytickými metódami.
Absorpcia
Absolútna biologická dostupnosť enoxaparínu sodného po s.c. injekcii vychádzajúca z anti-Xa aktivity
je približne 100 %.
Môžu sa použiť rôzne dávky, formy a dávkovacie režimy.
Priemernú maximálnu plazmatickú anti-Xa aktivitu možno pozorovať 3 až 5 hodín po subkutánnej injekcii a dosahuje približne 0,2, 0,4 a 1,0 a 1,3 IU/ml po jednorazovej s.c. aplikácii 2000 IU, 4000 IU,
100 IU/kg a 150 IU/kg (20 mg, 40 mg, 1 mg/kg a 1,5 mg/kg) v uvedenom poradí.
Intravenózna bolusová dávka 3000 IU (30 mg), po ktorej bezprostredne nasleduje dávka 100 IU/kg (1 mg/kg) podaná subkutánne každých 12 hodín, poskytuje počiatočný vrchol hladiny faktoru anti- Xa 1,16 IU/ml (n=16) a priemerná expozícia zodpovedá 88 % hladiny v stabilizovanom stave. Stabilizovaný stav sa dosahuje na druhý deň liečby.
Po opakovanom subkutánnom podaní dávky 4000 IU (40 mg) raz denne a dávky 150 IU/kg
(1,5 mg/kg) raz denne zdravým dobrovoľníkom, sa dosiahne ustálený stav na 2.deň a priemerná miera expozície je asi o 15 % vyššia ako po jednorazovom podaní. Po opakovanom subkutánnom podaní dávky 100 anti-Xa IU/kg dvakrát denne sa ustálený stav dosiahne od 3. po 4.deň a má priemernú expozíciu asi o 65 % vyššiu ako po jednorazovom podaní, maximálnu priemernú hodnotu 1,2 IU/ml
a minimálnu hodnotu 0,52 IU/ml.
Injekčný objem a koncentrácia dávky v rozmedzí 100-200 mg/ml nemá vplyv na farmakokinetické parametre u zdravých dobrovoľníkov.
Farmakokinetika enoxaparínu po podaní dávok vyšších ako sú odporúčané dávky je lineárna. Premenlivosť v rámci organizmu alebo medzi viacerými pacientami je nízka. Po opakovanom s.c. podávaní sa akumulácia nezistila.
Plazmatická anti-IIa aktivita enoxaparínu je po subkutánnom podaní približne 10-krát nižšia ako anti- Xa aktivita. Priemerná maximálna anti-IIa aktivita sa pozoruje približne 3 - 4 hodiny a dosahuje po subkutánnom podaní 100 IU/kg dvakrát denne 0,13 IU/ml a po subkutánnom podaní 150 IU/kg
(1,5 mg/kg) jedenkrát denne 0,19 IU/ml.
Distribúcia
Distribučný objem anti-Xa aktivity enoxaparínu sodného je asi 4,3 litrov a je blízky krvnému objemu.
Biotransformácia
Enoxaparín sodný sa primárne metabolizuje v pečeni desulfatizáciou a/alebo depolymerizáciou na zložky s nižšou molekulovou hmotnosťou s omnoho nižšou biologickou účinnosťou.
Eliminácia
Enoxaparín sodný je liek s nízkym klírens s priemerným klírensom plazmatickej anti-Xa aktivity po
podaní dávky 150 IU/kg (1,5 mg/kg) 6-hodinovou i.v. infúziou 0,74 l/hod.
Eliminácia sa javí byť jednofázová a eliminačný polčas anti-Xa aktivity je približne 5 hodín po
jednorazovom subkutánnom podaní až približne 7 hodín po opakovanom podaní enoxaparínu sodného. Renálny klírens aktívnych fragmentov predstavuje približne 10 % podanej dávky a celková renálna exkrécia aktívnych a neaktívnych fragmentov je 40 % dávky.
Špeciálneskupinypacientov
Starší ľudia
Na základe výsledkov farmakokinetickej analýzy sa zistilo, že pokiaľ je zachovaná normálna funkcia obličiek, kinetický profil enoxaparínu sodného sa u starších osôb v porovnaní s mladšími nelíši. Avšak
je známe, že funkcia obličiek sa s vekom znižuje a teda eliminácia enoxaparínu sodného u starších pacientov môže byť znížená (pozri časti 4.2 a 4.4).
Porucha funkcie pečene
V štúdii, ktorá sa robila u pacientov s pokročilou cirhózou liečených enoxaparínom sodným 4 000 IU (40 mg) jedenkrát denne bol pokles v maxime anti-Xa aktivity spojený s vzostupom závažnosti poškodenia pečene (hodnotené podľa Child-Pugh kategórií). Tento pokles bol pripisovaný hlavne poklesu hladiny ATIII, sekundárne zníženej syntéze ATIII u pacientov s poruchou funkcie pečene.
Porucha funkcie obličiek
Medzi klírensom plazmatickej anti-Xa aktivity a klírensom kreatinínu bol v ustálenom stave pozorovaný lineárny vzťah, čo naznačuje zníženie klírensu enoxaparínu sodného u pacientov s poruchou funkcie obličiek. Po opakovanej subkutánnej dávke 4000 IU raz denne je expozícia anti-Xa aktivity, vyjadrená AUC v ustálenom stave, pri mierne (klírens kreatinínu 50-80 ml/min) a pri stredne ťažkej (klírens kreatnínu 30-50 ml/min) poruche funkcie obličiek okrajovo zvýšená. U pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu <30 ml/min) je AUC v ustálenom stave, po opakovaných subkutánnych dávkach 4000 IU raz denne, významne zvýšená (priemerne o 65 %) (pozri časti 4.2 a 4.4).
Hemodialýza
Po jednorazovom i.v. podaní enoxaparínu sodného v dávke 25 IU, 50 IU alebo 100 IU/kg (0,25, 0,50 alebo 1,0 mg/kg) bola jeho farmakokinetika podobná ako u kontrolovanej populácie, avšak AUC bola dvakrát vyššia ako u kontrolovanej populácie.
Telesná hmotnosť
Po opakovaných s.c. dávkach 150 IU/kg (1,5 mg/kg) jedenkrát denne je priemerná AUC anti-Xa aktivity v ustálenom stave u obéznych zdravých dobrovoľníkov (BMI index 30-48 kg/m2) v porovnaní s osobami s normálnou hmotnosťou okrajovo zvýšená, zatiaľ čo maximálna plazmatická hladina anti-Xa aktivity zvýšená nie je. U obéznych pacientov je po subkutánnom podaní nižší hmotnosťou ovplyvnený klírens.
Po jednorazovom subkutánnom podaní enoxaparínu sodného v dávke 4000 IU (dávka nebola upravená na základe hmotnosti pacienta) ženám (<45 kg) a mužom (<57 kg) s nízkou hmotnosťou bolo zistené, že expozícia anti-Xa aktivity je v porovnaní s osobami s normálnou hmotnosťou u žien o 52 %
a u mužov o 27 % vyššia (pozri časť 4.4).
Farmakokinetickéinterakcie
Pri súbežnom podaní enoxaparínu a trombolytika sa nepozorovali žiadne farmakokinetické interakcie.
5.3 Predklinické údaje o bezpečnosti
V 13-týždňových štúdiach toxicity, kde sa podával s.c. enoxaparín potkanom a psom v dávke
15 mg/kg/deň a v 26 týždňových štúdiach toxicity, kde sa podával enoxaparín s.c. a i.v. potkanom
a opiciam v dávke 10 mg/kg/deň sa iné nežiaduce účinky enoxaparínu okrem antikoagulačného účinku nedokázali.
Nasledujúce testy nepreukázali mutagénne účinky enoxaparínu: Amesov test in-vitro, progresívny mutačný test na bunkách myšacích lymfómov in-vitro, humánny lymfocytový test chromozomálnych aberácií in-vitro a in-vivo test chromozomálnych aberácií na kostnej dreni potkanov.
Štúdie vykonané u gravidných samíc potkanov a králikov s dávkami enoxaparínu sodného do
30 mg/kg/deň nepreukázali žiadne teratogénne účinky ani fetotoxicitu. Po s.c. podaní dávky nižšej ako
20 mg/kg/deň nemal enoxaparín vplyv na fertilitu ani na reprodukčné schopnosti potkaních samcov
a samíc.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Voda na injekciu
6.2 Inkompatibility
Subkutánnainjekcia
Inhixa sa nesmie miešať so žiadnymi inými injekciami alebo infúziou.
I
ntravenózna
injekcia
(bolus)
iba
pre
akútnu
indikáciu
STEMI.
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnostiNaplnenástriekačka3 roky
Zriedenýlieksinjekčnýmroztokomchloridusodného9 mg/ml (0,9 %)alebo5%glukózyvovode8 hodín
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25 ° C. Neuchovávajte v mrazničke.
6.5 Druh obalu a obsah balenia0,8 ml roztoku v:
- sklenenej striekačke s označenej mierkou z číreho bezfarebného neutrálneho skla typu I s pevnou ihlou a krytom ihly uzavretým chlórbutylovou gumovou zátkou a s červeným polypropylénovým piestom. Injekčné striekačky môžu byť dodatočne vybavené poistným prvkom, ktorý chráni proti pichnutiu ihlou po vykonaní injekcie; alebo
- sklenenej striekačke s označenej mierkou z číreho bezfarebného neutrálneho skla typu I
s pevnou ihlou a krytom ihly uzavretým chlórbutylovou gumovou zátkou a s bielym polykarbonátovým piestom. Injekčné striekačky môžu byť dodatočne vybavené poistným UltraSafe Passive prvkom, ktorý chráni proti pichnutiu ihlou po vykonaní injekcie.
Balenia s:
- 2, 6 a 10 naplnenými striekačkami
- 2, 6, 10, 12 a 24 naplnenými striekačkami s ochranným krytom ihly
- 2 a 10 naplnenými striekačkami s UltraSafe Passive ochranným krytom ihly
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom NÁVO D NA P O UŽÍVANIE: NAP LNENÁ INJEKČNÁ STRIEKAČK A 
Ako máte podávať injekciu Inhixa sám sebe
Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.

- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte
miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa
1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
 2)
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená
a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.

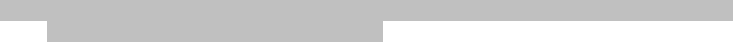 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný záhyb držíte počas celého podávania injekcie.
 8)
8) Rovným ťahom ihlu vytiahnite.
A
by st e sa vyhl i podli ati ne, mi est o vpi chu si po podaní i nj ekci e sami nem así rujt e.
9) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré

predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.Ako máte podávať injekciu Inhixa sám sebe
Naplnená injekčná striekačka môže mať priložený ochranný kryt ihly, ktorý chráni pred poranením ihlou. Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to

máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak
si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je,
použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.

- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte
miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
 2)
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená

a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .
 6)
6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného záhybu vpichnite celú dĺžku ihly.
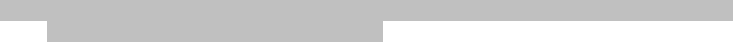 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný záhyb držíte počas celého podávania injekcie.
 8)
8) Rovným ťahom ihlu vytiahnite. Neprestávajte stláčať piest!
Aby ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.9) Stlačte silno piest striekačky. Poistný prvok ihly, ktorý má podobu plastového cylindra, sa

automaticky nasunie na ihlu a celú ju zakryje.
10) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré
predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Ako máte podávať injekciu Inhixa sám sebe
Naplnená injekčná striekačka môže mať priložený UltraSafe Passive ochranný kryt ihly, ktorý chráni pred poranením ihlou. Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.

- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.
- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej

sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
 2)
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená
a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.

 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný záhyb držíte počas celého podávania injekcie.
8) Rovným ťahom ihlu vytiahnite. Neprestávajte stláčať piest!
 A
by ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
9)
A
by ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
9) Uvoľnite piest a nechajte injekčnú striekačku vysunúť, pokiaľ nie je celá ihla chránená a kryt

nezapadne na miesto.
10) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré
predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITechdow Europe AB
Kåbovägen 32
75236 Uppsala
Švédsko
8. REGISTRAČNÉ ČÍSLOEU/1/16/1132/007
EU/1/16/1132/008
EU/1/16/1132/017
EU/1/16/1132/018
EU/1/16/1132/029
EU/1/16/1132/030
EU/1/16/1132/039
EU/1/16/1132/040
EU/1/16/1132/059
EU/1/16/1132/060
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 15/09/2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na
nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUInhixa 10 000 IU (100 mg)/1 ml injekčný roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE10 000 IU/ml (100 mg/ml) injekčný roztokKaždá naplnená injekčná striekačka obsahuje enoxaparín sodný 8 000 IU anti-Xa aktivity (čo
zodpovedá 80 mg) v 0,8 ml vody na injekciu.
Úplný zoznam pomocných látok, pozri časť 6.1
Enoxaparín sodný je biologické liečivo získané alkalickou depolymerizáciou benzylesteru heparínu derivovaného z prasacej črevnej sliznice.
3. LIEKOVÁ FORMAInjekčný roztok v naplnenej injekčnej striekačke. Číry, bezfarebný až svetložltý roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieInhixa je indikovaný u dospelých:
· Prevencia venóznej tromboembolickej choroby v chirurgii u pacientov so stredným a vysokým rizikom, najmä v ortopedickej alebo všeobecnej chirurgii vrátane onkologickej chirurgie.
· Prevencia venóznej tromboembolickej choroby u interných pacientov s akútnymi ochoreniami
(ako je akútna srdcová nedostatočnosť, respiračné zlyhanie, ťažké infekcie alebo reumatické ochorenia) a zníženou mobilitou so zvýšeným rizikom vzniku venóznej tromboembolickej choroby.
· Liečba hlbokej žilovej trombózy (DVT) a pľúcnej embolizácie (PE) okrem PE, ktorá by mohla vyžadovať trombolytickú liečbu alebo operáciu.
· Prevencia tvorby trombov v mimotelovom obehu počas dialýzy.
· Akútny koronárny syndróm:
- Liečba nestabilnej angíny a infarktu myokardu bez elevácie ST-segmentu (NSTEMI) v
kombinácii s kyselinou acetylsalicylovou, ktorá sa užíva perorálne.
- Liečba akútneho infarktu myokardu s eleváciou ST-segmentu (STEMI) vrátane pacientov, u ktorých sa plánuje konzervatívna (farmakologická) liečba alebo pacientov s následnou perkutánnou koronárnou intervenciou (PCI).
4.2 Dávkovanie a spôsob podávaniaDávkovaniePrevencia venóznej tromboembolickej choroby v chirurgii u pacientov so stredným a vysokýmrizikom
Individuálne riziko tromboembólie u pacientov možno odhadnúť pomocou validovaného modelu
stratifikácie rizika.
· U pacientov so stredným rizikom vzniku tromboembólie je odporúčaná dávka 2 000 IU (20 mg)
enoxaparínu sodného jedenkrát denne subkutánnou (s.c.) injekciou. Pri chirurgických výkonoch so stredným rizikom sa ukázalo ako účinné a bezpečné začať podávať enoxaparín sodný 2 000 IU
(20 mg) pred operáciou (2 hodiny pred operáciou).
U pacientov so stredným rizikom je potrebné pokračovať v profylaxii enoxaparínom sodným minimálne 7-10 dní bez ohľadu na to, ako sa pacient zotavuje (napr. mobilita), až kým sa pacient nezotaví z výrazne zníženej mobility.
· U pacientov s vysokým rizikom tromboembólie je odporúčaná dávka 4 000 IU (40 mg)
enoxaparínu sodného jedenkrát denne subkutánnou (s.c.) injekciou so začatím prednostne
12 hodín pred operáciou. Ak je potrebné začať profylaxiu skôr ako 12 hodín pred operáciou (napr. pacient s vysokým rizikom čakajúci na odloženú ortopedickú operáciu), posledná injekcia sa nemá podať neskôr ako 12 hodín pred operáciou a pokračovať 12 hodín po operácii.
o U pacientov podrobujúcich sa veľkej ortopedickej operácii sa odporúča predĺžiť tromboprofylaxiu až do 5 týždňov.
o U pacientov s vysokým rizikom venóznej tromboembólie (VTE) podrobujúcich sa brušnej alebo panvovej operácii kvôli nádorovému ochoreniu sa odporúča predĺžiť tromboprofylaxiu až do 4 týždňov.
Profylaxia venóznej tromboembólie u interných pacientov
Odporúčaná dávka enoxaparínu sodného je 4 000 IU (40 mg) jedenkrát denne s.c. injekciou.
Liečba enoxaparínom sodným sa predpisuje najmenej na 6 až 14 dní bez ohľadu na to, ako sa pacient zotavuje (napr. mobilita). Prínos liečby trvajúcej viac ako 14 dní sa nepotvrdil.
Liečba hlbokej žilovej trombózy (DVT) a pľúcnej embolizácie (PE)
Enoxaparín sodný sa môže podávať s.c. injekciou buď jedenkrát denne 150 IU/kg (1,5 mg/kg), alebo
dvakrát denne 100 IU/kg (1 mg/kg).
Režim musí zvoliť lekár na základe individuálneho posúdenia a vyhodnotenia rizika tromboembólie a rizika krvácania. Dávkovací režim 150 IU/kg (1,5 mg/kg) jedenkrát denne sa má použiť u nekomplikovaných pacientov s nízkym rizikom rekurencie VTE. U všetkých ostatných pacientov, ako sú pacienti s obezitou, symptomatickou PE, onkologickým ochorením, rekurentnou VTE alebo proximálnou trombózou (vena iliaca) sa má použiť dávkovací režim 100 IU/kg (1 mg/kg) dvakrát denne.
Liečba enoxaparínom sodným sa predpisuje priemerne na 10 dní. Liečbu perorálnymi antikoagulanciami treba začať, keď je to vhodné (pozri “Prechod medzi enoxaparínom sodným a perorálnymi antikoagulaciami” na konci časti 4.2).
Prevencia tvorby trombov v mimotelovom obehu počas dialýzy
Odporúčaná dávka je 100 IU/kg (1 mg/kg) enoxaparínu sodného.
U pacientov s vysokým rizikom krvácania sa má dávka znížiť na 50 IU/kg (0,5 mg/kg) pri dvojitom
cievnom prístupe alebo na 75 IU/kg (0,75 mg/kg) pri jednoduchom cievnom prístupe.
Počas dialýzy sa má enoxaparín sodný zaviesť do arteriálnej linky na začiatku dialýzy. Účinok tejto dávky je zvyčajne dostatočný pre 4-hodinovú dialýzu, ak sa však zistí prítomnosť fibrínových prstencov, napríklad pri dialýze trvajúcej dlhšie ako je bežné, môže sa podať ďalšia dávka 50 IU až
100 IU/kg (0,5 až 1 mg/kg).
Nie sú k dispozícii žiadne údaje týkajúce sa pacientov používajúcich enoxaparín sodný na profylaxiu alebo na liečbu v priebehu podávania dialýzy.
Akútny koronárny syndróm: liečba nestabilnej angíny a infarktu myokardu bez elevácie ST-segmentu
(NSTEMI) a akútneho infarktu myokardu s eleváciou ST-segmentu (STEMI)
· Na liečbu nestabilnej angíny a NSTEMI je odporúčaná dávka enoxaparínu sodného 100 IU/kg
(1 mg/kg) každých 12 hodín subkutánnou injekciou podávanou v kombinácii s antiagregačnou
liečbou. V liečbe treba pokračovať minimálne 2 dni a potom až do klinickej stabilizácie. Zvyčajná dĺžka liečby je 2 až 8 dní.
Všetkým pacientom sa odporúča podávať kyselinu acetylsalicylovú, ak nie je kontraindikovaná, so
začiatočnou perorálnou dávkou 150–300 mg (u pacientov bez predchádzajúcej liečby kyselinou acetylsalicylovou) a udržiavaciou dávkou 75–325 mg/deň, ktorá sa podáva dlhodobo bez ohľadu na stratégiu liečby.
· Na liečbu akútneho infarktu myokardu s eleváciou ST-segmentu STEMI je odporúčaná dávka enoxaparínu sodného jedna bolusová dávka 3000 IU (30 mg) podaná intravenózne (i.v.) plus dávka 100 IU/kg (1 mg/kg) podaná subkutánne (s.c.). Následne sa podáva dávka 100 IU/kg
(1 mg/kg) s.c. každých 12 hodín (s obmedzením na maximálne 10 000 IU (100 mg) na každú

z prvých dvoch dávok podaných s.c.). Súbežne sa má podávať vhodná antiagregačná liečba, ako je perorálne podávanie kyseliny acetylsalicylovej (75 mg až 325 mg jedenkrát denne), ak nie je kontraindikovaná. Odporúča sa, aby liečba enoxaparínom sodným trvala 8 dní alebo dovtedy, kým pacient neprejde do ambulantnej liečby, podľa toho, čo nastane skôr. Ak sa enoxaparín sodný podáva s trombolytikom (fibrín špecifickým alebo fibrín nešpecifickým), musí sa enoxaparín sodný podať v časovom rozmedzí 15 minút pred a 30 minút po začiatku fibrinolytickej liečby.
o Dávkovanie u pacientov vo veku ≥ 75 rokov je uvedené v časti “Starší ľudia”.
o U pacientov liečených perkutánnou koronárnou intervenciou (PCI) nie je potrebná
žiadna dodatočná dávka, ak bol enoxaparín sodný naposledy podaný subkutánne pred
menej ako ôsmimi hodinami pred insufláciou balónu. Ak bol enoxaparín sodný naposledy podaný subkutánne pred viac ako ôsmimi hodinami pred insufláciou
balónu, musí sa podať dávka 30 IU/kg (0,3 mg/kg) enoxaparínu sodného ako i.v.
bolusová dávka.
Pediatrická populáciaBezpečnosť a účinnosť enoxaparínu nebola u pediatrickej populácie stanovená.
Starší ľudiaPre všetky indikácie okrem STEMI u starších pacientov nie je potrebná úprava dávky, s výnimkou prípadov s poruchou funkcie obličiek (pozri časti “Porucha funkcie obličiek” a časť 4.4).
Na liečbu akútneho STEMI u pacientov vo veku 75 a viac rokov, sa počiatočná intravenózna
bolusová dávka nesmie použiť. Začnite dávkovanie subkutánnou dávkou 75 IU/kg (0,75 mg/kg)
každých 12 hodín (s obmedzením na maximum 7 500 IU (75 mg) len pre každú z prvých dvoch dávok podaných subkutánne, potom pre zostávajúce ďalšie dávky je odporúčané dávkovanie 75 IU/kg
(0,75 mg/kg) subkutánne). Dávkovanie u starších pacientov s poruchou funkcie obličiek je uvedené
nižšie v časti “Porucha funkcie obličiek” a v časti 4.4.
Porucha funkcie pečeneU pacientov s poruchou funkcie pečene sú k dispozícii len obmedzené údaje (pozri časti 5.1 a 5.2) a
treba u nich postupovať s opatrnosťou (pozri časť 4.4).
Porucha funkcie obličiek (pozri časti 4.4 a 5.2)· Závažná porucha funkcie obličiek
Enoxaparín sodný sa neodporúča u pacientov v terminálnom štádiu ochorenia obličiek (klírens kreatinínu <15 ml/min) pre nedostatok údajov v tejto populácii, okrem prevencie tvorby trombov v mimotelovom obehu počas hemodialýzy.
Tabuľka s dávkovaním pre pacientov so závažnou poruchou funkcie obličiek (klírens kreatinínu [15-
30] ml/min):
Indikácia Dávkovanie
Prevencia venóznej tromboembolickej choroby 2 000 IU (20 mg) s.c. jedenkrát denne
Liečba DVT a PE 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. jedenkrát

denne
Liečba angíny a NSTEMI 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. jedenkrát

denne
Liečba akútneho STEMI (pacienti vo veku do
75 rokov)
Liečba akútneho STEMI (pacienti vo veku nad
75 rokov)
1 x 3 000 IU (30 mg) IV bolus plus 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. a potom 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. každých 24 hodín
Bez i.v. úvodného bolusu, 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. a potom 100 IU/kg (1 mg/kg) telesnej hmotnosti s.c. každých 24 hodín
Úprava odporúčaného dávkovania sa nevzťahuje na indikáciu týkajúcu sa hemodialýzy.
· Stredne ťažká a mierna porucha funkcie obličiek
Aj keď pacientom so stredne ťažkou (klírens kreatinínu 30-50 ml/min) alebo miernou (klírens
kreatinínu 50-80 ml/min) poruchou funkcie obličiek nie je nutné dávku upravovať, odporúča sa dôsledné klinické sledovanie.
Spôsobpodávania
Inhixa sa nemá podávať intramuskulárne.
Na profylaxiu venóznej tromboembolickej choroby po chirurgickom zákroku, na liečbu DVT a PE, na liečbu nestabilnej angíny a NSTEMI sa enoxaparín sodný má podávať s.c. injekciou.
· Pri akútnom STEMI sa liečba začína jednou i.v. bolusovou injekciou, po ktorej ihneď nasleduje
s.c. injekcia.
· Na prevenciu tvorby trombov v mimotelovom obehu počas dialýzy sa podáva do arteriálnej linky dialyzačného obvodu.
Naplnená injekčná striekačka je pripravená na okamžité použitie.
Pri používaní ampuliek alebo viacdávkových injekčných liekoviek sa odporúča použiť tuberkulínovú injekčnú striekačku alebo ekvivalent, aby sa tým zabezpečilo, že bude do injekčnej striekačky natiahnutý správny objem lieku.
· s.c. injekčná technika:
Injekcia enoxaparínu sodného sa má podávať pacientovi prednostne v ležiacej polohe hlbokou s.c.
injekciou.
Ak používate naplnenú injekčnú striekačku, pred podaním injekcie z nej neodstrekujte vzduchovú bublinu, aby sa zabránilo stratám lieku. Ak je potrebné upraviť množstvo lieku, ktoré sa má podať, podľa telesnej hmotnosti pacienta, použite na dosiahnutie požadovaného množstva kalibrovanú injekčnú striekačku a prebytočné množstvo zlikvidujte. Uvedomte si, že v niektorých prípadoch nie je možné dosiahnuť presnú dávku kvôli kalibrácii (dielikom) na injekčnej striekačke, vtedy treba objem zaokrúhliť na najbližšiu hodnotu (najbližší dielik).
Injekcia sa má podávať do ľavej a pravej anterolaterálnej alebo posterolaterálnej časti brušnej steny.
Celá dĺžka ihly sa zavedie kolmo do kožného záhybu vytvoreného medzi palcom a ukazovákom. Kožný záhyb sa nemá uvoľniť dovtedy, kým injekcia nie je podaná celá. Po podaní injekcie miesto podania nemasírujte.
Poznámka pre naplnené injekčné striekačky s automatickým bezpečnostným systémom: bezpečnostný
systém sa aktivuje na konci injekcie (pozri pokyny v časti 6.6).
Ak si bude pacient podávať subkutánnu injekciu sám, pacienta treba upozorniť, aby si veľmi pozorne prečítal pokyny v písomnej informácii pre používateľa, ktorá je súčasťou balenia lieku.
i.v. (bolus) injekcia (len pre indikáciu STEMI):
Pri akútnom STEMI sa liečba začína jednou i.v. bolusovou injekciou, za ktorou ihneď nasleduje s.c.
injekcia.
Pri i.v. injekcii sa môže použiť buď viacdávková injekčná liekovka alebo naplnená injekčná striekačka.
Enoxaparín sodný sa má podať do i.v. linky. Nemá sa miešať ani podávať spolu s inými liekmi. Na zabránenie možnosti zmiešania enoxaparínu sodného s inými liekmi sa musí vybraný intravenózny prístup pred a aj po intravenóznej aplikácii enoxaparínu sodného premyť dostatočným množstvom soľného roztoku alebo roztoku dextrózy na vyčistenie prístupu pre liek. Enoxaparín sodný sa môže bezpečne podať spolu s normálnym roztokom chloridu sodného (soľný roztok) (0,9 %) alebo s 5 %- ným vodným roztokom dextrózy.
oÚvodný bolus 3 000 IU (30 mg)
Pomocou kalibrovanej naplnenej injekčnej striekačky odstreknite nadbytočný objem tak, aby injekčná
striekačka obsahovala len 3000 IU (30 mg, 0,3 ml) enoxaparínu sodného. Dávka 3000 IU (30 mg) sa
potom podáva priamo do intravenóznej linky.
oDodatočný bolus pri PCI v prípade, že sa posledné s.c. podanie uskutočnilo pred viac ako
8 hodinami pred insufláciou balónu
Pre pacientov liečených PCI sa má podať dodatočný i.v. bolus 30 IU/kg (0,3 mg/kg) a to vtedy, keď bol enoxaparín sodný naposledy podaný subkutánne pred viac ako 8 hodinami pred insufláciou balónu.
Na zabezpečenie presného odmerania malého objemu injekcie sa odporúča nariediť liek na 300 IU/ml (3 mg/ml). Na dosiahnutie koncentrácie 300 IU/ml (3 mg/ml) s použitím naplnených injekčných striekačiek obsahujúcich 6000 IU (60 mg) enoxaparínu sodného sa odporúča použiť infúzny vak
s objemom 50 ml (napr. použiť fyziologický roztok (0,9 %) alebo 5 %-ný vodný roztok dextrózy)
nasledujúcim spôsobom:
Injekčnou striekačkou odoberte z infúzneho vaku 30 ml roztoku a tento odobraný roztok odstráňte. Celý obsah naplnenej injekčnej striekačky obsahujúcej 6000 IU (60 mg) enoxaparínu sodného vstreknite do vaku k zostávajúcim 20 ml roztoku. Obsah vaku jemne premiešajte. Naberte požadovaný objem nariedeného roztoku do injekčnej striekačky určenej na podanie roztoku do intravenóznej linky.
Po ukončení riedenia sa dá vypočítať potrebný objem, ktorý je potrebný na podanie v injekcii, pomocou tohto vzorca: [objem nariedeného roztoku (ml) = hmotnosť pacienta (kg) x 0,1] alebo podľa nižšie uvedenej tabuľky. Riedenie roztoku sa odporúča robiť bezprostredne pred použitím.
Objem roztoku, ktorý má byť po nariedení podaný do i.v. linky v koncentrácii 300 IU (3 mg) /ml.
h
m
o
t
nosť požadovaná dávka
3
0 IU/kg (0,3 mg/kg)
o
bjem, ktorý má byť
podaný po nariedení na konečnú koncentráciu
30
0 IU (3 mg) / ml
[
k
g
] IU [mg] [ml]
45 1350 13,5 4,5
50 1500 15 5
55 1650 16,5 5,5
60 1800 18 6
65 1950 19,5 6,5
70 2100 21 7
75 2250 22,5 7,5
80 2400 24 8
85 2550 25.5 8.5
90 2700 27 9
95 2850 28,5 9,5
100 3000 30 10
105 3150 31,5 10,5
110 3300 33 11
115 3450 34.5 11.5
120 3600 36 12
125 3750 37,5 12,5
130 3900 39 13
135 4050 40,5 13,5
140 4200 42 14
145 4350 43,5 14,5
150 4500 45 15
· Injekcia do arteriálnej linky:
Podáva sa do arteriálnej linky dialyzačného obvodu na prevenciu tvorby trombov v mimotelovom
obehu počas hemodialýzy.
Prechodmedzienoxaparínomsodnýmaantikoagulanciami
· Prechod medzi enoxaparínom sodným a antagonistami vitamínu K (VKA)
Je nutné zintenzívniť klinické monitorovanie a laboratórne testy [protrombínový čas vyjadrený ako
International Normalized Ratio (INR)] s cieľom sledovať účinok VKA.
Nakoľko je tu časový interval, kým VKA dosiahne svoj maximálny účinok, liečba enoxaparínom sodným musí pokračovať v konštantnej dávke tak dlho, ako je to nutné na udržanie INR
v požadovanom terapeutickom rozsahu v danej indikácii v dvoch po sebe nasledujúcich testoch. U pacientov liečených VKA je potrebné liečbu VKA ukončiť a prvú dávku enoxaparínu sodného podať vtedy, keď INR poklesne pod terapeutický rozsah.
· Prechod medzi enoxaparínom sodným a priamymi perorálnymi antikoagulanciami (DOAC) U pacientov, ktorí dostávajú v súčasnosti enoxaparín sodný, je potrebné ukončiť túto liečbu a začať s užívaním DOAC od 0 do 2 hodín pred časom určeným pôvodne na podanie ďalšej dávky enoxaparínu sodného, dávkovanie DOAC sa má použiť tak, ako je uvedené v jeho SPC.
U pacientov, ktorí užívajú v súčasnosti DOAC, sa má prvá dávka enoxaparínu sodného podať v čase,
kedy sa pôvodne mala užiť ďalšia dávka DOAC.
Podanieprispinálnej/epidurálnejanestéziialebolumbálnejpunkcii
Ak sa lekár rozhodne podať antikoagulačnú liečbu v súvislosti s epidurálnou alebo spinálnou anestéziou/analgéziou alebo lumbálnou punkciou, odporúča sa dôsledné neurologické monitorovanie kvôli riziku neuraxiálnych hematómov (pozri časť 4.4).
- Pri dávkach používaných na prevenciu
Medzi poslednou injekciou enoxaparínu sodného pri profylaktických dávkach a zavedením ihly alebo katétra sa musí zachovať časový interval bez punkcie najmenej 12 hodín.
Pri kontinuálnych technikách sa má zachovať podobný posun najmenej 12 hodín pred odstránením katétra.
Pre pacientov s klírensom kreatinínu [15-30] ml/min treba uvažovať so zdvojnásobením časového intervalu punkcia/zavedenie katétra alebo odstránenie katétra na najmenej 24 hodín. Začatie liečby enoxaparínom sodným v dávke 2 000 IU (20 mg) 2 hodiny pred operáciou nie je kompatibilné s neuraxiálnou anestéziou.
- Pri dávkach používaných na liečbu
Medzi poslednou injekciou enoxaparínu sodného pri kuratívnych dávkach a zavedením ihly alebo katétra sa musí zachovať časový interval bez punkcie najmenej 24 hodín (pozri aj časť
4.3).
Pri kontinuálnych technikách sa má zachovať podobný posun najmenej 24 hodín pred odstránením katétra.
Pre pacientov s klírensom kreatinínu [15-30] ml/min treba uvažovať so zdvojnásobením časového intervalu punkcia/zavedenie katétra alebo odstránenie katétra na najmenej 48 hodín. Pacienti dostávajúci dávky dvakrát denne (t.j. 75 IU/kg (0,75 mg/kg) dvakrát denne alebo
100 IU/kg (1 mg/kg) dvakrát denne) majú vynechaťdruhú dávku enoxaparínu kvôli umožneniu dostatočného časového posunu pre zavedenie alebo odstránenie katétra.
Hladina anti-Xa je v týchto časových bodoch stále ešte detekovateľná a toto posunutie negarantuje, že
sa zabráni vytvoreniu neuraxiálneho hematómu.
Rovnako treba zvážiť posunutie času podania enoxaparínu sodného o najmenej 4 hodiny po spinálnej/epidurálnej punkcii alebo po odstránení katétra. Tento časový posun musí vychádať
z vyhodnotenia pomeru prínos - riziko berúc do úvahy aj riziko trombózy aj riziko krvácania
v kontexte liečby a rizikových faktorov konkrétneho pacienta.
4.3 Kontraindikácie
Enoxaparín sodný je kontraindikovaný u pacientov:
· s precitlivenosťou na enoxaparín sodný, heparín alebo jeho deriváty vrátane iných nízkomolekulových heparínov (LMWH) alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1;
· s anamnézou heparínom indukovanej trombocytopénie (HIT) sprostredkovanej imunitou za posledných 100 dní alebo s prítomnosťou cirkulujúcich protilátok (pozri aj časť 4.4);
· s aktívnym klinicky signifikantným krvácaním a stavmi s vysokým rizikom krvácania, vrátane nedávnej mozgovej príhody s krvácaním, so žalúdočnočrevným vredom, s prítomnosťou
malígnej neoplazmy s vysokým rizikom krvácania, nedávnou operáciou mozgu, chrbtice alebo oka, so známymi alebo suspektnými varixami ezofágu, s arteriovenóznymi malformáciami,
s vaskulárnou aneuryzmou alebo s veľkými intraspinálnymi alebo intracerebrálnymi vaskulárnymi abnormalitami;
· pri spinálnej alebo epidurálnej anestézii alebo lokálno-regionálnej anestézii, ak sa enoxaparín sodný použil v predchádzajúcich 24 hodinách (pozri časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
· Všeobecné
Enoxaparín sodný nemožno zamieňať (jednotku za jednotku) s inými nízkomolekulovými heparínmi (LMWHs). Tieto lieky sa líšia svojím výrobným postupom, molekulovou hmotnosťou, špecifickou anti-Xa a anti-IIa aktivitou, jednotkami, dávkovaním a klinickou účinnosťou a bezpečnosťou. Následkom toho majú rozdielnu farmakokinetiku a biologickú aktivitu (napr. antitrombínovú aktivitu a interakciu s krvnými doštičkami). Preto treba venovať osobitnú pozornosť špecifickým pokynom na používanie pre každý z týchto liekov a dodržiavať ich.
· Anamnéza HIT (>100 dní)
Používanie enoxaparínu sodného u pacientov s anamnézou imunitne sprostredkovanej HIT za posledných 100 dní alebo pri prítomnosti cirkulujúcich protilátok je kontraindikované (pozri časť 4.3). Cirkulujúce protilátky môžu pretrvávať niekoľko rokov.
U pacientov s anamnézou (>100 dní) heparínom indukovanej trombocytopénie bez prítomnosti
cirkulujúcich protilátok sa má enoxaparín sodný používať s mimoriadnou opatrnosťou. V takomto prípade možno urobiť rozhodnutie o použití enoxaparínu sodného len po starostlivom vyhodnotení pomeru prínos-riziko a po zvážení možnosti neheparínovej alternatívnej liečby (napr. danaparoid sodný alebo lepirudín).
· Monitorovanie počtu krvných doštičiek
Pri nízkomolekulových heparínoch existuje aj riziko vzniku heparínom indukovanej trombocytopénie sprostredkovanej protilátkami. Ak sa vyskytne trombocytopénia, zvyčajne sa objaví medzi 5. až
21.dňom od začiatku liečby enoxaparínom.
Riziko HIT je vyššie u pacientov po operácii a najmä po operácii srdca a u onkologických pacientov. Preto sa odporúča zmerať počet krvných doštičiek na začiatku liečby enoxaparínom sodným a potom merať pravidelne počas liečby.
Ak existujú klinické príznaky pripomínajúce HIT (nová epizóda arteriálneho a/alebo venózneho
tromboembolizmu, bolestivé kožné lézie v mieste injekcie, alergické alebo anafylaktoidné reakcie na liečbu), je potrebné zmerať počet krvných doštičiek. Pacienti musia byť upovedomení, že takéto príznaky sa môžu objaviť a ak sa to stane, musia informovať svojho lekára.
V praxi, ak sa potvrdí signifikantný pokles počtu krvných doštičiek (30 až 50 % z východiskovej hodnoty), liečba enoxaparínom sodným sa musí okamžite ukončiť a pacient musí prejsť na inú alternatívnu neheparínovú antikoagulačnú liečbu.
· Krvácanie
Rovnako ako pri iných antikoagulanciách, môže sa vyskytnúť v ktoromkoľvek mieste krvácanie.
Ak sa vyskytne, je nutné vyšetriť pôvod krvácania a začať vhodnú liečbu.
Rovnako ako pri inej antikoagulačnej liečbe, enoxaparín sodný sa má použiť s opatrnosťou v stavoch so zvýšeným potenciálom pre krvácanie, ako je napríklad:
· porucha hemostázy,
· peptický vred v anamnéze,
· nedávno prekonaná ischemická mozgová príhoda,
· ťažká arteriálna hypertenzia,
· nedávna diabetická retinopatia,
· neurologický alebo oftalmologický chirurgický výkon,
· súbežné podávanie liekov ovplyvňujúcich hemostázu (pozri časť 4.5).
· Laboratórne vyšetrenia
Enoxaparín sodný podávaný v dávkach za účelom profylaxie venóznej tromboembólie významne neovplyvňuje dobu krvácania a celkové koagulačné testy, nemá vplyv na agregáciu krvných doštičiek alebo na väzbu fibrinogénu na krvné doštičky.
Pri vyšších dávkach enoxaparínu sa môže zvýšiť aktivovaný parciálny tromboplastínový čas (aPTT) a
aktivovaný čas koagulácie (ACT). Predĺženia aPTT a ACT a zvýšený antitrombotický účinok enoxaparínu sodného nie sú v lineárnom vzťahu, a preto tieto hodnoty nie sú pre sledovanie účinku enoxaparínu sodného vhodné ani spoľahlivé.
· Spinálna/Epidurálna anestézia alebo lumbálna punkcia
Spinálna/epidurálna anestézia alebo lumbálna punkcia sa nesmie robiť v priebehu 24 hodín od podania
enoxaparínu sodného v terapeutických dávkach (pozri tiež časť4.3).
Pri súbežnom použití enoxaparínu a spinálnej / epidurálnej anestézie alebo spinálnej punkcii boli hlásené prípady neuraxiálnych hematómov, ktoré mali za následok dlhodobú alebo trvalú paralýzu. Pri
dávkovacom režime 4000 IU (40 mg) jedenkrát denne a nižšom sú tieto prípady zriedkavé. Riziko je
vyššie pri vyšších dávkovacích režimoch enoxaparínu sodného, pri použití pooperačných epidurálnych
katétrov, pri súbežnom užívaní ďalších liekov ovplyvňujúcich hemostázu ako sú nesteroidné protizápalové lieky (NSAID), pri traumatickej alebo opakovanej epidurálnej alebo spinálnej punkcii alebo u pacientov s operáciou chrbtice v anamnéze alebo deformáciou chrbtice v anamnéze.
Pri súbežnom použití enoxaparínu a epidurálnej alebo spinálnej anestézie / analgézie alebo spinálnej punkcii je potrebné na zníženie rizika vzniku krvácania vziať do úvahy farmakokinetický profil enoxaparínu sodného (pozri časť 5.2). Zavedenie alebo odstraňovanie epidurálneho katétra alebo lumbálnej punkcie je najlepšie robiť vtedy, keď je antikoagulačný účinok enoxaparínu nízky; avšak presný čas, kedy sa dosiahne dostatočne nízky antikoagulačný účinok u konkrétneho pacienta, nie je známy. U pacientov s klírensom kreatinínu [15 -30 ml/minúta] je potrebné zvažovať aj ďalšie okolnosti, pretože eliminácia enoxaparínu trvá dlhšie (pozri časť 4.2).
Ak sa lekár rozhodne podať antikoagulačnú liečbu v súvislosti s epidurálnou alebo spinálnou anestéziou/analgéziou alebo lumbálnou punkciou, je potrebné často monitorovať akékoľvek prejavy a príznaky neurologického poškodenia, ako je bolesť pozdĺž chrbtice, zmyslové a motorické ťažkosti (necitlivosť alebo slabosť dolných končatín), poruchy činnosti hrubého čreva a/alebo močového mechúra. Pacienta je potrebné poučiť, že má ihneď informovať lekára, ak spozoruje niektorý z vyššie uvedených prejavov alebo príznakov. Pri podozrení na prejavy alebo príznaky spinálneho hematómu
je potrebná urgentná diagnostika a okamžitá liečba, vrátane zváženia dekompresie miechy, aj keď táto liečba nemusí zabrániť alebo zvrátiť neurologické následky.
· Nekróza kože / kožná vaskulitída
Pri LMWH bola hlásená nekróza kože a kožná vaskulitída, v takých prípadoch treba okamžite liečbu ukončiť.
· Perkutánne koronárne revaskularizačné výkony
Aby sa minimalizovalo riziko krvácania pri cievnych inštrumentálnych výkonoch uskutočňovaných počas liečby nestabilnej angíny pectoris, NSTEMI a akútneho STEMI, dôsledne dodržiavajte intervaly
odporúčané medzi dávkami enoxaparínu sodného. Je to dôležité preto, aby sa dosiahla hemostáza v mieste punkcie po PCI. V prípade, že sa použije uzatváracia pomôcka, púzdro cievneho vodiča (sheat) možno odstrániť okamžite. Ak sa použije metóda manuálnej kompresie, púzdro cievneho
vodiča (sheat) sa má odstrániť po 6 hodinách po poslednej i.v./s.c. injekcii enoxaparínu sodného. Ak má liečba enoxaparínom sodným pokračovať, ďalšia plánovaná dávka enoxaparínu sa má podať
najskôr 6-8 hodín po odstránení puzdra. Má sa sledovať, či sa v mieste výkonu nevyskytnú príznaky krvácania alebo hematóm.
· Akútna infekčná endokarditída
U pacientov s akútnou infekčnou endokarditídou sa používanie heparínu obvykle neodporúča kvôli
riziku krvácania do mozgu. Ak sa jeho použitie považuje za absolútne nebyhnutné, rozhodnutie treba urobiť len po starostlivom individuálnom posúdení pomeru prínos-riziko.
· Umelá mechanická srdcová chlopňa
Používanie enoxaparínu sodného u pacientov s umelou mechanickou srdcovou chlopňou za účelom
tromboprofylaxie nebolo dostatočne preskúmané. U pacientov s umelou mechanickou srdcovou chlopňou, ktorým bol podávaný enoxaparín za účelom tromboprofylaxie, sa zaznamenali ojedinelé prípady trombózy umelej srdcovej chlopne. Nejasné okolnosti, vrátane základného ochorenia
a nedostatočných klinických údajov, obmedzujú zhodnotenie týchto prípadov. Niektoré z týchto prípadov boli gravidné ženy, u ktorých trombóza spôsobila smrť matky a plodu.
· Gravidné ženy s umelou mechanickou srdcovou chlopňou
Používanie enoxaparínu sodného u gravidných žien s umelou mechanickou srdcovou chlopňou
za účelom tromboprofylaxie nebolo dostatočne preskúmané. V klinickej štúdii s gravidnými ženami s umelou mechanickou srdcovou chlopňou, kde sa podával enoxaparín v dávke 100 IU/kg (1 mg/kg) dvakrát denne za účelom zníženia rizika tromboembólie, došlo u 2 z 8 žien k tvorbe krvných zrazenín, ktoré zablokovali chlopňu a spôsobili smrť matky a plodu. Po uvedení lieku na trh sa u gravidných
žien s umelou mechanickou srdcovou chlopňou, ktorým sa podával profylakticky enoxaparín,
zaznamenali ojedinelé prípady chlopňovej trombózy. Gravidné ženy s umelou mechanickou srdcovou
chlopňou môžu byť vystavené vyššiemu riziku tromboembólie.
· Starší ľudia
Pri podávaní profylaktických dávok enoxaparínu starším pacientom sa nepozorovala zvýšená
tendencia ku krvácaniu.
Starší pacienti (hlavne 80-roční a starší) môžu byť pri podávaní terapeutických dávok enoxaparínu vystavení vyššiemu riziku komplikácií s krvácaním. Odporúča sa preto starostlivé klinické sledovanie a u pacientov starších ako 75 rokov liečených na STEMI možno zvážiť zníženie dávky (pozri časti 4.2 a 5.2).
· Porucha funkcie obličiek
Pacienti s poruchou funkcie obličiek sú vystavení vyššiemu účinku enoxaparínu sodného, čím sa zvyšuje riziko krvácania. U týchto pacientov sa odporúča starostlivé klinické monitorovanie a možno zvážiť aj biologické monitorovanie meraním anti-Xa aktivity(pozri časti 4.2 a 5.2).
Enoxaparín sodný sa neodporúča u pacientov v terminálnom štádiu ochorenia obličiek (klírens
kreatinínu <15 ml/min) pre nedostatok údajov v tejto populácii okrem prevencie tvorby trombov
v mimotelovom obehu počas dialýzy.
Pacienti so závažnou poruchou funkcie obličiek (klírens kreatinínu 15-30 ml/min ) sú vystavení výrazne vyššiemu účinku enoxaparínu sodného, preto sa odporúča úprava terapeutických
a profylaktických dávkovacích režimov (pozri časť 4.2).
Pacientom so stredne ťažkou (klírens kreatinínu 30-50 ml/min) a miernou (klírens kreatinínu 50-
80 ml/min) poruchou funkcie obličiek nie je nutné upraviť dávku.
· Porucha funkcie pečene
U pacientov s poruchou funkcie pečene je potrebná opatrnosť pri používaní enoxaparínu sodného
kvôli zvýšenému potenciálu krvácania. Úprava dávky na základe monitorovania hladiny anti-Xa nie je
spoľahlivá u pacientov s cirhózou pečene a neodporúča sa (pozri časť 5.2).
· Nízka hmotnosť
Pacienti s nízkou hmotnosťou (ženy < 45 kg, muži < 57 kg) sú pri podávaní profylaktických dávok enoxaparínu sodného (neupravených podľa hmotnosti pacienta) vystavení vyššiemu účinku lieku, čo
môže viesť k vyššiemu riziku krvácania. Preto sa odporúča starostlivé klinické sledovanie takýchto pacientov (pozri časť 5.2).
· Obézni pacienti
Obézni pacienti majú vyššie riziko trombembolizmu. Bezpečnosť a účinnosť profylaktických dávok
u obéznych pacientov (BMI >30 kg/m2) nebola úplne stanovená a neexistuje konsenzus, pokiaľ ide
o úpravu dávok. U týchto pacientov je potrebné starostlivo sledovať prejavy a príznaky
tromboembolizmu.
· Hyperkaliémia
Heparíny môžu potláčať sekréciu aldosterónu v nadobličkách, čo spôsobuje hyperkaliémiu (pozri časť
4.8), najmä u pacientov s diabetom mellitus, chronickým zlyhaním obličiek, preexistujúcou
metabolickou acidózou, pacientov užívajúcich lieky, o ktorých je známe, že zvyšujú hladinu draslíka (pozri časť 4.5). Je potrebné pravidelne monitorovať plazmatické hladiny draslíka, najmä u rizikových pacientov.
· Sledovateľnosť lieku
Nízkomolekulové heparíny (LMWHs) sú biologické liečivá. Zdravotníckym pracovníkom sa odporúča zaznamenať obchodný názov a číslo šarže podaného lieku do zdravotného záznamu pacienta s cieľom zlepšiť sledovateľnosť LMWH.
4.5 Liekové a iné interakcie
Súbežnépoužívaniesaneodporúča:
· Lieky ovplyvňujúce hemostázu (pozri časť 4.4)
Pred začiatkom terapie enoxaparínom sa odporúča prerušiť liečbu niektorými liekmi ovplyvňujúcimi hemostázu, pokiaľ nie sú striktne indikované. Ak je kombinované používanie indikované, je potrebné pri používaní enoxaparínu sodného starostlivé príslušné klinické a laboratórne monitorovanie. K takýmto liekom patria:
- systémové salicyláty, kyselina acetylsalicylová a nesteroidné antiflogistiká (NSAID)
vrátane ketorolaku,
- iné trombolytiká (napr. altepláza, retepláza, streptokináza, tenektepláza, urokináza) a antikoagulanciá (pozri časť 4.2).
Súbežnépoužívaniesaodporúčasopatrnosťou:
Tieto lieky je možné podávať súbežne s enoxaparínom sodným s opatrnosťou:
· Iné lieky ovplyvňujúce hemostázu, ako sú:
- inhibítory zhlukovania krvných doštičiek vrátane kyseliny acetylsalicylovej používanej ako antiagregačný liek (v dávke na kardioprotekciu), klopidogrel, tiklopidín a antagonisty
glykoproteínu IIb/IIIa indikované pri akútnom koronárnom syndróme, kvôli riziku
krvácania,
- dextran 40,
- systémové glukokortikoidy.
· Lieky zvyšujúce hladinu draslíka:
Lieky zvyšujúce sérovú hladinu draslíka sa môžu podávať súbežne s enoxaparínom sodným pri starostlivom klinickom a laboratórnom monitorovaní (pozri časti 4.4 a 4.8).
4.6 Fertilita, gravidita a laktácia
Gravidita
U ľudí nie sú žiadne dôkazy o prechode enoxaparínu placentárnou bariérou v druhom a treťom
trimestri gravidity. O prvom trimestri nie sú k dispozícii žiadne informácie.
Štúdie na zvieratách nepreukázali žiadne známky fetálnej toxicity alebo teratogenity (pozri časť 5.3). Na údajoch o zvieratách sa preukázalo, že prechod enoxaparínu cez placentu je minimálny. Enoxaparín možno používať počas gravidity len ak lekár potvrdí jednoznačnú potrebu jeho použitia.
Ženy, ktoré dostávajú enoxaparín sodný počas gravidity, treba starostlivo monitorovať, pokiaľ ide o prejavy krvácania alebo výraznej antikoagulácie a upozorniť ich na riziko krvácania. Podľa celkových údajov u tehotných žien neexistuje dôkaz zvýšeného rizika krvácania, trombocytopénie alebo osteoporózy v porovnaní s rizikom pozorovaným u žien, ktoré nie sú gravidné, okrem rizika, ktoré sa pozorovalo u tehotných žien s umelou srdcovou chlopňou (pozri časť 4.4).
Ak sa plánuje epidurálna anestézia, odporúča sa predtým ukončiť liečbu enoxaparínom sodným (pozri časť 4.4).
Dojčenie
Nie je známe, či sa nezmenený enoxaparín vylučuje do ľudského materského mlieka. U dojčiacich potkanov je prechod enoxaparínu alebo jeho metabolitov do mlieka veľmi nízky. Perorálna absorpcia
enoxaparínu je nepravdepodobná. Inhixa sa môže používať počas dojčenia.
Fertilita
Nie sú žiadne klinické údaje súvisiace s enoxaparínom sodným týkajúce sa fertility. Štúdie na zvieratách nepreukázali žiadny vplyv na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Enoxaparín sodný nemá žiadny alebo má len zanedbateľný vplyv na schopnosť riadiť motorové
vozidlo a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn
bezpečnostného
profilu
Enoxaparín sa vyhodnocoval u viac ako 15 000 pacientov, ktorí dostávali enoxaparín v klinickom skúšaní. Z toho 1776 pacientov s rizikom tromboembolických komplikácií dostávalo enoxaparín ako prevenciu hlbokej žilovej trombózy po ortopedickej alebo abdominálnej operácii, 1169 pacientov
s akútnym interným ochorením s ťažkým obmedzením mobility dostávalo enoxaparín ako prevenciu hlbokej žilovej trombózy, 559 pacientov s pľúcnou embóliou alebo bez nej dostávalo enoxaparín na liečbu hlbokej žilovej trombózy, 1578 pacientov na liečbu nestabilnej angíny a non-Q-infarktu myokardu a 10 176 pacientov na liečbu akútneho STEMI.
Režim podávania enoxaparínu sodného v klinickom skúšaní sa menil v závislosti od indikácií. Pri prevencii hlbokej žilovej trombózy po operácii alebo u pacientov s akútnym interným ochorením
s ťažkým obmedzením mobility bola dávka enoxaparínu sodného 4 000 IU (40 mg) subkutánne
jedenkrát denne. Pri liečbe hlbokej žilovej trombózy (DVT) s pľúcnou embóliou (PE) alebo bez nej dostávali pacienti dávku buď 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín alebo dávku
150 IU/kg (1,5 mg/kg) subkutánne jedenkrát denne. V klinických štúdiách na liečbu nestabilnej angíny
a non-Q-infarktu myokardu boli dávky 100 IU/kg (1 mg/kg) subkutánne každých 12 hodín
a v klinickej štúdii na liečbu akútneho STEMI sa podával enoxaparín sodný v dávke 3 000 IU (30 mg)
intravenózne ako bolus a potom nasledovala dávka 100 IU/kg (1 mg/kg) subkutánne každých
12 hodín.
V klinických štúdiách boli najčastejšími hlásenými reakciami krvácanie, trombocytopénia a trombóza
(pozri časť 4.4 a 'Opis vybraných nežiaducich reakcií' nižšie).
Zoznam nežiaducich reakcií v tabuľkovom formáte
Ďalšie nežiaduce reakcie, ktoré sa pozorovali v klinických štúdiách a ktoré boli hlásené po uvedení
lieku na trh (* znamená reakcie zo skúseností po uvedení lieku na trh) sú podrobnejšie uvedené nižšie. Frekvencie výskytu sú definované takto: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) alebo neznáme (z dostupných údajov). V rámci každej triedy orgánového systému sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Poruchy krvi a lymfatického systému
· časté: krvácanie, hemoragická anémia*, trombocytopénia, trombocytóza
· zriedkavé: eozinofília*
· zriedkavé: prípady imunoalergickej trombocytopénie s trombózou, u niektorých bola trombóza komplikovaná orgánovým infarktom alebo ischémiou končatiny (pozri časť 4.4).
Poruchy imunitného systému
· časté: alergická reakcia
· zriedkavé: anafylaktické/anafylaktoidné reakcie vrátane šoku*
Poruchy nervového systému
· časté: bolesť hlavy*
Poruchy ciev
· zriedkavé: spinálny hematóm* (alebo neuraxiálny hematóm). Tieto reakcie majú za následok rôzne stupne neurologického poškodenia vrátane dlhodobej alebo permanentnej paralýzy (pozri
časť 4.4)
Poruchy pečene a žlčových ciest
· veľmi časté: zvýšenie pečeňových enzýmov (najmä transamináz > 3-násobok hornej hranice
normálu)
· menej časté: hepatocelulárne poškodenie pečene *,
· zriedkavé: cholestatické poškodenie pečene*
Poruchy kože a podkožného tkaniva
· časté: urtikária, pruritus, erytém
· menej časté: bulózna dermatitída
· zriedkavé: alopécia*
· zriedkavé: kožná vaskulitída*, kožná nekróza* obvykle sa vyskytuje v mieste vpichu injekcie
(predchádza jej zvyčajne purpura alebo erytematózne plaky, infiltrované a bolestivé).
Uzlíky v mieste vpichu injekcie * (zapálené uzlíky, ktoré neboli cystickým obalom enoxaparínu).
Vymiznú v priebehu niekoľkých dní a nie je potrebné kvôli tomu ukončiť liečbu.
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
· zriedkavé: osteoporóza* po dlhodobej liečbe (viac ako 3 mesiace).
Celkové poruchy a reakcie v mieste podania
· časté: hematóm v mieste vpichu injekcie, bolesť v mieste vpichu injekcie, iné reakcie v mieste vpichu injekcie (ako je opuch, krvácanie, hypersenzitivita, zápal, zhrubnutie, bolesť alebo reakcia)
· menej časté: lokálne podráždenie, kožná nekróza v mieste vpichu injekcie
Laboratórne a funkčné vyšetrenia
· zriedkavé : hyperkaliémia*(pozri časti 4.4 a 4.5)
Opisvybranýchnežiaducichreakcií
Krvácanie
Patrilo sem veľké krvácanie, zaznamenalo sa u viac ako u 4,2 % pacientov (chirurgickí pacienti). Niektoré z týchto prípadov boli fatálne. U chirurgických pacientov sa za veľké krvácanie považovalo (1) to, ktoré spôsobilo závažnú klinickú udalosť alebo (2) to, pri ktorom bol pokles hemoglobínu
≥ 2 g/dl alebo ktoré si vyžiadalo transfúziu 2 alebo viac jednotiek krvných prípravkov.
Retroperitoneálne a intrakraniálne krvácanie za vždy považovalo za veľké.
Podobne ako pri podávaní iných antikoagulancií, sa môže v prítomnosti pridružených rizikových faktorov ako sú organické poškodenia s tendenciou ku krvácaniu, invazívne zákroky alebo používanie liekov ovplyvňujúcich hemostázu, vyskytnúť krvácanie (pozri časti 4.4 a 4.5).
Trieda
orgánového systému
Poruchy krvi a lymfatického systému
Prevencia
u chirurgických
pacientov
veľmi časté:
krvácanie α
zriedkavé: retroperitoneálne krvácanie
Prevencia
u interných
pacientov
časté:
krvácanie α
Liečba pacientov
s DVT s PE alebo bez nej
veľmi časté:
krvácanie α
menej časté: intrakraniálne krvácanie, retroperitoneálne krvácanie
Liečba pacientov
s nestabilnou angínou a non-Q infarktom myokardu
časté:
krvácanie α
zriedkavé: retroperitoneálne krvácanie
Liečba pacientov
s akútnym STEMI
časté:
krvácanie α
menej časté: intrakraniálne krvácanie, retroperitoneálne krvácanie
 α
α: napríklad: hematóm, ekchymóza iná ako v mieste vpichu injekcie, hematóm v rane, hematúria, epistaxa
a gastrointestinálne krvácanie.
Trombocytopénia a trombocytóza
Trieda orgáno vého systém u Poruch y krvi
a
lymfati ckého systém u
Prevencia
u chirurgických
pacientov
veľmi časté:
trombocytózaβ
časté:
trombocytopénia
Prevencia
u interných
pacientov
menej časté:
trombocytopénia
Liečba pacientov
s DVT s PE alebo bez nej
veľmi časté:
trombocytóza β
časté:
trombocytopénia
Liečba pacientov s nestabilnou angínou a non-Q infarktom myokardu
menej časté:
trombocytopénia
Liečba pacientov
s akútnym STEMI
časté: trombocytózaβ trombocytopénia veľmi zriedkavé: imuno-alergická trombocytopénia
 β
β: zvýšenie počtu krvných doštičiek > 400 x 109/l
PediatrickápopuláciaBezpečnosť a účinnosť enoxaparínu sodného u detí nebola stanovená (pozri časť 4.2).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.
4.9 PredávkovaniePrejavyapríznakyNáhodné predávkovanie enoxaparínom sodným po subkutánnom, mimotelovom alebo intravenóznom podaní môže viesť ku krvácavým komplikáciám. Po perorálnom podaní, dokonca aj vysokých dávok,
nie je pravdepodobné, že sa enoxaparín sodný absorbuje.
LiečbaAntikoagulačný účinok enoxaparínu možno do veľkej miery neutralizovať pomalým intravenóznym podaním protamínu. Dávka protamínu závisí od dávky podaného enoxaparínu sodného; 1 mg
protamínu neutralizuje antikoagulačný účinok 100 IU (1 mg) enoxaparínu sodného, ak bol enoxaparín podaný v priebehu posledných 8 hodín. Ak bol enoxaparín podaný pred viac ako 8 hodinami alebo ak
je potrebná druhá dávka protamínu, môže sa podať infúzia protamínu v dávke 0,5 mg protamínu na
100 IU (1 mg) podaného enoxaparínu sodného. 12 hodín po podaní enoxaparínu nemusí byť podanie protamínu potrebné. Avšak anti-Xa aktivita enoxaparínu sodného sa nikdy (ani pri vysokých dávkach
protamínu) nezneutralizuje úplne (najviac asi 60 %) (pozri Súhrn charakteristických vlastností solí protamínu).
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antitrombotikum, skupina heparínov. ATC kód: B01A B05
Inhixa je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.euFarmakodynamickéúčinky
Enoxaparín je nízkomolekulový heparín so strednou molekulovou hmotnosťou približne
4500 daltonov, v ktorom sú oddelené antitrombotická a antikoagulačná aktivita štandardného heparínu. Liečivo je sodná soľ.
V in-vitro purifikovanom systéme má enoxaparín sodný vysokú anti-Xa aktivitu (približne 100 IU/mg) a nízku anti-IIa alebo antitrombínovú aktivitu (približne 28 IU/mg) s pomerom 3,6. Tieto antikoagulačné aktivity sú sprostredkované antitrombínom (ATIII), čo má za následok antitrombotické účinky u ľudí.
Okrem anti-Xa/IIa aktivity boli identifikované u zdravých ľudí a u pacientov, ako aj na predklinických modeloch, ďalšie antitrombotické a protizápalové vlastnosti enoxaparínu. Patrí sem ATIII- dependentná inhibícia ďalších koagulačných faktorov ako je faktor VIIa, indukcia uvoľňovania endogénneho inhibítora cesty tkanivového faktora (Tissue Factor Pathway Inhibitor (TFPI)) a znížené uvoľňovanie von Willebrandovho faktora (vWF) z vaskulárneho endotelu do krvného obehu. O týchto faktoroch je známe, že prispievajú k celkovému antitrombotickému účinku enoxaparínu.
Keď sa enoxaparín sodný používa ako profylaktická liečba, nemá významný vplyv na aPTT. Keď sa používa ako kuratívna liečba, aPTT sa môže predĺžiť o 1,5-2,2-násobok kontrolného času pri maxime účinku.
Klinická účinnosťabezpečnosť
Prevencia venóznej tromboembolickej choroby spojená s operáciou
Predĺžená profylaxia VTE po ortopedickej operácii
V dvojito zaslepenej štúdii predĺženej profylaxie u pacientov podstupujúcich náhradu bedrového kĺbu,
179 pacientov, ktorí nemali tromboembolickú chorobu a predtým počas hospitalizácie dostávali
4000 IU (40 mg) enoxaparínu sodného, boli po prepustení randomizovaní na buď 4000 IU (40 mg) (n=90) jedenkrát denne subkutánne, alebo placebo ( n=89) na 3 týždne. Výskyt DVT počas predĺženej profylaxie bol štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, nebola hlásená žiadna PE. Nevyskytlo sa žiadne veľké krvácanie.
Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo jedenkrát denne s.c. n (%)
Všetci pacienti liečení predĺženou
profylaxiou
90 (100) 89 (100)
celkovo VTE 6 (6,6) 18 (20,2) celkovo DVT (%) 6 (6,6)* 18 (20,2) proximálna DVT (%) 5 (5,6)# 7 (8,8)
*p hodnota oproti placebu =0,008
#p hodnota oproti placebu =0,537
V druhej dvojito zaslepenej štúdii bolo 262 pacientov bez VTE ochoreniapodstupujúcich operáciu s
náhradou bedrového kĺbu a predtým počas hospitalizácie liečených enoxaparínom sodným 4 000 IU (40 mg) s.c, . bolo randomizovaných po prepustení na buď enoxaparín sodný 4 000 IU (40 mg) (n=131) jedenkrát denne s.c., alebo placebo (n=131) počas 3 týždňov. Podobne ako v prvej štúdii bol výskyt VTE počas predĺženej profylaxie štatisticky významne nižší v skupine s enoxaparínom sodným v porovnaní s placebom, a to aj pre VTE celkovo (enoxaparín sodný 21 [16 %] oproti placebu 45
[34,4 %]; p=0,001) aj pre proximálnu DVT (enoxaparín sodný 8 [6,1%] oproti placebu 28 [21,4 %]; p=<0,001). Pokiaľ ide o veľké krvácanie, nezistil sa žiadny rozdiel medzi skupinami s enoxaparínom sodným a placebom.
Predĺžená profylaxia DVT po onkologickej operácii
Dvojito zaslepená, multicentrická klinická štúdia, porovnávala bezpečnosť a účinnosť štvortýždňového a jednotýždňového režimu profylaktického podávania enoxaparínu sodného
u 332 pacientov, ktorí sa podrobili elektívnej operácii z dôvodu rakoviny v brušnej alebo panvovej
oblasti. Pacienti dostávali enoxaparín sodný (4 000 IU (40 mg) s.c.) denne počas 6 až 10 dní a boli náhodne zaradení na liečbu enoxaparínom sodným alebo placebom počas ďalších 21 dní. Bilaterálna venografia sa realizovala medzi 21. a 31. dňom alebo skôr, ak sa vyskytli príznaky venózneho tromboembolizmu. Pacienti boli potom 3 mesiace sledovaní. Profylaxia enoxaparínom sodným počas
4 týždňov po operácii z dôvodu rakoviny v oblasti brucha alebo panvy štatisticky významne znížila výskyt venograficky preukázanej trombózy v porovnaní s profylaxiou enoxaparínom sodným počas jedného týždňa. Výskyt venózneho tromboembolizmu na konci dvojito zaslepenej fázy bol 12,0 % (n=20) v skupine s placebom a 4,8 % (n=8) v skupine s enoxaparínom sodným; p=0,02. Tento rozdiel pretrvával tri mesiace [13,8 % vs. 5,5 % (n=23 vs 9), p=0,01]. Neboli rozdiely vo výskyte krvácania alebo iných komplikácií počas dvojito zaslepenej alebo sledovacej fázy.
Prevencia venóznej tromboembolickej choroby u interných pacientov s akútnymi ochoreniami, kde sa očakáva obmedzenie mobility
V dvojito zaslepenej, multicentrickej štúdii s paralelnými skupinami sa provnával enoxaparín sodný
2 000 IU (20 mg) alebo 4 000 IU (40 mg) jedenkrát denne s.c. s placebom v prevencii DVT
u interných pacientov s ťažkým obmedzením mobility počas akútneho ochorenia (definované ako prejdená vzdialenosť <10 metrov za ≤3 dni). Táto štúdia zahŕňala pacientov so srdcovým zlyhaním (NYHA trieda III alebo IV); akútnym respiračným zlyhaním alebo komplikovanou chronicku respiračnou insuficienciou a akútnou infekciou alebo akútnou reumou; ak boli spojené aspoň s jedným VTE rizikovým faktorom (vek ≥75 rokov, rakovina, predchádzajúca VTE, obezita, varikózne vény, hormonálna liečba a chronické srdcové alebo respiračné zlyhanie).
Celkovo bolo v štúdii zaradených 1102 pacientov a 1073 pacientov bolo liečených. Liečba
pokračovala počas 6 až 14 dní (priemerné trvanie liečby 7 dní). Pri podávaní dávky 4 000 IU (40 mg)
jedenkrát denne s.c. enoxaparín sodný štatisticky významne znížil výskyt VTE v porovnaní
s placebom. Údaje týkajúce sa účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
2 000 IU (20 mg) jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo
n (%)
enoxaparín sodný
2 000 IU (20 mg) jedenkrát denne s.c. n (%)
enoxaparín sodný
4 000 IU (40 mg) jedenkrát denne s.c. n (%)
placebo
n (%)
v
š
etci liečení interní pacienti počas akútneho ochorenia
287 (100) 291(100) 288 (100)
celkovo VTE (%) 43 (15,0) 16 (5,5)* 43 (14,9) celkovo DVT (%) 43 (15,0) 16 (5,5) 40 (13,9) proximálna DVT (%) 13 (4,5) 5 (1,7) 14 (4,9) VTE = venózne tromboembolické udalosti, ktoré zahŕňali DVT, PE a smrť z dôvodu tromboembólie
* p hodnota oproti placebu = 0,0002
Približne 3 mesiace po zaradení zostával výskyt VTE štatisticky významne nižší v skupine liečenej
enoxaparínom sodným 4 000 IU (40 mg) v porovnaní so skupinou liečenou placebom.
Výskyt krvácania celkovo bol 8,6 % a výskyt veľkého krvácania 1,1 % v skupine s placebom, 11,7 %
a 0,3 % v skupine s enoxaparínom sodným 2 000 IU (20 mg) a 12,6 % a 1,7 % v skupine s enoxaparínom sodným 4 000 IU (40 mg).
Liečba hlbokej žilovej trombózy s pľúcnou embóliou alebo bez nej
V multicentrickej štúdii s paralelnými skupinami bolo 900 pacientov s akútnou DVT dolnej končatiny s pľúcnou embóliou alebo bez nej randomizovaných na hospitalizačnú liečbu buď (i) enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát denne s.c., (ii) enoxaparínom sodným 100 IU/kg (1 mg/kg) každých 12 hodín s.c. alebo (iii) i.v. bolusom heparínu (5 000 IU), po ktorom nasledovala kontinuálna infúzia (podávaná s cieľom dosiahnuť aPTT 55 až 85 sekúnd). Celkovo bolo v štúdii
randomizovaných 900 pacientov a všetci pacienti boli liečení. Všetci pacienti dostávali aj liečbu
warfarínom sodným (dávka bola upravená podľa protrombínového času s cieľom dosiahnuť INR 2,0 až 3,0) so začiatkom v priebehu 72 hodín od začatia liečby enoxaparínom sodným alebo štandardnej liečby heparínom a pokračovaním počas 90 dní. Enoxaparín sodný alebo štandardná liečba heparínom sa podávala minimálne 5 dní a dovtedy, kým sa nedosiahol cieľový INR warfarínu sodného. Obidva režimy s enoxaparínom sodným boli rovnocenné ako štandardná heparínová liečba, pokiaľ ide
o zníženie rizika rekurencie venózneho tromboembolizmu (DVT a/alebo PE). Údaje týkajúce sa
účinnosti sú uvedené v tabuľke nižšie.
 enoxaparín sodný
15
0 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
enoxaparín sodný
10
0 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
heparín
i.v. liečba upravovaná podľa aPTT
n (%)
enoxaparín sodný
15
0 IU/kg (1,5 mg/kg) jedenkrát denne s.c. n (%)
enoxaparín sodný
10
0 IU/kg (1 mg/kg) dvakrát denne s.c. n (%)
heparín
i.v. liečba upravovaná podľa aPTT
n (%)
v
š
etci liečení pacienti s DVT s PE alebo bez nej
298 (100) 312 (100) 290 (100)
celkovo VTE (%) 13 (4,4)* 9 (2,9)* 12 (4,1) iba DVT (%) 11 (3,7) 7 (2,2) 8 (2,8) proximálna DVT (%) 9 (3,0) 6 (1,9) 7 (2,4) PE (%) 2 (0,7) 2 (0,6) 4 (1,4) VTE = venózna tromboembolická udalosť (DVT a/alebo PE)
*interval spoľahlivosti 95 % pre rozdiely v liečbe celkovej VTE boli:
- enoxaparín sodný jedenkrát denne oproti heparínu (-3,0 až 3,5)
- enoxaparín sodný každých 12 hodín oproti heparínu (-4,2 až 1,7).
Veľké krvácanie bolo 1,7 % v skupine s enoxaparínom sodným 150 IU/kg (1,5 mg/kg) jedenkrát
denne, 1,3 % v skupine s enoxaparínom sodným 100 IU/kg (1 mg/kg) dvakrát denne a 2,1 % v skupine s heparínom.
Liečba nestabilnej angíny a infarktu myokardu bez elevácie ST
V rozsiahlej multicentrickej štúdii 3171 pacientov zaradených v akútnej faze nestabilnej anginy
pectoris alebo non-Q infarktu myokardu bolo randomizovaných do dvoch skupín tak, že pacienti
v jednej skupine dostávali spolu s kyselinou acetylsalicylovou (100 až 325 mg jedenkrát denne) buď s.c. injekciu enoxaparínu sodného v dávke 100 IU/kg (1 mg/kg) každých 12 hodín alebo i.v. nefrakcionovaný heparín upravený podľa aPTT. Pacienti museli byť hospitalizovaní minimálne 2 dni a maximálne 8 dní, až do klinickej stabilizácie, revaskularizačnej procedúry alebo prepustenia z
nemocnice. Pacienti museli byť sledovaní po dobu 30 dní. Enoxaparín sodný v porovnaní s heparínom
štatisticky významne znížil kombinovaný výskyt anginy pectoris, infarktu myokardu a smrti s poklesom 19,8 až 16,6 % (redukcia relatívneho rizika 16,2 %) v deň 14. Táto redukcia v kombinovanom výskyte pretrvávala po 30 dňoch (od 23,3 do 19,8 %; redukcia relatívneho rizika
15 %).
Pokiaľ ide o veľké krvácanie, neboli zistené žiadne rozdiely, aj keď krvácanie v mieste podania s.c. injekcie bolo častejšie.
Liečba akútneho infarktu myokardu s eleváciou ST-segmentu
V rozsiahlej multicentrickej štúdii bolo 20 479 pacientov so STEMI vhodných na fibrinolytickú liečbu randomizovaných do dvoch skupín; v jednej skupine dostali enoxaparín sodný ako jednu bolusovú i.v. dávku 3000 IU (30 mg) plus subkutánnu injekciu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg) a následne každých 12 hodín subkutánnu injekiu enoxaparínu sodného v dávke 100 IU/kg (1,0 mg/kg) a v druhej skupine dostávali intravenózne nefrakcionovaný heparín upravený podľa aPTT po dobu
48 hodín. Všetci pacienti boli taktiež liečení kyselinou acetylsalicylovou po dobu minimálne 30 dní.
Stratégia dávkovania enoxaparínu bola prispôsobená pre pacientov so závažne zhoršenou funkciou obličiek a pre starších pacientov vo veku 75 a viac rokov. Subkutánne injekcie enoxaparínu sa
podávali dovtedy, kým pacient nebol prepustený z nemocnice alebo po dobu maximálne 8 dní (podľa toho, čo nastalo skôr).
4716 pacientov sa podrobilo perkutánnej koronárnej intervencii, pričom dostávali antitrombotickú
podpornú liečbu zaslepenými liekmi štúdie. Preto pre pacientov liečených enoxaparínom musela byť vykonaná PCI s enoxaparínom (žiadna zmena), pričom bol použitý režim stanovený
v predchádzajúcich štúdiách t.j. žiadne ďalšie dávkovanie, ak od posledného subkutánneho podania do
insuflácie balónu uplynulo menej ako 8 hodín; i.v. bolus 30 IU/kg (0,3 mg/kg) enoxaparínu, ak od posledného subkutánneho podania do insuflácie balónu uplynulo viac ako 8 hodín.
Enoxaparín sodný v porovnaní s nefrakcionovaným heparínom štatisticky významne znížil výskyt
primárneho endpointu - smrti z akejkoľvek príčiny alebo re-infarktu myokardu v prvých 30 dňoch po randomizácii [9,9 percenta v skupine s enoxaparínom v porovnaní s 12,0 percentami v skupine
s nefrakcionovaným heparínom] pri redukcii relatívneho rizika 17 % (p<0,001).
Benefity liečby enoxaparínom (zjavné vo viacerých ukazovateľoch účinnosti) sa objavili už za 48 hodín, kedy redukcia relatívneho rizika re-infarktu myokardu bola 35 % v porovnaní s liečbou nefrakcionovaným heparínom (p<0,001).
Benefit enoxaparínu v primárnom ukazovateli bol konzistentný v rámci kľúčových podskupín vrátane
veku, pohlavia, lokácie infarktu, anamnézy diabetu, anamnézy predchádzajúceho infarktu myokardu, typu použitého fibrinolytika a času do liečby študijným liekom.
Zistil sa štatisticky významný benefit liečby enoxaparínom v porovnaní s nefrakcionovaným heparínom u pacientov, ktorí sa podrobili perkutánnej koronárnej intervencii v priebehu 30 dní po randomizácii (23 % redukcia relatívneho rizika) alebo ktorí boli liečení konzervatívne (farmakologicky) (15 % redukcia relatívneho rizika, p = 0,27 pre interakciu).
Výskyt združeného ukazovateľa, ktorým bolo úmrtie, re-infarkt alebo intrakraniálne hemoragie na
30.deň (merané ako čistý klinický benefit) bol štatisticky významne nižší (p<0,0001) v skupine s enoxaparínom (10,1 %) v porovnaní so skupinou s heparínom (12,2 %), čo predstavuje 17 % redukciu relatívneho rizika v prínos liečby enoxaparínom sodným.
Výskyt veľkého krvácania po 30 dňoch bol štatisticky významne vyšší (p<0,0001) v skupine
s enoxaparínom sodným (2,1 %) oproti skupine s heparínom (1,4 %). Vyšší výskyt gastrointestinálneho krvácania bol v skupine s enoxaparínom sodným (0,5 %) oproti skupine s heparínom (0,1 %), zatiaľ čo výskyt intrakraniálneho krvácania bol podobný v obidvoch skupinách (0,8 % s enoxaparínom sodným oproti 0,7 % s heparínom).
Prospešný účinok enoxaparínu na primárny endpoint pozorovaný počas prvých 30 dní sa zachoval počas 12 mesiacov sledovania.
Porucha funkcie pečene
Podľa lietrárnych údajov sa používanie enoxaparínu v dávke 4 000 IU (40 mg) u pacientov s cirhózou
(Child-Pugh trieda B-C) zdá byť bezpečné a účinné v prevencii trombózy portálnej vény. Treba poznamenať, že literárne štúdie môžu mať určité obmedzenia. U pacientov s poruchou pečene je potrebná opatrnosť, pretože títo pacienti majú vyšší potenciál krvácania (pozri časť 4.4) a u pacientov s cirhózou (Child-Pugh trieda A,B, C) sa žiadne štúdie týkajúce sa formálneho stanovenia dávky neuskutočnili.
5.2 Farmakokinetické vlastnosti
Všeobecnácharakteristika
Farmakokinetické parametre enoxaparínu sodného sa sledovali najmä vo vzťahu k časovému priebehu plazmatickej anti-Xa aktivity a tiež anti-IIa aktivity v odporúčaných dávkach a to po jednorazovom a opakovanom subkutánnom podaní a po jednorazovom i.v. podaní.
Kvantitatívne hodnotenie anti-Xa a anti-IIa farmakokinetických aktivít sa robilo validovanými
amidolytickými metódami.
Absorpcia
Absolútna biologická dostupnosť enoxaparínu sodného po s.c. injekcii vychádzajúca z anti-Xa aktivity
je približne 100 %.
Môžu sa použiť rôzne dávky, formy a dávkovacie režimy.
Priemernú maximálnu plazmatickú anti-Xa aktivitu možno pozorovať 3 až 5 hodín po subkutánnej injekcii a dosahuje približne 0,2, 0,4 a 1,0 a 1,3 IU/ml po jednorazovej s.c. aplikácii 2000 IU, 4000 IU,
100 IU/kg a 150 IU/kg (20 mg, 40 mg, 1 mg/kg a 1,5 mg/kg) v uvedenom poradí.
Intravenózna bolusová dávka 3000 IU (30 mg), po ktorej bezprostredne nasleduje dávka 100 IU/kg (1 mg/kg) podaná subkutánne každých 12 hodín, poskytuje počiatočný vrchol hladiny faktoru anti- Xa 1,16 IU/ml (n=16) a priemerná expozícia zodpovedá 88 % hladiny v stabilizovanom stave. Stabilizovaný stav sa dosahuje na druhý deň liečby.
Po opakovanom subkutánnom podaní dávky 4000 IU (40 mg) raz denne a dávky 150 IU/kg
(1,5 mg/kg) raz denne zdravým dobrovoľníkom, sa dosiahne ustálený stav na 2.deň a priemerná miera expozície je asi o 15 % vyššia ako po jednorazovom podaní. Po opakovanom subkutánnom podaní dávky 100 anti-Xa IU/kg dvakrát denne sa ustálený stav dosiahne od 3. po 4.deň a má priemernú expozíciu asi o 65 % vyššiu ako po jednorazovom podaní, maximálnu priemernú hodnotu 1,2 IU/ml
a minimálnu hodnotu 0,52 IU/ml.
Injekčný objem a koncentrácia dávky v rozmedzí 100-200 mg/ml nemá vplyv na farmakokinetické parametre u zdravých dobrovoľníkov.
Farmakokinetika enoxaparínu po podaní dávok vyšších ako sú odporúčané dávky je lineárna. Premenlivosť v rámci organizmu alebo medzi viacerými pacientami je nízka. Po opakovanom s.c. podávaní sa akumulácia nezistila.
Plazmatická anti-IIa aktivita enoxaparínu je po subkutánnom podaní približne 10-krát nižšia ako anti- Xa aktivita. Priemerná maximálna anti-IIa aktivita sa pozoruje približne 3 - 4 hodiny a dosahuje po subkutánnom podaní 100 IU/kg dvakrát denne 0,13 IU/ml a po subkutánnom podaní 150 IU/kg
(1,5 mg/kg) jedenkrát denne 0,19 IU/ml.
Distribúcia
Distribučný objem anti-Xa aktivity enoxaparínu sodného je asi 4,3 litrov a je blízky krvnému objemu.
Biotransformácia
Enoxaparín sodný sa primárne metabolizuje v pečeni desulfatizáciou a/alebo depolymerizáciou na
zložky s nižšou molekulovou hmotnosťou s omnoho nižšou biologickou účinnosťou.
Eliminácia
Enoxaparín sodný je liek s nízkym klírens s priemerným klírensom plazmatickej anti-Xa aktivity po
podaní dávky 150 IU/kg (1,5 mg/kg) 6-hodinovou i.v. infúziou 0,74 l/hod.
Eliminácia sa javí byť jednofázová a eliminačný polčas anti-Xa aktivity je približne 5 hodín po jednorazovom subkutánnom podaní až približne 7 hodín po opakovanom podaní enoxaparínu sodného.
Renálny klírens aktívnych fragmentov predstavuje približne 10 % podanej dávky a celková renálna
exkrécia aktívnych a neaktívnych fragmentov je 40 % dávky.
Špeciálneskupinypacientov
Starší ľudia
Na základe výsledkov farmakokinetickej analýzy sa zistilo, že pokiaľ je zachovaná normálna funkcia obličiek, kinetický profil enoxaparínu sodného sa u starších osôb v porovnaní s mladšími nelíši. Avšak
je známe, že funkcia obličiek sa s vekom znižuje a teda eliminácia enoxaparínu sodného u starších pacientov môže byť znížená (pozri časti 4.2 a 4.4).
Porucha funkcie pečene
V štúdii, ktorá sa robila u pacientov s pokročilou cirhózou liečených enoxaparínom sodným 4 000 IU (40 mg) jedenkrát denne bol pokles v maxime anti-Xa aktivity spojený s vzostupom závažnosti poškodenia pečene (hodnotené podľa Child-Pugh kategórií). Tento pokles bol pripisovaný hlavne poklesu hladiny ATIII, sekundárne zníženej syntéze ATIII u pacientov s poruchou funkcie pečene.
Porucha funkcie obličiek
Medzi klírensom plazmatickej anti-Xa aktivity a klírensom kreatinínu bol v ustálenom stave pozorovaný lineárny vzťah, čo naznačuje zníženie klírensu enoxaparínu sodného u pacientov s poruchou funkcie obličiek. Po opakovanej subkutánnej dávke 4000 IU raz denne je expozícia anti-Xa aktivity, vyjadrená AUC v ustálenom stave, pri mierne (klírens kreatinínu 50-80 ml/min) a pri stredne ťažkej (klírens kreatnínu 30-50 ml/min) poruche funkcie obličiek okrajovo zvýšená. U pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu <30 ml/min) je AUC v ustálenom stave, po opakovaných subkutánnych dávkach 4000 IU raz denne, významne zvýšená (priemerne o 65 %) (pozri časti 4.2 a 4.4).
Hemodialýza
Po jednorazovom i.v. podaní enoxaparínu sodného v dávke 25 IU, 50 IU alebo 100 IU/kg (0,25, 0,50 alebo 1,0 mg/kg) bola jeho farmakokinetika podobná ako u kontrolovanej populácie, avšak AUC bola dvakrát vyššia ako u kontrolovanej populácie.
Telesná hmotnosť
Po opakovaných s.c. dávkach 150 IU/kg (1,5 mg/kg) jedenkrát denne je priemerná AUC anti-Xa aktivity v ustálenom stave u obéznych zdravých dobrovoľníkov (BMI index 30-48 kg/m2) v porovnaní s osobami s normálnou hmotnosťou okrajovo zvýšená, zatiaľ čo maximálna plazmatická hladina anti-Xa aktivity zvýšená nie je. U obéznych pacientov je po subkutánnom podaní nižší hmotnosťou ovplyvnený klírens.
Po jednorazovom subkutánnom podaní enoxaparínu sodného v dávke 4000 IU (dávka nebola upravená na základe hmotnosti pacienta) ženám (<45 kg) a mužom (<57 kg) s nízkou hmotnosťou bolo zistené, že expozícia anti-Xa aktivity je v porovnaní s osobami s normálnou hmotnosťou u žien o 52 %
a u mužov o 27 % vyššia (pozri časť 4.4).
Farmakokinetickéinterakcie
Pri súbežnom podaní enoxaparínu a trombolytika sa nepozorovali žiadne farmakokinetické interakcie.
5.3 Predklinické údaje o bezpečnosti
V 13-týždňových štúdiach toxicity, kde sa podával s.c. enoxaparín potkanom a psom v dávke
15 mg/kg/deň a v 26 týždňových štúdiach toxicity, kde sa podával enoxaparín s.c. a i.v. potkanom
a opiciam v dávke 10 mg/kg/deň sa iné nežiaduce účinky enoxaparínu okrem antikoagulačného účinku nedokázali.
Nasledujúce testy nepreukázali mutagénne účinky enoxaparínu: Amesov test in-vitro, progresívny mutačný test na bunkách myšacích lymfómov in-vitro, humánny lymfocytový test chromozomálnych aberácií in-vitro a in-vivo test chromozomálnych aberácií na kostnej dreni potkanov.
Štúdie vykonané u gravidných samíc potkanov a králikov s dávkami enoxaparínu sodného do
30 mg/kg/deň nepreukázali žiadne teratogénne účinky ani fetotoxicitu. Po s.c. podaní dávky nižšej ako
20 mg/kg/deň nemal enoxaparín vplyv na fertilitu ani na reprodukčné schopnosti potkaních samcov
a samíc.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Voda na injekciu
6.2 Inkompatibility
Subkutánnainjekcia
Inhixa sa nesmie miešať so žiadnymi inými injekciami alebo infúziou.
I
ntravenózna
injekcia
(bolus)
iba
pre
akútnu
indikáciu
STEMI.
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnostiNaplnenástriekačka3 roky
Zriedenýlieksinjekčnýmroztokomchloridusodného9 mg/ml (0,9 %) alebo5%glukózyvovode8 hodín
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25 ° C. Neuchovávajte v mrazničke.
6.5 Druh obalu a obsah balenia1 ml roztoku v:
- sklenenej striekačke s označenej mierkou z číreho bezfarebného neutrálneho skla typu I s pevnou ihlou a krytom ihly uzavretým chlórbutylovou gumovou zátkou a s čiernym polypropylénovým piestom. Injekčné striekačky môžu byť dodatočne vybavené poistným prvkom, ktorý chráni proti pichnutiu ihlou po vykonaní injekcie; alebo
- sklenenej striekačke s označenej mierkou z číreho bezfarebného neutrálneho skla typu I
s pevnou ihlou a krytom ihly uzavretým chlórbutylovou gumovou zátkou a s bielym polykarbonátovým piestom. Injekčné striekačky môžu byť dodatočne vybavené poistným UltraSafe Passive prvkom, ktorý chráni proti pichnutiu ihlou po vykonaní injekcie.
Balenia s:
- 2, 6, 10, 30 a 90 naplnenými striekačkami
- 2, 6, 10, 12, 24 a 30 naplnenými striekačkami s ochranným krytom ihly
- 2 a 10 naplnenými striekačkami s UltraSafe Passive ochranným krytom ihly
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom NÁVO D NA P O UŽÍVANIE: NAP LNENÁ INJEKČNÁ STRIEKAČK A 
Ako máte podávať injekciu Inhixa sám sebe
Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.

- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte
miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa
1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
 2)
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
 Pamätajte:
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto
podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená
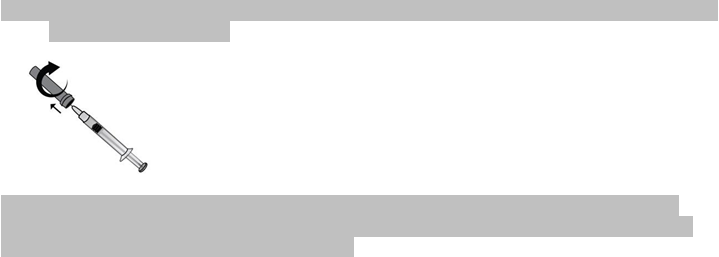
a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.

 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný záhyb držíte počas celého podávania injekcie.
 8)
8) Rovným ťahom ihlu vytiahnite.
Aby st e sa vyhl i podli ati ne, mi est o vpi chu si po podaní i nj ekci e sami nem así rujt e.
9) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré

predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.Ako máte podávať injekciu Inhixa sám sebe
Naplnená injekčná striekačka môže mať priložený ochranný kryt ihly, ktorý chráni pred poranením ihlou. Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to

máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak
si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.
- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.

- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte
miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
 2)
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená

a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .
 6)
6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného záhybu vpichnite celú dĺžku ihly.

 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný záhyb držíte počas celého podávania injekcie.
 8)
8) Rovným ťahom ihlu vytiahnite. Neprestávajte stláčať piest!
Aby ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.9) Stlačte silno piest striekačky. Poistný prvok ihly, ktorý má podobu plastového cylindra, sa

automaticky nasunie na ihlu a celú ju zakryje.
10) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré
predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Ako máte podávať injekciu Inhixa sám sebe
Naplnená injekčná striekačka môže mať priložený UltraSafe Passive ochranný kryt ihly, ktorý chráni pred poranením ihlou. Ak si dokážete podávať tento liek sám/sama, lekár alebo zdravotná sestra vám ukáže, ako to máte robiť. Nepokúšajte sa podávať si injekciu sám/sama bez toho, aby ste boli o tom poučený/á. Ak si nie ste istý/á, čo máte robiť, ihneď sa poraďte so svojím lekárom alebo zdravotnou sestrou.
Skôr, ako si podáte injekciu Inhixa- Skontrolujte si dátum exspirácie lieku. Po tomto dátume ho už nepoužívajte.
- Skontrolujte injekčnú striekačku, či nie je poškodená a či liek v nej je číry roztok. Ak nie je, použite inú injekčnú striekačku.

- Tento liek nepoužívajte, ak spozorujete akúkoľvek zmenu vzhľadu lieku.
- Uistite sa, že viete, aké množstvo lieku si idete podať.
- Skontrolujte si brucho, či posledná injekcia nespôsobila sčervenanie, zmenu farby kože, opuch, mokvanie, alebo či nie je ešte bolestivé; ak áno, povedzte to svojmu lekárovi alebo zdravotnej

sestre.
- Rozhodnite sa, do ktorého miesta si podáte injekciu svojho lieku. Pri každej injekcii zmeňte miesto vpichu z pravej strany brucha na ľavú a opačne. Tento liek sa má vpichnúť priamo pod kožu v brušnej časti, ale nie v blízkosti pupku alebo prípadnej jazvy (aspoň 5 cm ďalej od nich).
- Naplnená striekačka je určená len na jednorazové použitie.
Pokyny, ako si podať injekciu Inhixa1) Mydlom a vodou si umyte ruky a miesto podania injekcie. Osušte ich
 2)
2) Posaďte sa alebo si ľahnite do pohodlnej polohy, aby ste boli uvoľnený/á. Skontrolujte, že vidíte miesto, kam podáte injekciu. Ideálne je kreslo, sklápacie kreslo alebo posteľ vypodložená vankúšom.
3) Vyberte si miesto na pravej alebo ľavej strane brucha. To by malo byť najmenej 5 cm od pupku a smerom do boku.
Pamätajte: Injekciu nepodávajte do 5 cm od pupku alebo existujúcej jazvy či modriny. Miesto

podania injekcie si zvoľte na ľavej alebo pravej strane brucha, podľa toho, kde ste si podávali injekciu
naposledy.
4) Opatrne odstráňte z ihly ochranný kryt. Kryt zahoďte do odpadu. Striekačka je už naplnená
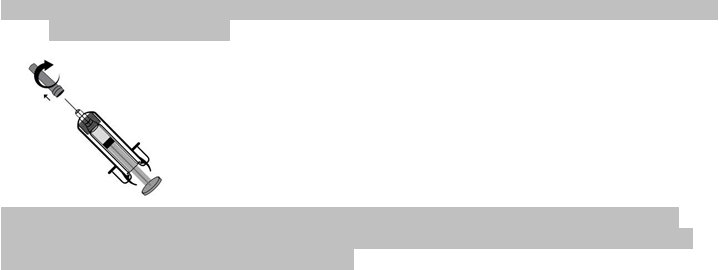
a pripravená na použitie.
Pred podaním injekcie
nestláčajte piest, aby ste vytlačili vzduchové bubliny. To môže viesť
k zníženiu množstva lieku. Hneď ako odstránite kryt, dajte pozor, aby sa ihla ničoho nedotkla. Zabezpečíte tak, aby ihla zostala čistá (sterilná).
5) Držte injekčnú striekačku rukou, ktorou píšete (ako ceruzku), a druhou rukou jemne stlačte

vyčistené miesto na bruchu a medzi palcom a ukazovákom vytvorte kožný záhyb.
Uistite sa, že
kožný záhyb drží t e počas celého podávania i nj ekci e .6) Injekčnú striekačku držte tak, aby ihla smerovala kolmo nadol (zvisle v uhle 90°). Do kožného

záhybu vpichnite celú dĺžku ihly.

 7)
7) Prstom zatlačte na piest. Liek sa tak dostane do tukového tkaniva brucha. Uistite sa, že kožný záhyb držíte počas celého podávania injekcie.
8) Rovným ťahom ihlu vytiahnite. Neprestávajte stláčať piest!
 A
by ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
9)
A
by ste sa vyhli podliatine, miesto vpichu si po podaní injekcie sami nemasírujte.
9) Uvoľnite piest a nechajte injekčnú striekačku vysunúť, pokiaľ nie je celá ihla chránená a kryt

nezapadne na miesto.
10) Použitú injekčnú striekačku s ochranným obalom odhoďte do poskytnutej nádoby na ostré
predmety. Kryt nádoby pevne zatvorte a uložte ju mimo dosah detí.
 Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.
Po naplnení nádobu dajte na likvidáciu vášmu lekárovi alebo zdravotnej sestre, ktorá chodí nanávštevy k pacientom. Nevkladajte ju do domáceho odpadu.Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITechdow Europe AB
Kåbovägen 32
75236 Uppsala
Švédsko
8. REGISTRAČNÉ ČÍSLOEU/1/16/1132/009
EU/1/16/1132/010
EU/1/16/1132/019
EU/1/16/1132/020
EU/1/16/1132/022
EU/1/16/1132/031
EU/1/16/1132/032
EU/1/16/1132/041
EU/1/16/1132/042
EU/1/16/1132/049
EU/1/16/1132/050
EU/1/16/1132/061
EU/1/16/1132/062
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 15/09/2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.