
pacienti s nízkou funkčnou rezervou beta buniek (napr. pacienti trpiaci diabetom 2. typu s nízkou hladinou C-peptidu alebo latentným autoimunitným diabetom dospelých (LADA) alebo pacienti s pankreatitídou v anamnéze), pacienti s ochoreniami vedúcimi k obmedzenému príjmu potravy alebo k závažnej dehydratácii, pacienti, u ktorých sú dávky inzulínu znížené, a pacienti so zvýšenou potrebou inzulínu z dôvodu akútneho ochorenia, chirurgického zákroku alebo nadmerného požívania alkoholu. U týchto pacientov sa inhibítory SGLT2 majú používať s opatrnosťou.
Obnovenie liečby inhibítormi SGLT2 u pacientov s anamnézou DKA počas liečby inhibítormi SGLT2 sa neodporúča s výnimkou prípadov, keď bol identifikovaný a vyriešený iný jednoznačný spúšťací faktor.
Bezpečnosť a účinnosť empagliflozínu u pacientov s diabetom 1. typu sa nestanovili a empagliflozín
sa nemá používať na liečbu pacientov s diabetom 1. typu. Obmedzené údaje z klinických skúšaní naznačujú, že DKA sa často vyskytuje u pacientov s diabetom 1. typu liečených inhibítormi SGLT2.
Použitie sliekmi,oktorýchjeznáme,žespôsobujúhypoglykémiu
Empagliflozín a linagliptín ako samostatné liečivá preukázali výskyt hypoglykémie porovnateľný s
placebom pri použití samostatne alebo v kombinácii s inými antidiabetikami, o ktorých nie je známe, že by spôsobovali hypoglykémiu (napr. metformín, tiazolidíndióny). Pri použití v kombinácii s
antidiabetikami, o ktorých je známe, že spôsobujú hypoglykémiu (napr. sulfonylmočoviny a/alebo inzulín), výskyt hypoglykémie pri oboch liečivách stúpol (pozri časť 4.8).
Nie sú dostupné údaje o riziku hypoglykémie pri Glyxambi používanom s inzulínom a/alebo sulfonylmočovinou. Odporúča sa opatrnosť, ak sa Glyxambi používa v kombinácii s antidiabetikami. Možno zvážiť zníženie dávky sulfonylmočoviny alebo inzulínu (pozri časť 4.2 a 4.5).
Akútna pankreatitída
Používanie inhibítorov dipeptidyl peptidázy-4 (DPP-4) bolo spojené s rizikom vzniku akútnej
pankreatitídy. U pacientov užívajúcich linagliptín boli po uvedení lieku na trh hlásené prípady akútnej pankreatítídy. Pacienti majú byť informovaní o typických príznakoch akútnej pankreatitídy.
V prípade podozrenia na pankreatitídu sa má liečba Glyxambi prerušiť. Ak sa akútna pankreatitída potvrdí, liečba Glyxambi sa nemá obnoviť. U pacientov s anamnézou pankreatitídy sa má postupovať s opatrnosťou.
Sledovanie funkcieobličiek
Vzhľadom na mechanizmus účinku je účinnosť empagliflozínu závislá od funkcie obličiek (pozri
časti 4.2, 5.1 a 5.2). Odporúča sa preto, aby sa funkcia obličiek zhodnotila:
· pred začiatkom liečby Glyxambi a pravidelne počas liečby, t. j. aspoň raz za rok,
· pred začiatkom súbežnej liečby akýmkoľvek liekom, ktorý môže mať negatívny vplyv na funkciu obličiek.
Použitie upacientovsporuchoufunkcieobličiek
Úprava dávky alebo ukončenie liečby Glyxambi môže byť potrebné u pacientov s eGFR pod
60 ml/min/1,73 m2 alebo CrCl < 60 ml/min (podrobnosti nájdete v časti 4.2). Glyxambi sa má vysadiť, ak je eGFR trvalo pod 45 ml/min/1,73 m2 alebo CrCl je trvalo pod 45 ml/min. Glyxambi sa nemá
používať u pacientov s ochorením obličiek v terminálnom štádiu ani u pacientov na dialýze, pretože sa
nepredpokladá, že bude u týchto pacientov účinný (pozri časť 5.2).
Použitie upacientovsrizikomdeplécieobjemu
Na základe mechanizmu účinku inhibítorov SGLT2 môže osmotická diuréza sprevádzajúca
terapeutickú glukozúriu viesť k miernemu poklesu krvného tlaku (pozri časť 5.1). U pacientov, pre ktorých môže pokles krvného tlaku vyvolaný empagliflozínom predstavovať riziko, ako sú pacienti so známym kardiovaskulárnym ochorením, pacienti užívajúci liečbu antihypertenzívami (napr. tiazid a kľučkové diuretiká, pozri aj časť 4.5) s hypotenziou v anamnéze alebo pacienti vo veku 75 rokov a starší, sa má preto postupovať opatrne.
V situáciách, ktoré môžu viesť k strate tekutín (napr. ochorenie gastrointestinálneho traktu), sa u pacientov užívajúcich empagliflozín odporúča pozorné sledovanie stavu objemu (napr. telesné vyšetrenie, merania krvného tlaku, laboratórne vyšetrenia vrátane hematokritu) a elektrolytov. Kým nedôjde k náprave straty tekutín, má sa zvážiť dočasné prerušenie liečby Glyxambi.
Infekcie močovýchciest
V klinických skúšaniach s Glyxambi bol výskyt infekcií močových ciest celkovo podobný u pacientov
liečených Glyxambi a u pacientov liečených empagliflozínom alebo linagliptínom. Frekvencie výskytu sú porovnateľné s výskytom infekcií močových ciest pri klinických skúšaniach empagliflozínu (pozri časť 4.8).
Celková frekvencia výskytu infekcie močových ciest, ktorá sa hlásila ako nežiaduca udalosť, bola u pacientov liečených 25 mg empagliflozínu a placebom podobná a u pacientov liečených 10 mg
empagliflozínu bola vyššia (pozri časť 4.8). Komplikovaná infekcia močových ciest (napr. pyelonefritída alebo urosepsa) sa vyskytla v podobnej frekvencii u pacientov liečených
empagliflozínom v porovnaní s placebom. Pyelonefritída a ureosepsa neboli hlásené v klinických skúšaniach u pacientov liečených Glyxambi. U pacientov s komplikovanými infekciami močových ciest sa má však zvážiť dočasné prerušenie liečby Glyxambi.
Poškodenie pečene
Pri empagliflozíne sa v klinických štúdiách hlásili prípady poškodenia pečene. Príčinný vzťah medzi
empagliflozínom a poškodením pečene sa nestanovil.
Zlyhanie srdca
Skúsenosti s empagliflozínom so zlyhaním srdca triedy I. – II. podľa klasifikácie Newyorskej srdcovej
asociácie (NYHA) sú obmedzené a v klinických štúdiách s empagliflozínom neexistujú žiadne skúsenosti so zlyhaním srdca triedy III. – IV. podľa klasifikácie NYHA.
Laboratórne vyhodnoteniamoču
Vzhľadom na mechanizmus účinku empagliflozínu budú mať pacienti užívajúci Glyxambi pozitívny
výsledok vyšetrenia glukózy v moči.
Staršie osoby
Vyššie riziko nežiaducich reakcií v dôsledku deplécie objemu bolo hlásené u pacientov vo veku
75 rokov a starších, ktorí boli liečení empagliflozínom, obzvlášť pri dávke 25 mg/deň (pozri časť 4.8). Terapeutické skúsenosti s Glyxambi u pacientov starších ako 75 rokov sú obmedzené a skúsenosti u
pacientov vo veku 85 rokov a starších nie sú dostupné. V tejto populácii sa neodporúča začínať liečbu
Glyxambi (pozri časť 4.2).
4.5 Liekové a iné interakcie
Neboli vykonané žiadne štúdie liekovej interakcie s Glyxambi a inými liekmi, tieto štúdie sa však vykonali s jednotlivými liečivami.
Na základe výsledkov farmakokinetických štúdií sa neodporúča žiadna úprava dávky Glyxambi pri súbežnom podávaní s bežne predpisovanými liekmi okrem liekov uvedených nižšie.
Farmakodynamické interakcie
Inzulín a sulfonylmočoviny
Inzulín a sulfonylmočoviny môžu zvýšiť riziko hypoglykémie. Na zníženie rizika môže byť preto
potrebná nižšia dávka inzulínu alebo sulfonylmočoviny, ak sa používa v kombinácii s Glyxambi (pozri časti 4.2, 4.4 a 4.8).
Diuretiká
Empagliflozín môže prispieť k diuretickému účinku tiazidu a kľučkových diuretík a môže zvýšiť
riziko dehydratácie a hypotenzie (pozri časť 4.4).
Farmakokinetické interakcie
Účinky iných liekov na empagliflozín
Empagliflozín sa väčšinou vylučuje v nezmenenej forme. Malá časť sa metabolizuje prostredníctvom
uridín-5-difosfoglukuronozyltransferázy (UGT), a preto sa neočakáva klinicky významný účinok inhibítorov UGT na empagliflozín (pozri časť 5.2). Účinok indukcie UGT na empagliflozín sa neskúmal. Má sa predísť súbežnému podávaniu so známymi induktormi enzýmov UGT z dôvodu rizika zníženej účinnosti empagliflozínu.
Súbežné podávanie empagliflozínu s probenecidom, inhibítorom enzýmov UGT a OAT3, viedlo
k 26 % zvýšeniu maximálnych plazmatických koncentrácií (Cmax) empagliflozínu a k 53 % zvýšeniu plochy pod krivkou závislosti koncentrácie od času (AUC). Tieto zmeny sa nepovažovali za klinicky významné.
Interakčná štúdia s gemfibrozilom, inhibítorom transportérov OAT3 a OATP1B1/1B3 in vitro, preukázala, že sa po súbežnom podaní zvýšila Cmax empagliflozínu o 15 % a AUC o 59 %. Tieto zmeny sa nepovažovali za klinicky významné.
Inhibícia transportérov OATP1B1/1B3 v dôsledku súbežného podávania s rifampicínom viedla k 75 % zvýšeniu Cmax a k 35 % zvýšeniu AUC empagliflozínu. Tieto zmeny sa nepovažovali za klinicky významné.
Interakčné štúdie vykonané u zdravých dobrovoľníkov naznačujú, že farmakokinetika empagliflozínu nebola ovplyvnená súbežným podávaním s metformínom, glimepiridom, pioglitazónom, sitagliptínom, linagliptínom, warfarínom, verapamilom, ramiprilom, simvastatínom, torasemidom a hydrochlórotiazidom.
Účinky empagliflozínu na iné lieky
Interakčné štúdie vykonané u zdravých dobrovoľníkov naznačujú, že empagliflozín nemá žiadny
klinicky významný účinok na farmakokinetiku metformínu, glimepiridu, pioglitazónu, sitagliptínu, linagliptínu, simvastatínu, warfarínu, ramiprilu, digoxínu, diuretík a perorálnych kontraceptív.
Účinky iných liekov na linagliptín
Súbežné podávanie s rifampicínom znížilo expozíciu linagliptínu o 40 %, čo naznačuje, že účinnosť
linagliptínu môže poklesnúť pri podávaní v kombinácii so silným induktorom P-glykoproteínu (P-gp) alebo izozýmu CYP3A4 cytochrómu P450 (CYP), najmä ak sa podávajú dlhodobo (pozri časť 5.2). Súbežné podávanie s inými silnými induktormi P-gp a CYP3A4, ako je karbamazepín, fenobarbital
a fenytoín, sa neskúmalo.
Súbežné podanie jednorazovej perorálnej dávky 5 mg linagliptínu a opakovaných perorálnych dávok
200 mg ritonaviru, silného inhibítora P-glykoproteínu a CYP3A4, zvýšilo AUC linagliptínu približne dvojnásobne a Cmax trojnásobne. Koncentrácie neviazaného liečiva, ktoré sú pri terapeutickej dávke linagliptínu zvyčajne menšie než 1 %, sa po súbežnom podaní ritonaviru zvýšili 4- až 5-násobne. Simulácie plazmatických koncentrácií linagliptínu v rovnovážnom stave s ritonavirom a bez ritonaviru ukázali, že zvýšenie expozície nebude spojené so zvýšenou kumuláciou. Tieto zmeny vo farmakokinetike linagliptínu sa nepovažovali za klinicky významné. Preto sa nepredpokladajú
klinicky významné interakcie s inými inhibítormi P-glykoproteínu/CYP3A4.
Interakčné štúdie vykonané u zdravých dobrovoľníkov naznačujú, že farmakokinetika linagliptínu
nebola ovplyvnená súbežným podávaním s metformínom a glibenklamidom.
Účinky linagliptínu na ďalšie lieky
Linagliptín je na základe mechanizmu slabý kompetitívny a slabý až stredne silný inhibítor CYP
izoenzýmu CYP3A4, no neinhibuje iné CYP izoenzýmy. Nie je induktorom CYP izoenzýmov. Linagliptín je substrát P-glykoproteínu a s nízkou účinnosťou inhibuje transport digoxínu sprostredkovaný P-glykoproteínom.
Linagliptín nemal žiaden klinicky významný účinok na farmakokinetiku metformínu, glibenklamidu, simvastatínu, pioglitazónu, warfarínu, digoxínu, empagliflozínu alebo perorálnych kontraceptív, čo poskytuje in vivo dôkaz o nízkej pravdepodobnosti vzniku liekových interakcii so substrátmi CYP3A4, CYP2C9, CYP2C8, P-gp a organického katiónového transportéra (OCT).
4.6 Fertilita, gravidita a laktácia
Účinky Glyxambi na graviditu, laktáciu a fertilitu nie sú známe. Účinky spojené s jednotlivými liečivami sú opísané nižšie.
Gravidita
Nie sú k dispozícii žiadne údaje o použití empagliflozínu a linagliptínu u gravidných žien.
Štúdie na zvieratách preukazujú, že empagliflozín a linagliptín v neskorom štádiu gravidity prechádzajú placentou, ale ani empagliflozín ani linagliptín nenaznačujú priame ani nepriame účinky z
hľadiska skorého embryonálneho vývoja (pozri časť 5.3). Štúdie na zvieratách s empagliflozínom však
preukázali nežiaduce účinky na postnatálny vývin (pozri časť 5.3). Ako preventívne opatrenie je vhodnejšie vyhnúť sa užívaniu lieku Glyxambi počas gravidity.
Dojčenie
O vylučovaní empagliflozínu a linagliptínu do mlieka nie sú u ľudí k dispozícii žiadne údaje.
Dostupné predklinické údaje pri zvieratách preukázali vylučovanie empagliflozínu a linagliptínu do mlieka. Riziko u novorodencov alebo dojčiat nemožno vylúčiť. Glyxambi sa nemá používať počas
dojčenia.
Fertilita
Nevykonali sa žiadne štúdie o účinku lieku Glyxambi alebo jednotlivých liečiv na fertilitu u ľudí.
Predklinické štúdie s empagliflozínom alebo linagliptínom ako samostatným liečivom nepreukázali priame ani nepriame účinky z hľadiska fertility (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Glyxambi má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti majú byť poučení, aby počas vedenia vozidiel a obsluhy strojov vykonali opatrenia na zabránenie hypoglykémii, najmä ak sa Glyxambi používa v kombinácii s inými antidiabetikami, o ktorých je známe, že spôsobujú hypoglykémiu (inzulín a analógy, sulfonylmočoviny).
4.8 Nežiaduce účinky
Súhrn profilubezpečnosti
Najčastejšia nežiaduca reakcia bola infekcia močových ciest (7,5 % s Glyxambi 10 mg empagliflozín/
5 mg linagliptín a 8,5 % s Glyxambi 25 mg empagliflozín/5 mg linagliptín) (pozri Popis vybraných nežiaducich reakcií). Najzávažnejšie nežiaduce reakcie boli ketoacidóza (< 0,1 %), pankreatítída
(0,2 %), precitlivenosť (0,6 %) a hypoglykémia (2,4 %) (pozri časť 4.4).
Celkovo je bezpečnostný profil Glyxambi v súlade s bezpečnostnými profilmi jednotlivých liečiv
(empagliflozín a linagliptín). Pri Glyxambi neboli zistené žiadne ďalšie nežiaduce reakcie.
Nežiaduce reakcie uvedené v tabuľke nižšie (pozri tabuľku 1) sú zoradené podľa tried orgánových systémov a na základe bezpečnostných profilov monoliečby empagliflozínom a linagliptínom. Informácie o nežiaducich reakciách, ktoré neboli hlásené v klinických skúšaniach s Glyxambi, vychádzajú zo skúseností s empagliflozínom a linagliptínom. Nežiaduce reakcie označené hviezdičkou (*) sú podrobnejšie opísané v časti „Popis vybraných nežiaducich reakcií“ nižšie.
Tabuľkový zoznamnežiaducichreakcií
Frekvencie sú definované ako veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté
(≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) alebo neznáme (z dostupných údajov).
Tabuľka 1 Nežiaduce reakcie
Trieda orgánových systémov Frekvencia výskytu Nežiaduca reakcia
Infekcie a nákazy Časté Infekcia močových ciest1,*
Časté
Časté
Vaginálna kandidóza, vulvovaginitída, balanitída a iné infekcie pohlavných orgánov1,*
Nazofaryngitída2
Poruchy imunitného systému Menej časté Precitlivenosť2
Menej časté Angioedém3, urtikária3
Poruchy metabolizmu a výživy Časté
Zriedkavé
Hypoglykémia (pri užívaní so sulfonylmočovinou alebo inzulínom)* Diabetická ketoacidóza4,#
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté Kašeľ2
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Menej časté
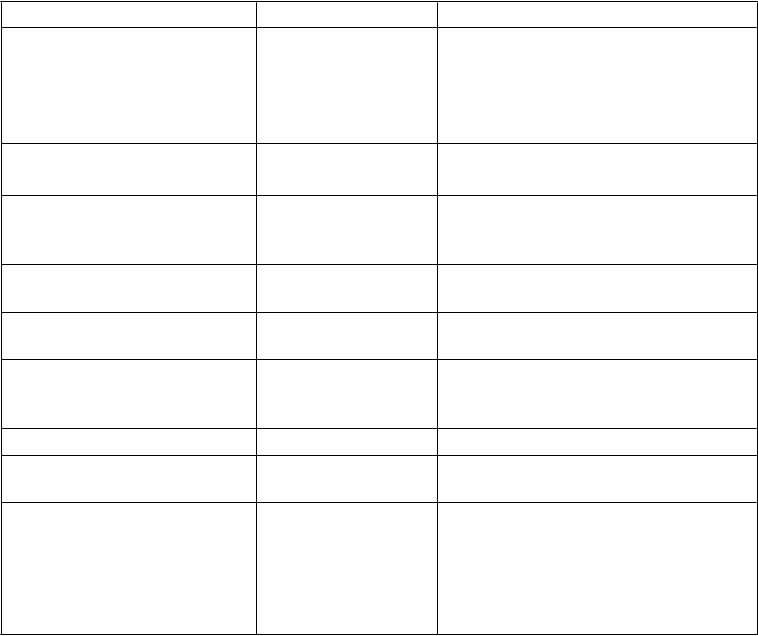
Zriedkavé
Časté Časté Neznáme
Pankreatitída2
Vred v ústach3
Pruritus1
Vyrážka3
Bulózny pemfigoid3
Poruchy ciev Menej časté Deplécia objemu1,*
Poruchy obličiek a močových ciest
Laboratórne a funkčné vyšetrenia
Časté
Menej časté
Časté
Časté
Menej časté Menej časté Menej časté
Zvýšená miera močenia1,*
Dyzúria1
Zvýšená hladina amylázy2
Zvýšená hladina lipázy2
Zvýšený hematokrit1,5
Zvýšená hladina lipidov v sére1,6
Zvýšená hladina kreatinínu v krvi/pokles glomerulárnej filtrácie1,*
1 vyplýva zo skúseností s empagliflozínom
2 vyplýva zo skúseností s linagliptínom
3 vyplýva zo skúseností po uvedení linagliptínu na trh
4 vyplýva zo skúseností po uvedení empagliflozínu na trh
5 Priemerné zmeny v porovnaní s východiskovou hodnotou hematokritu boli 3,3 % pre Glyxambi 10 mg/5 mg and
a 4,2 % pre Glyxambi 25 mg/5 mg, v porovnaní s 0,2 % pre placebo. V klinickom skúšaní empagliflozínu sa hodnoty hematokritu vrátili späť k východiskovým hodnotám po 30-dňovom období sledovania po ukončení liečby.
6 Priemerné percentuálne nárasty v porovnaní s východiskovými hodnotami Glyxambi 10 mg/5 mg a 25 mg/5 mg
oproti placebu boli pre celkový cholesterol 3,2 % a 4,6 % oproti 0,5 %, pre HDL-cholesterol 8,5 % a 6,2 % oproti
0,4 %, pre LDL-cholesterol 5,8 % a 11,0 % oproti 3,3 %, pre triglyceridy 0,5 % a 3,3 % oproti 6,4 %.
# pozri časť 4.4
Popis vybranýchnežiaducichreakcií
Hypoglykémia
V združených klinických skúšaniach s Glyxambi u pacientov s diabetes mellitus 2. typu a s
nedostatočnou kontrolou glykémie pri metformíne bola frekvencia hlásených hypoglykemických udalostí 2,4 %. Výskyt potvrdených hypoglykemických udalostí bol nízky (< 1,5 %). Nebol prítomný žiadny viditeľný rozdiel vo výskyte u pacientov liečených rôznymi silami dávok Glyxambi v porovnaní s liečbou empagliflozínom alebo linagliptínom.
Jeden pacient zaznamenal po podaní Glyxambi potvrdenú (definovanú skúšajúcim) veľkú hypoglykemickú udalosť (definovanú ako udalosť vyžadujúcu pomoc) v aktívne alebo placebom kontrolovaných skúšaniach (celková frekvencia výskytu 0,1 %).
Na základe skúseností s empagliflozínom a linagliptínom sa očakáva nárast rizika hypoglykémie pri súbežne liečbe inzulínom a/alebo sulfonylmočovinou (pozri časť 4.4 a informácie nižšie).
Hypoglykémia pri empagliflozíne
Frekvencia výskytu hypoglykémie závisela od základnej liečby v príslušných štúdiách a bola podobná ako pri monoliečbe empagliflozínom a placebom vo forme prídavnej liečby k liečbe metformínom a
vo forme prídavnej liečby k liečbe pioglitazónom +/− metformín. Frekvencia pacientov s hypoglykémiou sa zvýšila u pacientov liečených empagliflozínom v porovnaní s placebom, ak sa liek
podával vo forme prídavnej liečby k metformínu a sulfonylmočovine (10 mg empagliflozínu: 16,1 %,
25 mg empagliflozínu: 11,5 %, placebo: 8,4 %) a vo forme prídavnej liečby k inzulínu +/− metformín a +/− sulfonylmočovina (10 mg empagliflozínu: 19,5 %, 25 mg emplagliflozínu: 27,1 %, placebo:
20,6 % počas úvodných 18 týždňov liečby, keď nebolo možné upravovať dávku inzulínu; 10 mg
empagliflozínu: 36,1 %, 25 mg empagliflozínu: 34,8 %, placebo: 35,3 % počas 78-týždňového skúšania).
Závažná hypoglykémia pri empagliflozíne (udalosti vyžadujúce pomoc)
Frekvencia pacientov s veľkými hypoglykemickými udalosťami bola nízka (< 1 %) a bola podobná ako pri monoterapii empagliflozínom a placebom vo forme prídavnej liečby k liečbe metformínom a vo forme prídavnej liečby k liečbe pioglitazónom +/- metformín.
Frekvencia pacientov so závažnými hypoglykemickými udalosťami sa zvýšila u pacientov liečených empagliflozínom v porovnaní s placebom, ak sa liek podával vo forme prídavnej liečby k metformínu a sulfonylmočovine alebo vo forme prídavnej liečby k inzulínu +/- metformín a +/- sulfonylmočovina (10 mg empagliflozínu: 0 %, 25 mg emplagliflozínu: 1,3 %, placebo: 0 % počas úvodných 18 týždňov liečby, keď nebolo možné upravovať dávku inzulínu; 10 mg empagliflozínu: 0 %, 25 mg empagliflozínu: 1,3 %, placebo: 0 % počas 78-týždňového skúšania).
Hypoglykémia pri linagliptíne
Najčastejšie hlásenou nežiaducou reakciou v klinických skúšaniach s linagliptínom bola hypoglykémia, ktorá sa pozorovala pri trojkombinácii linagliptín plus metformín plus sulfonylmočovina (22,9 % verzus 14,8 % pri placebe).
Hypoglykémie v placebom kontrolovaných štúdiách (10,9 %; N= 471) boli mierne (80 %; N= 384), stredne závažné (16,6 %; N= 78) alebo závažné (1,9 %; N= 9).
Infekcia močových ciest
V klinických skúšaniach s Glyxambi sa nepozoroval významný rozdiel vo frekvencii infekcií
močových ciest u pacientov liečených Glyxambi (Glyxambi 25 mg/5 mg: 8,5 %; Glyxambi
10 mg/5 mg: 7,5 %) v porovnaní s pacientami liečenými empagliflozínom a linagliptínom. Frekvencie sú porovnateľné s frekvenciami hlásenými z klinických skúšaní s empagliflozínom (pozri aj časť 4.4).
V skúšaniach s empagliflozínom bola celková frekvencia výskytu infekcie močových ciest u pacientov liečených 25 mg empagliflozínu a placebom (7,6 %) podobná a u pacientov liečených 10 mg empagliflozínu (9,3 %) bola vyššia. Podobne ako pri placebe sa infekcia močových ciest hlásila častejšie pri empagliflozíne u pacientov s chronickými alebo opätovne sa vyskytujúcimi infekciami močových ciest v anamnéze. Závažnosť infekcií močových ciest bola podobná u pacientov liečených placebom s hláseniami miernej, strednej a závažnej intenzity. Infekcia močových ciest sa hlásila častejšie u žien liečených empagliflozínom v porovnaní s placebom; u mužov však táto situácia nenastala.
Vaginálna kandidóza, vulvovaginitída, balanitída a iná infekcia pohlavných orgánov
V klinických skúšaniach s Glyxambi boli infekcie pohlavných orgánov u pacientov liečených
Glyxambi (Glyxambi 25 mg/5 mg: 3,0 %; Glyxambi 10 mg/5 mg: 2,5 %) hlásené častejšie ako pri linagliptíne, ale menej často ako pri empagliflozíne. Celkovo sú frekvencie pri Glyxambi porovnateľné
s frekvenciami hlásenými z klinických skúšaní s empagliflozínom.
V skúšaniach s empagliflozínom sa častejšie hlásila vaginálna kandidóza, vulvovaginitída, balanitída a iné infekcie pohlavných orgánov pri 10 mg empagliflozínu (4,1 %) a 25 mg empagliflozínu (3,7 %) v porovnaní s placebom (0,9 %). Tieto infekcie sa hlásili častejšie u žien liečených empagliflozínom v porovnaní s placebom a odlišnosť vo frekvencii výskytu bola menej výrazná u mužov. Intenzita infekcií pohlavných orgánov bola mierna až stredne závažná, žiadna nebola závažná.
Zvýšená miera močenia
V klinických skúšaniach s Glyxambi bola zvýšená miera močenia u pacientov liečených Glyxambi
(Glyxambi 25 mg/5 mg: 2,6 %; Glyxambi 10 mg/5 mg: 1,4 %) hlásená častejšie ako pri linagliptíne, a s podobnou frekvenciou ako pri empagliflozíne. Celkovo sú frekvencie pri Glyxambi porovnateľné s frekvenciami hlásenými z klinických skúšaní s empagliflozínom.
V klinických skúšaniach s empagliflozínom sa zvýšená miera močenia (vrátane vopred definovanej polakizúrie, polyúrie a noktúrie) vo vyšších frekvenciách pozorovala u pacientov liečených empagliflozínom (10 mg empagliflozínu: 3,4 %, 25 mg empagliflozínu: 3,2 %) v porovnaní s placebom (1,0 %). Intenzita zvýšenej miery močenia bola mierna až stredne závažná. Frekvencia výskytu hlásenej noktúrie bola pri placebe a empagliflozíne podobná (< 1 %).
Deplécia objemu
V klinických skúšaniach s Glyxambi sa nepozoroval viditeľný rozdiel vo frekvencii deplécie objemu u
pacientov liečených Glyxambi (Glyxambi 25 mg/5 mg: 0,4 %; Glyxambi 10 mg/5 mg: 0,8 %) v porovnaní s pacientami liečenými empagliflozínom a linagliptínom. Frekvencie sú porovnateľné s frekvenciami hlásenými z klinických skúšaní s empagliflozínom.
V klinických skúšaniach s empagliflozínom bola celková frekvencia výskytu deplécie objemu (vrátane vopred definovaných pojmov zníženého krvného tlaku (ambulantne), zníženého systolického krvného tlaku, dehydratácie, hypotenzie, hypovolémie, ortostatickej hypotenzie a synkopy) u pacientov liečených empagliflozínom (10 mg empagliflozínu: 0,5 %, 25 mg empagliflozínu: 0,3 %) a placebom (0,3 %) podobná. U pacientov vo veku 75 rokov a starších liečených 10 mg empagliflozínu (2,3 %) alebo 25 mg empagliflozínu (4,4 %) bola frekvencia výskytu deplécie objemu v porovnaní s placebom (2,1 %) zvýšená.
Zvýšená hladina kreatinínu v krvi/pokles glomerulárnej filtrácie
V klinických skúšaniach s Glyxambi boli frekvencia pacientov so zvýšenou hladinou kreatinínu v krvi
(Glyxambi 25 mg/5 mg: 0,4 %; Glyxambi 10 mg/5 mg: 0 %) a pokles rýchlosti glomerulárnej filtrácie (Glyxambi 25 mg/5 mg: 0,4 %; Glyxambi 10 mg/5 mg: 0,6 %) porovnateľné s hodnotami z klinického skúšania empagliflozínu.
Celková frekvencia výskytu pacientov so zvýšenou hladinou kreatinínu v krvi a poklesom glomerulárnej filtrácie bola podobná pri empagliflozíne a placebe (nárast kreatinínu v krvi:
empagliflozín 10 mg 0,6 %, empagliflozín 25 mg 0,1 %, placebo 0,5 %, pokles glomerulárnej filtrácie:
empagliflozín 10 mg 0,1 %, empagliflozín 25 mg 0 %, placebo 0,3 %).
Staršie osobyV klinických skúšaniach bolo devätnásť pacientov vo veku 75 rokov a starších liečených s Glyxambi. Žiadny pacient nebol starší ako 85 rokov. Bezpečnostný profil Glyxambi sa u starších osôb nelíšil. Na
základe skúseností s empagliflozínom môže byť u starších osôb vyššie riziko deplécie objemu (pozri
časti 4.2, 4.4 a 5.2).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
PríloheV.4.9 PredávkovaniePríznakyJednorazové dávky až do 800 mg empagliflozínu (čo zodpovedá 32-násobku najvyššej odporúčanej
dennej dávky) u zdravých dobrovoľníkov a opakované denné dávky až do 100 mg empagliflozínu (čo zodpovedá 4-násobku najvyššej odporúčanej dennej dávky) u pacientov s diabetes mellitus 2. typu
nepreukázali v kontrolovaných klinických štúdiách žiadny toxický účinok. Empagliflozín zvýšil vylučovanie glukózy močom, čo viedlo k zvýšeniu objemu moču. Pozorované zvýšenie objemu moču
nezáviselo od dávky. U ľudí neexistujú žiadne skúsenosti s dávkami nad 800 mg.
Počas kontrolovaných klinických štúdii so zdravými jedincami sa celkovo dobre tolerovali jednorazové dávky do 600 mg linagliptínu (čo zodpovedá 120-násobku odporúčanej dávky). U ľudí nie sú žiadne skúsenosti s dávkami nad 600 mg.
LiečbaV prípade predávkovania je odôvodnené uplatniť bežné podporné opatrenia, napr. odstrániť
neabsorbovaný materiál z gastrointestinálneho traktu, použiť klinické monitorovanie a podľa potreby klinické opatrenia v nemocnici.
Odstránenie empagliflozínu hemodialýzou sa neskúmalo. Nepredpokladá sa eliminácia linagliptínu hemodialýzou alebo peritoneálnou dialýzou v terapeuticky významnom rozsahu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antidiabetiká, kombinácie perorálnych antidiabetík, ATC kód: A10BD19
Mechanizmus účinku
Glyxambi kombinuje dva lieky na liečbu hyperglykémie s komplementárnym mechanizmom účinku
na zlepšenie kontroly glykémie u pacientov s diabetes mellitus 2. typu: empagliflozín, inhibítor kotransportéra sodíka a glukózy (SGLT2), a linagliptín, inhibítor DPP-4.
Empagliflozín
Empagliflozín je reverzibilný, vysoko účinný (IC50 1,3 nmol) a selektívny kompetitívny inhibítor
SGLT2. Empagliflozín neinhibuje iné transportéry glukózy, ktoré sú dôležité pre transport glukózy do
periférnych tkanív, a je 5 000-násobne selektívnejší pre SGLT2 v porovnaní so SGLT1, hlavným transportérom zodpovedným za vstrebávanie glukózy v čreve.
SGLT2 je vo vysokej miere exprimovaný v obličkách, zatiaľ čo k jeho expresii v iných tkanivách nedochádza alebo je veľmi nízka. Ako hlavný transportér zodpovedá za reabsorpciu glukózy z glomerulárneho filtrátu späť do krvného obehu. U pacientov s diabetes mellitus 2. typu a hyperglykémiou sa prefiltruje a reabsorbuje väčšie množstvo glukózy.
Empagliflozín zlepšuje kontrolu glykémie u pacientov s diabetes mellitus 2. typu znížením reabsorpcie glukózy v obličkách. Množstvo glukózy vylúčené obličkami prostredníctvom tohto mechanizmuc vylučovania glukózy do moču závisí od koncentrácie glukózy v krvi a GFR. Inhibícia SGLT2 u pacientov s diabetes mellitus 2. typu a hyperglykémiou vedie k rozsiahlemu vylučovaniu glukózy do moču.
U pacientov s diabetes mellitus 2. typu sa vylučovanie glukózy močom zvýšilo okamžite po prvej dávke empagliflozínu a pretrvávalo počas 24-hodinového intervalu dávkovania. Zvýšené vylučovanie glukózy močom sa na konci 4-týždňového obdobia liečby udržalo, pričom priemer bol približne
78 g/deň. Zvýšené vylučovanie glukózy močom viedlo u pacientov s diabetes mellitus 2. typu k okamžitému zníženiu plazmatickej hladiny glukózy.
Empagliflozín zlepšuje plazmatickú hladinu glukózy nalačno a aj po jedle. Mechanizmus účinku empagliflozínu nie je závislý od funkcie beta buniek a dráhy inzulínu a to prispieva k nízkemu riziku hypoglykémie. Zaznamenalo sa zlepšenie náhradných ukazovateľov funkcie beta buniek vrátane hodnotenia pomocou modelu homeostázy β (Homeostasis Model Assessment β, HOMA β). Navyše vylučovanie glukózy močom spúšťa úbytok kalórií spojený s úbytkom telesného tuku a znížením telesnej hmotnosti. Glukozúria pozorovaná pri empagliflozíne je spojená s miernou diurézou, ktorá môže prispievať k pretrvávajúcemu a stredne závažnému zníženiu krvného tlaku.
Linagliptín
Linagliptín je inhibítor enzýmu DPP-4, enzýmu, ktorý sa podieľa na inaktivácii inkretínových
hormónov GLP-1 a GIP (glukagónu podobný peptid-1, glukózo-dependentný inzulínotropný polypeptid). Tieto hormóny sa rýchlo rozkladajú enzýmom DPP-4. Obidva inkretínové hormóny sú
zapojené do fyziologickej regulácie homeostázy glukózy. Inkretíny sa vylučujú pri nízkej bazálnej
hladine počas dňa a hladiny stúpajú bezprostredne po požití jedla. GLP-1 a GIP zvyšujú biosyntézu inzulínu a sekréciu z pankreatických beta buniek v prítomnosti normálnych alebo zvýšených hladín
glukózy v krvi. Okrem toho GLP-1 znižuje aj sekréciu glukagónu z pankreatických alfa buniek, čo
vedie k zníženiu výdaja glukózy pečeňou. Linagliptín sa veľmi účinne reverzibilným spôsobom viaže na DPP-4, a tak vedie k trvalému zvýšeniu a predĺženiu hladín aktívneho inkretínu. Linagliptín zvyšuje sekréciu inzulínu v závislosti od glukózy a znižuje sekréciu glukagónu, čo vedie k celkovému zlepšeniu glukózovej homeostázy. Linagliptín sa selektívne viaže na DPP-4 a vykazuje
> 10 000-násobnú selektivitu oproti aktivite DPP-8 alebo DPP-9 in vitro.
Klinická účinnosťabezpečnosť
Do klinických štúdií na vyhodnotenie bezpečnosti a účinnosti Glyxambi bolo zaradených celkovo
2 173 pacientov s diabetes mellitus 2. typu a nedostatočnou kontrolou glykémie. 1 005 pacientov bolo liečených Glyxambi 10 mg empagliflozínu/5 mg linagliptínu alebo 25 mg empagliflozínu/5 mg linagliptínu. V klinických skúšaniach boli pacienti liečení maximálne 24 alebo 52 týždňov.
Glyxambi ako prídavná liečba k metformínu
Pacienti štúdie s faktoriálnym dizajnom s nedostatočnou kontrolou pri metformíne boli liečení
24 týždňov s Glyxambi 10 mg/5 mg, Glyxambi 25 mg/5 mg, empagliflozínom 10 mg, empagliflozínom 25 mg alebo linagliptínom 5 mg. Liečba s Glyxambi viedla k štatisticky významnému zlepšeniu HbA1c a hladiny glukózy nalačno (FPG) v porovnaní s 5 mg linagliptínu, ako aj v porovnaní s 10 mg alebo 25 mg empagliflozínu. Glyxambi spôsobil aj štatisticky významné zlepšenie telesnej hmotnosti v porovnaní s linagliptínom 5 mg.
Tabuľka 2 Parametre účinnosti v klinickej štúdii porovnávajúcej Glyxambi s jednotlivými liečivami ako prídavnú liečbu u pacientov s nedostatočnou kontrolou pri metformíne
Glyxambi
2
5 mg/5 mg
Glyxambi
1
0 mg/5 mg
e
m
pagliflozín
2
5 mg
e
m
pagliflozín
1
0 mg
linagliptín
5 mg
Primárny koncový ukazovateľ: HbA
1c
(
%
) – 24 týždňov
Počet analyzovaných pacientov
Priemerná východisková hodnota (SE)
Zmena v porovnaní s východiskovou hodnotou v 24. týždni1:
- upravený priemer2 (SE)
134 135 140 137 128
7,90 (0,07) 7,95 (0,07) 8,02 (0,07) 8,00 (0,08) 8,02 (0,08)
−1,19 (0,06) −1,08 (0,06) −0,62 (0,06) −0,66 (0,06) −0,70 (0,06)
Porovnanie s empagliflozínom1:
- upravený priemer2 (SE)
- 95,0 % CI
- p-hodnota
Porovnanie s linagliptínom 5 mg1:
- upravený priemer2 (SE)
- 95,0 % CI
- p-hodnota
v porovnaní s
25 mg
−0,58 (0,09)
−0,75; −0,41
< 0,0001
−0,50 (0,09)
−0,67; −0,32
< 0,0001
v porovnaní s
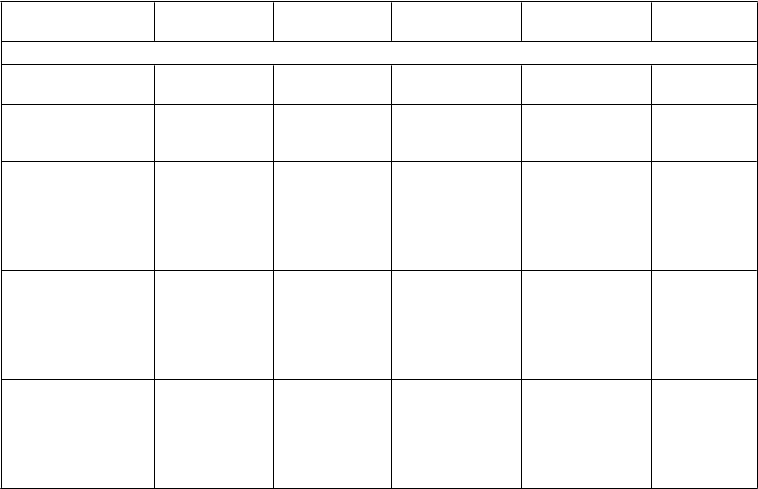
10 mg
−0,42 (0,09)
-0,59; -0,25
< 0,0001
−0,39 (0,09)
−0,56; −0,21
< 0,0001
-- -- --
-- -- --
1 Prevod hodnôt posledného sledovania (pred záchrannou liečbou glykémie) (LOCF)
2 Priemer upravený podľa východiskovej hodnoty a stratifikácie
V preddefinovanej podskupine pacientov s východiskovou hodnotou HbA1c vyššou alebo rovnajúcou
sa 8,5 % bol pokles od východiskovej hodnoty v HbA1c s Glyxambi 25 mg/5 mg −1,8 % po
24 týždňoch (p < 0,0001 v porovnaní s linagliptínom 5 mg, p < 0,001 v porovnaní s empagliflozínom
25 mg) a s Glyxambi 10 mg/5 mg −1,6 % (p < 0,01 v porovnaní s linagliptínom 5 mg, n.s. v porovnaní s empagliflozínom 10 mg).
Celkovo, účinky na redukciu HbA1c pozorované v 24. týždni pretrvávali aj v 52. týždni.
Empagliflozín u pacientov s nedostatočnou kontrolou pri metformíne a linagliptíne
Pacientom s nedostatočnou kontrolou pri maximálnej tolerovanej dávke metformínu bola po dobu
16 týždňov pridaná otvorená liečba linagliptínom 5 mg. Pacientom s nedostatočnou kontrolou po tomto 16-týždňovom období bola podaná dvojito zaslepená liečba s empagliflozínom 10 mg, empagliflozínom 25 mg alebo placebom po dobu 24 týždňov. Po tomto dvojito zaslepenom období liečba s empagliflozínom 10 mg a empagliflozínom 25 mg preukázala štatisticky významné zlepšenia HbA1c, FPG a telesnej hmotnosti s porovnaní s placebom. Všetci pacienti počas štúdie pokračovali v liečbe metformínom a linagliptínom 5 mg. Štatisticky významný väčší počet pacientov s východiskovou hodnotou HbA1c ≥ 7,0 % liečených obidvoma dávkami empagliflozínu dosiahol cieľovú hodnotu HbA1c < 7 % v porovnaní s placebom (pozri tabuľku 3). Po 24-týždňovej liečbe empagliflozínom klesol systolický aj diastolický krvný tlak, −2,6/−1,1 mmHg (n.s. v porovnaní s placebom pre SBP a DBP) s empagliflozínom 25 mg a −1,3/−0,1 mmHg (n.s. v porovnaní s placebom pre SBP a DBP) s empagliflozínom 10 mg.
Po 24 týždňoch bola použitá záchranná liečba u 4 (3,6 %) pacientov liečených empagliflozínom 25 mg a u 2 (1,8 %) pacientov liečených empagliflozínom 10 mg v porovnaní s 13 (12,0 %) pacientmi liečenými placebom (všetci pacienti liečení základnou liečbou metformínom + linagliptínom 5 mg).
Tabuľka 3 Parametre účinnosti v klinickej štúdii porovnávajúcej empagliflozín s placebom ako prídavnú liečbu u pacientov s nedostatočnou kontrolou pri metformíne a linagliptíne 5 mg
HbA
1c
(%
) – 24 týždňov
3
metformín + linagliptín 5 mg
e
m
pagliflozín 10 mg
1
e
m
pagliflozín 25 mg
1
placebo
2
N 109 110 106
Východisková hodnota (priemer) 7,97 7,97 7,96
Zmena od východiskovej
hodnoty
(upravený priemer)
−0,65 −0,56 0,14
Porovnanie s placebom: (upravený priemer)
(95 % CI)2
Telesná hmotnosť – 24
týždňov 3
−0,79 (−1,02; −0,55) P < 0,0001
−0,70 (−0,93; −0,46) P < 0,0001
N 109 110 106
Východisková hodnota (priemer)
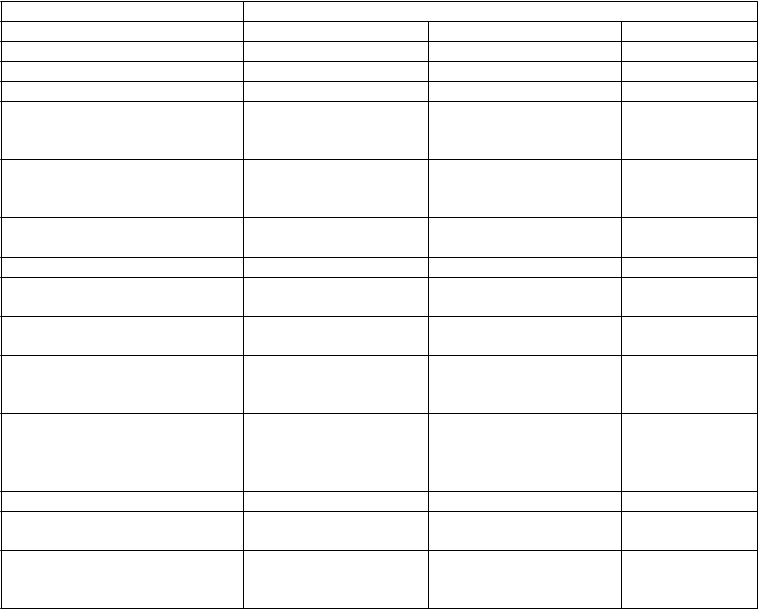
v kg
Zmena od východiskovej hodnoty (upravený priemer)
88,4 84,4 82,3
−3,1 −2,5 −0,3
Porovnanie s placebom
(upravený priemer) (95 % CI)1
Pacienti (%), ktorí dosiahli HbA1c < 7 % s východiskovou hodnotou HbA1c ≥ 7 % –
24 týždňov 4
−2,8 (−3,5; −2,1) P < 0,0001
−2,2 (−2,9; −1,5) p < 0,0001
N 100 107 100
Pacienti (%), ktorí dosiahli A1C
< 7 % 37,0 32,7 17,0
Porovnanie s placebom (pomer šancí) (95 % CI)5
4,0 (1,9; 8,7)
2,9 (1,4; 6,1)
1 Pacienti randomizovaní do skupín s empagliflozínom 10 mg alebo 25 mg dostávali Glyxambi 10 mg/5 mg alebo 25 mg/5 mg so základnou liečbou metformínom.
2 Pacienti randomizovaní do skupiny s placebom dostávali placebo s linagliptínom 5 mg so základnou liečbou metformínom.
3 Modely zmiešaných účinkov pre opakované merania (MMRM) pri celom analyzovanom súbore FAS (OC) zahŕňajú východiskovú hodnotu HbA1c, východiskovú hodnotu eGFR (MDRD), geografickú oblasť, návštevu, liečbu a liečbu
podľa interakcie pri návšteve. Pre FPG je uvedená aj východisková hodnota FPG. Pre hmotnosť je uvedená aj východisková hodnota hmotnosti.
4 Nehodnotené z hľadiska štatistickej významnosti, nie je súčasťou sekvenčného testovania pre sekundárne koncové ukazovatele.
5 Logistická regresia pri FAS (NCF) zahŕňa východiskovú hodnotu HbA1c, východiskovú hodnotu eGRF (MDRD), geografickú oblasť a liečbu, na základe pacientov s HbA1c 7 % a viac na začiatku liečby.
V preddefinovanej podskupine pacientov s východiskovou hodnotou HbA1c vyššou alebo rovnajúcou sa 8,5 % bol pokles od východiskovej hodnoty v HbA1c s empagliflozínom 25 mg/linagliptín 5 mg
−1,3 % po 24 týždňoch (p < 0,0001 v porovnaní s placebom a linagliptínom 5 mg) a s
empagliflozínom 10 mg/linagliptínom 5 mg −1,3 % po 24 týždňoch (p < 0,0001 v porovnaní s placebom a linagliptínom 5 mg).
Linagliptín 5 mg u pacientov s nedostatočnou kontrolou pri metformíne a empagliflozíne 10 mg a
empagliflozíne 25 mg
Pacientom s nedostatočnou kontrolou pri maximálnej tolerovanej dávke metformínu bola po dobu
16 týždňov pridaná otvorená liečba empagliflozínom 10 mg alebo empagliflozínom 25 mg. Pacientom s nedostatočnou kontrolou po tomto 16-týždňovom období bola podaná dvojito zaslepená liečba s
linagliptínom 5 mg alebo placebom po dobu 24 týždňov. Po tomto dvojito zaslepenom období u oboch
populácií (metformín + empagliflozín 10 mg a metformín + empagliflozín 25 mg) liečba s linagliptínom 5 mg preukázala štatisticky významné zlepšenia HbA1c v porovnaní s placebom. Všetci pacienti počas štúdie pokračovali s liečbou metformínom a empagliflozínom. Štatisticky významný väčší počet pacientov s východiskovou hodnotou HbA1c ≥ 7,0 % liečených linagliptínom dosiahol cieľovú hodnotu HbA1c < 7 % v porovnaní s placebom (pozri tabuľku 4).
Tabuľka 4 Parametre účinnosti v klinických štúdiách porovnávajúcich Glyxambi 10 mg/5 mg s empagliflozínom 10 mg, ako aj Glyxambi 25 mg/5 mg s empagliflozínom 25 mg vo forme prídavnej liečby u pacientov s nedostatočnou kontrolou s empagliflozínom
10 mg/25 mg a metformínom
metformín +
e
m
pagliflozín 10 mg
metformín +
e
m
pagliflozín 25 mg
HbA
1c
(%
) – 24 týždňov
1
linagliptín 5 mg placebo linagliptín 5 mg placebo
N 122 125 109 108
Východisková hodnota (priemer) 8,04 8,03 7,82 7,88
Zmena od východiskovej hodnoty
(upravený priemer) −0,53 −0,21 −0,58 −0,10
Porovnanie s placebom (upravený priemer) (95 % CI)
Pacienti (%), ktorí dosiahli HbA1c < 7 % s východiskovou hodnotou HbA1c ≥ 7 % –24 týždňov 2−0,32 (−0,52;
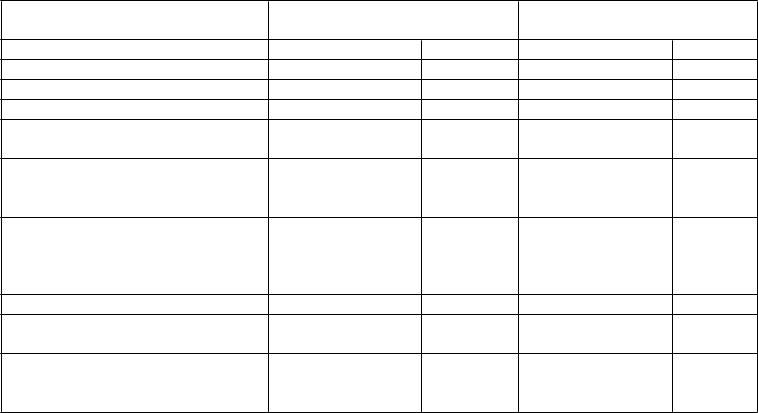
−0,13)
p = 0,0013
−0,47 (−0,66;
−0,28)
p < 0,0001
N 116 119 100 107
Pacienti (%), ktorí dosiahli HbA1c
< 7 %
25,9 10,9 36,0 15,0
Porovnanie s placebom (pomer šancí) (95 % CI)3
3,965 (1,771;
8,876)
p = 0,0008
4,429 (2,097; 9,353)
p < 0,0001
Pacienti randomizovaní do skupiny s linagliptínom 5 mg dostávali fixnú kombináciu tabliet Glyxambi 10 mg/5 mg plus metformín alebo fixnú kombináciu tabliet Glyxambi 25 mg/5 mg plus metformín. Pacienti randomizovaní do skupiny s placebom dostávali placebo plus empagliflozín 10 mg plus metformín alebo placebo plus empagliflozín 25 mg plus metformín.
1 Model MMRM pri FAS (OC) zahŕňa východiskovú hodnotu HbA1c, eGFR (MDRD), geografickú oblasť, návštevu, liečbu a liečbu podľa interakcie pri návšteve. Pre FPG je uvedená aj východisková hodnota FPG.
2 Nehodnotené z hľadiska štatistickej významnosti, nie je súčasťou sekvenčného testovania pre sekundárne koncové ukazovatele.
3 Logistická regresia pri FAS (NCF) východiskovú hodnotu zahŕňa HbA1c, východiskovú hodnotu eGRF (MDRD), geografickú oblasť a liečbu, na základe pacientov s HbA1c 7 % a viac na začiatku liečby.
Kardiovaskulárna bezpečnosť
V prospektívnej vopred špecifikovanej metaanalýze nezávisle posudzovaných kardiovaskulárnych
príhod u pacientov s diabetes mellitus 2. typu, ktoré pochádzali z 12 klinických štúdií s empagliflozínom zahŕňajúcich 10 036 pacientov a z 19 klinických štúdií s linagliptínom
zahŕňajúcich 9 459 pacientov, empagliflozín ani linagliptín nezvýšili kardiovaskulárne riziko.
Pediatrická populácia
Európska agentúra pre lieky upustila od povinnosti predložiť výsledky štúdií s Glyxambi vo všetkých
podskupinách pediatrickej populácie s diabetes mellitus 2. typu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Rýchlosť a stupeň absorpcie empagliflozínu a linagliptínu v Glyxambi zodpovedá biologickej dostupnosti empagliflozínu a linagliptínu pri podávaní vo forme samostatných tabliet.Farmakokinetické vlastnosti empagliflozínu a linagliptínu ako samostatných liekov boli rozsiahlo opísané u zdravých dobrovoľníkov a u pacientov s diabetes mellitus 2. typu. Farmakokinetické vlastnosti boli u zdravých osôb a u pacientov s diabetes mellitus 2. typu celkovo podobné.
Glyxambi preukázal podobný účinok s jedlom ako jednotlivé liečivá. Glyxambi sa preto môže užívať s jedlom alebo bez jedla.
Empagliflozín
Absorpcia
Po perorálnom podaní sa empagliflozín rýchlo absorboval, pričom maximálne plazmatické
koncentrácie sa vyskytli pri mediáne tmax 1,5 hodiny po podaní dávky. Plazmatické koncentrácie potom bifázicky klesli s rýchlou distribučnou fázou a relatívne pomalou terminálnou fázou. Pri 10 mg empagliflozínu užívanom jedenkrát denne bola priemerná plazmatická plocha pod krivkou závislosti koncentrácie od času (AUC) v rovnovážnom stave 1 870 nmol.h a Cmax v rovnovážnom stave bola
259 nmol/l a pri 25 mg empagliflozínu bola AUC v rovnovážnom stave 4 740 nmol.h a 687 nmol/l.
Systémová expozícia empagliflozínu sa zvýšila proporcionálne k dávke. Farmakokinetické parametre jednorazovej dávky a ustáleného stavu empagliflozínu boli podobné, čo naznačuje lineárnu farmakokinetiku z hľadiska času.'
Podávanie 25 mg empagliflozínu po konzumácii jedla s vysokým obsahom tuku a vysokokalorického jedla viedlo k mierne nižšej expozícii; AUC sa znížila približne o 16 % a Cmax približne o 37 % v porovnaní so stavom nalačno. Pozorovaný vplyv jedla na farmakokinetiku empagliflozínu sa nepovažoval za klinicky významný a empagliflozín sa môže podávať s jedlom alebo bez jedla.
Distribúcia
Zdanlivý distribučný objem v ustálenom stave bol na základe populačnej farmakokinetickej analýzy
stanovený na 73,8 l. Po podaní perorálneho roztoku [14C]-empagliflozínu zdravým dobrovoľníkom bolo rozdelenie červených krviniek približne 37 % a väzba na plazmatické bielkoviny bola 86 %.
Biotransformácia
V ľudskej plazme sa nestanovili žiadne hlavné metabolity a najviac zastúpenými metabolitmi boli tri
glukuronidové konjugáty (2-, 3- a 6-O-glukuronid). Systémová expozícia každému metabolitu predstavovala menej ako 10 % celkového materiálu súvisiaceho s liekom. Štúdie in vitro naznačujú, že
primárnou cestou metabolizmu empagliflozínu u ľudí je glukuronidácia prostredníctvom uridín
5‘-difosfát glukuronyltransferáz UGT2B7, UGT1A3, UGT1A8 a UGT1A9.
Eliminácia
Na základe analýzy populačnej farmakokinetiky sa zdanlivý terminálny polčas eliminácie
empagliflozínu stanovil na 12,4 hodiny a zdanlivý klírens po perorálnom podaní bol 10,6 l/hodinu. Interindividuálne variability klírensu empagliflozínu po perorálnom podaní boli 39,1 % a reziduálne variability klírensu empagliflozínu po perorálnom podaní boli 35,8 %. Pri dávkovaní jedenkrát denne sa ustálené plazmatické koncentrácie empagliflozínu dosiahli po piatej dávke. V súlade s polčasom sa v rovnovážnom stave pozorovala akumulácia až do 22 % s ohľadom na plazmatickú AUC.
Po podaní perorálneho roztoku [14C]-empagliflozínu zdravým jedincom sa približne 96 % podanej izotopom značenej látky vylúčilo stolicou (41 %) alebo močom (54 %). Väčšina izotopom značenej látky vylúčenej stolicou bola vo forme nezmeneného materského liečiva a približne polovica izotopom značenej látky sa vo forme nezmeneného materského liečiva vylúčila do moču.
Linagliptín
Absorpcia
Po perorálnom podaní 5 mg dávky zdravým dobrovoľníkom alebo pacientom sa linagliptín rýchlo
absorboval s výskytom maximálnych plazmatických koncentrácií (medián Tmax) o 1,5 hodiny po podaní dávky.
Po podávaní 5 mg linagliptínu jedenkrát denne sa dosiahol rovnovážny stav plazmatických koncentrácií po tretej dávke. Plazmatická AUC linagliptínu stúpla približne o 33 % po 5 mg dávkach v rovnovážnom stave v porovnaní s prvou dávkou. Intraindividuálne a interindividuálne koeficienty variácie pre AUC linagliptínu boli malé (12,6, % respektíve 28,5 %). Z dôvodu väzby linagliptínu na DPP-4 závislej od koncentrácie nie je farmakokinetika linagliptínu pri celkovej expozícii lineárna; celková plazmatická AUC linagliptínu vskutku stúpla pomalšie, než je úmerné dávke, zatiaľ čo AUC neviazaného linagliptínu stúpla takmer úmerne dávke.
Absolútna biologická dostupnosť linagliptínu je približne 30 %. Súbežná konzumácia jedla s vysokým obsahom tuku a linagliptínu predĺžila čas do dosiahnutia Cmax o 2 hodiny a znížila Cmax o 15 %, nepozoroval sa však žiadny vplyv na AUC0-72 h. Žiadny klinicky významný účinok zmien Cmax a Tmax sa neočakáva; preto sa linagliptín môže podávať s jedlom alebo bez jedla.
Plazmatické koncentrácie AUCτ,ss a Cmax,ss linagliptínu v rovnovážnom stave boli 153 nmol*hr/l a 12,9 nmol/l pre linagliptín 5 mg raz denne po dobu 7 dní.
Distribúcia
V dôsledku väzby na tkanivá je priemerný zdanlivý distribučný objem v rovnovážnom stave po
jednorazovej intravenóznej dávke 5 mg linagliptínu zdravým jedincom približne 1 110 litrov, čo poukazuje na to, že linagliptín sa extenzívne distribuuje do tkanív. Väzba linagliptínu na bielkoviny
plazmy je závislá od koncentrácie, klesá približne z 99 % pri 1 nmol/l na 75 – 89 % pri ≥ 30 nmol/l, čo
odráža saturáciu väzby na DPP-4 so zvyšovaním koncentrácie linagliptínu. Pri vysokých koncentráciách, kde je DPP-4 úplne saturovaný, sa 70 – 80 % linagliptínu viazalo na iné bielkoviny
plazmy než DPP-4, a preto bolo 30 – 20 % v plazme neviazaného.
Biotransformácia
Po perorálnej dávke 10 mg [14C] linagliptínu sa približne 5 % rádioaktivity vylúčilo do moču.
V eliminácii linagliptínu hrá metabolizmus menej dôležitú úlohu. Detegoval sa jeden hlavný metabolit s relatívnou expozíciou 13,3 % linagliptínu v rovnovážnom stave, ktorý sa ukázal ako farmakologicky
neaktívny, a teda neprispieva k inhibícii aktivity DPP-4 v plazme linagliptínom.
Eliminácia
Plazmatické koncentrácie linagliptínu klesajú trojfázovo s dlhým koncovým polčasom eliminácie
(koncový polčas eliminácie pre linagliptín viac ako 100 hodín), čo sa prevažne spája s nasýtiteľnou pevnou väzbou linagliptínu na DPP-4 a neprispieva ku kumulácii lieku. Efektívny polčas hromadenia linagliptínu stanovený na základe perorálneho podávania opakovaných dávok 5 mg linagliptínu je približne 12 hodín.
Po podaní perorálnej dávky [14C] linagliptínu zdravým jedincom sa približne 85 % podanej rádioaktívne značenej látky vylúčilo stolicou (80 %) alebo močom (5 %) v priebehu 4 dní od podania.
Renálny klírens v rovnovážnom stave bol približne 70 ml/min.
Porucha funkcieobličiek
Empagliflozín
U pacientov s miernou poruchou funkcie obličiek sa AUC empagliflozínu zvýšila približne o 18 %, u
pacientov so stredne závažnou poruchou funkcie obličiek približne o 20 %, u pacientov so závažnou poruchou funkcie obličiek (eGFR < 30 až < 90 ml/min/1,73 m2) o 66 % a u pacientov so zlyhávaním obličiek alebo ochorením obličiek v terminálnom štádiu (ESRD) približne o 48 % v porovnaní s jedincami s normálnou funkciou obličiek. Maximálne plazmatické hladiny empagliflozínu boli podobné u jedincov so stredne závažnou poruchou funkcie obličiek a zlyhávaním obličiek/ESRD v porovnaní s pacientmi s normálnou funkciou obličiek. Maximálne plazmatické hladiny empagliflozínu boli o zhruba 20 % vyššie u jedincov s miernou a závažnou poruchou funkcie obličiek pri porovnaní s jedincami s normálnou funkciou obličiek. Analýza populačnej farmakokinetiky preukázala, že
zdanlivý klírens po perorálnom podaní empagliflozínu sa znížil so znížením eGFR, čo viedlo k zvýšeniu expozície lieku (pozri časť 4.2).
Linagliptín
Na hodnotenie farmakokinetiky linagliptínu (dávka 5 mg) u pacientov s rôznymi stupňami chronickej
renálnej insuficiencie v porovnaní so zdravými jedincami s normálnou funkciou obličiek sa vykonala otvorená štúdia s opakovaným podávaním. Štúdia zahŕňala pacientov s renálnou insuficienciou klasifikovanou na základe klírensu kreatinínu ako mierna (50 až < 80 ml/min), stredne ťažká (30 až
< 50 ml/min) a ťažká (< 30 ml/min), ako aj pacientov s ESRD na hemodialýze. Okrem toho sa porovnávali pacienti s diabetes mellitus 2. typu a ťažkým poškodením funkcie obličiek (< 30 ml/min)
s pacientmi s diabetes mellitus 2. typu a normálnou funkciou obličiek.
V podmienkach rovnovážneho stavu bola expozícia linagliptínu u pacientov s miernym poškodením funkcie obličiek porovnateľná so zdravými jedincami. Pri stredne ťažkom poškodení funkcie obličiek
sa pozoroval mierny vzostup expozície asi o 1,7-násobok v porovnaní s kontrolnou skupinou .
Expozícia pacientov s diabetes mellitus 2. typu s ťažkou renálnou insuficienciou sa zvýšila asi o
1,4-násobok v porovnaní s pacientmi s diabetes mellitus 2. typu s normálnou funkciou obličiek. Predpoklady rovnovážneho stavu pre AUC linagliptínu u pacientov s ESRD naznačili porovnateľnú expozíciu, ako bola u pacientov so stredne ťažkým alebo ťažkým poškodením funkcie obličiek. Okrem toho sa nepredpokladá eliminácia linagliptínu hemodialýzou alebo peritoneálnou dialýzou
v terapeuticky významnom rozsahu (pozri časť 4.2).
Porucha funkciepečene
Empagliflozín
U pacientov s miernou poruchou funkcie pečene (podľa Child-Pughovej klasifikácie) sa AUC empagliflozínu zvýšila približne o 23 % a Cmax približne o 4 %, u pacientov so stredne závažnou poruchou funkcie pečene sa AUC empagliflozínu zvýšila približne o 47 % a Cmax približne o 23 % a u pacientov so závažnou poruchou funkcie pečene sa AUC empagliflozínu zvýšila približne o 75 % a Cmax približne o 48 % v porovnaní s jedincami s normálnou funkciou pečene (pozri časť 4.2).
Linagliptín
U pacientov bez diabetu s miernou, stredne ťažkou a ťažkou hepatálnou insuficienciou (podľa Child-Pughovej klasifikácie) boli priemerné AUC a Cmax linagliptínu podobné ako u zdravých jedincov po podaní opakovaných 5 mg dávok linagliptínu.
Index telesnejhmotnosti
Na základe indexu telesnej hmotnosti nie je potrebná žiadna úprava dávky Glyxambi. Index telesnej
hmotnosti nemá na základe analýzy populačnej farmakokinetiky žiadny klinicky významný účinok na farmakokinetiku empagliflozínu alebo linagliptínu.
Pohlavie
Pohlavie nemalo na základe analýzy populačnej farmakokinetiky žiadny klinicky významný účinok na
farmakokinetiku empagliflozínu alebo linagliptínu.
Rasa
Nepreukázal sa žiadny klinicky významný rozdiel vo farmakokinetike empagliflozínu alebo
linagliptínu na základe analýzy populačnej farmakokinetiky a v cielených štúdiách fázy I.
Staršie osoby
Vek nemal na základe analýzy populačnej farmakokinetiky žiadny klinicky významný vplyv na
farmakokinetiku empagliflozínu alebo linagliptínu. Staršie osoby (vo veku 65 až 80 rokov) mali porovnateľné plazmatické koncentrácie linagliptínu v porovnaní s mladšími jedincami.
Pediatrická populácia
Štúdie opisujúce farmakokinetiku empagliflozínu alebo linagliptínu u pediatrických pacientov sa ešte
nevykonali.
Liekové interakcie
Neboli vykonané žiadne štúdie liekovej interakcie s Glyxambi a inými liekmi, tieto štúdie sa však
vykonali s jednotlivými liečivami.
Hodnotenie empagliflozínu in vitro
Na základe štúdií in vitro empagliflozín neinhibuje, neinaktivuje ani neindukuje izoformy CYP450.
Empagliflozín neinhibuje UGT1A1, UGT1A3, UGT1A8, UGT1A9 alebo UGT2B7. Liekové interakcie týkajúce sa hlavných izoforiem CYP450 a UGT s empagliflozínom a súbežne podávanými substrátmi týchto enzýmov sa preto považujú za nepravdepodobné.
Údaje in vitro naznačujú, že primárnou cestou metabolizmu empagliflozínu u ľudí je glukuronidácia prostredníctvom uridín 5‘-difosfát glukuronyltransferáz UGT1A3, UGT1A8, UGT1A9 a UGT2B7.
Empagliflozín je substrát ľudských vychytávacích transportérov OAT3, OATP1B1 a OATP1B3, ale nie organických aniónových transportérov 1 (OAT1) a organických aniónových transportérov 2 (OCT2). Empagliflozín je substrát P-glykoproteínu (P-gp) a proteínu rezistencie rakoviny prsníka (breast cancer resistance protein, BCRP).
Empagliflozín v terapeutických dávkach neinhibuje P-gp. Na základe štúdií in vitro sa považuje za nepravdepodobné, že by empagliflozín spôsoboval interakcie s liekmi, ktoré sú substrátmi P-gp. Súbežné podávanie digoxínu, substrátu P-gp, s empagliflozínom viedlo k 6 % zvýšeniu AUC a k 14 % zvýšeniu Cmax digoxínu. Tieto zmeny sa nepovažovali za klinicky významné.
Empagliflozín in vitro neinhibuje ľudské vychytávacie transportéry, ako sú OAT3, OATP1B1 a OATP1B3, pri klinicky významných plazmatických koncentráciách a liekové interakcie so substrátmi týchto vychytávacích transportérov sa ako také považujú za nepravdepodobné.
Hodnotenie linagliptínu in vitro
Linagliptín bol substrát pre OATP8-, OCT2-, OAT4-, OCTN1- a OCTN2, čo indikuje možné
hepatálne vychytávanie prostredníctvom OATP8, renálne vychytávanie prostredníctvom OCT2 a renálnu sekréciu prostredníctvom OAT4, OCTN1 a OCTN2 a opätovnú absorpciu linagliptínu in vivo.
Aktivity OATP2, OATP8, OCTN1, OCT1 a OATP2 boli mierne až slabo inhibované linagliptínom.
5.3 Predklinické údaje o bezpečnosti
Všeobecné toxikologické štúdie na potkanoch až do 13 týždňov boli vykonané v kombinácii s empagliflozínom a linagliptínom.
Fokálne oblasti hepatocelulárnej nekrózy sa nachádzali v kombinovaných skupinách pri ≥ 15:
30 mg/kg linagliptínu: empagliflozínu (3,8-násobok klinickej expozície pre linagliptín a 7,8-násobok klinickej expozície pre empagliflozín), ako aj v skupine liečenej iba empagliflozínom, ale nie v
kontrolnej skupine. Klinický význam tohto zistenia zostáva neurčitý.
Pri expozíciách, ktoré dostatočne presahujú expozíciu u ľudí po terapeutických dávkach, kombinácia empagliflozínu a linagliptínu nemala žiadne teratogénne účinky a nepreukázala ani toxicitu pre matku.
Nežiaduce účinky na renálny vývoj neboli pozorované po podaní samotného empagliflozínu,
samotného linagliptín ani po podaní kombinácie týchto zložiek.
Empagliflozín
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, genotoxicity,
fertility a skorého embryonálneho vývinu neodhalili žiadne osobitné riziko pre ľudí.
V dlhodobých štúdiách toxicity pri hlodavcoch a psoch sa prejavy toxicity pozorovali pri expozíciách vyšších alebo rovnajúcich sa 10-násobku klinickej dávky empagliflozínu. Väčšina toxických účinkov bola identická so sekundárnymi farmakologickými vlastnosťami súvisiacimi s vylučovaním glukózy močom a nerovnováhou elektrolytov vrátane poklesu telesnej hmotnosti a telesného tuku, zvýšenej konzumácie jedla, hnačky, dehydratácie, poklesu sérovej hladiny glukózy a zvýšenia sérových hladín ostatných parametrov odzrkadľujúcich zvýšený metabolizmus bielkovín a glukoneogenézu, zmien v močení, ako sú polyúria a glukozúria a mikroskopických zmien zahŕňajúcich tvorbu minerálov v obličkách a v niektorých mäkkých a vaskulárnych tkanivách. Mikroskopický dôkaz o účinkoch zosilnených farmakologických vlastností na obličky, ktoré sa pozorovali pri niektorých druhoch, zahŕňal tubulárnu dilatáciu a tvorbu minerálov v tubuloch a panvičke približne pri 4-násobnej klinickej AUC expozície empagliflozínu súvisiacej s 25 mg dávkou.
V 2-ročnej štúdii karcinogenity empagliflozín nezvýšil výskyt nádorov pri samičkách potkana až do najvyššej dávky 700 mg/kg/deň, ktorá zodpovedá približne 72-násobku maximálnej klinickej AUC expozície empagliflozínu. Pri samčekoch potkana sa pri najvyššej dávke, ale nie pri 300 mg/kg/deň, čo zodpovedá 26-násobku maximálnej klinickej expozície empagliflozínu, pozorovali benígne vaskulárne proliferatívne lézie (hemangiómy) mezenterickej lymfatickej uzliny súvisiace s liečbou. Pri
samčekoch potkana sa pri dávke 300 mg/kg/deň a vyššej, ale nie pri dávke 100 mg/kg/deň, ktorá zodpovedá približne 18-násobku maximálnej klinickej expozície empagliflozínu, vo vyššej miere
pozorovali nádory intersticiálnych buniek semenníkov. Obidva nádory boli časté pri potkanoch a je
nepravdepodobné, že by sa vzťahovali na ľudí.
Empagliflozín nezvýšil výskyt nádorov pri samičkách myší pri dávkach až do 1 000 mg/kg/deň, čo zodpovedá približne 62-násobku maximálnej klinickej expozície empagliflozínu. Empagliflozín spôsobil vznik nádorov obličiek pri samčekoch myší pri dávke 1 000 mg/kg/deň, ale nie pri dávke
300 mg/kg/deň, čo zodpovedá približne 11-násobku maximálnej klinickej expozície empagliflozínu. Mechanizmus účinku pri týchto nádoroch závisí od prirodzenej predispozície samčekov myší na renálnu patológiu a metabolická cesta neodráža stav u ľudí. Nádory obličiek pri samčekoch myší sa
nepovažujú za významné pre ľudí.
Pri expozíciách, ktoré dostatočne presahujú expozíciu u ľudí po terapeutických dávkach,
empagliflozín nemal žiadne nežiaduce účinky na fertilitu ani skorý embryonálny vývin. Empagliflozín podávaný počas obdobia organogenézy nemal teratogénny účinok. Len pri dávkach toxických pre matky spôsoboval aj pokrivenie kostí končatiny pripotkanoch a zvýšený výskyt embryofetálnych potratov pri králikoch.
V štúdiách prenatálnej a postnatálnej toxicity empagliflozínu pri potkanoch sa pri expozíciách u matiek, ktoré predstavovali približne 4-násobok maximálnej klinickej expozície empagliflozínu, pozorovalo zníženie prírastku na hmotnosti mláďat. Pri systémovej expozícii ekvivalentnej maximálnej klinickej expozícii empagliflozínu sa žiadny takýto účinok nepozoroval. Význam týchto zistení pre ľudí nie je jasný.
V štúdiách juvenilnej toxicity empagliflozínu na potkanoch sa po podávaní empagliflozínu od 21. dňa po narodení do 90. dňa po narodení pozorovala pri mladých potkanoch minimálna až mierna renálna tubulárna a pelvická dilatácia iná ako nežiaduci účinok iba pri dávke 100 mg/kg/deň, čo zodpovedá približne 11-násobku maximálnej klinickej dávky 25 mg. Tieto zistenia chýbali po 13-týždňovom rekonvalescenčnom období bez lieku.
Linagliptín
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, genotoxicity,
fertility a skorého embryonálneho vývinu neodhalili žiadne osobitné riziko pre ľudí.
V dlhodobých štúdiách toxicity pri hlodavcoch a opiciach rodu Cynomolgus sa prejavy toxicity pozorovali pri expozíciách vyšších alebo rovnajúcich sa 300-násobku klinickej dávky linagliptínu.
Pri myšiach a potkanoch sú pečeň, obličky a gastrointestinálny trakt hlavnými cieľovými orgánmi toxicity. Vedľajšie účinky na reprodukčné orgány, štítnu žľazu a lymfatické orgány sa pozorovali u potkanov pri expozíciách vyšších ako 1 500-násobok klinickej expozície. Silné pseudoalergické reakcie sa pozorovali pri psoch pri stredných dávkach, pričom sekundárne spôsobovali kardiovaskulárne zmeny, ktoré sa považovali za špecifické pre psy. Pri opiciach rodu Cynomolgus boli cieľovými orgánmi toxicity pečeň, obličky, žalúdok, reprodukčné orgány, týmus, slezina
a lymfatické uzliny pri viac ako 450-násobnej klinickej expozícii u ľudí. Pri viac ako 100-násobku expozície u ľudí bolo pri opiciach hlavným nálezom podráždenie žalúdka.
2-ročné štúdie karcinogenity po perorálnom podaní potkanom a myšiam neodhalili žiaden výskyt karcinogenity pri potkanoch alebo u samčekoch myší. Signifikantne vyššia incidencia malígnych lymfómov len pri samičkách myší pri najvyššej dávke (> 200-násobok expozície u ľudí) sa nepovažuje za významnú pre ľudí. Na základe týchto štúdií nie sú žiadne obavy z hľadiska karcinogenity u ľudí.
Pri expozíciách, ktoré 900-násobne presahujú klinickú expozíciu, linagliptín nemal žiadne nežiaduce účinky na fertilitu ani skorý embryonálny vývin. Linagliptín podávaný počas obdobia organogenézy nemal teratogénny účinok. Len v dávkach toxických pre matky spôsoboval aj mierne zhoršenie osifikácie kostí pripotkanoch a zvýšený výskyt embryofetálnych potratov pri králikoch.
V štúdiách prenatálnej a postnatálnej toxicity linagliptínu pri potkanoch sa pri expozíciách matkám, ktoré predstavovali približne 1 500-násobok maximálnej klinickej expozície linagliptínu, pozorovalo zníženie prírastku na hmotnosti mláďat. Pri systémovej expozícii ekvivalentnej 49-násobku maximálnej klinickej expozície linagliptínu sa žiadny takýto účinok nepozoroval.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Glyxambi
10mg/5 mg
filmo
m
obalenétablety
Jadro
tablety manitol (E421)
hydrolyzát škrobu (kukuričného)
kukuričný škrob
kopovidón (nominálna K-hodnota 28)
krospovidón (typ B) mastenec magnéziumstearát
Filmovýobal hypromelóza 2910 manitol (E421) mastenec
oxid titaničitý (E171)
makrogol 6000
žltý oxid železitý (E172)
Glyxambi25mg/5 mgfilmomobalenétablety
Jadrotablety manitol (E421)
hydrolyzát škrobu (kukuričného)
kukuričný škrob
kopovidón (nominálna K-hodnota 28)
krospovidón (typ B)
mastenec magnéziumstearát
Filmovýobal hypromelóza 2910 manitol (E421) mastenec
oxid titaničitý (E171)
makrogol 6000
červený oxid železitý (E 172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
PVC/PVDC/hliníkové blistre s perforáciou umožňujúcou oddelenie jednotlivých dávok. Veľkosti balenia po 7 x 1, 10 x 1, 14 x 1, 28 x 1, 30 x 1, 60 x 1, 70 x 1, 90 x 1 a 100 x 1 filmom obalená tableta.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBoehringer Ingelheim International GmbH Binger Str. 173
D-5521 Ingelheim nad Rýnom
Nemecko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)Glyxambi10mg/5 mgfilmomobalenétablety EU/1/16/1146/001 (7 x 1 filmom obalená tableta) EU/1/16/1146/002 (10 x 1 filmom obalená tableta) EU/1/16/1146/003 (14 x 1 filmom obalená tableta) EU/1/16/1146/004 (28 x 1 filmom obalená tableta) EU/1/16/1146/005 (30 x 1 filmom obalená tableta) EU/1/16/1146/006 (60 x 1 filmom obalená tableta) EU/1/16/1146/007 (70 x 1 filmom obalená tableta) EU/1/16/1146/008 (90 x 1 filmom obalená tableta) EU/1/16/1146/009 (100 x 1 filmom obalená tableta)
Glyxambi25mg/5 mgfilmomobalenétablety EU/1/16/1146/010 (7 x 1 filmom obalená tableta) EU/1/16/1146/011 (10 x 1 filmom obalená tableta) EU/1/16/1146/012 (14 x 1 filmom obalená tableta) EU/1/16/1146/013 (28 x 1 filmom obalená tableta) EU/1/16/1146/014 (30 x 1 filmom obalená tableta) EU/1/16/1146/015 (60 x 1 filmom obalená tableta) EU/1/16/1146/016 (70 x 1 filmom obalená tableta) EU/1/16/1146/017 (90 x 1 filmom obalená tableta) EU/1/16/1146/018 (100 x 1 filmom obalená tableta)
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: {DD. mesiac RRRR}
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.