
s NSCLC užívajúcich gefitinib alebo chemoterapiu, ktorí boli sledovaní počas 12 týždňov, boli identifikované nasledujúce rizikové faktory pre vznik ILD (bez ohľadu na to, či pacient užíval gefitinibitib alebo chemoterapiu): fajčenie, nízka výkonnosť (performance status, PS ≥ 2), dôkaz redukcie normálneho pľúcneho tkaniva na základe CT vyšetrenia (≤ 50 %), nedávna diagnóza NSCLC (< 6 mesiacov), preexistujúca intersticiálna pľúcna choroba, starší vek (≥ 55 rokov) a súbežne sa vyskytujúce ochorenie srdca. Prevažne počas prvých 4 týždňov liečby bolo zvýšené riziko ILD pri gefitinibe ako pri chemoterapii (dosiahnutý OR 3,8; 95 % CI 1,9 až 7,7); potom relatívne riziko bolo nižšie (dosiahnutý OR 2,5; 95 % CI 1,1 až 5,8). Riziko mortality u pacientov, u ktorých došlo k vzniku ILD pri liečbe gefitinibom alebo pri chemoterapii, bolo vyššie u pacientov s nasledujúcimi rizikovými faktormi: fajčenie, dôkaz redukcie normálneho pľúcneho tkaniva na základe CT vyšetrenia (≤ 50 %), ILD, starší vek (≥ 65 rokov) a rozsiahle plochy adherentné k pleure (≥ 50 %).
Hepatotoxicita a porucha funkcie pečene
Abnormality pečeňových funkčných testov (vrátane zvýšenia alanínaminotransferázy, aspartátaminotransferázy, bilirubínu), sa pozorovali menej často, prejavujúce sa ako hepatitída (pozri časť 4.8).
Existujú jednotlivé prípady zlyhania pečene, ktoré v niektorých prípadoch viedli k fatálnym koncom. Preto sa odporúča pravidelné testovanie funkcie pečene. Gefitinib sa má používať v prípadoch ľahkých až stredne ťažkých zmien funkcie pečene so zvýšenou opatrnosťou. Ak ide o ťažké zmeny, má sa zvážiť ukončenie terapie.
Ukázalo sa, že porucha funkcie pečene z dôvodu cirhózy vedie k zvýšeniu plazmatických koncentrácií gefitinibu (pozri časť 5.2).
Interakcie s inými liekmi
Induktory CYP3A4 môžu zvýšiť metabolizmus gefitinibu a znížiť plazmatické koncentrácie gefitinibu. Súbežné podávanie induktorov CYP3A4 (napr. fenytoín, karbamazepín, rifampicín, barbituráty alebo rastlinné prípravky obsahujúce ľubovník bodkovaný (Hypericum perforatum)) môže preto znížiť účinnosť liečby a takejto kombinácii je potrebné sa vyhnúť (pozri časť 4.5).
U pacientov s genotypom slabých metabolizérov pre substráty CYP2D6 môže viesť liečba silnými inhibítormi CYP3A4 k zvýšeniu plazmatických koncentrácií gefitinibu. Pri začatí liečby inhibítormi CYP3A4 majú byť pacienti starostlivo sledovaní na možné nežiaduce účinku gefitinibu (pozri
časť 4.5).
U niektorých pacientov užívajúcich warfarín spolu s gefitinibom bolo zaznamenané zvýšenie International normalised ratio (INR) a/alebo prípady krvácania (pozri časť 4.5). U pacientov užívajúcich warfarín súbežne s gefitinibom sa majú pravidelne monitorovať zmeny protrombínového času (PT) alebo INR.
Lieky, ktoré spôsobujú signifikantné dlhodobé zvýšenie žalúdkového pH, ako sú inhibítory protónovej pumpy a H2 – antagonisty, môžu znižovať biologickú dostupnosť a koncentrácie gefitinibu v plazme,
a preto môžu znižovať jeho účinnosť. Ak sa antacidá užívajú pravidelne v krátkom časovom odstupe od podania gefitinibu, môžu mať podobný účinok (pozri časti 4.5 a 5.2).
Údaje z klinického skúšania II. fázy, kde sa súbežne užíval gefitinib a vinorelbín, naznačujú, že gefitinib môže spôsobiť exacerbáciu neutropenického efektu vinorelbínu.
Laktóza
Gefitinib Mylan obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, úplného deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nemajú tento liek užívať.
Sodík
Tento liek obsahuje menej ako 1 mmol (23 mg) sodíka v jednej tablete, to znamená, že sodík prakticky neobsahuje.
Ďalšie upozornenia pri užívaní
Pacienti majú byť poučení o tom, aby okamžite vyhľadali lekársku pomoc v prípade, ak u nich dôjde k ťažkej alebo pretrvávajúcej hnačke, nevoľnosti, vracaniu alebo anorexii, nakoľko tieto môžu nepriamo viesť k vzniku dehydratácie. Tieto symptómy sa majú liečiť podľa klinických príznakov (pozri časť 4.8).
Pacientov so známkami a príznakmi svedčiacimi pre keratitídu, akými sú akútny alebo zhoršený: zápal oka, slzenie, citlivosť na svetlo, rozmazané videnie, bolesť očí a/alebo červené oči, by mal
bezodkladne prezrieť špecialista oftalmológ.
Ak sa potvrdí diagnóza ulceratívnej keratitídy, liečba s gefitinibom sa má prerušiť, a ak sa príznaky nezlepšia, alebo ak sa príznaky pri znovunasadení gefitinibu znovu vyskytnú, malo by sa uvažovať o trvalom prerušení liečby.
Vo fáze I/II klinického skúšania sledujúceho podávanie gefitinibu a radiačnej liečby pediatrickým pacientom s novodiagnostikovaným gliómom mozgového kmeňa alebo nekompletnou resekciou supratentoriálneho malígneho gliómu boli hlásené 4 prípady (1 fatálny) krvácania do centrálneho nervového systému (CNS) z celkového počtu 45 pacientov zaradených do skúšania. Ďalší prípad krvácania do CNS bol hlásený u dieťaťa s ependymómom počas klinického skúšania s gefitinibom samotným. Zvýšené riziko cerebrálnej hemorágie u dospelých pacientov s NSCLC užívajúcich gefitinib nebolo stanovené.
Perforácia gastrointestinálneho traktu sa hlásila u pacientov užívajúcich gefitinib. Vo väčšine prípadov je spojená s ďalšími známymi rizikovými faktormi vrátane súčasného používania liekov, ako sú steroidy alebo NSAIDs, anamnéza gastrointestinálnej ulcerácie, vek, fajčenie alebo črevné metastázy
v miestach perforácie.
4.5 Liekové a iné interakcie
Gefitinib sa metabolizuje prostredníctvom izoenzýmu CYP3A4 cytochrómu P450 (prevažne)
a prostredníctvom cytochrómu CYP2D6.
Liečivá, ktoré môžu zvýšiť plazmatické koncentrácie gefitinibu
Štúdie in vitro preukázali, že gefitinib je substrátom p-glykoproteínu (Pgp). Dostupné údaje nenaznačujú žiadne klinické dôsledky k týmto in vitro zisteniam.
Substancie inhibujúce CYP3A4 môžu znížiť klírens gefitinibu. Súbežné podávanie so silnými inhibítormi aktivity CYP3A4 (napr. ketokonazol, posakonazol, vorikonazol, inhibítory proteázy, klaritromycín, telitromycín) môže zvýšiť plazmatické koncentrácie gefitinibu. Toto zvýšenie môže byť klinicky relevantné, nakoľko nežiaduce účinky majú súvislosť s dávkou a expozíciou. Toto zvýšenie môže byť výraznejšie u jednotlivých pacientov s genotypom slabých CYP2D6 metabolizérov. Predchádzajúca liečba itrakonazolom (silným inhibítorom cytochrómu CYP3A4) mala za následok
80 %-né zvýšenie strednej plochy pod krivkou (AUC) gefitinibu u zdravých dobrovoľníkov. V prípade súbežnej liečby so silnými inhibítormi cytochrómu CYP3A4 sa má u pacientov starostlivo sledovať výskyt nežiaducich účinkov gefitinibu.
Neexistujú údaje o súbežnej liečbe s inhibítormi cytochrómu CYP2D6, ale silní inhibítori tohto enzýmu môžu spôsobiť asi 2-násobné zvýšenie plazmatických koncentrácií gefitinibu u extenzívnych metabolizérov cytochrómu CYP2D6 (pozri časť 5.2). V prípade súbežnej liečby so silnými inhibítormi CYP2D6 sa má u pacientov starostlivo sledovať výskyt nežiaducich účinkov.
Liečivá, ktoré môžu znížiť plazmatické koncentrácie gefitinibu
Substancie, ktoré sú induktormi aktivity CYP3A4, môžu zvýšiť metabolizmus a znížiť plazmatické koncentrácie gefitinibu, a teda znížiť účinnosť gefitinibu. Neodporúča sa súbežné podávanie liekov indukujúcich cytochróm CYP3A4 (napr. fenytoín, karbamazepín, rifampicín, barbituráty alebo ľubovník bodkovaný/ Hypericum perforatum), ak je dostupná alternatívna liečba. Predchádzajúca liečba rifampicínom (silným induktorom cytochrómu CYP3A4) znížila u zdravých dobrovoľníkov
strednú hodnotu plochy pod krivkou (AUC) gefitinibu o 83 % (pozri časť 4.4).
Substancie, ktoré spôsobujú signifikantnú prolongovanú eleváciu žalúdkového pH, môžu znížiť plazmatické koncentrácie gefitinibu, a tak znížiť účinnosť gefitinibu. Vysoké dávky krátkodobo pôsobiacich antacíd môžu mať podobný účinok, ak sa užívajú pravidelne v krátkom časovom odstupe od užitia gefitinibu. Súbežné podávanie gefitinibu s ranitidínom zdravým dobrovoľníkom v dávkach spôsobujúcich pretrvávajúce zvýšenie žalúdkového pH ≥ 5 malo za následok zníženie stredného AUC gefitinibu o 47 % (pozri časti 4.4 a 5.2).
Liečivá, ktorých plazmatická koncentrácia môže byť zmenená gefitinibom
Štúdie in vitro preukázali, že gefitinib má obmedzený potenciál inhibovať cytochróm CYP2D6.
V klinickom skúšaní sa pacientom súbežne podával gefitinib s metoprololom (substrát CYP2D6). Malo to za následok 35% zvýšenie expozície metoprololu. Takéto zvýšenie môže byť potenciálne relevantné pre substráty CYP2D6 s úzkym terapeutickým indexom. Ak sa zvažuje podávanie substrátov CYP2D6 v kombinácii s gefitinibom, má sa zvážiť úprava dávky substrátu cytochrómu CYP2D6, a to najmä u produktov s úzkym terapeutickým oknom.
Gefitinib inhibuje transportný proteín BCRP in vitro, klinická závažnosť tohto zistenia však nie je známa.
Ďalšie potenciálne interakcie
Elevácia INR a/alebo prípady krvácania boli hlásené u niektorých pacientov súbežne užívajúcich warfarín (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Fertilita
Ženám vo fertilnom veku je treba odporučiť, aby počas liečby neotehotneli.
Gravidita
Nie sú k dispozícii údaje o použití gefitinibu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Potenciálne riziko pre ľudí nie je známe. Gefitinib Mylan má byť užívaný počas gravidity iba v nevyhnutných prípadoch.
Dojčenie
Nie je známe, či sa gefitinib vylučuje do materského mlieka. Gefitinib a metabolity gefitinibu sa vylučujú do mlieka dojčiacich potkanov (pozri časť 5.3). Gefitinib je kontraindikovaný počas dojčenia, a preto sa dojčenie počas liečby gefitinibom musí prerušiť (pozri časť 4.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Počas liečby gefitinibom bola pozorovaná asténia. Preto je potrebná zvýšená opatrnosť počas vedenia vozidla či obsluhy strojov u pacientov, ktorí u seba pozorovali tento príznak.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Nežiaduce reakcie zo spoločnej databázy klinických skúšaní III. fázy ISEL, INTEREST a IPASS (2462 pacientov liečených gefitinibom) preukázali, že najčastejšie hlásené nežiaduce reakcie, ktoré sa vyskytli u viac ako 20 % pacientov, sú hnačka a kožné reakcie (vrátane vyrážky, akné, suchej kože
a pruritu). Nežiaduce účinky sa zvyčajne vyskytujú počas prvého mesiaca liečby a vo všeobecnosti sú reverzibilné.
Približne u 8 % pacientov sa objavila ťažká nežiaduca reakcia (common toxicity criteria (CTC), stupeň
3 alebo 4).
Približne 3% pacientov ukončilo liečbu kvôli nežiaducim účinkom.
Intersticiálna choroba pľúc (ILD), často ťažká (CTC stupeň 3 – 4), sa vyskytla u 1,3 % pacientov. Boli hlásené prípady s fatálnym ukončením.
Tabuľkový zoznam nežiaducich reakcií
Bezpečnostný profil uvedený v Tabuľke 1 je založený na klinickom vývojovom programe gefitinibu
a skúsenostiach po jeho uvedení na trh. Nežiaduce reakcie boli v Tabuľke 1, kde je to možné, zaradené do kategórií podľa frekvencie na základe výskytu porovnateľných hlásení nežiaducich reakcií
z klinických skúšaní ISEL, INTEREST a IPASS v III fáze (2462 pacientov liečených gefitinibom).
Frekvencie výskytu nežiaducich účinkov sú definované ako: veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1000); veľmi zriedkavé
< 1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 1 – Nežiaduce reakcie
Nežiaduce reakcie podľa triedy orgánových systémov a frekvencie
Poruchy metabolizmu a výživy
Veľmi časté Anorexia, mierne alebo stredne závažná (CTC
stupňa 1 alebo 2).
Poruchy oka Časté Konjunktivitída, blefaritída a suché oči, hlavne mierne závažné (CTC stupňa 1).
Menej časté Erózia rohovky, reverzibilná a niekedy spojená s aberantným rastom rias.
Keratitída (0,12 %)
Poruchy ciev Časté Krvácanie, ako je epistaxia a hematúria.
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy kože
a podkožného tkaniva
Poruchy obličiek a močových ciest
Časté Intersticiálna choroba pľúc (1,3 %), často ťažká (CTC stupňa 3 – 4). Boli hlásené prípady s fatálnym ukončením.
Veľmi časté Hnačka, najmä mierne alebo stredne závažná (CTC
stupňa 1 alebo 2).
Vracanie, najmä mierne alebo stredne závažné (CTC
stupňa 1 alebo 2).
Nevoľnosť, najmä mierne závažná (CTC stupňa 1). Stomatitída, prevažne mierne závažná (CTC stupňa
1).
Časté Dehydratácia, sekundárna pri hnačke, nevoľnosti, vracaní a anorexii.
Sucho v ústach*, prevažne mierne závažné (CTC
stupňa 1). Menej časté Pankreatitída
Prederavenie (perforácia) gastrointestinálneho traktu.
Veľmi časté Zvýšenia hladiny alanínaminotransferázy, najmä mierne až stredne závažné.
Časté Zvýšenia hladiny aspartátamonitransferázy, najmä mierne až stredne závažné.
Zvýšenia hladiny celkového bilirubínu, najmä mierne až stredne závažné.
Menej časté Hepatitída**
Veľmi časté Kožné reakcie, najmä mierne až stredne závažné (CTC stupňa 1 alebo 2), pustulárna vyrážka, niekedy svrbivá so suchou pokožkou vrátane kožných trhlín na erytematóznom základe.
Časté Poruchy nechtov
Alopécia
Alergické reakcie (1,1 %) vrátane angioedému a žihľavky.
Zriedkavé Bulózne stavy vrátane toxickej epidermálnej nekrolýzy, Stevensovho-Johnsonovho syndrómu a multiformného erytému.
Kutánna vaskulitída
Časté Asymptomatické zvýšenie hladiny kreatinínu v krvi v laboratóriu.
Proteinúria
Celkové poruchy a reakcie v mieste podania
Cystitída
Zriedkavé Hemoragická cystitída
Veľmi časté Asténia, prevažne mierne závažná (CTC stupňa 1).
Časté Pyrexia

Frekvencia nežiaducich reakcií na liek súvisiacich s abnormálnymi laboratórnymi hodnotami je založená na pacientoch so zmenou východiskovej hodnoty 2 alebo ďalších stupňov CTC v príslušných laboratórnych parametroch.
*Táto nežiaduca reakcia sa môže vyskytnúť v súvislosti s ďalšími stavmi sucha (hlavne kožnými reakciami) pozorovanými pri gefitinibe.
**Patria sem jednotlivé prípady zlyhania pečene, ktoré v niektorých prípadoch viedli k fatálnym koncom.
Intersticiálna pľúcna choroba (ILD)V klinickom skúšaní INTEREST bola incidencia udalostí typu ILD 1,4 % (10) pacientov v skupine
s gefitinibom versus 1,1 % (8) pacientov v skupine s docetaxelom. Jeden prípad ILD sa skončil fatálne, a to u pacienta užívajúceho gefitinib.
V klinickom skúšaní ISEL bola incidencia udalostí typu ILD v celkovej populácii približne 1 %
v oboch liečebných ramenách. Väčšina hlásených udalostí typu ILD sa týkala pacientov ázijského pôvodu a incidencia ILD u pacientov ázijského pôvodu užívajúcich IRESSU a placebo bola približne
3 % a 4 %. Jeden prípad ILD sa skončil fatálne, a to u pacienta užívajúceho placebo.
V postmarketingovej štúdii zameranej na dohľad, uskutočnenej v Japonsku (3350 pacientov), bol hlásený výskyt prípadov typu ILD u pacientov užívajúcich gefitinib 5,8 %. Podiel prípadov ILD
s fatálnym ukončením bol 38,6 %.
V otvorenej časti klinického skúšania vo fáze III (IPASS) u 1217 pacientov porovnávajúcich gefitinib a kombinovanú chemoterapiu karboplatina/ paklitaxel ako prvú líniu liečby u vybraných pacientov
s pokročilým NSCLC v Ázii bol výskyt nežiaducich udalostí typu ILD 2,6 % v ramene s gefitinibom verzus 1,4 % v ramene karboplatina/paklitaxel.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovaniePre prípady predávkovania gefitinibom neexistuje žiadna špecifická liečba a možné symptómy predávkovania neboli stanovené. V I. fáze klinického skúšania bol však obmedzený počet pacientov liečený dennými dávkami až do 1000 mg. Bolo pozorované zvýšenie frekvencie a závažnosti niektorých nežiaducich reakcií, predovšetkým hnačky a kožnej vyrážky. Nežiaduce účinky spôsobené predávkovaním sa majú liečiť symptomaticky, závažnú formu hnačky treba liečiť podľa klinickej situácie. V jednej štúdii bol obmedzený počet pacientov liečených týždenne dávkami 1500 mg až
3500 mg. V tejto štúdii sa expozícia gefitinibu nezvýšila so zvyšujúcou sa dávkou, nežiaduce účinky boli väčšinou mierne až stredne závažné a boli v súlade so známym bezpečnostným profilom gefitinibu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Cytostatiká, inhibítory proteínkinázy, ATC kód: L01XE02
Mechanizmus účinku a farmakodynamické účinky
Epidermálny rastový faktor (EGF) a jeho receptor (EGFR [HER1; ErbB1]) boli identifikované ako kľúčové faktory v procese bunkového rastu a proliferácie normálnych a nádorových buniek. Aktivujúca EGFR mutácia v rámci rakovinovej bunky je dôležitým faktorom v podpore rastu nádorovej bunky blokujúcim apoptózu, zvyšujúci produkciu angiogénnych faktorov a facilitujúci proces metastázovania.
Gefitinib je selektívny malomolekulový inhibítor tyrozínkinázy receptora epidermálneho rastového faktora a je účinnou liečbou pre pacientov s tumormi s aktivujúcimi mutáciami tyrozínkinázovej domény EGFR bez ohľadu na líniu liečby. Nebola preukázaná klinicky relevantná aktivita u pacientov s tumormi so známou negativitou EGFR mutácie.
Bežné EGFR aktivujúce mutácie (delécie exónu 19, L858R) majú robustné údaje o odpovedi, ktoré podporujú citlivosť na gefitinib; napríklad prežívanie bez progresie HR (95% CI) 0,489 (0,336; 0,710) pre gefitinib oproti kombinovanej chemoterapii [WJTOG3405]. Údajov o odpovedi na gefitinib je menej u pacientov, ktorých nádory obsahujú menej časté mutácie; dostupné údaje naznačujú, že G719X, L861Q a S7681 sú senzibilizujúcimi mutáciami; a samotná prítomnosť mutácie T790M alebo inzercie exónu 20 sú mechanizmami rezistencie.
Rezistencia
Pri väčšine NSCLC nádorov so senzitizujúcimi mutáciami EGFR kinázy sa neskôr vyvinie rezistencia na liečbu gefitinibom s mediánom času do progresie ochorenia 1 rok. Asi v 60% prípadov je rezistencia spojená so sekundárnou mutáciou T790M, v týchto prípadoch je možné zvážiť inhibítory tyrozínkinázy EGFR targetované na T790M ako možnú liečbu v ďalšej línii. Ďalšie potenciálne mechanizmy rezistencie, ktoré boli hlásené po liečbe liekmi blokujúcimi EGFR signály, zahŕňajú: bypassovú signalizáciu ako je génová amplifikácia HER2 a MET a mutácie PIK3CA. V 5 – 10 %
prípadov sa zaznamenala fenotypová premena na malobunkový karcinóm pľúc.
Cirkulujúca nádorová DNA (ctDNA)
V štúdii IFUM sa stav mutácie hodnotil vo vzorkách nádorového tkaniva a ctDNA izolovanej
z plazmy pomocou sady Therascreen EGFR RGQ PCR (Qiagen). Obe vzorky ctDNA aj nádorového tkaniva boli hodnotiteľné u 652 pacientov z 1060 pacientov v skríningu. Miera objektívnej odpovede (ORR) u pacientov s pozitívnou mutáciou nádorového tkaniva a ctDNA bola 77 % (95 % interval spoľahlivosti: 66 % až 86 %) a u pacientov len s pozitívnou mutáciou nádorového tkaniva 60 % (95 % interval spoľahlivosti: 44 % až 74 %).
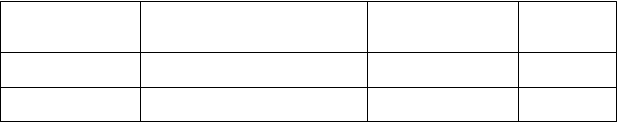
Tabuľka 2 – Súhrn východiskového stavu mutácie vo vzorkách nádorového tkaniva a ctDNA
u všetkých vyšetrených pacientov, u ktorých bolo možné vyhodnotiť obe vzorky
Meranie Definícia Miera IFUM
% (interval spoľahlivosti)
IFUM N
Citlivosť Podiel nádoru M +, ktorý je M +
podľa ctDNA
Špecifickosť Podiel nádoru M, ktorý je M podľa ctDNA
65,7 (55,8; 74,7) 105
99,8 (99,0; 100,0) 547
Tieto údaje sú v súlade s vopred naplánovanou exploračnou analýzou podskupiny Japoncov v skupine
IPASS (Goto 2012). V tejto štúdii bola použitá na analýzu mutácie EGFR pomocou sady EGFR Mutation Test Kit (DxS) ctDNA získaná zo séra, nie z plazmy (N = 86). V tejto štúdii bolo citlivosť
43,1%, špecificita 100%.
Klinická účinnosťa bezpečnosťPrvá línia liečbyRandomizované klinické skúšanie IPASS vo fáze III, prvá línia, bolo hodnotené na pacientoch
z Ázie1 s pokročilým (štádium IIIB alebo IV) NSCLC, histologicky potvrdeným adenokarcinómom, ktorí boli mierni fajčiari (zanechali fajčenie pred ≥ 15 rokmi a fajčili ≤ 10 rokov) alebo nikdy nefajčili (pozri Tabuľka 3).
1Čína, Filipíny, Hongkong, Indonézia, Japonsko, Malajzia, Singapur, Taiwan a Thajsko.
Tabuľka 3 – Výstupy týkajúce sa účinnosti pre gefitinib a pre karboplatinu/paklitaxel zo štúdie
IPASS
Populácia N Miery objektívnej odpovede a 95 %
interval spoľahlivosti pre rozdiel medzi
Primárny koncový ukazovateľ Prežívanie bez progresie (PFS)
a
,b
Celkové prežívanie
a
,b
liečbami
a
Celkovo 1217 43,0 % verzus 32,2 %
[5,3 %; 16,1 %]
HR 0,74
[0,65; 0,85]
5,7 m verzus 5,8 m p < 0,0001
HR 0,90
[0,79; 1,02]
18,8 m verzus 17,4 m
p = 0,1087
EGFR
mutácia pozitívna
261 71,2% verzus 47,3%
[12,0 %; 34,9 %]
HR 0,48
[0,36; 0,64]
9,5 m verzus 6,3 m
HR 1,00
[0,76; 1,33]
21,6 m
p < 0,0001 verzus 21,9 m
EGFR
mutácia negatívna
176 1,1% verzus 23,5%
[-32,5 %; -13,3 %]
HR 2,85
[2,05; 3,98]
1,5 m verzus 5,5 m
HR 1,18
[0,86; 1,63]
11,2 m
p < 0,0001 verzus 12,7 m
EGFR
mutácia neznáma
780 43,3% verzus 29,2%
[7,3 %; 20,6 %]
HR 0,68
[0,58 až 0,81]
6,6 m verzus 5,8 m
HR 0,82
[0,70 až 0,96]
18,9 m
p < 0,0001 verzus 17,2 m
a Predstavené hodnoty platia pre gefitinib a pre karboplatinu/paklitaxel.
b Malé „m“ je hodnota mediánov v mesiacoch. Čísla v hranatých zátvorkách sú 95 % intervaly spoľahlivosti pre HR
N Počet randomizovaných pacientov.
HR Pomer rizík (pomery rizík < 1 v prospech gefitinibu)
Kvalita života bola rozdielna v závislosti od stavu mutácie EGFR. U pacientov s aktivujúcou mutáciou
EGFR došlo u významne väčšieho počtu pacientov liečených gefitinibom k zlepšeniu kvality života a príznakov karcinómu pľúc v porovnaní s karboplatinou/paklitaxelem (pozri Tabuľka 4).
Tabuľka 4 – Výstupy týkajúce sa kvality života pre gefitinib a pre karboplatinu/paklitaxel zo
štúdie IPASS
Populácia N FACT L QoL – miera zlepšenia
a
LCS – miera zlepšenia príznakov
a
% %
Celkovo 1151 (48,0 % verzus 40,8 %)
(51,5% verzus 48,5%)
p = 0,0148 p = 0,3037
EGFR
259 (70,2% verzus 44,5%)
(75,6% verzus 53,9%)
mutácia pozitívna p < 0,0001 p = 0,0003
EGFR
169 (14,6% verzus 36,3%)
(20,2% verzus 47,5%)
mutácia negatívna p = 0,0021 p = 0,0002 Výsledky výstupného indexu skúšania podporovali výsledky FACT L a LCS
a Predstavené hodnoty platia pre gefitinib a pre karboplatinu/paklitaxel.
N Počet pacientov, u ktorých je možné hodnotiť analýzy kvality života. QoL Kvalita života.
FACT L Funkčné hodnotenie liečby rakoviny pľúc. LSC Podstupnica rakoviny pľúc.
Gefitinib preukázal v štúdii IPASS vynikajúce hodnoty prežitia bez progresie ochorenia (PFS), celkovej miery odpovede (ORR), kvality života (QoL) a zmiernenie symptómov bez signifikantného
rozdielu v celkovom prežívaní v porovnaní s karboplatínou/paklitaxelom u predtým neliečených pacientov s lokálne pokročilým alebo metastatickým NSCLC, ktorých nádory mali aktivujúce mutácie EGFR tyrozínkinázy.
Pacienti s predchádzajúcou liečbou
V randomizovanom klinickom skúšaní INTEREST vo fáze III boli hodnotení pacienti s lokálne pokročilým alebo metastatickým NSCLC, ktorí najskôr podstúpili chemoterapiu na základe platiny.
V celkovej populácii sa nepozoroval štatisticky signifikantný rozdiel medzi gefitinibom a docetaxelom (75 mg/m²) pokiaľ ide o celkové prežívanie, prežívaniebez progresie a mieru objektívnej odpovede (pozri Tabuľka 5).
Tabuľka 5 – Výstupy týkajúce sa účinnosti pre gefitinib verzus docetaxel zo štúdie INTEREST
Populácia N Miery objektívnej odpovede a 95 %
interval spoľahlivosti pre rozdiel medzi
Prežitie bez progresie ochorenia
a
,b
Primárny koncový ukazovate
ľ celkového
liečbami
a
prežívania
a
,b
Celkovo 1466 9,1% verzus 7,6%
[1,5 %; 4,5 %]
HR 1,04
[0,93; 1,18]
2,2 m verzus 2,7 m p = 0,4658
HR 1,020
[0,905; 1,150]
7,6 m verzus 8,0 m
p = 0,7332
EGFR mutácia pozitívna
44 42,1% verzus 21,1%
[-8,2 %; 46,0 %]
HR 0,16
[0,05; 0,49]
7,0 m verzus 4,1 m p = 0,0012
HR 0,83
[0,41; 1,67]
14,2 m verzus 16,6 m
p = 0,6043
EGFR mutácia negatívna
253 6,6% verzus 9,8%
[-10,5 %; 4,4 %]
HR 1,24
[0,94; 1,64]
1,7 m verzus 2,6 m
HR 1,02
[0,78; 1,33]
6,4 m a 6,0 m
p = 0,1353 p = 0,9131
Ázijská populáciac
323 19,7% verzus 8,7%
[3,1 %; 19,2 %]
HR 0,83
[0,64; 1,08]
2,9 m verzus 2,8 m p = 0,1746
HR 1,04
[0,80; 1,35]
10,4 m verzus 12,2 m
p = 0,7711
Neázijská populácia
1143 6,2% verzus 7,3%
[4,3 %; 2,0 %]
HR 1,12
[0,98; 1,28]
2,0 m verzus 2,7 m p = 0,1041
HR 1,01
[0,89; 1,14]
6,9 m verzus 6,9 m
p = 0,9259
a Predstavené hodnoty platia pre gefitinib a pre docetaxel.
b Malé „m“ je hodnota mediánov v mesiacoch. Čísla v hranatých zátvorkách sú 96 % intervaly spoľahlivosti pre celkové prežívanie HR v celkovej populácii, alebo 95 % intervaly spoľahlivosti pre HR
c Interval spoľahlivosti úplne pod hranicou 1,154, ktorá nie je nevýznamná (non-inferiority margin)
N Počet randomizovaných pacientov.
HR Pomer rizík (pomery rizík < 1 v prospech gefitinibu)
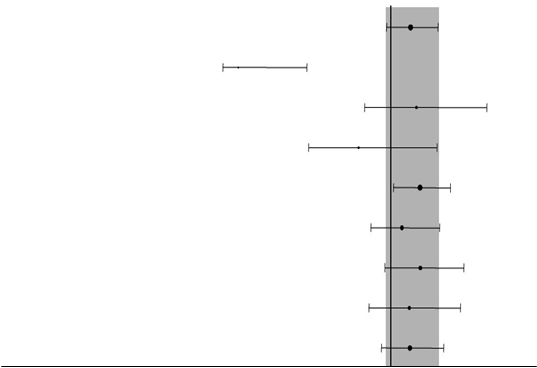
 Obrázky 1 a 2 – Výstupy týkajúce sa účinnosti v podskupinách neázijských pacientov v štúdii
INTEREST (počet pacientov N = počet randomizovaných pacientov) Celkové prežívanie
Obrázky 1 a 2 – Výstupy týkajúce sa účinnosti v podskupinách neázijských pacientov v štúdii
INTEREST (počet pacientov N = počet randomizovaných pacientov) Celkové prežívanie
Počet pacientov N
1143 Celkovo
27 EGFR mutácia +
222 EGFR mutácia ‐
133 Nikdy nefajčili
1010 Fajčili
600 S adenokarcinómom
543 Bez adenokarcinómu
369 Ženy
774 Muži
0,5 1,0 1,5 2,0
Pomer rizika (gefitinib a docetaxel) a 95 % interval spoľahlivostiNeupravená analýza Populácia PP pre klinické faktory Populácia ITT pre biomarkerové
faktory
Prežitie bez progresie ochorenia
ORR (%)
Počet
pacientov N
Gefitinib verzus docetaxel
1143 6,2 verzus 7,3 Celkovo
27 42,9
verzus 20,0
EGFR mutácia +
222 5,5 verzus 9,1 EGFR mutácia ‐
133 23,7
verzus 13,3
Nikdy nefajčili
1010 3,9 verzus 6,5 Fajčili
600 9,4 verzus 9,4 S adenokarcinómom
543 2,8 verzus 5,0 Bez adenokarcinómu
369 9,8 verzus 13,1 Ženy
774 4,4 verzus 4,6 Muži
0 0,5 1,0 1,5 2,0
Pomer rizika (gefitinib a docetaxel) a 95 % interval spoľahlivostiNeupravená analýza Populácia EFR
V randomizovanom klinickom skúšaní ISEL vo fáze III boli hodnotení pacienti s pokročilým NSCLC najprv liečení jedným alebo dvoma režimami chemoterapie, a ktorí neodpovedali na posledný režim alebo ho netolerovali. Gefitinib a najlepšia podporná starostlivosť boli porovnávané s placebom plus najlepšia podporná starostlivosť. Gefitinib nepredĺžil prežívanie v celkovej populácii. Výsledky prežívania boli rozdielne v závislosti od stavu fajčenia a rasovej príslušnosti (pozri Tabuľka 6).'
Tabuľka 6 – Výstupy týkajúce sa účinnosti pre gefitinib a pre placebo zo štúdie ISEL
Populácia N Miery objektívnej odpovede a 95 % interval spoľahlivosti pre rozdiel medzi
Čas do zlyhania liečby
a
,b
Primárny koncový ukazovateľ celkového prežívania
a,b,c
liečbami
a
Celkovo 1692 8,0 % verzus 1,3 %
[4,7 %; 8,8 %]
HR 0,82
[0,73; 0,92]
3,0 m
verzus 2,6 m
HR 0,89
[0,77; 1,02]
5,6 m
verzus 5,1 m
p = 0,0006 p = 0,0871
EGFR mutácia pozitívna 26 37,5 % verzus 0 %
[-15,1 %; 61,4 %]
HR 0,79
[0,20; 3,12]
10,8 m verzus 3,8 m p = 0,7382
HR NC

NR verzus 4,3 m

EGFR mutácia negatívna 189 2,6 % averzus0 %
[5,6 %; 7,3 %]
HR 1,10
[0,78; 1,56]
2,0 m
verzus 2,6 m
HR 1,16
[0,79; 1,72]
3,7 m
verzus 5,9 m
p = 0,5771 p = 0,4449
Nikdy nefajčili 375 18,1 % verzus 0 %
[12,3 %; 24,0 %]
HR 0,55
[0,42; 0,72]
5,6 m
verzus 2,8 m
HR 0,67
[0,49; 0,92]
8,9 m
verzus 6,1 m
p < 0,0001 p = 0,0124
Fajčili 1317 5,3 % verzus 1,6 %
[1,4 %; 5,7 %]
HR 0,89
[0,78; 1,01]
2,7 m
verzus 2,6 m
HR 0,92
[0,79; 1,06]
5,0 m
verzus 4,9 m
p = 0,0707 p = 0,2420
Ázijská populáciad 342 12,4 % verzus 2,1 %
[4,0 %; 15,8 %]
HR 0,69
[0,52; 0,91]
4,4 m
verzus 2,2 m
HR 0,66
[0,48; 0,91]
9,5 m
verzus 5,5 m
p = 0,0084 p = 0,0100
Neázijská populácia 1350 6,8 % verzus 1,0 %
[3,5 %; 7,9 %]
HR 0,86
[0,76; 0,98]
2,9 m
verzus 2,7 m
HR 0,92
[0,80; 1,07]
5,2 m
verzus 5,1 m
p = 0,0197 p = 0,2942
a Predstavené hodnoty platia pre gefitinib verzus placebo.
b Malé „m“ je hodnota mediánov v mesiacoch. Čísla v hranatých zátvorkách sú 95 % intervaly spoľahlivosti pre HR.
c Stratifikovaný logaritmický test poradí pre celkový počet. V inom prípade Coxov model pomerov rizík.
d Ázijský pôvod nezahŕňa pacientov s indickým pôvodom a odkazuje na rasový pôvod skupiny pacientov, a nie nevyhnutne na ich miesto narodenia.
N Počet randomizovaných pacientov.
NC Nevypočítané pre celkové prežívanie HR, pretože počet prípadov je príliš malý. NR Nedosiahnuté.
HR Pomer rizík (pomery rizík < 1 v prospech gefitinibu).
Štúdia IFUM bola jednoramenná, multicentrická štúdia vykonaná u pacientov kaukazskej populácie
(n = 106) s pozitívnou aktivujúcou senzibilizujúcou mutáciou EGFR u NSCLC. Táto štúdia potvrdila, že pôsobenie gefitinibu je podobné u kaukazskej a ázijskej populácie. ORR bolo podľa hodnotenia investigátora 70% a medián PFS bol 9,7 mesiaca. Tieto údaje sú podobné tým, ktoré sú uvedené
v IPASS štúdii.
Stav mutácie EGFR a klinické charakteristiky
Multiviariačnou analýzou u 786 pacientov kaukazskej populácie z klinických skúšaní s gefitinibom* (Tabuľka 7) sa preukázalo, že klinické charakteristiky ako nefajčiar (nikdy nefajčil), histologicky preukázaný adenokarcinóm a ženské pohlavie sú nezávislými predpovedajúcimi faktormi pre prítomnosť aktivujúcej mutácie EGFR. Ázijskí pacienti mali tiež vyšší výskyt nádorov s prítomnosťou aktivujúcej mutácie EGFR.
Tabuľka 7 – Súhrn multivariačnej logistickej regresnej analýzy na identifikáciu faktorov, ktoré
nezávisle predpovedali prítomnos
ťmutácií EGFR u 786 pacientov kaukazskej populácie*
Faktory, ktoré predpovedali prítomnosť
p hodnota Rozdiely mutácie
EGFR
Pozitívna prediktívna hodnota (u 9,5 % celkovej populácie je mutácia EGFR pozitívna (M+))
mutácie EGFR
Fajčiari
a nefajčiari
< 0,0001 6,5-krát vyššia
u ľudí, ktorí nikdy nefajčili, ako u tých, ktorí sú alebo boli fajčiarmi
28/70 (40 %) nefajčiarov je M+.
47/716 (7 %) fajčiarov je M+.
Histológia < 0,0001 4,4-krát vyššia v prípade
adenokarcinómu,, ako v prípade iného typu karcinómu
Pohlavie 0,0397 1,7-krát vyššia u žien
63/396 (16 %) pacientov s histologicky preukázaným adenokarcinómom je M+.
12/390 (3 %) pacientov s histologicky preukázaným iným typom karcinómu je M+.
40/235 (17 %) žien je M+.
ako u mužov 35/551 (6 %) mužov je M+.
*Z týchto štúdií: INTEREST, ISEL, INTACT 1&2, IDEAL 1&2, INVITE
5.2 Farmakokinetické vlastnosti
Absorpcia
Absorpcia gefitinibu po perorálnom podaní je pomalšia a k maximálnym koncentráciám gefitinibu
v plazme dochádza obvykle 3 až 7 hodín po podaní. U pacientov s karcinómom je priemerná absolútna biologická dostupnosť 59%. Expozícia gefitinibu nie je výrazne ovplyvnená jedlom. V klinickom skúšaní u zdravých dobrovoľníkov, u ktorých bolo pH žalúdka udržiavané nad pH5, bola expozícia gefitinibu znížená o 47%, pravdepodobne z dôvodu zhoršenej rozpustnosti gefitinibu v žalúdku
(pozri časti 4.4 a 4.5).
Distribúcia
Priemerný distribučný objem gefitinibu je v ustálenom stave 1400 l, čo naznačuje rozsiahlu distribúciu do tkanív. Väzba na bielkoviny krvnej plazmy dosahuje približne 90 %. Gefitinib sa viaže na sérový albumín a α1-kyslý glykoproteín.
In vitro údaje naznačujú, že gefitinib je substrátom membránového transportného proteínu Pg-p. Biotransformácia
In vitro údaje naznačujú, že cytochróm CYP3A4 a CYP2D6 sú hlavnými izoenzýmami P450,
podieľajúcimi sa na oxidačnom metabolizme gefitinibu.
Štúdie in vitro preukázali, že gefitinib má obmedzenú schopnosť inhibovať cytochróm CYP2D6. Gefitinib nevykazuje v skúškach na zvieratách žiadny účinok na indukciu enzýmov, ani signifikantnú inhibíciu (in vitro) akéhokoľvek iného enzýmu cytochrómu P450.
Gefitinib sa u ľudí extenzívne metabolizuje. Päť metabolitov bolo kompletne identifikovaných v stolici a 8 metabolitov v plazme. Hlavným identifikovaným metabolitom bol O-desmetyl gefitinib, ktorý bol
14-násobne menej účinný ako gefitinib v inhibícii EGFR stimulovaného bunkového rastu a nemal žiadny inhibičný efekt na rast nádorových buniek u myší. Nepredpokladá sa preto, že by prispieval ku klinickej aktivite gefitinibu.
V skúškach in vitro sa preukázalo, že tvorba O-desmetyl gefitinibu prebieha prostredníctvom cytochrómu CYP2D6. Úloha CYP2D6 v metabolickom klírens gefitinibu bola zhodnotená v klinickom skúšaní u zdravých dobrovoľníkov, genotypizovaných pre stav CYP2D6. U slabých metabolizérov neboli vyprodukované merateľné hladiny O-desmetyl gefitinibu. Hladiny expozície gefitinibu dosiahnuté u extenzívnych, ako aj slabých skupín metabolizérov mali rozličnú škálu hodnôt, ale priemerná expozícia gefitinibu bola 2-násobne vyššia v skupine slabých metabolizérov. Vyššie
priemerné expozície, ktoré by mohli byť dosiahnuté u ľudí bez aktívneho CYP2D6, môžu byť klinicky relevantné, nakoľko nežiaduce účinky súvisia s dávkou a expozíciou.
Eliminácia
Gefitinib sa vylučuje prevažne vo forme metabolitov stolicou, pričom eliminácia gefitinibu a jeho metabolitov obličkami predstavuje menej ako 40 % podanej dávky.
Celkový plazmatický klírens gefitinibu je približne 500 ml/min a stredný terminálny polčas je
u onkologických pacientov 41 hodín. Podávanie gefitinibu raz denne má za následok 2- až 8-násobnú akumuláciu, pričom rovnovážne expozície sa dosahujú po 7 až 10 dávkach. Cirkulujúce plazmatické koncentrácie v ustálenom stave sa zvyčajne udržiavajú v 2 až 3-násobnom rozmedzí počas 24- hodinového dávkovacieho intervalu.
Osobitné skupiny pacientov
V analýzach založených na populačných farmakokinetických údajoch u onkologických pacientov nebol zistený žiadny vzťah medzi predpokladanou koncentráciou v ustálenom stave a vekom pacienta, telesnou hmotnosťou, pohlavím, etnickým pôvodom alebo klírensom kreatinínu (viac ako 20 ml/min).
Porucha funkcie pečene
V I. fáze otvoreného klinického skúšania, pri ktorom sa pacientom s miernou, stredne ťažkou alebo ťažkou poruchou funkcie pečene z dôvodu cirhózy (v súlade s Childovou-Pughovou klasifikáciou) podala jediná dávka gefitinibu 250 mg, bolo pozorované zvýšenie expozície vo všetkých skupinách v porovnaní so zdravou kontrolnou skupinou. Bolo pozorované priemerne 3,1-násobné zvýšenie expozície gefitinibu u pacientov so stredne ťažkou a ťažkou poruchou funkcie pečene. Nikto
z pacientov nemal nádorové ochorenie, všetci mali cirhózu pečene a niektorí mali hepatitídu. Toto zvýšenie expozície môže byť klinicky relevantné, nakoľko nežiaduce skúsenosti súvisia s dávkou
a expozíciou gefitinibu.
Gefitinib bol hodnotený v klinickom skúšaní zahŕňajúcom 41 pacientov so solídnymi tumormi a s normálnou funkciou pečene alebo stredne ťažkou až ťažkou poruchou funkcie pečene (klasifikovanou v súlade s Common Toxicity Criteria pre AST, alkalickú fosfatázu a bilirubín)
v dôsledku pečeňových metastáz. Ukázalo sa, že po podávaní gefitinibu v dennej dávke 250 mg boli čas do dosiahnutia ustáleného stavu, celkový plazmatický klírens (CmaxSS) a expozícia v ustálenom stave (AUC24SS) podobné u skupiny pacientov s normálnou a stredne ťažko poškodenou funkciou pečene. Údaje zo sledovania 4 pacientov s ťažkým poškodením funkcie pečene z dôvodu metastáz do pečene naznačujú, že expozície v ustálenom stave sú u týchto pacientov tiež podobné ako u pacientov s normálnou funkciou pečene.
5.3 Predklinické údaje o bezpečnosti
Nežiaduce účinky, ktoré sa nepozorovali v klinických skúšaniach, pozorovali sa však u zvierat pri expozičných hladinách podobných klinickým expozičným hladinám a s možnou relevanciou ku klinickému užívaniu sú nasledovné:
– korneálna epiteliálna atrofia a korneálna translucencia,
– renálna papilárna nekróza,
– hepatocelulárna nekróza a eozinofilná sínusová makrofágová infiltrácia.
Údaje z predklinických štúdií (in vitro) naznačujú, že gefitinib má schopnosť inhibovať akčný potenciál procesu repolarizácie srdca (napr. QT interval). Klinické skúsenosti nepreukázali príčinnú súvislosť medzi predĺžením QT intervalu a gefitinibom.
Zníženie fertility u samíc potkanov bolo pozorované pri dávkach 20 mg/kg/deň.
Publikované štúdie preukázali, že u geneticky modifikovaných myší, u ktorých chýbala expresia EGFR, sa prejavili vývojové defekty súvisiace s epiteliálnou nezrelosťou rôznych orgánov vrátane kože, gastrointestinálneho traktu a pľúc. Počas podávania gefitinibu potkanom počas organogenézy nebol pozorovaný žiadny účinok na embryofetálny vývoj pri najvyšších dávkach (30 mg/kg/deň).
U králikov bola však pozorovaná redukcia hmotností plodov o 20 mg/kg/deň a viac. Ani u jedného živočíšneho druhu neboli pozorované žiadne liečivom indukované malformácie. Pri podávaní potkanom počas gravidity a pôrodu v dávkach 20 mg/kg/deň bolo pozorované skrátené prežívanie mláďat.
Po perorálnom podaní gefitinibu značeného uhlíkom14 dojčiacim potkanom 14 dní po pôrode boli koncentrácie rádioaktivity v mlieku 11 až 19-krát vyššie ako v krvi.
Gefitinib nepreukázal žiadny genotoxický potenciál.
V 2-ročnej štúdii karcinogenity u potkanov sa zistilo malé, ale štatisticky signifikantné zvýšenie incidencie hepatocelulárnych adenómov u samcov aj samíc potkanov a hemangiosarkómov mezenteriálnych lymfatických uzlín u samíc potkanov len pri najvyššej dávke (10 mg/kg/deň). Počas
2-ročnej štúdie karcinogenity na myšiach boli tiež pozorované hepatocelulárne adenómy, čo dokazuje mierne zvýšenú incidenciu tohto nálezu u samcov myší pri strednej dávke a u samcov a samíc myší pri najvyššej dávke. Tieto účinky sa ukázali ako štatisticky významné u samíc myší, nie však u samcov. Pri podávaní neúčinných hladín liečiva myšiam a potkanom nebol pozorovaný žiadny rozdiel
v klinickej expozícii. Klinický význam týchto nálezov nie je známy.
Výsledky štúdie in vitro fototoxicity preukázali, že gefitinib môže mať fototoxický potenciál.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety Monohydrát laktózy Mikrokryštalická celulóza (101) Krospovidón (typ A)
Povidón (K30) Nátriumlaurylsulfát Magnéziumstearát
Obal tablety Polyvinylalkohol (E1203) Makrogol 4000 (E1521) Mastenec (E553b)
Oxid titaničitý (E171)
Oxid železitý červený (E172) Oxid železitý žltý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 30 °C.
6.5 Druh obalu a obsah balenia
PVC/PVDC/hliníkový blister v škatuliach s obsahom 30 filmom obalených tabliet.
PVC/PVDC/hliníkový perforovaný blister s jednotlivými dávkami, v škatuliach s obsahom 30 x 1
filmom obalených tabliet.
Blistre môžu byť balené do hliníkových vreciek.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMylan S.A.S.
117 Allée des Parcs
69800 Saint Priest
Francúzsko
8. REGISTRAČNÉ ČÍSLAEU/1/18/1321/001
EU/1/18/1321/002
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.