
otiazidu, bumetanidu, valsartanu, digoxínu (substrát P-gp) alebo warfarínu (S-warfarínu, substrátu CYP2C9), alebo antikoagulačné vlastnosti warfarínu stanovené INR. Kombinácia jednej dávky dapagliflozínu 20 mg a simvastatínu (substrátu CYP3A4) vyústila do 19 % zvýšenia AUC simvastatínu a 31 % zvýšenia AUC kyseliny simvastatínovej. Zvýšenia expozícií simvastatínu
a kyseliny simvastatínovej sa nepovažujú za klinicky významné.
Interferencia s testom s 1,5-anhydroglucitolom (1,5-AG)
Monitorovanie glykemickej kontroly testom s 1,5-AG sa neodporúča, pretože merania s 1,5-AG sú
nespoľahlivé pri hodnotení glykemickej kontroly u pacientov užívajúcich inhibítory SGLT2. Na monitorovanie glykemickej kontroly sa odporúča použiť alternatívne metódy.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití dapagliflozínu u gravidných žien. Štúdie na potkanoch
preukázali toxicitu na vývoj obličiek v období, ktoré sa zhoduje s druhým a tretím trimestrom ľudskej
gravidity (pozri časť 5.3). Preto sa použitie dapagliflozínu počas druhého a tretieho trimestra gravidity neodporúča.
Ak sa zistí gravidita, liečba dapagliflozínom sa má ukončiť. Dojčenie
Nie je známe, či sa dapagliflozín a/alebo jeho metabolity vylučujú do materského mlieka u ľudí.
Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie dapagliflozínu/metabolitov do mlieka, ako aj farmakologicky sprostredkované účinky u dojčených potomkov (pozri časti 5.3). Riziko u novorodencov/dojčiat nie je možné vylúčiť. Dapagliflozín sa nemá užívať počas dojčenia.
Fertilita
Účinok dapagliflozínu na fertilitu u ľudí sa nesledoval. U samcov a samíc potkanov dapagliflozín
v žiadnych testovaných dávkach nepreukázali účinky na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Forxiga nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti majú byť upozornení na riziko hypoglykémie pri užívaní dapagliflozínu v kombinácii so sulfonylureou alebo inzulínom.
4.
8 Nežiaduce účinky
Zhrnutie
bezpečnostného
profilu
Diabetes mellitus 2. typu
V klinických štúdiách s diabetes mellitus 2. typu bolo viac ako 15 000 pacientov liečených
dapagliflozínom.
Primárne hodnotenie bezpečnosti a znášanlivosti sa vykonalo v súhrnnej vopred špecifikovanej analýze 13 krátkodobých (do 24 týždňov) placebom kontrolovaných štúdií s 2 360 jedincami liečenými dapagliflozínom 10 mg a s 2 295 jedincami dostávajúcimi placebo.
V štúdii s dapagliflozínom sledujúcej kardiovaskulárne účinky pri liečbe diabetes mellitus 2. typu (štúdia DECLARE, pozri časť 5.1) dostávalo 8 574 pacientov dapagliflozín 10 mg a 8 569 pacientov dostávalo placebo s mediánom času expozície 48 mesiacov. Celkovo bolo 30 623 pacientorokov expozície dapagliflozínu.
Najčastejšie hlásenými nežiaducimi reakciami vo všetkých klinických štúdiách boli genitálne infekcie.
Diabetes mellitus 1. typu
V dvoch placebom kontrolovaných štúdiách u osôb s diabetes mellitus 1. typu bolo 548 osôb liečených 5 mg dapagliflozínu a nastaviteľnou dávkou inzulínu a 532 osôb bolo liečených placebom a nastaviteľnou dávkou inzulínu.
Bezpečnostný profil dapagliflozínu u osôb s diabetes mellitus 1. typu bol podobný ako známy bezpečnostný profil dapagliflozínu u osôb s diabetes mellitus 2. typu. U pacientov s diabetes mellitus
1. typu bola diabetická ketoacidóza hlásená s častou frekvenciou. Pozri „Popis vybraných nežiaducich
reakcií“ a časť 4.4.
Srdcové zlyhávanie
V štúdii s dapagliflozínom sledujúcej kardiovaskulárne účinky liečby u pacientov so srdcovým zlyhávaním so zníženou ejekčnou frakciou (štúdia DAPA-HF) bolo 2 368 pacientov liečených 10 mg dapagliflozínu a 2 368 pacientov dostávalo placebo s mediánom času expozície 18 mesiacov. Populácia pacientov zahŕňala pacientov s diabetes mellitus 2. typu a pacientov bez diabetu,
a pacientov s eGFR ≥ 30 ml/min/1,73 m2.
Celkový bezpečnostný profil dapagliflozínu u pacientov so srdcovým zlyhávaním bol v súlade so známym bezpečnostným profilom dapagliflozínu.
Tabuľkový zoznam nežiaducich reakcií
Nasledujúce nežiaduce reakcie boli zistené v placebom kontrolovaných klinických štúdiách
a v sledovaní po uvedení lieku na trh. Pre žiadnu sa nezistila súvislosť s dávkou. Nežiaduce reakcie uvedené nižšie sú klasifikované podľa frekvencie a tried orgánových systémov (system organ class, SOC). Kategórie frekvencií sú definované podľa nasledovných pravidiel: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (nemožno odhadnúť z dostupných údajov).
Triedy orgánových
systémov
|
Veľm
i časté
|
Časté
*
|
Mene
j časté
**
|
Zriedkavé
|
Veľm
i zriedkavé
|
Infekcie a nákazy
|
|
Vulvovaginitída,
balanitída a súvisiace genitálne infekcie*,b,c Infekcia močových ciest*,b,d
|
Plesňová
infekcia**
|
|
Nekrotizujúca
fasciitída perinea (Fournierova gangréna)b,i
|
Poruch
y metabolizmu
a výživy
|
Hypoglykémia
(keď sa použil so SU alebo inzulínom)b
|
Diabetická
ketoacidóza
(pri diabetes mellitus
1. typu)b,i,k
|
Deplécia
objemub,e
Smäd**
|
Diabetická
ketoacidóza (pri diabetes mellitus 2. typu)b,i,k
|
|
Poruch
y nervového
systému
|
|
Závrat
|
|
|
|
Poruchy
gastrointestinálneho
traktu
|
|
|
Zápcha**
Sucho v ústach**
|
|
|
Poruch
y kože
a podkožného tkaniva
|
|
Vyrážkaj
|
|
|
Angioedém
|
Poruch
y kostrovej
a svalovej sústavy
a spojivového tkaniva
|
|
Bolesť chrbta*
|
|
|
|
Poruch
y obličiek
a močových ciest
|
|
Dyzúria
Polyúria*,f
|
Noktúria**
|
|
|
Poruchy
reprodukčného systém
u a prsníkov
|
|
|
Vulvovaginálny
pruritus**
Genitálny
pruritus**
|
|
|
Laboratórne
a funkčné vyšetrenia
|
|
Zvýšenie
hematokritug
Zníženie renálneho klírensu kreatinínu počas úvodnej liečbyb Dyslipidémiah
|
Zvýšenie
kreatinínu v krvi počas úvodnej liečby**,b Zvýšenie močoviny
v krvi** Zníženie hmotnosti**
|
|
|
|
|
Tabuľk
a 2 Nežiaduce reakcie v placebom kontrolovaných klinických štúdiách
a
a postmarketingové skúsenosti
aTabuľka ukazuje až 24-týždňové (krátkodobé) údaje bez ohľadu na záchrannú liečbu glykémie.
bĎalšie informácie pozri v súvisiacich odsekoch nižšie.
cVulvovaginitída, balanitída a súvisiace genitálne infekcie zahŕňajú, napr. preferované termíny: vulvovaginálna
mykotická infekcia, vaginálna infekcia, balanitída, genitálna plesňová infekcia, vulvovaginálna kandidóza, vulvovaginitída, kandidová balanitída, genitálna kandidóza, genitálna infekcia, genitálna infekcia u mužov, infekcia penisu, vulvitída, bakteriálna vaginitída a absces vulvy.
dInfekcia močových ciest zahŕňa nasledujúce preferované termíny uvedené v poradí hlásenej frekvencie: infekcia močových ciest, cystitída, infekcia močových ciest zapríčinená baktériami Escherichia, infekcie urogenitálneho traktu, pyelonefritída, trigonitída, uretritída, infekcia obličiek a prostatitída.
eDeplécia objemu zahŕňa, napr. preferované termíny: dehydratácia, hypovolémia, hypotenzia.
fPolyúria zahŕňa preferované termíny: polakizúria, polyúria, zvýšená tvorba moču.
gPriemerná zmena hematokritu oproti východiskovej hodnote bola 2,30 % pri dapagliflozíne 10 mg oproti -0,33 % pri placebe. Hodnoty hematokritu > 55 % boli hlásené u 1,3 % jedincov liečených
dapagliflozínom 10 mg oproti 0,4 % u jedincov s placebom.
hPriemerná percentuálna zmena z východiskovej hodnoty pre dapagliflozín 10 mg oproti placebu bola
v uvedenom poradí: celkový cholesterol 2,5 % oproti 0,0 %; HDL cholesterol 6,0 % oproti 2,7 %; LDL
cholesterol 2,9 % oproti -1,0 %; triglyceridy -2,7 % oproti -0,7 %.
i pozri časť 4.4
j Nežiaduca reakcia sa zistila po uvedení lieku na trh. Vyrážka zahŕňa nasledujúce preferované termíny uvedené v poradí podľa frekvencie v klinických štúdiách: vyrážka, generalizovaná vyrážka, pruritická vyrážka,
makulárna vyrážka, makulopapulárna vyrážka, pustulárna vyrážka, vezikulárna vyrážka a erytematózna vyrážka. V aktívne a placebom kontrolovaných klinických štúdiách (dapagliflozín, N = 5 936, celková kontrola, N =
3 403), frekvencia vyrážky bola podobná pre dapagliflozín (1,4 %) a celkovú kontrolu (1,4 %), v uvedenom poradí.
k Frekvencia nežiaducej reakcie bola identifikovaná v celej skúmanej populácii v 2 placebom kontrolovaných štúdiách u osôb s diabetes mellitus 1. typu.
l Hlásené v štúdii sledujúcej kardiovaskulárne účinky liečby u pacientov s diabetes 2. typu (DECLARE). Frekvencia je uvedená na základe ročného výskytu.
*Hlásené u ≥ 2 % jedincov a o ≥ 1 % častejšie a minimálne u ďalších 3 jedincov liečených s dapagliflozínom
10 mg v porovnaní s placebom.
**Hlásené skúšajúcim ako možno súvisiace, pravdepodobne súvisiace alebo súvisiace so skúmanou liečbou a hlásené u ≥ 0,2 % jedincov a o ≥ 0,1 % častejšie a minimálne u viac ako u 3 jedincov liečených
dapagliflozínom 10 mg v porovnaní s placebom.
Popis vybraných nežiaducich reakcií
Vulvovaginitída, balanitída a súvisiace genitálne infekcie
V súhrnnej analýze z 13 bezpečnostných štúdií boli vulvovaginitída, balanitída a súvisiace genitálne infekcie hlásené u 5,5 % jedincov užívajúcich dapagliflozín 10 mg a u 0,6 % jedincov, ktorí dostávali placebo. Väčšina infekcií bola mierna až stredne závažná a jedinci odpovedali na začiatočnú štandardnú liečbu a zriedkavo vyústili do ukončenia liečby dapagliflozínom. Tieto infekcie boli častejšie u žien (8,4 % a 1,2 % pre dapagliflozín a placebo, v uvedenom poradí) a u jedincov
s infekciami v anamnéze bola pravdepodobnosť rekurentných infekcií väčšia.
V štúdii DECLARE boli počty pacientov so závažnými nežiaducimi udalosťami genitálnych infekcií nízke a vyvážené: 2 pacienti v skupine s dapagliflozínom a 2 v skupine s placebom.
V štúdii DAPA-HF sa u žiadneho z pacientov v skupine s dapagliflozínom nehlásili závažné nežiaduce udalosti genitálnych infekcií, pričom tieto sa hlásili u jedného pacienta v skupine
s placebom. 7 (0,3 %) pacientov v skupine s dapagliflozínom malo nežiaduce udalosti vedúce
k ukončeniu liečby v dôsledku genitálnych infekcií, pričom v skupine s placebom nemal tieto udalosti žiadny pacient.
Nekrotizujúca fasciitída perinea (Fournierova gangréna)
U pacientov užívajúcich inhibítory SGLT2, vrátane dapagliflozínu, boli po uvedení lieku na trh hlásené prípady Fournierovej gangrény (pozri časť 4.4).
V štúdii DECLARE zahŕňajúcej 17 160 pacientov s diabetes mellitus 2. typu, s mediánom trvania expozície 48 mesiacov sa zaznamenalo celkovo 6 prípadov Fournierovej gangrény, jeden v skupine liečenej dapagliflozínom a 5 v skupine s placebom.
Hypoglykémia
Frekvencia výskytu hypoglykémie závisela od typu základnej liečby použitej v klinických štúdiách s diabetes mellitus.
V štúdiách s dapagliflozínom v monoterapii po pridaní k metformínu alebo po pridaní ku sitagliptínu (s metformínom alebo bez metformínu), frekvencia výskytu menej významných epizód hypoglykémie bola v liečených skupinách, vrátane placeba, podobná (< 5 %) až do 102 týždňov liečby. Vo všetkých štúdiách bol výskyt významných epizód hypoglykémie menej častý a v skupinách liečených
s dapagliflozínom alebo placebom porovnateľný. V štúdiách prídavnej liečby k sulfonyluree a prídavnej liečby k inzulínu bol výskyt hypoglykémie vyšší (pozri časť 4.5).
V štúdii prídavnej liečby ku glimepiridu boli v 24. a 48. týždni menej významné epizódy hypoglykémie hlásené častejšie v skupine liečenej s dapagliflozínom 10 mg a glimepiridom (6,0 % a 7,9 % v uvedenom poradí) ako v skupine s placebom a glimepiridom (2,1 % a 2,1 % v uvedenom poradí).
V štúdii prídavnej liečby k inzulínu boli významné epizódy hypoglykémie hlásené u 0,5 % a 1,0 % jedincov liečených dapagliflozínom 10 mg s inzulínom po 24 a 104 týždňoch, v uvedenom poradí, a u 0,5 % jedincov v skupine liečenej placebom s inzulínom po 24 a 104 týždňoch. Po
24 a 104 týždňoch boli menej významné epizódy hypoglykémie hlásené v uvedenom poradí u 40,3 %
a 53,1 % jedincov, ktorí dostávali dapagliflozín 10 mg s inzulínom a u 34,0 % a 41,6 % jedincov, ktorí dostávali placebo s inzulínom.
V štúdii prídavnej liečby k metformínu a sulfonylurey neboli hlásené žiadne významné epizódy hypoglykémie až do 24 týždňov. Menej významné epizódy hypoglykémie boli hlásené u 12,8 % jedincov, ktorí dostávali dapagliflozín 10 mg s metformínom a sulfonylureou a u 3,7 % jedincov, ktorí dostávali placebo s metformínom a sulfonylureou.
V štúdii DECLARE sa pri dapagliflozíne v porovnaní s placebom nepozorovalo zvýšené riziko významných epizód hypoglykémie. Významné epizódy hypoglykémie sa hlásili u 58 (0,7 %) pacientov liečených dapagliflozínom a u 83 (1,0 %) pacientov dostávajúcich placebo.
V štúdii DAPA-HF sa významné udalosti hypoglykémie hlásili u 4 (0,2 %) pacientov v liečebnej skupine s dapagliflozínom aj v skupine s placebom a pozorovali sa iba u pacientov s diabetes mellitus
2. typu.
Deplécia objemu
V súhrnnej analýze z 13 bezpečnostných štúdií boli hlásené reakcie naznačujúce depléciu objemu (vrátane hlásení dehydratácie, hypovolémie alebo hypotenzie) u 1,1 % jedincov užívajúcich dapagliflozín 10 mg a u 0,7 % jedincov užívajúcich placebo; závažné reakcie sa vyskytli u < 0,2 % jedincov a ich výskyt pri použití dapagliflozínu 10 mg a placeba bol vyrovnaný (pozri časť 4.4).
V štúdii DECLARE boli počty pacientov s udalosťami naznačujúcimi depléciu objemu vyrovnané medzi oboma liečebnými skupinami: 213 (2,5 %) v skupine s dapagliflozínom a 207 (2,4 %)
v skupine s placebom. Závažné nežiaduce udalosti sa hlásili u 81 (0,9 %) pacientov v skupine s dapagliflozínom a u 70 (0,8 %) pacientov v skupine s placebom. Výskyt udalostí bol vo všeobecnosti vyrovnaný medzi oboma liečebnými skupinami vo všetkých podskupinách zahŕňajúcich vek, užívanie diuretík, krvný tlak a užívanie inhibítorov enzýmu konvertujúceho angiotenzín
(ACE-I)/blokátorov receptorov typu 1 pre angiotenzín II (ARB). U pacientov s eGFR
< 60 ml/min/1,73 m2 na začiatku bolo v skupine s dapagliflozínom 19 závažných nežiaducich udalostí
naznačujúcich depléciu objemu a 13 udalostí v skupine s placebom.
V štúdii DAPA-HF bolo 170 (7,2 %) pacientov s udalosťami naznačujúcimi depléciu objemu
v skupine s dapagliflozínom a 153 (6,5 %) v skupine s placebom. V skupine s dapagliflozínom bolo menej pacientov so závažnými udalosťami príznakov naznačujúcich depléciu objemu (23 [1,0 %])
v porovnaní so skupinou s placebom (38 [1,6 %]). Výsledky boli podobné bez ohľadu na východiskový výskyt diabetu a východiskovú eGFR.
Diabetická ketoacidóza pri diabetes mellitus 2. typu
V štúdii DECLARE s mediánom expozície 48 mesiacov boli udalosti DKA hlásené u 27 pacientov
v skupine s dapagliflozínom 10 mg a u 12 pacientov v skupine s placebom. Udalosti sa vyskytli rovnomerne počas celého trvania štúdie. Z 27 pacientov s udalosťami DKA v skupine
s dapagliflozínom bolo 22 v čase udalosti súbežne liečených inzulínom. Spúšťacie faktory pre DKA sa v populácii s diabetes mellitus typu 2. očakávali (pozri časť 4.4).
V štúdii DAPA-HF sa udalosti DKA hlásili u 3 pacientov s diabetes mellitus 2. typu v skupine s dapagliflozínom, pričom v skupine s placebom sa tieto udalosti nehlásili u žiadneho pacienta.
Diabetická ketoacidóza pri diabetes mellitus 1. typu
V dvoch placebom kontrolovaných klinických štúdiách s dapagliflozínom pri diabetes mellitus 1. typu
sa pacientom odporúčalo sledovať si hladinu ketónov v krvi pri podozrení na príznaky DKA
a vyhľadať lekársku pomoc, ak si namerali v krvi hladinu ketónov ≥ 0,6 mmol/l. V súhrnných
52-týždňových údajoch boli udalosti DKA hlásené u 22 (4,0 %) pacientov v skupine s 5 mg dapagliflozínu a u 6 (1,1 %) pacientov v skupine s placebom, čo zodpovedá miere výskytu 4,62 pre
5 mg dapagliflozínu a 1,27 pre placebo na 100 pacientorokov. Udalosti DKA sa vyskytovali rovnomerne počas trvania klinickej štúdie. Najčastejšie spúšťacie faktory boli nedostatočné dávky inzulínu (vynechaná dávka inzulínu alebo porucha inzulínovej pumpy). 6 z 23 udalostí DKA
v skupine s 5 mg dapagliflozínu sa vyskytlo u pacientov s hladinou glukózy v krvi v euglykemickom rozmedzí (< 14 mmol/l alebo 250 mg/dl).
Infekciemočových ciestV súhrnnej analýze z 13 bezpečnostných štúdií boli infekcie močových ciest častejšie hlásené pri dapagliflozíne 10 mg v porovnaní s placebom (4,7 % oproti 3,5 % v uvedenom poradí; pozri časť 4.4). Väčšina infekcií bola mierna až stredne závažná a jedinci odpovedali na začiatočnú štandardnú liečbu
a zriedkavo viedli k ukončeniu liečby dapagliflozínom. Tieto infekcie boli častejšie u žien a u jedincov s infekciami v anamnéze bola pravdepodobnosť rekurentných infekcií väčšia.
V štúdii DECLARE boli závažné udalosti infekcií močových ciest hlásené menej často pri dapagliflozíne 10 mg v porovnaní s placebom, 79 (0,9 %) udalostí oproti 109 (1,3 %) v uvedenom poradí.
V štúdii DAPA-HF bolo 14 (0,6 %) pacientov so závažnými nežiaducimi udalosťami infekcií močových ciest v skupine s dapagliflozínom a 17 (0,7 %) v skupine s placebom. 5 (0,2 %) pacientov v skupine s dapagliflozínom aj v skupine s placebom malo nežiaduce udalosti vedúce k ukončeniu liečby v dôsledku infekcií močových ciest.
Zvýšený kreatinínNežiaduce reakcie týkajúce sa zvýšeného kreatinínu boli zoskupené (napr. znížený renálny klírens kreatinínu, porucha funkcie obličiek, zvýšená hladina kreatinínu v krvi a znížená rýchlosť glomerulárnej filtrácie). V bezpečnostnom súhrne 13 štúdií bolo toto zoskupenie reakcií hlásené
u 3,2 % pacientov, ktorí dostávali dapagliflozín 10 mg a u 1,8 % pacientov, ktorí dostávali placebo.
U pacientov s normálnou funkciou obličiek alebo s miernou poruchou funkcie obličiek (východisková hodnota eGFR ≥ 60 ml/min/1,73 m2) bolo toto zoskupenie reakcií hlásené u 1,3 % pacientov, ktorí dostávali dapagliflozín 10 mg a u 0,8 % pacientov, ktorí dostávali placebo. Tieto reakcie boli častejšie u pacientov s východiskovou hodnotou eGFR ≥ 30 a < 60 ml/min/1,73 m2 (18,5 % pri dapagliflozíne
10 mg oproti 9,3 % pri placebe).
Ďalšie hodnotenie pacientov, u ktorých sa vyskytli nežiaduce udalosti týkajúce sa obličiek, preukázalo, že väčšina z nich mala zmeny sérového kreatinínu ≤ 0,5 mg/dl oproti východiskovej hodnote. Zvýšenia kreatinínu boli zvyčajne prechodné počas kontinuálnej liečby alebo reverzibilné po ukončení liečby.
V štúdii DECLARE zahŕňajúcej starších pacientov a pacientov s poruchou funkcie obličiek (eGFR nižšia ako 60 ml/min/1,73 m2) sa eGFR postupom času znižovala v oboch liečebných skupinách. 1. rok bola priemerná hodnota eGFR mierne nižšia a 4. rok bola priemerná hodnota eGFR mierne vyššia v skupine s dapagliflozínom v porovnaní so skupinou s placebom.
V štúdii DAPA-HF sa eGFR v skupine s dapagliflozínom aj v skupine s placebom znižovala v priebehu času. Začiatočné zníženie priemernej eGFR v skupine s dapagliflozínom
bolo -4,3 ml/min/1,73 m2 a v skupine s placebom -1,1 ml/min/1,73 m2. Po 20 mesiacoch bola zmena eGFR oproti východiskovej hodnote podobná medzi liečebnými skupinami: -5,3 ml/min/1,73 m2 pre
dapagliflozín a -4,5 ml/min/1,73 m2 pre placebo.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNepreukázala sa toxicita dapagliflozínu u zdravých jedincov užívajúcich jednotlivé dávky až do
500 mg perorálne (50-násobok maximálnej odporúčanej dávky u ľudí). Títo jedinci mali glukózu detegovateľnú v moči po dobu, ktorá závisela od dávky (najmenej 5 dní pri dávke 500 mg), bez
akýchkoľvek hlásení dehydratácie, hypotenzie alebo nerovnováhy elektrolytov a bez akéhokoľvek klinicky významného účinku na QTc interval. Výskyt hypoglykémie bol podobný ako pri placebe. V klinických štúdiách s podávaním dávok jedenkrát denne až do 100 mg denne (10-násobok maximálnej odporúčanej dávky u ľudí) počas 2 týždňov zdravým jedincom a jedincom s diabetes mellitus 2. typu, bol výskyt hypoglykémie v porovnaní s placebom mierne vyšší a nebol závislý od dávky. Výskyt nežiaducich udalostí vrátane dehydratácie alebo hypotenzie bol podobný ako pri
placebe a nezistili sa žiadne klinicky významné zmeny výsledkov laboratórnych testov vrátane hodnôt elektrolytov v sére a biomarkerov funkcie obličiek v závislosti od dávky.
V prípade predávkovania je v závislosti od klinického stavu pacienta potrebné zahájiť vhodnú podpornú liečbu. Odstránenie dapagliflozínu hemodialýzou sa nesledovalo.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antidiabetiká, inhibítory sodíko-glukózového kotransportéra 2 (SGLT2), ATC kód: A10BK01
Mechanizmus účinku
Dapagliflozín je vysoko účinným (Ki: 0,55 nM), selektívnym a reverzibilným inhibítorom SGLT2.
Inhibícia SGLT2 dapagliflozínom znižuje reabsorpciu glukózy z glomerulárneho filtrátu
v proximálnom tubule obličiek za súbežného zníženia reabsorpcie sodíka, čo vedie k vylučovaniu glukózy močom a osmotickej diuréze. Dapagliflozín preto zvyšuje transport sodíka do distálneho tubulu. Predpokladá sa, že toto zvyšuje tubuloglomerulárnu spätnú väzbu a znižuje intraglomerulárny tlak. V kombinácii s osmotickou diurézou to vedie k zníženiu objemového preťaženia, zníženiu krvného tlaku a nižšiemu predpätiu (preload) a doťaženiu (afterload) srdca, čo môže mať priaznivé účinky na remodeláciu srdca. Ďalšie účinky zahŕňajú zvýšenie hematokritu a zníženie telesnej hmotnosti. Ako sa preukázalo v štúdii DAPA-HF, prínosy dapagliflozínu týkajúce sa srdca nie sú výlučne závislé od účinku znižujúceho hladinu glukózy v krvi a nie sú obmedzené len na pacientov
s diabetom.
Dapagliflozín zlepšuje hladinu glukózy v plazme nalačno aj po jedle znižovaním reabsorpcie glukózy obličkami, čo vedie k vylučovaniu glukózy močom. Toto vylučovanie glukózy (glykozúria) je pozorované po prvej dávke, pretrváva počas 24 hodinového intervalu dávkovania a udržiava sa počas trvania liečby. Množstvo glukózy odstránenej obličkami prostredníctvom tohto spôsobu účinku závisí od koncentrácie glukózy v krvi a od GFR. V dôsledku toho má dapagliflozín u osôb s normálnou hladinou glukózy v krvi nízku tendenciu spôsobovať hypoglykémiu. V odpovedi na hypoglykémiu dapagliflozín nezhoršuje normálnu endogénnu tvorbu glukózy. Dapagliflozín pôsobí nezávisle od sekrécie a účinku inzulínu. V klinických štúdiách s dapagliflozínom sa pozorovalo zlepšenie funkcie beta buniek hodnotením pomocou modelu homeostázy (Homeostasis Model Assessment-β,
HOMA-β).
SGLT2 je selektívne exprimovaný v obličkách. Dapagliflozín neinhibuje iné transportéry dôležité pre transport glukózy do periférnych tkanív a je > 1 400-násobne selektívnejší pre SGTL2 ako pre SGTL1, hlavný transportér v čreve zodpovedný za absorpciu glukózy.
Farmakodynamické účinky
Po podaní dapagliflozínu sa u zdravých jedincov a u jedincov s diabetes mellitus 2. typu zaznamenalo
zvýšené množstvo glukózy v moči. Pri dávke dapagliflozínu 10 mg denne počas 12 týždňov
u jedincov s diabetes mellitus 2. typu sa močom vylúčilo približne 70 g glukózy (čo zodpovedá
280 kcal/deň). Sledovalo sa trvalé vylučovanie glukózy u pacientov s diabetes mellitus 2. typu, ktorým sa podával dapagliflozín 10 mg/deň až 2 roky.
Pri dapagliflozíne malo vylučovanie glukózy močom za následok aj osmotickú diurézu a zvýšený objem moču u pacientov s diabetes mellitus 2. typu. Zvýšenie objemu moču u pacientov s diabetes mellitus 2. typu liečených dapagliflozínom 10 mg zostalo zachované po 12 týždňoch a predstavovalo približne 375 ml/deň. Zvýšenie objemu moču sa spájalo s malým a prechodným zvýšením vylučovania sodíka močom, ktoré nesúviselo so zmenami koncentrácií sodíka v sére.
Prechodne (3 až 7 dní) sa zvýšilo aj vylučovanie kyseliny močovej močom a bolo sprevádzané pretrvávajúcim poklesom koncentrácie kyseliny močovej v sére. Po 24 týždňoch sa pokles koncentrácie kyseliny močovej v sére pohyboval v rozmedzí -48,3 až -18,3 mikromolov/l
(-0,87 až -0,33 mg/dl).
Klinická účinnosť a bezpečnosť
Diabetes mellitus 2. typu
Zlepšenie kontroly glykémie aj zníženie kardiovaskulárnej morbidity a mortality sú neoddeliteľnou
súčasťou liečby diabetu 2. typu.
Na hodnotenie glykemickej účinnosti a bezpečnosti Forxigy sa vykonalo štrnásť dvojito zaslepených, randomizovaných, kontrolovaných klinických štúdií u 7 056 jedincov s diabetom 2. typu;
4 737 jedincov bolo v týchto štúdiách liečených dapagliflozínom. Dĺžka liečby bola v dvanástich štúdiách 24 týždňov, v 8 štúdiách s dlhodobým rozšírením bola v rozmedzí od 24 do 80 týždňov (až do celkového trvania štúdie 104 týždňov), v jednej štúdii bola 28 týždňov a v jednej štúdii bola
52 týždňov s dlhodobým rozšírením 52 a 104 týždňov (celkové trvanie štúdie 208 týždňov). Priemerná dĺžka liečby diabetu bola v rozmedzí od 1,4 do 16,9 rokov. Päťdesiat percent (50 %) malo miernu poruchu funkcie obličiek a 11 % malo stredne závažnú poruchu funkcie obličiek. Päťdesiatjeden percent (51 %) jedincov boli muži, 84 % belosi, 8 % aziati, 4 % černosi a 4 % príslušníci iných rás. Osemdesiatjeden percent (81 %) jedincov malo index telesnej hmotnosti
(BMI) ³ 27. Okrem toho sa uskutočnili dve 12-týždňové, placebom kontrolované štúdie u pacientov s nedostatočne kontrolovaným diabetom 2. typu a hypertenziou.
Štúdia kardiovaskulárnych účinkov liečby (DECLARE) sa uskutočnila s dapagliflozínom 10 mg v porovnaní s placebom u 17 160 pacientov s diabetes mellitus 2. typu s potvrdeným kardiovaskulárnym ochorením alebo bez neho, aby sa vyhodnotil účinok na kardiovaskulárne
a renálne udalosti.
Kontrola glykémie
Monoterapia
Na hodnotenie bezpečnosti a účinnosti monoterapie Forxigy sa u pacientov s nedostatočne kontrolovaným diabetes mellitus 2. typu vykonala dvojito zaslepená, placebom kontrolovaná štúdia v trvaní 24 týždňov (s pridaním obdobia rozšírenia). Liečba dapagliflozínom jedenkrát denne sa
v porovnaní s placebom prejavila štatisticky významnými (p < 0,0001) poklesmi hodnôt HbA1c
(tabuľka 3).
V období rozšírenej štúdie sa pokles hodnôt HbA1c zachoval až do 102. týždňa (upravená priemerná zmena od východiskových hodnôt -0,61 % pre dapagliflozín 10 mg a -0,17 % pre placebo).

 Tabuľk
a 3 Výsledky z 24. týždňa (LOCF
a
) placebom kontrolovanej štúdie dapagliflozínu v monoterapii
Tabuľk
a 3 Výsledky z 24. týždňa (LOCF
a
) placebom kontrolovanej štúdie dapagliflozínu v monoterapii
Dapagliflozín
Monoterapia
Placebo
10
mg
N
b
70 75
HbA1
c (%)
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Rozdiel oproti placebuc

(95 % IS)
Jedinci (%) dosahujúci: HbA1c < 7 %8,01
-0,89
-0,66*
(-0,96; -0,36)
7,79
-0,23
Upravený podľa východiskovej

hodnoty
Telesná hmotnosť (kg)50,8§ 31,6
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Rozdiel oproti placebuc
(95 % IS)
94,13
-3,16
-0,97
(-2,20; 0,25)
88,77
-2,19

aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred podaním záchrannej liečby zachráneným pacientom)
bVšetci zaradení jedinci, ktorí užili aspoň 1 dávku skúšaného lieku v štúdii pri dvojitom zaslepení počas
krátkodobého dvojito zaslepeného obdobia
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty
*p-hodnota < 0,0001 oproti placebu
§Nie je hodnotený z hľadiska štatistickej významnosti v dôsledku sekvenčného testovania sekundárnych koncových ukazovateľov
Prídavná kombinovaná liečbaV 52-týždňovej aktívne kontrolovanej non-inferiórnej štúdii (s 52 a 104-týždňovým rozšíreným obdobím) sa hodnotila Forxiga v prídavnej liečbe k metformínu v porovnaní so sulfonylureou (glipizid) v prídavnej liečbe k metformínu u jedincov s nedostatočnou kontrolou glykémie
(HbA1c > 6,5 % a ≤ 10 %). Výsledky v porovnaní s glipizidom preukázali podobný priemerný pokles
HbA1c od východiskovej hodnoty do 52. týždňa, čo dokazuje non-inferioritu (tabuľka 4). V 104. týždni bola upravená priemerná zmena od východiskovej hodnoty v HbA1c -0,32 % pre dapagliflozín a -0,14 % pre glipizid. V 208. týždni bola upravená priemerná zmena od východiskovej hodnoty
v HbA1c -0,10 % pre dapagliflozín a 0,20 % pre glipizid. Po 52, 104 a 208 týždňoch zaznamenalo najmenej jednu epizódu hypoglykémie významne menej jedincov v skupine liečenej dapagliflozínom (3,5 %, 4,3 % a 5,0 % v uvedenom poradí) v porovnaní so skupinou liečenou glipizidom (40,8 %,
47 % a 50,0 % v uvedenom poradí). V 104. a 208. týždni bol podiel jedincov, ktorí zostali v štúdii
56,2 % a 39,7 % pre skupinu liečených dapagliflozínom a 50,0 % a 34,6 % pre skupinu liečených glipizidom.
 Ta
b
u
ľ
k
a 4 Výsledky z 52. týždňa (LOCF
a
) aktívne kontrolovanej štúdie porovnávajúcej dapagliflozín s glipizidom v prídavnej liečbe k metformínu
Ta
b
u
ľ
k
a 4 Výsledky z 52. týždňa (LOCF
a
) aktívne kontrolovanej štúdie porovnávajúcej dapagliflozín s glipizidom v prídavnej liečbe k metformínu
Dapagliflozín
Glipizid
 U
k
azovateľ
+
me
t
formín +
me
t
formín
N
U
k
azovateľ
+
me
t
formín +
me
t
formín
Nb 400 401
HbA1c (%)
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Rozdiel v porovnaní s glipizidom + metformínc

(95 % IS)
Telesná hmotnosť (kg) Východiskový stav (priemer) Zmena od východiskového stavuc
Rozdiel oproti glipizid + metformínc
(95 % IS)
7,69
-0,52
0,00d
(-0,11; 0,11)
88,44
-3,22
-4,65*
(-5,14; -4,17)
7,74
-0,52
87,60
1,44

aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii
bRandomizovaní a liečení jedinci, u ktorých sa meranie vykonalo na začiatku a najmenej jedenkrát po
základnom hodnotení účinnosti
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty
dNon-inferiórny s kombináciou glipizid + metformín
*p-hodnota < 0,0001
Dapagliflozín v prídavnej liečbe k metformínu, glimepiridu, metformínu a sulfonylurey, sitagliptínu
(s metformínom alebo bez metformínu) alebo inzulínu v porovnaní s podávaním placeba spôsobil štatisticky významný pokles HbA1c po 24 týždňoch (p < 0,0001; tabuľky 5, 6 a 7).
Pokles HbA1c zaznamenaný v 24. týždni zostal zachovaný v prídavných kombinovaných štúdiách (glimepirid a inzulín) s údajmi zo 48. týždňa (glimepirid) a s údajmi až do 104. týždňa (inzulín). V 48. týždni, keď sa pridal k sitagliptínu (s metformínom alebo bez metformínu) priemerná zmena upravená podľa východiskovej hodnoty pre dapagliflozín 10 mg a placebo bola -0,30 % a 0,38 %, v uvedenom poradí. V prípade prídavnej štúdie k metformínu sa pokles HbA1c zachoval do 102. týždňa (priemerná zmena upravená podľa východiskovej hodnoty -0,78 % pre 10 mg a 0,02 % pre placebo). V 104.
týždni pre inzulín (s alebo bez pridania ďalších perorálnych liekov na zníženie glukózy) bol pokles
HbA1c -0,71 % a -0,06 % upravenej priemernej zmeny od východiskových hodnôt pre dapagliflozín
10 mg a placebo, v uvedenom poradí. Po 48 a 104 týždňoch zostala dávka inzulínu s priemernou dávkou 76 IU/deň stabilná v porovnaní s východiskovou hodnotou u jedincov liečených dapagliflozínom 10 mg. V skupine s placebom došlo k zvýšeniu priemeru 10,5 IU/deň a 18,3 IU/deň od východiskovej hodnoty (stredná priemerná dávka 84 a 92 IU/deň) po 48 a 104 týždňoch,
v uvedenom poradí. V 104. týždni bol podiel jedincov, ktorí zostali v štúdii 72,4 % pre skupinu liečených dapagliflozínom 10 mg a 54,8 % pre skupinu s placebom.
Tabuľk
a 5 Výsledky 24-týždňových (LOCF
a
) placebom kontrolovaných štúdií dapagliflozínu
 v prídavnej kombinovanej liečbe s metformínom alebo sitagliptínom (s metformínom alebo bez metformínu)
v prídavnej kombinovanej liečbe s metformínom alebo sitagliptínom (s metformínom alebo bez metformínu)
 Prídavn
á kombinácia
Metformín
Prídavn
á kombinácia
Metformín1
DPP-4 inhibítor (sitagliptín
(sitagliptín2)
± metformín1
Nb
| Dapagliflozín
10 mg
135
| Placebo
137
| Dapagliflozín
10 mg
223
| Placebo
224
|
HbA1c (%)
|
|
|
|
|
Východisková hodnota
| 7,92
| 8,11
| 7,90
| 7,97
|
(priemer)
|
|
|
|
|
Zmena od východiskovej
| -0,84
| -0,30
| -0,45
| 0,04
|
hodnoty
|
|
|
|
|
Rozdiel oproti placebuc
-0,54*
-0,48*
(95 % IS)
|
(-0,74; -0,34)
|
|
(-0,62; -0,34)
|
|
Jedinc
i (%) dosahujúci:
|
|
|
|
|
HbA1
c < 7 %
|
|
|
|
|
Upravený podľa
|
40,6**
|
25,9
|
|
|
východiskovej hodnoty
|
|
|
|
|
Telesn
á hmotnosť (kg)
|
|
|
|
|
Východisková hodnota
|
86,28
|
87,74
|
91,02
|
89,23
|
(priemer)
|
|
|
|
|
Zmena od východiskovej
|
-2,86
|
-0,89
|
-2,14
|
-0,26
|
hodnoty
|
|
|
|
|
Rozdiel oproti placebuc
|
-1,97*
|
|
-1,89*
|
|
(95 % IS)
|
(-2,63; -1,31)
|
|
(-2,37; -1,40)
|
|
|
|
1Metformín ≥ 1 500 mg/deň
2sitagliptín 100 mg/deň
aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred podaním záchrannej liečby zachráneným pacientom)
bVšetci randomizovaní jedinci, ktorí užili aspoň jednu dávku v dvojito zaslepenej štúdii počas krátkodobého dvojito zaslepeného obdobia
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty
*p-hodnota < 0,0001 oproti placebu + perorálne antidiabetikum
**p-hodnota < 0,05 oproti placebu + perorálne antidiabetikum
 Tabuľk
a 6 Výsledky 24-týždňových placebom kontrolovaných štúdií dapagliflozínu v prídavnej kombinovanej liečbe so sulfonylureou (glimepirid) alebo metformín a sulfonylurea
Prídavn
á kombinácia
Tabuľk
a 6 Výsledky 24-týždňových placebom kontrolovaných štúdií dapagliflozínu v prídavnej kombinovanej liečbe so sulfonylureou (glimepirid) alebo metformín a sulfonylurea
Prídavn
á kombinácia
 Sulfonylurea
(glimepiri
d
Sulfonylurea
(glimepiri
d1
)Sulfonylurea + metformín
+ metformín2
Na
|
Dapagliflozín
10 mg
151
|
Placebo
145
|
Dapagliflozín
10 mg
108
|
Placebo
108
|
HbA1
c (%)b
|
|
|
|
|
Východisková hodnota (priemer)
|
8,07
|
8,15
|
8,08
|
8,24
|
Zmena od východiskovej hodnotyc
|
-0,82
|
-0,13
|
-0,86
|
-0,17
|
Rozdiel oproti placebuc
|
-0,68*
|
|
-0,69*
|
|
(95 % IS)
|
(-0,86; -0,51)
|
|
(-0,89; -0,49)
|
|
Jedinc
i (%) dosahujúci:
|
|
|
|
|
HbA1
c < 7 % (LOCF)
d
|
|
|
|
|
Upravený podľa
|
31,7*
|
13,0
|
31,8*
|
11,1
|
východiskovej hodnoty
|
|
|
|
|
Telesn
á hmotnosť (kg) (LOCF)
d
|
|
|
|
|
Východisková hodnota (priemer)
|
80,56
|
80,94
|
88,57
|
90,07
|
Zmena od východiskovej hodnotyc
|
-2,26
|
-0,72
|
-2,65
|
-0,58
|
Rozdiel oproti placebuc
|
-1,54*
|
|
-2,07*
|
|
(95 % IS)
|
(-2,17; -0,92)
|
|
(-2,79; -1,35)
|
|
|
|
1glimepirid 4 mg/deň
2metformín (formulácie s okamžitým alebo predĺženým uvoľňovaním) ≥ 1500 mg/deň plus maximálne tolerovaná dávka, ktorá musí byť aspoň polovica maximálnej dávky sulfonylurey po dobu najmenej 8 týždňov pred vstupom do štúdie
a Randomizovaní a liečení pacienti s východiskovou hodnotou a najmenej 1 po východiskovej hodnote merania účinnosti.
bStĺpce 1 a 2, HbA1c analyzovaní LOCF (pozri odkaz d); stĺpce 3 a 4, HbA1c analyzovaní LRM (pozri odkaz e)
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty
dLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred podaním záchrannej liečby zachráneným
pacientom)
e LRM: Analýza longitudinálnych opakovaných meraní
*p-hodnota < 0,0001 oproti placebu + perorálne antidiabetiká
 Tabuľka 7 Výsledky z 24. týždňa (LOCFa) placebom kontrolovanej štúdie dapagliflozínu v kombinácii s inzulínom (samotným alebo s perorálnymi antidiabetikami)
Tabuľka 7 Výsledky z 24. týždňa (LOCFa) placebom kontrolovanej štúdie dapagliflozínu v kombinácii s inzulínom (samotným alebo s perorálnymi antidiabetikami)
Dapagliflozín 10 mg
+ inzulín
Placebo
+ inzulín
U
k
azovateľ
±
peroráln
eantidiabetiká
2
±
peroráln
eantidiabetiká
2
 N
Nb 194 193
HbA1c (%)
Východisková hodnota
(priemer)
Zmena od východiskovej hodnotyc
Rozdiel oproti placebuc

(95 % IS)
Telesná hmotnosť (kg) Východisková hodnota (priemer)
Zmena od východiskovej hodnotyc
Rozdiel oproti placebuc

(95 % IS)
Priemerná denná dávka8,58
-0,90
-0,60*
(-0,74; -0,45)
94,63
-1,67
-1,68*
(-2,19; -1,18)
8,46
-0,30
94,21
0,02
inzulín
u
(IU
)
1
Dapagliflozín 10 mg
+ inzulín
Placebo
+ inzulín
 U
k
azovateľ
±
peroráln
eantidiabetiká
2
±
peroráln
eantidiabetiká
2
U
k
azovateľ
±
peroráln
eantidiabetiká
2
±
peroráln
eantidiabetiká
2
Východisková dávka
(priemer)
Zmena od východiskovej dávkyc
Rozdiel oproti placebuc
(95 % IS)
Pacienti s priemerným znížením dennej dávky inzulínu najmenej o 10 % (%)
77,96
-1,16
-6,23*
(-8,84; -3,63)
19,7**
73,96
5,08
11,0

aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred alebo v deň 1. titrácie inzulínu nahor, v prípade potreby)
bVšetci zaradení jedinci, ktorí užili aspoň 1 dávku skúšaného lieku v štúdii pri dvojitom zaslepení počas krátkodobého dvojito zaslepeného obdobia
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty a použitého perorálneho antidiabetika
*p-hodnota < 0,0001 oproti placebo + inzulín ± perorálne antidiabetikum
**p-hodnota < 0,05 oproti placebo + inzulín ± perorálne antidiabetikum
1Titrácia režimov inzulínu nahor (vrátane krátkodobo pôsobiaceho inzulínu, strednodobo pôsobiaceho inzulínu a bazálneho inzulínu) bola povolená iba v prípade, keď jedinci spĺňali stanovené kritéria pre koncentráciu glukózy v plazme nalačno.
2Päťdesiat percent jedincov na začiatku dostávalo inzulín v monoterapii, 50 % užívalo 1 alebo
2 perorálne antidiabetiká pridané k inzulínu: Z tejto druhej skupiny 80 % jedincov užívalo metformín samotný, 12 % bolo liečených metformínom + sulfonylureou a zvyšným jedincom sa podávali iné perorálne antidiabetiká.
V kombinácii s metformínom u pacientov doteraz neliečených liekmiV dvoch aktívne kontrolovaných štúdiách hodnotiacich účinnosť a bezpečnosť dapagliflozínu (5 mg alebo 10 mg) v kombinácii s metformínom trvajúcich 24 týždňov u pacientov doteraz neliečených liekmi v porovnaní s liečbou jednozložkovými liekmi sa zúčastnilo celkovo 1 236 pacientov doteraz neliečených liekmi s nedostatočne kontrolovaným diabetom 2. typu (HbA1c ≥ 7,5 % a ≤ 12 %).
Liečba dapagliflozínom 10 mg v kombinácii s metformínom (až do 2 000 mg denne) poskytla významné zlepšenia HbA1c v porovnaní s jednotlivými zložkami (tabuľka 8) a viedla k väčšiemu zníženiu plazmatickej glukózy nalačno (fasting plasma glucose, FPG) (v porovnaní s jednotlivými zložkami) a telesnej hmotnosti (v porovnaní s metformínom).
 Tabuľka 8 Výsledky v 24. týždni (LOCFa) v aktívne kontrolovanej štúdii dapagliflozínu v kombinácii s metformínom u pacientov doteraz neliečených liekmi
Tabuľka 8 Výsledky v 24. týždni (LOCFa) v aktívne kontrolovanej štúdii dapagliflozínu v kombinácii s metformínom u pacientov doteraz neliečených liekmi
Parameter
Dapagliflozín
10 mg +
Dapagliflozín
10 mg
Metformín
metformín
Nb 211b 219b 208b
 HbA1c (%)
HbA1c (%)
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Odlišnosť od dapagliflozínuc
(95 % IS)
Odlišnosť od metformínuc
(95 % IS)
9,10
-1,98
-0,53*
(-0,74; -0,32)
-0,54*
(-0,75; -0,33)
9,03
-1,45
-0,01
(-0,22; 0,20)
9,03
-1,44

aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred záchranou liečbou u zachránených jedincov).

bVšetci randomizovaní pacienti, ktorí užili minimálne jednu dávku dvojito zaslepeného skúšaného lieku počas krátkodobého dvojito zaslepeného skúšania.
cpriemer najmenších štvorcov upravený na východiskovú hodnotu
*p-hodnota <0,0001
Kombinovaná liečba s exenatidom s predĺženým uvoľňovanímV 28-týždňovej dvojito zaslepenej štúdii kontrolovanej aktívnym komparátorom sa porovnával
dapagliflozín v kombinácii s exenatidom s predĺženým uvoľňovaním (agonista receptora GLP-1) so samotným dapagliflozínom a samotným exenatidom s predĺženým uvoľňovaním u osôb
s nedostatočnou glykemickou kontrolou samotným metformínom (HbA1c ≥ 8 % a ≤ 12 %). Vo
všetkých liečebných skupinách došlo k zníženiu hodnoty HbA1c oproti východiskovej hodnote.
V liečebnej skupine s kombináciou 10 mg dapagliflozínu a exenatidu s predĺženým uvoľňovaním sa preukázali významnejšie zníženia hodnôt HbA1c oproti východiskovej hodnote v porovnaní so samotným dapagliflozínom a samotným exenatidom s predĺženým uvoľňovaním (tabuľka 9).
Tabuľka 9 Výsledky jednej 28-týždňovej klinickej štúdie s dapagliflozínom a exenatidoms predĺženým uvoľňovaním v porovnaní so samotným dapagliflozínom a samotným exenatidom s predĺženým uvoľňovaním v kombinácii s metformínom (intent to treat patients = zamerané na liečbu pacientov)
s predĺženým uvoľňovaním v kombinácii s metformínom (intent to treat patients = zamerané na liečbu pacientov)
Parameter
Dapagliflozí
n 10 mg
QD
+
exenatid
s predĺženým
uvoľňovaní
m 2 mg
QW
Dapagliflozín
10 mg QD
+
p
lacebo QW
Exenatid
s predĺženým
uvoľňovaní
m 2 mg
QW
+
p
lacebo QD

 N 228
230 227
HbA1
c (%)
N 228
230 227
HbA1
c (%)
Východisková hodnota
(priemer) 9,29 9,25 9,26
Zmena oproti východiskovej
hodnotea -1,98 -1,39 -1,60
Priemerný rozdiel v zmene

od východiskovej hodnoty medzi kombináciou a jednotlivým liekom (95 % IS)
Osoby (%), ktoré dosiahli-0,59*
(-0,84; -0,34)
-0,38**
(-0,63; -0,13)
HbA1
c <
7 % 44,7 19,1 26,9
 Telesná hmotnosť (kg)
Telesná hmotnosť (kg)Východisková hodnota
(priemer) 92,13 90,87 89,12
Zmena oproti východiskovej
hodnotea -3,55 -2,22 -1,56
Priemerný rozdiel v zmene od východiskovej hodnoty
medzi kombináciou a jednotlivým liekom (95 % IS)
-1,33*
(-2,12; -0,55)
-2,00*
(-2,79; -1,20)

QD=jedenkrát denne, QW=jedenkrát týždenne, N=počet pacientov, IS=interval spoľahlivosti.
a Upravené priemery najmenších štvorcov (least squares, LS priemery) a rozdiel(y) liečebnej skupiny v zmene oproti východiskovým hodnotám v 28. týždni sú modelované použitím zmiešaného modelu s opakovanými
meraniami (mixed model with repeated measures, MMRM) vrátane liečby, regiónu, východiskovej hodnoty
HbA1c stratum (< 9,0 % alebo ≥ 9,0 %), týždňa a týždňa liečby s interakciami ako fixných faktorov a východiskovej hodnoty ako kovariátu.
*p < 0,001, **p < 0,01.
P-hodnoty sú všetky p-hodnoty upravené pre multiplicitu.
Analýzy nezahŕňajú merania po podaní záchrannej liečby a po predčasnom prerušení podávania skúšaného lieku.
Koncentrácia glukózy v plazme nalačno
Liečba dapagliflozínom 10 mg v monoterapii alebo ako prídavná liečba k metformínu, glimepiridu, metformínu a sulfonylurey, sitagliptínu (s metformínom alebo bez metformínu) alebo inzulínu sa prejavila štatisticky významným poklesom FPG (-1,90 až -1,20 mmol/l [-34,2 až -21,7 mg/dl]) oproti placebu (-0,33 až 0,21 mmol/l [-6,0 až 3,8 mg/dl]). Tento účinok sa pozoroval v 1. týždni liečby
a v rozšírených štúdiách sa zachoval až do 104. týždňa.
Kombinovaná liečba dapagliflozínom 10 mg a exenatidom s predĺženým uvoľňovaním mala za následok signifikantne väčšie zníženie FPG v 28. týždni: -3,66 mmol/l (-65,8 mg/dl), v porovnaní
s -2,73 mmol/l (-49,2 mg/dl) pre samotný dapagliflozín (p < 0,001) a -2,54 mmol/l (-45,8 mg/dl) pre
samotný exenatid (p < 0,001).
V štúdii zameranej na diabetických pacientov s eGFR ≥ 45 až < 60 ml/min/1,73 m2 liečba dapagliflozínom preukázala pokles FPG v 24. týždni: -1,19 mmol/l (-21,46 mg/dl) v porovnaní s 0,27 mmol/l (-4,87 mg/dl) pre placebo (p=0,001).
Glykémia po jedle
Liečba dapagliflozínom 10 mg ako prídavná liečba ku glimepiridu sa prejavila štatisticky významným poklesom glykémie 2 hodiny po jedle po 24 týždňoch, ktorý pretrval až do 48. týždňa.
Liečba dapagliflozínom 10 mg po pridaní ku sitagliptínu (s metformínom alebo bez metformínu) sa prejavila významným poklesom glykémie 2 hodiny po jedle po 24 týždňoch, ktorý pretrval až do 48. týždňa.
Kombinovaná liečba dapagliflozínom 10 mg a exenatidom s predĺženým uvoľňovaním mala za následok signifikantne väčšie zníženie hladiny glukózy 2 hodiny po jedle v 28. týždni v porovnaní s ktorýmkoľvek liekom v monoterapii.
Telesná hmotnosť
Dapagliflozín 10 mg v prídavnej liečbe k metformínu, glimepiridu, metformínu a sulfonylurey, sitagliptínu (s metformínom alebo bez metformínu) alebo inzulínu sa prejavil štatisticky významným poklesom hmotnosti po 24 týždňoch (p < 0,0001, tabuľky 5 a 6). V dlhšie trvajúcich štúdiách boli tieto účinky trvalé. Po 48 týždňoch rozdiel pre dapagliflozín po pridaní ku sitagliptínu
(s metformínom alebo bez metformínu) bol v porovnaní s placebom -2,22 kg. Po 102 týždňoch,
rozdiel pre dapagliflozín po pridaní k metformínu v porovnaní s placebom alebo po pridaní k inzulínu bol v porovnaní s placebom -2,14 a -2,88 kg, v uvedenom poradí.
Dapagliflozín mal za následok ako prídavná liečba k metformínu v aktívne kontrolovanej
non-inferiorálnej štúdii štatisticky významné zníženie telesnej hmotnosti v porovnaní s glipizidom po
52 týždňoch -4,65 kg (p < 0,0001, tabuľka 4), ktoré bolo trvalé po 104 a 208 týždňoch (-5,06 kg a -4,38 kg v uvedenom poradí).
Dapagliflozín 10 mg v kombinácii s exenatidom s predĺženým uvoľňovaním preukázal signifikantne väčší pokles telesnej hmotnosti v porovnaní s ktorýmkoľvek liekom v monoterapii (tabuľka 9).
Na hodnotenie podielu aktívnej telesnej hmoty sa použila počas 24 týždňovej štúdie
u 182 diabetických pacientov duálna RTG absorpciometria (DXA), ktorá dokázala pre dapagliflozín
10 mg plus metformín v porovnaní s placebom plus metformínom zníženie telesnej hmotnosti
a množstva telesného tuku na základe merania pomocou DXA skôr, než straty beztukového tkaniva
a tekutín. Liečba s Forxigou a metformínom v porovnaní s liečbou s placebom a metformínom ukázala
numerický pokles viscerálneho adipózneho tkaniva v podštúdii so zobrazovaním magnetickou rezonanciou.
Krvný tlakVo vopred špecifikovanej súhrnnej analýze 13 placebom kontrolovaných štúdií, v 24. týždni bola zaznamenaná zmena krvného tlaku oproti východiskovej hodnote pri liečbe dapagliflozínom 10 mg: systolického -3,7 mmHg a diastolického -1,8 mmHg v porovnaní so zmenou krvného tlaku oproti východiskovej hodnote v skupine s placebom: systolického -0,5 mmHg a diastolického -0,5 mmHg. Rovnaké poklesy sa pozorovali až do 104. týždňa.
Kombinovaná liečba dapagliflozínom 10 mg a exenatidom s predĺženým uvoľňovaním mala za následok signifikantne väčšie zníženie systolického krvného tlaku v 28. týždni (-4,3 mmHg) v porovnaní so samotným dapagliflozínom (-1,8 mmHg, p < 0,05) a samotným exenatidom
s predĺženým uvoľňovaním (-1,2 mmHg, p < 0,01).
V dvoch 12-týždňových, placebom kontrolovaných štúdiách bolo liečených dapagliflozínom 10 mg alebo placebom celkovo 1 062 pacientov s nedostatočne kontrolovaným diabetom 2. typu
a hypertenziou (aj napriek predchádzajúcej stabilnej liečbe ACE-I alebo ARB v jednej štúdii a ACE-I alebo ARB plus jedno ďalšie antihypertenzívum v druhej štúdii). V 12. týždni u oboch štúdií dapagliflozín v dávke 10 mg spolu so zvyčajným antidiabetikom vyvolali zlepšenie HbA1c a znížili
placebom korigovaný systolický krvný tlak v priemere o 3,1 a 4,3 mmHg, v uvedenom poradí.
V štúdii zameranej na diabetických pacientov s eGFR ≥ 45 až < 60 ml/min/1,73 m2 liečba dapagliflozínom preukázala pokles systolického krvného tlaku v sede v 24. týždni: -4,8 mmHg v porovnaní s -1,7 mmHg pre placebo (p < 0,05).
Kontrola glykémie u pacientov so stredne závažnou poruchou funkcie obličiek CKD 3A(eGFR ≥ 45 až < 60 ml/min/1,73 m2)Účinnosť dapagliflozínu sa hodnotila v štúdii zameranej na diabetických pacientov s eGFR ≥ 45 až
< 60 ml/min/1,73 m2 s neadekvátnou glykemickou kontrolou pri zvyčajnej liečbe. Liečba
dapagliflozínom viedla k zníženiu HbA1c a telesnej hmotnosti v porovnaní s placebom (tabuľka 10).
 Tabuľka 10 Výsledky placebom kontrolovanej štúdie s dapagliflozínom v 24. týždni u diabetických pacientov s eGFR ≥ 45 až < 60 ml/min/1,73 m2
Tabuľka 10 Výsledky placebom kontrolovanej štúdie s dapagliflozínom v 24. týždni u diabetických pacientov s eGFR ≥ 45 až < 60 ml/min/1,73 m2
Dapagliflozína
Placeboa
10
mg
N
b
159 161
HbA1c (%)
Východisková hodnota (priemer) 8,35 8,03
Zmena oproti východiskovej hodnoteb -0,37 -0,03
Rozdiel oproti placebub

(95 % IS)
Telesná hmotnosť (kg)-0,34*
(-0,53, -0,15)
Východisková hodnota (priemer) 92,51 88,30
Percentuálna zmena oproti východiskovej hodnotec
Rozdiel v percentuálnej zmene oproti placebuc
-3,42 -2,02
-1,43*
(95
% IS) (-2,15, -0,69)
a Metformín alebo metformíniumchlorid boli súčasťou bežnej liečby u 69,4 % pacientov s dapagliflozínom a u 64,0 % s placebom.
b Priemer najmenších štvorcov upravený na východiskovú hodnotu
c Odvodené od priemeru najmenších štvorcov upraveného na východiskovú hodnotu
* p<0,001
Pacienti s východiskovou hodnotou HbA1c ≥ 9 %
Vo vopred špecifikovanej analýze jedincov s východiskovou hodnotou HbA1c ≥ 9,0 % sa pri liečbe dapagliflozínom 10 mg v 24. týždni zaznamenalo štatisticky významné zníženie HbA1c v monoterapii (upravená priemerná zmena od východiskovej hodnoty: -2,04 % a 0,19 % pre dapagliflozín 10 mg
a placebo, v uvedenom poradí) a v prídavnej liečbe k metformínu (upravená priemerná zmena od východiskovej hodnoty: -1,32 % a -0,53 % pre dapagliflozín a placebo, v uvedenom poradí).
Kardiovaskulárne a renálne účinky liečby
Štúdia DECLARE (Dapagliflozin Effect on Cardiovascular Events) bola medzinárodná, multicentrická, randomizovaná, dvojito zaslepená, placebom kontrolovaná klinická štúdia navrhnutá na zistenie účinku dapagliflozínu v porovnaní s placebom na kardiovaskulárne udalosti po pridaní
k aktuálnej liečbe. Všetci pacienti mali diabetes mellitus 2. typu a minimálne dva ďalšie kardiovaskulárne rizikové faktory (vek ≥ 55 rokov u mužov alebo ≥ 60 rokov u žien a jeden alebo viac z nasledujúcich: dyslipidémia, hypertenzia alebo fajčenie v súčasnosti) alebo potvrdené kardiovaskulárne ochorenie.
6 974 (40,6 %) zo 17 160 randomizovaných pacientov malo potvrdené kardiovaskulárne ochorenie a 10 186 (59,4 %) nemalo potvrdené kardiovaskulárne ochorenie, 8 582 pacientov bolo randomizovaných na dapagliflozín 10 mg a 8 578 na placebo s mediánom sledovania 4,2 rokov.
Priemerný vek populácie v štúdii bol 63,9 rokov, 37,4 % boli ženy. Celkovo 22,4 % malo diabetes ≤ 5
rokov, priemerná dĺžka trvania diabetu bola 11,9 rokov. Priemerná hodnota HbA1c bola 8,3 %
a priemerný BMI bol 32,1 kg/m2.
Na začiatku malo 10,0 % pacientov srdcové zlyhávanie v anamnéze. Priemerná eGFR bola
85,2 ml/min/1,73 m2, 7,4 % pacientov malo eGFR < 60 ml/min/1,73 m2, a 30,3 % pacientov malo mikro- alebo makroalbuminúriu (pomer albumín v moči/kreatinín v moči (urine albumin to creatinine
ratio [UACR]) ≥ 30 až ≤ 300 mg/g alebo > 300 mg/g, v uvedenom poradí).
Väčšina pacientov (98 %) na začiatku užívala jedno alebo viac antidiabetík, vrátane metformínu
(82 %), inzulínu (41 %) a sulfonylurey (43 %).
Primárnymi ukazovateľmi boli čas do prvého výskytu príhody zloženej zo smrti z kardiovaskulárnych príčin, infarktu myokardu alebo ischemickej cievnej mozgovej príhody (MACE) a čas do prvého výskytu príhody pozostávajúcej z hospitalizácie z dôvodu srdcového zlyhávania alebo smrti
z kardiovaskulárnych príčin. Sekundárne koncové ukazovatele boli združený ukazovateľ funkcie obličiek a úmrtnosť zo všetkých príčin.
Významné kardiovaskulárne udalosti
Dapagliflozín 10 mg v porovnaní s placebom preukázal non-inferioritu pre ukazovateľ zložený
zo smrti z kardiovaskulárnych príčin, infarktu myokardu alebo ischemickej cievnej mozgovej príhody
(jednostranná p-hodnota < 0,001).
Srdcové zlyhávanie alebo smrť z kardiovaskulárnych príčin
Dapagliflozín 10 mg v porovnaní s placebom preukázal superioritu v prevencii ukazovateľa zloženého z hospitalizácie z dôvodu srdcového zlyhávania alebo smrti z kardiovaskulárnych príčin (obrázok 1). Rozdiel v liečebnom účinku bol ovplyvnený hospitalizáciou z dôvodu srdcového zlyhávania a žiaden rozdiel sa nepozoroval pri smrti z kardiovaskulárnych príčin (obrázok 2).
Prevaha prínosu liečby dapagliflozínom v porovnaní s placebom sa pozorovala u pacientov
s potvrdeným kardiovaskulárnym ochorením aj u pacientov bez neho, u pacientov so srdcovým zlyhávaním aj u pacientov bez neho na začiatku liečby a bol konzistentný vo všetkých podskupinách zahŕňajúcich vek, pohlavie, funkciu obličiek (eGFR) a región.
Obrázok 1 Čas do prvého výskytu hospitalizácie z dôvodu srdcového zlyhávania alebo smrti z kardiovaskulárnych príčin
Pacienti v riziku je počet pacientov v riziku na začiatku obdobia. HR=Pomer rizika, IS=Interval spoľahlivosti.
Výsledky primárnych a sekundárnych ukazovateľov sú zobrazené na obrázku 2. Lepší účinok dapagliflozínu v porovnaní s placebom nebol preukázaný pre MACE (p=0,172). Združený ukazovateľ renálnych funkcií a úmrtnosti zo všetkých príčin preto nebol súčasťou testovania na potvrdenie výsledkov.
Obrázo
k 2 Účinky liečby na primárne združené ukazovatele a ich komponenty a na sekundárne ukazovatele a komponenty
Združený ukazovateľ renálnych funkcií definovaný ako: potvrdený pokles eGFR ≥ 40 % na eGFR < 60 ml/min/1,73 m2
a/alebo ochorenie obličiek v terminálnom štádiu (dialýza ≥ 90 dní alebo transplantácia obličky, potvrdené pretrvávanie eGFR
< 15 ml/min/1,73 m2) a/alebo smrť z renálnych alebo kardiovaskulárnych príčin.
p-hodnoty sú dvojstranné. p-hodnoty pre sekundárny ukazovateľ a pre jednotlivé komponenty sú nominálne. Čas do prvej udalosti bol analyzovaný použitím Coxovho modelu proporcionálneho rizika. Počet prvých udalostí pre jednotlivé
komponenty sú aktuálne počty prvých udalostí každého komponentu a nezohľadňuje počet udalostí v združenom ukazovateli.
IS=interval spoľahlivosti.
NefropatiaDapagliflozín znížil výskyt udalostí ukazovateľa zloženého z potvrdeného pretrvávajúceho zníženia eGFR, ochorenia obličiek v terminálnom štádiu, smrti z renálnych alebo kardiovaskulárnych príčin. Rozdiel medzi skupinami bol ovplyvnený znížením v počte udalostí jednotlivých renálnych komponentov; pretrvávajúce zníženie eGFR, ochorenie obličiek v terminálnom štádiu a smrť z renálnych príčin (obrázok 2).
Pomer rizika (hazard ratio, HR) pre čas do nefropatie (pretrvávajúce zníženie eGFR, ochorenie obličiek v terminálnom štádiu a smrť z renálnych príčin) bol 0,53 (95 % IS 0,43; 0,66) pre dapagliflozín oproti placebu.
Dapagliflozín okrem toho znížil aj nový nástup pretrvávajúcej albuminúrie (HR 0,79 [95 % IS 0,72;
0,87]) a viedol k väčšej regresii makroalbuminúrie (HR 1,82 [95 % IS 1,51; 2,20]) v porovnaní s placebom.
Diabetes mellitus 1. typuDapagliflozín ako doplnková liečba k nastaviteľnej dávke inzulínu sa skúmal v dvoch 24-týždňových
randomizovaných, dvojito zaslepených, placebom kontrolovaných klinických štúdiách
s 28-týždňovým predĺžením na zhodnotenie účinnosti a bezpečnosti u dospelých pacientov s diabetes mellitus 1. typu a s nedostatočnou kontrolou glykémie (definovanou ako HbA1c ≥ 7,5 %) na samotnom inzulíne. Po 8-týždňovom vstupnom období na optimalizáciu liečby diabetu u každého pacienta (kontrola glykémie vrátane hyperglykémie a hypoglykémie, diéta a pohybová aktivita) bolo celkovo 1 646 pacientov s HbA1c ≥ 7,5 % a ≤ 10,5 % randomizovaných na 5 mg dapagliflozínu jedenkrát denne, 10 mg dapagliflozínu jedenkrát denne alebo placebo jedenkrát denne. Počas štúdie bola dávka inzulínu podľa potreby upravená.
Glykemická kontrola
V 24. týždni liečba dapagliflozínom jedenkrát denne poskytla štatisticky významné a klinicky významné zlepšenie HbA1c v porovnaní s placebom (tabuľka 11). Toto zistenie sa v podskupinách zhodovalo. V obidvoch štúdiách boli v 52. týždni upravené priemerné zmeny HbA1c oproti východiskovej hodnote v porovnaní s placebom -0,33 % a -0,20 % u pacientov liečených 5 mg dapagliflozínu. Liečba dapagliflozínom nebola spojená so zvýšením podielu pacientov
s hypoglykemickými príhodami v porovnaní s placebom. Počet pacientov so závažnou
hypoglykémiou bol porovnateľný v liečebných skupinách (6,9 % v skupine s dapagliflozínom a 7,5 %
v skupine s placebom v 24. týždni).
Podiel pacientov, ktorí dosiahli zníženie HbA1c o ≥ 0,5 % bez závažnej hypoglykémie, bol významne vyšší u pacientov liečených dapagliflozínom v porovnaní s placebom (tabuľka 11).
Tabuľka 11 Výsledky v 24. týždni z dvoch placebom kontrolovaných klinických štúdií s dapagliflozínom ako doplnková liečba k inzulínu u dospelých s diabetes mellitus 1. typuŠtúdia MB102229 Štúdia MB102230
s dapagliflozínom ako doplnková liečba k inzulínu u dospelých s diabetes mellitus 1. typuŠtúdia MB102229 Štúdia MB102230Parameter účinnosti
| Dapagliflozín
| Placebo +
| Dapagliflozín
| Placebo +
|
| 5 mg + inzulín
| inzulín
| 5 mg + inzulín
| inzulín
|
| N=259
| N=260
| N=271
| N=272
|
HbA1c (%)
|
|
|
|
|
Východisková hodnota
| 8,52
| 8,50
| 8,45
| 8,40
|
(priemer)
|
|
|
|
|
Zmena od východiskovej
| -0,45
| -0,03
| -0,34
| 0,03
|
hodnoty
|
|
|
|
|
Rozdiel oproti placebu
| -0,42*
|
| -0,37*
|
|
95 % IS
| (-0,56; -0,28)
|
| (-0,49; -0,26)
|
|
Jedinci (%) dosahujúci
| 49,6*
| 25,3
| 39,5*
| 20,1
|
pokles HbA1c o ≥ 0,5 %
|
|
|
|
|
bez závažnej
|
|
|
|
|
hypoglykémie
|
|
|
|
|
Telesná hmotnosť (kg)
|
|
|
|
|
Východisková hodnota
| 81,67
| 84,42
| 79,22
| 79,03
|
(priemer)
|
|
|
|
|
Zmena od východiskovej
| -2,84
| 0,15
| -2,50
| 0,06
|
hodnoty
|
|
|
|
|
Rozdiel oproti placebu
| -2,96*
|
| -2,56*
|
|
95 % IS
| (-3,63; -2,28)
|
| (-3,12; -2,00)
|
|
* p < 0,0001 oproti placebu
|
|
|
|
|
Variabilita glykémieUpravené priemerné zmeny priemernej amplitúdy variability hladiny glukózy od východiskovej
hodnoty do 24. týždňa pre dapagliflozín 5 mg v porovnaní s placebom boli -0,96 mmol/l
(-17,30 mg/dl), resp. -0,55 mmol/l (-9,85 mg/dl) v obidvoch štúdiách (p <0,0001).
V obidvoch štúdiách bolo zistené štatisticky významné zvýšenie percentuálneho podielu hodnôt hladín glukózy v rozmedzí > 3,9 mmol/l až ≤ 10 mmol/l (> 70 mg/dl až ≤ 180 mg/dl) o 9,11 %, resp.
9,02 % (p < 0,0001) pre 5 mg dapagliflozínu v porovnaní s placebom od východiskovej hodnoty do
24. týždňa. Tento nárast nebol sprevádzaný zvýšeným percentuálnym podielom 24-hodinových
hodnôt hladiny glukózy < 3,9 mmol/l (70 mg/dl).
Dávka inzulínu
V obidvoch štúdiách boli zistené štatisticky významné rozdiely (p < 0,0001) v percentuálnom poklese celkovej dávky inzulínu o -8,80 %, resp. -10,78 % od východiskovej hodnoty pre 5 mg dapagliflozínu, resp. placebo v 24. týždni.
Telesná hmotnosť
Pre dapagliflozín v porovnaní s placebom sa preukázalo štatisticky významné zníženie telesnej hmotnosti (tabuľka 11). Pacienti liečení dapagliflozínom vykazovali nepretržitý pokles hmotnosti počas 24 týždňov. V dvoch štúdiách v 52. týždni boli upravené priemerné zmeny telesnej hmotnosti oproti východiskovej hodnote pre 5 mg dapagliflozínu -2,56 kg v porovnaní s placebom -3,50 kg.
Srdcové zlyhávanie
Štúdia DAPA-HF (Dapagliflozin And Prevention of Adverse outcomes in Heart Failure) bola
medzinárodná, multicentrická, randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia u pacientov so srdcovým zlyhávaním (funkčná trieda II-IV podľa NYHA klasifikácie [New York Heart Association]) so zníženou ejekčnou frakciou (ejekčná frakcia ľavej komory [left ventricular ejection fraction, LVEF] ≤ 40 %) navrhnutá na stanovenie účinku dapagliflozínu v porovnaní
s placebom, po pridaní k základnej štandardnej liečbe, na výskyt smrti z kardiovaskulárnych príčin a zhoršenia srdcového zlyhávania.
2 373 zo 4 744 pacientov bolo randomizovaných do skupiny s 10 mg dapagliflozínu a 2 371 do skupiny s placebom a boli sledovaní počas mediánu 18 mesiacov. Priemerný vek populácie štúdie bol
66 rokov, 77 % bolo mužov.
Na začiatku štúdie malo 67,5 % pacientov srdcové zlyhávanie triedy NYHA II, 31,6 % triedy NYHA III a 0,9 % triedy NYHA IV, medián LVEF bol 32 %. 56 % prípadov srdcového zlyhávania bolo ischemických, 36 % bolo neischemických a 8 % bolo neznámej etiológie. V každej liečebnej skupine malo 42 % pacientov anamnézu diabetes mellitus 2. typu a ďalšie 3 % pacientov v každej skupine boli klasifikované ako pacienti s diabetes mellitus 2. typu na základe HbA1c ≥ 6,5 % pri vstupe do štúdie
aj pri randomizácii. Pacienti sa liečili štandardnou liečbou; 94 % pacientov bolo liečených ACE-I, ARB alebo kombináciou inhibítora receptorov pre angiotenzín a inhibítora neprilyzínu (angiotensin receptor-neprilysin inhibitor, ARNI; 11 %), 96 % betablokátorom, 71 % antagonistom mineralokortikoidných receptorov (mineralocorticoid receptor antagonist, MRA), 93 % diuretikom a 26 % malo implantovateľné zariadenie.
Do štúdie boli zahrnutí pacienti s eGFR ≥ 30 ml/min/1,73 m2 pri vstupe do štúdie. Priemerná eGFR
bola 66 ml/min/1,73 m2, 41 % pacientov malo eGFR < 60 ml/min/1,73 m2 a 15 % malo eGFR < 45 ml/min/1,73 m2.
Smrť z kardiovaskulárnych príčin a zhoršenie srdcového zlyhávania
Dapagliflozín v porovnaní s placebom preukázal superioritu v prevencii primárneho združeného ukazovateľa smrti z kardiovaskulárnych príčin, hospitalizácie pre srdcové zlyhávanie alebo urgentnej návštevy lekára pre srdcové zlyhávanie (HR 0,74 [95 % IS: 0,65; 0,85], p < 0,0001). Účinok bol pozorovaný včasne a pretrvával počas celého trvania štúdie (obrázok 3).
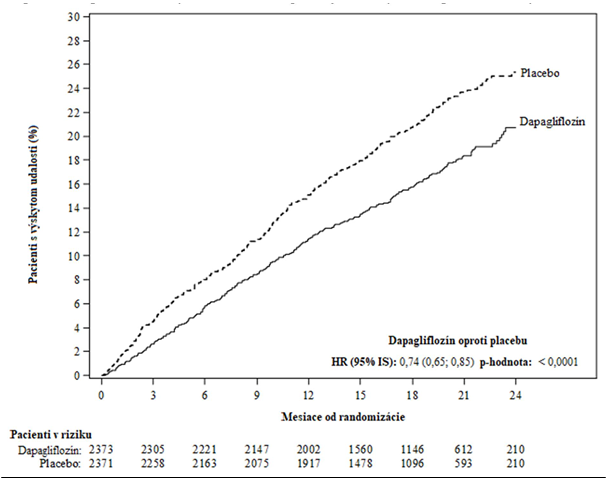 Obrázok 3 Čas do prvého výskytu združeného ukazovateľa smrti z kardiovaskulárnych príčin, hospitalizácie pre srdcové zlyhávanie alebo urgentnej návštevy lekára pre srdcové zlyhávanie
Obrázok 3 Čas do prvého výskytu združeného ukazovateľa smrti z kardiovaskulárnych príčin, hospitalizácie pre srdcové zlyhávanie alebo urgentnej návštevy lekára pre srdcové zlyhávanie
Urgentná návšteva lekára pre srdcové zlyhávanie bola definovaná ako bezodkladné, neplánované lekárske vyšetrenie, napr.
na pohotovosti a potreba liečby zhoršenia srdcového zlyhávania (inej ako iba zvýšenie dávky perorálnych diuretík). Pacienti v riziku predstavujú počet pacientov v riziku na začiatku obdobia.
Všetky tri komponenty primárneho združeného ukazovateľa individuálne prispeli k účinku liečby
(obrázok 4). Vyskytlo sa niekoľko urgentných návštev lekára pre srdcové zlyhávanie.
Obrázo
k 4 Účinky liečby na primárny združený ukazovateľ, jeho komponenty a na úmrtnosť zo všetkých príčin
Charakteristiky
HR (95 % IS)
Osoby s výskytom udalosti
(miera udalosti)
Pomer rizika
(95 % IS)
p-hodnota
Združený ukazovateľ kardiovaskulárnej smrti, hospitalizácie pre srdcové zlyhávanie alebo urgentnej návštevy lekára
pre srdcové zlyhávanie
Dapagliflozín
(N = 2 373)
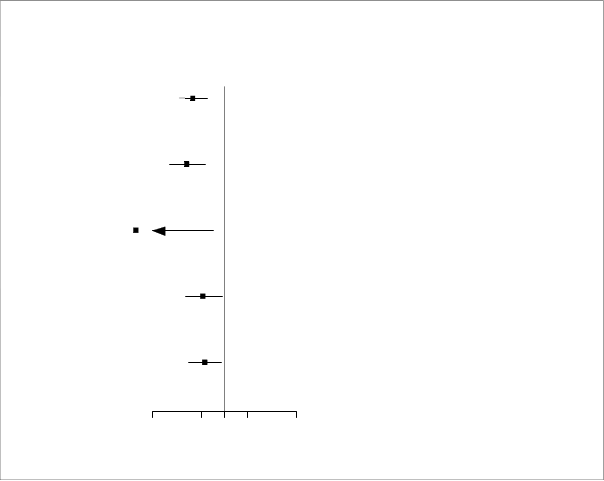
386 (11,6)
Placebo
(N = 2 371)
502 (15,6)
0,74 (0,65; 0,85)
< 0,0001
Hospitalizácie
pre srdcové zlyhávanie
231 (6,9)
318 (9,8)
0,70 (0,59; 0,83)
< 0,0001
Urgentná návšteva lekára
pre srdcové zlyhávanie
10 (0,3)
23 (0,7)
0,43 (0,20; 0,90)
0,0213
Kardiovaskulárna smrť
227 (6,5)
273 (7,9)
0,82 (0,69; 0,98)
0,0294
Úmrtnosť zo všetkých príčin
276 (7,9)
329 (9,5)
0,83 (0,71; 0,97)
0,0217
0,5 0,8 1 1,25 2
V prospech dapagliflozínu |
V prospech placeba
Urgentná návšteva lekára pre srdcové zlyhávanie bola definovaná ako bezodkladné, neplánované lekárske vyšetrenie, napr.
na pohotovosti a potreba liečby zhoršenia srdcového zlyhávania (inej ako iba zvýšenie dávky perorálnych diuretík).
Počet prvých udalostí pre jednotlivé komponenty je skutočný počet prvých udalostí pre každý komponent a nezapočítava sa do počtu udalostí v združenom ukazovateli.
Miery udalostí sú uvedené ako počet osôb s výskytom udalosti na 100 pacientorokov sledovania. p-hodnoty pre jednotlivé komponenty a úmrtnosť zo všetkých príčin sú nominálne.
Dapagliflozín tiež znížil celkový počet hospitalizácií pre srdcové zlyhávanie (prvej a opakujúcich sa) a smrti z kardiovaskulárnych príčin; v skupine s dapagliflozínom bolo 567 udalostí oproti 742 udalostiam v skupine s placebom (pomer miery výskytu udalostí [Rate Ratio] 0,75 [95 % IS: 0,65;
0,88], p = 0,0002).
Prínos liečby dapagliflozínom sa pozoroval u pacientov so srdcovým zlyhávaním s prítomným diabetes mellitus 2. typu alebo bez neho. Dapagliflozín znížil primárny združený ukazovateľ výskytu smrti z kardiovaskulárnych príčin a zhoršenia srdcového zlyhávania s HR 0,75 (95 % IS: 0,63; 0,90) u pacientov s diabetom a s HR 0,73 (95 % IS: 0,60; 0,88) u pacientov bez diabetu.
Prínos liečby dapagliflozínom oproti placebu na primárny ukazovateľ bol tiež konzistentný naprieč ďalšími kľúčovými podskupinami zahŕňajúcimi súbežnú liečbu srdcového zlyhávania, funkciu obličiek (eGFR), vek, pohlavie a región.
Výsledky hlásené pacientmi – príznaky srdcového zlyhávania
Účinok liečby dapagliflozínom na príznaky srdcového zlyhávania sa hodnotil pomocou celkového skóre príznakov dotazníka KCCQ-TSS (Total Symptom Score of the Kansas City Cardiomyopathy Questionnaire), ktorý kvantifikuje frekvenciu a závažnosť príznakov srdcového zlyhávania zahŕňajúcich únavu, periférny edém, dyspnoe a ortopnoe. Skóre sa pohybuje od 0 do 100, pričom vyššie skóre predstavuje lepší zdravotný stav.
Liečba dapagliflozínom viedla k štatisticky významnému a klinicky významnému prínosu týkajúcemu sa príznakov srdcového zlyhávania oproti placebu na základe stanovenia zmeny KCCQ-TSS v 8. mesiaci oproti východiskovej hodnote (pomer výhier [Win Ratio] 1,18 [95 % IS: 1,11; 1,26],
p < 0,0001). K výsledkom prispela frekvencia príznaku aj záťaž spôsobená príznakom. Prínos sa pozoroval v zlepšení príznakov srdcového zlyhávania aj v prevencii zhoršenia príznakov srdcového zlyhávania.
V analýze respondentov bol podiel pacientov s klinicky významným zlepšením skóre KCCQ-TSS v 8. mesiaci oproti východiskovej hodnote, definovaným ako zlepšenie o 5 bodov alebo viac, vyšší
v liečebnej skupine s dapagliflozínom v porovnaní s placebom. Podiel pacientov s klinicky významným zhoršením, definovaným ako zhoršenie o 5 bodov alebo viac, bol nižší v liečebnej skupine s dapagliflozínom v porovnaní s placebom. Prínosy pozorované pri dapagliflozíne pretrvali aj
pri uplatnení konzervatívnejších limitov pre väčšiu klinicky významnú zmenu (tabuľka 12).
 Tabuľka 12 Počet a percentuálny podiel pacientov s klinicky významným zlepšením a zhoršením skóre KCCQ-TSS v 8. mesiaci
Tabuľka 12 Počet a percentuálny podiel pacientov s klinicky významným zlepšením a zhoršením skóre KCCQ-TSS v 8. mesiaci
 Zmen
a v 8. mesiaci oproti východiskovej hodnote:
Dapagliflozí
n 10 mg n
a
=
2 086
Placebo
n
a
=
2 062
Zmen
a v 8. mesiaci oproti východiskovej hodnote:
Dapagliflozí
n 10 mg n
a
=
2 086
Placebo
n
a
=
2 062
 Zlepšeni
e
n (%) so zlepšením
b
n (%) so zlepšením
b
Miera
pravdepodobnosti
c
(9
5 % IS)
p
-
h
o
dnot
a
f
Zlepšeni
e
n (%) so zlepšením
b
n (%) so zlepšením
b
Miera
pravdepodobnosti
c
(9
5 % IS)
p
-
h
o
dnot
a
f
≥ 5 bodov 933 (44,7) 794 (38,5) 1,14 (1,06; 1,22)
≥ 10 bodov 689 (33,0) 579 (28,1) 1,13 (1,05; 1,22)

≥ 15 bodov 474 (22,7) 406 (19,7) 1,10 (1,01; 1,19)
0,0002
0,0018
0,0300
 Zhoršeni
e
n (%) so zhoršením
d
n (%) so zhoršením
d
Miera
pravdepodobnosti
e
(9
5 % IS)
p
-
h
o
dnot
a
f
Zhoršeni
e
n (%) so zhoršením
d
n (%) so zhoršením
d
Miera
pravdepodobnosti
e
(9
5 % IS)
p
-
h
o
dnot
a
f
≥ 5 bodov 537 (25,7) 693 (33,6) 0,84 (0,78; 0,89)

≥ 10 bodov 395 (18,9) 506 (24,5) 0,85 (0,79; 0,92)
a Počet pacientov so sledovaným skóre KCCQ-TSS alebo pacientov, ktorí umreli pred 8. mesiacom.
< 0,0001
< 0,0001
b Počet pacientov s pozorovaným zlepšením oproti východiskovej hodnote minimálne o 5, 10 alebo 15 bodov. Pacienti, ktorí umreli pred daným časovým bodom, sa započítavajú ako pacienti bez zlepšenia.
c Pre zlepšenie je miera pravdepodobnosti > 1 v prospech dapagliflozínu v dávke 10 mg.
d Počet pacientov s pozorovaným zhoršením oproti východiskovej hodnote minimálne o 5 alebo 10 bodov. Pacienti, ktorí umreli pred daným časovým bodom, sa započítavajú ako pacienti so zhoršením.
e Pre zhoršenie je miera pravdepodobnosti < 1 v prospech dapagliflozínu v dávke 10 mg.
f p-hodnoty sú nominálne.
Nefropatia
Vyskytlo sa niekoľko udalostí renálneho združeného ukazovateľa (potvrdené trvalé ≥ 50 % zníženie eGFR, ESRD alebo smrť z renálnych príčin); výskyt bol 1,2 % v skupine s dapagliflozínom a 1,6 % v skupine s placebom.
Pediatrická
populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s dapagliflozínom
v jednej alebo vo viacerých podskupinách pediatrickej populácie v liečbe diabetes mellitus 2. typu a diabetes mellitus 1. typu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s dapagliflozínom vo všetkých podskupinách pediatrickej populácie v prevencii kardiovaskulárnych udalostí u pacientov s chronickým srdcovým zlyhávaním (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Dapagliflozín sa rýchlo a dobre absorboval po perorálnom podaní. Maximálne koncentrácie
dapagliflozínu v plazme (Cmax) sa zvyčajne dosiahli do 2 hodín od podania nalačno. Geometrický priemer hodnôt Cmax a AUCτ dapagliflozínu v rovnovážnom stave po podávaní jednej 10 mg dávky denne bol 158 ng/ml a 628 ng h/ml v uvedenom poradí. Absolútna biologická dostupnosť dapagliflozínu po podaní dávky 10 mg je 78 %. Pri podaní s jedlom s vysokým obsahom tuku
v porovnaní s podaním nalačno sa Cmax dapagliflozínu znížilo do 50 % a Tmax predĺžilo približne o 1 hodinu, ale nezmenilo sa AUC. Tieto zmeny sa nepovažujú za klinicky významné. Preto sa
Forxiga môže podávať s jedlom alebo bez jedla.
Distribúcia
Dapagliflozín sa približne v 91 % viaže na bielkoviny. Väzba na bielkoviny ostala pri rôznych
chorobných stavoch nezmenená (napr. pri poruche funkcie obličiek alebo pečene). Priemerný
distribučný objem dapagliflozínu v rovnovážnom stave bol 118 litrov.
Biotransformácia
Dapagliflozín sa značne metabolizuje, hlavne za vzniku dapagliflozín 3-O-glukuronidu, ktorý je
inaktívnym metabolitom. Dapagliflozín 3-O-glukuronid alebo ďalšie metabolity sa nepodieľajú na
účinkoch znižujúcich hladinu glukózy. Tvorba dapagliflozín 3-O-glukuronidu je sprostredkovaná UGT1A9, enzýmom, ktorý sa nachádza v pečeni a v obličkách a metabolizácia sprostredkovaná CYP bola u ľudí nepodstatnou časťou klírensu.
Eliminácia
Po podaní jednej perorálnej dávky dapagliflozínu 10 mg zdravým jedincom bol priemerný terminálny
polčas dapagliflozínu v plazme (t1/2) 12,9 hodín. Priemerný celkový systémový klírens dapagliflozínu podaného intravenózne bol 207 ml/min. Dapagliflozín a súvisiace metabolity sa eliminujú hlavne vylučovaným močom, s menej ako 2 % nezmeneného dapagliflozínu. Po podaní 50 mg dávky
[14C]-dapagliflozínu sa vylúčilo 96 %, 75 % v moči a 21 % v stolici. V stolici sa približne 15 % dávky
vylúčilo v nezmenenej forme.
Linearita
Expozícia dapagliflozínu sa zvyšovala úmerne so zvyšujúcou sa dávkou v rozmedzí 0,1 až 500 mg
a jeho farmakokinetika sa nezmenila s časom pri opakovanom dennom podávaní až 24 týždňov.
Osobitné skupiny pacientov
Porucha funkcie obličiek
V rovnovážnom stave (20 mg dapagliflozínu jedenkrát denne počas 7 dní) bola priemerná systémová expozícia dapagliflozínu u pacientov s diabetes mellitus 2. typu a miernou, stredne závažnou alebo závažnou poruchou funkcie obličiek (určené meraním plazmatického klírens iohexolu) o 32 %, 60 %
a 87 % vyššia ako u pacientov s diabetes mellitus 2. typu s normálnou funkciou obličiek. 24-hodinové vylučovanie glukózy močom v rovnovážnom stave značne záviselo od funkcie obličiek a u jedincov
s diabetes mellitus 2. typu s normálnou funkciou obličiek sa vylúčilo 85 g glukózy/deň, u jedincov
s miernou poruchou funkcie obličiek 52 g/deň, so stredne závažnou poruchou funkcie obličiek
18 g/deň a so závažnou poruchou funkcie obličiek 11 g/deň. Vplyv hemodialýzy na expozíciu dapagliflozínu nie je známy.
Poruchafunkciepečene
U jedincov s miernou alebo stredne závažnou poruchou funkcie pečene (Childova-Pughova trieda A a B) boli priemerné hodnoty dapagliflozínu Cmax o 12 % a AUC o 36 % vyššie ako u zdravých jedincov spárovaných kontrol. Tieto rozdiely sa nepovažujú za klinicky významné. U jedincov
so závažnou poruchou funkcie pečene (Childova-Pughova trieda C) boli priemerné hodnoty dapagliflozínu Cmax o 40 % a AUC o 67 % vyššie ako u zdravých jedincov spárovaných kontrol.
Starší pacienti (≥ 65 rokov)
Zvýšenie expozície v závislosti od veku nie je klinicky významné u jedincov do 70 rokov. Zvýšenú expozíciu je však možné očakávať kvôli zníženej funkcii obličiek súvisiacej s vekom. Nie sú k dispozícii dostatočné údaje na vytvorenie záverov o expozícii u pacientov vo veku > 70 rokov.
Pediatrická populácia
Farmakokinetika sa u detí a dospievajúcich nesledovala.
Pohlavie
Priemerná AUCss dapagliflozínu u žien bola odhadom približne o 22 % vyššia ako u mužov.
Rasová príslušnosť
V systémovej expozícii medzi belochmi, černochmi a aziatmi nie sú klinicky významné rozdiely.
Telesná hmotnosť
Zistilo sa, že expozícia dapagliflozínu sa znižuje so zvyšujúcou hmotnosťou. Preto pacienti s nízkou
hmotnosťou môžu mať o trocha vyššiu expozíciu a pacienti s vyššou hmotnosťou o trochu nižšiu expozíciu. Rozdiely v expozícii sa však nepovažujú za klinicky významné.
5.3 Predklinické údaje o bezpečnosti
Neklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a fertility neodhalili žiadne osobitné riziko pre ľudí. Dapagliflozín nevyvolal nádory ani u myší ani u potkanov pri žiadnej z dávok hodnotených v rámci dvojročných štúdií karcinogenity.
Reprodukčná a vývojová toxicita
Priame podávanie dapagliflozínu dojčeným mláďatám potkanov a nepriama expozícia v pokročilej
brezivosti (v období zodpovedajúcom druhému a tretiemu trimestru gravidity vzhľadom na
dozrievanie obličiek u ľudí) a dojčenia sú spojené so zvýšeným výskytom a/alebo závažnosťou dilatácie obličkovej panvičky a dilatácie tubulov u potomstva.
V štúdii juvenilnej toxicity, v ktorej sa dapagliflozín podával priamo mladým potkanom od 21. do 90. dňa po narodení, sa zaznamenala dilatácia obličkovej panvičky a tubulov pri všetkých hladinách dávok, expozície mláďat pri najnižšej testovanej dávke boli ≥ 15-násobkom maximálnej odporúčanej dávky u ľudí. Tieto zistenia súviseli so zvýšením hmotnosti obličiek závislým od dávky
a s makroskopickým zväčšením obličiek pozorovaným pri všetkých dávkach. Dilatácia obličkovej panvičky a tubulov pozorovaná u mláďat v priebehu približne 1 mesiaca zotavovania sa nezvrátila úplne.
V separátnej štúdii prenatálneho a postnatálneho vývoja sa dapagliflozín podával brezivým samiciam potkanov od gestačného dňa 6 po postnatálny deň 21 a mláďatá boli lieku nepriamo vystavené in
utero a počas dojčenia. (Vykonala sa satelitná štúdia na stanovenie expozície dapagliflozínu v mlieku a u mláďat). Zistil sa zvýšený výskyt alebo závažnosť dilatácie obličkovej panvičky u dospelých potomkov liečených samíc, hoci iba pri najvyšších testovaných dávkach (expozície pre samice-matky predstavovali 1 415-násobok maximálnej odporúčanej dávky u ľudí a pre mláďatá 137-násobok maximálnej odporúčanej dávky u ľudí). Ďalšia vývojová toxicita bola obmedzená na zníženie telesnej hmotnosti mláďat v závislosti od dávky a pozorovala sa iba pri dávkach ≥ 15 mg/kg/deň (expozícia mláďat ≥ 29-násobne vyššia ako hodnoty u ľudí pri maximálnych odporúčaných dávkach). Toxicita pre brezivé samice bola zrejmá iba pri najvyšších testovaných dávkach a bola obmedzená na prechodné zníženie telesnej hmotnosti a spotrebu potravy pri danej dávke. Hladina, pri ktorej nebol
pozorovaný žiadny nežiaduci účinok (NOAEL) na vývojovú toxicitu, najnižšia testovaná dávka, súvisí
so systémovou expozíciou brezivých samíc mnohonásobnej dávke, ktorá je približne 19-násobkom hodnoty u ľudí pri maximálnej odporúčanej dávke.
V ďalších štúdiách zameraných na embryofetálny vývin potkanov a králikov sa dapagliflozín podával v obdobiach predstavujúcich hlavné obdobia organogenézy u každého z druhov. Pri žiadnej testovanej dávke sa nezistila toxicita pre brezivé samice králikov ani toxicita ovplyvňujúca vývin králikov; najvyššia testovaná dávka súvisí so systémovou expozíciou pri približne 1 191-násobku maximálnej odporúčanej dávky u ľudí. U potkanov dapagliflozín nevykazoval ani embryoletálny ani teratogénny účinok pri expozícii do 1 441-násobku maximálnej odporúčanej dávky u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
celulóza, mikrokryštalická (E460i)
laktóza
krospovidón (E1202)
oxid kremičitý (E551)
stearát horečnatý (E470b)
Filmový obal
polyvinylalkohol (E1203)
oxid titaničitý (E171)
makrogol 3350
mastenec (E553b)
žltý oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Alu/Alu blister
Balenia po 14, 28 a 98 filmom obalených tabliet v neperforovaných kalendárnych blistroch.
Balenia po 30x1 a 90x1 filmom obalených tabliet v perforovaných blistroch s jednotlivou dávkou. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAstraZeneca AB
SE-151 85 Södertälje
Švédsko
8. REGISTRAČNÉ ČÍSLAEU/1/12/795/001 14 filmom obalených tabliet EU/1/12/795/002 28 filmom obalených tabliet EU/1/12/795/003 98 filmom obalených tabliet
EU/1/12/795/004 30x1 (jednotlivá dávka) filmom obalených tabliet
EU/1/12/795/005 90x1 (jednotlivá dávka) filmom obalených tabliet
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. novembra 2012
Dátum posledného predĺženia registrácie: 28. augusta 2017
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1. NÁZOV LIEKU
Forxiga 10 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jedna tableta obsahuje monohydrát dapagliflozín propándiolu, čo zodpovedá 10 mg dapagliflozínu
(dapagliflozin).
Pomocná látka so známym účinkom
Jedna 10 mg tableta obsahuje 50 mg laktózy.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta (tableta).
Žlté, bikonvexné, približne 1,1 x 0,8 cm diagonálne filmom obalené tablety v tvare kosoštvorca s vyrytým označením „10“ na jednej strane a „1428“ na druhej strane.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Diabetes mellitus 2. typu
Forxiga je indikovaná dospelým pacientom na liečbu nedostatočne kontrolovaného diabetes mellitus
2. typu ako doplnková liečba k diéte a pohybovej aktivite.
- ako monoterapia, keď sa užívanie metformínu kvôli neznášanlivosti považuje za nevhodné.
- ako doplnok k iným liekom na liečbu diabetes mellitus 2. typu.
Výsledky štúdií s ohľadom na kombináciu terapií, účinky na kontrolu glykémie, kardiovaskulárne udalosti a skúmané populácie, pozri časti 4.4, 4.5 a 5.1.
Srdcové zlyhávanie
Forxiga je indikovaná dospelým pacientom na liečbu symptomatického chronického srdcového
zlyhávania so zníženou ejekčnou frakciou.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Diabetes mellitus 2. typu
Odporúčaná dávka je 10 mg dapagliflozínu jedenkrát denne.
Ak sa dapagliflozín používa v kombinácii s inzulínom alebo látkami stimulujúcimi sekréciu inzulínu, ako je sulfonylurea, môže sa zvážiť nižšia dávka inzulínu alebo látok stimulujúcich sekréciu inzulínu na zníženie rizika hypoglykémie (pozri časti 4.5 a 4.8).
Srdcové zlyhávanie
Odporúčaná dávka je 10 mg dapagliflozínu jedenkrát denne.
V štúdii DAPA-HF sa dapagliflozín podával spolu s ďalšími liekmi na srdcové zlyhávanie (pozri časť
5.1).
Osobitné skupiny pacientov
Liečba diabetes mellitus u pacientov s poruchou funkcie obličiek
Vzhľadom na to, že glykemická účinnosť závisí od funkcie obličiek, Forxiga sa nemá nasadiť na zlepšenie kontroly glykémie u pacientov s rýchlosťou glomerulárnej filtrácie [GFR] < 60 ml/min a má sa vysadiť v prípade GFR trvale nižšieho ako 45 ml/min (pozri časti 4.4, 4.8, 5.1 a 5.2).
Na základe funkcie obličiek nie je potrebná úprava dávky.
Liečba srdcového zlyhávania u pacientov s poruchou funkcie obličiek
Na základe funkcie obličiek nie je potrebná úprava dávky (pozri časť 4.4).
K dispozícii sú obmedzené skúsenosti s dapagliflozínom v liečbe srdcového zlyhávania u pacientov so závažnou poruchou funkcie obličiek (GFR < 30 ml/min).
Porucha funkcie pečene
U pacientov s miernou alebo stredne závažnou poruchou funkcie pečene nie je potrebná žiadna úprava
dávky. U pacientov so závažnou poruchou funkcie pečene sa odporúča začiatočná dávka 5 mg. Pokiaľ sa dobre znáša, môže byť dávka zvýšená na 10 mg (pozri časti 4.4 a 5.2).
Pacienti s diabetes mellitus 1. typu
Forxiga 10 mg sa neodporúča na liečbu srdcového zlyhávania u pacientov s diabetes mellitus 1. typu
(pozri časť 4.4).
Starší pacienti (≥ 65 rokov)
Nie je odporúčaná žiadna úprava dávky v závislosti od veku.
Pediatrická populácia
Bezpečnosť a účinnosť dapagliflozínu u detí vo veku 0 až < 18 rokov nebola doteraz stanovená. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Forxiga sa môže užívať perorálne jedenkrát denne s jedlom alebo bez jedla kedykoľvek počas dňa.
Tablety sa majú prehltnúť celé.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Porucha funkcie obličiek
Liečba diabetes mellitus
Glykemická účinnosť dapagliflozínu závisí od funkcie obličiek a účinnosť je znížená u pacientov so stredne závažnou poruchou funkcie obličiek a pravdepodobne chýba u pacientov so závažnou poruchou funkcie obličiek (pozri časti 4.2, 5.1 a 5.2). U jedincov so stredne závažnou poruchou funkcie obličiek (GFR < 60 ml/min) mal vyšší podiel pacientov liečených dapagliflozínom
v porovnaní s placebom nežiaduce reakcie vo zvýšení kreatinínu, fosforu, parathormónu (PTH)
a hypotenzii.
Forxiga sa nemá nasadiť na zlepšenie kontroly glykémie pri liečbe diabetes mellitus u pacientov s GFR < 60 ml/min a má sa vysadiť v prípade GFR trvale nižšieho ako 45 ml/min. Forxiga sa
neskúmala u pacientov so závažnou poruchou funkcie obličiek (GFR < 30 ml/min) alebo s ochorením obličiek v terminálnom štádiu (end stage renal disease, ESRD).
Monitorovanie funkcie obličiek sa odporúča nasledovne:
· Pred začatím liečby dapagliflozínom a potom najmenej raz ročne (pozri časti 4.2, 4.8, 5.1 a 5.2).
· Pred začatím súbežného užívania liekov, ktoré môžu znížiť funkciu obličiek a potom v pravidelných intervaloch.
· Pri funkcii obličiek s GFR < 60 ml/min najmenej 2 až 4-krát za rok.
Liečba srdcového zlyhávania
K dispozícii sú obmedzené skúsenosti s dapagliflozínom v liečbe srdcového zlyhávania u pacientov so závažnou poruchou funkcie obličiek (GFR < 30 ml/min).
U pacientov liečených dapagliflozínom na srdcové zlyhávanie aj na diabetes mellitus 2. typu sa má pri pretrvávajúcom poklese GFR pod 45 ml/min zvážiť prídavná liečba znižujúca hladinu glukózy.
Porucha funkcie pečene
K dispozícii sú len obmedzené skúsenosti u pacientov s poruchou funkcie pečene z klinických štúdií.
U pacientov so závažnou poruchou funkcie pečene je zvýšená expozícia dapagliflozínu (pozri časti 4.2
a 5.2).
Použitie u pacientov s rizikom deplécie objemu a/alebo hypotenziou
Vzhľadom na mechanizmus účinku, dapagliflozín zvyšuje diurézu, ktorá môže viesť k miernemu
poklesu krvného tlaku pozorovanému v klinických štúdiách (pozri časť 5.1). Toto môže byť
výraznejšie u pacientov s veľmi vysokou koncentráciou glukózy v krvi.
Opatrnosť je potrebná u pacientov, u ktorých by dapagliflozínom privodený pokles krvného tlaku mohol predstavovať riziko, ako sú pacienti na antihypertenznej liečbe s anamnézou hypotenzie alebo starší pacienti.
V prípade pridružených stavov, ktoré môžu viesť k deplécii objemu (napr. gastrointestinálne ochorenie), sa odporúča starostlivo sledovať stav objemu (napr. fyzikálne vyšetrenie, meranie krvného tlaku, laboratórne testy vrátane hematokritu a elektrolytov). U pacientov, u ktorých sa vyvinula deplécia objemu, sa odporúča dočasné prerušenie liečby dapagliflozínom pokiaľ sa neupraví deplécia (pozri časť 4.8).
Diabetická ketoacidóza
U pacientov so zvýšeným rizikom diabetickej ketoacidózy (DKA) sa majú inhibítory
sodíko-glukózového kotransportéra 2 (SGLT2) používať s opatrnosťou. Pacienti, u ktorých môže byť vyššie riziko DKA, zahŕňajú pacientov s nízkou funkčnou rezervou beta-buniek (napr. pacienti
s diabetom 1. typu, pacienti s diabetom 2. typu s nízkou hladinou C-peptidu alebo s latentným autoimunitným diabetom u dospelých (LADA) alebo pacienti s pankreatitídou v anamnéze), pacienti so stavmi vedúcimi k obmedzenému príjmu potravy alebo závažnej dehydratácii, pacienti, u ktorých
sú dávky inzulínu znížené a pacienti so zvýšenou potrebou inzulínu z dôvodu akútneho ochorenia, chirurgického zákroku alebo nadmerného požívania alkoholu.
Riziko výskytu diabetickej ketoacidózy sa musí zvážiť v prípade nešpecifických symptómov ako sú nauzea, vracanie, anorexia, bolesť brucha, nadmerný smäd, ťažkosti s dýchaním, zmätenosť, neobvyklá únava alebo ospalosť. Ak sa vyskytnú tieto príznaky, pacienti majú byť okamžite vyšetrení na ketoacidózu, bez ohľadu na hladinu glukózy v krvi.
Pred začatím liečby dapagliflozínom sa majú zvážiť faktory v anamnéze pacienta, ktoré by ho mohli predisponovať ku ketoacidóze.
Liečba sa má prerušiť u pacientov hospitalizovaných kvôli závažným chirurgickým zákrokom alebo akútnym závažným ochoreniam. U týchto pacientov sa odporúča sledovať hladinu ketónov. Uprednostňuje sa meranie hladiny ketónov v krvi namiesto moču. Liečba dapagliflozínom sa môže opäť začať, ak je hladina ketónov normálna a stav pacienta je stabilizovaný.
Diabetes mellitus 2. typu
U pacientov liečených inhibítormi SGLT2, vrátane dapagliflozínu, boli hlásené zriedkavé prípady DKA, vrátane život ohrozujúcich a fatálnych prípadov. V mnohých prípadoch bol prejav tohto stavu atypický len s mierne zvýšenými hodnotami glukózy v krvi, menej ako 14 mmol/l (250 mg/dl).
U pacientov so suspektnou alebo diagnostikovanou DKA sa má liečba dapagliflozínom okamžite prerušiť.
Obnovenie liečby inhibítorom SGLT2 u pacientov s anamnézou DKA prítomnou počas liečby inhibítorom SGLT2 sa neodporúča, pokiaľ nebol identifikovaný a odstránený iný jednoznačný spúšťací faktor.
Diabetes mellitus 1. typu
V štúdiách s diabetes mellitus 1. typu s dapagliflozínom bola DKA hlásená s častou frekvenciou. Dapagliflozín v dávke 10 mg sa nemá používať na liečbu pacientov s diabetom 1. typu.
Nekrotizujúca fasciitída perinea (Fournierova gangréna)
U pacientov a pacientok užívajúcich inhibítory SGLT2 boli po uvedení lieku na trh hlásené prípady
nekrotizujúcej fasciitídy perinea (známej tiež ako Fournierova gangréna) (pozri časť 4.8). Ide o zriedkavú, ale závažnú a potenciálne život ohrozujúcu udalosť, ktorá vyžaduje urgentný chirurgický zákrok a antibiotickú liečbu.
Pacientov je potrebné upozorniť, aby vyhľadali lekársku pomoc, ak sa u nich vyskytne kombinácia príznakov zahŕňajúcich bolesť, citlivosť, erytém alebo opuch v oblasti genitálií alebo perinea spolu s horúčkou alebo malátnosťou. Lekár si má byť vedomý, že nekrotizujúcej fasciitíde môže predchádzať urogenitálna infekcia alebo perineálny absces. V prípade podozrenia na Fournierovu
gangrénu sa má podávanie Forxigy prerušiť a má sa urýchlene začať liečba (zahŕňajúca antibiotiká a
chirurgickú excíziu a vyčistenie rany).
Infekcie močových ciest
Vylučovanie glukózy močom môže súvisieť so zvýšeným rizikom infekcie močových ciest; preto sa
má počas liečby pyelonefritídy alebo urosepsy zvážiť dočasné prerušenie liečby dapagliflozínom.
Starší pacienti (≥ 65 rokov)
Starší pacienti môžu mať zvýšené riziko vzniku deplécie objemu a je u nich väčšia pravdepodobnosť,
že budú liečení diuretikami.
U starších pacientov je väčšia pravdepodobnosť, že majú poruchu funkcie obličiek a/alebo sú liečení antihypertenzívnymi liekmi, ktoré môžu spôsobiť zmeny renálnych funkcií, ako sú inhibítory angiotenzín konvertujúceho enzýmu (angiotensin converting enzyme inhibitors, ACE-I) a blokátory receptorov typu 1 pre angiotenzín II (angiotensin II type 1 receptor blockers, ARB). Na starších pacientov sa vzťahujú tie isté odporúčania s ohľadom na funkciu obličiek ako na ostatných pacientov (pozri časti 4.2, 4.4, 4.8 a 5.1).
Srdcové zlyhávanie
Skúsenosti s dapagliflozínom u pacientov so srdcovým zlyhávaním triedy IV podľa klasifikácie
NYHA sú obmedzené.
Amputácie dolných končatín
V dlhodobých klinických štúdiách diabetes mellitus 2. typu s inhibítormi SGLT2 sa pozoroval
zvýšený počet prípadov amputácie dolných končatín (hlavne prstov). Nie je známe, či sa jedná
o skupinový účinok. Je dôležité odporučiť pacientom s diabetom pravidelnú preventívnu starostlivosť o chodidlá.
Laboratórne vyšetrenie moču
Vzhľadom k mechanizmu účinku, budú mať pacienti užívajúci Forxigu test na glukózu v moči
pozitívny.
Laktóza
Tablety obsahujú laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie,
celkového deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Farmakodynamické interakcie
Diuretiká
Dapagliflozín sa môže pridať k diuretickému účinku tiazidu a slučkových diuretík a môže zvýšiť
riziko dehydratácie a hypotenzie (pozri časť 4.4).
Inzulín a látky stimulujúce sekréciu inzulínu
Inzulín a látky stimulujúce sekréciu inzulínu, ako je sulfonylurea, spôsobujú hypoglykémiu. Preto sa
môže vyžadovať nižšia dávka inzulínu alebo látok stimulujúcich sekréciu inzulínu, aby sa znížilo riziko hypoglykémie pri použití v kombinácii s dapagliflozínom u pacientov s diabetes mellitus 2. typu (pozri časti 4.2 a 4.8).
Farmakokinetické interakcie
Dapagliflozín sa metabolizuje hlavne konjugáciou na glukuronid sprostredkovanou
UDP-glukuronozyltransferázou 1A9 (UGT1A9).
V štúdiách in vitro dapagliflozín neinhiboval ani cytochróm P450 (CYP) 1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4, ani neindukoval CYP1A2, CYP2B6 alebo CYP3A4. Preto sa nepredpokladá, že by dapagliflozín menil metabolický klírens súbežne podávaných liekov, ktoré sú metabolizované týmito enzýmami.
Účinok iných liekov na dapagliflozín
Interakčné štúdie vykonané u zdravých jedincov, väčšinou s jednodávkovým režimom užívania,
naznačujú, že farmakokinetika dapagliflozínu sa nemení metformínom, pioglitazónom, sitagliptínom, glimepiridom, voglibózou, hydrochlorotiazidom, bumetanidom, valsartanom alebo simvastatínom.
Po súbežnom podaní dapagliflozínu s rifampicínom (induktor rôznych aktívnych transportérov a enzýmov metabolizujúcich liečivá) sa pozorovalo 22 % zníženie systémovej expozície dapagliflozínu (AUC), ale bez klinicky významného účinku na 24-hodinové vylučovanie glukózy močom. Úprava dávky sa neodporúča. Klinicky významný účinok s inými induktormi (napr. karbamazepín, fenytoín, fenobarbital) sa neočakáva.
Po súbežnom podávaní dapagliflozínu s kyselinou mefenamovou (inhibítor UGT1A9) sa pozorovalo
55 % zvýšenie systémovej expozície dapagliflozínu, ale bez klinicky významného účinku na
24-hodinové vylučovanie glukózy močom. Úprava dávkovania sa neodporúča.
Účinok
dapagliflozínu
na
iné
lieky
V interakčných štúdiách vykonaných u zdravých jedincov, väčšinou s jednodávkovým režimom
užívania, dapagliflozín nezmenil farmakokinetiku metformínu, pioglitazónu, sitagliptínu, glimepiridu, hydrochlorotiazidu, bumetanidu, valsartanu, digoxínu (substrát P-gp) alebo warfarínu (S-warfarínu, substrátu CYP2C9), alebo antikoagulačné vlastnosti warfarínu stanovené INR. Kombinácia jednej dávky dapagliflozínu 20 mg a simvastatínu (substrátu CYP3A4) vyústila do 19 % zvýšenia AUC simvastatínu a 31 % zvýšenia AUC kyseliny simvastatínovej. Zvýšenia expozícií simvastatínu
a kyseliny simvastatínovej sa nepovažujú za klinicky významné.
Interferencia s testom s 1,5-anhydroglucitolom (1,5-AG)
Monitorovanie glykemickej kontroly testom s 1,5-AG sa neodporúča, pretože merania s 1,5-AG sú
nespoľahlivé pri hodnotení glykemickej kontroly u pacientov užívajúcich inhibítory SGLT2. Na monitorovanie glykemickej kontroly sa odporúča použiť alternatívne metódy.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití dapagliflozínu u gravidných žien. Štúdie na potkanoch
preukázali toxicitu na vývoj obličiek v období, ktoré sa zhoduje s druhým a tretím trimestrom ľudskej gravidity (pozri časť 5.3). Preto sa použitie dapagliflozínu počas druhého a tretieho trimestra gravidity neodporúča.
Ak sa zistí gravidita, liečba dapagliflozínom sa má ukončiť. Dojčenie
Nie je známe, či sa dapagliflozín a/alebo jeho metabolity vylučujú do materského mlieka u ľudí.
Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie dapagliflozínu/metabolitov do mlieka, ako aj farmakologicky sprostredkované účinky u dojčených potomkov (pozri časti 5.3). Riziko u novorodencov/dojčiat nie je možné vylúčiť. Dapagliflozín sa nemá užívať počas dojčenia.
Fertilita
Účinok dapagliflozínu na fertilitu u ľudí sa nesledoval. U samcov a samíc potkanov dapagliflozín
v žiadnych testovaných dávkach nepreukázali účinky na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Forxiga nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti majú byť upozornení na riziko hypoglykémie pri užívaní dapagliflozínu v kombinácii so sulfonylureou alebo inzulínom.
4.8 Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Diabetes mellitus 2. typu
V klinických štúdiách s diabetes mellitus 2. typu bolo viac ako 15 000 pacientov liečených dapagliflozínom.
Primárne hodnotenie bezpečnosti a znášanlivosti sa vykonalo v súhrnnej vopred špecifikovanej analýze 13 krátkodobých (do 24 týždňov) placebom kontrolovaných štúdií s 2 360 jedincami liečenými dapagliflozínom 10 mg a s 2 295 jedincami dostávajúcimi placebo.
V štúdii s dapagliflozínom sledujúcej kardiovaskulárne účinky pri liečbe diabetes mellitus 2. typu (štúdia DECLARE, pozri časť 5.1) dostávalo 8 574 pacientov dapagliflozín 10 mg a 8 569 pacientov dostávalo placebo s mediánom času expozície 48 mesiacov. Celkovo bolo 30 623 pacientorokov expozície dapagliflozínu.
Najčastejšie hlásenými nežiaducimi reakciami vo všetkých klinických štúdiách boli genitálne infekcie.
Srdcové zlyhávanieV štúdii s dapagliflozínom sledujúcej kardiovaskulárne účinky liečby u pacientov so srdcovým zlyhávaním so zníženou ejekčnou frakciou (štúdia DAPA-HF) bolo 2 368 pacientov liečených 10 mg dapagliflozínu a 2 368 pacientov dostávalo placebo s mediánom času expozície 18 mesiacov. Populácia pacientov zahŕňala pacientov s diabetes mellitus 2. typu a pacientov bez diabetu,
a pacientov s eGFR ≥ 30 ml/min/1,73 m2.
Celkový bezpečnostný profil dapagliflozínu u pacientov so srdcovým zlyhávaním bol v súlade so známym bezpečnostným profilom dapagliflozínu.
Tabuľkový zoznam nežiaducich reakciíNasledujúce nežiaduce reakcie boli zistené v placebom kontrolovaných klinických štúdiách
a v sledovaní po uvedení lieku na trh. Pre žiadnu sa nezistila súvislosť s dávkou. Nežiaduce reakcie uvedené nižšie sú klasifikované podľa frekvencie a tried orgánových systémov (system organ class, SOC). Kategórie frekvencií sú definované podľa nasledovných pravidiel: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000) a neznáme (nemožno odhadnúť z dostupných údajov).
Tabuľka 1 Nežiaduce reakcie v placebom kontrolovaných klinických štúdiáchaTriedy orgánových systémov
| Veľmi časté
| Časté*
| Menej časté**
| Zriedkavé
| Veľmi zriedkavé
| Infekcie a nákazy
|
| Vulvovaginitída,
balanitída
a súvisiace
genitálne infekcie*,b,c Infekcia močových ciest*,b,d
| Plesňová
infekcia**
|
| Nekrotizujúca
fasciitída perinea (Fournierova gangréna)b,i
| Poruchy metabolizmu
a výživy
| Hypoglykémia
(keď sa použil so SU alebo inzulínom)b
|
| Deplécia
objemub,e
Smäd**
| Diabetická
ketoacidóza (pri diabetes mellitus 2. typu)b,i,k
|
| Poruchy nervového
systému
|
| Závrat
|
|
|
| Poruchy
gastrointestinálneho traktu
|
|
| Zápcha**
Sucho v ústach**
|
|
| Poruchy kože
a podkožného tkaniva
|
| Vyrážkaj
|
|
| Angioedém
| Poruchy kostrovej
a svalovej sústavy
a spojivového tkaniva
|
| Bolesť chrbta*
|
|
|
| Poruchy obličiek
a močových ciest
|
| Dyzúria
Polyúria*,f
| Noktúria**
|
|
|
|
|
a postmarketingové skúsenosti
Poruchy
reprodukčného
systém
u a prsníkov
|
|
|
Vulvovaginálny pruritus**
Genitálny pruritus**
|
|
|
Laboratórne
a funkčné vyšetrenia
|
|
Zvýšenie
hematokritug
Zníženie
renálneho klírensu kreatinínu počas úvodnej liečbyb Dyslipidémiah
|
Zvýšenie
kreatinínu v krvi počas úvodnej liečby**,b Zvýšenie močoviny
v krvi**
Zníženie hmotnosti**
|
|
|
aTabuľka ukazuje až 24-týždňové (krátkodobé) údaje bez ohľadu na záchrannú liečbu glykémie.
bĎalšie informácie pozri v súvisiacich odsekoch nižšie.
cVulvovaginitída, balanitída a súvisiace genitálne infekcie zahŕňajú, napr. preferované termíny: vulvovaginálna mykotická infekcia, vaginálna infekcia, balanitída, genitálna plesňová infekcia, vulvovaginálna kandidóza, vulvovaginitída, kandidová balanitída, genitálna kandidóza, genitálna infekcia, genitálna infekcia u mužov, infekcia penisu, vulvitída, bakteriálna vaginitída a absces vulvy.
dInfekcia močových ciest zahŕňa nasledujúce preferované termíny uvedené v poradí hlásenej frekvencie:
infekcia močových ciest, cystitída, infekcia močových ciest zapríčinená baktériami Escherichia, infekcie urogenitálneho traktu, pyelonefritída, trigonitída, uretritída, infekcia obličiek a prostatitída.
eDeplécia objemu zahŕňa, napr. preferované termíny: dehydratácia, hypovolémia, hypotenzia.
fPolyúria zahŕňa preferované termíny: polakizúria, polyúria, zvýšená tvorba moču.
gPriemerná zmena hematokritu oproti východiskovej hodnote bola 2,30 % pri dapagliflozíne 10 mg oproti -0,33 % pri placebe. Hodnoty hematokritu > 55 % boli hlásené u 1,3 % jedincov liečených dapagliflozínom 10 mg oproti 0,4 % u jedincov s placebom.
hPriemerná percentuálna zmena z východiskovej hodnoty pre dapagliflozín 10 mg oproti placebu bola
v uvedenom poradí: celkový cholesterol 2,5 % oproti 0,0 %; HDL cholesterol 6,0 % oproti 2,7 %; LDL
cholesterol 2,9 % oproti -1,0 %; triglyceridy -2,7 % oproti -0,7 %.
i pozri časť 4.4
j Nežiaduca reakcia sa zistila po uvedení lieku na trh. Vyrážka zahŕňa nasledujúce preferované termíny uvedené v poradí podľa frekvencie v klinických štúdiách: vyrážka, generalizovaná vyrážka, pruritická vyrážka,
makulárna vyrážka, makulopapulárna vyrážka, pustulárna vyrážka, vezikulárna vyrážka a erytematózna vyrážka. V aktívne a placebom kontrolovaných klinických štúdiách (dapagliflozín, N = 5 936, celková kontrola, N =
3 403), frekvencia vyrážky bola podobná pre dapagliflozín (1,4 %) a celkovú kontrolu (1,4 %), v uvedenom poradí.
k Hlásené v štúdii sledujúcej kardiovaskulárne účinky liečby u pacientov s diabetes 2. typu (DECLARE). Frekvencia je uvedená na základe ročného výskytu.
*Hlásené u ≥ 2 % jedincov a o ≥ 1 % častejšie a minimálne u ďalších 3 jedincov liečených s dapagliflozínom
10 mg v porovnaní s placebom.
**Hlásené skúšajúcim ako možno súvisiace, pravdepodobne súvisiace alebo súvisiace so skúmanou liečbou a hlásené u ≥ 0,2 % jedincov a o ≥ 0,1 % častejšie a minimálne u viac ako u 3 jedincov liečených dapagliflozínom 10 mg v porovnaní s placebom.
Popis vybraných nežiaducich reakciíVulvovaginitída, balanitída a súvisiace genitálne infekcieV súhrnnej analýze z 13 bezpečnostných štúdií boli vulvovaginitída, balanitída a súvisiace genitálne infekcie hlásené u 5,5 % jedincov užívajúcich dapagliflozín 10 mg a u 0,6 % jedincov, ktorí dostávali placebo. Väčšina infekcií bola mierna až stredne závažná a jedinci odpovedali na začiatočnú štandardnú liečbu a zriedkavo vyústili do ukončenia liečby dapagliflozínom. Tieto infekcie boli častejšie u žien (8,4 % a 1,2 % pre dapagliflozín a placebo, v uvedenom poradí) a u jedincov
s infekciami v anamnéze bola pravdepodobnosť rekurentných infekcií väčšia.
V štúdii DECLARE boli počty pacientov so závažnými udalosťami genitálnych infekcií nízke a vyvážené: 2 pacienti v skupine s dapagliflozínom a 2 v skupine s placebom.
V štúdii DAPA-HF sa u žiadneho z pacientov v skupine s dapagliflozínom nehlásili závažné nežiaduce udalosti genitálnych infekcií, pričom tieto sa hlásili u jedného pacienta v skupine
s placebom. 7 (0,3 %) pacientov v skupine s dapagliflozínom malo nežiaduce udalosti vedúce
k ukončeniu liečby v dôsledku genitálnych infekcií, pričom v skupine s placebom nemal tieto udalosti žiadny pacient.
Nekrotizujúca fasciitída perinea (Fournierova gangréna)
U pacientov užívajúcich inhibítory SGLT2, vrátane dapagliflozínu, boli po uvedení lieku na trh hlásené prípady Fournierovej gangrény (pozri časť 4.4).
V štúdii DECLARE zahŕňajúcej 17 160 pacientov s diabetes mellitus 2. typu, s mediánom trvania expozície 48 mesiacov sa zaznamenalo celkovo 6 prípadov Fournierovej gangrény, jeden v skupine liečenej dapagliflozínom a 5 v skupine s placebom.
Hypoglykémia
Frekvencia výskytu hypoglykémie závisela od typu základnej liečby použitej v klinických štúdiách
diabetes mellitus.
V štúdiách s dapagliflozínom v monoterapii po pridaní k metformínu alebo po pridaní ku sitagliptínu (s metformínom alebo bez metformínu), frekvencia výskytu menej významných epizód hypoglykémie bola v liečených skupinách, vrátane placeba, podobná (< 5 %) až do 102 týždňov liečby. Vo všetkých štúdiách bol výskyt významných epizód hypoglykémie menej častý a v skupinách liečených
s dapagliflozínom alebo placebom porovnateľný. V štúdiách prídavnej liečby k sulfonyluree
a prídavnej liečby k inzulínu bol výskyt hypoglykémie vyšší (pozri časť 4.5).
V štúdii prídavnej liečby ku glimepiridu boli v 24. a 48. týždni menej významné epizódy hypoglykémie hlásené častejšie v skupine liečenej s dapagliflozínom 10 mg a glimepiridom (6,0 % a 7,9 % v uvedenom poradí) ako v skupine s placebom a glimepiridom (2,1 % a 2,1 % v uvedenom poradí).
V štúdii prídavnej liečby k inzulínu boli významné epizódy hypoglykémie hlásené u 0,5 % a 1,0 % jedincov liečených dapagliflozínom 10 mg s inzulínom po 24 a 104 týždňoch, v uvedenom poradí, a u 0,5 % jedincov v skupine liečenej placebom s inzulínom po 24 a 104 týždňoch. Po
24 a 104 týždňoch boli menej významné epizódy hypoglykémie hlásené v uvedenom poradí u 40,3 %
a 53,1 % jedincov, ktorí dostávali dapagliflozín 10 mg s inzulínom a u 34,0 % a 41,6 % jedincov, ktorí dostávali placebo s inzulínom.
V štúdii prídavnej liečby k metformínu a sulfonylurey neboli hlásené žiadne významné epizódy hypoglykémie až do 24 týždňov. Menej významné epizódy hypoglykémie boli hlásené u 12,8 % jedincov, ktorí dostávali dapagliflozín 10 mg s metformínom a sulfonylureou a u 3,7 % jedincov, ktorí dostávali placebo s metformínom a sulfonylureou.
V štúdii DECLARE sa pri dapagliflozíne v porovnaní s placebom nepozorovalo zvýšené riziko významných epizód hypoglykémie. Významné epizódy hypoglykémie sa hlásili u 58 (0,7 %) pacientov liečených dapagliflozínom a u 83 (1,0 %) pacientov dostávajúcich placebo.
V štúdii DAPA-HF sa významné udalosti hypoglykémie hlásili u 4 (0,2 %) pacientov v liečebnej skupine s dapagliflozínom aj v skupine s placebom a pozorovali sa iba u pacientov s diabetes mellitus
2. typu.
Deplécia objemu
V súhrnnej analýze z 13 bezpečnostných štúdií boli hlásené reakcie naznačujúce depléciu objemu (vrátane hlásení dehydratácie, hypovolémie alebo hypotenzie) u 1,1 % jedincov užívajúcich dapagliflozín 10 mg a u 0,7 % jedincov užívajúcich placebo; závažné reakcie sa vyskytli u < 0,2 % jedincov a ich výskyt pri použití dapagliflozínu 10 mg a placeba bol vyrovnaný (pozri časť 4.4).
V štúdii DECLARE boli počty pacientov s udalosťami naznačujúcimi depléciu objemu vyrovnané medzi oboma liečebnými skupinami: 213 (2,5 %) v skupine s dapagliflozínom a 207 (2,4 %)
v skupine s placebom. Závažné nežiaduce udalosti sa hlásili u 81 (0,9 %) pacientov v skupine s dapagliflozínom a u 70 (0,8 %) pacientov v skupine s placebom. Výskyt udalostí bol vo
všeobecnosti vyrovnaný medzi oboma liečebnými skupinami vo všetkých podskupinách zahŕňajúcich vek, užívanie diuretík, krvný tlak a užívanie inhibítorov enzýmu konvertujúceho angiotenzín
(ACE-I)/blokátorov receptorov typu 1 pre angiotenzín II (ARB). U pacientov s eGFR
< 60 ml/min/1,73 m2 na začiatku bolo v skupine s dapagliflozínom 19 závažných nežiaducich udalostí naznačujúcich depléciu objemu a 13 udalostí v skupine s placebom.
V štúdii DAPA-HF bolo 170 (7,2 %) pacientov s udalosťami naznačujúcimi depléciu objemu
v skupine s dapagliflozínom a 153 (6,5 %) v skupine s placebom. V skupine s dapagliflozínom bolo menej pacientov so závažnými udalosťami príznakov naznačujúcich depléciu objemu (23 [1,0 %])
v porovnaní so skupinou s placebom (38 [1,6 %]). Výsledky boli podobné bez ohľadu na
východiskový výskyt diabetu a východiskovú eGFR.
Diabetická ketoacidóza pri diabetes mellitus 2. typu
V štúdii DECLARE s mediánom expozície 48 mesiacov boli udalosti DKA hlásené u 27 pacientov v skupine s dapagliflozínom 10 mg a u 12 pacientov v skupine s placebom. Udalosti sa vyskytli rovnomerne počas celého trvania štúdie. Z 27 pacientov s udalosťami DKA v skupine
s dapagliflozínom bolo 22 v čase udalosti súbežne liečených inzulínom. Spúšťacie faktory pre DKA sa
v populácii s diabetes mellitus typu 2. očakávali (pozri časť 4.4).
V štúdii DAPA-HF sa udalosti DKA hlásili u 3 pacientov s diabetes mellitus 2. typu v skupine s dapagliflozínom, pričom v skupine s placebom sa tieto udalosti nehlásili u žiadneho pacienta.
Infekcie močových ciest
V súhrnnej analýze z 13 bezpečnostných štúdií boli infekcie močových ciest častejšie hlásené pri dapagliflozíne 10 mg v porovnaní s placebom (4,7 % oproti 3,5 % v uvedenom poradí; pozri časť 4.4). Väčšina infekcií bola mierna až stredne závažná a jedinci odpovedali na začiatočnú štandardnú liečbu
a zriedkavo viedli k ukončeniu liečby dapagliflozínom. Tieto infekcie boli častejšie u žien
a u jedincov s infekciami v anamnéze bola pravdepodobnosť rekurentných infekcií väčšia.
V štúdii DECLARE boli závažné udalosti infekcií močových ciest hlásené menej často pri dapagliflozíne 10 mg v porovnaní s placebom, 79 (0,9 %) udalostí oproti 109 (1,3 %) v uvedenom poradí.
V štúdii DAPA-HF bolo 14 (0,6 %) pacientov so závažnými nežiaducimi udalosťami infekcií močových ciest v skupine s dapagliflozínom a 17 (0,7 %) v skupine s placebom. 5 (0,2 %) pacientov v skupine s dapagliflozínom aj v skupine s placebom malo nežiaduce udalosti vedúce k ukončeniu liečby v dôsledku infekcií močových ciest.
Zvýšený kreatinín
Nežiaduce reakcie týkajúce sa zvýšeného kreatinínu boli zoskupené (napr. znížený renálny klírens
kreatinínu, porucha funkcie obličiek, zvýšená hladina kreatinínu v krvi a znížená rýchlosť glomerulárnej filtrácie). V bezpečnostnom súhrne 13 štúdií bolo toto zoskupenie reakcií bolo hlásené u 3,2 % pacientov, ktorí dostávali dapagliflozín 10 mg a u 1,8 % pacientov, ktorí dostávali placebo.
U pacientov s normálnou funkciou obličiek alebo s miernou poruchou funkcie obličiek (východisková hodnota eGFR ≥ 60 ml/min/1,73 m2) bolo toto zoskupenie reakcií hlásené u 1,3 % pacientov, ktorí dostávali dapagliflozín 10 mg a u 0,8 % pacientov, ktorí dostávali placebo. Tieto reakcie boli častejšie u pacientov s východiskovou hodnotou eGFR ≥ 30 a < 60 ml/min/1,73 m2 (18,5 % pri dapagliflozíne
10 mg oproti 9,3 % pri placebe).
Ďalšie hodnotenie pacientov, u ktorých sa vyskytli nežiaduce udalosti týkajúce sa obličiek, preukázalo, že väčšina z nich mala zmeny sérového kreatinínu ≤ 0,5 mg/dl oproti východiskovej hodnote. Zvýšenia kreatinínu boli zvyčajne prechodné počas kontinuálnej liečby alebo reverzibilné po ukončení liečby.
V štúdii DECLARE zahŕňajúcej starších pacientov a pacientov s poruchou funkcie obličiek (eGFR
nižšia ako 60 ml/min/1,73 m2) sa eGFR postupom času znižovala v oboch liečebných skupinách. 1.
rok bola priemerná hodnota eGFR mierne nižšia a 4. rok bola priemerná hodnota eGFR mierne vyššia v skupine s dapagliflozínom v porovnaní so skupinou s placebom.
V štúdii DAPA-HF sa eGFR v skupine s dapagliflozínom aj v skupine s placebom znižovala v priebehu času. Začiatočné zníženie priemernej eGFR v skupine s dapagliflozínom
bolo -4,3 ml/min/1,73 m2 a v skupine s placebom -1,1 ml/min/1,73 m2. Po 20 mesiacoch bola zmena
eGFR oproti východiskovej hodnote podobná medzi liečebnými skupinami: -5,3 ml/min/1,73 m2 pre dapagliflozín a -4,5 ml/min/1,73 m2 pre placebo.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNepreukázala sa toxicita dapagliflozínu u zdravých jedincov užívajúcich jednotlivé dávky až do
500 mg perorálne (50-násobok maximálnej odporúčanej dávky u ľudí). Títo jedinci mali glukózu detegovateľnú v moči po dobu, ktorá závisela od dávky (najmenej 5 dní pri dávke 500 mg), bez akýchkoľvek hlásení dehydratácie, hypotenzie alebo nerovnováhy elektrolytov a bez akéhokoľvek klinicky významného účinku na QTc interval. Výskyt hypoglykémie bol podobný ako pri placebe. V klinických štúdiách s podávaním dávok jedenkrát denne až do 100 mg denne (10-násobok maximálnej odporúčanej dávky u ľudí) počas 2 týždňov zdravým jedincom a jedincom s diabetes mellitus 2. typu, bol výskyt hypoglykémie v porovnaní s placebom mierne vyšší a nebol závislý od dávky. Výskyt nežiaducich udalostí vrátane dehydratácie alebo hypotenzie bol podobný ako pri
placebe a nezistili sa žiadne klinicky významné zmeny výsledkov laboratórnych testov vrátane hodnôt
elektrolytov v sére a biomarkerov funkcie obličiek v závislosti od dávky.
V prípade predávkovania je v závislosti od klinického stavu pacienta potrebné zahájiť vhodnú podpornú liečbu. Odstránenie dapagliflozínu hemodialýzou sa nesledovalo.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antidiabetiká, inhibítory sodíko-glukózového kotransportéra 2 (SGLT2), ATC kód: A10BK01
Mechanizmus účinkuDapagliflozín je vysoko účinným (Ki: 0,55 nM), selektívnym a reverzibilným inhibítorom SGLT2.
Inhibícia SGLT2 dapagliflozínom znižuje reabsorpciu glukózy z glomerulárneho filtrátu
v proximálnom tubule obličiek za súbežného zníženia reabsorpcie sodíka, čo vedie k vylučovaniu glukózy močom a osmotickej diuréze. Dapagliflozín preto zvyšuje transport sodíka do distálneho tubulu. Predpokladá sa, že toto zvyšuje tubuloglomerulárnu spätnú väzbu a znižuje intraglomerulárny tlak. V kombinácii s osmotickou diurézou to vedie k zníženiu objemového preťaženia, zníženiu krvného tlaku a nižšiemu predpätiu (preload) a doťaženiu (afterload) srdca, čo môže mať priaznivé účinky na remodeláciu srdca. Ďalšie účinky zahŕňajú zvýšenie hematokritu a zníženie telesnej hmotnosti. Ako sa preukázalo v štúdii DAPA-HF, prínosy dapagliflozínu týkajúce sa srdca nie sú výlučne závislé od účinku znižujúceho hladinu glukózy v krvi a nie sú obmedzené len na pacientov'
s diabetom.
Dapagliflozín zlepšuje hladinu glukózy v plazme nalačno aj po jedle znižovaním reabsorpcie glukózy obličkami, čo vedie k vylučovaniu glukózy močom. Toto vylučovanie glukózy (glykozúria) je
pozorované po prvej dávke, pretrváva počas 24 hodinového intervalu dávkovania a udržiava sa počas trvania liečby. Množstvo glukózy odstránenej obličkami prostredníctvom tohto spôsobu účinku závisí od koncentrácie glukózy v krvi a od GFR. V dôsledku toho má dapagliflozín u osôb s normálnou hladinou glukózy v krvi nízku tendenciu spôsobovať hypoglykémiu. V odpovedi na hypoglykémiu dapagliflozín nezhoršuje normálnu endogénnu tvorbu glukózy. Dapagliflozín pôsobí nezávisle od sekrécie a účinku inzulínu. V klinických štúdiách s dapagliflozínom sa pozorovalo zlepšenie funkcie beta buniek hodnotením pomocou modelu homeostázy (Homeostasis Model Assessment-β,
HOMA-β).
SGLT2 je selektívne exprimovaný v obličkách. Dapagliflozín neinhibuje iné transportéry dôležité pre transport glukózy do periférnych tkanív a je > 1 400-násobne selektívnejší pre SGTL2 ako pre SGTL1, hlavný transportér v čreve zodpovedný za absorpciu glukózy.
Farmakodynamické účinky
Po podaní dapagliflozínu sa u zdravých jedincov a u jedincov s diabetes mellitus 2. typu zaznamenalo
zvýšené množstvo glukózy v moči. Pri dávke dapagliflozínu 10 mg denne počas 12 týždňov
u jedincov s diabetes mellitus 2. typu sa močom vylúčilo približne 70 g glukózy (čo zodpovedá
280 kcal/deň). Sledovalo sa trvalé vylučovanie glukózy u pacientov s diabetes mellitus 2. typu, ktorým sa podával dapagliflozín 10 mg/deň až 2 roky.
Pri dapagliflozíne malo vylučovanie glukózy močom za následok aj osmotickú diurézu a zvýšený objem moču u pacientov s diabetes mellitus 2. typu. Zvýšenie objemu moču u pacientov s diabetes mellitus 2. typu liečených dapagliflozínom 10 mg zostalo zachované po 12 týždňoch a predstavovalo približne 375 ml/deň. Zvýšenie objemu moču sa spájalo s malým a prechodným zvýšením vylučovania sodíka močom, ktoré nesúviselo so zmenami koncentrácií sodíka v sére.
Prechodne (3 až 7 dní) sa zvýšilo aj vylučovanie kyseliny močovej močom a bolo sprevádzané pretrvávajúcim poklesom koncentrácie kyseliny močovej v sére. Po 24 týždňoch sa pokles koncentrácie kyseliny močovej v sére pohyboval v rozmedzí -48,3 až -18,3 mikromolov/l
(-0,87 až -0,33 mg/dl).
Klinická účinnosť a bezpečnosť
Diabetes mellitus 2. typu
Zlepšenie kontroly glykémie aj zníženie kardiovaskulárnej morbidity a mortality sú neoddeliteľnou
súčasťou liečby diabetu 2. typu.
Na hodnotenie glykemickej účinnosti a bezpečnosti Forxigy sa vykonalo štrnásť dvojito zaslepených, randomizovaných, kontrolovaných klinických štúdií u 7 056 jedincov s diabetom 2. typu;
4 737 jedincov bolo v týchto štúdiách liečených dapagliflozínom. Dĺžka liečby bola v dvanástich štúdiách 24 týždňov, v 8 štúdiách s dlhodobým rozšírením bola v rozmedzí od 24 do 80 týždňov (až do celkového trvania štúdie 104 týždňov), v jednej štúdii bola 28 týždňov a v jednej štúdii bola
52 týždňov s dlhodobým rozšírením 52 a 104 týždňov (celkové trvanie štúdie 208 týždňov). Priemerná dĺžka liečby diabetu bola v rozmedzí od 1,4 do 16,9 rokov. Päťdesiat percent (50 %) malo miernu poruchu funkcie obličiek a 11 % malo stredne závažnú poruchu funkcie obličiek. Päťdesiatjeden percent (51 %) jedincov boli muži, 84 % belosi, 8 % aziati, 4 % černosi a 4 % príslušníci iných rás. Osemdesiatjeden percent (81 %) jedincov malo index telesnej hmotnosti
(BMI) ³ 27. Okrem toho sa uskutočnili dve 12-týždňové, placebom kontrolované štúdie u pacientov s nedostatočne kontrolovaným diabetom 2. typu a hypertenziou.
Štúdia kardiovaskulárnych účinkov liečby (DECLARE) sa uskutočnila s dapagliflozínom 10 mg v porovnaní s placebom u 17 160 pacientov s diabetes mellitus 2. typu s potvrdeným kardiovaskulárnym ochorením alebo bez neho, aby sa vyhodnotil účinok na kardiovaskulárne
a renálne udalosti.
Kontrola glykémie
Monoterapia
Na hodnotenie bezpečnosti a účinnosti monoterapie Forxigy sa u pacientov s nedostatočne
kontrolovaným diabetes mellitus 2. typu vykonala dvojito zaslepená, placebom kontrolovaná štúdia v trvaní 24 týždňov (s pridaním obdobia rozšírenia). Liečba dapagliflozínom jedenkrát denne sa
v porovnaní s placebom prejavila štatisticky významnými (p < 0,0001) poklesmi hodnôt HbA1c
(tabuľka 2).
V období rozšírenej štúdie sa pokles hodnôt HbA1c zachoval až do 102. týždňa (upravená priemerná zmena od východiskových hodnôt -0,61 % pre dapagliflozín 10 mg a -0,17 % pre placebo).

 Tabuľka 2 Výsledky z 24. týždňa (LOCFa) placebom kontrolovanej štúdie dapagliflozínu v monoterapii
Tabuľka 2 Výsledky z 24. týždňa (LOCFa) placebom kontrolovanej štúdie dapagliflozínu v monoterapii
Dapagliflozín
Monoterapia
Placebo
10
mg
N
b
70 75
HbA1
c (%)
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Rozdiel oproti placebuc
(95 % IS)
 Jedinci (%) dosahujúci: HbA1c < 7 %
Jedinci (%) dosahujúci: HbA1c < 7 %8,01
-0,89
-0,66*
(-0,96; -0,36)
7,79
-0,23
Upravený podľa východiskovej
hodnoty
 Telesná hmotnosť (kg)
Telesná hmotnosť (kg)50,8§ 31,6
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Rozdiel oproti placebuc
(95 % IS)
94,13
-3,16
-0,97
(-2,20; 0,25)
88,77
-2,19

aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred podaním záchrannej liečby zachráneným pacientom)
bVšetci zaradení jedinci, ktorí užili aspoň 1 dávku skúšaného lieku v štúdii pri dvojitom zaslepení počas krátkodobého dvojito zaslepeného obdobia
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty
*p-hodnota < 0,0001 oproti placebu
§Nie je hodnotený z hľadiska štatistickej významnosti v dôsledku sekvenčného testovania sekundárnych koncových ukazovateľov
Prídavná kombinovaná liečbaV 52-týždňovej aktívne kontrolovanej non-inferiórnej štúdii (s 52 a 104-týždňovým rozšíreným obdobím) sa hodnotila Forxiga v prídavnej liečbe k metformínu v porovnaní so sulfonylureou (glipizid) v prídavnej liečbe k metformínu u jedincov s nedostatočnou kontrolou glykémie
(HbA1c > 6,5 % a ≤ 10 %). Výsledky v porovnaní s glipizidom preukázali podobný priemerný pokles HbA1c od východiskovej hodnoty do 52. týždňa, čo dokazuje non-inferioritu (tabuľka 3). V 104. týždni bola upravená priemerná zmena od východiskovej hodnoty v HbA1c -0,32 % pre dapagliflozín a -0,14 % pre glipizid. V 208. týždni bola upravená priemerná zmena od východiskovej hodnoty
v HbA1c -0,10 % pre dapagliflozín a 0,20 % pre glipizid. Po 52, 104 a 208 týždňoch zaznamenalo najmenej jednu epizódu hypoglykémie významne menej jedincov v skupine liečenej dapagliflozínom (3,5 %, 4,3 % a 5,0 % v uvedenom poradí) v porovnaní so skupinou liečenou glipizidom (40,8 %,
47 % a 50,0 % v uvedenom poradí). V 104. a 208. týždni bol podiel jedincov, ktorí zostali v štúdii
56,2 % a 39,7 % pre skupinu liečených dapagliflozínom a 50,0 % a 34,6 % pre skupinu liečených glipizidom.
 Ta
b
u
ľ
k
a 3 Výsledky z 52. týždňa (LOCF
a
) aktívne kontrolovanej štúdie porovnávajúcej dapagliflozín s glipizidom v prídavnej liečbe k metformínu
Ta
b
u
ľ
k
a 3 Výsledky z 52. týždňa (LOCF
a
) aktívne kontrolovanej štúdie porovnávajúcej dapagliflozín s glipizidom v prídavnej liečbe k metformínu
Dapagliflozín
Glipizid
 U
k
azovateľ
+
me
t
formín +
me
t
formín
N
U
k
azovateľ
+
me
t
formín +
me
t
formín
Nb 400 401
HbA1c (%)
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Rozdiel v porovnaní s glipizidom + metformínc

(95 % IS)
Telesná hmotnosť (kg) Východiskový stav (priemer) Zmena od východiskového stavuc
Rozdiel oproti glipizid + metformínc
(95 % IS)
7,69
-0,52
0,00d
(-0,11; 0,11)
88,44
-3,22
-4,65*
(-5,14; -4,17)
7,74
-0,52
87,60
1,44

aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii
bRandomizovaní a liečení jedinci, u ktorých sa meranie vykonalo na začiatku a najmenej jedenkrát po
základnom hodnotení účinnosti
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty
dNon-inferiórny s kombináciou glipizid + metformín
*p-hodnota < 0,0001
Dapagliflozín v prídavnej liečbe k metformínu, glimepiridu, metformínu a sulfonylurey, sitagliptínu
(s metformínom alebo bez metformínu) alebo inzulínu v porovnaní s podávaním placeba spôsobil štatisticky významný pokles HbA1c po 24 týždňoch (p < 0,0001; tabuľky 4, 5 a 6).
Pokles HbA1c zaznamenaný v 24. týždni zostal zachovaný v prídavných kombinovaných štúdiách (glimepirid a inzulín) s údajmi zo 48. týždňa (glimepirid) a s údajmi až do 104. týždňa (inzulín). V 48. týždni, keď sa pridal k sitagliptínu (s metformínom alebo bez metformínu) priemerná zmena upravená podľa východiskovej hodnoty pre dapagliflozín 10 mg a placebo bola -0,30 % a 0,38 %, v uvedenom poradí. V prípade prídavnej štúdie k metformínu sa pokles HbA1c zachoval do 102. týždňa (priemerná zmena upravená podľa východiskovej hodnoty -0,78 % pre 10 mg a 0,02 % pre placebo). V 104.
týždni pre inzulín (s alebo bez pridania ďalších perorálnych liekov na zníženie glukózy) bol pokles
HbA1c -0,71 % a -0,06 % upravenej priemernej zmeny od východiskových hodnôt pre dapagliflozín
10 mg a placebo, v uvedenom poradí. Po 48 a 104 týždňoch zostala dávka inzulínu s priemernou dávkou 76 IU/deň stabilná v porovnaní s východiskovou hodnotou u jedincov liečených dapagliflozínom 10 mg. V skupine s placebom došlo k zvýšeniu priemeru 10,5 IU/deň a 18,3 IU/deň od východiskovej hodnoty (stredná priemerná dávka 84 a 92 IU/deň) po 48 a 104 týždňoch,
v uvedenom poradí. V 104. týždni bol podiel jedincov, ktorí zostali v štúdii 72,4 % pre skupinu liečených dapagliflozínom 10 mg a 54,8 % pre skupinu s placebom.
Tabuľk
a 4 Výsledky 24-týždňových (LOCF
a
) placebom kontrolovaných štúdií dapagliflozínu
 v prídavnej kombinovanej liečbe s metformínom alebo sitagliptínom (s metformínom alebo bez metformínu)
v prídavnej kombinovanej liečbe s metformínom alebo sitagliptínom (s metformínom alebo bez metformínu)
 Prídavn
á kombinácia
Metformín
Prídavn
á kombinácia
Metformín1
DPP-4 inhibítor (sitagliptín
(sitagliptín2)
± metformín1
Nb
| Dapagliflozín
10 mg
135
| Placebo
137
| Dapagliflozín
10 mg
223
| Placebo
224
|
HbA1c (%)
|
|
|
|
|
Východisková hodnota
| 7,92
| 8,11
| 7,90
| 7,97
|
(priemer)
|
|
|
|
|
Zmena od východiskovej
| -0,84
| -0,30
| -0,45
| 0,04
|
hodnoty
|
|
|
|
|
Rozdiel oproti placebuc
-0,54*
-0,48*
(95 % IS)
|
(-0,74; -0,34)
|
|
(-0,62; -0,34)
|
|
Jedinc
i (%) dosahujúci:
|
|
|
|
|
HbA1
c < 7 %
|
|
|
|
|
Upravený podľa
|
40,6**
|
25,9
|
|
|
východiskovej hodnoty
|
|
|
|
|
Telesn
á hmotnosť (kg)
|
|
|
|
|
Východisková hodnota
|
86,28
|
87,74
|
91,02
|
89,23
|
(priemer)
|
|
|
|
|
Zmena od východiskovej
|
-2,86
|
-0,89
|
-2,14
|
-0,26
|
hodnoty
|
|
|
|
|
Rozdiel oproti placebuc
|
-1,97*
|
|
-1,89*
|
|
(95 % IS)
|
(-2,63; -1,31)
|
|
(-2,37; -1,40)
|
|
|
|
1Metformín ≥ 1 500 mg/deň
2sitagliptín 100 mg/deň
aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred podaním záchrannej liečby zachráneným pacientom)
bVšetci randomizovaní jedinci, ktorí užili aspoň jednu dávku v dvojito zaslepenej štúdii počas krátkodobého dvojito zaslepeného obdobia
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty
*p-hodnota < 0,0001 oproti placebu + perorálne antidiabetikum
**p-hodnota < 0,05 oproti placebu + perorálne antidiabetikum
 Tabuľk
a 5 Výsledky 24-týždňových placebom kontrolovaných štúdií dapagliflozínu v prídavnej kombinovanej liečbe so sulfonylureou (glimepirid) alebo metformín a sulfonylurea
Prídavn
á kombinácia
Tabuľk
a 5 Výsledky 24-týždňových placebom kontrolovaných štúdií dapagliflozínu v prídavnej kombinovanej liečbe so sulfonylureou (glimepirid) alebo metformín a sulfonylurea
Prídavn
á kombinácia
 Sulfonylurea
(glimepiri
d
Sulfonylurea
(glimepiri
d1
)Sulfonylurea + metformín
+ metformín2
Na
|
Dapagliflozín
10 mg
151
|
Placebo
145
|
Dapagliflozín
10 mg
108
|
Placebo
108
|
HbA1
c (%)b
|
|
|
|
|
Východisková hodnota (priemer)
|
8,07
|
8,15
|
8,08
|
8,24
|
Zmena od východiskovej hodnotyc
|
-0,82
|
-0,13
|
-0,86
|
-0,17
|
Rozdiel oproti placebuc
|
-0,68*
|
|
-0,69*
|
|
(95 % IS)
|
(-0,86; -0,51)
|
|
(-0,89; -0,49)
|
|
Jedinc
i (%) dosahujúci:
|
|
|
|
|
HbA1
c < 7 % (LOCF)
d
|
|
|
|
|
Upravený podľa
|
31,7*
|
13,0
|
31,8*
|
11,1
|
východiskovej hodnoty
|
|
|
|
|
Telesn
á hmotnosť (kg) (LOCF)
d
|
|
|
|
|
Východisková hodnota (priemer)
|
80,56
|
80,94
|
88,57
|
90,07
|
Zmena od východiskovej hodnotyc
|
-2,26
|
-0,72
|
-2,65
|
-0,58
|
Rozdiel oproti placebuc
|
-1,54*
|
|
-2,07*
|
|
(95 % IS)
|
(-2,17; -0,92)
|
|
(-2,79; -1,35)
|
|
|
|
1glimepirid 4 mg/deň
2metformín (formulácie s okamžitým alebo predĺženým uvoľňovaním) ≥ 1500 mg/deň plus maximálne tolerovaná dávka, ktorá musí byť aspoň polovica maximálnej dávky sulfonylurey po dobu najmenej 8 týždňov pred vstupom do štúdie
a Randomizovaní a liečení pacienti s východiskovou hodnotou a najmenej 1 po východiskovej hodnote merania účinnosti.
bStĺpce 1 a 2, HbA1c analyzovaní LOCF (pozri odkaz d); stĺpce 3 a 4, HbA1c analyzovaní LRM (pozri odkaz e)
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty
dLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred podaním záchrannej liečby zachráneným
pacientom)
e LRM: Analýza longitudinálnych opakovaných meraní
*p-hodnota < 0,0001 oproti placebu + perorálne antidiabetiká
 Tabuľka 6 Výsledky z 24. týždňa (LOCFa) placebom kontrolovanej štúdie dapagliflozínu v kombinácii s inzulínom (samotným alebo s perorálnymi antidiabetikami)
Tabuľka 6 Výsledky z 24. týždňa (LOCFa) placebom kontrolovanej štúdie dapagliflozínu v kombinácii s inzulínom (samotným alebo s perorálnymi antidiabetikami)
Dapagliflozín 10 mg
+ inzulín
Placebo
+ inzulín
U
k
azovateľ
±
peroráln
eantidiabetiká
2
±
peroráln
eantidiabetiká
2
 N
Nb 194 193
HbA1c (%)
Východisková hodnota
(priemer)
Zmena od východiskovej hodnotyc
Rozdiel oproti placebuc

(95 % IS)
Telesná hmotnosť (kg) Východisková hodnota (priemer)
Zmena od východiskovej hodnotyc
Rozdiel oproti placebuc

(95 % IS)
Priemerná denná dávka8,58
-0,90
-0,60*
(-0,74; -0,45)
94,63
-1,67
-1,68*
(-2,19; -1,18)
8,46
-0,30
94,21
0,02
inzulín
u
(IU
)
1
Dapagliflozín 10 mg
+ inzulín
Placebo
+ inzulín
 U
k
azovateľ
±
peroráln
eantidiabetiká
2
±
peroráln
eantidiabetiká
2
U
k
azovateľ
±
peroráln
eantidiabetiká
2
±
peroráln
eantidiabetiká
2
Východisková dávka
(priemer)
Zmena od východiskovej dávkyc
Rozdiel oproti placebuc
(95 % IS)
Pacienti s priemerným znížením dennej dávky inzulínu najmenej o 10 % (%)
77,96
-1,16
-6,23*
(-8,84; -3,63)
19,7**
73,96
5,08
11,0

aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred alebo v deň 1. titrácie inzulínu nahor, v prípade potreby)
bVšetci zaradení jedinci, ktorí užili aspoň 1 dávku skúšaného lieku v štúdii pri dvojitom zaslepení počas krátkodobého dvojito zaslepeného obdobia
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty a použitého perorálneho antidiabetika
*p-hodnota < 0,0001 oproti placebo + inzulín ± perorálne antidiabetikum
**p-hodnota < 0,05 oproti placebo + inzulín ± perorálne antidiabetikum
1Titrácia režimov inzulínu nahor (vrátane krátkodobo pôsobiaceho inzulínu, strednodobo pôsobiaceho inzulínu a bazálneho inzulínu) bola povolená iba v prípade, keď jedinci spĺňali stanovené kritéria pre koncentráciu glukózy v plazme nalačno.
2Päťdesiat percent jedincov na začiatku dostávalo inzulín v monoterapii, 50 % užívalo 1 alebo
2 perorálne antidiabetiká pridané k inzulínu: Z tejto druhej skupiny 80 % jedincov užívalo metformín samotný, 12 % bolo liečených metformínom + sulfonylureou a zvyšným jedincom sa podávali iné perorálne antidiabetiká.
V kombinácii s metformínom u pacientov doteraz neliečených liekmiV dvoch aktívne kontrolovaných štúdiách hodnotiacich účinnosť a bezpečnosť dapagliflozínu (5 mg alebo 10 mg) v kombinácii s metformínom trvajúcich 24 týždňov u pacientov doteraz neliečených liekmi v porovnaní s liečbou jednozložkovými liekmi sa zúčastnilo celkovo 1 236 pacientov doteraz neliečených liekmi s nedostatočne kontrolovaným diabetom 2. typu (HbA1c ≥ 7,5 % a ≤ 12 %).
Liečba dapagliflozínom 10 mg v kombinácii s metformínom (až do 2 000 mg denne) poskytla významné zlepšenia HbA1c v porovnaní s jednotlivými zložkami (tabuľka 7) a viedla k väčšiemu zníženiu plazmatickej glukózy nalačno (fasting plasma glucose, FPG) (v porovnaní s jednotlivými zložkami) a telesnej hmotnosti (v porovnaní s metformínom).
 Tabuľka 7 Výsledky v 24. týždni (LOCFa) v aktívne kontrolovanej štúdii dapagliflozínu v kombinácii s metformínom u pacientov doteraz neliečených liekmi
Tabuľka 7 Výsledky v 24. týždni (LOCFa) v aktívne kontrolovanej štúdii dapagliflozínu v kombinácii s metformínom u pacientov doteraz neliečených liekmi
Parameter
Dapagliflozín
10 mg +
Dapagliflozín
10 mg
Metformín
metformín
Nb 211b 219b 208b
 HbA1c (%)
HbA1c (%)
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Odlišnosť od dapagliflozínuc
(95 % IS)
Odlišnosť od metformínuc
(95 % IS)
9,10
-1,98
-0,53*
(-0,74; -0,32)
-0,54*
(-0,75; -0,33)
9,03
-1,45
-0,01
(-0,22; 0,20)
9,03
-1,44

aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred záchranou liečbou u zachránených jedincov).
bVšetci randomizovaní pacienti, ktorí užili minimálne jednu dávku dvojito zaslepeného skúšaného lieku počas krátkodobého dvojito zaslepeného skúšania.
cpriemer najmenších štvorcov upravený na východiskovú hodnotu

*p-hodnota <0,0001
Kombinovaná liečba s exenatidom s predĺženým uvoľňovanímV 28-týždňovej dvojito zaslepenej štúdii kontrolovanej aktívnym komparátorom sa porovnával dapagliflozín v kombinácii s exenatidom s predĺženým uvoľňovaním (agonista receptora GLP-1) so samotným dapagliflozínom a samotným exenatidom s predĺženým uvoľňovaním u osôb
s nedostatočnou glykemickou kontrolou samotným metformínom (HbA1c ≥ 8 % a ≤ 12 %). Vo všetkých liečebných skupinách došlo k zníženiu hodnoty HbA1c oproti východiskovej hodnote.
V liečebnej skupine s kombináciou 10 mg dapagliflozínu a exenatidu s predĺženým uvoľňovaním sa preukázali významnejšie zníženia hodnôt HbA1c oproti východiskovej hodnote v porovnaní so samotným dapagliflozínom a samotným exenatidom s predĺženým uvoľňovaním (tabuľka 8).
Tabuľka 8 Výsledky jednej 28-týždňovej klinickej štúdie s dapagliflozínom a exenatidom s predĺženým uvoľňovaním v porovnaní so samotným dapagliflozínom a samotným exenatidom s predĺženým uvoľňovaním v kombinácii s metformínom (intent to treat patients = zamerané na liečbu pacientov)
s predĺženým uvoľňovaním v porovnaní so samotným dapagliflozínom a samotným exenatidom s predĺženým uvoľňovaním v kombinácii s metformínom (intent to treat patients = zamerané na liečbu pacientov)
Parameter
Dapagliflozí
n 10 mg
QD
+
exenatid
 s predĺženým uvoľňovaním 2 mg QW
Dapagliflozín
10 mg QD
+
p
lacebo QW
Exenatid
s predĺženým uvoľňovaním 2 mg QW
+
p
lacebo QD
s predĺženým uvoľňovaním 2 mg QW
Dapagliflozín
10 mg QD
+
p
lacebo QW
Exenatid
s predĺženým uvoľňovaním 2 mg QW
+
p
lacebo QD
 N 228
230 227
HbA1
c (%)
N 228
230 227
HbA1
c (%)
Východisková hodnota
(priemer) 9,29 9,25 9,26
Zmena oproti východiskovej
hodnotea -1,98 -1,39 -1,60
Priemerný rozdiel v zmene

od východiskovej hodnoty medzi kombináciou a jednotlivým liekom (95 % IS)
Osoby (%), ktoré dosiahli-0,59*
(-0,84; -0,34)
-0,38**
(-0,63; -0,13)
 HbA1
c
HbA1
c <
7 % 44,7 19,1 26,9
Telesná hmotnosť (kg)Východisková hodnota
(priemer) 92,13 90,87 89,12
Zmena oproti východiskovej
hodnotea -3,55 -2,22 -1,56
Priemerný rozdiel v zmene od východiskovej hodnoty
medzi kombináciou a jednotlivým liekom (95 % IS)
-1,33*
(-2,12; -0,55)
-2,00*
(-2,79; -1,20)

QD=jedenkrát denne, QW=jedenkrát týždenne, N=počet pacientov, IS=interval spoľahlivosti.
a Upravené priemery najmenších štvorcov (least squares, LS priemery) a rozdiel(y) liečebnej skupiny v zmene oproti východiskovým hodnotám v 28. týždni sú modelované použitím zmiešaného modelu s opakovanými meraniami (mixed model with repeated measures, MMRM) vrátane liečby, regiónu, východiskovej hodnoty HbA1c stratum (< 9,0 % alebo ≥ 9,0 %), týždňa a týždňa liečby s interakciami ako fixných faktorov
a východiskovej hodnoty ako kovariátu.
*p < 0,001, **p < 0,01.
P-hodnoty sú všetky p-hodnoty upravené pre multiplicitu.
Analýzy nezahŕňajú merania po podaní záchrannej liečby a po predčasnom prerušení podávania skúšaného lieku.
Koncentrácia glukózy v plazme nalačno
Liečba dapagliflozínom 10 mg v monoterapii alebo ako prídavná liečba k metformínu, glimepiridu,
metformínu a sulfonylurey, sitagliptínu (s metformínom alebo bez metformínu) alebo inzulínu sa prejavila štatisticky významným poklesom FPG (-1,90 až -1,20 mmol/l [-34,2 až -21,7 mg/dl]) oproti placebu (-0,33 až 0,21 mmol/l [-6,0 až 3,8 mg/dl]). Tento účinok sa pozoroval v 1. týždni liečby
a v rozšírených štúdiách sa zachoval až do 104. týždňa.
Kombinovaná liečba dapagliflozínom 10 mg a exenatidom s predĺženým uvoľňovaním mala za následok signifikantne väčšie zníženie FPG v 28. týždni: -3,66 mmol/l (-65,8 mg/dl), v porovnaní
s -2,73 mmol/l (-49,2 mg/dl) pre samotný dapagliflozín (p < 0,001) a -2,54 mmol/l (-45,8 mg/dl) pre samotný exenatid (p < 0,001).
V štúdii zameranej na diabetických pacientov s eGFR ≥ 45 až < 60 ml/min/1,73 m2 liečba dapagliflozínom preukázala pokles FPG v 24. týždni: -1,19 mmol/l (-21,46 mg/dl) v porovnaní s 0,27 mmol/l (-4,87 mg/dl) pre placebo (p=0,001).
Glykémia po jedle
Liečba dapagliflozínom 10 mg ako prídavná liečba ku glimepiridu sa prejavila štatisticky významným poklesom glykémie 2 hodiny po jedle po 24 týždňoch, ktorý pretrval až do 48. týždňa.
Liečba dapagliflozínom 10 mg po pridaní ku sitagliptínu (s metformínom alebo bez metformínu) sa prejavila významným poklesom glykémie 2 hodiny po jedle po 24 týždňoch, ktorý pretrval až do 48. týždňa.
Kombinovaná liečba dapagliflozínom 10 mg a exenatidom s predĺženým uvoľňovaním mala za následok signifikantne väčšie zníženie hladiny glukózy 2 hodiny po jedle v 28. týždni v porovnaní s ktorýmkoľvek liekom v monoterapii.
Telesná hmotnosť
Dapagliflozín 10 mg v prídavnej liečbe k metformínu, glimepiridu, metformínu a sulfonylurey, sitagliptínu (s metformínom alebo bez metformínu) alebo inzulínu sa prejavil štatisticky významným poklesom hmotnosti po 24 týždňoch (p < 0,0001, tabuľky 4 a 5). V dlhšie trvajúcich štúdiách boli tieto účinky trvalé. Po 48 týždňoch rozdiel pre dapagliflozín po pridaní ku sitagliptínu
(s metformínom alebo bez metformínu) bol v porovnaní s placebom -2,22 kg. Po 102 týždňoch, rozdiel pre dapagliflozín po pridaní k metformínu v porovnaní s placebom alebo po pridaní k inzulínu bol v porovnaní s placebom -2,14 a -2,88 kg, v uvedenom poradí.
Dapagliflozín mal za následok ako prídavná liečba k metformínu v aktívne kontrolovanej
non-inferiorálnej štúdii štatisticky významné zníženie telesnej hmotnosti v porovnaní s glipizidom po
52 týždňoch -4,65 kg (p < 0,0001, tabuľka 3), ktoré bolo trvalé po 104 a 208 týždňoch (-5,06 kg a -4,38 kg v uvedenom poradí).
Dapagliflozín 10 mg v kombinácii s exenatidom s predĺženým uvoľňovaním preukázal signifikantne väčší pokles telesnej hmotnosti v porovnaní s ktorýmkoľvek liekom v monoterapii (tabuľka 8).
Na hodnotenie podielu aktívnej telesnej hmoty sa použila počas 24 týždňovej štúdie
u 182 diabetických pacientov duálna RTG absorpciometria (DXA), ktorá dokázala pre dapagliflozín
10 mg plus metformín v porovnaní s placebom plus metformínom zníženie telesnej hmotnosti
a množstva telesného tuku na základe merania pomocou DXA skôr, než straty beztukového tkaniva
a tekutín. Liečba s Forxigou a metformínom v porovnaní s liečbou s placebom a metformínom ukázala numerický pokles viscerálneho adipózneho tkaniva v podštúdii so zobrazovaním magnetickou rezonanciou.
Krvný tlak
Vo vopred špecifikovanej súhrnnej analýze 13 placebom kontrolovaných štúdií, v 24. týždni bola zaznamenaná zmena krvného tlaku oproti východiskovej hodnote pri liečbe dapagliflozínom 10 mg:
systolického -3,7 mmHg a diastolického -1,8 mmHg v porovnaní so zmenou krvného tlaku oproti východiskovej hodnote v skupine s placebom: systolického -0,5 mmHg a diastolického -0,5 mmHg. Rovnaké poklesy sa pozorovali až do 104. týždňa.
Kombinovaná liečba dapagliflozínom 10 mg a exenatidom s predĺženým uvoľňovaním mala za následok signifikantne väčšie zníženie systolického krvného tlaku v 28. týždni (-4,3 mmHg) v porovnaní so samotným dapagliflozínom (-1,8 mmHg, p < 0,05) a samotným exenatidom
s predĺženým uvoľňovaním (-1,2 mmHg, p < 0,01).
V dvoch 12-týždňových, placebom kontrolovaných štúdiách bolo liečených dapagliflozínom 10 mg alebo placebom celkovo 1 062 pacientov s nedostatočne kontrolovaným diabetom 2. typu
a hypertenziou (aj napriek predchádzajúcej stabilnej liečbe ACE-I alebo ARB v jednej štúdii a ACE-I alebo ARB plus jedno ďalšie antihypertenzívum v druhej štúdii). V 12. týždni u oboch štúdií dapagliflozín v dávke 10 mg spolu so zvyčajným antidiabetikom vyvolali zlepšenie HbA1c a znížili placebom korigovaný systolický krvný tlak v priemere o 3,1 a 4,3 mmHg, v uvedenom poradí.
V štúdii zameranej na diabetických pacientov s eGFR ≥ 45 až < 60 ml/min/1,73 m2 liečba dapagliflozínom preukázala pokles systolického krvného tlaku v sede v 24. týždni: -4,8 mmHg v porovnaní s -1,7 mmHg pre placebo (p < 0,05).
Kontrola glykémie u pacientov so stredne závažnou poruchou funkcie obličiek CKD 3A(eGFR ≥ 45 až < 60 ml/min/1,73 m2)Účinnosť dapagliflozínu sa hodnotila v štúdii zameranej na diabetických pacientov s eGFR ≥ 45 až
< 60 ml/min/1,73 m2 s neadekvátnou glykemickou kontrolou pri zvyčajnej liečbe. Liečba dapagliflozínom viedla k zníženiu HbA1c a telesnej hmotnosti v porovnaní s placebom (tabuľka 9).
 Tabuľka 9 Výsledky placebom kontrolovanej štúdie s dapagliflozínom v 24. týždni u diabetických pacientov s eGFR ≥ 45 až < 60 ml/min/1,73 m2
Tabuľka 9 Výsledky placebom kontrolovanej štúdie s dapagliflozínom v 24. týždni u diabetických pacientov s eGFR ≥ 45 až < 60 ml/min/1,73 m2
Dapagliflozína
Placeboa
10
mg
N
b
159 161
HbA1c (%)
Východisková hodnota (priemer) 8,35 8,03
Zmena oproti východiskovej hodnoteb -0,37 -0,03
Rozdiel oproti placebub

(95 % IS)
Telesná hmotnosť (kg)-0,34*
(-0,53, -0,15)
Východisková hodnota (priemer) 92,51 88,30
Percentuálna zmena oproti východiskovej hodnotec
Rozdiel v percentuálnej zmene oproti placebuc
-3,42 -2,02
-1,43*
(95
% IS) (-2,15, -0,69)
a Metformín alebo metformíniumchlorid boli súčasťou bežnej liečby u 69,4 % pacientov s dapagliflozínom a u 64,0 % s placebom.
b Priemer najmenších štvorcov upravený na východiskovú hodnotu
c Odvodené od priemeru najmenších štvorcov upraveného na východiskovú hodnotu
* p<0,001
Pacienti s východiskovou hodnotou HbA1c ≥ 9 %
Vo vopred špecifikovanej analýze jedincov s východiskovou hodnotou HbA1c ≥ 9,0 % sa pri liečbe dapagliflozínom 10 mg v 24. týždni zaznamenalo štatisticky významné zníženie HbA1c v monoterapii (upravená priemerná zmena od východiskovej hodnoty: -2,04 % a 0,19 % pre dapagliflozín 10 mg
a placebo, v uvedenom poradí) a v prídavnej liečbe k metformínu (upravená priemerná zmena od východiskovej hodnoty: -1,32 % a -0,53 % pre dapagliflozín a placebo, v uvedenom poradí).
Kardiovaskulárne a renálne účinky liečby
Štúdia DECLARE (Dapagliflozin Effect on Cardiovascular Events) bola medzinárodná, multicentrická, randomizovaná, dvojito zaslepená, placebom kontrolovaná klinická štúdia navrhnutá na zistenie účinku dapagliflozínu v porovnaní s placebom na kardiovaskulárne udalosti po pridaní
k aktuálnej liečbe. Všetci pacienti mali diabetes mellitus 2. typu a minimálne dva ďalšie kardiovaskulárne rizikové faktory (vek ≥ 55 rokov u mužov, alebo ≥ 60 rokov u žien a jeden alebo viac z nasledujúcich: dyslipidémia, hypertenzia alebo fajčenie v súčasnosti) alebo potvrdené kardiovaskulárne ochorenie.
6 974 (40,6 %) zo 17 160 randomizovaných pacientov malo potvrdené kardiovaskulárne ochorenie a 10 186 (59,4 %) nemalo potvrdené kardiovaskulárne ochorenie, 8 582 pacientov bolo randomizovaných na dapagliflozín 10 mg a 8 578 na placebo s mediánom sledovania 4,2 rokov.
Priemerný vek populácie v štúdii bol 63,9 rokov, 37,4 % boli ženy. Celkovo 22,4 % malo diabetes ≤ 5
rokov, priemerná dĺžka trvania diabetu bola 11,9 rokov. Priemerná hodnota HbA1c bola 8,3 %
a priemerný BMI bol 32,1 kg/m2.
Na začiatku malo 10,0 % pacientov srdcové zlyhávanie v anamnéze. Priemerná eGFR bola
85,2 ml/min/1,73 m2, 7,4 % pacientov malo eGFR < 60 ml/min/1,73 m2, a 30,3 % pacientov malo mikro- alebo makroalbuminúriu (pomer albumín v moči/kreatinín v moči (urine albumin to creatinine
ratio [UACR]) ≥ 30 až ≤ 300 mg/g alebo > 300 mg/g, v uvedenom poradí).
Väčšina pacientov (98 %) na začiatku užívala jedno alebo viac antidiabetík, vrátane metformínu
(82 %), inzulínu (41 %) a sulfonylurey (43 %).
Primárnymi ukazovateľmi boli čas do prvého výskytu príhody zloženej zo smrti z kardiovaskulárnych príčin, infarktu myokardu alebo ischemickej cievnej mozgovej príhody (MACE) a čas do prvého výskytu príhody zloženej z hospitalizácie z dôvodu srdcového zlyhávania alebo smrti
z kardiovaskulárnych príčin. Sekundárne ukazovatele boli združený ukazovateľ funkcie obličiek a úmrtnosť zo všetkých príčin.
Významné kardiovaskulárne udalosti
Dapagliflozín 10 mg v porovnaní s placebom preukázal non-inferioritu pre ukazovateľ zložený
zo smrti z kardiovaskulárnych príčin, infarktu myokardu alebo ischemickej cievnej mozgovej príhody
(jednostranná p-hodnota < 0,001).
Srdcové zlyhávanie alebo smrť z kardiovaskulárnych príčin
Dapagliflozín 10 mg v porovnaní s placebom preukázal superioritu v prevencii ukazovateľa zloženého z hospitalizácie z dôvodu srdcového zlyhávania alebo smrti z kardiovaskulárnych príčin (obrázok 1). Rozdiel v liečebnom účinku bol ovplyvnený hospitalizáciou z dôvodu srdcového zlyhávania a žiaden rozdiel sa nepozoroval pri smrti z kardiovaskulárnych príčin (obrázok 2).
Prevaha prínosu liečby dapagliflozínom v porovnaní s placebom sa pozorovala u pacientov
s potvrdeným kardiovaskulárnym ochorením aj u pacientov bez neho, u pacientov so srdcovým
zlyhávaním aj u pacientov bez neho na začiatku liečby a bol konzistentný vo všetkých podskupinách zahŕňajúcich vek, pohlavie, funkciu obličiek (eGFR) a región.
Obrázok 1 Čas do prvého výskytu hospitalizácie z dôvodu srdcového zlyhávania alebo smrti z kardiovaskulárnych príčin
Pacienti v riziku je počet pacientov v riziku na začiatku obdobia. HR=Pomer rizika, IS=Interval spoľahlivosti.
Výsledky primárnych a sekundárnych ukazovateľov sú zobrazené na obrázku 2. Lepší účinok dapagliflozínu v porovnaní s placebom nebol preukázaný pre MACE (p=0,172). Združený ukazovateľ renálnych funkcií a úmrtnosti zo všetkých príčin preto nebol súčasťou testovania na potvrdenie výsledkov.
Obrázok 2 Účinky liečby na primárne združené ukazovatele a ich komponenty a na sekundárne ukazovatele a komponenty
Združený ukazovateľ renálnych funkcií definovaný ako: potvrdený pokles eGFR ≥ 40 % na eGFR < 60 ml/min/1,73 m2
a/alebo ochorenie obličiek v terminálnom štádiu (dialýza ≥ 90 dní alebo transplantácia obličky, potvrdené pretrvávanie eGFR
< 15 ml/min/1,73 m2) a/alebo smrť z renálnych alebo kardiovaskulárnych príčin.
p-hodnoty sú dvojstranné. p-hodnoty pre sekundárny ukazovateľ a pre jednotlivé komponenty sú nominálne. Čas do prvej udalosti bol analyzovaný použitím Coxovho modelu proporcionálneho rizika. Počet prvých udalostí pre jednotlivé
komponenty sú aktuálne počty prvých udalostí každého komponentu a nezohľadňuje počet udalostí v združenom ukazovateli.
IS=interval spoľahlivosti.
NefropatiaDapagliflozín znížil výskyt udalostí ukazovateľa zloženého z potvrdeného pretrvávajúceho zníženia eGFR, ochorenia obličiek v terminálnom štádiu, smrti z renálnych alebo kardiovaskulárnych príčin. Rozdiel medzi skupinami bol ovplyvnený znížením v počte udalostí jednotlivých renálnych komponentov; pretrvávajúce zníženie eGFR, ochorenie obličiek v terminálnom štádiu a smrť
z renálnych príčin (obrázok 2).
Pomer rizika (hazard ratio, HR) pre čas do nefropatie (pretrvávajúce zníženie eGFR, ochorenie obličiek v terminálnom štádiu a smrť z renálnych príčin) bol 0,53 (95 % IS 0,43; 0,66) pre dapagliflozín oproti placebu.
Dapagliflozín okrem toho znížil aj nový nástup pretrvávajúcej albuminúrie (HR 0,79 [95 % IS 0,72;
0,87]) a viedol k väčšej regresii makroalbuminúrie (HR 1,82 [95 % IS 1,51; 2,20]) v porovnaní s placebom.
Srdcové zlyhávanieŠtúdia DAPA-HF (Dapagliflozin And Prevention of Adverse outcomes in Heart Failure) bola
medzinárodná, multicentrická, randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia u pacientov so srdcovým zlyhávaním (funkčná trieda II-IV podľa NYHA klasifikácie [New York Heart Association]) so zníženou ejekčnou frakciou (ejekčná frakcia ľavej komory [left ventricular ejection fraction, LVEF] ≤ 40 %) navrhnutá na stanovenie účinku dapagliflozínu v porovnaní
s placebom, po pridaní k základnej štandardnej liečbe, na výskyt smrti z kardiovaskulárnych príčin a zhoršenia srdcového zlyhávania.
2 373 zo 4 744 pacientov bolo randomizovaných do skupiny s 10 mg dapagliflozínu a 2 371 do skupiny s placebom a boli sledovaní počas mediánu 18 mesiacov. Priemerný vek populácie štúdie bol
66 rokov, 77 % bolo mužov.
Na začiatku štúdie malo 67,5 % pacientov srdcové zlyhávanie triedy NYHA II, 31,6 % triedy NYHA III a 0,9 % triedy NYHA IV, medián LVEF bol 32 %. 56 % prípadov srdcového zlyhávania bolo ischemických, 36 % bolo neischemických a 8 % bolo neznámej etiológie. V každej liečebnej skupine malo 42 % pacientov anamnézu diabetes mellitus 2. typu a ďalšie 3 % pacientov v každej skupine boli klasifikované ako pacienti s diabetes mellitus 2. typu na základe HbA1c ≥ 6,5 % pri vstupe do štúdie
aj pri randomizácii. Pacienti sa liečili štandardnou liečbou; 94 % pacientov bolo liečených ACE-I,
ARB alebo kombináciou inhibítora receptorov pre angiotenzín a inhibítora neprilyzínu (angiotensin receptor-neprilysin inhibitor, ARNI; 11 %), 96 % betablokátorom, 71 % antagonistom mineralokortikoidných receptorov (mineralocorticoid receptor antagonist, MRA), 93 % diuretikom a 26 % malo implantovateľné zariadenie.
Do štúdie boli zahrnutí pacienti s eGFR ≥ 30 ml/min/1,73 m2 pri vstupe do štúdie. Priemerná eGFR
bola 66 ml/min/1,73 m2, 41 % pacientov malo eGFR < 60 ml/min/1,73 m2 a 15 % malo
eGFR < 45 ml/min/1,73 m2.
Smrťz kardiovaskulárnych príčin a zhoršenie srdcového zlyhávania
Dapagliflozín v porovnaní s placebom preukázal superioritu v prevencii primárneho združeného ukazovateľa smrti z kardiovaskulárnych príčin, hospitalizácie pre srdcové zlyhávanie alebo urgentnej návštevy lekára pre srdcové zlyhávanie (HR 0,74 [95 % IS: 0,65; 0,85], p < 0,0001). Účinok bol pozorovaný včasne a pretrvával počas celého trvania štúdie (obrázok 3).
 Obrázok 3 Čas do prvého výskytu združeného ukazovateľa smrti z kardiovaskulárnych príčin, hospitalizácie pre srdcové zlyhávanie alebo urgentnej návštevy lekára pre srdcové zlyhávanie
Obrázok 3 Čas do prvého výskytu združeného ukazovateľa smrti z kardiovaskulárnych príčin, hospitalizácie pre srdcové zlyhávanie alebo urgentnej návštevy lekára pre srdcové zlyhávanie
Urgentná návšteva lekára pre srdcové zlyhávanie bola definovaná ako bezodkladné, neplánované lekárske vyšetrenie, napr.
na pohotovosti a potreba liečby zhoršenia srdcového zlyhávania (inej ako iba zvýšenie dávky perorálnych diuretík). Pacienti v riziku predstavujú počet pacientov v riziku na začiatku obdobia.
Všetky tri komponenty primárneho združeného ukazovateľa individuálne prispeli k účinku liečby
(obrázok 4). Vyskytlo sa niekoľko urgentných návštev lekára pre srdcové zlyhávanie.
Obrázok 4 Účinky liečby na primárny združený ukazovateľ, jeho komponenty a na úmrtnosť zo všetkých príčin
Charakteristiky
HR (95 % IS)
Osoby s výskytom udalosti
(miera udalosti)
Pomer rizika
(95 % IS)
p-hodnota
Združený ukazovateľ kardiovaskulárnej smrti, hospitalizácie pre srdcové zlyhávanie alebo urgentnej návštevy lekára
pre srdcové zlyhávanie
Dapagliflozín
(N = 2 373)

386 (11,6)
Placebo
(N = 2 371)
502 (15,6)
0,74 (0,65; 0,85)
< 0,0001
Hospitalizácie
pre srdcové zlyhávanie
231 (6,9)
318 (9,8)
0,70 (0,59; 0,83)
< 0,0001
Urgentná návšteva lekára
pre srdcové zlyhávanie
10 (0,3)
23 (0,7)
0,43 (0,20; 0,90)
0,0213
Kardiovaskulárna smrť
227 (6,5)
273 (7,9)
0,82 (0,69; 0,98)
0,0294
Úmrtnosť zo všetkých príčin
276 (7,9)
329 (9,5)
0,83 (0,71; 0,97)
0,0217
0,5 0,8 1 1,25 2
V prospech dapagliflozínu |
V prospech placeba
Urgentná návšteva lekára pre srdcové zlyhávanie bola definovaná ako bezodkladné, neplánované lekárske vyšetrenie, napr.
na pohotovosti a potreba liečby zhoršenia srdcového zlyhávania (inej ako iba zvýšenie dávky perorálnych diuretík).
Počet prvých udalostí pre jednotlivé komponenty je skutočný počet prvých udalostí pre každý komponent a nezapočítava sa do počtu udalostí v združenom ukazovateli.
Miery udalostí sú uvedené ako počet osôb s výskytom udalosti na 100 pacientorokov sledovania. p-hodnoty pre jednotlivé komponenty a úmrtnosť zo všetkých príčin sú nominálne.
Dapagliflozín tiež znížil celkový počet hospitalizácií pre srdcové zlyhávanie (prvej a opakujúcich sa) a smrti z kardiovaskulárnych príčin; v skupine s dapagliflozínom bolo 567 udalostí oproti 742 udalostiam v skupine s placebom (pomer miery výskytu udalostí [Rate Ratio] 0,75 [95 % IS: 0,65;
0,88], p = 0,0002).
Prínos liečby dapagliflozínom sa pozoroval u pacientov so srdcovým zlyhávaním s prítomným diabetes mellitus 2. typu alebo bez neho. Dapagliflozín znížil primárny združený ukazovateľ výskytu smrti z kardiovaskulárnych príčin a zhoršenia srdcového zlyhávania s HR 0,75 (95 % IS: 0,63; 0,90) u pacientov s diabetom a s HR 0,73 (95 % IS: 0,60; 0,88) u pacientov bez diabetu.
Prínos liečby dapagliflozínom oproti placebu na primárny ukazovateľ bol tiež konzistentný naprieč ďalšími kľúčovými podskupinami zahŕňajúcimi súbežnú liečbu srdcového zlyhávania, funkciu obličiek (eGFR), vek, pohlavie a región.
Výsledky hlásené pacientmi – príznaky srdcového zlyhávania
Účinok liečby dapagliflozínom na príznaky srdcového zlyhávania sa hodnotil pomocou celkového skóre príznakov dotazníka KCCQ-TSS (Total Symptom Score of the Kansas City Cardiomyopathy Questionnaire), ktorý kvantifikuje frekvenciu a závažnosť príznakov srdcového zlyhávania zahŕňajúcich únavu, periférny edém, dyspnoe a ortopnoe. Skóre sa pohybuje od 0 do 100, pričom vyššie skóre predstavuje lepší zdravotný stav.
Liečba dapagliflozínom viedla k štatisticky významnému a klinicky významnému prínosu týkajúcemu sa príznakov srdcového zlyhávania oproti placebu na základe stanovenia zmeny KCCQ-TSS v 8. mesiaci oproti východiskovej hodnote (pomer výhier [Win Ratio] 1,18 [95 % IS: 1,11; 1,26],
p < 0,0001). K výsledkom prispela frekvencia príznaku aj záťaž spôsobená príznakom. Prínos sa pozoroval v zlepšení príznakov srdcového zlyhávania aj v prevencii zhoršenia príznakov srdcového zlyhávania.
V analýze respondentov bol podiel pacientov s klinicky významným zlepšením skóre KCCQ-TSS v 8. mesiaci oproti východiskovej hodnote, definovaným ako zlepšenie o 5 bodov alebo viac, vyšší
v liečebnej skupine s dapagliflozínom v porovnaní s placebom. Podiel pacientov s klinicky významným zhoršením, definovaným ako zhoršenie o 5 bodov alebo viac, bol nižší v liečebnej skupine s dapagliflozínom v porovnaní s placebom. Prínosy pozorované pri dapagliflozíne pretrvali aj
pri uplatnení konzervatívnejších limitov pre väčšiu klinicky významnú zmenu (tabuľka 10).
 Tabuľka 10 Počet a percentuálny podiel pacientov s klinicky významným zlepšením a zhoršením skóre KCCQ-TSS v 8. mesiaci
Tabuľka 10 Počet a percentuálny podiel pacientov s klinicky významným zlepšením a zhoršením skóre KCCQ-TSS v 8. mesiaci
 Zmen
a v 8. mesiaci oproti východiskovej hodnote:
Dapagliflozín
10 mg n
a
=
2 086
Placebo
n
a
=
2 062
Zmen
a v 8. mesiaci oproti východiskovej hodnote:
Dapagliflozín
10 mg n
a
=
2 086
Placebo
n
a
=
2 062
 Zlepšeni
e
n (%) so zlepšením
b
n (%) so zlepšením
b
M
iera
pravdepodobnosti
c
(9
5 % IS)
p
-
h
o
dnot
a
f
Zlepšeni
e
n (%) so zlepšením
b
n (%) so zlepšením
b
M
iera
pravdepodobnosti
c
(9
5 % IS)
p
-
h
o
dnot
a
f
≥ 5 bodov 933 (44,7) 794 (38,5) 1,14 (1,06; 1,22)
≥ 10 bodov 689 (33,0) 579 (28,1) 1,13 (1,05; 1,22)

≥ 15 bodov 474 (22,7) 406 (19,7) 1,10 (1,01; 1,19)
0,0002
0,0018
0,0300
 Zhoršeni
e
n (%) so zhoršením
d
n (%) so zhoršením
d
M
iera
pravdepodobnosti
e
(9
5 % IS)
p
-
h
o
dnot
a
f
Zhoršeni
e
n (%) so zhoršením
d
n (%) so zhoršením
d
M
iera
pravdepodobnosti
e
(9
5 % IS)
p
-
h
o
dnot
a
f
≥ 5 bodov 537 (25,7) 693 (33,6) 0,84 (0,78; 0,89)

≥ 10 bodov 395 (18,9) 506 (24,5) 0,85 (0,79; 0,92)
a Počet pacientov so sledovaným skóre KCCQ-TSS alebo pacientov, ktorí umreli pred 8. mesiacom.
< 0,0001
< 0,0001
b Počet pacientov s pozorovaným zlepšením oproti východiskovej hodnote minimálne o 5, 10 alebo 15 bodov. Pacienti, ktorí umreli pred daným časovým bodom, sa započítavajú ako pacienti bez zlepšenia.
c Pre zlepšenie je miera pravdepodobnosti > 1 v prospech dapagliflozínu v dávke 10 mg.
d Počet pacientov s pozorovaným zhoršením oproti východiskovej hodnote minimálne o 5 alebo 10 bodov. Pacienti, ktorí umreli pred daným časovým bodom, sa započítavajú ako pacienti so zhoršením.
e Pre zhoršenie je miera pravdepodobnosti < 1 v prospech dapagliflozínu v dávke 10 mg.
f p-hodnoty sú nominálne.
Nefropatia
Vyskytlo sa niekoľko udalostí renálneho združeného ukazovateľa (potvrdené trvalé ≥ 50 % zníženie eGFR, ESRD alebo smrť z renálnych príčin); výskyt bol 1,2 % v skupine s dapagliflozínom a 1,6 % v skupine s placebom.
Pediatrická
populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s dapagliflozínom
v jednej alebo vo viacerých podskupinách pediatrickej populácie v liečbe diabetes mellitus 2. typu a diabetes mellitus 1. typu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s dapagliflozínom vo všetkých podskupinách pediatrickej populácie v prevencii kardiovaskulárnych udalostí u pacientov s chronickým srdcovým zlyhávaním (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Dapagliflozín sa rýchlo a dobre absorboval po perorálnom podaní. Maximálne koncentrácie
dapagliflozínu v plazme (Cmax) sa zvyčajne dosiahli do 2 hodín od podania nalačno. Geometrický priemer hodnôt Cmax a AUCτ dapagliflozínu v rovnovážnom stave po podávaní jednej 10 mg dávky denne bol 158 ng/ml a 628 ng h/ml v uvedenom poradí. Absolútna biologická dostupnosť dapagliflozínu po podaní dávky 10 mg je 78 %. Pri podaní s jedlom s vysokým obsahom tuku
v porovnaní s podaním nalačno sa Cmax dapagliflozínu znížilo do 50 % a Tmax predĺžilo približne o 1 hodinu, ale nezmenilo sa AUC. Tieto zmeny sa nepovažujú za klinicky významné. Preto sa
Forxiga môže podávať s jedlom alebo bez jedla.
Distribúcia
Dapagliflozín sa približne v 91 % viaže na bielkoviny. Väzba na bielkoviny ostala pri rôznych
chorobných stavoch nezmenená (napr. pri poruche funkcie obličiek alebo pečene). Priemerný
distribučný objem dapagliflozínu v rovnovážnom stave bol 118 litrov.
Biotransformácia
Dapagliflozín sa značne metabolizuje, hlavne za vzniku dapagliflozín 3-O-glukuronidu, ktorý je
inaktívnym metabolitom. Dapagliflozín 3-O-glukuronid alebo ďalšie metabolity sa nepodieľajú na
účinkoch znižujúcich hladinu glukózy. Tvorba dapagliflozín 3-O-glukuronidu je sprostredkovaná UGT1A9, enzýmom, ktorý sa nachádza v pečeni a v obličkách a metabolizácia sprostredkovaná CYP bola u ľudí nepodstatnou časťou klírensu.
Eliminácia
Po podaní jednej perorálnej dávky dapagliflozínu 10 mg zdravým jedincom bol priemerný terminálny
polčas dapagliflozínu v plazme (t1/2) 12,9 hodín. Priemerný celkový systémový klírens dapagliflozínu podaného intravenózne bol 207 ml/min. Dapagliflozín a súvisiace metabolity sa eliminujú hlavne vylučovaným močom, s menej ako 2 % nezmeneného dapagliflozínu. Po podaní 50 mg dávky
[14C]-dapagliflozínu sa vylúčilo 96 %, 75 % v moči a 21 % v stolici. V stolici sa približne 15 % dávky
vylúčilo v nezmenenej forme.
Linearita
Expozícia dapagliflozínu sa zvyšovala úmerne so zvyšujúcou sa dávkou v rozmedzí 0,1 až 500 mg
a jeho farmakokinetika sa nezmenila s časom pri opakovanom dennom podávaní až 24 týždňov.
Osobitné skupiny pacientov
Porucha funkcie obličiek
V rovnovážnom stave (20 mg dapagliflozínu jedenkrát denne počas 7 dní) bola priemerná systémová expozícia dapagliflozínu u pacientov s diabetes mellitus 2. typu a miernou, stredne závažnou alebo závažnou poruchou funkcie obličiek (určené meraním plazmatického klírens iohexolu) o 32 %, 60 %
a 87 % vyššia ako u pacientov s diabetes mellitus 2. typu s normálnou funkciou obličiek. 24-hodinové vylučovanie glukózy močom v rovnovážnom stave značne záviselo od funkcie obličiek a u jedincov
s diabetes mellitus 2. typu s normálnou funkciou obličiek sa vylúčilo 85 g glukózy/deň, u jedincov
s miernou poruchou funkcie obličiek 52 g/deň, so stredne závažnou poruchou funkcie obličiek
18 g/deň a so závažnou poruchou funkcie obličiek 11 g/deň. Vplyv hemodialýzy na expozíciu dapagliflozínu nie je známy.
Poruchafunkciepečene
U jedincov s miernou alebo stredne závažnou poruchou funkcie pečene (Childova-Pughova trieda A a B) boli priemerné hodnoty dapagliflozínu Cmax o 12 % a AUC o 36 % vyššie ako u zdravých jedincov spárovaných kontrol. Tieto rozdiely sa nepovažujú za klinicky významné. U jedincov
so závažnou poruchou funkcie pečene (Childova-Pughova trieda C) boli priemerné hodnoty dapagliflozínu Cmax o 40 % a AUC o 67 % vyššie ako u zdravých jedincov spárovaných kontrol.
Starší pacienti (≥ 65 rokov)
Zvýšenie expozície v závislosti od veku nie je klinicky významné u jedincov do 70 rokov. Zvýšenú expozíciu je však možné očakávať kvôli zníženej funkcii obličiek súvisiacej s vekom. Nie sú k dispozícii dostatočné údaje na vytvorenie záverov o expozícii u pacientov vo veku > 70 rokov.
Pediatrická populácia
Farmakokinetika sa u detí a dospievajúcich nesledovala.
Pohlavie
Priemerná AUCss dapagliflozínu u žien bola odhadom približne o 22 % vyššia ako u mužov.
Rasová príslušnosť
V systémovej expozícii medzi belochmi, černochmi a aziatmi nie sú klinicky významné rozdiely.
Telesná hmotnosť
Zistilo sa, že expozícia dapagliflozínu sa znižuje so zvyšujúcou hmotnosťou. Preto pacienti s nízkou
hmotnosťou môžu mať o trocha vyššiu expozíciu a pacienti s vyššou hmotnosťou o trochu nižšiu expozíciu. Rozdiely v expozícii sa však nepovažujú za klinicky významné.
5.3 Predklinické údaje o bezpečnosti
Neklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a fertility neodhalili žiadne osobitné riziko pre ľudí. Dapagliflozín nevyvolal nádory ani u myší ani u potkanov pri žiadnej z dávok hodnotených v rámci dvojročných štúdií karcinogenity.
Reprodukčná a vývojová toxicita
Priame podávanie dapagliflozínu dojčeným mláďatám potkanov a nepriama expozícia v pokročilej
brezivosti (v období zodpovedajúcom druhému a tretiemu trimestru gravidity vzhľadom na
dozrievanie obličiek u ľudí) a dojčenia sú spojené so zvýšeným výskytom a/alebo závažnosťou dilatácie obličkovej panvičky a dilatácie tubulov u potomstva.
V štúdii juvenilnej toxicity, v ktorej sa dapagliflozín podával priamo mladým potkanom od 21. do 90. dňa po narodení, sa zaznamenala dilatácia obličkovej panvičky a tubulov pri všetkých hladinách dávok, expozície mláďat pri najnižšej testovanej dávke boli ≥ 15-násobkom maximálnej odporúčanej dávky u ľudí. Tieto zistenia súviseli so zvýšením hmotnosti obličiek závislým od dávky
a s makroskopickým zväčšením obličiek pozorovaným pri všetkých dávkach. Dilatácia obličkovej panvičky a tubulov pozorovaná u mláďat v priebehu približne 1 mesiaca zotavovania sa nezvrátila úplne.
V separátnej štúdii prenatálneho a postnatálneho vývoja sa dapagliflozín podával brezivým samiciam potkanov od gestačného dňa 6 po postnatálny deň 21 a mláďatá boli lieku nepriamo vystavené in
utero a počas dojčenia. (Vykonala sa satelitná štúdia na stanovenie expozície dapagliflozínu v mlieku a u mláďat). Zistil sa zvýšený výskyt alebo závažnosť dilatácie obličkovej panvičky u dospelých potomkov liečených samíc, hoci iba pri najvyšších testovaných dávkach (expozície pre samice-matky predstavovali 1 415-násobok maximálnej odporúčanej dávky u ľudí a pre mláďatá 137-násobok maximálnej odporúčanej dávky u ľudí). Ďalšia vývojová toxicita bola obmedzená na zníženie telesnej hmotnosti mláďat v závislosti od dávky a pozorovala sa iba pri dávkach ≥ 15 mg/kg/deň (expozícia mláďat ≥ 29-násobne vyššia ako hodnoty u ľudí pri maximálnych odporúčaných dávkach). Toxicita pre brezivé samice bola zrejmá iba pri najvyšších testovaných dávkach a bola obmedzená na prechodné zníženie telesnej hmotnosti a spotrebu potravy pri danej dávke. Hladina, pri ktorej nebol
pozorovaný žiadny nežiaduci účinok (NOAEL) na vývojovú toxicitu, najnižšia testovaná dávka, súvisí
so systémovou expozíciou brezivých samíc mnohonásobnej dávke, ktorá je približne 19-násobkom hodnoty u ľudí pri maximálnej odporúčanej dávke.
V ďalších štúdiách zameraných na embryofetálny vývin potkanov a králikov sa dapagliflozín podával v obdobiach predstavujúcich hlavné obdobia organogenézy u každého z druhov. Pri žiadnej testovanej dávke sa nezistila toxicita pre brezivé samice králikov ani toxicita ovplyvňujúca vývin králikov; najvyššia testovaná dávka súvisí so systémovou expozíciou pri približne 1 191-násobku maximálnej odporúčanej dávky u ľudí. U potkanov dapagliflozín nevykazoval ani embryoletálny ani teratogénny účinok pri expozícii do 1 441-násobku maximálnej odporúčanej dávky u ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
celulóza, mikrokryštalická (E460i)
laktóza
krospovidón (E1202)
oxid kremičitý (E551)
stearát horečnatý (E470b)
Filmový obal
polyvinylalkohol (E1203)
oxid titaničitý (E171)
makrogol 3350
mastenec (E553b)
žltý oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Alu/Alu blister
Balenia po 10 filmom obalených tabliet v neperforovaných blistroch.
Balenia po 14, 28 a 98 filmom obalených tabliet v neperforovaných kalendárnych blistroch. Balenia po 30x1 a 90x1 filmom obalených tabliet v perforovaných blistroch s jednotlivou dávkou.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAstraZeneca AB
SE-151 85 Södertälje
Švédsko
8. REGISTRAČNÉ ČÍSLAEU/1/12/795/006 14 filmom obalených tabliet EU/1/12/795/007 28 filmom obalených tabliet EU/1/12/795/008 98 filmom obalených tabliet
EU/1/12/795/009 30x1 (jednotlivá dávka) filmom obalených tabliet EU/1/12/795/010 90x1 (jednotlivá dávka) filmom obalených tabliet EU/1/12/795/011 10 filmom obalených tabliet
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 12. novembra 2012
Dátum posledného predĺženia registrácie: 28. augusta 2017
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu