u:
Obsah 1 inhalačnej kapsuly (12 mg) sa vdychuje 15 minút pred očakávanou aktivitou alebo vystavením sa alergénu. U dospelých pacientov so závažnou astmou môžu byť potrebné 2 kapsuly (24 mg).
Porucha funkcie obličiek a pečeneNeexistuje teoretický dôvod, ktorý by naznačoval potrebu úpravy dávkovania formoterolu u pacientov s poruchou funkcie obličiek a pečene. Nezískali sa však ani klinické údaje, ktoré by podporovali jeho užívanie u týchto skupín pacientov.
Spôsob podávaniaKapsule sa používajú iba na inhalačné použitie.
Treba aj zabezpečiť, aby pacienti dostali od lekára alebo lekárnika inštrukcie, ako majú inhalátor používať.
Pokyny na použitie:
1. Stiahnite vrchnák inhalátora.

2. Uchopte pevne spodnú časť inhalátora a otvorte inhalátor otočením náustka v smere šípky.
3. Suchými rukami vložte kapsulu do lôžka v tvare kapsuly v spodnej časti inhalátora.
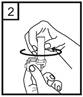
4. Otočením náustka uzavrite inhalátor.
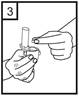
5. Držte inhalátor vo zvislej polohe (náustkom smerom nahor) a pevne stlačte len jedenkrát naraz obe tlačidlá v spodnej časti inhalátora. Tým sa prepichne kapsula. Uvoľnite tlačidlá.
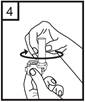
6. Vydýchnite čo najhlbšie.

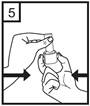
7. Vložte náustok do úst a mierne zakloňte hlavu. Obopnite náustok perami a vdychujte tak rýchlo a hlboko, ako sa len dá.

8. Zadržte dych tak dlho, kým vám to nie je nepríjemné, a vyberte inhalátor z úst. Potom dýchajte
normálne. Otvorte inhalátor a overte si, či v kapsule neostal prášok. Ak v kapsule ostal zvyšok
prášku, opakujte kroky 6 až 8.
9. Po použití vyberte prázdnu kapsulu a uzavrite náustok.
Poznámka:
Môže sa stať, že sa želatínová kapsula rozpadne na menšie časti a malé kúsky želatíny skončia počas inhalácie v ústach a hrdle. Želatína nie je škodlivá, v ústach zmäkne a dá sa potom prehltnúť. Riziko fragmentácie želatínovej kapsuly možno minimalizovať tým, že obe tlačidlá sa stlačia len jedenkrát, a tak sa kapsula neprepichne viac ako raz.
Kapsula by mala ostať v blistrovom obale dovtedy, kým ju nie je potrebné použiť. Vybrať sa má z blistrového obalu až
bezprostredne pred použitím.
Čistenie inhalátora:
Zvyšky prášku odstráňte z náustka a lôžka na kapsulu utretím suchou handričkou. Môžete použiť aj čistú mäkkú kefku.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníFormoterol sa nemá používať (a nie je postačujúci) ako začiatočná liečba astmy.
Pacienti s astmou, vyžadujúci liečbu ß
2-sympatomimetikami s predĺženým účinkom majú tiež užívať primerané udržiavacie dávky protizápalovo pôsobiacich liekov, kortikosteroidov. Pacientov je potrebné poučiť o nutnosti pokračovania v protizápalovej liečbe aj počas podávania lieku formoterol a to aj vtedy, keď dôjde k zmierneniu príznakov základného ochorenia. Ak by ťažkosti pretrvávali, alebo ak je potrebné zvýšiť dávky ß
2-agonistov, obyčajne ide o zhoršenie základného ochorenia, čo si vyžaduje prehodnotenie udržiavacej liečby.
Hoci sa formoterol môže používať ako doplnková liečba v prípade, že inhalačné kortikosteroidy neposkytujú adekvátnu kontrolu symptómov astmy, pacienti nemajú začínať liečbu formoterolom počas akútnej ťažkej exacerbácie astmy alebo ak sa u nich astma signifikantne alebo náhle zhoršila.
Počas liečby formoterolom sa môžu vyskytnúť závažné s astmou spojené nežiaduce účinky a exacerbácie. Pacientov je treba požiadať aby pokračovali v liečbe, avšak vyhľadali lekára v prípade, že symptómy astmy ostávajú nezmenené alebo sa zhoršujú po zaradení formoterolu do liečby. Len čo sa dosiahne kontrola symptómov astmy, má sa zvážiť postupné znižovanie dávky formoterolu. Počas znižovania dávky lieku je dôležitá pravidelná kontrola pacientov. Má sa užívať najnižšia účinná dávka formoterolu.
Maximálna denná dávka sa nemá prekročiť. Dlhodobá bezpečnosť pravidelnej liečby pri podávaní dávok vyšších ako 36 mg za deň u dospelých astmatikov, 18 mg za deň u detí s astmou a 18 mg za deň u pacientov s COPD nebola preukázaná.
Potreba častejšej aplikácie lieku (t.j. profylaktická liečba, napr.: kortikosteroidy a dlhodobo pôsobiace ß
2-sympatomimetiká) niekoľkokrát každý týždeň na prevenciu bronchokonstrikcie indukovanej námahou, napriek adekvátnej udržiavacej liečbe, môže byť znakom suboptimálnej kontroly astmy, liečbu je treba prehodnotiť a preskúmať kompliance pacienta.
Formoterol sa má podávať opatrne u pacientov s tyreotoxikózou, feochromocytómom, hypertrofickou obštrukčnou kardiomyopatiou, s idiopatickou subvalvulárnou aortálnou stenózou, ťažkou hypertenziou, s aneuryzmou alebo s inými závažnými kardiovaskulárnymi poruchami akými sú: ischemická choroba srdca, tachyarytmie alebo ťažké srdcové zlyhanie.
Formoterol môže vyvolať predĺženie QTc-intervalu. Opatrnosť je nutná pri liečbe pacientov s predĺženým QTc intervalom a u pacientov, ktorí užívajú lieky ovplyvňujúce QTc interval (pozri časť 4.5).
U diabetických pacientov sa na začiatku liečby odporúča vykonávať doplnkové vyšetrenia glykémie vzhľadom na hyperglykemizujúci účinok ß
2-sympatomimetík.
Pri liečbe ß
2-sympatomimetikami môže dôjsť k závažnej hypokaliémii. Mimoriadna opatrnosť je potrebná u pacientov so závažnou akútnou astmou, keďže v dôsledku hypoxie sa môže zvyšovať súvisiace riziko. Hypokaliemický účinok sa môže potencovať súbežnou liečbou derivátmi xantínu, steroidmi a diuretikami. Preto je potrebné monitorovať hladiny draslíka v sére.
Podobne ako pri akejkoľvek inhalačnej liečbe, môže dôjsť k paradoxnému bronchospazmu. Ak sa prejaví, má sa liečba okamžite ukončiť a začať alternatívna liečba (pozri časť 4.8).
Pri liečbe pacientov s nasledovnými chorobami treba venovať mimoriadnu pozornosť, najmä dávkovaniu:
– srdcové arytmie napr. tachyarytmie, tretí stupeň atrioventrikulárneho bloku
– arterioskleróza
– hypertyreóza
– tumor nadobličiek
– liek nesmie byť podávaný aspoň 12 hodín pred narkózou s halogénovou anestéziou.
Formoterol inhalačný prášok sa nemá používať terapeuticky v prípade predčasného pôrodu alebo hroziaceho potratu.
U pacientov s existujúcim ochorením srdca sa pri súbežnom podávaní teofylínu a formoterolu vyžaduje opatrnosť.
Pediatrická populáciaDeťom sa tento liek musí podávať pod dohľadom dospelej osoby. Deti do 6 rokov nemajú byť liečené formoterolom, z dôvodu nedostačných skúseností pre túto skupinu.
Tento liek obsahuje monohydrát laktózy (menej ako 500 mikrogramov na podanú dávku). Toto množstvo bežne nespôsobuje problémy u ľudí s intoleranciou laktózy.
Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, celkovým deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek.
4.5 Liekové a iné interakcieNevykonali sa žiadne špecifické interakčné štúdie s liekom formoterol.
Súbežná liečba inými sympatomimetikami, akými sú iné ß
2-agonisty alebo efedrín, môže potencovať nežiaduce účinky lieku formoterol a môže si vyžiadať titráciu dávky.
Súbežná liečba xantínovými derivátmi, steroidmi alebo diuretikami, akými sú tiazidové a slučkové diuretiká, môže potencovať zriedkavý hypokaliemický nežiaduci účinok ß
2-mimetík.
Hypokaliémia môže zvýšiť dispozíciu k arytmiám u pacientov, liečených srdcovými glykozidmi.
Existuje teoretické riziko, že súbežná liečba inými liekmi, ktoré predlžujú QTc-interval, môže spôsobiť vznik farmakodynamickej interakcie s formoterolom a zvýšiť možné riziko vzniku komorových arytmií. Takýmito liekmi sú napr. niektoré antihistaminiká (napr. terfenadín, astemizol, mizolastín), niektoré antiarytmiká (napr. chinidín, disopyramid, prokaínamid), erytromycín a tricyklické antidepresíva.
U pacientov, ktorým sa súbežne podáva anestézia pomocou halogénových uhľovodíkov, je zvýšené riziko arytmií.
Bronchodilatačný účinok formoterolu sa môže zvýšiť liekmi s anticholinergickým účinkom.
ß-blokátory môžu oslabovať, prípadne inhibovať účinok lieku formoterol.
Formoterol sa preto nemá užívať súbežne s ß-blokátormi (vrátane očných kvapiek), pokiaľ to nie je nevyhnutne potrebné.
Formoterol môže vytvárať interakcie s inhibítormi monoaminooxidázy, a preto by sa nemal podávať pacientom, ktorí sa liečia inhibítormi monoaminooxidázy, alebo počas 14 dní po ukončení takejto liečby.
Sympatomimetické účinky L-dopy, L-tyroxínu, oxytocínu a alkoholu môžu byť potenciované súbežným podávaním formoterolu.
4.6 Fertilita, gravidita a laktáciaGraviditaNie sú dostupné dostatočné údaje o podávaní formoterolu tehotným ženám. V štúdiách vykonaných na zvieratách formoterol spôsoboval stratu implantovaného embrya a znižoval včasné postnatálne prežívanie a pôrodnú hmotnosť. Uvedené účinky sa zistili pri podstatne vyššej systémovej expozícii aká sa počas podávania lieku formoterol dosahuje v klinickej praxi. Liečba formoterolom sa má zvážiť vo všetkých štádiách tehotenstva, ak je potrebné dosiahnuť adekvátnu kontrolu astmy. Rovnako ako pri ktoromkoľvek lieku sa má o použití počas tehotenstva uvažovať len v tom prípade, ak je očakávaný prínos liečby pre matku vyšší ako akékoľvek možné riziko pre plod. Potenciálne riziko pre človeka nie je známe.
DojčenieNie je známe, či formoterol prechádza do ľudského mlieka. Formoterol sa v malom množstve zistil v mlieku dojčiacich potkanov. Podávanie formoterolu dojčiacim ženám sa má zvažovať len v prípade, že očakávaný prínos liečby pre matku je vyšší ako akékoľvek možné riziko pre dieťa.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeFormoterol-ratiopharm 12 µg nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje.
Výskyt vedľajších účinkov, ako sú tremor a nervozita, môže ovplyvniť schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyNajčastejšie hlásené nežiaduce účinky liečby ß
2-agonistami, akými sú tremor a palpitácie, bývajú mierne a vymiznú počas niekoľkých dní liečby.
Nežiaduce účinky súvisiace s formoterolom sú uvedené nižšie a sú zoradené podľa triedy orgánových systémov a výskytu. Výskyt je definovaný ako: veľmi časté (³1/10), časté (³1/100) až <1/10), menej časté (³1/1 000 až < 1/100), zriedkavé (³1/10 000 až < 1/1000) a veľmi zriedkavé (<1/10 000).
Poruchy imunitného systému
Zriedkavé
Veľmi zriedkavé
|
Reakcie z precitlivenosti, napr. bronchospazmus, exantém, žihľavka, svrbenie, závažná hypotenzia, angioneurotický edém
Periférny edém
|
Poruchy metabolizmu a výživy
Zriedkavé
|
Hypokaliémia/ hyperkaliémia
|
Veľmi zriedkavé
| Hyperglykémia
|
Psychiatrické poruchy
Menej časté
|
Agitácia, nepokoj, poruchy spánku
|
Poruchy nervového systému
Časté
Menej časté
Veľmi zriedkavé
|
Bolesť hlavy, tremor
Úzkosť, nervozita, nespavosť
Poruchy chuti, závraty
|
Poruchy srdca a srdcovej činnosti
Časté
Menej časté
Zriedkavé
Veľmi zriedkavé
|
Palpitácie
Tachykardia
Srdcové arytmie, napr. fibrilácia predsiení, supraventrikulárna tachykardia, extrasystoly
Angina pectoris, predĺženie QT-intervalu
|
Poruchy ciev (extrakardiálne)
Veľmi zriedkavé
|
Zmeny tlaku krvi
|
Poruchy dýchacej sústavy, hrudníka a mediastína
Časté
Menej časté
Zriedkavé
|
Dyspnoe
Zhoršenie bronchospazmu
Paradoxný bronchospazmus
|
Poruchy gastrointestinálneho traktu
Menej časté
Zriedkavé
|
Podráždenie orofaryngu
Nauzea
|
Poruchy kože a podkožného tkaniva
Zriedkavé
|
Urtikária, svrbenie, exantém
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Menej časté
|
Svalové kŕče, myalgia
|
Podobne ako pri všetkých druhoch inhalačnej liečby, vo veľmi zriedkavých prípadoch sa môže objaviť paradoxný bronchospazmus (pozri časť 4.4).
Liečba ß
2-sympatomimetikami môže zvyšovať hladinu inzulínu, voľných mastných kyselín, glycerolu
a ketónových látok.
Pomocná látka, monohydrát laktózy obsahuje malé množstvo mliečnych proteínov. Tieto môžu zapríčiniť alergické reakcie.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovanieS liečbou predávkovania sú obmedzené klinické skúsenosti. Predávkovanie pravdepodobne má viesť k objaveniu sa príznakov typických pre podanie ß
2-sympatomimetických látok, akými sú tremor, bolesti hlavy, palpitácie. V ojedinelých prípadoch boli zaznamenané: tachykardia, hyperglykémia, hypokalémia, predĺženie QT
c intervalu, arytmia, nauzea a vracanie. V uvedených prípadoch môže byť indikovaná podporná a symptomatická liečba.
Môže sa zvážiť podávanie kardioselektívnych ß-blokátorov, avšak tieto sa majú podávať mimoriadne opatrne, nakoľko môžu vyvolať bronchospazmus. Má sa sledovať hladina draslíka v sére.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: selektívne agonisty beta-2 adrenergných receptorov
ATC kód: R03AC13.
Formoterol je silný selektívny agonista beta-2 adrenergných receptorov. Formoterol preukazuje bronchodilatačný účinok u pacientov s reverzibilnou obštrukciou dýchacích ciest. Účinok nastupuje rýchlo (v priebehu 1 - 3 minút) a je stále signifikantný 12 hodín po inhalácii.
Formoterol inhibuje uvoľňovanie histamínu a leukotriénov z pasívne senzibilizovaných ľudských pľúc. V pokusoch na zvieratách sa pozorovali určité protizápalové vlastnosti, ako napríklad potlačenie edému a nahromadenie zápalových buniek.
U ľudí sa formoterol ukázal účinný v prevencii bronchospazmov indukovaných inhalačnými alergénmi, fyzickou aktivitou, chladným vzduchom, histamínom a metacholínom.
U pacientov so stabilizovaným chronickým obštrukčným ochorením pľúc, ktoré má reverzibilnú zložku, sa ukázalo, že formoterol inhalovaný v dávkach 12 a 24 mikrogramov dvakrát denne má bronchodilatačný účinok s náhlym začiatkom a trvaním aspoň 12 hodín. Okrem toho liečba viedla k subjektívnemu zlepšeniu kvality života, ktoré sa hodnotilo pomocou dotazníka „Saint George´s Respiratory Questionnaire“.'
5.2 Farmakokinetické vlastnostiAbsorpciaNa základe údajov o iných inhalovaných liečivách možno predpokladať, že asi 90 % formoterolu podaného inhalátorom sa prehltne a potom absorbuje z gastrointestinálneho traktu. To znamená, že farmakokinetické vlastnosti perorálnej formy sa vo veľkej miere uplatňujú aj pri inhalačnom prášku. Po inhalácii terapeutických dávok sa plazmatické hladiny formoterolu nedajú detekovať v súčasnosti používanými analytickými metódami.
Absorpcia je rýchla a rozsiahla. Pri vyššej ako terapeutickej dávke (120 mikrogramov) sa najvyššia plazmatická koncentrácia pozoruje 5 minút po inhalácii, zatiaľ čo po podaní perorálnej dávky 80 mikrogramov rádioaktívne značeného formoterolu sa z nej absorbuje minimálne 65 % a perorálne dávky až do 300 mikrogramov sa ľahko absorbujú, pričom maximálne koncentrácie nezmeneného formoterolu sa dosiahnu za 0,5 – 1 hodinu. U pacientov s CHOCHP, ktorí sa liečili 12 týždňov fumarátom formoterolu v dávkach 12 alebo 24 mikrogramov dvakrát denne, sa plazmatické koncentrácie formoterolu pohybovali 10 minút po inhalácii medzi 11,5 a 25,7 pmol/l, 2 hodiny po inhalácii medzi 11,5 a 23,3 pmol/l a 6 hodín po inhalácii medzi 11,5 a 50,3 pmol/l.
Farmakokinetika formoterolu sa javí lineárna v rozsahu skúmaných perorálnych dávok, t.j. 20 – 300 mikrogramov. Opakované perorálne podávanie 40 – 160 mikrogramov denne nevedie k významnej akumulácii liečiva. Maximálna rýchlosť vylučovania po podaní 12 – 96 mikrogramov sa dosahuje v priebehu 1 - 2 hodín po inhalácii.
Po 12 týždňoch podávania 12 mikrogramov alebo 24 mikrogramov formoterolu v prášku dvakrát denne sa vylučovanie nezmeneného formoterolu močom zvýšilo o 63 - 73 % u dospelých pacientov a o 18 - 84 % u detí, čo svedčí o miernej a spontánne odznievajúcej akumulácii formoterolu v plazme po opakovaných dávkach.
Štúdie skúmajúce kumulatívnu exkréciu formoterolu a/alebo jeho (R,R) a (S,S)-enantiomérov močom po inhalácii suchého prášku (12 - 96 mikrogramov) alebo aerosólových foriem (12 - 96 mikrogramov) ukázali, že absorpcia sa lineárne zvyšuje s dávkou.
DistribúciaVäzba formoterolu na plazmatické bielkoviny je 61 - 64 % (34 % primárne na albumín).
V rozsahu koncentrácií, ktoré sa dosahujú pri terapeutických dávkach, nenastáva nasýtenie väzbových miest.
BiotransformáciaFormoterol sa eliminuje primárne metabolizmom, pričom priama glukuronidácia je hlavnou cestou biotransformácie, O-demetylácia, nasledovaná ďalšou glukuronidáciou, je ďalšou metabolickou cestou. Transformáciu katalyzujú mnohopočetné izoenzýmy CYP450 (2D6, 2C19, 2C9 a 2A6), a tak potenciál pre metabolické liekové interakcie je nízky. Kinetika formoterolu po jednotlivej dávke a po opakovanom podávaní je podobná, čo nasvedčuje, že nenastáva nijaká autoindukcia ani inhibícia metabolizmu.
ElimináciaZdá sa, že eliminácia formoterolu z cirkulácie je polyfázická: eliminačný polčas závisí od časového intervalu, ktorý sa berie do úvahy. Na základe koncentrácií v plazme a v krvi do 6, 8 alebo 12 hodín po perorálnom podaní sa stanovil eliminačný polčas približne 2 - 3 hodiny. Na základe rýchlostí vylučovania do moču, ktoré sa pohybovali medzi 3 a 16 hodinami po inhalácii, sa vypočítal polčas približne 5 hodín.
Údaje o kinetike formoterolu v plazme a rýchlosti vylučovania do moču u zdravých dobrovoľníkov po inhalácii poukazujú na bifázickú elimináciu s konečným polčasom eliminácie (R,R)-enantiomérov 13,9 hodín a (S,S)-enantiomérov 12,3 hodín. Približne 6,4 – 8 % dávky sa získa z moču vo forme nezmeneného formoterolu, pričom podiel (R,R)-enantioméru je 40 % a (S,S)-enantioméru 60 %.
Po jednotlivej perorálnej dávke
3H-formoterolu sa získa z moču 59 - 62 % dávky a zo stolice 32 - 34 % dávky. Renálny klírens formoterolu je 150 ml/min.
U dospelých pacientov s astmou sa po opakovaných dávkach 12 a 24 mikrogramov získa z moču približne 10 % dávky vo forme nezmeneného formoterolu a 15 - 18 % dávky vo forme konjugovaného formoterolu. U detí sa po opakovaných dávkach 12 a 24 mikrogramov získa z moču približne 6 % dávky vo forme nezmeneného formoterolu a 6,5 - 9 % dávky vo forme konjugovaného formoterolu. Tak ako u zdravých dobrovoľníkov aj u dospelých pacientov predstavovali (R,R)- a (S,S)-enantioméry 40 % a 60 % nezmeneného liečiva vylučovaného do moču, pričom po opakovanom podávaní dávok nenastávala relatívna akumulácia jedného enantioméru oproti druhému.
5.3 Predklinické údaje o bezpečnostiÚčinky formoterolu pozorované v štúdiách zameraných na toxicitu na potkanoch a psoch boli hlavne na kardiovaskulárny systém a skladali sa z hyperémie, tachykardie, arytmie a lézie myokardu. Tieto účinky sú známe farmakologické prejavy pozorované po podaní vysokých dávok beta-2 agonistov.
MutagenitaPokusy skúmajúce mutagenitu používali široké spektrum experimentálnych výstupov. V nijakom z uskutočnených pokusov
in vitro alebo
in vivo sa nezaznamenali genotoxické účinky.
Karcinogenita2-ročné štúdie na potkanoch a myšiach neukázali nijaký karcinogénny potenciál.
Samce myší, ktoré sa liečili veľmi vysokými dávkami formoterolu, mali o niečo vyšší výskyt benígnych subkapsulárnych bunkových tumorov nadobličiek. To je pravdepodobne dôsledok zmien vo fyziologickom procese starnutia.
Dve štúdie na potkanoch, pokrývajúce dve rozličné dávkovacie rozpätia, ukázali vzostup počtu prípadov mezoovariálneho leiomyómu. Tieto benígne neoplazmy typicky súviseli s dlhodobou liečbou potkanov vysokými koncentráciami liečiv s beta2 adrenergným účinkom. Podobne sa pozoroval vysoký počet prípadov ovariálnych cýst a benígnych granulómov alebo tumorov tekálnych buniek. Je známe, že betaagonisty postihujú ováriá potkanov, čo je pravdepodobne špecifické pre hlodavce. Pri užívaní vyšších dávok sa zaznamenalo aj niekoľko iných typov tumorov, ale ich frekvencia bola taká istá ako frekvencia v kontrolnej populácii z minulosti. Takéto tumory sa nezaznamenali v experimentoch pri užívaní nízkych dávok.
Pri podávaní najnižšej dávky, ktorá bola dávkou poskytujúcou 10-krát vyššiu systémovú expozíciu, ako je očakávaná expozícia po maximálnej odporúčanej dávke formoterolu, sa nijaká z incidencií tumorov nezvýšila na štatisticky významnú úroveň.
Na základe týchto nálezov a chýbania mutagénneho potenciálu možno vyvodiť, že formoterol pri terapeutických dávkach nepredstavuje karcinogénne riziko.
Reprodukčná toxicitaÚdaje z pokusov na zvieratách - pozri časť 4.6. Po perorálnom podaní sa formoterol vylučuje do mlieka dojčiacich potkanov.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokObsah kapsuly: monohydrát laktózy (ktorá obsahuje malé množstvá mliečnych proteínov).
Obal kapsuly: želatína
6.2 InkompatibilityNeaplikovateľné
6.3 Čas použiteľnosti2 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25 ºC. Uchovávajte v pôvodnom obale.
6.5 Druh obalu a obsah baleniaPVC/PVDC/Alu blister a jednodávkový inhalátor pre prášok na inhaláciu.
Veľkosti balení1 inhalátor + 10, 20, 30, 50, 56, 60, 100, 120, 180 alebo 200 kapsúl
2 inhalátory + 100 kapsúl
4 inhalátory + 200 kapsúl
50 inhalátorov + 500 kapsúl
50 alebo 60 kapsúl bez inhalátora
Multibalenie obsahujúce 2 inhalátory + 100 (2x50) kapsúl
Multibalenie obsahujúce 2 inhalátory + 120 (2x60) kapsúl
Multibalenie obsahujúce 3 inhalátory + 180 (3x60) kapsúl
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6. Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIratiopharm GmbH, Graf-Arco-Strasse 3, 89079 Ulm, Nemecko
8. REGISTRAČNÉ ČÍSLO14/0248/04-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 24. septembra 2004
Dátum posledného predĺženia registrácie: 12. decembra 2012
10. DÁTUM REVÍZIE TEXTUJanuár 2020