čný faktor VII.
CHARAKTERISTIKAĽudský koagulačný faktor VII je vitamín K-dependentný koagulačný faktor, prítomný v normálnej ľudskej plazme. Je to zymogén aktívnej serínovej proteázy faktora VIIa, ktorým sa spúšťa vonkajšia koagulačná dráha. Podanie ľudského faktora VII zaistí zvýšenie plazmatickej hladiny faktora VII a dočasne koriguje poruchu koagulácie u pacientov s nedostatkom faktora VII.
INDIKÁCIE
Liečba a profylaxia porúch zrážania krvi zapríčinených, alebo spojených s nedostatkom faktora VII.
KONTRAINDIKÁCIEPri podávaní lieku sa odporúča obozretnosť u pacientov so známou alergickou reakciou na jednotlivé zložky prípravku.
Vysoké riziko trombózy alebo diseminovanej intravaskulárnej koagulácie (pozri časť „Upozornenia“).
NEŽIADUCE ÚČINKYObčas boli pozorované reakcie z precitlivenosti alebo alergické reakcie (ako urtikária, nauzea, dávenie, dyspnoe, pokles krvného tlaku), ktoré v niektorých prípadoch progredovali do ťažkej anafylaxie (vrátane šoku).
Výnimočne bola pozorovaná horúčka.
Počas liečby faktormi protrombínového komplexu, z ktorých jedným je aj koagulačný faktor VII, sa môžu vyskytnúť tromboembolické príhody, najmä po podaní vysokých dávok a/alebo u pacientov s rizikovými faktormi trombózy.
V ojedinelých prípadoch môže substitučná liečba Factor VII NF Baxter viesť k tvorbe cirkulujúcich protilátok inhibujúcich faktor VII. Avšak z klinickej praxe nebol žiaden takýto prípad hlásený.
INTERAKCIEV súčasnosti nie sú známe žiadne farmakologické interakcie ľudského koagulačného faktora VII s inými liečivami.
Interferencia so sérologickými testami:Pri koagulačných testoch senzitívnych na heparín, u pacientov liečených vysokými dávkami Factor VII NF Baxter, treba brať do úvahy podiel heparínu, ktorý sa dostane do obehu spolu s prípravkom. Ak je to nutné, možno účinok heparínu neutralizovať pridaním protamínu do testovanej vzorky.
DÁVKOVANIEPre zriedkavosť tohto ochorenia sú dostupné iba obmedzené údaje na klinické využitie faktora VII. Z tohto dôvodu sa môže dať iba všeobecný návod na dávkovanie, avšak individuálne potrebná dávka sa môže zistiť na základe pravidelného stanovenia hladiny faktora VII v plazme a kontinuálneho monitorovania klinického stavu pacienta.
Všeobecne sa predpokladá, že podanie 1 I.U. koncentrátu faktora VII na kg telesnej hmotnosti zvýši aktivitu faktora VII okolo 2 %.
Potrebná dávka sa stanoví pomocou nasledujúceho vzorca:
Požadované jednotky = telesná hmotnosť (kg) x žiadané zvýšenie F VII (%) x 0,6
Podané množstvo a frekvencia dávok by mali vždy sledovať klinickú účinnosť v jednotlivých prípadoch.
Typ krvácania
| Terapeuticky potrebná hladina aktivity faktora VII v plazme
| Doba potrebná na udržiavanie terapeutickej hladiny aktivity faktora VII v plazme
|
Menšie krvácanie a menšie chirurgické zákroky
|
10 - 20 %
| Jedna dávka (menšie krvácanie) alebo do úplného zahojenia rany (menšie chirurgické zákroky)
|
Vážne krvácanie a väčšie chirurgické zákroky
|
20 - 25 %
| 8 až 10 dní alebo do úplného zahojenia rany
|
|
Intervaly dávok sa musia prispôsobiť ku krátkemu cirkulačnému polčasu faktora VII
(približne 3 až 5 hodín).
SPÔSOB PODÁVANIA
Factor VII NF Baxter rozpustite tesne pred použitím.
Rozpustený roztok sa musí použiť ihneď (prípravok neobsahuje žiadne konzervačné látky).
Nepoužívajte roztoky ktoré sú zakalené alebo obsahujú usadeniny. Všetok nespotrebovaný roztok alebo odpadový materiál znehodnoťte podľa predpisov.
Rozpustenie lyofilizovanej substancie:1. Zohrejte neotvorenú liekovku s rozpúšťadlom na izbovú teplotu (max. 37 °C).
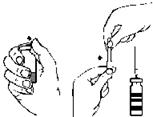
2. Odstráňte kryty z liekoviek s koncentrátom a s rozpúšťadlom (obr. A) a očistite zátky.
3. Otočením a ťahom odstráňte ochranný kryt z jedného konca obojstrannej ihly (obr. B).Odkrytý hrot ihly zapichnite cez gumovú zátku do injekčnej liekovky s rozpúšťadlom (obr. C).
4. Odstráňte ochranný kryt z druhého konca obojstrannej ihly a dajte pozor aby ste sa ho nedotkli.
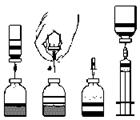
5. Prevráťte liekovku s rozpúšťadlom nad liekovku s koncentrátom a zapichnite voľný koniec obojstrannej ihly cez gumovú zátku liekovky s koncentrátom (obr. D). Vákuum v liekovke nasaje rozpúšťadlo.
6. Odpojte obe liekovky vytiahnutím ihly z liekovky s koncentrátom (obr. E). Rozpustenie sa urýchli jemným miešaním alebo točením.
7. Po úplnom rozpustení koncentrátu zapichnite priloženú odvzdušňovaciu ihlu (obr. F), vzniknutá pena sa stratí. Vytiahnite odvzdušňovaciu ihlu.
obr.A obr.B obr.C obr.D obr.E obr.F obr.G
Injekcia:1. Točením a ťahom odstráňte ochranný kryt z priloženej ihly s filtrom a nasaďte ju na sterilnú jednorazovú striekačku. Natiahnite roztok do striekačky (obr. G).
2. Odpojte ihlu s filtrom od striekačky a roztok aplikujte pomaly (max. rýchlosť injekcie 2 ml/min) intravenózne, cez priloženú infúznu súpravu s krídlovým adaptérom (alebo cez priloženú jednorazovú ihlu).
3. Pri liečbe v domácom prostredí sa uistite, že použité ihly a striekačky ste opäť vrátili do škatule so súpravou na rozpúšťanie, ktorú vráťte do hemofilického centra.
Infúzia:Ak podávate infúziu použite infúznu súpravu s primeraným filtrom.
UPOZORNENIA
Ak sa počas podávania lieku Factor VII NF Baxter vyskytnú reakcie z precitlivenosti, treba injekciu/infúziu ihneď zastaviť. Mierne reakcie je možné zvládnuť antihistaminikami, avšak pri liečbe ťažkých hypotenzívnych stavov treba postupovať podľa zásad súčasnej protišokovej liečby.
Na základe skúseností s prípravkami protrombínového komplexu, existuje u pacientov liečených koncentrátom ľudského koagulačného faktora VII potenciálne riziko trombózy alebo intravaskulárnej koagulácie. Kvôli tomuto potenciálnemu riziku tromboembolických komplikácií, treba byť opatrný pri podávaní vyšších dávok koncentrátov ľudského plazmatického koagulačného faktora VII pacientom s ischemickou chorobou srdca alebo infarktom myokardu v anamnéze, pacientom s chorobami pečene, pacientom po operácii, novorodencom a pacientom s rizikom tromboembolických príhod alebo diseminovanej intravaskulárnej koagulácie. V každej z týchto situácií je treba zvážiť potenciálny úžitok liečby koncentrátom ľudského koagulačného faktora VII oproti riziku týchto komplikácií.
U pacientov so známou precitlivenosťou na heparín alebo heparínom navodenou trombocytopéniou v anamnéze sa môže koncentrát ľudského koagulačného faktora VII podať iba v prípade život ohrozujúceho krvácania.'
Nakoľko množstvo sodíka v maximálnej dennej dávke môže prekročiť 200 mg, môže to mať škodlivý účinok u pacientov na neslanej diéte.
U pacientov, ktorí majú dostať koncentráty plazmatického faktora VII sa odporúča vhodné očkovanie (hepatitída typu A a B).
PredávkovaniePredávkovanie faktormi protrombínového komplexu môže viesť k vyvolaniu diseminovanej intravaskulárnej koagulácie, tromboembolických komplikácií alebo infarktu myokardu. Z dôvodov potenciálneho rizika trombózy, sa odporúča pri podávaní vysokých dávok faktorov protrombínového komplexu stanoviť plazmatickú hladinu, aby sa neprekročila maximálna hladina faktora VII 130 %.
Používanie v gravidite a počas laktácieBezpečnosť podávania Factor VII NF Baxter gravidným a dojčiacim ženám nebola overená v kontrolných klinických štúdiách.
Experimentálne štúdie na zvieratách nie sú vhodné na hodnotenie bezpečnosti prípravku vo vzťahu k reprodukcii, vývoju embrya a plodu, priebehu gravidity, peri- a postnatálnemu vývoju. Preto by sa mal prípravok Factor VII NF Baxter podávať počas gravidity a laktácie iba v jednoznačne indikovaných prípadoch.
Špeciálne upozornenie
Factor VII NF Baxter je vyrobený z ľudskej plazmy.
Pri podávaní liekov pripravených z ľudskej krvi alebo plazmy, sa nedá úplne vylúčiť možnosť vzniku infekčných chorôb spôsobených prenosom infekčných agens. Vzťahuje sa to tiež na patogény doteraz neznámeho pôvodu.
Aby sa znížilo riziko prenosu infekcie, vykonávajú sa vhodné opatrenia pri výbere darcov a darovanej plazmy, zhromaždená (poolovaná) plazma sa testuje a do výrobného procesu sú zahrnuté postupy na odstránenie /inaktiváciu vírusov.
Na zníženie rizika na najmenšiu mieru boli zavedené nasledovné opatrenia: Testovanie zhromaždenej plazmy na prítomnosť sekvencií vírusových genómov HIV-1 a HIV-2, HBV a HCV pomocou polymerázovej reťazovej reakcie (HIQ-PCR)
1, požiadavky na výber darcu (One-Time-Donor-Exclusion), skladovanie jednotlivých odberov (Inventory Hold) a program pre spätné vyhľadanie (Lookback Program).
Účinnosť postupov na odstránenie/inaktiváciu vírusov môže byť obmedzená voči niektorým vírusom bez lipidového obalu, ako napr. parvovírus B19 a dodnes neznáme vírusy. Parvovírus B19 môže ťažko postihnúť zvlášť imunodeficientných pacientov alebo séronegatívne gravidné ženy.
VAROVANIEPri uchovávaní pri teplote +2°C až +8 °C je čas použiteľnosti prípravku 3 roky.
Nepoužívajte po uplynutí času použiteľnosti vyznačenom na obale.
BALENIEFactor VII NF Baxter sa dodáva ako lyofilizovaný prášok v liekovkách s obsahom 600 I.U., určený na rozpustenie v 10 ml sterilizovanej vody na injekciu.
Každé balenie tiež obsahuje súpravu na rozpúšťanie a aplikáciu.
Veľkosť balenia: 1 x 600 I.U. + 10 ml rozpúšťadla (voda na injekciu)
UCHOVÁVANIEUchovávajte pri teplote +2°C až +8 °C (v chladničke).
Nezmrazujte. Uchovávajte v originálnom balení, v ktorom je prípravok chránený pred svetlom. Uchovávajte mimo dosahu a dohľadu detí.
DÁTUM POSLEDNEJ REVÍZIE TEXTU December 2007