
sa začať alternatívna liečba (pozri časti 4.3 a 4.6).
Pacienti s depléciou sodíka a/alebo objemu
V placebom kontrolovaných klinických skúšaniach sa pozorovala výrazná hypotenzia u 0,4%
pacientov s nekomplikovanou hypertenziou liečených Exforge. U pacientov s aktivovaným systémom renín-angiotenzín (ako sú pacienti s depléciou objemu a/alebo soli liečení vysokými dávkami diuretík), ktorí dostávajú blokátory angiotenzínových receptorov, sa môže vyskytnúť symptomatická hypotenzia. Odporúča sa úprava tohto stavu pred podaním Exforge alebo starostlivý lekársky dohľad na začiatku liečby.
Ak pri užívaní Exforge vznikne hypotenzia, pacienta je potrebné uložiť na chrbát a v prípade potreby podať intravenóznu infúziu fyziologického roztoku. V liečbe možno pokračovať po stabilizovaní krvného tlaku.
Hyperkaliémia
Pri súčasnom užívaní doplnkov draslíka, diuretík šetriacich kálium, náhrad soli obsahujúcich draslík alebo iných liekov, ktoré môžu zvyšovať hladiny draslíka (heparín, atď.), je potrebná opatrnosť a časté
monitorovanie hladín draslíka.
Stenóza renálnej artérie
Exforge sa má používať s opatrnosťou na liečbu hypertenzie u pacientov s unilaterálnou alebo
bilaterálnou stenózou renálnej artérie alebo stenózou artérie pri solitérnej obličke, pretože u takýchto
pacientov sa môže zvýšiť močovina v krvi a kreatinín v sére.
Transplantáciaobličky
Zatiaľ nie sú skúsenosti s bezpečným použitím Exforge u pacientov, ktorí sa nedávno podrobili
transplantácii obličky.
Zhoršeniefunkciepečene
Valsartan sa eliminuje prevažne nezmenený žlčou. Biologický polčas amlodipínu je u pacientov s poruchou funkcie pečene predĺžený a hodnoty AUC sú vyššie; odporúčania na dávkovanie neboli stanovené. Osobitná opatrnosť je potrebná pri podávaní Exforge pacientom s miernym až stredne ťažkým zhoršením funkcie pečene alebo obštrukciou žlčových ciest.
U pacientov s miernym až stredne ťažkým zhoršením funkcie pečene bez cholestázy je maximálna
odporúčaná dávka 80 mg valsartanu.
Zhoršenie funkcie obličiek
U pacientov s miernym až stredne ťažkým zhoršením funkcie obličiek (GFR >30 ml/min/1,73 m2) nie je potrebná úprava dávkovania Exforge. Pri stredne ťažkom zhoršení funkcie obličiek sa odporúča monitorovanie hladín draslíka a kreatinínu.
Primárny hyperaldosteronizmus
Pacienti s primárnym hyperaldosteronizmom nemajú byť liečení antagonistom angiotenzínu II
valsartanom, pretože ich systém renín-angiotenzín je ovplyvnený primárnym ochorením.
Angioedém
U pacientov liečených valsartanom bol hlásený angioedém, vrátane opuchu hrtana a hlasivky, ktorý spôsobil obštrukciu dýchacích ciest a/alebo opuch tváre, pier, hltana a/alebo jazyka. U niektorých
z týchto pacientov sa v minulosti vyskytol angioedém pri užití iných liečiv, vrátane inhibítorov ACE.
Exforge sa má okamžite vysadiť a nemá sa znova podať pacientom, u ktorých vznikne angioedém.
Zlyhanie srdca/stav po infarkte myokardu
U citlivých osôb možno v dôsledku inhibície systému renín-angiotenzín-aldosterón predpokladať zmeny funkcie obličiek. U pacientov s ťažkým zlyhaním srdca, u ktorých funkcia obličiek môže závisieť od aktivity systému renín-angiotenzín-aldosterón, sa liečba inhibítormi ACE a antagonistami receptorov angiotenzínu spájala s oligúriou a/alebo progredujúcou azotémiou a (zriedka) s akútnym zlyhaním obličiek a/alebo úmrtím. Podobné následky boli hlásené pri valsartane. Pri hodnotení stavu pacientov so zlyhávaním srdca alebo po infarkte myokardu sa má vždy vyšetriť funkcia obličiek.
V dlhodobom placebom kontrolovanom klinickom skúšaní (PRAISE-2) amlodipínu u pacientov so zlyhaním srdca triedy III a IV podľa NYHA (New York Heart Association Classification) neischemickej etiológie sa amlodipín spájal so zvýšeným počtom hlásení pľúcneho edému napriek tomu, že v porovnaní s placebom nebol významný rozdiel v incidencii zhoršenia zlyhania srdca.
Blokátory kalciových kanálov, vrátane amlodipínu, sa majú používať s opatrnosťou u pacientov s kongestívnym srdcovým zlyhávaním, keďže môžu zvyšovať riziko kardiovaskulárnych príhod a mortality v budúcnosti.
Stenóza aortálnej a mitrálnej chlopne
Tak ako pri všetkých ostatných vazodilatanciách, osobitná opatrnosť sa vyžaduje u pacientov s mitrálnou stenózou alebo významnou aortálnou stenózou, ktorá nie je závažná.
Duálna inhibícia systému renín-angiotenzín-aldosterón (RAAS)
Preukázalo sa, že súbežné použitie inhibítorov ACE, ARB alebo aliskirenu zvyšuje riziko hypotenzie, hyperkaliémie a zníženia funkcie obličiek (vrátane akútneho zlyhania obličiek). Duálna inhibícia
RAAS kombinovaným použitím inhibítorov ACE, ARB alebo aliskirenu sa preto neodporúča (pozri
časti 4.5 a 5.1).
Ak sa liečba duálnou inhibíciou považuje za absolútne nevyhnutnú, má sa podať iba pod dohľadom odborníka a u pacienta sa majú často a dôsledne kontrolovať funkcia obličiek, elektrolyty a krvný tlak. Inhibítory ACE a ARB sa nemajú súbežne používať u pacientov s diabetickou nefropatiou.
Exforge sa neskúmal v žiadnej inej populácii pacientov okrem pacientov s hypertenziou.
4.5 Liekové a iné interakcie
I
nterakcie
spoločné
pre
kombináciu
Neuskutočnili sa žiadne liekové interakčné štúdie s Exforge a inými liekmi.
Pri súčas nom užívaní je potre bné vzi ať do úvahy
Iné antihypertenzíva
Bežne používané antihypertenzíva (napr. alfablokátory, diuretiká) a iné lieky, ktoré môžu vyvolať hypotenzívne nežiaduce účinky (napr. tricyklické antidepresíva, alfablokátory na liečbu benígnej
hyperplázie prostaty), môžu zvyšovať antihypertenzívny účinok kombinácie.
Interakcie s amlodipínom
Súčas né uží vani e sa ne odporúč a
Grapefruit alebo grapefruitová šťava
Podanie amlodipínu s grapefruitom alebo grapefruitovou šťavou sa neodporúča, pretože u niektorých
pacientov sa môže zvýšiť biologická dostupnosť, čo zosilní účinky na zníženie krvného tlaku.
Opat rnosť potre bná pri súčasnom uží vaní
Inhibítory CYP3A4
Súčasné užívanie amlodipínu so silnými alebo stredne silnými inhibítormi CYP3A4 (inhibítormi proteáz, azolovými antimykotikami, makrolidmi, ako sú erytromycín alebo klaritromycín, verapamil
alebo diltiazem) môže zapríčiniť významné zvýšenie expozície amlodipínu. Klinický význam týchto
zmien vo farmakokinetike sa môže viac prejaviť u starších pacientov. Preto sa môže vyžadovať
klinické monitorovanie a úprava dávky.
Induktory CYP3A4 (antikonvulzíva [napr. karbamazepín, fenobarbital, fenytoín, fosfenytoín, primidón], rifampicín, Hypericum perforatum)
K dispozícii nie sú žiadne údaje týkajúce sa účinku induktorov CYP3A4 na amlodipín. Súčasné užívanie s induktormi CYP3A4 (napr. rifampicínom, Hypericum perforatum) môže znížiť plazmatické
koncentrácie amlodipínu. Amlodipín sa má spolu s induktormi CYP3A4 používať s opatrnosťou.
Simvastatín
Súbežné opakované podávanie dávok 10 mg amlodipínu s 80 mg simvastatínu vyvolalo zvýšenie expozície simvastatínu o 77% v porovnaní s podávaním samotného simvastatínu. U pacientov liečených amlodipínom sa odporúča obmedziť dávku simvastatínu na 20 mg denne.
Dantrolén (infúzia)
U zvierat sa po podaní verapamilu a intravenózneho dantrolénu pozoruje letálna fibrilácia komôr a srdcový kolaps v spojení s hyperkaliémiou. Vzhľadom na riziko hyperkaliémie sa odporúča, aby sa pacienti náchylní na malígnu hypertermiu a pri regulovaní malígnej hypertermie vyhýbali súčasnému podávaniu blokátorov kalciových kanálov, ako je amlodipín.
Pri súčas nom užívaní je potre bné vzi ať do úvahy
Iné
V klinických interakčných štúdiách amlodipín neovplyvňoval farmakokinetiku atorvastatínu, digoxínu, warfarínu alebo cyklosporínu.
Interakcie s valsartanom
Súčas né uží vani e sa ne odporúč a
Lítium
Počas súčasného podávania lítia s inhibítormi enzýmu konvertujúceho angiotenzín alebo antagonistami receptorov angiotenzínu II vrátane valsartanu sa zaznamenalo reverzibilné zvýšenie sérových koncentrácií a toxicity lítia. Preto sa počas súbežného používania odporúča starostlivo monitorovať koncentrácie lítia v sére. Ak sa používa aj diuretikum, Exforge môže pravdepodobne ďalej zvýšiť riziko toxických príznakov lítia.
 D
i
uretiká šetriace kálium, doplnky draslíka, náhrady soli obsahujúce draslík a iné látky, ktoré môžu zvyšovať hladiny draslíka
D
i
uretiká šetriace kálium, doplnky draslíka, náhrady soli obsahujúce draslík a iné látky, ktoré môžu zvyšovať hladiny draslíka
Ak sa má v kombinácii s valsartanom predpísať liek, ktorý ovplyvňuje hladiny draslíka, odporúča sa monitorovať plazmatické hladiny draslíka.
Opatrnosť potre bná pri súčasnom uží vaní Nesteroidné antiflogistiká (NSAIDs), vrátane selektívnych inhibítorov COX-2, acetylsalicylovej kyseliny (>3 g/deň) a neselektívnych NSAIDsKeď sa antagonisty angiotenzínu II podávajú súčasne s NSAIDs, môže dôjsť k oslabeniu
antihypertenzívneho účinku. Okrem toho súbežné užívanie antagonistov angiotenzínu II a NSAIDs môže mať za následok väčšie riziko zhoršovania funkcie obličiek a zvýšenie draslíka v sére. Preto sa odporúča monitorovanie funkcie obličiek na začiatku liečby, ako aj náležitá hydratácia pacienta.
Inhibítory transportéra vychytávania (rifampicín, cyklosporín) alebo efluxného transportéra(ritonavir)Výsledky štúdie
in vitro s tkanivom ľudskej pečene ukazujú, že valsartan je substrátom pečeňového
transportéra vychytávania OATP1B1 a pečeňového efluxného transportéra MRP2. Súbežné podávanie
inhibítorov transportéra vychytávania (rifampicínu, cyklosporínu) alebo efluxného transportéra
(ritonaviru) môže zvýšiť systémovú expozíciu valsartanu.
Duálna inhibícia RAAS pôsobením ARB, inhibítorov ACE alebo aliskirenuÚdaje z klinických skúšaní ukázali, že duálna inhibícia RAAS kombinovaným použitím inhibítorov
ACE, ARB alebo aliskirenu sa spája s vyššou frekvenciou nežiaducich udalostí, ako sú hypotenzia, hyperkaliémia a znížená funkcia obličiek (vrátane akútneho zlyhania obličiek), v porovnaní s použitím látky ovplyvňujúcej RAAS v monoterapii (pozri časti 4.3, 4.4 a 5.1).
InéPri monoterapii valsartanom sa nezistili žiadne klinicky významné interakcie s nasledujúcimi
liečivami: cimetidín, warfarín, furosemid, digoxín, atenolol, indometacín, hydrochlorotiazid,
amlodipín, glibenklamid.
4.6 Fertilita, gravidita a laktáciaGraviditaAmlodipínBezpečnosť podávania amlodipínu u žien počas gravidity nebola stanovená. Štúdie na zvieratách preukázali reprodukčnú toxicitu pri vysokých dávkach (pozri časť 5.3). Použitie počas gravidity sa
odporúča iba vtedy, ak niet bezpečnejšej alternatívy a ak ochorenie samotné predstavuje zvýšené
riziko pre matku a plod.
ValsartanPoužitie antagonistov receptorov angiotenzínu II (AIIRA) sa neodporúča počas prvého trimestra gravidity (pozri časť 4.4). Použitie AIIRA je kontraindikované počas druhého a tretieho trimestra gravidity (pozri časti 4.3 a 4.4).
Epidemiologické dôkazy týkajúce sa rizika teratogenity po expozícii inhibítorom ACE počas prvého
trimestra gravidity neboli nezvratné; malé zvýšenie rizika však nemožno vylúčiť. Zatiaľ čo nie sú kontrolované epidemiologické údaje o riziku pri antagonistoch receptorov angiotenzínu II (AIIRA), podobné riziká môžu existovať pre túto skupinu liekov. Ak sa nepretržitá liečba AIIRA nepovažuje za nevyhnutnú, pacientky plánujúce graviditu je potrebné previesť na alternatívnu antihypertenzívnu liečbu, ktorá má potvrdený bezpečnostný profil pri použití počas gravidity. Keď sa potvrdí gravidita, liečba AIIRA sa má okamžite ukončiť a ak je to potrebné, má sa začať alternatívna liečba.
Je známe, že expozícia AIIRA pri liečbe počas druhého a tretieho trimestra gravidity vyvoláva u ľudí fetotoxické účinky (zhoršenie funkcie obličiek, oligohydramnión, spomalenie osifikácie lebky) a toxické účinky u novorodencov (zlyhanie obličiek, hypotenzia, hyperkaliémia) (pozri časť 5.3).
Ak by došlo k expozícii AIIRA od druhého trimestra gravidity, odporúča sa ultrazvukové vyšetrenie funkcie obličiek a lebky.
Dojčatá, ktorých matky užívali AIIRA, je potrebné dôsledne sledovať pre hypotenziu (pozri časti 4.3
a 4.4).
Laktácia
Nie sú dostupné informácie o použití Exforge v období dojčenia, preto sa Exforge neodporúča
a vhodnejšie sú iné druhy liečby s lepšie preukázaným bezpečnostným profilom počas dojčenia, najmä pri dojčení novorodencov alebo predčasne narodených detí.
Fertilita
Nie sú žiadne klinické štúdie o fertilite pri Exforge.
Valsartan
Valsartan nemal nežiaduce účinky na reprodukčnú schopnosť samcov a samíc potkana pri perorálnych dávkach do 200 mg/kg/deň. Táto dávka je 6-krát vyššia než maximálna odporúčaná dávka u ľudí pri prepočte na mg/m2 (výpočty vychádzajú z perorálnej dávky 320 mg/deň u pacienta s telesnou hmotnosťou 60 kg).
Amlodipín
U niektorých pacientov liečených blokátormi kalciových kanálov boli hlásené reverzibilné biochemické zmeny v hlavičke spermií. Nie sú dostatočné klinické údaje týkajúce sa možného účinku
amlodipínu na fertilitu. V jednej štúdii u potkanov boli zaznamenané nežiaduce účinky na fertilitu u
samcov (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pacienti užívajúci Exforge majú pri vedení vozidiel alebo obsluhe strojov vziať do úvahy, že občas sa môžu vyskytnúť závraty alebo únava.
Amlodipín môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Ak pacienti užívajúci amlodipín trpia závratmi, bolesťou hlavy, únavou alebo nutkaním na vracanie, ich schopnosť reagovať môže byť narušená.
4.8 Nežiaduce účinky
Zhrnutieprofilubezpečnosti
Bezpečnosť Exforge sa vyhodnotila v piatich kontrolovaných klinických skúšaniach
s 5 175 pacientmi, z ktorých 2 613 dostávalo valsartan v kombinácii s amlodipínom. Zistilo sa, že nasledujúce nežiaduce reakcie sa vyskytujú najčastejšie alebo sú najvýznamnejšie alebo najzávažnejšie: nazofaryngitída, chrípka, precitlivenosť, bolesť hlavy, synkopa, ortostatická hypotenzia, edém, jamkovitý edém, edém tváre, periférny edém, únava, sčervenanie, asténia a nával horúčavy.
T
abuľkový
zoznam
nežiaducich
reakcií
Nežiaduce účinky sú zoradené podľa frekvencie s použitím nasledujúcej konvencie: veľmi časté
(≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov).
T
rieda orgánového
systému MedDRA
N
ežiaduce reakcie Frekvencia
E
x
f
orge Amlodipín Valsartan
Infekcie a nákazy Nazofaryngitída Časté -- -- Chrípka Časté -- --
Poruchy krvi a lymfatického systému
Znížený hemoglobín a hematokrit
-- -- Neznáme
Leukopénia -- Veľmi -- zriedkavé
Neutropénia -- -- Neznáme
Trombocytopénia, niekedy s purpurou
-- Veľmi
zriedkavé
Neznáme
Poruchy imunitného systému
Precitlivenosť Zriedkavé Veľmi
zriedkavé
Neznáme
Poruchy metabolizmu a
výživy
Anorexia Menej časté -- -- Hyperkalciémia Menej časté -- --
Hyperglykémia -- Veľmi -- zriedkavé
Hyperlipidémia Menej časté -- -- Hyperurikémia Menej časté -- -- Hypokaliémia Časté -- -- Hyponatriémia Menej časté -- --
Psychické poruchy Depresia -- Menej časté -- Úzkosť Zriedkavé -- -- Nespavosť/poruchy spánku -- Menej časté -- Kolísanie nálady -- Menej časté -- Zmätenosť -- Zriedkavé --
Poruchy nervového systému
Abnormálna koordinácia Menej časté -- -- Závraty Menej časté Časté -- Posturálne závraty Menej časté -- -- Dysgeúzia -- Menej časté -- Extrapyramídový syndróm -- Neznáme -- Bolesť hlavy Časté Časté --
Hypertónia -- Veľmi -- zriedkavé
Parestézia Menej časté Menej časté --
Periférna neuropatia, neuropatia
-- Veľmi -- zriedkavé
Somnolencia Menej časté Časté -- Synkopa -- Menej časté -- Tremor -- Menej časté -- Hypoestézia -- Menej časté --
Poruchy oka Porucha videnia Zriedkavé Menej časté --
Zhoršenie videnia Menej časté Menej časté --

Poruchy ucha a labyrintu
Tinitus Zriedkavé Menej časté -- Vertigo Menej časté -- Menej časté
Poruchy srdca a
srdcovej činnosti
Palpitácie Menej časté Časté -- Synkopa Zriedkavé -- -- Tachykardia Menej časté -- --
Arytmie (vrátane bradykardie, komorovej tachykardie a fibrilácie predsiení)
-- Veľmi -- zriedkavé
Infarkt myokardu -- Veľmi -- zriedkavé
Poruchy ciev Sčervenanie -- Časté -- Hypotenzia Zriedkavé Menej časté -- Ortostatická hypotenzia Menej časté -- --
Poruchy dýchacej sústavy, hrudníka a
Vaskulitída -- Veľmi
zriedkavé
Kašeľ Menej časté Veľmi
zriedkavé
Neznáme
Menej časté
mediastína
Dyspnoe -- Menej časté -- Faryngolaryngeálna bolesť Menej časté -- -- Rinitída -- Menej časté --
Poruchy gastrointestinál-neho traktu
Nepríjemné pocity v bruchu, bolesť v hornej časti brucha Zmena vo vyprázdňovaní čriev
Menej časté Časté Menej časté
-- Menej časté --
Zápcha Menej časté -- -- Hnačka Menej časté Menej časté -- Suchosť v ústach Menej časté Menej časté -- Dyspepsia -- Menej časté --
Gastritída -- Veľmi -- zriedkavé
Hyperplázia ďasien -- Veľmi -- zriedkavé
Nauzea Menej časté Časté --
Pankreatitída -- Veľmi -- zriedkavé
Vracanie -- Menej časté --
Poruchy pečene a žlčových ciest
Abnormálne funkčné testy pečene vrátane zvýšenia bilirubínu v krvi
-- Veľmi
zriedkavé*
Neznáme
Hepatitída -- Veľmi -- zriedkavé
Intrahepatálna cholestáza, ikterus
-- Veľmi -- zriedkavé
Poruchy kože a
Alopécia -- Menej časté --
podkožného tkaniva
Angioedém -- Veľmi
zriedkavé
Neznáme
Bulózna dermatitída -- -- Neznáme
Erytém Menej časté -- --
Multiformný erytém -- Veľmi -- zriedkavé
Exantém Zriedkavé Menej časté -- Hyperhidróza Zriedkavé Menej časté -- Reakcia z fotosenzitivity -- Menej časté -- Pruritus Zriedkavé Menej časté Neznáme Purpura -- Menej časté -- Exantém Menej časté Menej časté Neznáme Zmena farby kože -- Menej časté --
Urtikária a iné formy exantému
-- Veľmi -- zriedkavé
Exfoliatívna dermatitída -- Veľmi -- zriedkavé
Stevensov-Johnsonov syndróm
-- Veľmi -- zriedkavé
Quinckeho edém -- Veľmi -- zriedkavé
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Artralgia Menej časté Menej časté -- Bolesť chrbta Menej časté Menej časté -- Opuch kĺbov Menej časté -- -- Svalové kŕče Zriedkavé Menej časté -- Myalgia -- Menej časté Neznáme Opuch členkov -- Časté -- Pocit ťažoby Zriedkavé -- -- Zvýšený kreatinín v krvi -- -- Neznáme Porucha močenia -- Menej časté -- Nyktúria -- Menej časté -- Polakizúria Zriedkavé Menej časté -- Polyúria Zriedkavé -- --
Zlyhanie a poškodenie funkcie obličiek
-- -- Neznáme
Poruchy reprodukčného
systému a prsníkov
Impotencia -- Menej časté -- Erektilná dysfunkcia Zriedkavé -- -- Gynekomastia -- Menej časté --
Celkové poruchy a
Asténia Časté Menej časté --
reakcie v mieste podania
Nepríjemné pocity, celková
nevoľnosť
-- Menej časté --
Únava Časté Časté Menej časté Edém tváre Časté -- -- Sčervenenie, nával horúčavy Časté -- --
Nekardiálna bolesť v
hrudníku
-- Menej časté --
Laboratórne a funkčné vyšetrenia
Edém Časté Časté -- Periférny edém Časté -- -- Bolesť -- Menej časté -- Jamkovitý edém Časté -- -- Zvýšený draslík v krvi -- -- Neznáme Zvýšenie telesnej hmotnosti -- Menej časté -- Zníženie telesnej hmotnosti -- Menej časté --
* Najčastejšie charakteru cholestázy
Ďalšieinformácieokombinácii
Periférny edém, známy vedľajší účinok amlodipínu, sa spravidla pozoroval s nižšou incidenciou
u pacientov, ktorí dostávali kombináciu amlodipín/valsartan, ako u pacientov, ktorí dostávali samotný amlodipín. V dvojito slepých, kontrolovaných klinických skúšaniach bola nasledujúca incidencia
periférneho edému podľa dávky:
% pacientov, u ktorých sa
vyskytol periférny edém
Valsartan (mg)
0 40 80 160 320
A
ml
odipín
(m
g
)
0 3,0 5,5 2,4 1,6 0,9
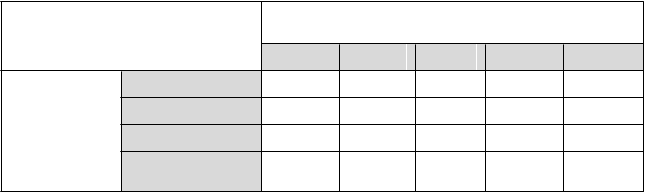
2,5 8,0 2,3 5,4 2,4 3,9
5 3,1 4,8 2,3 2,1 2,4
10 10,3 NA NA 9,0 9,5
Priemerná incidencia periférneho edému pri kombinácii amlodipín/valsartan rovnomerne rozložená na
všetky dávky bola 5,1%.
Ď
alšie
informácie
o
jednotlivých
zložkách
Nežiaduce reakcie hlásené v minulosti pri jednej zo zložiek (amlodipíne alebo valsartane) môžu predstavovať potenciálne nežiaduce reakcie aj pri Exforge, hoci sa v klinických skúšaniach alebo po uvedení na trh nepozorovali.
Amlodipín
Časté Somnolencia, závraty, palpitácie, abdominálna bolesť, nauzea, opuch členkov.
Menej časté Insomnia, zmeny nálady (vrátane úzkosti), depresia, tremor, dysgeúzia, synkopa, hypoestézia, poruchy videnia (vrátane diplopie), tinnitus, hypotenzia, dyspnoe,
rinitída, vracanie, dyspepsia, alopécia, purpura, zmeny sfarbenia pokožky,
hyperhidróza, pruritus, exantém, myalgia, svalové kŕče, bolesť, ťažkosti pri močení, zvýšená frekvencia močenia, impotencia, gynekomastia, bolesť na hrudi, celková nevoľnosť, zvýšenie telesnej hmotnosti, zníženie telesnej hmotnosti.
Zriedkavé Zmätenosť.
Veľmi
zriedkavé
Leukopénia, trombocytopénia, alergické reakcie, hyperglykémia, zvýšený svalový tonus, periférna neuropatia, infarkt myokardu, arytmia (vrátane bradykardie, komorovej tachykardie a fibrilácie predsiení), vaskulitída, pankreatitída, gastritída, hyperplázia gingivy, hepatitída, ikterus, zvýšenie hepatálnych enzýmov*, angioedém, erythema multiforme, žihľavka, exfoliatívna dermatitída, Stevensov- Johnsonov syndróm, Quinckeho edém, fotosenzitivita.
* najčastejšie charakteru cholestázy
Boli hlásené ojedinelé prípady extrapyramídového syndrómu.
ValsartanNeznáme Pokles hemoglobínu, pokles hematokritu, neutropénia, trombocytopénia, zvýšenie hladiny draslíka v sére, zvýšenie hodnôt funkčných testov pečene vrátane zvýšenia sérového bilirubínu, zlyhanie a poškodenie funkcie obličiek, zvýšenie hladiny kreatinínu v sére, angioedém, myalgia, vaskulitída, precitlivenosť vrátane sérovej choroby.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieSymptómyS predávkovaním Exforge nie sú skúsenosti. Hlavným príznakom predávkovania valsartanu je asi výrazná hypotenzia so závratmi. Predávkovanie amlodipínu môže mať za následok nadmernú periférnu vazodilatáciu a možno reflexnú tachykardiu. Bola hlásená výrazná a potenciálne dlhodobá systémová hypotenzia prechádzajúca až do šoku a šok končiaci sa smrťou.
LiečbaAk k požitiu lieku došlo nedávno, možno zvážiť vyvolanie vracania alebo výplach žalúdka. Ukázalo sa, že podanie aktívneho uhlia zdravým dobrovoľníkom ihneď alebo do dvoch hodín od požitia
amlodipínu významne znížilo jeho absorpciu. Klinicky významná hypotenzia spôsobená
predávkovaním Exforge vyžaduje aktívnu kardiovaskulárnu podpornú liečbu, vrátane častého
monitorovania funkcie srdca a dýchania, vyvýšenie končatín a sledovanie objemu cirkulujúcich tekutín a vylučovania moču. Pri obnovení cievneho tonusu a krvného tlaku môže pomôcť vazokonstrikčná látka za predpokladu, že jeho podanie nie je kontraindikované. Intravenózne podanie kalciumglukonátu môže byť prospešné pri zvrátení účinkov blokády kalciových kanálov.
Nie je pravdepodobné, že sa valsartan alebo amlodipín odstránia hemodialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: látky účinkujúce na systém renín-angiotenzín; antagonisty angiotenzínu
II, kombinácie; antagonisty angiotenzínu II a blokátory kalciových kanálov, ATC kód: C09DB01
Exforge kombinuje dve antihypertenzívne zlúčeniny s komplementárnymi mechanizmami znižovania krvného tlaku u pacientov s esenciálnou hypertenziou: amlodipín patrí do liekovej triedy antagonistov kalcia a valsartan do triedy antagonistov angiotenzínu II. Kombinácia týchto látok má aditívny antihypertenzívny účinok, znižuje krvný tlak vo väčšej miere ako každá zložka samotná.
Amlodipín/Valsartan
Kombinácia amlodipínu a valsartanu vyvoláva aditívne zníženie krvného tlaku súvisiace s dávkou v celom rozmedzí terapeutických dávok. Antihypertenzívny účinok jednorazovej dávky tejto
kombinácie pretrvával 24 hodín.
Klinické skúšania kontrolované placebom
Viac ako 1 400 pacientov s hypertenziou dostávalo Exforge raz denne v dvoch klinických skúšaniach
kontrolovaných placebom. Boli do nich zaradení dospelí s miernou až stredne ťažkou
nekomplikovanou esenciálnou hypertenziou (priemerný diastolický tlak krvi v sede ³95 a
<110 mmHg). Pacienti s vysokým kardiovaskulárnym rizikom – zlyhanie srdca, diabetes typu I
a nedostatočne kontrolovaný diabetes typu II a v anamnéze infarkt myokardu alebo cievna mozgová príhoda v priebehu jedného roka – boli vylúčení.
Klinické skúšania kontrolované účinným liekom u pacientov, ktorí nereagovali na monoterapiu
V multicentrickom, randomizovanom, dvojito slepom klinickom skúšaní s paralelnými skupinami kontrolovanom účinnou látkou sa preukázala normalizácia krvného tlaku (diastolický krvný tlak v
sede na konci obdobia medzi dávkami <90 mmHg na konci klinického skúšania) u pacientov
s nedostatočným znížením krvného tlaku pri dávke 160 mg valsartanu u 75% pacientov liečených
amlodipínom/valsartanom 10 mg/160 mg a u 62% pacientov liečených amlodipínom/valsartanom
5 mg/160 mg v porovnaní s 53% pacientov, ktorí ostali na 160 mg valsartanu. Pridanie 10 mg a 5 mg
amlodipínu ďalej znížilo systolický/diastolický krvný tlak o 6,0/4,8 mmHg a 3,9/2,9 mmHg v porovnaní s pacientmi, ktorí ostali iba na 160 mg valsartanu.
V multicentrickom, randomizovanom, dvojito slepom klinickom skúšaní s paralelnými skupinami kontrolovanom účinnou látkou sa preukázala normalizácia krvného tlaku (diastolický krvný tlak v sede na konci obdobia medzi dávkami <90 mmHg na konci klinického skúšania) u pacientov
s nedostatočným znížením krvného tlaku pri dávke 10 mg amlodipínu u 78% pacientov liečených
amlodipínom/valsartanom 10 mg/160 mg v porovnaní so 67% pacientov, ktorí ostali na 10 mg amlodipínu. Pridanie 160 mg valsartanu ďalej znížilo systolický/diastolický krvný tlak o
2,9/2,1 mmHg v porovnaní s pacientmi, ktorí ostali iba na 10 mg amlodipínu.
Exforge sa skúmal aj v klinickom skúšaní kontrolovanom účinnou látkou so 130 pacientmi s hypertenziou s priemerným diastolickým krvným tlakom v sede ≥110 mmHg a <120 mmHg. V tomto klinickom skúšaní (východisková hodnota tlaku krvi 171/113 mmHg) znížil liečebný režim Exforge
v dávke 5 mg/160 mg titrovanej na 10 mg/160 mg krvný tlak v sede o 36/29 mmHg v porovnaní s
32/28 mmHg pri liečebnom režime lisinoprilu/hydrochlorotiazidu v dávke 10 mg/12,5 mg titrovanej na 20 mg/12,5 mg.
Vo dvoch klinických skúšaniach s dlhodobým následným sledovaním pretrvával účinok Exforge počas
jedného roka. Náhle vysadenie Exforge sa nespájalo s rýchlym vzostupom krvného tlaku.
Vek, pohlavie, rasa alebo index telesnej hmotnosti (≥30 kg/m2, <30 kg/m2) neovplyvnili odpoveď na
Exforge.
Exforge sa neskúmal v žiadnej inej populácii pacientov okrem pacientov s hypertenziou. Valsartan sa skúmal u pacientov po infarkte myokardu a so zlyhaním srdca. Amlodipín sa skúmal u pacientov s chronickou stabilnou angina pectoris, vazospastickou angínou a angiograficky potvrdenou ischemickou chorobou srdca.
Amlodipín
Zložka amlodipínu v Exforge inhibuje transmembránový vstup iónov vápnika do hladkého svalstva srdca a ciev. Mechanizmus antihypertenzívneho pôsobenia amlodipínu je podmienený priamym
relaxačným účinkom na hladké svalstvo ciev, čo vyvoláva pokles odporu periférnych ciev a krvného tlaku. Experimentálne údaje naznačujú, že amlodipín sa viaže na dihydropyridínové aj na
nedihydropyridínové väzbové miesta. Kontraktilné procesy srdcového svalstva a hladkého svalstva ciev závisia od pohybu extracelulárnych iónov vápnika do týchto buniek cez špecifické iónové kanály.
Po podaní terapeutických dávok pacientom s hypertenziou amlodipín vyvoláva vazodilatáciu, čo vedie k poklesu krvného tlaku u ležiaceho aj stojaceho pacienta. Tento pokles nesprevádza pri chronickom podávaní významná zmena srdcovej frekvencie ani plazmatických hladín katecholamínov.
Plazmatické koncentrácie korelujú s účinkom u mladých aj starších pacientov.
U pacientov s hypertenziou s normálnou funkciou obličiek terapeutické dávky amlodipínu vyvolali zníženie odporu obličkových ciev a zvýšenie rýchlosti glomerulárnej filtrácie a efektívneho prietoku plazmy obličkami, a to bezo zmeny filtrovanej frakcie alebo proteinúrie.
Tak ako pri iných blokátoroch kalciových kanálov, hemodynamické merania srdcovej funkcie v pokoji a pri telesnej námahe (alebo chôdzi) u pacientov s normálnou ventrikulárnou funkciou, ktorí sa liečili amlodipínom, spravidla ukázali malé zvýšenie srdcového indexu bez významného ovplyvnenia dP/dt alebo koncového diastolického tlaku alebo koncového objemu v ľavej komore. V štúdiách hemodynamiky sa podávanie amlodipínu v rozmedzí terapeutických dávok intaktným zvieratám a ľuďom nespájalo s negatívnym inotropným účinkom, a to ani vtedy, keď sa ľuďom súčasne podávali betablokátory.
Amlodipín nemení funkciu sinoatriálneho uzla ani átrioventrikulárne vedenie u intaktných zvierat alebo ľudí. V klinických skúšaniach, v ktorých sa podával amlodipín v kombinácii s betablokátormi pacientom buď s hypertenziou, alebo s angina pectoris, sa nepozorovali nežiaduce účinky na elektrokardiografické parametre.
Použitie u pacientov s hypertenziou
Randomizované, dvojito zaslepené klinické skúšanie morbidity a mortality s názvom Klinické skúšanie prevencie infarktu myokardu liečbou znižujúcou krvný tlak a lipidy (Antihypertensive and Lipid-Lowering treatment to prevent Heart Attack Trial, ALLHAT) sa uskutočnilo na porovnanie novších spôsobov liečby: amlodipín 2,5-10 mg/deň (blokátor kalciových kanálov) alebo lizinopril
10-40 mg/deň (inhibítor ACE) ako liečby prvej línie oproti liečbe tiazidovým diuretikom
chlórtalidónom 12,5-25 mg/deň pri ľahkej až stredne ťažkej hypertenzii.
Celkovo 33 357 pacientov s hypertenziou vo veku 55 rokov alebo starších bolo randomizovaných a sledovaných v priemere 4,9 roka. Pacienti mali aspoň jeden ďalší rizikový faktor pre koronárnu chorobu srdca vrátane infarktu myokardu alebo cievnej mozgovej príhody v minulosti (>6 mesiacov pred zaradením do klinického skúšania) alebo dokumentovaného iného aterosklerotického kardiovaskulárneho ochorenia (celkovo 51,5%), diabetu 2. typu (36,1%), HDL cholesterolu <35 mg/dl alebo <0,906 mmol/l (11,6%), hypertrofie ľavej komory diagnostikovanej pomocou elektrokardiogramu alebo echokardiograficky (20,9%), fajčenia cigariet v súčasnosti (21,9%).
Primárny parameter sa skladal z fatálnej koronárnej choroby srdca alebo nefatálneho infarktu myokardu. Primárny parameter sa významne nelíšil medzi liečbou založenou na amlodipíne a chlórtalidóne: pomer rizika (RR) 0,98, 95% IS (0,90-1,07), p=0,65. Medzi sekundárnymi parametrami bola incidencia srdcového zlyhávania (súčasť zloženého kombinovaného kardiovaskulárneho parametra) významne vyššia v skupine amlodipínu v porovnaní so skupinou chlórtalidónu (10,2%
oproti 7,7%, RR 1,38, 95% IS [1,25-1,52], p<0,001). V úmrtiach z akejkoľvek príčiny však nebol
významný rozdiel medzi liečbou založenou na amlodipíne a chlórtalidóne: RR 0,96, 95% IS
[0,89-1,02], p=0,20.
Valsartan
Valsartan je perorálne aktívny, účinný a špecifický antagonista receptorov angiotenzínu II. Účinkuje selektívne na receptor podtypu AT1, krorý je zodpovedný za známe účinky angiotenzínu II. Zvýšené plazmatické hladiny angiotenzínu II po blokáde receptora AT1 valsartanom môžu stimulovať neblokovaný receptor podtypu AT2, čo môže vyvážiť účinok stimulácie receptora AT1. Valsartan nevykazuje čiastočnú agonistickú aktivitu na receptore AT1 a má oveľa vyššiu (asi 20 000-násobnú) afinitu k receptoru AT1 než k AT2.'
Valsartan neinhibuje ACE, známy tiež ako kinináza II, ktorý premieňa angiotenzín I na angiotenzín II a rozkladá bradykinín. Pretože účinok na ACE a potenciácia bradykinínu alebo substancie P nie sú prítomné, antagonisty angiotenzínu II pravdepodobne nevyvolávajú kašeľ. V klinických skúšaniach,
v ktorých sa valsartan porovnával s inhibítorom ACE, bola incidencia suchého kašľa významne nižšia
(p<0,05) u pacientov liečených valsartanom než u pacientov liečených inhibítorom ACE (2,6% oproti
7,9%). V klinickom skúšaní s pacientmi, ktorí mali v anamnéze suchý kašeľ počas liečby inhibítorom
ACE, malo kašeľ 19,5% osôb užívajúcich valsartan a 19,0% užívajúcich tiazidové diuretikum v porovnaní so 68,5% osôb, ktorým sa podával inhibítor ACE (p<0,05). Valsartan neblokuje ani sa neviaže na receptory iných hormónov alebo iónové kanály, o ktorých je známe, že sú dôležité v kardiovaskulárnej regulácii.
Podávanie valsartanu pacientom s hypertenziou vyvoláva pokles krvného tlaku bez ovplyvnenia tepovej frekvencie.
U väčšiny pacientov po podaní jednorazovej perorálnej dávky nastupuje antihypertenzívny účinok
v priebehu 2 hodín a maximálny pokles krvného tlaku sa dosiahne počas 4-6 hodín. Antihypertenzívny účinok pretrváva 24 hodín po podaní. Pri opakovanom podávaní maximálne zníženie krvného tlaku pri akejkoľvek dávke sa spravidla dosiahne v priebehu 2-4 týždňov a zachováva sa počas dlhodobej
liečby. Náhle vysadenie valsartanu sa nespájalo s náhlym zvýšením krvného tlaku, ani inými
nežiaducimi klinickými udalosťami.
Iné: duálna inhibícia systému renín-angiotenzín-aldosterón (RAAS)
Dve rozsiahle randomizované, kontrolované klinické skúšania (ONTARGET [ONgoing Telmisartan
Alone and in combination with Ramipril Global Endpoint Trial] a VA NEPHRON-D [The Veterans
Affairs Nephropathy in Diabetes]) skúmali použitie kombinácie inhibítora ACE a ARB.
Skúšanie ONTARGET sa vykonalo u pacientov s kardiovaskulárnym alebo cerebrovaskulárnym ochorením v anamnéze, alebo u pacientov s diabetes mellitus 2. typu, u ktorých sa preukázalo poškodenie cieľových orgánov. Skúšanie VA NEPHRON-D sa vykonalo u pacientov s diabetes mellitus 2. typu a diabetickou nefropatiou.
Tieto skúšania neukázali významný priaznivý účinok na renálne a/alebo kardiovaskulárne ukazovatele a mortalitu, zatiaľ čo v porovnaní s monoterapiou sa pozorovalo zvýšené riziko hyperkaliémie, akútneho poškodenia obličiek a/alebo hypotenzie. Vzhľadom na podobné farmakodynamické vlastnosti sú tieto výsledky relevantné aj pre ostatné inhibítory ACE a ARB.
Inhibítory ACE a ARB sa preto nemajú používať súbežne u pacientov s diabetickou nefropatiou (pozri
časť 4.4).
Skúšanie ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints) bolo navrhnuté na otestovanie prínosu pridania aliskirenu k štandardnej liečbe inhibítorom ACE alebo ARB u pacientov s diabetes mellitus 2. typu a chronickým ochorením obličiek, kardiovaskulárnym ochorením, alebo oboma ochoreniami. Skúšanie bolo predčasne ukončené pre zvýšené riziko nežiaducich udalostí. V skupine aliskirenu bolo numericky viac úmrtí
z kardiovaskulárnej príčiny a cievnych mozgových príhod ako v skupine placeba a v skupine
aliskirenu boli častejšie hlásené sledované nežiaduce udalosti a závažné nežiaduce udalosti
(hyperkaliémia, hypotenzia a renálna dysfunkcia) ako v skupine placeba.
5.2 Farmakokinetické vlastnosti
Linearita
Amlodipín a valsartan majú lineárnu farmakokinetiku.
Amlodipín/Valsartan
Po perorálnom podaní Exforge sa maximálne plazmatické koncentrácie valsartanu dosiahnu za 3
a amlodipínu za 6-8 hodín. Rýchlosť a miera absorpcie Exforge sa rovnajú biologickej dostupnosti valsartanu a amlodipínu, keď sa podávajú ako osobitné tablety.
Amlodipín
Absorpcia: Po perorálnom podaní terapeutických dávok samotného amlodipínu sa jeho maximálne plazmatické koncentrácie dosiahnu v priebehu 6-12 hodín. Absolútna biologická dostupnosť sa vypočítala
medzi 64% a 80%. Biologická dostupnosť amlodipínu nie je ovplyvnená požitím jedla.
Distribúcia: Distribučný objem je približne 21 l/kg. V štúdiách s amlodipínom in vitro sa ukázalo, že približne 97,5% cirkulujúceho liečiva sa viaže na bielkoviny plazmy.
Biotransformácia: Amlodipín sa extenzívne (približne 90%) metabolizuje v pečeni na neaktívne
metabolity.
Eliminácia: Eliminácia amlodipínu z plazmy je bifázická s terminálnym polčasom eliminácie približne
30 až 50 hodín. Rovnovážne hladiny v plazme sa dosiahnu po kontinuálnom podávaní za 7-8 dní. Močom sa vylúči 10% pôvodného amlodipínu a 60% jeho metabolitov.
Valsartan
Absorpcia: Po perorálnom podaní samotného valsartanu sa jeho maximálne plazmatické koncentrácie dosiahnu za 2-4 hodiny. Priemerná absolútna biologická dostupnosť je 23%. Jedlo znižuje expozíciu
valsartanu (stanovené ako AUC) asi o 40% a maximálnu plazmatickú koncentráciu (Cmax) asi o 50%, aj keď asi po 8 hodinách od podania sú koncentrácie valsartanu v plazme podobné v skupinách, ktoré ho užili buď s jedlom, alebo nalačno. Tento pokles AUC však nesprevádza klinicky významné
zníženie terapeutického účinku, a preto sa valsartan môže užívať buď s jedlom, alebo bez jedla.
Distribúcia: Rovnovážny distribučný objem valsartanu po intravenóznom podaní je asi 17 litrov, čo naznačuje, že valsartan sa extenzívne nedistribuuje do tkanív. Valsartan sa vo vysokej miere viaže na bielkoviny séra (94-97%), prevažne na sérový albumín.
Biotransformácia: Valsartan sa netransformuje vo veľkom rozsahu, pretože iba asi 20% dávky sa
nájde ako metabolity. V plazme bol v nízkych koncentráciách zistený hydroxymetabolit (menej ako
10% AUC valsartanu). Tento metabolit je farmakologicky neaktívny.
Eliminácia: Valsartan vykazuje multiexponenciálnu kinetiku rozkladu (t½α<1 hod a t½ß asi 9 hod). Valsartan sa primárne eliminuje stolicou (asi 83% dávky) a močom (asi 13% dávky), prevažne ako nezmenené liečivo. Po intravenóznom podaní plazmatický klírens valsartanu je asi 2 l/hod a jeho renálny klírens 0,62 l/hod (asi 30% celkového klírensu). Polčas valsartanu je 6 hodín.
Osobitné skupiny pacientov
Deti a dospievajúci (ml adší ako 18 rokov)
Nie sú dostupné farmakokinetické údaje u pediatrickej populácie.
St arší pacienti (vo vek u 65 rokov a viac)
Čas do dosiahnutia maximálnych plazmatických koncentrácií amlodipínu je podobný u mladých a starších pacientov. U starších pacientov klírens amlodipínu má tendenciu klesať, čo spôsobuje zväčšenie plochy pod krivkou (AUC) a predĺženie polčasu eliminácie. Priemerná systémová AUC valsartanu je o 70% vyššia u starších ako u mladých ľudí, preto je pri zvyšovaní dávkovania potrebná opatrnosť.
Zhorše ni e f unkc ie obl i či ek
Farmakokinetiku amlodipínu zhoršenie funkcie obličiek významne neovplyvňuje. Podľa očakávania pri zlúčenine, ktorej renálny klírens predstavuje iba 30% celkového plazmatického klírensu, sa nepozorovala žiadna korelácia medzi funkciou obličiek a systémovou expozíciou valsartanu.
Zhorše ni e f unkc ie peče ne
K dispozícii sú veľmi obmedzené údaje týkajúce sa podávania amlodipínu u pacientov s poruchou funkcie pečene. Pacienti s poruchou funkcie pečene majú znížený klírens amlodipínu, čo má za následok zväčšenie AUC približne o 40-60%. V priemere je u pacientov s ľahkým až stredne ťažkým chronickým ochorením pečene expozícia (stanovená hodnotami AUC) valsartanu dvojnásobná
v porovnaní so zdravými dobrovoľníkmi (so zodpovedajúcim vekom, pohlavím a telesnou hmotnosťou). U pacientov s ochorením pečene je potrebné postupovať opatrne (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
Amlodipín/Valsartan
V štúdiách na zvieratách sa pozorovali nasledujúce nežiaduce reakcie s možným klinickým
významom:
Histopatologické príznaky zápalu sliznice žalúdka sa pozorovali u samcov potkanov pri expozícii asi
1,9-krát (valsartan) a 2,6-krát (amlodipín) vyššej, než sú klinické dávky 160 mg valsartanu a 10 mg amlodipínu. Pri vyšších expozíciách dochádzalo k ulcerácii a erózii žalúdočnej sliznice u samcov aj
samíc. Podobné zmeny sa tiež pozorovali v skupine, v ktorej sa podával len valsartan (expozícia
8,5-11,0-krát vyššia, ako je klinická dávka 160 mg valsartanu).
Vyššia incidencia a závažnosť bazofílie/hyalinizácie renálnych tubulov, dilatácie a obličkových
valcov, ako aj intersticiálny lymfocytový zápal a hypertrofia medie arteriol sa zistili pri expozícii
8-13-krát (valsartan) a 7-8-krát (amlodipín) vyššej, ako sú klinické dávky 160 mg valsartanu a 10 mg amlodipínu. Podobné zmeny sa našli aj v skupine, v ktorej sa podával len valsartan (expozícia
8,5-11,0-krát vyššia, ako je klinická dávka 160 mg valsartanu).
V štúdii embryo-fetálneho vývoja potkanov sa zaznamenali vyššie incidencie dilatovaných
močovodov, malformácií sternebrae a neosifikovaných článkov predných končatín pri expozíciách asi
12-krát (valsartan) a 10-krát (amlodipín) vyšších, ako sú klinické dávky 160 mg valsartanu a 10 mg
amlodipínu. Dilatované močovody sa našli aj v skupine, v ktorej sa podával len valsartan (expozícia
12-krát vyššia, ako je klinická dávka 160 mg valsartanu). V tejto štúdii boli prítomné iba slabé príznaky toxicity u gravidných samíc (stredne závažný pokles telesnej hmotnosti). Hladina bez
pozorovaného účinku z hľadiska účinkov na vývoj predstavovala 3-násobok (valsartan) a 4-násobok
(amlodipín) klinickej expozícii (na základe AUC).
Pri jednotlivých zložkách sa nenašli dôkazy mutagenity, klastogenity alebo karcinogenity.
Amlodipín
Reprodukčnátoxikológia
Reprodukčné štúdie u potkanov a myší preukázali oneskorený dátum pôrodu, dlhšie trvanie pôrodu a znížený počet prežívajúcich mláďat pri dávkach približne 50-krát vyšších, ako je maximálna odporúčaná dávka pre ľudí vyjadrená v mg/kg.
Poškodenie
f
e
r
t
i
l
ity
Nebol zaznamenaný žiaden účinok na fertilitu potkanov, ktoré boli liečené amlodipínom (samce počas
64 dní a samice 14 dní pred párením) v dávkach až do 10 mg/kg/deň (8-násobok* maximálnej odporúčanej dávky u ľudí rovnajúcej sa 10 mg po prepočítaní na mg/m2 povrchu). V inej štúdii s potkanmi, v ktorej boli samce potkanov liečené 30 dní amlodipíniumbesilátom v dávke porovnateľnej s dávkou u ľudí vyjadrenej v mg/kg, boli v plazme zistené poklesy hormónu stimulujúceho folikuly a testosterónu, ako aj zníženie hustoty spermií a počtu zrelých spermatoblastov a Sertoliho podporných buniek.
Karcinogenéza, mutagenéza
U potkanov a myší užívajúcich amlodipín v potrave počas dvoch rokov v koncentráciách vypočítaných tak, aby sa zabezpečili denné dávky 0,5, 1,25 a 2,5 mg/kg/deň, sa nepreukázali žiadne dôkazy o jeho karcinogenite. Najvyššia dávka v mg (pre myši približne rovnaká a pre potkany rovnajúca sa dvojnásobnej* maximálnej odporúčanej klinickej dávke 10 mg po prepočítaní na mg/m2 povrchu) sa blížila maximálnej tolerovanej dávke pre myši, ale nie pre potkany.
Štúdie mutagenity neodhalili žiadne účinky súvisiace s liekom či už na génovej alebo chromozomálnej
úrovni.
* Pri telesnej hmotnosti pacienta 50 kg
Valsartan
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom
podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej a vývinovej toxicity neodhalili
žiadne osobitné riziko pre ľudí.
Maternálne toxické dávky u potkanov (600 mg/kg/deň) počas posledných dní gestácie a laktácie viedli u potomkov k nižšiemu prežívaniu, nižšiemu prírastku hmotnosti a oneskorenému vývoju (oddelenie vonkajšej chrupavkovej časti ucha a otvorenie ušného kanála) (pozri časť 4.6). Tieto dávky u potkanov (600 mg/kg/deň) sú približne 18-krát vyššie ako maximálna odporúčaná dávka pre ľudí na mg/m2 (výpočty predpokladajú perorálnu dávku 320 mg/deň a pacienta s hmotnosťou 60 kg).
V predklinických štúdiách bezpečnosti vyvolali vysoké dávky valsartanu (200 až 600 mg/kg telesnej hmotnosti) u potkanov zníženie parametrov krvných buniek (erytrocytov, hemoglobínu, hematokritu) a dokázané zmeny renálnej hemodynamiky (mierne zvýšenie dusíka močoviny v krvi a hyperpláziu obličkových tubulov a bazofíliu u samcov). Tieto dávky u potkanov (200 až 600 mg/kg/deň) sú približne 6- až 18-krát vyššie ako maximálna odporúčaná dávka pre ľudí na mg/m2 (výpočty predpokladajú perorálnu dávku 320 mg/deň a pacienta s hmotnosťou 60 kg).
Pri porovnateľných dávkach u opíc kozmáčov boli zmeny podobné, hoci závažnejšie, najmä
v obličkách, kde sa vyvinuli do nefropatie, vrátane zvýšeného dusíka močoviny a kreatinínu v krvi.
U oboch druhov sa pozorovala aj hypertrofia obličkových juxtaglomerulárnych buniek. Za príčinu všetkých zmien sa považoval farmakologický účinok valsartanu, ktorý zvlášť u kozmáčov vyvoláva dlhodobú hypotenziu. Vzhľadom na terapeutické dávky valsartanu u ľudí sa nezdá, že by hypertrofia obličkových juxtaglomerulárnych buniek bola významná.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Exforge 5 mg/80 mg filmom obalené tablety
Jadro tablety:
Mikrokryštalická celulóza Krospovidón typu A
Koloidný bezvodý oxid kremičitý
Magnéziumstearát
Obal tablety:
Hypromelóza
Oxid titaničitý (E171) Žltý oxid železitý (E172) Makrogol 4000
Mastenec
Exforge 5 mg/160 mg filmom obalené tablety
Jadro tablety:
Mikrokryštalická celulóza
Krospovidón typu A
Koloidný bezvodý oxid kremičitý
Magnéziumstearát
Obal tablety:
Hypromelóza
Oxid titaničitý (E171) Žltý oxid železitý (E172) Makrogol 4000
Mastenec
Exforge 10 mg/160 mg filmom obalené tablety
Jadro tablety:
Mikrokryštalická celulóza
Krospovidón typu A
Koloidný bezvodý oxid kremičitý
Magnéziumstearát
Obal tablety:
Hypromelóza
Oxid titaničitý (E171) Žltý oxid železitý (E172)
Červený oxid železitý (E172)
Makrogol 4000
Mastenec
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30°C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC blistre. Jeden blister obsahuje 7, 10 alebo 14 filmom obalených tabliet.
Veľkosti balenia: 7, 14, 28, 30, 56, 90, 98 alebo 280 filmom obalených tabliet a spoločné balenia
obsahujúce 280 (4x70 alebo 20x14) filmom obalených tabliet.
PVC/PVDC blistre s perforáciou, umožňujúce oddelenie jednotlivej dávky. Jeden blister obsahuje 7,
10 alebo 14 filmom obalených tabliet.
Veľkosti balenia: 56, 98 alebo 280 filmom obalených tabliet.
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR
Veľká Británia
8. REGISTRAČNÉ ČÍSLA
Exforge 5 mg/80 mg filmom obalené tablety
EU/1/06/370/001
EU/1/06/370/002
EU/1/06/370/003
EU/1/06/370/004
EU/1/06/370/005
EU/1/06/370/006
EU/1/06/370/007
EU/1/06/370/008
EU/1/06/370/025
EU/1/06/370/026
EU/1/06/370/027
EU/1/06/370/034
EU/1/06/370/037
Exforge 5 mg/160 mg filmom obalené tablety
EU/1/06/370/009
EU/1/06/370/010
EU/1/06/370/011
EU/1/06/370/012
EU/1/06/370/013
EU/1/06/370/014
EU/1/06/370/015
EU/1/06/370/016
EU/1/06/370/028
EU/1/06/370/029
EU/1/06/370/030
EU/1/06/370/035
EU/1/06/370/038
Exforge 10 mg/160 mg filmom obalené tablety
EU/1/06/370/017
EU/1/06/370/018
EU/1/06/370/019
EU/1/06/370/020
EU/1/06/370/021
EU/1/06/370/022
EU/1/06/370/023
EU/1/06/370/024
EU/1/06/370/031
EU/1/06/370/032
EU/1/06/370/033
EU/1/06/370/036
EU/1/06/370/039
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 17. január 2007
Dátum posledného predĺženia: 17. január 2012
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu