
(CYP) 1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4, ani neindukoval CYP1A2, CYP2B6 alebo CYP3A4. Preto sa nepredpokladá, že by tento liek menil metabolický klírens súbežne podávaných liekov, ktoré sú metabolizované týmito enzýmami.
Účinokinýchliekovnadapagliflozín
Interakčné štúdie vykonané u zdravých jedincov väčšinou s jednodávkovým režimom užívania naznačujú, že farmakokinetika dapagliflozínu sa nemení pioglitazónom, sitagliptínom, glimepiridom,
voglibózou, hydrochlorotiazidom, bumetanidom, valsartanom alebo simvastatínom.
Po súbežnom podaní dapagliflozínu s rifampicínom (induktor rôznych aktívnych transportérov
a enzýmov metabolizujúcich liečivá) sa pozorovalo 22% zníženie systémovej expozície dapagliflozínu
(AUC), ale bez klinicky významného účinku na 24-hodinové vylučovanie glukózy močom. Úprava dávkovania sa neodporúča. Klinicky významný účinok s inými induktormi (napr. karbamazepín,
fenytoín, fenobarbital) sa neočakáva.
Po súbežnom podávaní dapagliflozínu s kyselinou mefenamovou (inhibítor UGT1A9) sa pozorovalo
55% zvýšenie systémovej expozície dapagliflozínu, ale bez klinicky významného účinku na 24- hodinové vylučovanie glukózy močom. Úprava dávkovania sa neodporúča.
Účinok
dapagliflozínu
na
iné
lieky
V interakčných skúšaniach vykonaných u zdravých jedincov väčšinou s jednodávkovým režimom užívania dapagliflozín nezmenil farmakokinetiku pioglitazónu, sitagliptínu, glimepiridu, hydrochlorotiazidu, bumetanidu, valsartanu, digoxínu (substrát P-gp) alebo warfarínu (S-warfarínu, substrátu CYP2C9), alebo antikoagulačné účinky warfarínu stanovené INR. Kombinácia jednej dávky dapagliflozínu 20 mg a simvastatínu (substrátu CYP3A4) vyústilo do 19% zvýšenia AUC simvastatínu a 31% zvýšenia AUC kyseliny simvastatínovej. Zvýšenia expozícií simvastatínu a kyseliny simvastatínovej sa nepovažujú za klinicky významné.
Ďalšieinterakcie
Vplyv fajčenia, stravy, rastlinných produktov a alkoholu na farmakokinetiku dapagliflozínu sa nesledoval.
Pediatrickápopulácia
Interakčné štúdie sa uskutočnili len u dospelých.
Metformín
Kombinácie,ktorésaneodporúčajú
Pri akútnej intoxikácii alkoholom (obzvlášť v prípade hladovania, podvýživy alebo pri poruche funkcie pečene) dochádza kvôli metformínu, liečivu v tomto lieku, k zvýšeniu rizika laktátovej acidózy (pozri časť 4.4). Konzumácii alkoholu a liekov obsahujúcich alkohol sa má vyhnúť.
Katiónové látky, ktoré sa eliminujú renálnou tubulárnou sekréciou (napr. cimetidín), môžu interagovať s metformínom kompetíciou o spoločné renálne tubulárne transportné systémy. Skúšanie vykonané
u siedmych normálnych zdravých dobrovoľníkov ukázalo, že cimetidín podávaný v dávke 400 mg
dvakrát denne zvýšil systémovú expozíciu metformínu (AUC) o 50 % a Cmax o 81 %. Preto sa má pri súbežnom podávaní s katiónovými látkami, ktoré sa eliminujú renálnou tubulárnou sekréciou, zvážiť dôkladné sledovanie glykemickej kontroly, úprava dávky v rámci odporúčaného dávkovania a zmeny v liečbe diabetu.
Intravaskulárne podávanie jódovaných kontrastných látok v rádiologických skúšaniach môže viesť k renálnemu zlyhaniu, ktorého výsledkom je kumulácia metformínu a riziko laktátovej acidózy. Užívanie tohto lieku sa má preto prerušiť pred alebo v čase takéhoto testu a v užívaní sa nemá pokračovať skôr, ako 48 hodín po teste a iba po opätovnom vyhodnotení renálnej funkcie a zistení, že je normálna (pozri časť 4.4).
Kombináciavyžadujúcaopatrnosťpripoužívaní
Glukokortikoidy (podávané systémovo a lokálne), beta-2 agonisty a diuretiká majú vnútornú hyperglykemickú aktivitu. Pacient má byť informovaný a častejšie sa má sledovať glukóza v krvi, obzvlášť na začiatku liečby takýmito liekmi. V prípade potreby sa má dávka lieku znižujúceho hladinu glukózy upraviť počas liečby s iným liekom a po jeho vysadení.
Diuretiká, obzvlášť slučkové diuretiká, môžu kvôli ich potenciálu znižovania funkcie obličiek zvýšiť riziko laktátovej acidózy.
Inzulín a inzulínové sekretagogy
Inzulín a inzulínové sekretagogy, ako sú deriváty sulfonylurey spôsobujú hypoglykémiu. Preto sa môže vyžadovať nižšia dávka inzulínu alebo inzulínového sekretagogu, aby sa znížilo riziko
hypoglykémie pri použití v kombinácii s metformínom (pozri časti 4.2 a 4.8).
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii nie sú žiadne údaje o použití lieku Ebymect alebo dapagliflozínu u gravidných žien. Štúdie na potkanoch liečených dapagliflozínom preukázali toxicitu na vývoj obličiek v období, ktoré
sa zhoduje s druhým a tretím trimestrom ľudskej gravidity (pozri časť 5.3). Preto sa použitie tohto
lieku počas druhého a tretieho trimestra gravidity neodporúča. Obmedzené množstvo údajov o použití
metformínu u gravidných žien nepreukázalo zvýšené riziko kongenitálnych malformácií. Štúdie
s metformínom na zvieratách nepreukázali škodlivé účinky z hľadiska gravidity, embryonálneho alebo fetálneho vývoja, pôrodu alebo postnatálneho vývoja (pozri tiež časť 5.3).
Keď pacientka plánuje otehotnieť a počas gravidity, neodporúča sa liečiť diabetes týmto liekom, ale na udržanie hladiny glukózy v krvi čo najbližšej k fyziologickým hodnotám sa má použiť inzulín, aby sa znížilo riziko malformácií plodu spojené s abnormálnymi hladinami glukózy v krvi.
Laktácia
Nie je známe, či sa tento liek alebo dapagliflozín (a/alebo jeho metabolity) vylučujú do ľudského mlieka. Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie
dapagliflozínu/metabolitov do mlieka, ako aj farmakologicky sprostredkované účinky u laktujúcich
potomkov (pozri časť 5.3). Metformín sa v malých množstvách vylučuje do ľudského mlieka. Riziko u novorodencov/dojčiat nemôže byť vylúčené.
Tento liek nemá byť užívaný počas laktácie. Fertilita
Účinok tohto lieku alebo dapagliflozínu na fertilitu u ľudí sa nesledoval. U samcov a samíc potkanov
dapagliflozín v žiadnych testovaných dávkach nepreukázal účinok na fertilitu. Štúdie s metformínom na zvieratách nepreukázali reprodukčnú toxicitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Dapagliflozín alebo metformín nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti majú byť upozornení na riziko hypoglykémie v prípade, že sa tento liek používa v kombinácii s inými liekmi znižujúcimi hladinu glukózy o ktorých je známe, že spôsobujú hypoglykémiu.
4.8 Nežiaduce účinky
Preukázala sa bioekvivalencia lieku Ebymect so súčasne podávaným dapagliflozínom a metformínom
(pozri časť 5.2). S tabletami lieku Ebymect sa nevykonali žiadne terapeutické klinické skúšania.
Dapagliflozínplusmetformín
Súhrnbezpečnostnéhoprofilu
V 5 placebom kontrolovaných skúšaniach s dapagliflozínom ako prídavnej liečbe k metformínu boli výsledky bezpečnosti podobné ako v združenej vopred špecifikovanej analýze 12 placebom
kontrolovaných skúšaní s dapagliflozínom (pozri Dapagliflozín, Súhrn bezpečnostného profilu nižšie).
V skupine s dapagliflozínom plus metformín sa nezistili sa žiadne ďalšie nežiaduce reakcie oproti nežiaducim reakciám hláseným pre jednotlivé liečivá. V separátnej združenej analýze dapagliflozínu
ako prídavnej liečbe k metformínu bolo 623 jedincov liečených dapagliflozínom 10 mg ako prídavnou
liečbou k metformínu a 523 jedincov dostávalo placebo s metformínom.
Dapagliflozín
Súhrnbezpečnostnéhoprofilu
V združenej vopred špecifikovanej analýze 13 placebom kontrolovaných skúšaní bolo 2 360 jedincov liečených dapagliflozínom 10 mg a 2 295 pacientov dostávalo placebo.
Najčastejšie hlásenou nežiaducou reakciou bola hypoglykémia, ktorá závisela od typu použitej základnej liečby v každom skúšaní. Frekvencia drobných epizód hypoglykémie bola vo všetkých liečených skupinách podobná vrátane placeba, s výnimkou skúšania s pridaním sulfonylurey (SU)
a pridaním inzulínovej liečby. Kombinovaná liečba so sulfonylureou a pridaním inzulínu mala vyššiu frekvenciu výskytu hypoglykémie (pozri Hypoglykémia nižšie).
Tabuľkový
zoznam
nežiaducich
reakcií
Nasledujúce nežiaduce reakcie boli zistené v placebom kontrolovaných klinických skúšaniach
s dapagliflozínom plus metformín, v skúšaniach s dapagliflozínom a v skúšaniach s metformínom a zo skúseností po uvedení lieku na trh. Pre žiadnu sa nezistila súvislosť s dávkou. Nežiaduce reakcie
uvedené nižšie sú klasifikované podľa frekvencie a tried orgánových systémov. Kategórie frekvencií
sú definované podľa nasledovných pravidiel: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (nemožno odhadnúť z dostupných údajov).
Tabuľka 1. Nežiaduce reakcie v skúšaniach s dapagliflozínom a metformínom s okamžitým uvoľňovaním a pri používaní lieku po jeho uvedení na trha
Trieda orgánových systémov
Veľmi časté Časté Menej časté Veľmi zriedkavé
Infekcie a nákazy Vulvovaginitída, balanitída
a súvisiace genitálne infekcie*,b,c Infekcia močových ciest*,b,d
Plesňová infekcia**
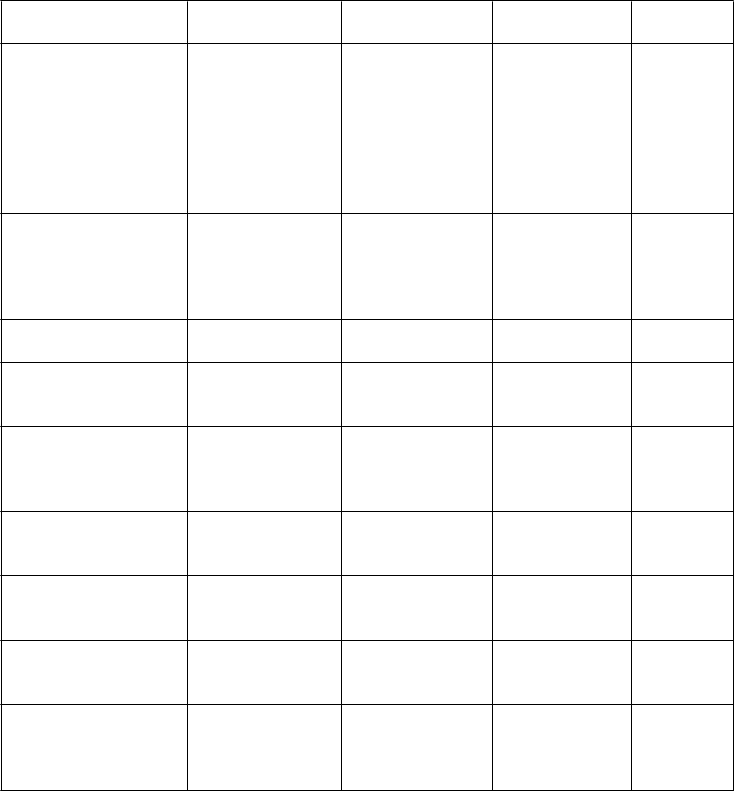 Poruchy metabolizmu a výživy
Poruchy nervového systému
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy kože
a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
Poruchy obličiek a močových ciest
Poruchy reprodukčného systému a prsníkov
Poruchy metabolizmu a výživy
Poruchy nervového systému
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy kože
a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
Poruchy obličiek a močových ciest
Poruchy reprodukčného systému a prsníkov
Hypoglykémia (keď sa použil so SU alebo inzulínom)b
Gastrointestinálne príznakyj,§
Porucha chuti§
Závrat
Bolesť chrbta*
Dysúria
Polyúria*,f
Deplécia objemub,e Smäd
**Zápcha
** Sucho v ústach**
Noktúria
** Porucha funkcie obličiek**,b Vulvovaginálny pruritus** Genitálny pruritus**
Laktátová acidóza Nedostatok vitamínu B12h,§
Poruchy funkcie pečene§ Hepatitída§ Urtikária§ Erytém§ Pruritus§
Trieda orgánových systémov
Veľmi časté Časté Menej časté Veľmi zriedkavé
Laboratórne a funkčné vyšetrenia
Zvýšenie hematokritug Zníženie renálneho
klírensu kreatinínub Dyslipidémiaj
Zvýšenie kreatinínu v krvi**,b Zvýšenie močoviny v krvi** Zníženie
hmotnosti**

aTabuľka ukazuje nežiaduce reakcie z až 24-týždňových (krátkodobé) údajov bez ohľadu na záchrannú liečbu glykémie, okrem tých označených §, pre ktoré nežiaduce reakcie a kategórie frekvencie vychádzajú z informácií, ktoré sú k dispozícii v súhrne charakteristických vlastností lieku pre metformín dostupný v EÚ.
bĎalšie informácie pozri v súvisiacich odsekoch nižšie.
cVulvovaginitída, balanitída a súvisiace genitálne infekcie zahŕňajú napr. vopred definované preferenčné termíny: vulvovaginálna mykotická infekcia, vaginálna infekcia, balanitída, genitálna mykotická infekcia, vulvovaginálna kandidóza, vulvovaginitída, kandidová balanitída, genitálna kandidóza, genitálna infekcia, genitálna infekcia u mužov, infekcia penisu, vulvitída, bakteriálna vaginitída a absces vulvy.
dInfekcia močových ciest zahŕňa nasledujúce preferenčné termíny uvedené v poradí hlásenej frekvencie: infekcia močových ciest, cystitída, infekcia močových ciest zapríčinená baktériami Escherichia, infekcie urogenitálneho
traktu, pyelonefritída, trigonitída, uretritída, infekcia obličiek a prostatitída.
eDeplécia objemu zahŕňa napr. vopred definované preferenčné termíny: dehydratácia, hypovolémia, hypotenzia.
fPolyúria zahŕňa preferenčné termíny: polakizúria, polyúria, zvýšená tvorba moču.
gPriemerná zmena hematokritu oproti východiskovej hodnote bola 2,30 % pri dapagliflozíne 10 mg oproti
-0,33 % pri placebe. Hodnoty hematokritu > 55 % boli hlásené u 1,3 % jedincov liečených dapagliflozínom
10 mg oproti 0,4 % u jedincov s placebom.
hDlhodobá liečba metformínom bola spojená s poklesom absorpcie vitamínu B12, čo môže veľmi zriedkavo viesť ku klinicky významnému nedostatku vitamínu B12 (napr. megaloblastická anémia).
iGastrointestinálne príznaky, ako sú nauzea, vracanie, hnačka, bolesť brucha a strata chuti do jedla sa najčastejšie vyskytujú na začiatku liečby a vo väčšine prípadov samovoľne vymiznú.
jPriemerná percentuálna zmena z východiskovej hodnoty pre dapagliflozín 10 mg oproti placebu bola
v uvedenom poradí: celkový cholesterol 2,5 % oproti 0,0 %; HDL cholesterol 6,0 % oproti 2,7 %; LDL
cholesterol 2,9 % oproti -1,0 %; triglyceridy -2,7 % oproti -0,7 %.
*Hlásené u ≥ 2 % jedincov a o ≥ 1% častejšie a minimálne u ďalších 3 jedincov liečených s dapagliflozínom
10 mg v porovnaní s placebom.
**Hlásené skúšajúcim ako možno súvisiace, pravdepodobne súvisiace alebo súvisiace so skúmanou liečbou a hlásené u ≥ 0,2 % jedincov a o ≥ 0,1 % častejšie a minimálne u viac ako u 3 jedincov liečených
dapagliflozínom 10 mg v porovnaní s placebom.
PopisvybranýchnežiaducichreakciíDapagliflozínplusmetformínHypoglykémiaV skúšaniach s dapagliflozínom ako prídavnej liečbe k metformínu boli hlásené menej významné epizódy hypoglykémie s podobnou frekvenciou v skupine liečenej dapagliflozínom 10 mg plus
metformín (6,9 %) ako v skupine placebo plus metformín (5,5 %). Nehlásili sa žiadne významné epizódy hypoglykémie.
V 24 týždňovom skúšaní prídavnej liečby k metformínu a sulfonylurey boli u 12,8% jedincov hlásené menej významné epizódy hypoglykémie, ktorí dostávali dapagliflozín 10 mg plus metformín
a sulfonylureu a u 3,7% jedincov, ktorí dostávali placebo plus metformín a sulfonylureu. Neboli hlásené žiadne významné epizódy hypoglykémie.
DapagliflozínHypoglykémiaFrekvencia výskytu hypoglykémie závisela od typu základnej liečby použitej v každom skúšaní.
Pri skúšaniach s dapagliflozínom ako prídavnej liečbe k metformínu alebo ako prídavnej liečbe
k sitagliptínu (s alebo bez metformínu) bola frekvencia menej významných epizód hypoglykémie vo všetkých liečených skupinách vrátane skupiny s placebom podobná (< 5 %) do 102 týždňa liečby. Vo
všetkých skúšaniach bol výskyt významných epizód hypoglykémie menej častý a v skupinách liečených s dapagliflozínom alebo placebom porovnateľný. V skúšaní prídavnej liečby k inzulínu bol pozorovaný vyšší výskyt hypoglykémie (pozri časť 4.5).
V skúšaní prídavnej liečby k inzulínu do 104 týždňa boli významné epizódy hypoglykémie hlásené
u 0,5 % jedincov liečených dapagliflozínom plus inzulín v 24. týždni a u 1,0 % jedincov v 104. týždni a u 0,5 % jedincov v skupine, ktorí dostávali placebo plus inzulín v 24. týždni a 104. týždni. V 24.
a 104. týždni boli menej významné epizódy hypoglykémie hlásené v uvedenom poradí u 40,3 %
a 53,1% jedincov liečených dapagliflozín 10 mg plus inzulín a u 34,0 % a 41,6 % jedincov, ktorí dostávali placebo plus inzulín.
Depléciaobjemu
Reakcie súvisiace s depléciou objemu (vrátane hlásení dehydratácie, hypovolémie alebo hypotenzie)
boli hlásené u 1,1 % jedincov užívajúcich dapagliflozín 10 mg a u 0,7 % jedincov užívajúcich placebo; závažné reakcie sa vyskytli u < 0,2 % jedincov a ich výskyt pri použití dapagliflozínu 10 mg a placeba bol vyrovnaný (pozri časť 4.4).
Vulvovaginitída,balanitídaasúvisiacegenitálneinfekcie
Vulvovaginitída, balanitída a súvisiace genitálne infekcie boli hlásené u 5,5 % jedincov užívajúcich dapagliflozín 10 mg a u 0,6 % jedincov, ktorí dostávali placebo. Väčšina infekcií bola mierna až stredne závažná a jedinci odpovedali na úvodnú štandardnú liečbu a zriedkavo vyústili do ukončenia liečby dapagliflozínom. Tieto infekcie boli častejšie u žien (8,4 % a 1,2 % pre dapagliflozín a placebo, v uvedenom poradí) a u jedincov s infekciami v anamnéze bola pravdepodobnosť rekurentných infekcií väčšia.
Infekciemočovýchciest
Infekcie močových ciest boli častejšie hlásené pre dapagliflozín 10 mg v porovnaní s placebom (4,7 %
oproti 3,5 % v uvedenom poradí; pozri časť 4.4). Väčšina infekcií bola mierna až stredne závažná a jedinci odpovedali na úvodnú štandardnú liečbu a zriedkavo viedli k ukončeniu liečby dapagliflozínom. Tieto infekcie boli častejšie u žien a u jedincov s infekciami v anamnéze bola pravdepodobnosť rekurentných infekcií väčšia.
Zvýšený kreatinín
Nežiaduce reakcie lieku týkajúce sa zvýšeného kreatinínu boli zoskupené (napr. znížený renálny klírens kreatinínu, porucha funkcie obličiek, zvýšená hladina kreatinínu v krvi a znížená rýchlosť glomerulárnej filtrácie). Toto zoskupenie reakcií bolo hlásené u 3,2 % pacientov, ktorí dostávali dapagliflozín 10 mg a u 1,8 % pacientov, ktorí dostávali placebo. U pacientov s normálnou funkciou obličiek alebo s miernou poruchou funkcie obličiek (východisková hodnota eGFR ≥
60 ml/min/1,73m2) bolo toto zoskupenie reakcií hlásené u 1,3 % pacientov, ktorí dostávali
dapagliflozín 10 mg a u 0,8 % pacientov, ktorí dostávali placebo. Tieto reakcie boli častejšie u pacientov s východiskovou hodnotou eGFR ≥30 a <60 ml/min/1,73m2 (18,5 % pri dapagliflozíne
10 mg oproti 9,3 % pri placebe).
Ďalšie hodnotenie pacientov, u ktorých sa vyskytli nežiaduce udalosti týkajúce sa obličiek, preukázalo, že väčšina z nich mala zmeny sérového kreatinínu ≤ 0,5 mg/dl oproti východiskovej hodnote. Zvýšenia kreatinínu boli zvyčajne prechodné počas kontinuálnej liečby alebo reverzibilné po ukončení liečby.
Parathormón(PTH)
Pozorovalo sa malé zvýšenie hladín PTH v sére s väčším zvýšením u jedincov s vyššou základnou koncentráciou PTH. Meranie kostnej denzity u pacientov s normálnou alebo miernou poruchou
funkcie obličiek nepreukázalo úbytok kostnej hmoty počas liečby po dobu dvoch rokov.
Malignity
Počas klinických skúšaní bol celkový podiel jedincov s malígnymi alebo nešpecifikovanými nádormi podobný u liečených dapagliflozínom (1,50 %) ako u liečených placebom/komparátorom (1,50 %),
a údaje u zvierat nenaznačujú karcinogenitu alebo mutagenitu (pozri časť 5.3). Pri zvažovaní prípadov
vyskytujúcich sa nádorov v rôznych orgánových systémoch bolo relatívne riziko spojené
s dapagliflozínom viac ako 1 u niektorých typov nádorov (močový mechúr, prostata, prsník) a menej ako 1 pre iné (napr. krv a lymfatický, ovariálny, renálny trakt), ktorého výsledkom nebolo celkové zvýšenie rizika vzniku nádorov spojených s dapagliflozínom. Zvýšenie/zníženie rizika nebolo štatisticky významné v žiadnom z orgánových systémov. Vzhľadom na nedostatok nálezov nádorov
v neklinických skúšaniach rovnako, ako krátka latencia medzi prvou expozíciou lieku a diagnostikou nádoru, je považovaná príčinná súvislosť za nepravdepodobnú. Musí sa zvažovať s opatrnosťou vzhľadom na numerickú nerovnováhu nádorov prsníka, močového mechúra a prostaty, čo bude ďalej skúmané v postmarketingových štúdiách.
OsobitnéskupinypacientovStaršípacienti(≥ 65rokov)U jedincov vo veku ≥ 65 rokov sa hlásili nežiaduce reakcie súvisiace s poškodením funkcie obličiek alebo zlyhaním obličiek u 7,7 % jedincov liečených dapagliflozínom a u 3,8 % jedincov dostávajúcich
placebo (pozri časť 4.4). Najčastejšie hlásenou nežiaducou reakciou súvisiacou s funkciou obličiek
bolo zvýšenie kreatinínu v sére. Väčšina týchto reakcií bola prechodná a reverzibilná. U jedincov vo veku ≥ 65 rokov boli nežiaduce reakcie deplécie objemu, najčastejšie hlásené ako hypotenzia, sa zaznamenali u 1,7 % jedincov liečených dapagliflozínom a u 0,8 % jedincov dostávajúcich placebo (pozri časť 4.4).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieOdstránenie dapagliflozínu hemodialýzou sa nesledovalo. Najúčinnejší spôsob odstránenia metformínu a laktátu je hemodialýza.
DapagliflozínNepreukázala sa žiadna toxicita dapagliflozínu u zdravých jedincov užívajúcich jednotlivé dávky až do 500 mg perorálne (50-násobok maximálnej odporúčanej dávky u ľudí). Títo jedinci mali glukózu detegovateľnú v moči po dobu, ktorá závisela od dávky (najmenej 5 dní pri dávke 500 mg), bez hlásení dehydratácie, hypotenzie alebo nerovnováhy elektrolytov a bez klinicky významného účinku na QTc interval. Výskyt hypoglykémie bol podobný ako pri placebe. V klinických skúšaniach
s podávaním dávok jedenkrát do 100 mg denne (10-násobok maximálnej odporúčanej dávky u ľudí) počas 2 týždňov zdravým jedincom a jedincom s diabetes mellitus 2. typu, bol výskyt hypoglykémie v porovnaní s placebom mierne vyšší a nebol závislý od dávky. Výskyt nežiaducich udalostí vrátane dehydratácie alebo hypotenzie bol podobný ako pri placebe a nezistili sa žiadne klinicky významné zmeny výsledkov laboratórnych vyšetrení vrátane hodnôt elektrolytov v sére a biomarkerov funkcie obličiek v závislosti od dávky.
V prípade predávkovania je v závislosti od klinického stavu pacienta potrebné zahájiť vhodnú podpornú liečbu.
MetformínZávažné predávkovanie metformínom (alebo koexistujúce riziká laktátovej acidózy) môže viesť k laktátovej acidóze. Laktátová acidóza je naliehavá medicínska udalosť, ktorá sa musí liečiť
v nemocnici.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antidiabetiká, kombinácia perorálnych antidiabetík, ATC kód: A10BD15
Mechanizmusúčinku
Ebymect kombinuje dve antihyperglykemické látky s rozdielnym a komplementárnym mechanizmom účinku na zlepšenie kontroly glykémie u pacientov s diabetom 2. typu: dapagliflozín, inhibítor sodíkoglukózového kotransportéra 2 (SGLT2) a metformíniumchlorid, člen skupiny biguanidov.
Dapagliflozín
Dapagliflozín je vysoko účinným (Ki: 0,55 nM), selektívnym a reverzibilným inhibítorom sodíkoglukózového kotransportéra 2 (SGLT2).
SGLT2 je selektívne exprimovaný v obličkách bez expresie zisťovanej vo viac ako 70 ďalších tkanivách vrátane pečene, kostrového svalstva, adipózneho tkaniva, prsníka, močového mechúra
a mozgu. SGLT2 je hlavným transportérom zodpovedným za reabsorpciu glukózy z glomerulárneho filtrátu späť do krvného obehu. Napriek prítomnosti hyperglykémie pri diabete 2. typu reabsorpcia
prefiltrovanej glukózy naďalej pokračuje. Dapagliflozín zlepšuje plazmatickú hladinu glukózy nalačno aj po jedle znižovaním reabsorpcie glukózy obličkami, čo vedie k vylučovaniu glukózy močom. Toto vylučovanie glukózy (glykozúria) je pozorované po prvej dávke, pretrváva počas 24 hodinového
intervalu dávkovania a udržiava sa počas trvania liečby. Množstvo glukózy odstránenej obličkami prostredníctvom tohto mechanizmu účinku závisí od koncentrácie glukózy v krvi a od GFR.
V odpovedi na hypoglykémiu dapagliflozín nezhoršuje normálnu endogénnu tvorbu glukózy. Dapagliflozín pôsobí nezávisle od sekrécie a účinku inzulínu. V klinických skúšaniach
s dapagliflozínom sa pozorovalo zlepšenie funkcie beta buniek hodnotením pomocou modelu homeostázy (Homeostasis Model Assessment-β, HOMA-β).
Vylučovanie glukózy močom (glykuréza) navodené dapagliflozínom súvisí s kalorickou stratou a so znížením telesnej hmotnosti. Inhibícia glukózy a kontrasportu sodíka dapagliflozínom je spojená
s miernou diurézou a prechodnou natriurézou.
Dapagliflozín neinhibuje iné transportéry dôležité pre transport glukózy do periférnych tkanív a je
> 1 400-násobne selektívnejší pre SGTL2 ako pre SGTL1, hlavný transportér v čreve zodpovedný za absorpciu glukózy.
Metformín
Metformín je biguanid s antihyperglykemickými účinkami, ktorý znižuje bazálnu aj postprandiálnu plazmatickú glukózu. Nestimuluje sekréciu inzulínu a preto nespôsobuje hypoglykémiu.
Metformín môže účinkovať troma mechanizmami:
- znížením tvorby hepatálnej glukózy inhibíciou glukoneogenézy a glykogenolýzy,
- zlepšením periférneho vychytávania a využitia glukózy vo svaloch miernym zvýšením citlivosti na inzulín,
- spomalením absorpcie glukózy v črevách.
Metformín stimuluje intracelulárnu syntézu glykogénu pôsobením na glykogénsyntázu. Metformín zvyšuje transportnú kapacitu špecifických typov membránových transportérov glukózy (GLUT-1
a GLUT-4).
Farmakodynamickéúčinky
Dapagliflozín
Po podaní dapagliflozínu sa u zdravých jedincov a u jedincov s diabetes mellitus 2. typu pozorovalo zvýšené množstvo glukózy v moči. Pri dávke dapagliflozínu 10 mg denne počas 12 týždňov
u jedincov s diabetes mellitus 2. typu sa močom vylúčilo približne 70 g glukózy (čo zodpovedá
280 kcal/deň). U pacientov s diabetes mellitus 2. typu, ktorým sa podával dapagliflozín 10 mg/deň až
2 roky, sa pozorovalo trvalé vylučovanie glukózy.
Pri dapagliflozíne malo vylučovanie glukózy močom za následok aj osmotickú diurézu a zvýšenie objemu moču u pacientov s diabetes mellitus 2. typu. Zvýšenie objemu moču u pacientov s diabetes mellitus 2. typu liečených dapagliflozínom 10 mg zostalo zachované po 12 týždňoch a predstavovalo približne 375 ml/deň. Zvýšenie objemu moču sa spájalo s malým a prechodným zvýšením vylučovania sodíka močom, ktoré nesúviselo so zmenami koncentrácií sodíka v sére.
Prechodne (3 až 7 dní) sa zvýšilo aj vylučovanie kyseliny močovej močom a bolo sprevádzané pretrvávajúcim poklesom koncentrácie kyseliny močovej v sére. Po 24 týždňoch sa pokles koncentrácie kyseliny močovej v sére pohyboval v rozmedzí -48,3 až -18,3 mikromolov/l (-0,87 až -
0,33 mg/dl).
Farmakodynamika dapagliflozínu 5 mg podávaného dvakrát denne a dapagliflozínu 10 mg podávaného jedenkrát denne sa porovnávala u zdravých jedincov. Ustálená inhibícia reabsorpcie glukózy a množstvo glukózy vylúčené močom počas 24-hodinového obdobia boli pri obidvoch dávkovacích režimoch rovnaké.
Metformín
U ľudí má metformín, nezávisle od jeho účinku na glykémiu, priaznivé účinky na metabolizmus lipidov. Tieto účinky sa preukázali pri terapeutických dávkach v kontrolovaných strednodobých alebo dlhodobých klinických skúšaniach: metformín znižuje hladiny celkového cholesterolu, LDL cholesterolu a triglyceridov.
V klinických skúšaniach bolo užívanie metformínu spojené buď s udržiavaním stabilnej váhy, alebo jej miernym znížením.
Klinickáúčinnosťabezpečnosť
Súbežné podávanie dapagliflozínu a metformínu sa skúmalo u jedincov s diabetom typu 2, ktorí neboli
dostatočne kontrolovaní metformínom samotným alebo v kombinácii s inhibítorom DPP-4 (sitagliptín), sulfonylureou alebo s inzulínom. Liečba dapagliflozínom plus metformín pri všetkých dávkach vyvoláva klinicky a štatisticky významné zlepšenia HbA1c a plazmatickej hladiny glukózy nalačno v porovnaní s placebo v kombinácií s metformínom. Tieto klinicky významné účinky na glykémiu pretrvávali počas dlhodobého horizontu rozšírenia až do 104 týždňov. Zníženia HbA1c sa pozorovali vo všetkých podskupinách vrátane pohlavia, veku, rasy, dĺžky trvania ochorenia
a východiskovej hodnoty indexu telesnej hmotnosti (body mass index, BMI). Pri kombinovaných liečbach s dapagliflozínom a metformínom sa v 24. týždni tiež pozorovali klinicky a štatisticky
významné zlepšenia v priemerných zmenách telesnej hmotnosti oproti východiskovej hodnote v
porovnaní s kontrolnou liečbou. Zníženia telesnej hmotnosti sa dlhodobo udržali až do 208 týždňov. Okrem toho sa liečba dapagliflozínom dvakrát denne ako prídavná liečba k metformínu preukázala
ako účinná a bezpečná u jedincov s diabetom typu 2. Okrem toho sa uskutočnili dve 12-týždňové,
placebom kontrolované štúdie u pacientov s nedostatočne kontrolovaným diabetom 2. typu a hypertenziou.
Kontrolaglykémie
V 52-týždňovom aktívne kontrolovanom skúšaní non-inferiority (s 52 a 104-týždňovým obdobím predĺženia) sa hodnotil dapagliflozín 10 mg ako prídavná liečba k metformínu v porovnaní so
sulfonylureou (glipizid) ako prídavnej liečbe k metformínu u jedincov s nedostatočnou kontrolou
glykémie (HbA1c > 6,5 % a ≤ 10 %). Výsledky v porovnaní s glipizidom preukázali podobný priemerný pokles HbA1c od východiskovej hodnoty do 52. týždňa, čím sa preukázala non-inferiorita
(tabuľka 2). V 104. týždni bola upravená hodnota priemernej zmeny HbA1c z východiskovej hodnoty
-0,32 % pri dapagliflozíne a -0,14 % pri glipizide. V 208. týždni bola priemerná zmena od východiskovej hodnoty v HbA1c -0,10% pre dapagliflozín a 0,20% pre glipizid. V 52., 104.
a 208. týždni sa v signifikantne menšom podiele jedincov v skupine liečenej dapagliflozínom (3,5 %,
4,3 % a 5,0% v uvedenom poradí) objavila minimálne jedna príhoda hypoglykémie v porovnaní so skupinou liečenou glipizidom (40,8 %, 47 % a 50,0 % v uvedenom poradí). Podiel jedincov, ktorí
v skúšaní zostali v 104. a 208. týždni, bol 56,2 % a 39,7 % pri skupine liečenej dapagliflozínom a 50,0 % a 34,6 % pri skupine liečenej glipizidom.
Tabuľka 2. Výsledky v 52. týždni (LOCFa) v aktívne kontrolovanom skúšaní porovnávajúcom dapagliflozín s glipizidom ako prídavnej liečbe k metformínu
Parameter
Dapagliflozín
+ metformín
Glipizid
+ metformín

 N
Nb 400 401
HbA1c (%)

Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Odlišnosť od glipizidu + metformínc
(95% IS)
Telesná hmotnosť (kg) Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Odlišnosť od glipizidu + metformínc
(95% IS)
7,69
-0,52
0,00d
(-0,11; 0,11)
88,44
-3,22
-4,65*
(-5,14; -4,17)
7,74
-0,52
87,60
1,44


aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii
bRandomizovaní a liečení jedinci, u ktorých sa meranie účinnosti vykonalo na začiatku a najmenej jedenkrát po základnom hodnotení účinnosti
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty
d Non-inferiórne voči glipizid + metformín
*hodnota p < 0,0001
Dapagliflozín ako prídavná liečba buď k metformínom osamote, metformínu v kombinácii so sitagliptínom, sulfonylureou alebo s inzulínom (s ďalším perorálnymi antidiabetikami vrátane metformínu alebo bez nich ) viedol k štatisticky významným priemerným zníženiam HbA1c v 24. týždni v porovnaní s jedincami, ktorí dostávali placebo (p < 0,0001; tabuľka 3, 4 a 5). Dapagliflozín
5 mg dvakrát denne spôsobil štatisticky signifikantné zníženia HbA1c v 16. týždni v porovnaní s jedincami, ktorí dostávali placebo (p < 0,0001; tabuľka 3).
V skúšaniach prídavnej kombinácie zníženia HbA1c pozorované v 24. týždni pretrvávali. Pri skúšaní prídavnej liečby k metformínu zníženia HbA1c pretrvávali počas 102. týždňa (upravený priemer zmeny od východiskovej hodnoty pri dapagliflozíne 10 mg -0,78 % a 0,02 % pri placebe). V 48. týždni pri metformíne plus sitagliptín bola upravená priemerná zmena od východiskovej hodnoty -
0,44 % pri dapagliflozíne 10 mg a 0,15 % pri placebe. V 104. týždni pri inzulíne (s ďalšími perorálnymi antidiabetikami vrátane metformínu alebo bez nich) boli zníženia HbA1c -0,71 % pri
upravenej priemernej zmene od východiskovej hodnoty dapagliflozíne 10 mg a -0,06 % pri placebe.
V 48. a 104. týždni zostala dávka inzulínu stabilná v porovnaní s východiskovou hodnotou u jedincov liečených dapagliflozínom 10 mg, s priemernou dávkou 76 IU/deň. V skupine s placebom sa objavilo
zvýšenie od východiskovej hodnoty o 10,5 IU/deň v 48. týždni a o 18,3 IU/deň v 104. týždni (stredná
hodnota priemernej dávky 84 a 92 IU/deň). Podiel jedincov, ktorí zostali v skúšaní v 104. týždni, bol
72,4 % pri skupine liečenej dapagliflozínom 10 mg a 54,8 % pri skupine s placebom.
V separátnej analýze jedincov používajúcich inzulín plus metformín sa pozorovali podobné zníženia
HbA1C ako boli pozorované v celej skúšanej populácii u jedincov liečených dapagliflozínom
s inzulínom plus metformín. V 24. týždni bola zmena HbA1c od východiskovej hodnoty u jedincov liečených dapagliflozínom plus inzulín s metformínom -0,93 %.
Tabuľka 3. Výsledky (LOCFa) placebom kontrolovaným skúšaní až do 24. týždňa dapagliflozínu ako prídavnej liečby v kombinácii s metformínom alebo s metformínom plus sitagliptín
kombinácia s prídavnou liečbou
Metformín1 Metformín1, b Metformín1 + sitagliptín2
Dapagliflozín
10 mg QD
Placebo
QD
Dapagliflozín
5 mg BID
Placebo
BID
Dapagliflozín
10 mg QD
Placebo
QD
Nc 135 137 99 101 113 113
HbA1c (%)
Východisková hodnota
(priemer)
Zmena
od východisko vej hodnotyd Odlišnosť od placebad
(95 % IS) Jedinci (%) dosahujúci: HbA1c < 7 %
Upravené na
7,92
-0,84
-0,54*
(-0,74; -0,34)
8,11
-0,30
7,79
-0,65
-0,35*
(-0,52; -0,18)
7,94
-0,30
7,80
-0,43
-0,40*
(-0,58; -0,23)
7,87
-0,02
východiskovú hodnotu
Telesná
40,6** 25,9 38,2**
(N = 90)
21,4 (N = 87)
hmotnosť (kg) Východisková hodnota (priemer) Zmena
od východisko vej hodnotyd Odlišnosť od placebad
(95 % IS)
86,28
-2,86
-1,97*
(-2,63; -1,31)
87,74
-0,89
93,62
-2,74
-1,88***
(-2,52; -1,24)
88,82
-0,86
93,95
-2,35
-1,87*
(-2,61; -1,13)
94,17
-0,47

Skratky: QD: jedenkrát denne; BID: dvakrát denne
1metformín ≥ 1500 mg/deň; 2sitagliptín 100 mg/deň
aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred záchranou liečbou u zachránených jedincov)
bplacebom kontrolované 16-týždňové skúšanie
cvšetci randomizovaní pacienti, ktorí užili minimálne jednu dávku dvojito zaslepeného skúšaného lieku počas krátkodobého dvojito zaslepeného skúšania
dpriemer najmenších štvorcov upravený na východiskovú hodnotu
*hodnota p < 0,0001 v porovnaní s placebom + perorálne antidiabetikum
**hodnota p < 0,05 v porovnaní s placebom + perorálne antidiabetikum
***percentuálne vyjadrenie zmeny v telesnej hmotnosti bolo analyzované ako kľúčový sekundárny cieľový ukazovateľ
(p < 0,0001); absolútna zmena v telesnej hmotnosti (v kg) bola analyzovaná s nominálnou hodnotou p (p < 0,0001).
Tabuľka 4. Výsledky 24-týždňového placebom kontrolovaného skúšania dapagliflozínu v prídavnej kombinovanej liečbe s metformínom a sulfonylureou
 Prídavná kombináciaSulfonylurea+ Metformín
Prídavná kombináciaSulfonylurea+ Metformín1
Dapagliflozín
10 mg
Placebo
Na 108 108
HbA1c (%)b
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Rozdiel oproti placebuc
(95 % IS)
Jedinci (%) dosahujúci: HbA1c < 7 %
8,08
-0,86
−0,69*
(−0,89, −0,49)
8,24
-0,17
Upravený podľa východiskovej hodnoty
Telesná hmotnosť (kg)
31,8* 11,1
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Rozdiel oproti placebuc
(95 % IS)
88,57
-2,65
−2,07*
(−2,79, −1,35)
90,07
-0,58







1 Metformín (formulácie s okamžitým alebo predĺženým uvoľňovaním) ≥1500 mg/deň plus maximálne tolerovaná dávka sulfonylurey, ktorá musí byť aspoň polovica maximálnej dávky po dobu najmenej
8 týždňov pred vstupom do štúdie.
a Randomizovaní a liečení pacienti s východiskovou hodnotou a s najmenej jedným povýchodiskovým meraním účinnosti.
b HbA1c analyzovaní LRM (Analýza longitudinálnych opakovaných meraní)
c cPriemer najmenších štvorcov upravený na východiskovú hodnotu
* p-hodnota < 0,0001 oproti placebu + perorálne antidiabetiká

Tabuľka 5. Výsledky v 24. týždni (LOCFa) v placebom kontrolovanom skúšaní dapagliflozínu v kombinácii s inzulínom (osamote alebo s perorálnymi antidiabetikami vrátane metformínu)
Dapagliflozín 10 mg
+ inzulín
Placebo
+ inzulín
Parameter
±
perorálne
antidiabetíká
2
±
perorálne
antidiabetíká
2
Nb 194 193
 HbA1c (%)
HbA1c (%)
Východisková hodnota
(priemer)
Zmena od východiskovej hodnotyc
Odlišnosť od placebac
(95 % IS)
 Telesná hmotnosť (kg)
Telesná hmotnosť (kg) Východisková hodnota (priemer)
Zmena od východiskovej hodnotyc

Odlišnosť od placebac
(95 % IS)
Priemerná denná dávka inzulínu (IU)1
Východisková hodnota
(priemer)
Zmena od východiskovej hodnotyc
Odlišnosť od placebac
(95 % IS)
Jedinci so znížením priemernej dennej dávky
inzulínu o minimálne
10 % (%)
8,58
-0,90
-0,60*
(-0,74; -0,45)
94,63
-1,67
-1,68*
(-2.19; -1.18)
77,96
-1,16
-6,23*
(-8,84; -3,63)
19,7**
8,46
-0,30
94,21
0,02
73,96
5,08
11,0

aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred dátumom prvej vzostupnej titrácie, ak bola potrebná)
bvšetci randomizovaní jedinci, ktorí užili minimálne jednu dávku dvojito zaslepeného skúšaného lieku počas krátkodobého obdobia dvojitého zaslepenia
cpriemer najmenších štvorcov upravený na východiskovú hodnotu a prítomnosť perorálneho antidiabetika
*hodnota p < 0,0001 v porovnaní s placebom + inzulín ± perorálne antidiabetikum
**hodnota p < 0,05 v porovnaní s placebom + inzulín ± perorálne antidiabetikum
1vzostupná titrácia inzulínových režimov (vrátane inzulínu s krátkodobým účinkom, stredne dlhým účinkom a bazálneho inzulínu) bola dovolená v prípade, ak jedinci splnili vopred definované kritéria FPG
2päťdesiat percent jedincov používalo liečbu inzulínom v monoterapii na začiatku; 50 % užívalo 1 alebo
2 perorálne antidiabetíká ako prídavok k inzulínu: v druhej skupine užívalo 80 % metformín osamote,
12 % užívalo metformín plus liečbu sulfonylureou a zvyšok pacientov užíval iné perorálne antidiabetiká.
Plazmatická hladina glukózy nalačnoLiečba dapagliflozínom ako prídavnej liečby buď k metformínu osamote (dapagliflozín 10 mg QD
alebo dapagliflozín 5 mg BID) alebo metformínu plus sitagliptín, sulfonylurea alebo inzulínu viedla
k štatisticky významným zníženiam v plazmatickej hladine glukózy nalačno (-1,90 až -1,20 mmol/l [-
34,2 až -21,7 mg/dl]) v porovnaní s placebom (-0,58 až 0,18 mmol/l [-10,4 až 3,3 mg/dl]) v 16. týždni
(5 mg BID) alebo 24. týždni. Tento účinok sa pozoroval v 1. týždni liečby a v predĺžených skúšaniach sa udržal až do 104. týždňa.
Hladina glukózy po jedle
Liečba dapagliflozínom 10 mg ako prídavnej liečby k sitagliptínu plus metformín viedla k zníženiam v hladinám glukózy po jedle po 2 hodinách v 24. týždni a zníženia sa udržali až do 48. týždňa.
Telesnáhmotnosť
Dapagliflozín ako prídavná liečba k metformínu osamote alebo k metformínu plus sitagliptín, sulfonylurea alebo k inzulínu (s ďalšími perorálnymi antidiabetikami vrátane metformínu alebo bez nich) viedla k štatisticky významnému zníženiu telesnej hmotnosti až do 24. týždňa (p < 0,0001, tabuľka 3, 4 a 5). Tieto účinky pretrvávali v dlhodobých skúšaniach. V 48. týždni bola odlišnosť pri dapagliflozíne ako prídavnej liečby k metformínu plus sitagliptín v porovnaní s placebom -2,07 kg. V 102. týždni bola odlišnosť pri dapagliflozíne ako prídavnej liečby k metformínu v porovnaní
s placebom -2,14 alebo ako prídavnej liečby k inzulínu v porovnaní s placebom -2,88 kg.
Ako prídavná liečba k metformínu v aktívne kontrolovanom skúšaní non-inferiority, dapagliflozín viedol k štatisticky významnej zmene v telesnej hmotnosti v porovnaní s glipizidom o -4,65 kg v 52. týždni (p < 0,0001, tabuľka 2), ktorá v 104. a 208. týždni pretrvávala (-5,06 kg a -4.38 kg v uvedenom poradí).
24-týždňové skúšanie u 182 jedincov s diabetom, u ktorých sa na zhodnotenie zloženia tela použila dvojenergetická röntgenová absorpciometria (DXA), sa pri dapagliflozíne 10 mg plus metformín
v porovnaní s placebom plus metformín preukázalo skôr zníženie telesnej hmotnosti a množstva telesného tuku, na základe merania pomocou DXA, ako chudého tkaniva alebo úbytku tekutín. Liečba dapagliflozínom 10 mg plus metformín preukázala početný úbytok viscerálneho adipózneho tkaniva
v porovnaní s liečbou placebom plus metformín v podskúšaní s použitím zobrazovania pomocou magnetickej rezonancie.
Krvnýtlak
Vo vopred špecifikovanej združenej analýze 13 placebom kontrolovaných skúšaní viedla liečba dapagliflozínom 10 mg k zmene v systolickom krvnom tlaku z východiskovej hodnoty o -3,7 mmHg a diastolického krvného tlaku o -1,8 mmHg v porovnaní s -0,5 mmHg pri systolickom a -0,5 mmHg diastolickom krvnom tlaku v skupine s placebom v 24. týždni. Rovnaké poklesy sa pozorovali až do
104. týždňa.
V dvoch 12-týždňových, placebom kontrolovaných štúdiách bolo liečených dapagliflozínom 10 mg alebo placebom celkovo 1 062 pacientov s nedostatočne kontrolovaným diabetom 2. typu a hypertenziou (aj napriek predchádzajúcej stabilnej liečbe ACE-I alebo ARB v jednej štúdii a ACE-I alebo ARB plus jedno ďalšie antihypertenzívum v druhej štúdii). V 12. týždni u oboch štúdií dapagliflozín v dávke 10 mg spolu so zvyčajným antidiabetikom vyvolali zlepšenie HbA1c a znížili placebom korigovaný systolický krvný tlak v priemere o 3,1 a 4,3 mmHg, v uvedenom poradí.
Kardiovaskulárnabezpečnosť
V klinickom programe sa vykonala meta-analýza kardiovaskulárnych udalostí. V klinickom programe bolo 34,4 % jedincov s kardiovaskulárnym ochorením v anamnéze (okrem hypertenzie) na začiatku
a 67,9 % malo hypertenziu. Kardiovaskulárne epizódy boli posudzované nezávislou posudkovou komisiou. Primárnym cieľovým ukazovateľom bol čas do výskytu prvej udalosti jedného
z nasledovných výsledkov: kardiovaskulárna smrť, cievna mozgová príhoda, infarkt myokardu (IM)
alebo hospitalizácia pre nestabilnú angínu. Primárne epizódy sa objavili v miere 1,62 % na jeden pacientsky rok u jedincov liečených dapagliflozínom a 2,06 % u jedincov s liečbou porovnávaným liekom na jeden pacientsky rok. Pomer rizika porovnávajúci dapagliflozín s porovnávaným liekom bol
0,79 (95% interval spoľahlivosti [IS]: 0,58; 1,07), naznačujúci, že v tejto analýze sa dapagliflozín nespájal so zvýšením kardiovaskulárneho rizika u pacientov s diabetes mellitus 2. typu.
Kardiovaskulárna smrť, IM a cievna mozgová príhoda sa pozorovali pri pomere rizika
0,77 (95% IS: 0,54; 1,10).
PacientisvýchodiskovouhodnotouHbA1c≥ 9 %
Vo vopred špecifikovanej analýze jedincov s východiskovou hodnotou HbA1c ≥ 9,0 % viedla liečba dapagliflozínom 10 mg k štatisticky významným zníženiam HbA1c v 24. týždni ako prídavku
k metformínu (upravená priemerná zmena od východiskovej hodnoty: -1,32 % pre dapagliflozín a -
0,53 % pre placebo).
Metformín
Prospektívna randomizovaná štúdia (UKPDS) preukázala dlhodobý prínos intenzívnej kontroly glukózy pri diabete 2. typu. Analýza výsledkov u pacientov s nadváhou liečených metformínom po zlyhaní liečby samotnou diétou preukázala:
- signifikantné zníženie absolútneho rizika akejkoľvek komplikácie súvisiacej s diabetom
v skupine s metformínom (29,8 prípadov/1 000 pacientskych rokov) oproti skupine so samotnou diétou (43,3 prípadov/1 000 pacientskych rokov), p = 0,0023 a oproti skupinám
s kombinovanou liečbou sulfonylureou a monoterapiou inzulínom (40,1 prípadov/1 000
pacientskych rokov), p = 0,0034;
- signifikantné zníženie absolútneho rizika akejkoľvek mortality súvisiacej s diabetom: metformín
7,5 prípadov/1 000 pacientskych rokov, samotná diéta 12,7 prípadov/1 000 pacientskych rokov, p = 0,017;
- signifikantné zníženie absolútneho rizika celkovej mortality: metformín 13,5 prípadov/1 000
pacientskych rokov oproti samotnej diéte 20,6 prípadov/1 000 pacientskych rokov, (p = 0,011)
a oproti skupinám s kombinovanou liečbou sulfonylureou a monoterapiou inzulínom
18,9 prípadov/1 000 pacientskych rokov (p = 0,021);
- signifikantné zníženie absolútneho rizika infarktu myokardu: metformín 11 prípadov/1 000
pacientskych rokov, samotná diéta 18 prípadov/1 000 pacientskych rokov, (p = 0,01).
Pediatrickápopulácia
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií s liekom Ebymect vo všetkých podskupinách pediatrickej populácie pre diabetes mellitus 2. typu (informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Kombinované tablety Ebymect sú považované za bioekvivalentné so súbežným podávaním zodpovedajúcich dávok dapagliflozínu a metformíniumchloridu podávaných spolu vo forme jednotlivých tabliet.
Porovnávali sa farmakokinetiky dapagliflozínu 5 mg dvakrát denne a dapagliflozínu 10 mg jedenkrát denne u zdravých jedincov. Podávanie dapagliflozínu 5 mg dvakrát denne poskytlo podobné celkové expozície (AUCss) počas 24 hodín ako dapagliflozín 10 mg podávaný jedenkrát denne. Tak ako sa očakávalo, podávanie dapagliflozínu 5 mg dvakrát denne viedlo k nižším maximálnym plazmatickým koncentráciám (Cmax) a vyšším minimálnym plazmatickým koncentráciám dapagliflozínu (Cmin)
v porovnaní s podávaním dapagliflozínu 10 mg jedenkrát denne.
Interakciasjedlom
Podávanie tohto lieku zdravým dobrovoľníkom po jedle s vysokým obsahom tuku v porovnaní
s podávaním nalačno viedlo k rovnakému rozsahu expozície dapagliflozínu aj metformínu. Strava oneskorila dosiahnutie maximálnej koncentrácie o 1 až 2 hodiny a znížila maximálnu plazmatickú
koncentráciu dapagliflozínu o 29 % a metformínu o 17 %. Tieto zmeny sa nepovažujú za klinicky
významné.
Pediatrickápopulácia
Farmakokinetika v pediatrickej populácii sa neskúmala.
Nasledujúce informácie odrážajú farmakokinetické vlastnosti jednotlivých liečiv v tomto lieku.
Dapagliflozín
Absorpcia
Dapagliflozín sa rýchlo a dobre absorboval po perorálnom podaní. Maximálne plazmatické koncentrácie dapagliflozínu (Cmax) sa zvyčajne dosiahli do 2 hodín od podania nalačno. Geometrický
priemer hodnôt Cmax a AUCτ dapagliflozínu v rovnovážnom stave po podávaní jednej 10 mg dávky
denne bol 158 ng/ml a 628 ng h/ml v uvedenom poradí. Absolútna biologická dostupnosť dapagliflozínu po perorálnom podaní dávky 10 mg je 78 %.
Distribúcia
Dapagliflozín sa približne z 91 % viaže na bielkoviny. Väzba na bielkoviny ostala pri rôznych chorobných stavoch nezmenená (napr. pri poruche funkcie obličiek alebo pečene). Priemerný
distribučný objem dapagliflozínu v rovnovážnom stave bol 118 litrov.
Biotransformácia
Dapagliflozín sa extenzívne metabolizuje, hlavne za vzniku dapagliflozín 3-O-glukuronidu, ktorý je inaktívnym metabolitom. Dapagliflozín 3-O-glukuronid alebo ďalšie metabolity sa nepodieľajú na
účinkoch znižujúcich hladinu glukózy. Tvorba dapagliflozín 3-O-glukuronidu je sprostredkovaná
UGT1A9, enzýmom, ktorý sa nachádza v pečeni a v obličkách a metabolizácia sprostredkovaná CYP
bola u ľudí nepatrná.
Eliminácia
Po perorálnom podaní jednej dávky dapagliflozínu 10 mg zdravým jedincom bol priemerný terminálny polčas dapagliflozínu v plazme (t1/2) 12,9 hodín. Priemerný celkový systémový klírens dapagliflozínu podaného intravenózne bol 207 ml/min. Dapagliflozín a súvisiace metabolity sa eliminujú hlavne vylučovaním močom s menej ako 2 % nezmeneného dapagliflozínu. Po podaní
50 mg dávky [14C]-dapagliflozínu sa vylúčilo 96 %, 75 % v moči a 21 % v stolici. V stolici sa približne 15 % dávky vylúčilo v nezmenenej forme.
Linearita
Expozícia dapagliflozínu sa zvyšovala úmerne so zvyšujúcou sa dávkou v rozmedzí 0,1 až 500 mg a jeho farmakokinetika sa pri opakovanom dennom podávaní až 24 týždňov s časom nezmenila.
Osobitnéskupinypacientov
Porucha funkcie obličiek
V rovnovážnom stave (20 mg dapagliflozínu jedenkrát denne počas 7 dní) bola priemerná systémová expozícia dapagliflozínu u pacientov s diabetes mellitus 2.typu a miernou, stredne ťažkou alebo
ťažkou poruchou funkcie obličiek (určené meraním plazmatického klírens iohexolu) o 32 %, 60 %
a 87 % vyššia ako u pacientov s diabetes mellitus 2. typu s normálnou funkciou obličiek. 24-hodinové vylučovanie glukózy močom v rovnovážnom stave značne záviselo od funkcie obličiek a u jedincov
s diabetes mellitus 2. typu s normálnou funkciou obličiek sa vylúčilo 85 g glukózy/deň, u jedincov
s miernou poruchou funkcie obličiek 52 g/deň, so stredne ťažkou poruchou funkcie obličiek 18 g/deň a s ťažkým poškodením funkcie obličiek 11 g/deň. Vplyv hemodialýzy na expozíciu dapagliflozínu nie je známy.
Porucha funkcie pečene
U jedincov s miernou alebo stredne ťažkou poruchou pečene (Child-Pughove triedy A a B) boli priemerné hodnoty dapagliflozínu Cmax o 12 % a AUC o 36 % vyššie ako u zdravých jedincov párových kontrol. Tieto rozdiely sa nepovažujú za klinicky významné. U jedincov s ťažkou poruchou funkcie pečene (Child-Pughova trieda C) boli priemerné hodnoty dapagliflozín Cmax o 40 % a AUC o 67 % vyššie ako u zdravých pacientov párových kontrol.
Starší pacienti (≥ 65 rokov)
Zvýšenie expozície v závislosti od veku nie je klinicky významné u jedincov do 70 rokov. Zvýšenú expozíciu je však možné očakávať kvôli zníženej funkcii obličiek súvisiacej s vekom. Nie sú
k dispozícii dostatočné údaje na vytvorenie záverov o expozícii u pacientov vo veku > 70 rokov.
Pohlavie
Priemerná AUCss dapagliflozínu bola u žien bola odhadnutá o 22 % vyššia ako u mužov.
Rasovápríslušnosť
V systémovej expozícii medzi belochmi, černochmi a aziatmi nie sú klinicky významné rozdiely.
Telesnáhmotnosť
Zistilo sa že expozícia dapagliflozínu za znižuje so zvyšujúcou hmotnosťou. Preto pacienti s nízkou hmotnosťou môžu mať o niečo vyššiu expozíciu a pacienti s vyššou hmotnosťou o niečo nižšiu
expozíciu. Rozdiely v expozícii sa nepovažujú za klinicky významné.
Pediatrickápopulácia
Farmakokinetika sa v pediatrickej populácii nesledovala.
Metformín
Absorpcia
Po podaní perorálnej dávky metformínu sa Tmax dosiahne za 2,5 hodiny. Absolútna biologická dostupnosť 500 mg alebo 850 mg tablety metformínu je u zdravých jedincov približne 50-60 %. Po perorálnej dávke bolo v stolici vylúčených 20-30 % neabsorbovanej frakcie.
Po perorálnom podaní je absorpcia metformínu saturovateľná a neúplná. Predpokladá sa, že farmakokinetika absorpcie metformínu je nelineárna. Pri obvyklých dávkach a dávkovacích schémach metformínu sa rovnovážne plazmatické koncentrácie dosiahnu za 24-48 hodín a sú zvyčajne nižšie ako
1 µg/ml. V kontrolovaných klinických skúškach maximálne plazmatické hladiny (Cmax) metformínu neprekročili 4 µg/ml, a to ani pri maximálnych dávkach.
Distribúcia
Väzba na plazmatické proteíny je zanedbateľná. Metformín preniká do erytrocytov. Maximálna koncentrácia v krvi je nižšia než maximálna plazmatická koncentrácia a dochádza k nej približne v rovnakom čase. Červené krvinky najpravdepodobnejšie predstavujú sekundárny distribučný kompartment. Priemerný Vd sa pohyboval medzi 63-276 l.
Biotransformácia
Metformín sa vylučuje nezmenený močom. U ľudí neboli identifikované žiadne metabolity.
Eliminácia
Renálny klírens metformínu je > 400 ml/min, čo poukazuje na to, že metformín je eliminovaný glomerulárnou filtráciou a tubulárnou sekréciou. Po perorálnej dávke je zjavný konečný polčas
eliminácie približne 6,5 hodiny.
Osobitnéskupinypacientov
Porucha funkcie obličiek
U pacientov so zníženou funkciou obličiek (na základe merania klírensu kreatinínu) je renálny klírens znížený proporcionálne ku klírensu kreatinínu, a preto je polčas eliminácie predĺžený, čo vedie
k zvýšeným hladinám metformínu v plazme.
5.3 Predklinické údaje o bezpečnosti
Súbežnépodávaniedapagliflozínuametformínu
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní neodhalili žiadne osobitné riziko pre ľudí.
Nasledujúce informácie odrážajú predklinické údaje o bezpečnosti jednotlivých liečiv v lieku
Ebymect.
Dapagliflozín
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a fertility neodhalili žiadne osobitné riziko pre ľudí. Dapagliflozín nevyvolal nádory ani u myší alebo potkanov pri žiadnej z dávok hodnotených v rámci dvojročných štúdií karcinogenity.
Reprodukčnátoxicitaatoxicitavývinu
Priame podávanie dapagliflozínu dojčeným mláďatám potkanov a nepriama expozícia v pokročilej brezivosti (v období zodpovedajúcom druhému a tretiemu trimestru gravidity vzhľadom na
dozrievanie obličiek u ľudí) a laktácie sú spojené so zvýšeným výskytom a/alebo závažnosťou
dilatácie obličkovej panvičky a dilatácie tubulov u potomstva.
V skúšaní juvenilnej toxicity, v ktorej sa dapagliflozín podával priamo mladým potkanom od 21. do
90. dňa po narodení, sa zaznamenala dilatácia obličkovej panvičky a tubulov pri všetkých hladinách dávok; expozície mláďat pri najnižšej testovanej dávke boli ≥ 15-násobkom maximálnej odporúčanej dávky u ľudí. Tieto zistenia súviseli so zvýšením hmotnosti obličiek závislým od dávky
a s makroskopickým zväčšením obličiek pozorovaným pri všetkých dávkach. Dilatácia obličkovej panvičky a tubulov pozorovaná u mláďat v priebehu približne 1 mesiaca zotavovania sa nezvrátila
úplne.
V separátnom skúšaní prenatálneho a postnatálneho vývoja sa dapagliflozín podával brezivým samiciam potkanov od gestačného dňa 6 po postnatálny deň 21 a mláďatá boli lieku nepriamo vystavené in utero a počas laktácie. (Vykonalo sa satelitné skúšanie na stanovenie expozície dapagliflozínu v mlieku a u mláďat). Zistil sa zvýšený výskyt alebo závažnosť dilatácie obličkovej panvičky u dospelých potomkov liečených samíc, hoci iba pri najvyšších testovaných dávkach (expozície pre samice-matky predstavovali 1415-násobok maximálnej odporúčanej dávky u ľudí a pre mláďatá 137-násobok maximálnej odporúčanej dávky u ľudí). Ďalšia vývinová toxicita bola obmedzená na zníženie telesnej hmotnosti mláďat v závislosti od dávky a pozorovala sa iba pri dávkach ≥ 15 mg/kg/deň (expozícia mláďat ≥ 29 násobne vyššia ako hodnoty u ľudí pri maximálnych odporúčaných dávkach). Toxicita pre brezivé samice bola zrejmá iba pri najvyšších testovaných dávkach a bola obmedzená na prechodné zníženie telesnej hmotnosti a spotrebu potravy pri danej dávke. Hladina, pri ktorej nebol pozorovaný žiadny nežiaduci účinok (NOAEL) na vývinovú toxicitu, najnižšia testovaná dávka, súvisí so systémovou expozíciou brezivých samíc mnohonásobnej dávke, ktorá je približne 19-násobkom hodnoty u ľudí pri maximálnej odporúčanej dávke.
V ďalších skúšaniach zameraných na embryofetálny vývin potkanov a králikov sa dapagliflozín podával v obdobiach predstavujúcich hlavné obdobia organogenézy u každého z druhov. Pri žiadnej testovanej dávke sa nezistila toxicita pre brezivé samice králikov ani toxicita ovplyvňujúca vývin králikov; najvyššia testovaná dávka súvisí so systémovou expozíciou pri približne 1191-násobku maximálnej odporúčanej dávky u ľudí. U potkanov dapagliflozín nevykazoval ani embryoletálny ani teratogénny účinok pri expozícii do 1441-násobku maximálnej odporúčanej dávky u ľudí.
Metformín
Predklinické údaje pre metformín na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity a vývinu
neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadrotablety: Hydroxypropylcelulóza (E463) Mikrokryštalická celulóza (E460(i)) Magnéziumstearát (E470b)
Sodná soľ karboxymetylškrobu typu A
Filmový
obal: Polyvinylalkohol (E1203) Makrogol 3350 (E1520(iii)) Mastenec (E553b)
Oxid titaničitý (E171) Žltý oxid železitý (E172) Červený oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
PVC/PCTFE/Alu blister. Veľkosti balenia:
14, 28, 56 a 60 filmom obalených tabliet v blistroch bez perforácie.
60 x 1 filmom obalená tableta v blistroch s perforáciou umožňujúcich oddelenie jednotlivej dávky. Viacnásobné balenie obsahujúce 196 (2 balenia po 98) filmom obalených tabliet v blistroch bez perforácie.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
AstraZeneca AB
SE-151 85 Södertälje
Švédsko
8. REGISTRAČNÉ ČÍSLA
EU/1/15/1051/001 5 mg/850 mg 14 tabliet EU/1/15/1051/002 5 mg/850 mg 28 tabliet EU/1/15/1051/003 5 mg/850 mg 56 tabliet EU/1/15/1051/004 5 mg/850 mg 60 tabliet
EU/1/15/1051/005 5 mg/850 mg 60 x 1 tableta (jednotlivá dávka) EU/1/15/1051/006 5 mg/850 mg 196 (2 x 98) tabliet (viacnásobné balenie)
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUEbymect 5 mg/1 000 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá tableta obsahuje monohydrát dapagliflozín propándiolu, čo zodpovedá 5 mg dapagliflozínu a 1 000 mg metformíniumchloridu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAFilmom obalená tableta (tableta).
Žlté, bikonvexné, 10,5 x 21,5 mm oválne filmom obalené tablety s vyrytým označením „5/1000“ na jednej strane a „1069“ na druhej strane.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieEbymect je indikovaný u dospelých vo veku 18 rokov a starších s diabetes mellitus 2. typu ako doplnok k diéte a cvičeniu na zlepšenie kontroly glykémie
• u pacientov nedostatočne kontrolovaných ich maximálnou tolerovanou dávkou samotného
metformínu,
• v kombinácii s inými liekmi znižujúcimi hladinu glukózy vrátane inzulínu, u pacientov nedostatočne kontrolovaných metformínom a týmito liekmi (dostupné údaje o rôznych kombináciách pozri časti 4.4,
4.5 a 5.1),
• u pacientov, ktorí už sú liečení kombináciou jednotlivých tabliet dapagliflozínu a metformínu.
4.2 Dávkovanie a spôsob podávaniaDávkovanieUpacientovnedostatočnekontrolovanýchmetformínomvmonoterapiialebometformínomvkombináciisinýmiliekmiznižujúcimihladinuglukózyvrátaneinzulínuOdporúčaná dávka je jedna tableta dvakrát denne. Každá tableta obsahuje fixnú dávku dapagliflozínu
a metformínu (pozri časť 2). Pacienti nedostatočne kontrolovaní samotným metformínom alebo metformínom v kombinácii s inými liekmi znižujúcimi hladinu glukózy vrátane inzulínu majú dostať celkovú dennú dávku lieku Ebymect zodpovedajúcu 10 mg dapagliflozínu plus celkovú dennú dávku metformínu alebo najbližšiu terapeuticky vhodnú dávku, ktorú už pacient užíva. Keď sa Ebymect používa v kombinácii s inzulínom alebo inzulínové sekretagogum ako je sulfonylurea, môže sa zvážiť nižšia dávka inzulínu alebo sulfonylurey na zníženie rizika hypoglykémie (pozri časti 4.5 a 4.8).
Upacientov,ktoríprechádzajúzkombináciejednotlivýchtablietdapagliflozínuametformínuPacienti, ktorí prechádzajú z kombinácie jednotlivých tabliet dapagliflozínu (celková denná dávka
10 mg) a metformínu na Ebymect majú dostať rovnakú dennú dávku dapagliflozínu a metformínu, ktorú už pacient užíva, alebo najbližšiu terapeuticky vhodnú dávku metformínu.
Osobitné
skupiny
pacientov
Porucha funkcie obličiek
U pacientov s miernou poruchou funkcie obličiek sa úprava dávkovania neodporúča. Tento liek sa nesmie používať u pacientov so stredne ťažkou až ťažkou poruchou funkcie obličiek (pacienti
s klírensom kreatinínu [CrCl] < 60 ml/min alebo odhadovanou glomerulárnou filtráciou [eGFR]
< 60 ml/min/1,73 m2, pozri časti 4.3, 4.4, 4.8, 5.1 a 5.2).
Porucha funkcie pečene
Tento liek sa nesmie používať u pacientov s poruchou funkcie pečene (pozri časti 4.3, 4.4 a 5.2).
Starší pacienti (≥ 65 rokov)
Vzhľadom na to, že metformín sa z časti eliminuje obličkami a pretože u starších pacientov je väčšia pravdepodobnosť, že majú zníženú funkciu obličiek, tento liek sa má so stúpajúcim vekom používať
s opatrnosťou. Monitorovanie funkcie obličiek je potrebné na to, aby napomohlo zabrániť laktátovej acidóze spojenej s metformínom, obzvlášť u starších pacientov (pozri časti 4.3 a 4.4). Pri
dapagliflozíne sa má sa vziať do úvahy riziko deplécie objemu (pozri časti 4.4 a 5.2). Vzhľadom na obmedzenú terapeutickú skúsenosť s dapagliflozínom u pacientov vo veku 75 rokov a starších sa začatie liečby u tejto populácie neodporúča.
Pediatrická populácia
Bezpečnosť a účinnosť lieku Ebymect u detí a dospievajúcich vo veku od narodenia až < 18 rokov neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Ebymect sa má podávať dvakrát denne s jedlom, aby sa obmedzili gastrointestinálne nežiaduce reakcie spojené s metformínom.
4.3 Kontraindikácie
Ebymect je kontraindikovaný u pacientov:
- s precitlivenosťou na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1;
- s diabetickou ketoacidózou, diabetickou prekómou;
- so stredne ťažkou a ťažkou poruchou funkcie obličiek (klírens kreatinínu < 60 ml/min; eGFR
< 60 ml/min/1,73 m2) (pozri časti 4.2, 4.4 a 5.2);
- s akútnymi stavmi, ktoré môžu zmeniť funkciu obličiek, ako je:
- dehydratácia,
- ťažká infekcia,
- šok;
- s akútnym alebo chronickým ochorením, ktoré môže spôsobiť hypoxiu tkaniva, ako je:
- zlyhanie srdca alebo dýchania,
- nedávny infarkt myokardu,
- šok;
- s poruchou funkcie pečene (pozri časti 4.2, 4.4 a 5.2);
- s akútnou otravou alkoholom, alkoholizmom (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
Ebymect sa nemá používať u pacientov s diabetom 1. typu alebo na liečbu diabetickej ketoacidózy.
Laktátováacidóza
Laktátová acidóza je veľmi zriedkavá, ale závažná (vysoká úmrtnosť pri absencii okamžitej liečby) metabolická komplikácia, ktorá sa môže vyskytnúť v dôsledku kumulácie metformínu, zložky tohto lieku. Hlásené prípady laktátovej acidózy u pacientov užívajúcich metformín sa vyskytli predovšetkým u diabetických pacientov so závažným renálnym zlyhaním. Incidencia laktátovej acidózy sa môže a má znížiť aj zhodnotením iných súvisiacich rizikových faktorov, ako sú zle
kontrolovaný diabetes, ketóza, dlhotrvajúce hladovanie, nadmerné požívanie alkoholu, hepatálna insuficiencia a akékoľvek stavy spojené s hypoxiou.
Diagnóza
Pri výskyte nešpecifických príznakov ako sú svalové kŕče s poruchami trávenia, bolesť brucha a závažná asténia sa má zvážiť riziko laktátovej acidózy.
Laktátová acidóza sa vyznačuje acidotickým dyspnoe, bolesťou brucha a hypotermiou, ktoré vyúsťujú do kómy. Diagnostické laboratórne nálezy sú znížené pH krvi, hladiny laktátu v plazme vyššie ako
5 mmol/l a zväčšená aniónová medzera (anion gap) a pomer laktát/pyruvát. Pri podozrení na
metabolickú acidózu sa má podávanie lieku prerušiť a pacient má byť okamžite hospitalizovaný (pozri časť 4.9).
Použitieupacientovsporuchoufunkcieobličiek
Účinnosť dapagliflozínu, zložky tohto lieku, závisí od funkcie obličiek a účinnosť je znížená
u pacientov so stredne ťažkou poruchou funkcie obličiek a pravdepodobne absentuje u pacientov
s ťažkou poruchou funkcie obličiek (pozri časť 4.2). Okrem toho sa metformín vylučuje obličkami
a stredne ťažká až ťažká porucha funkcie obličiek zvyšuje riziko laktátovej acidózy (pozri časť 4.4). Tento liek sa preto nesmie používať u pacientov so stredne ťažkou až ťažkou poruchou funkcie
obličiek (pacienti s CrCl < 60 ml/min alebo odhadovanou glomerulárnou filtráciou [eGFR]
< 60 ml/min/1,73 m2, pozri časť 4.3).
Monitorovanie funkcie obličiek sa odporúča nasledovne:
• Pred začatím liečby a potom najmenej raz ročne (pozri časti 4.2, 4.8, 5.1 a 5.2).
• Pred začatím súbežného užívania liekov, ktoré môžu znížiť funkciu obličiek, a potom v pravidelných intervaloch.
• Pri funkcii obličiek približujúcej sa k stredne ťažkej poruche funkcie obličiek, najmenej 2 až 4 krát
za rok. Ak funkcia obličiek klesne pod CrCl < 60 ml/min alebo eGFR < 60 ml/min/1,73 m2, liečba sa musí ukončiť.
Znížená funkcia obličiek u starších pacientov je častá a asymptomatická. V situáciách, v ktorých môže dôjsť k poškodeniu funkcie obličiek, napríklad na začiatku antihypertenzívnej liečby alebo liečby diuretikami alebo na začiatku liečby nesteroidovými protizápalovými liekmi (NSA), je potrebná osobitná opatrnosť.
Použitieupacientovsrizikomdeplécieobjemu,hypotenzioua/alebosnerovnováhouelektrolytov Vzhľadom na mechanizmus účinku, dapagliflozín zvyšuje diurézu spojenú s miernym poklesom krvného tlaku (pozri časť 5.1), ktorá môže byť výraznejšia u pacientov s vysokými koncentráciami glukózy v krvi.
Tento liek sa neodporúča používať u pacientov užívajúcich slučkové diuretiká (pozri časť 4.5) alebo u pacientov s depléciou objemu, napr. z dôvodu akútneho ochorenia (ako je gastrointestinálne ochorenie).
Opatrnosť je potrebná u pacientov, u ktorých by dapagliflozínom navodený pokles krvného tlaku mohol predstavovať riziko, ako sú pacienti so známym kardiovaskulárnym ochorením, pacienti na antihypertenznej liečbe s hypotenziou v anamnéze alebo starší pacienti.
U pacientov užívajúcich tento liek, v prípade pridružených stavov, ktoré môžu viesť k deplécii objemu, sa odporúča starostlivo sledovať stav objemu (napr. fyzikálne vyšetrenie, merania krvného tlaku, laboratórne vyšetrenia vrátane hematokritu) a elektrolytov. U pacientov, u ktorých sa vyvinula deplécia objemu, sa odporúča dočasné prerušenie liečby týmto liekom pokiaľ sa deplécia neupraví (pozri časť 4.8).
Infekciemočovýchciest
V združenej analýze v trvaní až 24 týždňov bol výskyt infekcií močových ciest hlásený častejšie
v skupine s dapagliflozínom v porovnaní s placebom (pozri časť 4.8). Pyelonefritída bola menej častá
a vyskytla sa s podobnou frekvenciou ako v kontrolnej skupine. Vylučovanie glukózy močom môže súvisieť so zvýšeným rizikom infekcie močových ciest; preto sa má počas liečby pyelonefritídy alebo urosepsy zvážiť dočasné prerušenie liečby.
Staršípacienti(≥65rokov)
U starších pacientov je väčšia pravdepodobnosť, že majú poruchu funkcie obličiek a/alebo sú liečení antihypertenzívnymi liekmi, ktoré môžu spôsobiť zmeny funkcie obličiek, ako sú inhibítory angiotenzín konvertujúceho enzýmu (ACE-I) a blokátory receptorov typu 1 pre angiotenzín II (ARB). Na starších pacientov sa vzťahujú tie isté odporúčania s ohľadom na funkciu obličiek ako na ostatných pacientov (pozri časti 4.2, 4.4, 4.8 a 5.1).
U jedincov vo veku ≥ 65 rokov mala väčšina jedincov liečených dapagliflozínom nežiaduce reakcie súvisiace s poruchou funkcie obličiek alebo zlyhaním v porovnaní so skupinou s placebom. Najčastejšie hlásenou nežiaducou reakciou súvisiacou s funkciou obličiek boli zvýšené hodnoty kreatinínu v sére, z ktorých väčšina bola prechodná a reverzibilná (pozri časť 4.8).
Starší pacienti môžu mať vyššie riziko vzniku deplécie objemu a je u nich väčšia pravdepodobnosť, že budú liečení diuretikami. U jedincov vo veku ≥ 65 rokov mala väčšina jedincov liečených dapagliflozínom nežiaduce reakcie spojené s depléciou objemu (pozri časť 4.8).
Terapeutická skúsenosť u pacientov vo veku 75 rokov a starších je obmedzená. Začatie liečby sa v tejto populácii neodporúča (pozri časti 4.2 a 5.2).
Zlyhaniesrdca
Skúsenosti s použitím u pacientov so zlyhaním srdca triedy I-II podľa klasifikácie New York Heart
Association (NYHA) sú obmedzené a nie sú žiadne skúsenosti z klinických skúšaní s dapagliflozínom u pacientov so zlyhaním srdca triedy III-IV podľa klasifikácie NYHA.
Použitieupacientovliečenýchpioglitazónom
Aj keď príčinná súvislosť medzi dapagliflozínom a rakovinou močového mechúra je nepravdepodobná
(pozri časti 4.8 a 5.3), ako preventívne opatrenie sa tento liek neodporúča na použitie u pacientov súbežne liečených pioglitazónom. Dostupné epidemiologické údaje pre pioglitazón naznačujú mierne zvýšené riziko rakoviny močového mechúra u diabetikov liečených pioglitazónom.
Zvýšenýhematokrit
Pri liečbe s dapagliflozínom sa pozoroval nárast hematokritu (pozri časť 4.8), preto je opatrnosť u pacientov s už zvýšeným hematokritom oprávnená.
Kombinácie,ktorésanesledovali
Dapagliflozín v kombinácii s analógmi glukagónu podobného peptidu-1 (GLP-1) sa nesledoval.
Laboratórnevyšetreniamoču
Vzhľadom na mechanizmus účinku, budú mať pacienti užívajúci tento liek pozitívny test na glukózu v moči.
Podaniejódovanejkontrastnejlátky
Intravaskulárne podanie jódovaných kontrastných látok v rádiologických skúšaniach môže viesť
k renálnemu zlyhaniu. Toto môže vyvolať kumuláciu metformínu, ktorá môže zvýšiť riziko laktátovej acidózy. Užívanie tohto lieku sa má preto prerušiť pred alebo v čase takéhoto testu a v užívaní sa nemá pokračovať skôr ako 48 hodín po teste a iba po opätovnom vyhodnotení funkcie obličiek a zistení, že
je normálna (pozri časť 4.5).
Chirurgický
zákrok
Pretože tento liek obsahuje metformín, liečba sa musí prerušiť 48 hodín pred plánovaným chirurgickým zákrokom v celkovej, spinálnej alebo epidurálnej anestézii. V liečbe sa môže opätovne pokračovať najskôr 48 hodín po chirurgickom zákroku alebo po návrate na perorálnu stravu a iba
v prípade normálnej funkcie obličiek.
Zmenaklinickéhostavupacientovsdoterazkontrolovanýmdiabetom2.typu
Keďže tento liek obsahuje metformín, pacient s doteraz dobre kontrolovaným diabetom 2. typu pomocou tohto lieku, u ktorého sa objavia laboratórne abnormality alebo klinické ochorenie (obzvlášť
nejasné a ťažko definovateľné ochorenie), má byť urýchlene vyšetrený na dôkaz ketoacidózy alebo
laktátovej acidózy. Vyšetrenie má zahŕňať elektrolyty a ketóny v sére, glukózu v krvi a ak je indikované, pH krvi, hladiny laktátu, pyruvátu a metformínu. Ak sa vyskytne ktorákoľvek forma acidózy, liečba sa musí okamžite ukončiť a začať s ďalšími primeranými nápravnými opatreniami.
4.5 Liekové a iné interakcie
Súbežné podávanie opakovaných dávok dapagliflozínu a metformínu významne nezmenilo farmakokinetiku dapagliflozínu ani metformínu u zdravých jedincov.
Neuskutočnili sa žiadne interakčné štúdie s liekom Ebymect. V nasledujúcom texte sú uvedené informácie dostupné pre jednotlivé liečivá.
DapagliflozínFarmakodynamickéinterakcie Diuretiká
Tento liek sa môže pridať k diuretickému účinku tiazidu a slučkových diuretík a môže zvýšiť riziko dehydratácie a hypotenzie (pozri časť 4.4).
Inzulín a inzulínové sekretagogy
Inzulín a inzulínové sekretagogy, ako sú deriváty sulfonylurey spôsobujú hypoglykémiu. Preto sa môže vyžadovať nižšia dávka inzulínu alebo inzulínového sekretagogu, aby sa znížilo riziko
hypoglykémie pri použití v kombinácii s dapagliflozínom (pozri časti 4.2 a 4.8).
Farmakokinetickéinterakcie
Dapagliflozín sa metabolizuje hlavne konjugáciou na glukuronid sprostredkovanou UDP- glukuronozyltransferázou 1A9 (UGT1A9).
V štúdiách in vitro dapagliflozín neinhiboval ani cytochróm P450 (CYP) 1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4, ani neindukoval CYP1A2, CYP2B6 alebo CYP3A4. Preto sa nepredpokladá, že by tento liek menil metabolický klírens súbežne podávaných liekov, ktoré sú metabolizované týmito enzýmami.
Účinokinýchliekovnadapagliflozín
Interakčné štúdie vykonané u zdravých jedincov väčšinou s jednodávkovým režimom užívania naznačujú, že farmakokinetika dapagliflozínu sa nemení pioglitazónom, sitagliptínom, glimepiridom,
voglibózou, hydrochlorotiazidom, bumetanidom, valsartanom alebo simvastatínom.
Po súbežnom podaní dapagliflozínu s rifampicínom (induktor rôznych aktívnych transportérov
a enzýmov metabolizujúcich liečivá) sa pozorovalo 22% zníženie systémovej expozície dapagliflozínu
(AUC), ale bez klinicky významného účinku na 24-hodinové vylučovanie glukózy močom. Úprava dávkovania sa neodporúča. Klinicky významný účinok s inými induktormi (napr. karbamazepín,
fenytoín, fenobarbital) sa neočakáva.
Po súbežnom podávaní dapagliflozínu s kyselinou mefenamovou (inhibítor UGT1A9) sa pozorovalo
55% zvýšenie systémovej expozície dapagliflozínu, ale bez klinicky významného účinku na 24- hodinové vylučovanie glukózy močom. Úprava dávkovania sa neodporúča.
Účinok
dapagliflozínu
na
iné
lieky
V interakčných skúšaniach vykonaných u zdravých jedincov väčšinou s jednodávkovým režimom užívania dapagliflozín nezmenil farmakokinetiku pioglitazónu, sitagliptínu, glimepiridu, hydrochlorotiazidu, bumetanidu, valsartanu, digoxínu (substrát P-gp) alebo warfarínu (S-warfarínu, substrátu CYP2C9), alebo antikoagulačné účinky warfarínu stanovené INR. Kombinácia jednej dávky dapagliflozínu 20 mg a simvastatínu (substrátu CYP3A4) vyústilo do 19% zvýšenia AUC simvastatínu a 31% zvýšenia AUC kyseliny simvastatínovej. Zvýšenia expozícií simvastatínu a kyseliny simvastatínovej sa nepovažujú za klinicky významné.
Ďalšieinterakcie
Vplyv fajčenia, stravy, rastlinných produktov a alkoholu na farmakokinetiku dapagliflozínu sa nesledoval.
Pediatrickápopulácia
Interakčné štúdie sa uskutočnili len u dospelých.
Metformín
Kombinácie,ktorésaneodporúčajú
Pri akútnej intoxikácii alkoholom (obzvlášť v prípade hladovania, podvýživy alebo pri poruche funkcie pečene) dochádza kvôli metformínu, liečivu v tomto lieku, k zvýšeniu rizika laktátovej acidózy (pozri časť 4.4). Konzumácii alkoholu a liekov obsahujúcich alkohol sa má vyhnúť.
Katiónové látky, ktoré sa eliminujú renálnou tubulárnou sekréciou (napr. cimetidín), môžu interagovať s metformínom kompetíciou o spoločné renálne tubulárne transportné systémy. Skúšanie vykonané
u siedmych normálnych zdravých dobrovoľníkov ukázalo, že cimetidín podávaný v dávke 400 mg
dvakrát denne zvýšil systémovú expozíciu metformínu (AUC) o 50 % a Cmax o 81 %. Preto sa má pri súbežnom podávaní s katiónovými látkami, ktoré sa eliminujú renálnou tubulárnou sekréciou, zvážiť dôkladné sledovanie glykemickej kontroly, úprava dávky v rámci odporúčaného dávkovania a zmeny v liečbe diabetu.
Intravaskulárne podávanie jódovaných kontrastných látok v rádiologických skúšaniach môže viesť k renálnemu zlyhaniu, ktorého výsledkom je kumulácia metformínu a riziko laktátovej acidózy. Užívanie tohto lieku sa má preto prerušiť pred alebo v čase takéhoto testu a v užívaní sa nemá pokračovať skôr, ako 48 hodín po teste a iba po opätovnom vyhodnotení renálnej funkcie a zistení, že je normálna (pozri časť 4.4).
Kombináciavyžadujúcaopatrnosťpripoužívaní
Glukokortikoidy (podávané systémovo a lokálne), beta-2 agonisty a diuretiká majú vnútornú hyperglykemickú aktivitu. Pacient má byť informovaný a častejšie sa má sledovať glukóza v krvi, obzvlášť na začiatku liečby takýmito liekmi. V prípade potreby sa má dávka lieku znižujúceho hladinu glukózy upraviť počas liečby s iným liekom a po jeho vysadení.
Diuretiká, obzvlášť slučkové diuretiká, môžu kvôli ich potenciálu znižovania funkcie obličiek zvýšiť riziko laktátovej acidózy.
Inzulín a inzulínové sekretagogy
Inzulín a inzulínové sekretagogy, ako sú deriváty sulfonylurey spôsobujú hypoglykémiu. Preto sa môže vyžadovať nižšia dávka inzulínu alebo inzulínového sekretagogu, aby sa znížilo riziko
hypoglykémie pri použití v kombinácii s metformínom (pozri časti 4.2 a 4.8).
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii nie sú žiadne údaje o použití lieku Ebymect alebo dapagliflozínu u gravidných žien. Štúdie na potkanoch liečených dapagliflozínom preukázali toxicitu na vývoj obličiek v období, ktoré
sa zhoduje s druhým a tretím trimestrom ľudskej gravidity (pozri časť 5.3). Preto sa použitie tohto
lieku počas druhého a tretieho trimestra gravidity neodporúča. Obmedzené množstvo údajov o použití
metformínu u gravidných žien nepreukázalo zvýšené riziko kongenitálnych malformácií. Štúdie
s metformínom na zvieratách nepreukázali škodlivé účinky z hľadiska gravidity, embryonálneho alebo fetálneho vývoja, pôrodu alebo postnatálneho vývoja (pozri tiež časť 5.3).
Keď pacientka plánuje otehotnieť a počas gravidity, neodporúča sa liečiť diabetes týmto liekom, ale na udržanie hladiny glukózy v krvi čo najbližšej k fyziologickým hodnotám sa má použiť inzulín, aby sa znížilo riziko malformácií plodu spojené s abnormálnymi hladinami glukózy v krvi.
Laktácia
Nie je známe, či sa tento liek alebo dapagliflozín (a/alebo jeho metabolity) vylučujú do ľudského mlieka. Dostupné farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie
dapagliflozínu/metabolitov do mlieka, ako aj farmakologicky sprostredkované účinky u laktujúcich
potomkov (pozri časť 5.3). Metformín sa v malých množstvách vylučuje do ľudského mlieka. Riziko u novorodencov/dojčiat nemôže byť vylúčené.
Tento liek nemá byť užívaný počas laktácie. Fertilita
Účinok tohto lieku alebo dapagliflozínu na fertilitu u ľudí sa nesledoval. U samcov a samíc potkanov
dapagliflozín v žiadnych testovaných dávkach nepreukázal účinok na fertilitu. Štúdie s metformínom na zvieratách nepreukázali reprodukčnú toxicitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Dapagliflozín alebo metformín nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti majú byť upozornení na riziko hypoglykémie v prípade, že sa tento liek používa v kombinácii s inými liekmi znižujúcimi hladinu glukózy o ktorých je známe, že spôsobujú hypoglykémiu.
4.8 Nežiaduce účinky
Preukázala sa bioekvivalencia lieku Ebymect so súčasne podávaným dapagliflozínom a metformínom
(pozri časť 5.2). S tabletami lieku Ebymect sa nevykonali žiadne terapeutické klinické skúšania.
Dapagliflozínplusmetformín
Súhrnbezpečnostnéhoprofilu
V 5 placebom kontrolovaných skúšaniach s dapagliflozínom ako prídavnej liečbe k metformínu boli výsledky bezpečnosti podobné ako v združenej vopred špecifikovanej analýze 12 placebom
kontrolovaných skúšaní s dapagliflozínom (pozri Dapagliflozín, Súhrn bezpečnostného profilu nižšie).
V skupine s dapagliflozínom plus metformín sa nezistili sa žiadne ďalšie nežiaduce reakcie oproti nežiaducim reakciám hláseným pre jednotlivé liečivá. V separátnej združenej analýze dapagliflozínu
ako prídavnej liečbe k metformínu bolo 623 jedincov liečených dapagliflozínom 10 mg ako prídavnou
liečbou k metformínu a 523 jedincov dostávalo placebo s metformínom.
Dapagliflozín
Súhrnbezpečnostnéhoprofilu
V združenej vopred špecifikovanej analýze 13 placebom kontrolovaných skúšaní bolo 2 360 jedincov liečených dapagliflozínom 10 mg a 2 295 jedincov dostávalo placebo.
Najčastejšie hlásenou nežiaducou reakciou bola hypoglykémia, ktorá závisela od typu použitej základnej liečby v každom skúšaní. Frekvencia drobných epizód hypoglykémie bola vo všetkých liečených skupinách podobná vrátane placeba, s výnimkou skúšania s pridaním sulfonylurey (SU)
a pridaním inzulínovej liečby. Kombinovaná liečba so sulfonylureou a pridaním inzulínu mala vyššiu frekvenciu výskytu hypoglykémie (pozri Hypoglykémia nižšie).
Tabuľkový
zoznam
nežiaducich
reakcií
Nasledujúce nežiaduce reakcie boli zistené v placebom kontrolovaných klinických skúšaniach
s dapagliflozínom plus metformín, v skúšaniach s dapagliflozínom a v skúšaniach s metformínom a zo skúseností po uvedení lieku na trh. Pre žiadnu sa nezistila súvislosť s dávkou. Nežiaduce reakcie
uvedené nižšie sú klasifikované podľa frekvencie a tried orgánových systémov. Kategórie frekvencií
sú definované podľa nasledovných pravidiel: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (nemožno odhadnúť z dostupných údajov).
Tabuľka 1. Nežiaduce reakcie v skúšaniach s dapagliflozínom a metformínom s okamžitým uvoľňovaním a pri používaní lieku po jeho uvedení na trha
Trieda orgánových systémov
Veľmi časté Časté Menej časté Veľmi zriedkavé
Infekcie a nákazy Vulvovaginitída, balanitída
a súvisiace genitálne infekcie*,b,c Infekcia močových ciest*,b,d
Plesňová infekcia**
 Poruchy metabolizmu a výživy
Poruchy nervového systému
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy kože
a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
Poruchy obličiek a močových ciest
Poruchy reprodukčného systému a prsníkov
Poruchy metabolizmu a výživy
Poruchy nervového systému
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy kože
a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
Poruchy obličiek a močových ciest
Poruchy reprodukčného systému a prsníkov
Hypoglykémia (keď sa použil so SU alebo inzulínom)b
Gastrointestinálne príznakyj,§
Porucha chuti§
Závrat
Bolesť chrbta*
Dysúria
Polyúria*,f
Deplécia objemub,e Smäd
**Zápcha
** Sucho v ústach**
Noktúria
** Porucha funkcie obličiek**,b Vulvovaginálny pruritus** Genitálny pruritus**
Laktátová acidóza Nedostatok vitamínu B12h,§
Poruchy funkcie pečene§ Hepatitída§ Urtikária§ Erytém§ Pruritus§
Trieda orgánových systémov
Veľmi časté Časté Menej časté Veľmi zriedkavé
Laboratórne a funkčné vyšetrenia
Zvýšenie hematokritug Zníženie renálneho
klírensu kreatinínub Dyslipidémiaj
Zvýšenie kreatinínu v krvi**,b Zvýšenie močoviny v krvi** Zníženie
hmotnosti**

aTabuľka ukazuje nežiaduce reakcie z až 24-týždňových (krátkodobé) údajov bez ohľadu na záchrannú liečbu glykémie, okrem tých označených §, pre ktoré nežiaduce reakcie a kategórie frekvencie vychádzajú z informácií, ktoré sú k dispozícii v súhrne charakteristických vlastností lieku pre metformín dostupný v EÚ.
bĎalšie informácie pozri v súvisiacich odsekoch nižšie.
cVulvovaginitída, balanitída a súvisiace genitálne infekcie zahŕňajú napr. vopred definované preferenčné termíny: vulvovaginálna mykotická infekcia, vaginálna infekcia, balanitída, genitálna mykotická infekcia, vulvovaginálna kandidóza, vulvovaginitída, kandidová balanitída, genitálna kandidóza, genitálna infekcia, genitálna infekcia u mužov, infekcia penisu, vulvitída, bakteriálna vaginitída a absces vulvy.
dInfekcia močových ciest zahŕňa nasledujúce preferenčné termíny uvedené v poradí hlásenej frekvencie: infekcia močových ciest, cystitída, infekcia močových ciest zapríčinená baktériami Escherichia, infekcie urogenitálneho
traktu, pyelonefritída, trigonitída, uretritída, infekcia obličiek a prostatitída.
eDeplécia objemu zahŕňa napr. vopred definované preferenčné termíny: dehydratácia, hypovolémia, hypotenzia.
fPolyúria zahŕňa preferenčné termíny: polakizúria, polyúria, zvýšená tvorba moču.
gPriemerná zmena hematokritu oproti východiskovej hodnote bola 2,30 % pri dapagliflozíne 10 mg oproti
-0,33 % pri placebe. Hodnoty hematokritu > 55 % boli hlásené u 1,3 % jedincov liečených dapagliflozínom
10 mg oproti 0,4 % u jedincov s placebom.
hDlhodobá liečba metformínom bola spojená s poklesom absorpcie vitamínu B12, čo môže veľmi zriedkavo viesť ku klinicky významnému nedostatku vitamínu B12 (napr. megaloblastická anémia).
iGastrointestinálne príznaky, ako sú nauzea, vracanie, hnačka, bolesť brucha a strata chuti do jedla sa najčastejšie vyskytujú na začiatku liečby a vo väčšine prípadov samovoľne vymiznú.
jPriemerná percentuálna zmena z východiskovej hodnoty pre dapagliflozín 10 mg oproti placebu bola
v uvedenom poradí: celkový cholesterol 2,5 % oproti 0,0 %; HDL cholesterol 6,0 % oproti 2,7 %; LDL
cholesterol 2,9 % oproti -1,0 %; triglyceridy -2,7 % oproti -0,7 %.
*Hlásené u ≥ 2 % jedincov a o ≥ 1% častejšie a minimálne u ďalších 3 jedincov liečených s dapagliflozínom
10 mg v porovnaní s placebom.
**Hlásené skúšajúcim ako možno súvisiace, pravdepodobne súvisiace alebo súvisiace so skúmanou liečbou a hlásené u ≥ 0,2 % jedincov a o ≥ 0,1 % častejšie a minimálne u viac ako u 3 jedincov liečených
dapagliflozínom 10 mg v porovnaní s placebom.
PopisvybranýchnežiaducichreakciíDapagliflozínplusmetformínHypoglykémiaV skúšaniach s dapagliflozínom ako prídavnej liečbe k metformínu boli hlásené menej významné epizódy hypoglykémie s podobnou frekvenciou v skupine liečenej dapagliflozínom 10 mg plus
metformín (6,9 %) ako v skupine placebo plus metformín (5,5 %). Nehlásili sa žiadne významné epizódy hypoglykémie.
V 24 týždňovom skúšaní prídavnej liečby k metformínu a sulfonylurey boli u 12,8% jedincov hlásené menej významné epizódy hypoglykémie, ktorí dostávali dapagliflozín 10 mg plus metformín
a sulfonylureu a u 3,7% jedincov, ktorí dostávali placebo plus metformín a sulfonylureu. Neboli hlásené žiadne významné epizódy hypoglykémie.
DapagliflozínHypoglykémiaFrekvencia výskytu hypoglykémie závisela od typu základnej liečby použitej v každom skúšaní.
Pri skúšaniach s dapagliflozínom ako prídavnej liečbe k metformínu alebo ako prídavnej liečbe
k sitagliptínu (s alebo bez metformínu) bola frekvencia menej významných epizód hypoglykémie vo všetkých liečených skupinách vrátane skupiny s placebom podobná (< 5 %) do 102 týždňa liečby. Vo
všetkých skúšaniach bol výskyt významných epizód hypoglykémie menej častý a v skupinách liečených s dapagliflozínom alebo placebom porovnateľný. V skúšaní prídavnej liečby k inzulínu bol pozorovaný vyšší výskyt hypoglykémie (pozri časť 4.5).
V skúšaní prídavnej liečby k inzulínu do 104 týždňa boli významné epizódy hypoglykémie hlásené'
u 0,5 % jedincov liečených dapagliflozínom plus inzulín v 24. týždni a u 1,0 % jedincov v 104. týždni a u 0,5 % jedincov v skupine, ktorí dostávali placebo plus inzulín v 24. týždni a 104. týždni. V 24.
a 104. týždni boli menej významné epizódy hypoglykémie hlásené v uvedenom poradí u 40,3 %
a 53,1% jedincov liečených dapagliflozín 10 mg plus inzulín a u 34,0 % a 41,6 % jedincov, ktorí dostávali placebo plus inzulín.
Depléciaobjemu
Reakcie súvisiace s depléciou objemu (vrátane hlásení dehydratácie, hypovolémie alebo hypotenzie)
boli hlásené u 1,1 % jedincov užívajúcich dapagliflozín 10 mg a u 0,7 % jedincov užívajúcich placebo; závažné reakcie sa vyskytli u < 0,2 % jedincov a ich výskyt pri použití dapagliflozínu 10 mg a placeba bol vyrovnaný (pozri časť 4.4).
Vulvovaginitída,balanitídaasúvisiacegenitálneinfekcie
Vulvovaginitída, balanitída a súvisiace genitálne infekcie boli hlásené u 5,5 % jedincov užívajúcich dapagliflozín 10 mg a u 0,6 % jedincov, ktorí dostávali placebo. Väčšina infekcií bola mierna až stredne závažná a jedinci odpovedali na úvodnú štandardnú liečbu a zriedkavo vyústili do ukončenia liečby dapagliflozínom. Tieto infekcie boli častejšie u žien (8,4 % a 1,2 % pre dapagliflozín a placebo, v uvedenom poradí) a u jedincov s infekciami v anamnéze bola pravdepodobnosť rekurentných infekcií väčšia.
Infekciemočovýchciest
Infekcie močových ciest boli častejšie hlásené pre dapagliflozín 10 mg v porovnaní s placebom (4,7 %
oproti 3,5 % v uvedenom poradí; pozri časť 4.4). Väčšina infekcií bola mierna až stredne závažná a jedinci odpovedali na úvodnú štandardnú liečbu a zriedkavo viedli k ukončeniu liečby dapagliflozínom. Tieto infekcie boli častejšie u žien a u jedincov s infekciami v anamnéze bola pravdepodobnosť rekurentných infekcií väčšia.
Zvýšený kreatinín
Nežiaduce reakcie lieku týkajúce sa zvýšeného kreatinínu boli zoskupené (napr. znížený renálny klírens kreatinínu, porucha funkcie obličiek, zvýšená hladina kreatinínu v krvi a znížená rýchlosť glomerulárnej filtrácie). Toto zoskupenie reakcií bolo hlásené u 3,2 % pacientov, ktorí dostávali dapagliflozín 10 mg a u 1,8 % pacientov, ktorí dostávali placebo. U pacientov s normálnou funkciou obličiek alebo s miernou poruchou funkcie obličiek (východisková hodnota eGFR ≥
60 ml/min/1,73m2) bolo toto zoskupenie reakcií hlásené u 1,3 % pacientov, ktorí dostávali
dapagliflozín 10 mg a u 0,8 % pacientov, ktorí dostávali placebo. Tieto reakcie boli častejšie u pacientov s východiskovou hodnotou eGFR ≥ 30 a < 60 ml/min/1,73m2 (18,5 % pri dapagliflozíne
10 mg oproti 9,3 % pri placebe).
Ďalšie hodnotenie pacientov, u ktorých sa vyskytli nežiaduce udalosti týkajúce sa obličiek, preukázalo, že väčšina z nich mala zmeny sérového kreatinínu ≤ 0,5 mg/dl oproti východiskovej hodnote. Zvýšenia kreatinínu boli zvyčajne prechodné počas kontinuálnej liečby alebo reverzibilné po ukončení liečby.
Parathormón(PTH)
Pozorovalo sa malé zvýšenie hladín PTH v sére s väčším zvýšením u jedincov s vyššou základnou koncentráciou PTH. Meranie kostnej denzity u pacientov s normálnou alebo miernou poruchou
funkcie obličiek nepreukázalo úbytok kostnej hmoty počas liečby po dobu dvoch rokov.
Malignity
Počas klinických skúšaní bol celkový podiel jedincov s malígnymi alebo nešpecifikovanými nádormi podobný u liečených dapagliflozínom (1,50 %) ako u liečených placebom/komparátorom (1,50 %),
a údaje u zvierat nenaznačujú karcinogenitu alebo mutagenitu (pozri časť 5.3). Pri zvažovaní prípadov
vyskytujúcich sa nádorov v rôznych orgánových systémoch bolo relatívne riziko spojené
s dapagliflozínom viac ako 1 u niektorých typov nádorov (močový mechúr, prostata, prsník) a menej ako 1 pre iné (napr. krv a lymfatický, ovariálny, renálny trakt), ktorého výsledkom nebolo celkové zvýšenie rizika vzniku nádorov spojených s dapagliflozínom. Zvýšenie/zníženie rizika nebolo štatisticky významné v žiadnom z orgánových systémov. Vzhľadom na nedostatok nálezov nádorov
v neklinických skúšaniach rovnako, ako krátka latencia medzi prvou expozíciou lieku a diagnostikou nádoru, je považovaná príčinná súvislosť za nepravdepodobnú. Musí sa zvažovať s opatrnosťou vzhľadom na numerickú nerovnováhu nádorov prsníka, močového mechúra a prostaty, čo bude ďalej skúmané v postmarketingových štúdiách.
OsobitnéskupinypacientovStaršípacienti(≥ 65rokov)U jedincov vo veku ≥ 65 rokov sa hlásili nežiaduce reakcie súvisiace s poškodením funkcie obličiek alebo zlyhaním obličiek u 7,7 % jedincov liečených dapagliflozínom a u 3,8 % jedincov dostávajúcich
placebo (pozri časť 4.4). Najčastejšie hlásenou nežiaducou reakciou súvisiacou s funkciou obličiek
bolo zvýšenie kreatinínu v sére. Väčšina týchto reakcií bola prechodná a reverzibilná. U jedincov vo veku ≥ 65 rokov boli nežiaduce reakcie deplécie objemu, najčastejšie hlásené ako hypotenzia, sa zaznamenali u 1,7 % jedincov liečených dapagliflozínom a u 0,8 % jedincov dostávajúcich placebo (pozri časť 4.4).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieOdstránenie dapagliflozínu hemodialýzou sa nesledovalo. Najúčinnejší spôsob odstránenia metformínu a laktátu je hemodialýza.
DapagliflozínNepreukázala sa žiadna toxicita dapagliflozínu u zdravých jedincov užívajúcich jednotlivé dávky až do 500 mg perorálne (50-násobok maximálnej odporúčanej dávky u ľudí). Títo jedinci mali glukózu detegovateľnú v moči po dobu, ktorá závisela od dávky (najmenej 5 dní pri dávke 500 mg), bez hlásení dehydratácie, hypotenzie alebo nerovnováhy elektrolytov a bez klinicky významného účinku na QTc interval. Výskyt hypoglykémie bol podobný ako pri placebe. V klinických skúšaniach
s podávaním dávok jedenkrát do 100 mg denne (10-násobok maximálnej odporúčanej dávky u ľudí) počas 2 týždňov zdravým jedincom a jedincom s diabetes mellitus 2. typu, bol výskyt hypoglykémie v porovnaní s placebom mierne vyšší a nebol závislý od dávky. Výskyt nežiaducich udalostí vrátane dehydratácie alebo hypotenzie bol podobný ako pri placebe a nezistili sa žiadne klinicky významné zmeny výsledkov laboratórnych vyšetrení vrátane hodnôt elektrolytov v sére a biomarkerov funkcie obličiek v závislosti od dávky.
V prípade predávkovania je v závislosti od klinického stavu pacienta potrebné zahájiť vhodnú podpornú liečbu.
MetformínZávažné predávkovanie metformínom (alebo koexistujúce riziká laktátovej acidózy) môže viesť k laktátovej acidóze. Laktátová acidóza je naliehavá medicínska udalosť, ktorá sa musí liečiť
v nemocnici.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antidiabetiká, kombinácia perorálnych antidiabetík, ATC kód: A10BD15
Mechanizmusúčinku
Ebymect kombinuje dve antihyperglykemické látky s rozdielnym a komplementárnym mechanizmom účinku na zlepšenie kontroly glykémie u pacientov s diabetom 2. typu: dapagliflozín, inhibítor sodíkoglukózového kotransportéra 2 (SGLT2) a metformíniumchlorid, člen skupiny biguanidov.
Dapagliflozín
Dapagliflozín je vysoko účinným (Ki: 0,55 nM), selektívnym a reverzibilným inhibítorom sodíkoglukózového kotransportéra 2 (SGLT2).
SGLT2 je selektívne exprimovaný v obličkách bez expresie zisťovanej vo viac ako 70 ďalších tkanivách vrátane pečene, kostrového svalstva, adipózneho tkaniva, prsníka, močového mechúra
a mozgu. SGLT2 je hlavným transportérom zodpovedným za reabsorpciu glukózy z glomerulárneho filtrátu späť do krvného obehu. Napriek prítomnosti hyperglykémie pri diabete 2. typu reabsorpcia
prefiltrovanej glukózy naďalej pokračuje. Dapagliflozín zlepšuje plazmatickú hladinu glukózy nalačno aj po jedle znižovaním reabsorpcie glukózy obličkami, čo vedie k vylučovaniu glukózy močom. Toto vylučovanie glukózy (glykozúria) je pozorované po prvej dávke, pretrváva počas 24 hodinového
intervalu dávkovania a udržiava sa počas trvania liečby. Množstvo glukózy odstránenej obličkami prostredníctvom tohto mechanizmu účinku závisí od koncentrácie glukózy v krvi a od GFR.
V odpovedi na hypoglykémiu dapagliflozín nezhoršuje normálnu endogénnu tvorbu glukózy. Dapagliflozín pôsobí nezávisle od sekrécie a účinku inzulínu. V klinických skúšaniach
s dapagliflozínom sa pozorovalo zlepšenie funkcie beta buniek hodnotením pomocou modelu homeostázy (Homeostasis Model Assessment-β, HOMA-β).
Vylučovanie glukózy močom (glykuréza) navodené dapagliflozínom súvisí s kalorickou stratou a so znížením telesnej hmotnosti. Inhibícia glukózy a kontrasportu sodíka dapagliflozínom je spojená
s miernou diurézou a prechodnou natriurézou.
Dapagliflozín neinhibuje iné transportéry dôležité pre transport glukózy do periférnych tkanív a je
> 1 400-násobne selektívnejší pre SGTL2 ako pre SGTL1, hlavný transportér v čreve zodpovedný za absorpciu glukózy.
Metformín
Metformín je biguanid s antihyperglykemickými účinkami, ktorý znižuje bazálnu aj postprandiálnu plazmatickú glukózu. Nestimuluje sekréciu inzulínu a preto nespôsobuje hypoglykémiu.
Metformín môže účinkovať troma mechanizmami:
- znížením tvorby hepatálnej glukózy inhibíciou glukoneogenézy a glykogenolýzy,
- zlepšením periférneho vychytávania a využitia glukózy vo svaloch miernym zvýšením citlivosti na inzulín,
- spomalením absorpcie glukózy v črevách.
Metformín stimuluje intracelulárnu syntézu glykogénu pôsobením na glykogénsyntázu. Metformín zvyšuje transportnú kapacitu špecifických typov membránových transportérov glukózy (GLUT-1
a GLUT-4).
Farmakodynamickéúčinky
Dapagliflozín
Po podaní dapagliflozínu sa u zdravých jedincov a u jedincov s diabetes mellitus 2. typu pozorovalo zvýšené množstvo glukózy v moči. Pri dávke dapagliflozínu 10 mg denne počas 12 týždňov
u jedincov s diabetes mellitus 2. typu sa močom vylúčilo približne 70 g glukózy (čo zodpovedá
280 kcal/deň). U pacientov s diabetes mellitus 2. typu, ktorým sa podával dapagliflozín 10 mg/deň až
2 roky, sa pozorovalo trvalé vylučovanie glukózy.
Pri dapagliflozíne malo vylučovanie glukózy močom za následok aj osmotickú diurézu a zvýšenie objemu moču u pacientov s diabetes mellitus 2. typu. Zvýšenie objemu moču u pacientov s diabetes mellitus 2. typu liečených dapagliflozínom 10 mg zostalo zachované po 12 týždňoch a predstavovalo približne 375 ml/deň. Zvýšenie objemu moču sa spájalo s malým a prechodným zvýšením vylučovania sodíka močom, ktoré nesúviselo so zmenami koncentrácií sodíka v sére.
Prechodne (3 až 7 dní) sa zvýšilo aj vylučovanie kyseliny močovej močom a bolo sprevádzané pretrvávajúcim poklesom koncentrácie kyseliny močovej v sére. Po 24 týždňoch sa pokles koncentrácie kyseliny močovej v sére pohyboval v rozmedzí -48,3 až -18,3 mikromolov/l (-0,87 až -
0,33 mg/dl).
Farmakodynamika dapagliflozínu 5 mg podávaného dvakrát denne a dapagliflozínu 10 mg podávaného jedenkrát denne sa porovnávala u zdravých jedincov. Ustálená inhibícia reabsorpcie glukózy a množstvo glukózy vylúčené močom počas 24-hodinového obdobia boli pri obidvoch dávkovacích režimoch rovnaké.
Metformín
U ľudí má metformín, nezávisle od jeho účinku na glykémiu, priaznivé účinky na metabolizmus lipidov. Tieto účinky sa preukázali pri terapeutických dávkach v kontrolovaných strednodobých alebo dlhodobých klinických skúšaniach: metformín znižuje hladiny celkového cholesterolu, LDL cholesterolu a triglyceridov.
V klinických skúšaniach bolo užívanie metformínu spojené buď s udržiavaním stabilnej váhy, alebo jej miernym znížením.
Klinickáúčinnosťabezpečnosť
Súbežné podávanie dapagliflozínu a metformínu sa skúmalo u jedincov s diabetom typu 2, ktorí neboli
dostatočne kontrolovaní metformínom samotným alebo v kombinácii s inhibítorom DPP-4 (sitagliptín), sulfonylureou alebo s inzulínom. Liečba dapagliflozínom plus metformín pri všetkých dávkach vyvoláva klinicky a štatisticky významné zlepšenia HbA1c a plazmatickej hladiny glukózy nalačno v porovnaní s placebo v kombinácií s metformínom. Tieto klinicky významné účinky na glykémiu pretrvávali počas dlhodobého horizontu rozšírenia až do 104 týždňov. Zníženia HbA1c sa pozorovali vo všetkých podskupinách vrátane pohlavia, veku, rasy, dĺžky trvania ochorenia
a východiskovej hodnoty indexu telesnej hmotnosti (body mass index, BMI). Pri kombinovaných liečbach s dapagliflozínom a metformínom sa v 24. týždni tiež pozorovali klinicky a štatisticky
významné zlepšenia v priemerných zmenách telesnej hmotnosti oproti východiskovej hodnote v
porovnaní s kontrolnou liečbou. Zníženia telesnej hmotnosti sa dlhodobo udržali až do 208 týždňov. Okrem toho sa liečba dapagliflozínom dvakrát denne ako prídavná liečba k metformínu preukázala
ako účinná a bezpečná u jedincov s diabetom typu 2. Okrem toho sa uskutočnili dve 12-týždňové,
placebom kontrolované štúdie u pacientov s nedostatočne kontrolovaným diabetom 2. typu a hypertenziou.
Kontrolaglykémie
V 52-týždňovom aktívne kontrolovanom skúšaní non-inferiority (s 52 a 104-týždňovým obdobím predĺženia) sa hodnotil dapagliflozín 10 mg ako prídavná liečba k metformínu v porovnaní so
sulfonylureou (glipizid) ako prídavnej liečbe k metformínu u jedincov s nedostatočnou kontrolou
glykémie (HbA1c > 6,5 % a ≤ 10 %). Výsledky v porovnaní s glipizidom preukázali podobný priemerný pokles HbA1c od východiskovej hodnoty do 52. týždňa, čím sa preukázala non-inferiorita
(tabuľka 2). V 104. týždni bola upravená hodnota priemernej zmeny HbA1c z východiskovej hodnoty
-0,32 % pri dapagliflozíne a -0,14 % pri glipizide. V 208. týždni bola priemerná zmena od východiskovej hodnoty v HbA1c -0,10% pre dapagliflozín a 0,20% pre glipizid. V 52., 104. a
208. týždni sa v signifikantne menšom podiele jedincov v skupine liečenej dapagliflozínom (3,5 % ,
4,3 % a 5,0 % v uvedenom poradí) objavila minimálne jedna príhoda hypoglykémie v porovnaní so skupinou liečenou glipizidom (40,8 %, 47 % a 50,0 % v uvedenom poradí). Podiel jedincov, ktorí
v skúšaní zostali v 104. a 208. týždni, bol 56,2 % a 39,7 % pri skupine liečenej dapagliflozínom a 50,0 % a 34,6 % pri skupine liečenej glipizidom.
Tabuľka 2. Výsledky v 52. týždni (LOCFa) v aktívne kontrolovanom skúšaní porovnávajúcom dapagliflozín s glipizidom ako prídavnej liečbe k metformínu
Parameter
Dapagliflozín
+ metformín
Glipizid
+ metformín

 N
Nb 400 401
HbA1c (%)

Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Odlišnosť od glipizidu + metformínc
(95% IS)
Telesná hmotnosť (kg) Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Odlišnosť od glipizidu + metformínc
(95% IS)
7,69
-0,52
0,00d
(-0,11; 0,11)
88,44
-3,22
-4,65*
(-5,14; -4,17)
7,74
-0,52
87,60
1,44


aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii
bRandomizovaní a liečení jedinci, u ktorých sa meranie účinnosti vykonalo na začiatku a najmenej jedenkrát po základnom hodnotení účinnosti
cPriemer najmenších štvorcov upravený podľa východiskovej hodnoty
d Non-inferiórne voči glipizid + metformín
*hodnota p < 0,0001
Dapagliflozín ako prídavná liečba buď k metformínom osamote, metformínu v kombinácii so sitagliptínom, sulfonylureou alebo s inzulínom (s ďalším perorálnymi antidiabetikami vrátane metformínu alebo bez nich ) viedol k štatisticky významným priemerným zníženiam HbA1c v 24. týždni v porovnaní s jedincami, ktorí dostávali placebo (p < 0,0001; tabuľka 3, 4 a 5). Dapagliflozín
5 mg dvakrát denne spôsobil štatisticky signifikantné zníženia HbA1c v 16. týždni v porovnaní s jedincami, ktorí dostávali placebo (p < 0,0001; tabuľka 3).
V skúšaniach prídavnej kombinácie zníženia HbA1c pozorované v 24. týždni pretrvávali. Pri skúšaní prídavnej liečby k metformínu zníženia HbA1c pretrvávali počas 102. týždňa (upravený priemer zmeny od východiskovej hodnoty pri dapagliflozíne 10 mg -0,78 % a 0,02 % pri placebe). V 48. týždni pri metformíne plus sitagliptín bola upravená priemerná zmena od východiskovej hodnoty -
0,44 % pri dapagliflozíne 10 mg a 0,15 % pri placebe. V 104. týždni pri inzulíne (s ďalšími perorálnymi antidiabetikami vrátane metformínu alebo bez nich) boli zníženia HbA1c -0,71 % pri
upravenej priemernej zmene od východiskovej hodnoty dapagliflozíne 10 mg a -0,06 % pri placebe.
V 48. a 104. týždni zostala dávka inzulínu stabilná v porovnaní s východiskovou hodnotou u jedincov liečených dapagliflozínom 10 mg, s priemernou dávkou 76 IU/deň. V skupine s placebom sa objavilo
zvýšenie od východiskovej hodnoty o 10,5 IU/deň v 48. týždni a o 18,3 IU/deň v 104. týždni (stredná
hodnota priemernej dávky 84 a 92 IU/deň). Podiel jedincov, ktorí zostali v skúšaní v 104. týždni, bol
72,4 % pri skupine liečenej dapagliflozínom 10 mg a 54,8 % pri skupine s placebom.
V separátnej analýze jedincov používajúcich inzulín plus metformín sa pozorovali podobné zníženia
HbA1C ako boli pozorované v celej skúšanej populácii u jedincov liečených dapagliflozínom
s inzulínom plus metformín. V 24. týždni bola zmena HbA1c od východiskovej hodnoty u jedincov liečených dapagliflozínom plus inzulín s metformínom -0,93 %.
Tabuľka 3. Výsledky (LOCFa) placebom kontrolovaným skúšaní až do 24. týždňa dapagliflozínu ako prídavnej liečby v kombinácii s metformínom alebo s metformínom plus sitagliptín
kombinácia s prídavnou liečbou
Metformín1 Metformín1, b Metformín1 + sitagliptín2
Dapagliflozín
10 mg QD
Placebo
QD
Dapagliflozín
5 mg BID
Placebo
BID
Dapagliflozín
10 mg QD
Placebo
QD
Nc 135 137 99 101 113 113
HbA1c (%)
Východisková hodnota (priemer)
Zmena
od východiskovej hodnotyd Odlišnosť od placebad
(95 % IS) Jedinci (%) dosahujúci: HbA1c < 7 %
Upravené na
7,92
-0,84
-0,54*
(-0,74; -0,34)
8,11
-0,30
7,79
-0,65
-0,35*
(-0,52; -0,18)
7,94
-0,30
7,80
-0,43
-0,40*
(-0,58; -0,23)
7,87
-0,02
východiskovú hodnotu
Telesná hmotnosť
40,6** 25,9 38,2**
(N = 90)
21,4 (N = 87)
(kg) Východisková hodnota (priemer) Zmena
od východiskovej hodnotyd Odlišnosť od placebad
(95 % IS)
86,28
-2,86
-1,97*
(-2,63; -1,31)
87,74
-0,89
93,62
-2,74
-1,88***
(-2,52; -1,24)
88,82
-0,86
93,95
-2,35
-1,87*
(-2,61; -1,13)
94,17
-0,47
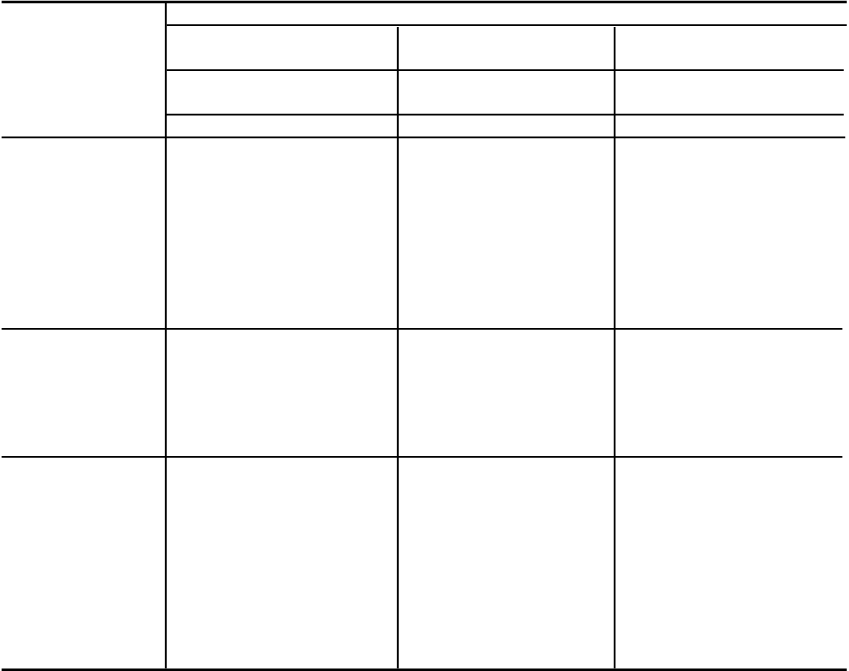
Skratky: QD: jedenkrát denne; BID: dvakrát denne
1metformín ≥ 1500 mg/deň; 2sitagliptín 100 mg/deň
aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred záchranou liečbou u zachránených jedincov)
bplacebom kontrolované 16-týždňové skúšanie
cvšetci randomizovaní pacienti, ktorí užili minimálne jednu dávku dvojito zaslepeného skúšaného lieku počas krátkodobého dvojito zaslepeného skúšania
dpriemer najmenších štvorcov upravený na východiskovú hodnotu
*hodnota p < 0,0001 v porovnaní s placebom + perorálne antidiabetikum
**hodnota p < 0,05 v porovnaní s placebom + perorálne antidiabetikum
***percentuálne vyjadrenie zmeny v telesnej hmotnosti bolo analyzované ako kľúčový sekundárny cieľový ukazovateľ
(p < 0,0001); absolútna zmena v telesnej hmotnosti (v kg) bola analyzovaná s nominálnou hodnotou p (p < 0,0001).
Tabuľka 4. Výsledky 24-týždňového placebom kontrolovaného skúšania dapagliflozínu v prídavnej kombinovanej liečbe s metformínom a sulfonylureou
 Prídavná kombináciaSulfonylurea+ Metformín
Prídavná kombináciaSulfonylurea+ Metformín1
Dapagliflozín
10 mg
Placebo
Na 108 108
HbA1c (%)b
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Rozdiel oproti placebuc
(95 % IS)
Jedinci (%) dosahujúci: HbA1c < 7 %
8,08
-0,86
−0,69*
(−0,89, −0,49)
8,24
-0,17
Upravený podľa východiskovej hodnoty
Telesná hmotnosť (kg)
31,8* 11,1
Východisková hodnota (priemer) Zmena od východiskovej hodnotyc Rozdiel oproti placebuc
(95 % IS)
88,57
-2,65
−2,07*
(−2,79, −1,35)
90,07
-0,58







1 Metformín (formulácie s okamžitým alebo predĺženým uvoľňovaním) ≥1500 mg/deň plus maximálne tolerovaná dávka sulfonylurey, ktorá musí byť aspoň polovica maximálnej dávky po dobu najmenej
8 týždňov pred vstupom do štúdie.
a Randomizovaní a liečení pacienti s východiskovou hodnotou a s najmenej jedným povýchodiskovým meraním účinnosti.
b HbA1c analyzovaní LRM (Analýza longitudinálnych opakovaných meraní)
c cPriemer najmenších štvorcov upravený na východiskovú hodnotu
* p-hodnota < 0,0001 oproti placebu + perorálne antidiabetiká

Tabuľka 5. Výsledky v 24. týždni (LOCFa) v placebom kontrolovanom skúšaní dapagliflozínu v kombinácii s inzulínom (osamote alebo s perorálnymi antidiabetikami vrátane metformínu)
Dapagliflozín 10 mg
+ inzulín
Placebo
+ inzulín
Parameter
±
perorálne
antidiabetíká
2
±
perorálne
antidiabetíká
2
Nb 194 193
 HbA1c (%)
HbA1c (%)
Východisková hodnota
(priemer)
Zmena od východiskovej hodnotyc
Odlišnosť od placebac
(95 % IS)
 Telesná hmotnosť (kg)
Telesná hmotnosť (kg) Východisková hodnota (priemer)
Zmena od východiskovej hodnotyc

Odlišnosť od placebac
(95 % IS)
Priemerná denná dávka inzulínu (IU)1
Východisková hodnota
(priemer)
Zmena od východiskovej hodnotyc
Odlišnosť od placebac
(95 % IS)
Jedinci so znížením priemernej dennej dávky
inzulínu o minimálne
10 % (%)
8,58
-0,90
-0,60*
(-0,74; -0,45)
94,63
-1,67
-1,68*
(-2.19; -1.18)
77,96
-1,16
-6,23*
(-8,84; -3,63)
19,7**
8,46
-0,30
94,21
0,02
73,96
5,08
11,0

aLOCF: Analýza, ktorá používa posledné hodnotenie v štúdii (pred dátumom prvej vzostupnej titrácie, ak bola potrebná)
bvšetci randomizovaní jedinci, ktorí užili minimálne jednu dávku dvojito zaslepeného skúšaného lieku počas krátkodobého obdobia dvojitého zaslepenia
cpriemer najmenších štvorcov upravený na východiskovú hodnotu a prítomnosť perorálneho antidiabetika
*hodnota p < 0,0001 v porovnaní s placebom + inzulín ± perorálne antidiabetikum
**hodnota p < 0,05 v porovnaní s placebom + inzulín ± perorálne antidiabetikum
1vzostupná titrácia inzulínových režimov (vrátane inzulínu s krátkodobým účinkom, stredne dlhým účinkom a bazálneho inzulínu) bola dovolená v prípade, ak jedinci splnili vopred definované kritéria FPG
2päťdesiat percent jedincov používalo liečbu inzulínom v monoterapii na začiatku; 50 % užívalo 1 alebo
2 perorálne antidiabetíká ako prídavok k inzulínu: v druhej skupine užívalo 80 % metformín osamote,
12 % užívalo metformín plus liečbu sulfonylureou a zvyšok pacientov užíval iné perorálne antidiabetiká.
Plazmatická hladina glukózy nalačnoLiečba dapagliflozínom ako prídavnej liečby buď k metformínu osamote (dapagliflozín 10 mg QD
alebo dapagliflozín 5 mg BID) alebo metformínu plus sitagliptín, sulfonylurea alebo inzulínu viedla
k štatisticky významným zníženiam v plazmatickej hladine glukózy nalačno (-1,90 až -1,20 mmol/l [-
34,2 až -21,7 mg/dl]) v porovnaní s placebom (-0,58 až 0,18 mmol/l [-10,4 až 3,3 mg/dl]) v 16. týždni
(5 mg BID) alebo 24. týždni. Tento účinok sa pozoroval v 1. týždni liečby a v predĺžených skúšaniach sa udržal až do 104. týždňa.
Hladina glukózy po jedle
Liečba dapagliflozínom 10 mg ako prídavnej liečby k sitagliptínu plus metformín viedla k zníženiam v hladinám glukózy po jedle po 2 hodinách v 24. týždni a zníženia sa udržali až do 48. týždňa.
Telesnáhmotnosť
Dapagliflozín ako prídavná liečba k metformínu osamote alebo k metformínu plus sitagliptín, sulfonylureaalebo k inzulínu (s ďalšími perorálnymi antidiabetikami vrátane metformínu alebo bez nich) viedla k štatisticky významnému zníženiu telesnej hmotnosti až do 24. týždňa (p < 0,0001, tabuľka 3,4 a 5). Tieto účinky pretrvávali v dlhodobých skúšaniach. V 48. týždni bola odlišnosť pri dapagliflozíne ako prídavnej liečby k metformínu plus sitagliptín v porovnaní s placebom -2,07 kg. V 102. týždni bola odlišnosť pri dapagliflozíne ako prídavnej liečby k metformínu v porovnaní
s placebom -2,14 alebo ako prídavnej liečby k inzulínu v porovnaní s placebom -2,88 kg.
Ako prídavná liečba k metformínu v aktívne kontrolovanom skúšaní non-inferiority, dapagliflozín viedol k štatisticky významnej zmene v telesnej hmotnosti v porovnaní s glipizidom o -4,65 kg v 52. týždni (p < 0,0001, tabuľka 2), ktorá v 104. a 208. týždni pretrvávala (-5,06 kg a -4.38 kg v uvedenom poradí).
24-týždňové skúšanie u 182 jedincov s diabetom, u ktorých sa na zhodnotenie zloženia tela použila dvojenergetická röntgenová absorpciometria (DXA), sa pri dapagliflozíne 10 mg plus metformín
v porovnaní s placebom plus metformín preukázalo skôr zníženie telesnej hmotnosti a množstva telesného tuku, na základe merania pomocou DXA, ako chudého tkaniva alebo úbytku tekutín. Liečba dapagliflozínom 10 mg plus metformín preukázala početný úbytok viscerálneho adipózneho tkaniva
v porovnaní s liečbou placebom plus metformín v podskúšaní s použitím zobrazovania pomocou magnetickej rezonancie.
Krvnýtlak
Vo vopred špecifikovanej združenej analýze 13 placebom kontrolovaných skúšaní viedla liečba dapagliflozínom 10 mg k zmene v systolickom krvnom tlaku z východiskovej hodnoty o -3,7 mmHg a diastolického krvného tlaku o -1,8 mmHg v porovnaní s -0,5 mmHg pri systolickom a -0,5 mmHg diastolickom krvnom tlaku v skupine s placebom v 24. týždni. Rovnaké poklesy sa pozorovali až do
104. týždňa.
V dvoch 12-týždňových, placebom kontrolovaných štúdiách bolo liečených dapagliflozínom 10 mg alebo placebom celkovo 1 062 pacientov s nedostatočne kontrolovaným diabetom 2. typu a hypertenziou (aj napriek predchádzajúcej stabilnej liečbe ACE-I alebo ARB v jednej štúdii a ACE-I alebo ARB plus jedno ďalšie antihypertenzívum v druhej štúdii). V 12. týždni u oboch štúdií dapagliflozín v dávke 10 mg spolu so zvyčajným antidiabetikom vyvolali zlepšenie HbA1c a znížili placebom korigovaný systolický krvný tlak v priemere o 3,1 a 4,3 mmHg, v uvedenom poradí.
Kardiovaskulárnabezpečnosť
V klinickom programe sa vykonala meta-analýza kardiovaskulárnych udalostí. V klinickom programe bolo 34,4 % jedincov s kardiovaskulárnym ochorením v anamnéze (okrem hypertenzie) na začiatku
a 67,9 % malo hypertenziu. Kardiovaskulárne epizódy boli posudzované nezávislou posudkovou komisiou. Primárnym cieľovým ukazovateľom bol čas do výskytu prvej udalosti jedného
z nasledovných výsledkov: kardiovaskulárna smrť, cievna mozgová príhoda, infarkt myokardu (IM)
alebo hospitalizácia pre nestabilnú angínu. Primárne epizódy sa objavili v miere 1,62 % na jeden pacientsky rok u jedincov liečených dapagliflozínom a 2,06 % u jedincov s liečbou porovnávaným liekom na jeden pacientsky rok. Pomer rizika porovnávajúci dapagliflozín s porovnávaným liekom bol
0,79 (95% interval spoľahlivosti [IS]: 0,58; 1,07), naznačujúci, že v tejto analýze sa dapagliflozín nespájal so zvýšením kardiovaskulárneho rizika u pacientov s diabetes mellitus 2. typu.
Kardiovaskulárna smrť, IM a cievna mozgová príhoda sa pozorovali pri pomere rizika
0,77 (95% IS: 0,54; 1,10).
PacientisvýchodiskovouhodnotouHbA1c≥ 9 %
Vo vopred špecifikovanej analýze jedincov s východiskovou hodnotou HbA1c ≥ 9,0 % viedla liečba dapagliflozínom 10 mg k štatisticky významným zníženiam HbA1c v 24. týždni ako prídavku
k metformínu (upravená priemerná zmena od východiskovej hodnoty: -1,32 % pre dapagliflozín a -
0,53 % pre placebo).
Metformín
Prospektívna randomizovaná štúdia (UKPDS) preukázala dlhodobý prínos intenzívnej kontroly glukózy pri diabete 2. typu. Analýza výsledkov u pacientov s nadváhou liečených metformínom po zlyhaní liečby samotnou diétou preukázala:
- signifikantné zníženie absolútneho rizika akejkoľvek komplikácie súvisiacej s diabetom
v skupine s metformínom (29,8 prípadov/1 000 pacientskych rokov) oproti skupine so samotnou diétou (43,3 prípadov/1 000 pacientskych rokov), p = 0,0023 a oproti skupinám
s kombinovanou liečbou sulfonylureou a monoterapiou inzulínom (40,1 prípadov/1 000
pacientskych rokov), p = 0,0034;
- signifikantné zníženie absolútneho rizika akejkoľvek mortality súvisiacej s diabetom: metformín
7,5 prípadov/1 000 pacientskych rokov, samotná diéta 12,7 prípadov/1 000 pacientskych rokov, p = 0,017;
- signifikantné zníženie absolútneho rizika celkovej mortality: metformín 13,5 prípadov/1 000
pacientskych rokov oproti samotnej diéte 20,6 prípadov/1 000 pacientskych rokov, (p = 0,011)
a oproti skupinám s kombinovanou liečbou sulfonylureou a monoterapiou inzulínom
18,9 prípadov/1 000 pacientskych rokov (p = 0,021);
- signifikantné zníženie absolútneho rizika infarktu myokardu: metformín 11 prípadov/1 000
pacientskych rokov, samotná diéta 18 prípadov/1 000 pacientskych rokov, (p = 0,01).
Pediatrickápopulácia
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií s liekom Ebymect vo všetkých podskupinách pediatrickej populácie pre diabetes mellitus 2. typu (informácie o použití
v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Kombinované tablety Ebymect sú považované za bioekvivalentné so súbežným podávaním zodpovedajúcich dávok dapagliflozínu a metformíniumchloridu podávaných spolu vo forme jednotlivých tabliet.
Porovnávali sa farmakokinetiky dapagliflozínu 5 mg dvakrát denne a dapagliflozínu 10 mg jedenkrát denne u zdravých jedincov. Podávanie dapagliflozínu 5 mg dvakrát denne poskytlo podobné celkové expozície (AUCss) počas 24 hodín ako dapagliflozín 10 mg podávaný jedenkrát denne. Tak ako sa očakávalo, podávanie dapagliflozínu 5 mg dvakrát denne viedlo k nižším maximálnym plazmatickým koncentráciám (Cmax) a vyšším minimálnym plazmatickým koncentráciám dapagliflozínu (Cmin)
v porovnaní s podávaním dapagliflozínu 10 mg jedenkrát denne.
Interakciasjedlom
Podávanie tohto lieku zdravým dobrovoľníkom po jedle s vysokým obsahom tuku v porovnaní
s podávaním nalačno viedlo k rovnakému rozsahu expozície dapagliflozínu aj metformínu. Strava oneskorila dosiahnutie maximálnej koncentrácie o 1 až 2 hodiny a znížila maximálnu plazmatickú
koncentráciu dapagliflozínu o 29 % a metformínu o 17 %. Tieto zmeny sa nepovažujú za klinicky
významné.
Pediatrickápopulácia
Farmakokinetika v pediatrickej populácii sa neskúmala.
Nasledujúce informácie odrážajú farmakokinetické vlastnosti jednotlivých liečiv v tomto lieku.
Dapagliflozín
Absorpcia
Dapagliflozín sa rýchlo a dobre absorboval po perorálnom podaní. Maximálne plazmatické koncentrácie dapagliflozínu (Cmax) sa zvyčajne dosiahli do 2 hodín od podania nalačno. Geometrický
priemer hodnôt Cmax a AUCτ dapagliflozínu v rovnovážnom stave po podávaní jednej 10 mg dávky
denne bol 158 ng/ml a 628 ng h/ml v uvedenom poradí. Absolútna biologická dostupnosť dapagliflozínu po perorálnom podaní dávky 10 mg je 78 %.
Distribúcia
Dapagliflozín sa približne z 91 % viaže na bielkoviny. Väzba na bielkoviny ostala pri rôznych chorobných stavoch nezmenená (napr. pri poruche funkcie obličiek alebo pečene). Priemerný
distribučný objem dapagliflozínu v rovnovážnom stave bol 118 litrov.
Biotransformácia
Dapagliflozín sa extenzívne metabolizuje, hlavne za vzniku dapagliflozín 3-O-glukuronidu, ktorý je inaktívnym metabolitom. Dapagliflozín 3-O-glukuronid alebo ďalšie metabolity sa nepodieľajú na
účinkoch znižujúcich hladinu glukózy. Tvorba dapagliflozín 3-O-glukuronidu je sprostredkovaná
UGT1A9, enzýmom, ktorý sa nachádza v pečeni a v obličkách a metabolizácia sprostredkovaná CYP
bola u ľudí nepatrná.
Eliminácia
Po perorálnom podaní jednej dávky dapagliflozínu 10 mg zdravým jedincom bol priemerný terminálny polčas dapagliflozínu v plazme (t1/2) 12,9 hodín. Priemerný celkový systémový klírens dapagliflozínu podaného intravenózne bol 207 ml/min. Dapagliflozín a súvisiace metabolity sa eliminujú hlavne vylučovaním močom s menej ako 2 % nezmeneného dapagliflozínu. Po podaní
50 mg dávky [14C]-dapagliflozínu sa vylúčilo 96 %, 75 % v moči a 21 % v stolici. V stolici sa približne 15 % dávky vylúčilo v nezmenenej forme.
Linearita
Expozícia dapagliflozínu sa zvyšovala úmerne so zvyšujúcou sa dávkou v rozmedzí 0,1 až 500 mg a jeho farmakokinetika sa pri opakovanom dennom podávaní až 24 týždňov s časom nezmenila.
Osobitnéskupinypacientov
Porucha funkcie obličiek
V rovnovážnom stave (20 mg dapagliflozínu jedenkrát denne počas 7 dní) bola priemerná systémová expozícia dapagliflozínu u pacientov s diabetes mellitus 2.typu a miernou, stredne ťažkou alebo
ťažkou poruchou funkcie obličiek (určené meraním plazmatického klírens iohexolu) o 32 %, 60 %
a 87 % vyššia ako u pacientov s diabetes mellitus 2. typu s normálnou funkciou obličiek. 24-hodinové vylučovanie glukózy močom v rovnovážnom stave značne záviselo od funkcie obličiek a u jedincov
s diabetes mellitus 2. typu s normálnou funkciou obličiek sa vylúčilo 85 g glukózy/deň, u jedincov
s miernou poruchou funkcie obličiek 52 g/deň, so stredne ťažkou poruchou funkcie obličiek 18 g/deň a s ťažkým poškodením funkcie obličiek 11 g/deň. Vplyv hemodialýzy na expozíciu dapagliflozínu nie je známy.
Porucha funkcie pečene
U jedincov s miernou alebo stredne ťažkou poruchou pečene (Child-Pughove triedy A a B) boli priemerné hodnoty dapagliflozínu Cmax o 12 % a AUC o 36 % vyššie ako u zdravých jedincov párových kontrol. Tieto rozdiely sa nepovažujú za klinicky významné. U jedincov s ťažkou poruchou funkcie pečene (Child-Pughova trieda C) boli priemerné hodnoty dapagliflozín Cmax o 40 % a AUC o 67 % vyššie ako u zdravých pacientov párových kontrol.
Starší pacienti (≥ 65 rokov)
Zvýšenie expozície v závislosti od veku nie je klinicky významné u jedincov do 70 rokov. Zvýšenú expozíciu je však možné očakávať kvôli zníženej funkcii obličiek súvisiacej s vekom. Nie sú
k dispozícii dostatočné údaje na vytvorenie záverov o expozícii u pacientov vo veku > 70 rokov.
Pohlavie
Priemerná AUCss dapagliflozínu bola u žien bola odhadnutá o 22 % vyššia ako u mužov.
Rasovápríslušnosť
V systémovej expozícii medzi belochmi, černochmi a aziatmi nie sú klinicky významné rozdiely.
Telesnáhmotnosť
Zistilo sa že expozícia dapagliflozínu za znižuje so zvyšujúcou hmotnosťou. Preto pacienti s nízkou hmotnosťou môžu mať o niečo vyššiu expozíciu a pacienti s vyššou hmotnosťou o niečo nižšiu
expozíciu. Rozdiely v expozícii sa nepovažujú za klinicky významné.
Pediatrickápopulácia
Farmakokinetika sa v pediatrickej populácii nesledovala.
Metformín
Absorpcia
Po podaní perorálnej dávky metformínu sa Tmax dosiahne za 2,5 hodiny. Absolútna biologická dostupnosť 500 mg alebo 850 mg tablety metformínu je u zdravých jedincov približne 50-60 %. Po perorálnej dávke bolo v stolici vylúčených 20-30 % neabsorbovanej frakcie.
Po perorálnom podaní je absorpcia metformínu saturovateľná a neúplná. Predpokladá sa, že farmakokinetika absorpcie metformínu je nelineárna. Pri obvyklých dávkach a dávkovacích schémach metformínu sa rovnovážne plazmatické koncentrácie dosiahnu za 24-48 hodín a sú zvyčajne nižšie ako
1 µg/ml. V kontrolovaných klinických skúškach maximálne plazmatické hladiny (Cmax) metformínu neprekročili 4 µg/ml, a to ani pri maximálnych dávkach.
Distribúcia
Väzba na plazmatické proteíny je zanedbateľná. Metformín preniká do erytrocytov. Maximálna koncentrácia v krvi je nižšia než maximálna plazmatická koncentrácia a dochádza k nej približne v rovnakom čase. Červené krvinky najpravdepodobnejšie predstavujú sekundárny distribučný kompartment. Priemerný Vd sa pohyboval medzi 63-276 l.
Biotransformácia
Metformín sa vylučuje nezmenený močom. U ľudí neboli identifikované žiadne metabolity.
Eliminácia
Renálny klírens metformínu je > 400 ml/min, čo poukazuje na to, že metformín je eliminovaný glomerulárnou filtráciou a tubulárnou sekréciou. Po perorálnej dávke je zjavný konečný polčas
eliminácie približne 6,5 hodiny.
Osobitnéskupinypacientov
Porucha funkcie obličiek
U pacientov so zníženou funkciou obličiek (na základe merania klírensu kreatinínu) je renálny klírens znížený proporcionálne ku klírensu kreatinínu, a preto je polčas eliminácie predĺžený, čo vedie
k zvýšeným hladinám metformínu v plazme.
5.3 Predklinické údaje o bezpečnosti
Súbežnépodávaniedapagliflozínuametformínu
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní neodhalili žiadne osobitné riziko pre ľudí.
Nasledujúce informácie odrážajú predklinické údaje o bezpečnosti jednotlivých liečiv v lieku
Ebymect.
Dapagliflozín
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a fertility neodhalili žiadne osobitné riziko pre ľudí. Dapagliflozín nevyvolal nádory ani u myší alebo potkanov pri žiadnej z dávok hodnotených v rámci dvojročných štúdií karcinogenity.
Reprodukčnátoxicitaatoxicitavývinu
Priame podávanie dapagliflozínu dojčeným mláďatám potkanov a nepriama expozícia v pokročilej brezivosti (v období zodpovedajúcom druhému a tretiemu trimestru gravidity vzhľadom na
dozrievanie obličiek u ľudí) a laktácie sú spojené so zvýšeným výskytom a/alebo závažnosťou
dilatácie obličkovej panvičky a dilatácie tubulov u potomstva.
V skúšaní juvenilnej toxicity, v ktorej sa dapagliflozín podával priamo mladým potkanom od 21. do
90. dňa po narodení, sa zaznamenala dilatácia obličkovej panvičky a tubulov pri všetkých hladinách dávok; expozície mláďat pri najnižšej testovanej dávke boli ≥ 15-násobkom maximálnej odporúčanej dávky u ľudí. Tieto zistenia súviseli so zvýšením hmotnosti obličiek závislým od dávky
a s makroskopickým zväčšením obličiek pozorovaným pri všetkých dávkach. Dilatácia obličkovej panvičky a tubulov pozorovaná u mláďat v priebehu približne 1 mesiaca zotavovania sa nezvrátila
úplne.
V separátnom skúšaní prenatálneho a postnatálneho vývoja sa dapagliflozín podával brezivým samiciam potkanov od gestačného dňa 6 po postnatálny deň 21 a mláďatá boli lieku nepriamo vystavené in utero a počas laktácie. (Vykonalo sa satelitné skúšanie na stanovenie expozície dapagliflozínu v mlieku a u mláďat). Zistil sa zvýšený výskyt alebo závažnosť dilatácie obličkovej panvičky u dospelých potomkov liečených samíc, hoci iba pri najvyšších testovaných dávkach (expozície pre samice-matky predstavovali 1415-násobok maximálnej odporúčanej dávky u ľudí a pre mláďatá 137-násobok maximálnej odporúčanej dávky u ľudí). Ďalšia vývinová toxicita bola obmedzená na zníženie telesnej hmotnosti mláďat v závislosti od dávky a pozorovala sa iba pri dávkach ≥ 15 mg/kg/deň (expozícia mláďat ≥ 29 násobne vyššia ako hodnoty u ľudí pri maximálnych odporúčaných dávkach). Toxicita pre brezivé samice bola zrejmá iba pri najvyšších testovaných dávkach a bola obmedzená na prechodné zníženie telesnej hmotnosti a spotrebu potravy pri danej dávke. Hladina, pri ktorej nebol pozorovaný žiadny nežiaduci účinok (NOAEL) na vývinovú toxicitu, najnižšia testovaná dávka, súvisí so systémovou expozíciou brezivých samíc mnohonásobnej dávke, ktorá je približne 19-násobkom hodnoty u ľudí pri maximálnej odporúčanej dávke.
V ďalších skúšaniach zameraných na embryofetálny vývin potkanov a králikov sa dapagliflozín podával v obdobiach predstavujúcich hlavné obdobia organogenézy u každého z druhov. Pri žiadnej testovanej dávke sa nezistila toxicita pre brezivé samice králikov ani toxicita ovplyvňujúca vývin králikov; najvyššia testovaná dávka súvisí so systémovou expozíciou pri približne 1191-násobku maximálnej odporúčanej dávky u ľudí. U potkanov dapagliflozín nevykazoval ani embryoletálny ani teratogénny účinok pri expozícii do 1441-násobku maximálnej odporúčanej dávky u ľudí.
Metformín
Predklinické údaje pre metformín na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity a vývinu
neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadrotablety: Hydroxypropylcelulóza (E463) Mikrokryštalická celulóza (E460(i)) Magnéziumstearát (E470b)
Sodná soľ karboxymetylškrobu typu A
Filmový
obal: Polyvinylalkohol (E1203) Makrogol 3350 (E1520(iii)) Mastenec (E553b)
Oxid titaničitý (E171) Žltý oxid železitý (E172)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti3 roky.
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaPVC/PCTFE/Alu blister. Veľkosti balenia:
14, 28, 56 a 60 filmom obalených tabliet v blistroch bez perforácie.
60 x 1 filmom obalená tableta v blistroch s perforáciou umožňujúcich oddelenie jednotlivej dávky. Viacnásobné balenie obsahujúce 196 (2 balenia po 98) filmom obalených tabliet v blistroch bez
perforácie.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAstraZeneca AB
SE-151 85 Södertälje
Švédsko
8. REGISTRAČNÉ ČÍSLAEU/1/15/1051/007 5 mg/1000 mg 14 tabliet EU/1/15/1051/008 5 mg/1000 mg 28 tabliet EU/1/15/1051/009 5 mg/1000 mg 56 tabliet EU/1/15/1051/010 5 mg/1000 mg 60 tabliet
EU/1/15/1051/011 5 mg/1000 mg 60 x 1 tableta (jednotlivá dávka) EU/1/15/1051/012 5 mg/1000 mg 196 (2 x 98) tabliet (viacnásobné balenie)
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.