
br />avatrombopagu týždenne
• Ukončite liečbu avatrombopagom.
|
T
abuľka 3: Titračné úrovne dávok avatrombopagu u pacientov s primárnou chronickou
im
unitnou trombocytopéniou
D
ávka
≠
|
Ú
roveň dávok
|
40 mg jedenkrát denne
|
6
|
40 mg trikrát týždenne A 20 mg po štyri zvyšné dni každého týždňa
|
5
|
20 mg jedenkrát denne*
|
4
|
20 mg trikrát týždenne
|
3
|
20 mg dvakrát týždenne ALEBO 40 mg jedenkrát týždenne
|
2
|
20 mg jedenkrát týždenne
|
1
|
* Začiatočný režim dávkovania pre všetkých pacientov
okrem tých, ktorí užívajú
stredne silné alebo silné duálne induktory alebo
stredne silné alebo silné duálne inhibítory CYP2C9 a CYP3A4/5
alebo len CYP2C9.
≠ Pacienti, ktorí užívajú avatrombopag menej často ako jedenkrát denne, majú užívať tento liek každý týždeň konzistentne.
3. Úroveň dávok : tri za sebou nenasledujúce dni v týždni, napr. pondelok, streda a piatok
2. Úroveň dávok : dva za sebou nenasledujúce dni v týždni, napr. pondelok a piatok
1. Úroveň dávok : každý týždeň v rovnaký deň, napr. pondelok
V prípade vynechania dávky majú pacienti užiť vynechanú dávku avatrombopagu hneď, ako si na to spomenú. Pacienti nemajú užívať dve dávky naraz, aby nahradili vynechanú dávku, a nasledujúcu dávku majú užiť podľa aktuálneho režimu.
Avatrombopag sa môže podávať spolu s inými liekmi na ITP. Pri kombinácii avatrombopagu s inými liekmi na liečbu primárnej ITP sa má sledovať počet trombocytov, aby sa zabránilo prekročeniu odporúčaného rozsahu počtu trombocytov a má sa určiť, či sa má dávka niektorého z liekov znížiť.
Ukončenie liečbyAk sa počet trombocytov po 4 týždňoch podávania maximálnej dávky 40 mg jedenkrát denne nezvýši na ≥ 50 x 109/l, liečba avatrombopagom sa má ukončiť. Ak je počet trombocytov po
2 týždňoch podávania dávky 20 mg jedenkrát týždenne vyšší ako 250 x 109/l, liečba Dopteletom sa
má ukončiť.
O
dporúčané dávkovanie so súbežne podávanými stredne silnými alebo silnými duálnymi induktormi alebo inhibítormi CYP2C9 a CYP3A4/5 alebo len CYP2C9 u pacientov s chronickou imunitnou trombocytopéniou
Odporúčané začiatočné dávky avatrombopagu u pacientov s chronickou imunitnou trombocytopéniou, ktorí súbežne dostávajú iné lieky, sú zhrnuté v tabuľke 4.
Tabuľka 4: Odporúčaná začiatočná dávka avatrombopagu u pacientov s primárnou chronickou imunitnou trombocytopéniou na základe súbežne podávaných liekovSúbežne podávané lieky
| Odporúčaná začiatočná dávka
|
Stredne silné alebo silné duálne inhibítory CYP2C9
a CYP3A4/5 alebo len CYP2C9 (napr. flukonazol)
| 20 mg (1 tableta) trikrát týždenne
|
Stredne silné alebo silné duálne induktory CYP2C9
a CYP3A4/5 alebo len CYP2C9 (napr. rifampicín, enzalutamid)
| 40 mg (2 tablety) jedenkrát denne
|
Osobitné skupiny pacientovStarší pacientiU pacientov vo veku 65 rokov a starších nie je potrebná žiadna úprava dávky (pozri časť 5.2).
Porucha funkcie obličiekAvatrombopag sa nevylučuje obličkami, preto u pacientov s miernou alebo stredne závažnou poruchou funkcie obličiek nie je potrebná žiadna úprava dávky. Avatrombopag sa neskúmal
u pacientov so závažnou poruchou funkcie obličiek (pozri časť 5.2).
Porucha funkcie pečeneU pacientov s miernou (Childova-Pughova trieda A) až stredne závažnou (Childova-Pughova trieda B)
poruchou funkcie pečene nie je potrebná žiadna úprava dávky.
Z dôvodu obmedzených dostupných údajov nebola stanovená bezpečnosť a účinnosť avatrombopagu u pacientov so závažnou poruchou funkcie pečene (Childova-Pughova trieda C, skóre MELD > 24) (pozri časť 4.4). Nepredpokladá sa potreba úpravy dávky u týchto pacientov. Liečba avatrombopagom sa má u pacientov so závažnou poruchou funkcie pečene začať len ak očakávaný prínos prevažuje nad očakávanými rizikami (pozri časti 4.4 a 5.2).
Súbežné ochoreniaBezpečnosť a účinnosť avatrombopagu u dospelých pacientov s chronickou ITP a vírusom ľudskej imunodeficiencie [HIV], vírusom hepatitídy C [HCV] alebo u pacientov so známym systémovým lupusom erythematosus, akútnou hepatitídou, aktívnou chronickou hepatitídou, cirhózou, lymfoproliferatívnym ochorením, myeloproliferatívnymi poruchami, leukémiou, myelodyspláziou (MDS), súbežným malígnym ochorením a významným kardiovaskulárnym ochorením (napr. kongestívne zlyhanie srdca stupňa III/IV, fibrilácia predsiení, stav po bypasse koronárnych artérií alebo zavedenie stentu) neboli z dôvodu obmedzených alebo chýbajúcich informácií stanovené.
Pediatrická populáciaBezpečnosť a účinnosť avatrombopagu u detí mladších ako 18 rokov neboli stanovené. K dispozícii nie sú žiadne údaje.
Polymorfizmus straty funkcie CYP2C9Expozícia avatrombopagu sa môže zvýšiť u pacientov s polymorfizmom straty funkcie CYP2C9*2
a CYP2C9*3. U zdravých jedincov (n = 2), ktorí boli homozygoti pre tieto mutácie (slabí metabolizátori) bola expozícia približne 2-násobne vyššia v porovnaní s jedincami s divokým typom
CYP2C9.
Spôsob podávania
Doptelet je určený na perorálne použitie a tablety sa majú užívať s jedlom (pozri časť 5.2).
4.3 Kontraindikácie
Precitlivenosť na avatrombopag alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Trombotické/tromboembolické príhody
U pacientov s chronickým ochorením pečene je známe zvýšené riziko výskytu tromboembolických
príhod. U pacientov s chronickým ochorením pečene, ktorí mali počet trombocytov > 200 x 109/l
a dostávali agonistu trombopoetínového receptora, sa hlásila zvýšená frekvencia výskytu trombózy portálnej žily (pozri časť 4.8). U pacientov s chronickou imunitnou trombocytopéniou sa
tromboembolické príhody (arteriálne alebo venózne) vyskytli u 7 % (9/128) pacientov užívajúcich
avatrombopag (pozri časť 4.8).
Doptelet sa neskúmal u pacientov s predchádzajúcim výskytom tromboembolických príhod. Pri podávaní Dopteletu pacientom so známymi rizikovými faktormi výskytu tromboembólie, okrem iného vrátane genetických protrombických ochorení (faktor V Leiden, protrombín 20210A, antitrombínová nedostatočnosť alebo nedostatočnosť proteínu C alebo S), pokročilého veku, dlhodobo imobilizovaných pacientov, zhubných nádorov, antikoncepcie a hormonálnej substitučnej liečby, chirurgického zákroku/úrazu, obezity a fajčenia je potrebné zvážiť potenciálne zvýšené trombotické riziko. Doptelet sa nemá podávať pacientom s chronickým ochorením pečene alebo chronickou imunitnou trombocytopéniou pri pokuse o normalizovanie počtu trombocytov.
Predĺženie intervalu QTcso súbežne podávanými liekmi
Pri expozíciách podobných expozíciám dosahovaným pri dávkach 40 mg a 60 mg Doptelet
nepredlžoval interval QT v žiadnom klinicky významnom rozsahu. Na základe analýzy údajov zo súhrnných klinických skúšaní u pacientov s chronickým ochorením pečene sa ani pri najvyššom
odporúčanom terapeutickom dávkovacom režime neočakávajú účinky spôsobujúce priemerné
predĺženie intervalu QTc o > 20 ms. Pri súbežnom podávaní Dopteletu so stredne silnými alebo silnými duálnymi inhibítormi CYP3A4/5 a CYP2C9 alebo so stredne silnými alebo silnými
inhibítormi CYP2C9 je však potrebná opatrnosť, pretože tieto lieky môžu zvyšovať expozície
avatrombopagu. Opatrnosť je potrebná aj u pacientov s polymorfizmom straty funkcie CYP2C9, pretože u nich môže byť zvýšená expozícia avatrombopagu.
Opätovný výskyt trombocytopénie a krvácaniapoukončeníliečbyupacientov s chronickouimunitnou trombocytopéniou
Po ukončení liečby avatrombopagom je u pacientov s ITP pravdepodobný opätovný výskyt
trombocytopénie. Po ukončení liečby avatrombopagom sa počet trombocytov u väčšiny pacientov vráti do 2 týždňov na východiskové hodnoty, čo zvyšuje riziko krvácania a v niektorých prípadoch
môže viesť ku krvácaniu. Ak sa liečba avatrombopagom ukončí v prítomnosti antikoagulancií alebo
látok pôsobiacich proti trombocytom, existuje zvýšené riziko krvácania. U pacientov sa má po ukončení liečby avatrombopagom starostlivo sledovať zníženie počtu trombocytov a vhodnou liečbou sa má zabrániť krvácaniu. Po ukončení liečby avatrombopagom sa odporúča opätovne začať liečbu ITP podľa aktuálnych liečebných smerníc. Doplnková liečba môže zahŕňať prerušenie podávania antikoagulačnej liečby a/alebo liečby pôsobiacej proti trombocytom, zvrátenie antikoagulácie alebo podporu tvorby trombocytov.
Z
výšená hladina retikulínu v kostnej dreni
Zvýšená hladina retikulínu v kostnej dreni je pravdepodobne výsledkom stimulácie receptora
trombopoetínového (TPO) receptora, ktorá vedie k zvýšenému počtu megakaryocytov v kostnej dreni, ktoré môžu následne uvoľňovať cytokíny. Morfologické zmeny v periférnych krvných bunkách môžu naznačovať zvýšenú hladinu retikulínu, ktorá sa dá zistiť biopsiou kostnej drene. Preto sa pred liečbou avatrombopagom a počas nej odporúčajú vyšetrenia bunkových morfologických anomálií použitím steru z periférnej krvi a kompletného krvného obrazu (CBC).
Ak sa u pacientov zistí nedostatočná účinnosť a abnormálny ster z periférnej krvi, podávanie
avatrombopagu sa má ukončiť, má sa vykonať fyzikálne vyšetrenie a zvážiť biopsia kostnej drene
s vhodným sfarbením pre retikulín. Ak je dostupný výsledok predchádzajúcej biopsie kostnej drene, má sa urobiť porovnanie. Ak je účinnosť zachovaná a zároveň sú u pacientov pozoruje abnormálny
ster z periférnej krvi, lekár má urobiť príslušné klinické posúdenie vrátane zváženia biopsie kostnej drene a znovu sa má prehodnotiť pomer prínosu a rizika avatrombopagu a alternatívnych možností
liečby ITP.
Progresia existujúceho myelodysplastického syndrómu (MDS)
Účinnosť a bezpečnosť Dopteletu neboli pri liečbe trombocytopénie spôsobenej MDS stanovené.
Doptelet sa mimo klinických štúdií nemá používať na liečbu trombocytopénie spôsobenej MDS.
Existuje teoretická obava, že agonisti trombopoietínového receptora (TPO-R) môžu stimulovať progresiu existujúcich hematologických malignít ako je MDS. Agonisti TPO-R sú rastové faktory, ktoré vedú k expanzii trombopoetických progenitorových buniek, ich diferenciácii a k tvorbe trombocytov. K exprimácii TPO-R dochádza predovšetkým na povrchu buniek myeloidnej línie.
V prípade agonistov TPO-R existuje riziko, že môžu stimulovať progresiu existujúcich hematopoetických malignít ako je MDS.
Diagnóza ITP u dospelých a starších pacientov sa má potvrdiť vylúčením iných klinických entít prejavujúcich sa trombocytopéniou, predovšetkým sa musí vylúčiť diagnóza MDS. V priebehu ochorenia a liečby sa má zvážiť vykonanie aspirácie a biopsie kostnej drene, najmä u pacientov starších ako 60 rokov, u pacientov so systémovými príznakmi alebo abnormálnymi prejavmi, ako je napríklad zvýšený počet periférnych blastových buniek.
Závažná porucha funkcie pečene
Informácie o používaní avatrombopagu u pacientov so závažnou poruchou funkcie pečene
(Childova-Pughova trieda C, skóre MELD > 24) sú obmedzené. Avatrombopag sa má u týchto
pacientov používať len ak očakávaný prínos prevažuje nad očakávanými rizikami (pozri časti 4.2
a 5.2).
Pacienti so závažnou poruchou funkcie pečene majú byť podporovaní v súlade s klinickou praxou
a podľa potreby pomocou dôkladného sledovania skorých prejavov zhoršenia alebo nového výskytu
encefalopatie, ascitu a sklonu k trombóze alebo krvácaniu, prostredníctvom pečeňových funkčných
testov, testov na vyhodnotenie stavu krvnej zrážanlivosti a prostredníctvom zobrazovania portálnej žily.
Pacientov s ochorením pečene Childovej-Pughovej triedy C, ktorí užívajú avatrombopag pred invazívnym zákrokom, je potrebné vyhodnotiť v deň zákroku ohľadne neočakávane vysokého zvýšenia počtu trombocytov.
Použitie u pacientov s chronickým ochorením pečene, ktorí majú podstúpiťinvazívnyzákrok
Cieľom liečby Dopteletom je zvýšenie počtu trombocytov. Aj keď je pravdepodobné, že profil
prínosu-rizika pre iné zákroky, ktoré neboli špecificky zahrnuté v klinických štúdiách, bude
porovnateľný, účinnosť a bezpečnosť avatrombopagu neboli stanovené pri veľkých chirurgických
zákrokoch, ako je laparotómia, torakotómia, chirurgické zákroky na otvorenom srdci, kraniotómia alebo excízia orgánov.
Opakovaná liečba u pacientov s chronickýmochorenímpečene,ktorímajúpodstúpiťinvazívnyzákrok
Informácie o používaní avatrombopagu u pacientov už predtým užívajúcich avatrombopag sú
obmedzené.
Súbežné podávanie s liekmi obsahujúcimi interferón
Pre lieky obsahujúce interferón je známe, že znižujú počet trombocytov, preto to treba zvážiť pri
súbežnom podávaní avatrombopagu s liekmi obsahujúcimi interferón.
Laktóza
Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, celkovým deficitom laktázy
alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Inhibítory P-gp
Súbežné používanie avatrombopagu s inhibítormi P-gp malo za následok zmeny expozície, ktoré
neboli klinicky významné. Neodporúča sa žiadna úprava dávky (pozri časť 5.2).
Inhibítory CYP3A4/5 a CYP2C9
Súbežne používanie avatrombopagu so stredne silnými alebo silnými duálnymi inhibítormi CYP3A4/5
a CYP2C9 (napr. flukonazol) zvyšuje expozíciu avatrombopagu. Pri súbežnom používaní avatrombopagu so stredne silnými alebo silnými inhibítormi CYP2C9 sa očakáva zvýšenie expozície
avatrombopagu.
Chronické ochorenie pečene
Nepredpokladá sa, že by zvýšená expozícia avatrombopagu mala klinicky významný účinok na počet
trombocytov v dôsledku 5-dňovej liečby a neodporúča sa žiadna úprava dávky. U týchto pacientov však treba v deň zákroku vyhodnotiť neočakávane vysoké zvýšenie počtu trombocytov (pozri časti 4.2 a 5.2).
Chronická imunitná trombocytopénia
Pri súbežnom používaní so stredne silným alebo silným duálnym inhibítorom CYP2C9 a CYP3A4/5
sa má znížiť začiatočná dávka avatrombopagu (pozri tabuľku 4 a časť 4.2). U pacientov dostávajúcich stredne silné alebo silné inhibítory CYP2C9 sa má tiež zvážiť zníženie začiatočnej dávky.
U pacientov, ktorí počas liečby avatrombopagom začnú liečbu stredne silnými alebo silnými duálnymi inhibítormi CYP2C9 a CYP3A4/5 alebo stredne silnými alebo silnými inhibítormi CYP2C9, sa má sledovať počet trombocytov a podľa potreby upraviť dávka avatrombopagu (pozri tabuľku 2,
tabuľku 3 a časť 4.2).
Induktory CYP3A4/5 a CYP2C9
Súbežné používanie stredne silných alebo silných duálnych induktorov CYP3A4/5 a CYP2C9 (napr.
rifampicín, enzalutamid) znižuje expozíciu avatrombopagu a môže mať za následok znížený účinok na počet trombocytov. Pri súbežnom používaní avatrombopagu so stredne silnými alebo silnými induktormi CYP2C9 sa očakáva zníženie expozície avatrombopagu.
C
hronické
o
chorenie
pečene
Nepredpokladá sa, že by znížená expozícia avatrombopagu mala klinicky významný účinok na počet
trombocytov v dôsledku 5-dňovej liečby. Neodporúča sa žiadna úprava dávky (pozri časť 5.2).
Chronická imunitná trombocytopénia
Pri súbežnom používaní so stredne silným alebo silným duálnym induktorom CYP2C9 a CYP3A4/5
sa má zvýšiť odporúčané začiatočné dávkovanie Dopteletu (pozri tabuľku 4 a časť 4.2). U pacientov dostávajúcich stredne silné alebo silné induktory CYP2C9 sa má tiež zvážiť zvýšenie začiatočnej
dávky.
U pacientov, ktorí počas liečby avatrombopagom začnú liečbu stredne silnými alebo silnými duálnymi induktormi CYP2C9 a CYP3A4/5 alebo stredne silnými alebo silnými induktormi CYP2C9, sa má sledovať počet trombocytov a podľa potreby upraviť dávka (pozri tabuľku 2, tabuľku 3 a časť 4.2).
Lieky naliečbuITP
Medzi lieky používané na liečbu ITP v kombinácii s avatrombopagom v klinických skúšaniach patrili
kortikosteroidy, danazol, dapsón a intravenózny imunoglobulín (IVIg). Pri kombinovaní avatrombopagu s inými liekmi na liečbu ITP sa má sledovať počet trombocytov, aby sa neprekročil
odporúčaný rozsah.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití avatrombopagu u gravidných
žien. Štúdie na zvieratách sú nedostatočné z hľadiska reprodukčnej toxicity (pozri časť 5.3). Doptelet
sa neodporúča užívať počas gravidity a u žien vo fertilnom veku nepoužívajúcich antikoncepciu.
Dojčenie
Nie sú k dispozícii žiadne údaje o prítomnosti avatrombopagu v ľudskom mlieku, účinkoch na
dojčené dieťa ani účinkoch na tvorbu mlieka. Nie je známe, či sa avatrombopag alebo jeho
metabolity vylučujú do ľudského mlieka. Avatrombopag bol prítomný v mlieku laktujúcich potkanov, pozri časť 5.3. Riziko u dojčených novorodencov nemôže byť vylúčené. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu Dopteletom sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Účinok avatrombopagu na ľudskú fertilitu nebol stanovený a riziko nemožno vylúčiť. V štúdiách na
zvieratách nemal avatrombopag žiadny účinok na samčiu a samičiu fertilitu ani skorú embryogenézu u potkanov (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Doptelet nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Z
hrnutie bezpečnostného profiluChronickéochoreniepečeneBezpečnosť avatrombopagu sa vyhodnocovala v dvoch randomizovaných, dvojito zaslepených,
placebom kontrolovaných skúšaniach ADAPT-1 a ADAPT-2, v ktorých dostávalo 430 pacientov s chronickým ochorením pečene a trombocytopéniou buď avatrombopag (n = 274) alebo placebo
(n = 156), a u ktorých sa uskutočnilo 1 vyhodnotenie bezpečnosti po podaní dávky.
Chronická imunitná trombocytopéniaBezpečnosť avatrombopagu sa vyhodnocovala v troch kontrolovaných skúšaniach a jednom
nekontrolovanom skúšaní, do ktorých bolo zaradených 161 pacientov s chronickou imunitnou trombocytopéniou. Súhrnné údaje o bezpečnosti z týchto štyroch skúšaní zahŕňali 128 pacientov, ktorí
boli vystavení avatrombopagu s mediánom trvania 29 týždňov.
Tabuľkový zoznam nežiaducich reakciíNežiaduce účinky sú klasifikované podľa preferovaného výrazu a triedy orgánových systémov
a frekvencie. Frekvencie sú definované ako: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej
časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000).
Populácia štúdie chronického ochorenia pečeneTrieda orgánových systémov
(terminológia MedDRA*)
|
Časté
|
Menej časté
|
Poruchy krvi a lymfatického systému
|
| anémia
|
Poruchy ciev
|
| trombóza portálnej žily
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
|
| bolesť kostí
myalgia
|
Celkové poruchy a reakcie v mieste podania
| únava
| pyrexia
|
* Medicínsky slovník pre regulačné činnosti (Medical Dictionary for Regulatory Activities,
MedDRA) verzia 19.1.
Populácia štúdie chronickej primárnej imunitnej trombocytopénieTrieda orgánových
systémov podľa
terminológie MedDRA*
| Frekvencia
| Nežiaduca reakcia
|
Infekcie a nákazy
| menej časté
| furunkulitída, septická tromboflebitída, infekcia horných dýchacích ciest
|
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
| menej časté
| myelofibróza
|
Poruchy krvi a lymfatického systému
| časté
| trombocytopénia, anémia, splenomegália
|
menej časté
| leukocytóza
|
Poruchy metabolizmu a výživy
| časté
| hyperlipidémia, znížená chuť do jedla
|
menej časté
| dehydratácia, hypertriglyceridémia, zvýšená chuť
do jedla, nedostatok železa
|
Psychické poruchy
| menej časté
| výkyvy nálady
|
T
rieda orgánových systémov podľa terminológie MedDRA*
|
Frekvencia
|
N
ežiaduca reakcia
|
Poruchy nervového systému
|
veľmi časté
|
bolesť hlavy
|
časté
|
závrat, nepríjemné pocity v hlave, migréna, parestézia
|
menej časté
|
cievna mozgová príhoda, kognitívna porucha, dysgeúzia, hypestézia, porucha zmyslového vnímania, prechodný ischemický atak
|
Poruchy oka
|
menej časté
|
abnormálny pocit v oku, podráždenie očí, svrbenie očí, opuch očí, zvýšené slzenie,
nepríjemný pocit v očiach, fotofóbia, oklúzia
sietnicovej artérie, rozmazané videnie, zhoršenie zraku
|
Poruchy ucha a labyrintu
|
menej časté
|
bolesť v uchu, hyperakúzia
|
Poruchy srdca a srdcovej
činnosti
|
menej časté
|
infarkt myokardu
|
Poruchy ciev
|
časté
|
hypertenzia
|
menej časté
|
trombóza hlbokých žíl, trombóza krčných žíl,
vazokonstrikcia
|
Poruchy dýchacej sústavy,
hrudníka a mediastína
|
časté
|
epistaxa, dyspnoe
|
menej časté
|
hemoptýza, upchatý nos, pľúcna embólia
|
Poruchy gastrointestinálneho
traktu
|
časté
|
nevoľnosť, hnačka, vracanie, bolesť v hornej
časti brucha, plynatosť
|
menej časté
|
nepríjemný pocit v bruchu, distenzia brucha,
bolesť v dolnej časti brucha, anorektálne varixy, zápcha, grganie, gastroezofageálna refluxná choroba, glosodýnia, hemoroidy, orálna parestézia, opuchnutý jazyk, porucha jazyka
|
Poruchy pečene a žlčových
ciest
|
menej časté
|
trombóza portálnej žily
|
Poruchy kože a podkožného tkaniva
|
časté
|
vyrážka, akné, petéchie, svrbenie
|
menej časté
|
alopécia, suchá koža, ekchymóza, hyperhidróza,
porucha pigmentácie, svrbivá vyrážka, krvácanie z kože, podráždenie kože
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
|
časté
|
artralgia, bolesť chrbta, bolesť končatín, myalgia, bolesť svalov a kostí
|
menej časté
|
artropatia, nepríjemný pocit v končatinách, svalové kŕče, svalová slabosť, bolesť hrudných svalov a kostí
|
Poruchy obličiek a močových
ciest
|
menej časté
|
hematúria
|
Poruchy reprodukčného
systému a prsníkov
|
menej časté
|
menorágia, bolesť bradaviek
|
Celkové poruchy a reakcie v mieste podania
|
veľmi časté
|
únava
|
časté
|
asténia
|
menej časté
|
nepríjemný pocit v hrudi, hlad, bolesť, periférny
opuch
|
T
rieda orgánových systémov podľa terminológie MedDRA*
|
Frekvencia
|
N
ežiaduca reakcia
|
Laboratórne a funkčné
vyšetrenia
|
časté
|
zvýšená hladina glukózy v krvi, zvýšený počet
trombocytov, znížená hladina glukózy v krvi, zvýšená hladina triglyceridov v krvi, zvýšená
hladina laktátdehydrogenázy v krvi, zvýšený
počet trombocytov, zvýšená hladina alanínaminotransferázy, zvýšená hladina gastrínu v krvi
|
menej časté
|
zvýšená hladina aspartátaminotransferázy, zvýšený krvný tlak, nepravidelný srdcový
rytmus, zvýšená hladina pečeňových enzýmov
|
* Medicínsky slovník pre regulačné činnosti (Medical Dictionary for Regulatory Activities,
MedDRA) verzia 19.1.
Popis vybraných nežiaducich reakciíTromboembolicképríhodyV klinických skúšaniach ADAPT-1 a ADAPT-2 u pacientov s trombocytopéniou a chronickým
ochorením pečene sa v súvislosti s liečbou vyskytol u 1 pacienta prípad trombózy portálnej žily
(n = 1/430), ktorý bol hlásený 14 dní po ukončení liečby Dopteletom. Táto nežiaduca reakcia bola
vyhodnotená ako nezávažná.
V štyroch súhrnných klinických skúšaniach u pacientov s chronickou imunitnou trombocytopéniou sa tromboembolické príhody pozorovali u 7 % (9/128) pacientov. Jedinou tromboembolickou príhodou, ktorá sa vyskytla u viac ako 1 individuálneho pacienta, bola cievna mozgová príhoda, ktorá sa vyskytla u 1,6 % (2/128) pacientov.
Trombocytopénia po ukončeníliečbyupacientovschronickouimunitnoutrombocytopéniouV 4 súhrnných klinických skúšaniach u pacientov s chronickou imunitnou trombocytopéniou sa po
ukončení liečby pozorovali prechodné zníženia počtu trombocytov na hladiny nižšie než východiskové hladiny u 8,6 % (11/128) pacientov liečených avatrombopagom.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNa predávkovanie avatrombopagom nie je k dispozícii žiadne špecifické antidotum. Ak dôjde
k predávkovaniu alebo ak existuje podozrenie na predávkovanie, má sa ukončiť podávanie Dopteletu a pozorne sledovať počet trombocytov, keďže avatrombopag zvyšuje počet trombocytov v závislosti od dávky.
5 FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antihemoragiká, iné systémové hemostatiká, ATC kód: B02BX08
Mechanizmus účinku
Avatrombopag je perorálne aktívny agonista trombopoetínového (TPO) receptora s veľkosťou malej
molekuly, ktorý stimuluje proliferáciu a diferenciáciu megakaryocytov z progenitorových buniek kostnej drene vedúcu k zvýšenej tvorbe trombocytov. Avatrombopag nekonkuruje TPO pri väzbe na TPO receptor a má aditívny účinok s TPO na tvorbu trombocytov.
Klinická účinnosť abezpečnosť
Štúdiechronickéhoochoreniapečene
Účinnosť a bezpečnosť avatrombopagu pri liečbe dospelých pacientov s chronickým ochorením
pečene a počtom trombocytov ˂ 50 x 109/l, ktorí majú podstúpiť zákrok, sa skúmali v 2 identicky navrhnutých, multicentrických, randomizovaných, dvojito zaslepených štúdiách fázy 3
(ADAPT-1 a ADAPT-2). V oboch štúdiách boli pacienti pridelení do kohorty s nízkym počiatočným
počtom trombocytov (˂ 40 x 109/l) alebo do kohorty s vysokým počiatočným počtom trombocytov (≥ 40 až ˂ 50 x 109/l) na základe ich počiatočného počtu trombocytov. Pacienti boli randomizovaní v pomere 2:1 buď na užívanie avatrombopagu alebo placeba.
Pacienti v kohorte nízkeho počiatočného počtu trombocytov dostávali 60 mg avatrombopagu alebo zodpovedajúceho placeba jedenkrát denne počas 5 dní a pacienti v kohorte vysokého počiatočného počtu trombocytov dostávali 40 mg avatrombopagu alebo zodpovedajúceho placeba jedenkrát denne počas 5 dní. U spôsobilých pacientov bol vykonaný zákrok (zákroky s nízkym rizikom krvácania, ako je endoskopia a kolonoskopia (60,8 %), stredným rizikom krvácania, ako je biopsia pečene
a chemoembolizácia HCC (17,2 %) alebo vysokým rizikom krvácania, ako sú dentálne zákroky
a rádiofrekvenčná ablácia (22,1 %) 5 až 8 dní po poslednej dávke liečby. Populácie pacientov boli
podobné medzi kohortami s nízkym a vysokým počiatočným počtom trombocytov a pozostávali zo
66 % mužov a 35 žien, medián veku bol 58 rokov a 61 % bolo bielej rasy, 34 % bolo ázijského pôvodu a 3 % boli čiernej rasy. Celkovo 24,8 % pacientov bolo vo veku ≥ 65 rokov, 4,6 % bolo vo veku ≥ 75 rokov a len 1 (0,2 %) pacient bol vo veku ≥ 85 rokov. Skóre MELD pacientov bolo
v rozsahu od < 10 (37,5 %), od 10 do 14 (46,3 %) a od > 14 do < 24 (16,2 %) a zahrnutí boli pacienti s CTP triedy A (56,4 %), triedy B (38,1 %) a triedy C (5,6 %).
V štúdii ADAPT-1 bolo randomizovaných celkom 231 pacientov, 149 pacientov do skupiny
s avatrombopagom a 82 pacientov do skupiny s placebom. V kohorte s nízkym počiatočným počtom trombocytov bol priemerný počiatočný počet trombocytov v skupine liečenej avatrombopagom
31,1 x 109/l a v skupine, ktorej sa podávalo placebo, 30,7 x 109/l. V kohorte s vysokým počiatočným
počtom trombocytov bol priemerný počiatočný počet trombocytov v skupine liečenej
avatrombopagom 44,3 x 109/l a v skupine, ktorej sa podávalo placebo, 44,9 x 109/l.
V štúdii ADAPT-2 bolo randomizovaných celkom 204 pacientov, 128 pacientov do liečebnej skupiny s avatrombopagom a 76 pacientov do liečebnej skupiny s placebom. V kohorte s nízkym počiatočným počtom trombocytov bol priemerný počiatočný počet trombocytov v skupine liečenej avatrombopagom 32,7 x 109/l a v skupine, ktorej sa podávalo placebo, 32,5 x 109/l. V kohorte
s vysokým počiatočným počtom trombocytov bol priemerný počiatočný počet trombocytov v skupine
liečenej avatrombopagom 44,3 x 109/l a v skupine, ktorej sa podávalo placebo, 44,5 x 109/l.
Pacienti reagujúci na liečbu boli definovaní ako pacienti, ktorí po randomizácii a až do 7 dní po vykonaní zákroku nepotrebovali transfúziu trombocytov ani žiadny záchranný postup kvôli krvácaniu. Výsledky sú uvedené v tabuľke 5.
T
abuľka 5: Výsledky účinnosti v kohorte a liečebnej skupine s nízkym počiatočným počtom trombocytov – štúdie ADAPT-1 a ADAPT-2
K
ohorta s nízkym počiatočným počtom trombocytov (< 40 x 10
9
/
l)
|
K
ategória
|
ADAPT
-
1
|
ADAPT
-
2
|
Placebo
(
n = 48)
|
A
vatrombopag
60 mg
(
n = 90)
|
Placebo
(
n = 43)
|
A
vatrombopag
60 mg
(
n = 70)
|
P
omer pacientov, ktorí nepotrebovali transfúziu trombocytov ani žiadny záchranný postup kvôli krvácaniu
|
P
acienti reagujúci na liečbu
95 % IS
a
|
23 %
(
11; 35)
|
66 %
(
56; 75)
|
35 %
(
21; 49)
|
69 %
(
58; 79)
|
H
odnota p
b
|
˂ 0,0001
|
0,0006
|
Pomer pacientov, ktorí v deň vykonania zákroku dosiahli počet trombocytov ≥ 50 × 10
9
/l
|
P
acienti reagujúci na liečbu
95 % IS
a
|
4 %
(
0, 10)
|
69 %
(
59, 79)
|
7 %
(
0, 15)
|
67 %
(
56, 78)
|
H
odnota p
b
|
˂ 0,0001
|
˂ 0,0001
|
Z
m
ena v počte trombocytov od počiatočného stavu po deň vykonania zákroku
|
P
riemer (SD) x 109/l
|
0,8 (6,4)
|
32,0 (25,5)
|
3,0 (10,0)
|
31,3 (24,1)
|
Medián x 109/l
|
0,5
|
28,3
|
0,5
|
28,0
|
H
odnota p
c
|
˂ 0,0001
|
˂ 0,0001
|
V
ysoký počiatočný počet trombocytov (≥ 40 až < 50 x 10
9
/
l)
|
K
ategória
|
ADAPT
-
1
|
ADAPT
-
2
|
Placebo
(
n = 34)
|
A
vatrombopag
40 mg
(
n = 59)
|
Placebo
(
n = 33)
|
A
vatrombopag
40 mg
(
n = 58)
|
P
omer pacientov, ktorí nepotrebovali transfúziu trombocytov ani žiadny záchranný postup kvôli krvácaniu
|
P
acienti reagujúci na liečbu
95 % IS
a
|
38 %
(
22; 55)
|
88 %
(
80; 96)
|
33 %
(
17; 49)
|
88 %
(
80; 96)
|
H
odnota p
b
|
˂ 0,0001
|
˂ 0,0001
|
Pomer pacientov, ktorí v deň vykonania zákroku dosiahli počet trombocytov ≥ 50 × 10
9
/l
|
P
acienti reagujúci na liečbu
95 % IS
a
|
21 %
(
7, 34)
|
88 %
(
80, 96)
|
39 %
(
23, 56)
|
93 %
(
87, 100)
'
|
H
odnota p
b
|
˂ 0,0001
|
˂ 0,0001
|
Z
m
ena v počte trombocytov od počiatočného stavu po deň vykonania zákroku
|
P
riemer (SD) x 109/l
|
1,0 (9,3)
|
37,1 (27,4)
|
5,9 (14,9)
|
44,9 (33,0)
|
Medián x 109/l
|
0,0
|
33,0
|
3,3
|
41,3
|
H
odnota p
c
|
˂ 0,0001
|
˂ 0,0001
|
a. Obojstranný 95 % interval spoľahlivosti na základe normálneho priblíženia. b. Cochranov-Mantelov-Haenszelov test.
c. Wilcoxonov test súčtu poradia.
|
Meraná hodnota zvýšenia počtu trombocytov sa pozorovala v oboch liečebných skupinách
s avatrombopagom v priebehu času od 4. dňa po podaní dávky, pričom maximum dosiahla
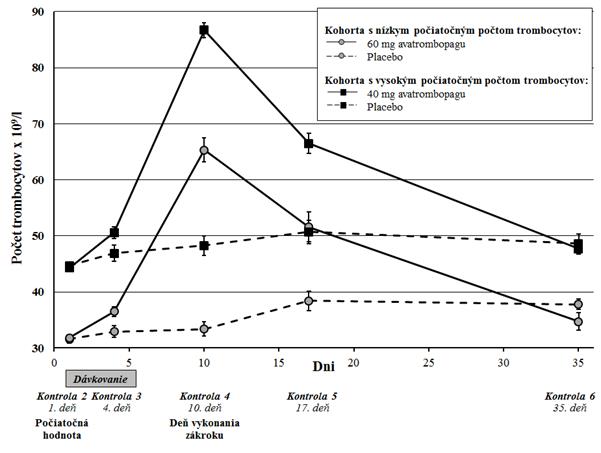
v 10. - 13. deň a potom sa vrátila na takmer počiatočné hodnoty v 35. deň (obrázok 1). Priemerný
počet trombocytov zostal vyšší alebo rovný 50 x 109/l v 17. deň (5. kontrola).
O
brázok 1: Priemerný počet trombocytov (+/- štandardná chyba) podľa dní od začatia
podávania lieku a kohort a liečebných skupín podľa počiatočného počtu trombocytov
– súhrnné údaje zo štúdií ADAPT-1 a ADAPT-2
Účinnosť avatrombopagu bola podobná v rámci rôznych podskupín pre súhrnnú populáciu štúdií fázy 3 (ADAPT-1 a ADAPT-2). Pomer osôb, ktoré nepotrebovali transfúziu trombocytov ani žiadny záchranný postup kvôli krvácaniu bol vo všeobecnosti podobný v rámci všetkých podskupín.
Štúdie chronickej imunitnej trombocytopénieÚčinnosť Dopteletu u dospelých pacientov s chronickou imunitnou trombocytopéniou sa
vyhodnocovala v multicentrickej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii fázy 3 (štúdia 302). Pacienti predtým dostávali jednu alebo viac predchádzajúcich terapií chronickej
imunitnej trombocytopénie a mali priemerné skríningové a východiskové počty trombocytov
< 30 x 109/l. Pacienti boli centrálne stratifikovaní podľa stavu splenektómie, východiskového počtu trombocytov (≤ 15 alebo > 15 x 109/l) a používania súbežnej liečby chronickej imunitnej trombocytopénie a následne boli randomizovaní (v pomere 2 : 1) do skupiny dostávajúcej po dobu
6 mesiacov buď avatrombopag alebo placebo. Pacienti dostávali začiatočnú dávku 20 mg jedenkrát
denne, pričom dávky boli následne titrované na základe trombocytovej odpovede.
Okrem toho mohli pacienti postupne vysadiť súbežne podávané lieky na ITP a dostať záchrannú liečbu podľa miestnych štandardov starostlivosti. Viac ako polovica všetkých pacientov v každej liečebnej skupine podstúpila v minulosti ≥ 3 predchádzajúce liečby ITP a 29 % pacientov v skupine s placebom
a 34 % pacientov v skupine s avatrombopagom malo v minulosti splenektómiu.
Randomizovaných bolo 49 pacientov, 32 do skupiny s avatrombopagom a 17 do skupiny s placebom, s podobným priemerným [SD] východiskovým počtom trombocytov v týchto 2 liečebných skupinách (14,1 [8,6] x 109/l a 12,7 [7,8] x 109/l, v uvedenom poradí). Medián veku bol 44 rokov, 63 % boli ženy a 94 % boli belosi, 4 % aziati a 2 % černosi. Celkom 8,2 % pacientov bolo vo veku ≥ 65 rokov
a žiadny pacient nebol vo veku ≥ 75 rokov. Medián trvania expozície bol 26 týždňov v prípade pacientov liečených avatrombopagom a 6 týždňov v prípade pacientov liečených placebom. Primárnym výsledkom účinnosti v tomto skúšaní bol kumulatívny počet týždňov, v ktorých bol počet trombocytov ≥ 50 x 109/l počas 6-mesačného obdobia liečby pri absencii záchrannej liečby. Pacienti liečení avatrombopagom mali pri absencii záchrannej liečby dlhšie trvanie počtu trombocytov na úrovni ≥ 50 x 109/l v porovnaní s pacientmi, ktorí dostávali placebo (medián 12,4 [0, 25] týždňa oproti
0 [0, 2] týždňom, v uvedenom poradí, p < 0,0001) (pozri tabuľku 6).
Tabuľka 6: Kumulatívny počet týždňov trombocytovej odpovede – štúdia 302
Primárny výsledok účinnosti
| Avatrombopag
(n = 32)
| Placebo
(n = 17)
|
Kumulatívny počet týždňov s trombocytovou odpoveďou*
|
Priemerná hodnota (SD)
| 12,0 (8,75)
| 0,1 (0,49)
|
Medián
| 12,4
| 0,0
|
Minimum, maximum
| 0, 25
| 0, 2
|
Hodnota p Wilcoxonovho hodnotiaceho
sumačného testu
| < 0,0001
|
* Kumulatívny počet týždňov trombocytovej odpovede je definovaný ako celkový počet týždňov,
v ktorých bol počet trombocytov ≥ 50 x 109/l počas 6 mesiacov liečby pri absencii záchrannej liečby.
Okrem toho väčší podiel pacientov v skupine liečenej avatrombopagom mal na 8. deň počet trombocytov ≥ 50 x 109/l v porovnaní s placebom (21/32, 66 % oproti 0/17, 0,0 %, v uvedenom poradí, 95 % IS (47, 86), p < 0,0001). Aj keď len niekoľko osôb dostávalo na začiatku liečby súbežne podávané lieky na ITP, väčší podiel pacientov v skupine liečenej avatrombopagom dosiahol zníženie
používania súbežne podávaných liekov na ITP od začiatku liečby v porovnaní s placebom (5/15, 33 %
oproti 0/7, 0,0 %, v uvedenom poradí, 95 % IS (12, 62), p = 0,1348).
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Dopteletom vo
všetkých podskupinách pediatrickej populácie pre trombocytopéniu ako sekundárny dôsledok ochorenia pečene (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaProfily plazmatických koncentrácií v čase po perorálnom podaní avatrombopagu boli charakterizované
krátkym časovým oneskorením (0,5 - 0,75 hodín) s maximálnou expozíciou 6 - 8 hodín po podaní dávky. Vo farmakokinetických štúdiách s viacnásobnou dávkou u zdravých dobrovoľníkov sa ustálený
stav dosiahol v 5. deň podávania dávok. Na vyhodnotenie účinkov jedla s vysokým a nízkym obsahom
tukov na biologickú dostupnosť a farmakokinetickú variabilitu avatrombopagu sa vykonali otvorené, randomizované klinické skúšania s dizajnom skrížených opakovaní u zdravých dobrovoľníkov.
Podávanie oboch typov jedla nemalo žiadne klinicky významné účinky na mieru (Cmax) ani rozsah
(AUC) expozície avatrombopagu. Pri podávaní s jedlom však došlo k významnému zníženiu
(približne o 50 %) variability hodnôt AUC a Cmax medzi osobami a u jednotlivých osôb (pozri časť 4.2
a 4.5).
Interakcie s jedlomSúbežné podávanie avatrombopagu buď s jedlom s vysokým alebo s nízkym obsahom tukov neviedlo
ku klinicky významným zmenám v rýchlosti ani rozsahu absorpcie avatrombopagu. Podávanie avatrombopagu s jedlom s vysokým aj s nízkym obsahom tukov však znížilo farmakokinetickú variabilitu avatrombopagu medzi osobami a u jednotlivých osôb približne o 50 %. Preto sa odporúča podávanie avatrombopagu s jedlom (pozri časť 4.2).
D
is
t
ri
b
úcia
Štúdie
in vitro naznačujú, že avatrombopag je vysoko viazaný na ľudské plazmatické proteíny
(> 96 %). Zjavný distribučný objem avatrombopagu u pacientov s trombocytopéniou a chronickým ochorením pečene je na základe populačnej farmakokinetickej analýzy približne 180 l a zjavný distribučný objem u pacientov s chronickou imunitnou trombocytopéniou je približne 235 l, čo naznačuje, že avatrombopag sa rozsiahlo distribuuje.
BiotransformáciaOxidatívny metabolizmus avatrombopagu je sprostredkovaný hlavne CYP2C9 a CYP3A4.
Avatrombopag je substrátom pri transporte sprostredkovanom p-glykoproteínom (P-gp), aj keď sa pri súbežnom podávaní so silným inhibítorom P-gp neočakávajú žiadne klinicky významné rozdiely vo
zvýšení počtu trombocytov. Na základe štúdií
in vitro sa neočakáva, že iné transportné proteíny
(OATP1B1, OATP1B3, OCT2, OAT1 a OAT3) budú hrať dôležitú úlohu v dostupnosti avatrombopagu.
Tabuľka 7: Liekové interakcie: Zmeny farmakokinetických vlastností avatrombopagu v prítomnosti súbežne podávaného lieku
Súbežne podávaný liek*
| Priemerný geometrický pomer [90 % IS]
farmakokinetických vlastností avatrombopagu s/bez súbežne podávaného lieku (žiadny účinok = 1,00)
|
AUC0-inf
| Cmax
|
Silný inhibítor CYP3A
|
Itrakonazol
| 1,37 (1,10; 1,72)
| 1,07 (0,86; 1,35)
|
Stredne silný inhibítor CYP3A a CYP2C9
|
Flukonazol
| 2,16 (1,71; 2,72)
| 1,17 (0,96; 1,42)
|
Stredne silný induktor CYP2C9 a silný induktor CYP3A
|
Rifampín
| 0,57 (0,47; 0,62)
| 1,04 (0,88; 1,23)
|
Inhibítor P-gp
|
Cyklosporín
| 0,83 (0,65; 1,04)
| 0,66 (0,54; 0,82)
|
Inhibítor P-gp a stredne silný inhibítor CYP3A
|
Verapamil
| 1,61 (1,21; 2,15)
| 1,26 (0,96; 1,66)
|
* v ustálenom stave okrem cyklosporínu, ktorý sa podával ako jednorazová dávka
Účinok avatrombopaguAvatrombopag neinhibuje CYP1A, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 ani
CYP3A, neindukuje CYP1A, CYP2B6, CYP2C a CYP3A a len slabo indukuje CYP2C8 a CYP2C9
in vitro.Avatrombopag inhibuje transportéry organických aniónov (OAT) 1 a 3 a proteín rezistencie rakoviny prsníka (BCRP), avšak neinhibuje polypeptidové transportéry organických aniónov (OATP) 1B1
a 1B3 ani transportér organických katiónov (OCT) 2
in vitro.
Účinok transportných proteínovAvatrombopag je substrátom pri transporte sprostredkovanom p-glykoproteínom (P-gp) (pozri
tabuľku 7). Avatrombopag nie je substrátom pre OATP1B1, OATP1B3, OCT2, OAT1 ani OAT3.
E
l
i
mi
n
ácia
Hlavnou cestou vylučovania avatrombopagu je vylučovanie stolicou. Po podaní jednorazovej 20 mg
dávky 14C-avatrombopagu zdravým mužským dobrovoľníkom sa 88 % dávky vylúčilo stolicou a 6 %
močom. Z 88 % materiálu súvisiaceho s liekom v stolici bolo 77 % identifikovaných ako materská látka (34 %) a 4-hydroxy metabolit (44 %). V plazme sa nezaznamenali žiadne metabolity
avatrombopagu.
Priemerný plazmatický polčas eliminácie (%CV) avatrombopagu je približne 19 hodín (19 %). Priemerný (%CV) klírens avatrombopagu sa odhaduje na 6,9 l/h (29 %).
Linearita
Avatrombopag preukazoval po podaní jednorazovej dávky v rozsahu od 10 mg (0,5-násobok najnižšej
schválenej dávky) do 80 mg (1,3-násobok najvyššej odporúčanej dávky) farmakokinetické vlastnosti
úmerné dávke.
Osobitné skupiny pacientov
Starší pacienti
Populačná farmakokinetická analýza plazmatických koncentrácií avatrombopagu z klinických štúdií so zdravými osobami a pacientami s trombocytopéniou spôsobenou chronickým ochorením pečene alebo zdravými osobami a pacientmi s ITP, ktoré zahŕňali 11 % (84/787) a 4 % (24/577) študijnej populácie vo veku ≥ 65 rokov, v uvedenom poradí, naznačovala, že expozície avatrombopagu nie sú ovplyvnené vekom (pozri časť 4.2).
Rasové alebo etnické skupiny
Populačná farmakokinetická analýza plazmatických koncentrácií avatrombopagu z klinických štúdií so zdravými osobami, pacientami s trombocytopéniou spôsobenou chronickým ochorením pečene
a pacientami s ITP naznačovala, že expozície avatrombopagu sú podobné v rámci všetkých
skúmaných ľudských rás.
Porucha funkcie obličiek
Štúdie u ľudí preukázali, že renálna cesta nie je hlavnou cestou eliminácie nezmeneného avatrombopagu ani jeho metabolitov. Na základe známeho metabolického profilu avatrombopagu
a skutočnosti, že len 6 % dávky sa vylučuje v moči, sa pravdepodobnosť vplyvu poruchy funkcie obličiek na farmakokinetické vlastnosti avatrombopagu považuje za veľmi nízku (pozri časti 4.2
a 4.8).
Populačná farmakokinetická analýza avatrombopagu u zdravých osôb a u osôb s trombocytopéniou spôsobenou chronickým ochorením pečene naznačovala podobné expozície u zdravých osôb a u osôb
s miernou alebo stredne závažnou poruchou funkcie obličiek (CrCL ≥ 30 ml/min., Cockcroft-Gault).
Farmakokinetické a farmakodynamické vlastnosti avatrombopagu sa neskúmali u pacientov so závažnou poruchou funkcie obličiek (CrCL < 30 ml/min., Cockcroft-Gault) vrátane pacientov vyžadujúcich hemodialýzu.
Porucha funkcie pečene
Populačná farmakokinetická analýza vyhodnocovala plazmatické expozície avatrombopagu
u pacientov s miernou až stredne závažnou poruchou funkcie pečene na základe skóre modelu pre
ochorenie pečene v konečnom štádiu (MELD) a Childových-Turcotteových-Pughových skóre. Medzi pacientami s Childovými-Turcotteovými-Pughovými skóre (rozsah = 5 až 12) alebo skóre MELD
(rozsah = 4 až 23) a zdravými osobami sa nepozorovali žiadne dôležité rozdiely v expozícii
avatrombopagu. Plazmatické expozície avatrombopagu boli porovnateľné u pacientov s chronickým ochorením pečene sekundárne spôsobeným vírusovou hepatitídou (n = 242), steatohepatitídou nespôsobenou alkoholom (n = 45) a ochorením pečene spôsobeným alkoholom (n = 49) v pivotnej štúdii fázy 3 a boli tiež porovnateľné s hodnotami u zdravých osôb (n = 391). Z dôvodu obmedzených
dostupných informácií sa má u pacientov s Childovými-Turcotteovými-Pughovými skóre C
avatrombopag používať len v prípade, ak očakávaný prínos prevažuje nad očakávanými rizikami.
5.3 Predklinické údaje o bezpečnosti
Avatrombopag nestimuluje tvorbu trombocytov u myší, potkanov, opíc ani psov kvôli svojej jedinečnej špecifickosti voči TPO receptoru. Preto údaje z týchto štúdií na zvieratách nepredstavujú úplný model možných nežiaducich účinkov súvisiacich so zvýšením počtu trombocytov spôsobeným avatrombopagom u ľudí.
Účinky v predklinických štúdiách sa pozorovali iba pri expozíciách považovaných za dostatočne vyššie, ako je maximálna expozícia u ľudí, čo poukazuje na malý význam týchto zistení pre klinické použitie. Primárna toxicita avatrombopagu v pivotných štúdiách s opakovanou dávkou bola zistená
v žalúdku pri vysokých dávkach s primeranými bezpečnostnými hranicami pri porovnaní
s expozíciami pri maximálnej odporúčanej dávke u ľudí; tieto účinky boli reverzibilné aj v štúdiách chronickej toxicity.
Karcinogenéza
V dvojročnej štúdii karcinogenity na myšiach a potkanoch sa pri vysokých dávkach vyskytli v žalúdku
žalúdočné nádorové ochorenia (karcinoidy) neuroendokrinných buniek (enterochromafínu podobné bunky, ECL bunky). Žalúdočné karcinoidy sa považovali za pravdepodobne spôsobené dlhotrvajúcou hypergastrinémiou pozorovanou v štúdiách toxicity. Význam žalúdočných karcinoidov súvisiacich
s hypergastrinémiou u hlodavcov sa pre ľudí vo všeobecnosti považuje za nízkorizikový.
Avatrombopag nemal mutagénny účinok v bakteriálnom teste reverznej mutácie (AMES) in vitro ani
klastogénny účinok v teste chromozómových aberácií ľudských lymfocytov in vitro ani v teste s potkaními mikrojadrami buniek kostnej drene in vivo.
Zvieracia toxikológia a/alebo farmakológia
V 4-týždňových alebo dlhších štúdiách toxicity s opakovanou dávkou sa u myší, potkanov a opíc
cynomolgus pozorovali žalúdočné lézie súvisiace s liečbou. U týchto druhov sa avatrombopag spájal s histopatologickými zmenami sliznice fundu žľaznatého žalúdka charakterizovanými degeneráciou žľaznatého epitelu so znížením počtu zrelých parietálnych buniek. Tento účinok sa nespájal so zápalovou odpoveďou ani dôkazom erózie a tvorby vredov. Závažnosť žalúdkových lézií závisela od dávky a trvania podávania avatrombopagu a preukazovala jasný trend smerom k reverzibilite počas obdobia zotavovania. Expozície (AUC) pri dávkach, ktoré nepreukazovali žiadne žalúdkové lézie
v rámci všetkých druhov, boli 3- až 33-násobne vyššie ako expozície u ľudí pri maximálnej odporúčanej dávke pre ľudí.
Reprodukčná a vývojová toxicita
Avatrombopag nemal žiadny vplyv na fertilitu ani skorý embryonálny vývoj u samcov potkanov pri
22-násobných expozíciách, ani u samíc potkanov pri 114-násobných expozíciách hodnoty AUC
u pacientov pri odporúčanej dávke 60 mg jedenkrát denne.
Vylučovanie do mlieka
Avatrombopag bol prítomný v mlieku laktujúcich potkanov po perorálnom podaní rádioaktívne
označeného avatrombopagu. Farmakokinetické parametre avatrombopagu v mlieku boli podobné hodnotám v plazme s pomerom expozície rádioaktivity súvisiacej s avatrombopagom (mlieko ku plazme) 0,94.
Štúdie vykonávané u zvieracích mláďat
V 10-týždňovej toxikologickej štúdii vykonávanej u mláďat potkanov sa avatrombopag podával
v dávkach od 20 do 300 mg/kg/deň. Pri dávkach do 300 mg/kg/deň sa nezistila žiadna úmrtnosť ani
žiadne klinické príznaky súvisiace s testovanou látkou. V žalúdku dochádzalo pri dávkach
100 a 300 mg/kg/deň k výskytu degenerácie, regeneračnej hyperplázii a atrofii žľazového epitelu závislých od dávky. Expozície na úrovni 100 mg/kg/deň u samcov potkanov boli 14-násobkom hodnoty AUC u pacientov pri maximálnej odporúčanej dávke 60 mg jedenkrát denne. Avatrombopag nespôsoboval žalúdočné zmeny u samcov mláďat potkanov pri expozíciách na úrovni 7-násobku hodnoty AUC pozorovanej u pacientov pri maximálnej odporúčanej dávke 60 mg jedenkrát denne. Pri dávke 300 mg/kg/deň (expozícia samíc potkanov bola na úrovni 50-násobku expozície u ľudí na základe hodnoty AUC pri dávke 60 mg denne) bol tiež pozorovaný zvýšený výskyt základnej fokálnej mineralizácie v obličkách samíc.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety monohydrát laktózy, mikrokryštalická celulóza (E460(i)), krospovidón typu B (E1202),
koloidný oxid kremičitý, bezvodý (E551),
stearát horečnatý (E 470b).
Filmový obal poly(vinylalkohol) (E1203), mastenec (E553b),
makrogol 3350 (E1521),
oxid titaničitý (E171),
žltý oxid železitý (E 172).
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
5 rokov.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Blister (polyamidom a polyvinylchloridom laminovaný hliníkový film s pretlačovacou hliníkovou polyetyléntereftalátovou fóliou) obsahujúci buď 10 alebo 15 filmom obalených tabliet. Každá škatuľa obsahuje jeden blister s 10 alebo 15 filmom obalenými tabletami alebo dva blistre s 15 filmom obalenými tabletami.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISwedish Orphan Biovitrum AB (publ) SE-112 76 Stockholm
Švédsko
8. REGISTRAČNÉ ČÍSLOEU/1/19/1373/001
EU/1/19/1373/002
EU/1/19/1373/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. júna 2019
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.