
linických štúdiách vykonaných s Dafirom HCT a na známom bezpečnostnom profile jeho jednotlivých zložiek amlodipínu, valsartanu a hydrochlorotiazidu.
Informácie o Dafire HCT
Bezpečnosť Dafira HCT sa vyhodnotila pri jeho maximálnej dávke 10 mg/320 mg/25 mg v jednej kontrolovanej krátkodobej (8 týždňov) klinickej štúdii s 2 271 pacientmi, z ktorých 582 dostávalo valsartan v kombinácii s amlodipínom a hydrochlorotiazidom. Nežiaduce reakcie boli spravidla mierne a prechodné a len zriedkavo vyžadovali ukončenie liečby. V tomto klinickom skúšaní kontrolovanom účinným liekom boli najčastejšími dôvodmi na ukončenie liečby Dafirom HCT závraty a hypotenzia (0,7%).
V kontrolovanej klinickej štúdii trvajúcej 8 týždňov sa nepozorovali žiadne významné nové alebo neočakávané nežiaduce reakcie pri liečbe trojkombináciou v porovnaní so známymi účinkami zložiek v monoterapii alebo pri liečbe dvojkombináciou.
V kontrolovanej klinickej štúdii trvajúcej 8 týždňov boli pozorované zmeny laboratórnych parametrov pri kombinácii Dafira HCT len malé a v súlade s farmakologickým mechanizmom účinku látok použitých v monoterapii. Prítomnosť valsartanu v trojkombinácii oslabila hypokaliemický účinok hydrochlorotiazidu.
Nasledujúce nežiaduce reakcie, uvedené podľa triedy orgánových systémov MedDRA a frekvencie, sa týkajú Dafira HCT (amlodipín/valsartan/HCT) a samostatne amlodipínu, valsartanu a HCT.
Veľmi časté: ≥l/10; časté: ≥l/100 až <l/10; menej časté: ≥l/1 000 až <1/100; zriedkavé: ≥1/10 000 až
<1/1 000; veľmi zriedkavé <1/10 000), neznáme (z dostupných údajov).
Trieda
orgánového systému MedDRA
Nežiaduce reakcie
Frekvencia
Dafiro
HCT
Amlodipín Valsartan HCT
Poruchy krvi
a lymfatického systému
Agranulocytóza, útlm kostnej drene
Pokles hemoglobínu a hematokritu
-- -- Veľmi zriedkavé
-- -- Neznáme --
Hemolytická anémia -- -- -- Veľmi zriedkavé
Leukopénia -- Veľmi zriedkavé
-- Veľmi zriedkavé
Neutropénia -- -- Neznáme --

Poruchy imunitného systému
Trombocytopénia -- Veľmi zriedkavé
Precitlivenosť -- Veľmi zriedkavé
Neznáme Zriedkavé
Neznáme Veľmi zriedkavé
Poruchy metabolizmu a
Anorexia Menej časté -- -- -- Hyperkalciémia Menej časté -- -- Zriedkavé
výživy
Hyperglykémia -- Veľmi zriedkavé
-- Zriedkavé
Psychické poruchy
Poruchy nervového
Hyperlipidémia Menej časté -- -- -- Hyperurikémia Menej časté -- -- Menej časté Hypochloremická alkalóza -- -- -- Veľmi
zriedkavé
Hypokaliémia Časté -- -- Časté Hypomagneziémia -- -- -- Menej časté Hyponatriémia Menej časté -- -- Menej časté Depresia -- -- -- Zriedkavé Nespavosť/poruchy spánku Menej časté Menej časté -- Zriedkavé Kolísanie nálady -- Menej časté --
Abnormálna koordinácia Menej časté -- -- -- Závraty Časté Časté -- Zriedkavé
systému
Posturálne závraty, závraty pri námahe
Menej časté -- -- --
Dysgeúzia Menej časté Menej časté -- -- Extrapyramídový syndróm -- Neznáme -- -- Bolesť hlavy Časté Časté -- Zriedkavé
Hypertónia -- Veľmi zriedkavé
-- --
Letargia Menej časté -- -- -- Parestézia Menej časté Menej časté -- Zriedkavé
Periférna neuropatia, neuropatia
Menej časté Veľmi zriedkavé
-- --
Somnolencia Menej časté Časté -- -- Synkopa Menej časté Menej časté -- -- Tremor -- Menej časté -- --
Poruchy oka Porucha videnia Menej časté Menej časté -- Menej časté
Poruchy ucha a
Tinitus -- Menej časté -- --
labyrintu Vertigo Menej časté -- Menej časté --
Poruchy srdca a srdcovej činnosti
Palpitácie -- Časté -- -- Tachykardia Menej časté -- -- --
Arytmia (vrátane bradykardie, komorovej tachykardie a fibrilácie predsiení)
-- Veľmi zriedkavé
-- Zriedkavé
Infarkt myokardu -- Veľmi zriedkavé
-- --
Poruchy ciev
Sčervenanie -- Časté -- -- Hypotenzia Časté Menej časté -- -- Ortostatická hypotenzia Menej časté -- -- Menej časté Flebitída, tromboflebitída Menej časté -- -- --

Vaskulitída -- Veľmi zriedkavé
Neznáme --
Poruchy
dýchacej sústavy,
Kašeľ Menej časté Veľmi zriedkavé
Menej časté --
hrudníka a
Dyspnoe Menej časté Menej časté -- --
mediastína
Respiračná tieseň, pľúcny edém, pneumonitída
-- -- -- Veľmi zriedkavé
Rinitída -- Menej časté -- -- Podráždenie hrdla Menej časté -- -- --
Poruchy gastrointestinál-
Nepríjemné pocity v bruchu, bolesť v hornej časti brucha
Menej časté Časté Menej časté Zriedkavé
neho traktu
Zapáchajúci dych Menej časté -- -- --
Zmena vo vyprázdňovaní
čriev
-- Menej časté -- --
Zápcha -- -- -- Zriedkavé Znížená chuť do jedenia -- -- -- Menej časté Hnačka Menej časté Menej časté -- Zriedkavé Suchosť v ústach Menej časté Menej časté -- -- Dyspepsia Časté Menej časté -- --
Gastritída -- Veľmi zriedkavé
Hyperplázia ďasien -- Veľmi zriedkavé
-- --
-- --
Nauzea Menej časté Časté -- Menej časté
Pankreatitída -- Veľmi zriedkavé
-- Veľmi zriedkavé
Vracanie Menej časté Menej časté -- Menej časté
Poruchy pečene a žlčových ciest
Vzostup hepatálnych enzýmov vrátane zvýšenia bilirubínu v sére
-- Veľmi zriedkavé
Neznáme --
Hepatitída -- Veľmi zriedkavé
-- --
Intrahepatálna cholestáza, ikterus
-- Veľmi zriedkavé
-- Zriedkavé
Poruchy kože a
Alopécia -- Menej časté --
podkožného tkaniva
Angioedém -- Veľmi zriedkavé
Neznáme --
Reakcie podobné kožnému lupus erythematosus, reaktivácia kožného lupus erythematosus
-- -- -- Veľmi zriedkavé
Multiformný erytém -- Veľmi zriedkavé
-- --
Exantém -- Menej časté -- -- Hyperhidróza Menej časté Menej časté -- -- Reakcia z fotosenzitivity* -- -- -- Zriedkavé Pruritus Menej časté Menej časté Neznáme -- Purpura -- Menej časté -- Zriedkavé Exantém -- Menej časté Neznáme Menej časté Zmena farby kože -- Menej časté -- --
Urtikária -- Veľmi zriedkavé
-- Menej časté
Nekrotizujúca vaskulitída a toxická epidermálna nekrolýza
-- -- -- Veľmi zriedkavé
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Artralgia -- Menej časté -- -- Bolesť chrbta Menej časté Menej časté -- -- Opuch kĺbov Menej časté -- -- -- Svalové kŕče Menej časté Menej časté -- -- Svalová slabosť Menej časté -- -- -- Myalgia Menej časté Menej časté Neznáme -- Bolesť končatín Menej časté -- -- -- Zvýšenie kreatinínu v sére Menej časté -- Neznáme -- Porucha močenia Menej časté
Nyktúria -- Menej časté -- -- Polakizúria Časté Menej časté
Akútne zlyhanie obličiek Menej časté -- -- --
Zlyhanie a poškodenie funkcie obličiek
-- -- Neznáme Zriedkavé
Poruchy reprodukčného systému a prsníkov
Celkové poruchy a reakcie v
Erektilná dysfunkcia Menej časté Menej časté -- Menej časté
Gynekomastia Menej časté -- --
Abázia, porucha chôdze Menej časté -- -- -- Asténia Menej časté Menej časté -- --
mieste podania
Nepríjemné pocity, celková nevoľnosť
Menej časté Menej časté -- --
Únava Časté Časté Menej časté --
Nekardiálna bolesť v hrudníku
Menej časté Menej časté -- --
Laboratórne a
Edém Časté Časté -- -- Bolesť -- Menej časté -- -- Zvýšenie lipidov -- Časté
funkčné
vyšetrenia
Zvýšenie močovinového dusíka v krvi
Zvýšenie kyseliny močovej v krvi
Menej časté -- -- -- Menej časté -- --
Glykozúria Zriedkavé Zníženie draslíka v sére Menej časté -- -- -- Zvýšenie draslíka v sére -- -- Neznáme -- Zvýšenie telesnej hmotnosti Menej časté Menej časté -- -- Zníženie telesnej hmotnosti -- Menej časté -- --
* Pozri časť 4.4 Fotosenzitivita
4.9 PredávkovanieSymptómyS predávkovaním Dafira HCT nie sú skúsenosti. Hlavným príznakom predávkovania valsartanu je asi výrazná hypotenzia so závratmi. Predávkovanie amlodipínu môže mať za následok nadmernú periférnu vazodilatáciu a možno reflexnú tachykardiu. Pri amlodipíne bola hlásená výrazná a potenciálne dlhodobá systémová hypotenzia vrátane šoku končiaceho sa smrťou.
LiečbaAmlodipín/valsartan/hydrochlorotiazidKlinicky významná hypotenzia spôsobená predávkovaním Dafira HCT vyžaduje aktívnu kardiovaskulárnu podpornú liečbu, vrátane častého monitorovania funkcie srdca a dýchania, vyvýšenia končatín a sledovania objemu cirkulujúcich tekutín a vylučovania moču. Pri obnovení cievneho tonusu a krvného tlaku môže pomôcť vazokonstrikčná látka za predpokladu, že jej podanie
nie je kontraindikované. Intravenózne podanie kalciumglukonátu môže byť prospešné pri zvrátení účinkov blokády kalciových kanálov.
Amlodipín
Ak k požitiu lieku došlo nedávno, možno zvážiť vyvolanie vracania alebo výplach žalúdka. Ukázalo sa, že podanie aktívneho uhlia zdravým dobrovoľníkom ihneď alebo do dvoch hodín od požitia amlodipínu významne znížilo jeho absorpciu.
Odstránenie amlodipínu hemodialýzou nie je pravdepodobné.
Valsartan
Odstránenie valsartanu hemodialýzou nie je pravdepodobné.
Hydrochlorotiazid
Predávkovanie hydrochlorotiazidom sa spája s depléciou elektrolytov (hypokaliémia, hypochlorémia) a s hypovolémiou, ktoré sú dôsledkom nadmernej diurézy. Najčastejšími príznakmi a prejavmi predávkovania sú nauzea a somnolencia. Hypokaliémia môže mať za následok svalové kŕče a/alebo zvýraznenie arytmie spojenej so súbežným podávaním digitálisových glykozidov alebo niektorých antiarytmík.
Miera odstránenia hydrochlorotiazidu hemodialýzou sa nestanovila.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antagonisty angiotenzínu II, samotné (valsartan), kombinácie s derivátmi dihydropyridínu (amlodipín) a tiazidovými diuretikami (hydrochlorotiazid), ATC kód: C09DX01 valsartan, amlodipín a hydrochlorotiazid.
Dafiro HCT kombinuje tri antihypertenzívne zlúčeniny s komplementárnymi mechanizmami znižovania krvného tlaku u pacientov s esenciálnou hypertenziou: amlodipín patrí do liekovej triedy antagonistov kalcia a valsartan do triedy antagonistov angiotenzínu II a hydrochlorotiazid patrí do triedy tiazidových diuretík. Kombinácia týchto látok má aditívny antihypertenzívny účinok.
Amlodipín/valsartan/hydrochlorotiazid
Dafiro HCT sa skúmalo v dvojito slepej štúdii kontrolovanej účinným liekom u pacientov s hypertenziou. Celkovo 2 271 pacientov so stredne ťažkou až ťažkou hypertenziou (priemerná východisková hodnota systolického/diastolického krvného tlaku bola 170/107) dostávalo liečbu amplodipínom/valsartanom/hydrochlorotiazidom 10 mg/320 mg/25 mg, valsartanom/hydrochlorotiazidom 320 mg/25 mg, amlodipínom/valsartanom 10 mg/320 mg alebo hydrochlorotiazidom/amlodipínom 25 mg/10 mg. Na začiatku štúdie pacienti dostávali nižšie dávky ich liečebnej kombinácie a na plnú terapeutickú dávku boli titrovaní do 2. týždňa.
V 8. týždni bol priemerný pokles systolického/diastolického krvného tlaku 39,7/24,7 mmHg pri Dafire
HCT, 32,0/19,7 mmHg pri valsartane/hydrochlorotiazide, 33,5/21,5 mmHg pri amlodipíne/valsartane a 31,5/19,5 mmHg pri amlodipíne/hydrochlorotiazide. Liečba trojkombináciou bola štatisticky lepšia ako liečba ktoroukoľvek z troch dvojkombinácií vzhľadom na zníženie diastolického a systolického krvného tlaku. Pokles systolického/diastolického krvného tlaku pri Dafire HCT bol o 7,6/5,0 mmHg väčší ako pri valsartane/hydrochlorotiazide, o 6,2/3,3 mmHg väčší ako pri amlodipíne/valsartane a o
8,2/5,3 mmHg väčší ako pri amlodipíne/hydrochlorotiazide. Plný hypotenzívny účinok sa dosiahol po
2 týždňoch užívania ich maximálnej dávky Dafira HCT. U štatisticky vyššieho podielu pacientov sa
dosiahlo zníženie krvného tlaku (<140/90 mmHg) pri Dafire HCT (71%) v porovnaní s liečbou ktoroukoľvek z troch dvojkombinácií (45-54%) (p<0,0001).
V podskupine 283 pacientov zameranej na ambulantné monitorovanie krvného tlaku sa pozoroval klinicky a štatisticky lepší pokles 24-hodinového systolického a diastolického krvného tlaku pri trojkombinácii v porovnaní s valsartanom/hydrochlorotiazidom, valsartanom/amlodipínom a hydrochlorotiazidom/amlodipínom.
Amlodipín
Zložka amlodipínu v Dafire HCT inhibuje transmembránový vstup iónov vápnika do hladkého svalstva srdca a ciev. Mechanizmus antihypertenzívneho pôsobenia amlodipínu je podmienený priamym relaxačným účinkom na hladké svalstvo ciev, čo vyvoláva pokles odporu periférnych ciev a krvného tlaku. Experimentálne údaje naznačujú, že amlodipín sa viaže na dihydropyridínové aj na nedihydropyridínové väzbové miesta. Kontraktilné procesy srdcového svalstva a hladkého svalstva ciev závisia od pohybu extracelulárnych iónov vápnika do týchto buniek cez špecifické iónové kanály.
Po podaní terapeutických dávok pacientom s hypertenziou amlodipín vyvoláva vazodilatáciu, čo vedie k poklesu krvného tlaku u ležiaceho aj stojaceho pacienta. Tento pokles nesprevádza pri chronickom podávaní významná zmena srdcovej frekvencie ani plazmatických hladín katecholamínov.
Plazmatické koncentrácie korelujú s účinkom u mladých aj starších pacientov.
U pacientov s hypertenziou s normálnou funkciou obličiek terapeutické dávky amlodipínu vyvolali zníženie odporu obličkových ciev a zvýšenie rýchlosti glomerulárnej filtrácie a efektívneho prietoku plazmy obličkami, a to bezo zmeny filtrovanej frakcie alebo proteinúrie.
Valsartan
Valsartan je perorálne aktívny, účinný a špecifický antagonista receptorov angiotenzínu II. Účinkuje selektívne na receptor podtypu AT1, ktorý je zodpovedný za známe účinky angiotenzínu II.
Podávanie valsartanu pacientom s hypertenziou vyvoláva pokles krvného tlaku bez ovplyvnenia tepovej frekvencie.
U väčšiny pacientov po podaní jednorazovej perorálnej dávky nastupuje antihypertenzívny účinok
v priebehu 2 hodín a maximálny pokles krvného tlaku sa dosiahne počas 4-6 hodín. Antihypertenzívny účinok pretrváva 24 hodín po podaní. Pri opakovanom podávaní maximálne zníženie krvného tlaku pri akejkoľvek dávke sa spravidla dosiahne v priebehu 2-4 týždňov.
Hydrochlorotiazid
Miesto účinku tiazidových diuretík je primárne v distálnom stočenom tubule obličiek. Ukázalo sa, že v kôre obličiek sa vyskytuje vysokoafinitný receptor ako primárne väzbové miesto pre pôsobenie tiazidových diuretík a inhibíciu transportu NaCl v distálnom stočenom tubule. Tiazidy účinkujú prostredníctvom inhibície symportéra Na+Cl-, možno kompetíciou o miesto Cl-, čím ovplyvňujú mechanizmy reabsorpcie elektrolytov: priamo zvyšujú vylučovanie sodíka a chloridu v približne rovnakom rozsahu, a týmto diuretickým účinkom nepriamo znižujú objem plazmy s následným zvýšením plazmatickej aktivity renínu, sekrécie aldosterónu a strát draslíka močom, aj znížením draslíka v sére.
Európska lieková agentúra netrvá na povinnosti predložiť výsledky štúdií s Dafirom HCT u všetkých podsúborov pediatrickej populácie pri esenciálnej hypertenzii. Informácie o použití u detí pozri v časti
4.2.
5.2 Farmakokinetické vlastnosti
Linearita
Amlodipín, valsartan a hydrochlorotiazid majú lineárnu farmakokinetiku.
Amlodipín/valsartan/hydrochlorotiazid
Po perorálnom podaní Dafira HCT zdravým dospelým osobám sa dosiahnu maximálne plazmatické koncentrácie amlodipínu za 6-8 hodín, valsartanu za 3 hodiny a hydrochlorotiazidu za 2 hodiny.
Rýchlosť a rozsah absorpcie amlodipínu, valsartanu a hydrochlorotiazidu z Dafira HCT sú rovnaké ako pri podávaní v osobitných liekoch.
Amlodipín
Absorpcia: Po perorálnom podaní terapeutických dávok samotného amlodipínu sa jeho maximálne plazmatické koncentrácie dosiahnu v priebehu 6-12 hodín. Absolútna biologická dostupnosť sa vypočítala medzi 64% a 80%. Biologická dostupnosť amlodipínu nie je ovplyvnená požitím jedla.
Distribúcia: Distribučný objem je približne 21 l/kg. V štúdiách s amlodipínom in vitro sa ukázalo, že približne 97,5% cirkulujúceho liečiva sa viaže na bielkoviny plazmy.
Biotransformácia: Amlodipín sa extenzívne (približne 90%) metabolizuje v pečeni na neaktívne metabolity.
Eliminácia: Eliminácia amlodipínu z plazmy je bifázická s terminálnym polčasom eliminácie približne
30 až 50 hodín. Rovnovážne hladiny v plazme sa dosiahnu po kontinuálnom podávaní za 7-8 dní. Močom sa vylúči 10% pôvodného amlodipínu a 60% jeho metabolitov.
Valsartan
Absorpcia: Po perorálnom podaní samotného valsartanu sa jeho maximálne plazmatické koncentrácie dosiahnu za 2-4 hodiny. Priemerná absolútna biologická dostupnosť je 23%. Jedlo znižuje expozíciu valsartanu (stanovené ako AUC) asi o 40% a maximálnu plazmatickú koncentráciu (Cmax) asi o 50%, aj keď asi po 8 hodinách od podania sú koncentrácie valsartanu v plazme podobné v skupinách, ktoré ho užili buď s jedlom, alebo nalačno. Tento pokles AUC však nesprevádza klinicky významné zníženie terapeutického účinku, a preto sa valsartan môže užívať buď s jedlom, alebo bez jedla.
Distribúcia: Rovnovážny distribučný objem valsartanu po intravenóznom podaní je asi 17 litrov, čo naznačuje, že valsartan sa extenzívne nedistribuuje do tkanív. Valsartan sa vo vysokej miere viaže na bielkoviny séra (94-97%), prevažne na sérový albumín.
Biotransformácia: Valsartan sa netransformuje vo veľkom rozsahu, pretože iba asi 20% dávky sa nájde ako metabolity. V plazme bol v nízkych koncentráciách zistený hydroxymetabolit (menej ako
10% AUC valsartanu). Tento metabolit je farmakologicky neaktívny.
Eliminácia: Valsartan sa primárne eliminuje stolicou (asi 83% dávky) a močom (asi 13% dávky), prevažne ako nezmenené liečivo. Po intravenóznom podaní plazmatický klírens valsartanu je asi
2 l/hod a jeho renálny klírens 0,62 l/hod (asi 30% celkového klírensu). Polčas valsartanu je 6 hodín.
Hydrochlorotiazid
Absorpcia:Absorpcia hydrochlorotiazidu po perorálnom podaní je rýchla (tmax približne 2 hodiny). V terapeutickom rozmedzí je vzostup priemernej AUC lineárny a úmerný dávke. Po opakovanom podávaní hydrochlorotiazidu sa kinetika nemení a akumulácia je minimálna, keď sa podáva raz denne. Súčasné podávanie s jedlom podľa hlásení zvyšuje aj znižuje systémovú dostupnosť hydrochlorotiazidu v porovnaní s podávaním nalačno. Tieto účinky sú malé a majú minimálny
klinický význam. Absolútna biologická dostupnosť hydrochlorotiazidu po perorálnom podaní je
60-80%.
Distribúcia: Zdanlivý distribučný objem je 4-8 l/kg. Cirkulujúci hydrochlorotiazid sa viaže na sérové bielkoviny (40-70%), hlavne na sérový albumín. Hydrochlorotiazid sa tiež akumuluje v erytrocytoch v hladine približne 1,8-krát vyššej ako v plazme.
Biotransformácia: Hydrochlorotiazid sa eliminuje ako nezmenené liečivo.
Eliminácia: Viac ako 95% absorbovanej dávky sa vylúči ako nezmenená látka močom. Obličkový klírens sa skladá z pasívnej filtrácie a aktívnej sekrécie do renálneho tubulu. Terminálny polčas je
6-15 hodín.
Osobitné populácie
Pediatrickí pacienti (vo veku menej ako 18 rokov)
Nie sú dostupné farmakokinetické údaje u pediatrickej populácie.
Starší pacienti (vo veku 65 rokov alebo viac)
Čas do dosiahnutia maximálnych plazmatických koncentrácií amlodipínu je podobný u mladých a starších pacientov. U starších pacientov klírens amlodipínu má tendenciu klesať, čo spôsobuje zväčšenie plochy pod krivkou (AUC) a predĺženie polčasu eliminácie. Priemerná systémová AUC valsartanu je o 70% vyššia u starších ako u mladých ľudí, preto je pri zvyšovaní dávkovania potrebná opatrnosť.
Systémová expozícia valsartanu je mierne zvýšená u starších pacientov v porovnaní s mladšími, ale nepreukázalo sa, že by to bolo klinicky významné.
Obmedzené údaje naznačujú, že systémový klírens hydrochlorotiazidu je znížený u zdravých aj hypertenzných starších osôb v porovnaní s mladými zdravými dobrovoľníkmi.
Keďže tieto tri zložky tolerujú rovnako dobre mladší aj starší pacienti, odporúčajú sa normálne dávkovacie režimy (pozri časť 4.2).
Poškodenie funkcie obličiek
Farmakokinetiku amlodipínu poškodenie funkcie obličiek významne neovplyvňuje. Podľa očakávania pri zlúčenine, ktorej renálny klírens predstavuje iba 30% celkového plazmatického klírensu, sa nepozorovala žiadna korelácia medzi funkciou obličiek a systémovou expozíciou valsartanu.
Pacienti s ľahkým až stredne ťažkým poškodením funkcie obličiek môžu preto dostať obvyklú začiatočnú dávku (pozri časti 4.2 a 4.4).
Poškodenie funkcie pečene
Pacienti s insuficienciou pečene majú znížený klírens amlodipínu, čo má za následok zväčšenie AUC približne o 40-60%. V priemere je u pacientov s ľahkým až stredne ťažkým chronickým ochorením pečene expozícia (stanovená hodnotami AUC) valsartanu dvojnásobná v porovnaní so zdravými dobrovoľníkmi (so zodpovedajúcim vekom, pohlavím a telesnou hmotnosťou). U pacientov s ochorením pečene je potrebné postupovať opatrne (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
V rôznych predklinických štúdiách bezpečnosti amplodipínu, valsartanu, hydrochlorotiazidu, valsartanu/hydrochlorotiazidu, amlodipínu/valsartanu a amlodipínu/valsartanu/hydrochlorotiazidu (Dafiro HCT) vykonaných na viacerých živočíšnych druhoch sa nepreukázala systémová ani cieľová orgánová toxicita, ktorá by nepriaznivo ovplyvnila vývoj Dafira HCT pre klinické použitie u ľudí.
Predklinické štúdie bezpečnosti trvajúce do 13 týždňov sa vykonali s amlodipínom/valsartanom/hydrochlorotiazidom na potkanoch. Kombinácia viedla k očakávanému poklesu erytrocytovej masy (erytrocytov, hemoglobínu, hematokritu a retikulocytov), vzostupu močoviny v sére, vzostupu kreatinínu v sére, zvýšeniu draslíka v sére, k juxtaglomerulárnej (JG) hyperplázii v obličke a fokálnym eróziám v žľazovom žalúdku potkanov. Všetky tieto zmeny boli reverzibilné po 4-týždňovom období zotavenia a boli považované za vystupňované farmakologické účinky.
Kombinácia amlodipínu/valsartanu/hydrochlorotiazidu sa netestovala na genotoxicitu alebo karcinogenitu, pretože nebol žiaden dôkaz o akejkoľvek interakcii medzi týmito látkami, ktoré sú už dlhý čas na trhu. Amlodipín, valsartan a hydrochlorotiazid však boli samostatne testované na genotoxicitu a karcinogenitu s negatívnymi výsledkami.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety Mikrokryštalická celulóza Krospovidón
Koloidný bezvodý oxid kremičitý
Magnéziumstearát
Obal tablety
Hypromelóza
Oxid titaničitý (E171) Makrogol 4000
Mastenec
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30°C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC blistre. Jeden blister obsahuje 7, 10 alebo 14 filmom obalených tabliet. Veľkosti balenia: 14, 28, 30, 56, 90, 98 alebo 280 filmom obalených tabliet.
Spoločné balenia obsahujúce 280 tabliet, tvorené 20 škatuľkami, z ktorých každá obsahuje 14 tabliet.
PVC/PVDC perforované blistre s jednotlivými dávkami na použitie v nemocniciach: Veľkosti balenia: 56, 98 alebo 280 filmom obalených tabliet.
Spoločné balenia obsahujúce 280 tabliet, tvorené 4 škatuľkami, z ktorých každá obsahuje 70 tabliet. Nie všetky veľkosti balenia alebo liekové sily musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Novartis Europharm Limited
Wimblehurst Road
Horsham
West Sussex, RH12 5AB Veľká Británia
8. REGISTRAČNÉ ČÍSLA
9. DÁTUM PRVEJ REGISTRÁCIE / PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
1. NÁZOV LIEKU
Dafiro HCT 10 mg/160 mg/12,5 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá filmom obalená tableta obsahuje 10 mg amlodipínu (ako amlodipíniumbesilátu), 160 mg valsartanu a 12,5 mg hydrochlorotiazidu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta (tableta)
Bledožlté oválne bikonvexné tablety so skoseným okrajom, s vyrazeným označením „NVR” na jednej strane a „VDL” na druhej strane.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba esenciálnej hypertenzie, ako náhradná liečba u dospelých pacientov, ktorých krvný tlak je primerane znížený kombináciou amlodipínu, valsartanu a hydrochlorotiazidu (HCT), ktoré sa užívajú buď ako tri jednozložkové lieky, alebo ako dvojzložkový a jednozložkový liek.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Odporúčané dávkovanie lieku Dafiro HCT je jedna tableta denne, ktorá sa má užívať podľa možnosti ráno.
Skôr ako pacienti prejdú na liečbu Dafirom HCT, majú mať stav upravený stabilnými dávkami jednotlivých zložiek užívaných v rovnakom čase. Dávka Dafira HCT má byť založená na dávkach jednotlivých zložiek kombinácie v čase zmeny liečby.
Maximálna odporúčaná dávka Dafira HCT je 10 mg/320 mg/25 mg. Osobitné populácie
Poškodenie funkcie obličiek
Pre hydrochlorotiazidovú zložku je Dafiro HCT kontraindikované u pacientov s ťažkým poškodením funkcie obličiek (klírens kreatinínu <30 ml/min) (pozri časti 4.3 a 5.2). U pacientov s miernym až stredne ťažkým poškodením funkcie obličiek nie je potrebná úprava dávkovania. U pacientov so stredne ťažkým poškodením funkcie obličiek sa odporúča monitorovanie hladín draslíka a kreatinínu.
Poškodenie funkcie pečene
Pre hydrochlorotiazidovú a valsartanovú zložku je Dafiro HCT kontraindikované u pacientov so závažným poškodením funkcie pečene (pozri časť 4.3). U pacientov s miernym až stredne ťažkým poškodením funkcie pečene bez cholestázy je maximálna odporúčaná dávka valsartanu 80 mg, preto nie je Dafiro HCT vhodné pre túto skupinu pacientov (pozri časti 4.3, 4.4 a 5.2).
Srdcové zlyhávanie a ischemická choroba srdca
U pacientov so srdcovým zlyhávaním a ischemickou chorobou srdca sú obmedzené skúsenosti
s použitím Dafira HCT, najmä s maximálnou dávkou. Opatrnosť je potrebná u pacientov so srdcovým
zlyhávaním a ischemickou chorobou srdca, zvlášť pri maximálnej dávke Dafira HCT
10 mg/320 mg/25 mg.
Starší pacienti (vo veku 65 rokov alebo viac)
Opatrnosť vrátane častejšieho monitorovania krvného tlaku sa odporúča u starších pacientov, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
Pediatrická populácia
Použitie Dafira HCT u pediatrickej populácie (pacienti vo veku menej ako 18 rokov) v indikácii esenciálna hypertenzia nie je relevantné.
Spôsob podávania
Dafiro HCT možno užívať s jedlom alebo bez jedla. Tablety sa majú prehĺtať celé s trochou vody, v rovnakom dennom čase, podľa možnosti ráno.
4.3 Kontraindikácie
− Precitlivenosť na liečivá, na iné sulfonamidy, na dihydropyridínové deriváty alebo na ktorúkoľvek z pomocných látok.
− Druhý a tretí trimester gravidity (pozri časti 4.4 a 4.6).
− Poškodenie funkcie pečene, biliárna cirhóza alebo cholestáza.
− Ťažké zhoršenie funkcie obličiek (GFR <30 ml/min/1,73 m2), anúria a dialyzovaní pacienti.
− Refraktérna hypokaliémia, hyponatriémia, hyperkalciémia a symptomatická hyperurikémia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pacienti s depléciou sodíka a/alebo objemu
Výrazná hypotenzia vrátane ortostatickej hypotenzie sa pozorovala u 1,7% pacientov pri liečbe maximálnou dávkou Dafira HCT (10 mg/320 mg/25 mg) v porovnaní s 1,8% pacientov pri valsartane/hydrochlorotiazide (320 mg/25 mg), 0,4% pacientov pri amlodipíne/valsartane
(10 mg/320 mg) a 0,2% pacientov pri hydrochlorotiazide/amplodipíne (25 mg/10 mg)
v kontrolovanom klinickom skúšaní u pacientov so stredne ťažkou až ťažkou nekomplikovanou hypertenziou. U pacientov s aktivovaným systémom renín-angiotenzín (ako sú pacienti s depléciou objemu a/alebo soli liečení vysokými dávkami diuretík), ktorí dostávajú antagonisty receptorov angiotenzínu II (AIIRA), sa môže vyskytnúť symptomatická hypotenzia. Odporúča sa úprava tohto stavu pred podaním Dafira HCT alebo starostlivý lekársky dohľad na začiatku liečby.
Ak pri užívaní Dafira HCT vznikne výrazná hypotenzia, pacienta je potrebné uložiť na chrbát a v prípade potreby podať intravenóznu infúziu fyziologického roztoku. V liečbe možno pokračovať po stabilizovaní krvného tlaku.
Zmeny elektrolytov v sére
Amlodipín/valsartan/hydrochlorotiazid
V kontrolovanom klinickom skúšaní Dafira HCT sa protichodné účinky valsartanu 320 mg a hydrochlorotiazidu 25 mg na draslík v sére u mnohých pacientov približne vyvážili. U iných pacientov môže prevládať jeden alebo druhý účinok. Pravidelné stanovovanie elektrolytov v sére sa má vykonávať v primeraných intervaloch, aby sa zistila možná elektrolytová nerovnováha.
Pravidelné stanovovanie sérových elektrolytov a najmä draslíka sa má robiť vo vhodných intervaloch, aby sa zistila prípadná nerovnováha elektrolytov, zvlášť u pacientov s inými rizikovými faktormi, napr. pri poškodení funkcie obličiek, podávaní iných liekov alebo pri nerovnováhe elektrolytov
v anamnéze.
Valsartan
Súčasné použitie s doplnkami draslíka, diuretikami šetriacimi draslík, náhradami solí obsahujúcimi draslík alebo inými liekmi, ktoré môžu hladinu draslíka zvyšovať (heparín atď.), sa neodporúča. Podľa potreby sa má monitorovať hladina draslíka.
Hydrochlorotiazid
Pri liečbe tiazidovými diuretikami vrátane hydrochlorotiazidu sa zaznamenala hypokaliémia.
Liečba tiazidovými diuretikami vrátane hydrochlorotiazidu sa spája s hyponatriémiou a hypochloremickou alkalózou. Tiazidy vrátane hydrochlorotiazidu zvyšujú vylučovanie horčíka močom, čo môže spôsobiť hypomagneziémiu. Tiazidové diuretiká znižujú vylučovanie vápnika. Môže to spôsobiť hyperkalciémiu.
Poškodenie funkcie obličiek
U pacientov s miernym až stredne ťažkým poškodením funkcie obličiek (GFR >30 ml/min/1,73 m2) nie je potrebná úprava dávkovania Dafira HCT. Pri používaní Dafira HCT u pacientov s poškodením funkcie obličiek sa odporúča pravidelné monitorovanie draslíka, kreatinínu a kyseliny močovej v sére.
Stenóza renálnej artérie
Nie sú dostupné údaje o používaní Dafira HCT u pacientov s unilaterálnou alebo bilaterálnou stenózou renálnej artérie alebo stenózou artérie pri solitérnej obličke.
Transplantácia obličky
Zatiaľ nie sú skúsenosti s bezpečným použitím Dafira HCT u pacientov, ktorí sa nedávno podrobili transplantácii obličky.
Poškodenie funkcie pečene
Valsartan sa eliminuje prevažne nezmenený žlčou, zatiaľ čo amlodipín sa extenzívne metabolizuje v pečeni. U pacientov s ľahkým až stredne ťažkým poškodením funkcie pečene bez cholestázy je maximálna odporúčaná dávka valsartanu 80 mg, preto Dafiro HCT nie je vhodné pre túto skupinu pacientov (pozri časti 4.2, 4.3 a 5.2).
Zlyhávanie srdca a ischemická choroba srdca
U citlivých osôb možno v dôsledku inhibície systému renín-angiotenzín-aldosterón predpokladať zmeny funkcie obličiek. U pacientov s ťažkým zlyhávaním srdca, u ktorých funkcia obličiek môže závisieť od aktivity systému renín-angiotenzín-aldosterón, sa liečba inhibítormi enzýmu konvertujúceho angiotenzín (ACE) a antagonistami receptorov angiotenzínu spájala s oligúriou a/alebo progredujúcou azotémiou a (zriedka) s akútnym zlyhaním obličiek a/alebo úmrtím. Podobné následky boli hlásené pri valsartane.
V dlhodobom placebom kontrolovanom klinickom skúšaní (PRAISE-2) amlodipínu u pacientov so zlyhávaním srdca triedy III a IV podľa NYHA (New York Heart Association Classification) neischemickej etiológie sa amlodipín spájal so zvýšeným počtom hlásení pľúcneho edému napriek tomu, že v porovnaní s placebom nebol významný rozdiel v incidencii zhoršenia zlyhávania srdca.
Opatrnosť je potrebná u pacientov so srdcovým zlyhávaním a ischemickou chorobou srdca, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
Stenóza aortálnej a mitrálnej chlopne, obštrukčná hypertrofická kardiomyopatia
Tak ako pri všetkých ostatných vazodilatanciách, osobitná opatrnosť sa vyžaduje u pacientov s aortálnou alebo mitrálnou stenózou alebo obštrukčnou hypertrofickou kardiomyopatiou.
Gravidita
Liečba antagonistami receptorov angiotenzínu II (AIIRA) sa nemá začať počas gravidity. Ak sa nepretržitá liečba AIIRA nepovažuje za nevyhnutnú, pacientky plánujúce graviditu je potrebné previesť na alternatívnu antihypertenzívnu liečbu, ktorá má potvrdený bezpečnostný profil pri použití
počas gravidity. Keď sa potvrdí gravidita, liečba AIIRA sa má okamžite ukončiť a ak je to potrebné, má sa začať alternatívna liečba (pozri časti 4.3 a 4.6).
Primárny hyperaldosteronizmus
Pacienti s primárnym hyperaldosteronizmom nemajú byť liečení antagonistom angiotenzínu II valsartanom, pretože ich systém renín-angiotenzín nie je aktivovaný. Preto sa Dafiro HCT u tejto populácie neodporúča.
Systémový lupus erythematosus
Tiazidové diuretiká vrátane hydrochlorotiazidu spôsobujú podľa hlásení exacerbáciu alebo aktiváciu systémového lupus erythematosus.
Iné metabolické poruchy
Tiazidové diuretiká vrátane hydrochlorotiazidu môžu zmeniť glukózovú toleranciu a zvýšiť hladiny cholesterolu, triacylglycerolov a kyseliny močovej v sére. U pacientov s diabetes môže byť potrebné upraviť dávkovanie inzulínu alebo perorálnych antidiabetík.
Tiazidy môžu znižovať vylučovanie vápnika močom a spôsobovať prechodné a mierne zvýšenie hladín vápnika v sére, aj keď nie sú prítomné známe poruchy metabolizmu vápnika. Výrazná hyperkalciémia môže svedčiť o skrytom hyperparatyreoidizme. Tiazidy sa majú vysadiť ešte pred vykonaním testov funkcie prištítnych teliesok.
Fotosenzitivita
Pri tiazidových diuretikách boli hlásené prípady reakcií z fotosenzitivity (pozri časť 4.8). Ak sa počas liečby Dafirom HCT vyskytne reakcia z fotosenzitivity, odporúča sa liečbu ukončiť. Ak sa opätovné podanie diuretika považuje za potrebné, odporúča sa chrániť oblasti vystavené slnečnému žiareniu alebo umelému UVA.
Všeobecné upozornenia
Opatrnosť je potrebná u pacientov, u ktorých sa v minulosti preukázala precitlivenosť na iné antagonisty receptorov angiotenzínu II. Reakcie z precitlivenosti na hydrochlorotiazid sú pravdepodobnejšie u pacientov s alergiou a astmou.
Starší pacienti (vo veku 65 rokov alebo viac)
Opatrnosť vrátane častejšieho monitorovania krvného tlaku sa odporúča u starších pacientov, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
4.5 Liekové a iné interakcie
Formálne štúdie interakcií Dafira HCT s inými liekmi sa nevykonali. Preto sa v tejto časti uvádzajú len informácie o interakciách s inými liekmi, ktoré sú známe pre jednotlivé liečivá.
Je však dôležité vziať do úvahy, že Dafiro HCT môže zvyšovať hypotenzívny účinok iných antihypertenzív.
Súbežné používanie sa neodporúča
Jednotlivá
z
ložka
 Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi
Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi
Valsartan a
HCT
Lítium Počas súčasného podávania inhibítorov ACE a tiazidov, napr. hydrochlorotiazidu, sa zaznamenalo reverzibilné zvýšenie sérových koncentrácií a toxicity lítia. Napriek nedostatočným skúsenostiam so súčasným podávaním valsartanu a lítia sa táto kombinácia neodporúča. Ak sa ukáže, že je potrebná, odporúča sa starostlivo monitorovať
hladiny lítia v sére (pozri časť 4.4).
Valsartan Diuretiká šetriace kálium, doplnky draslíka, náhrady soli obsahujúce draslík

a iné látky, ktoré môžu zvyšovať hladiny draslíka
Ak sa za potrebnú považuje kombinácia valsartanu s liekom, ktorý ovplyvňuje hladiny draslíka, odporúča sa časté monitorovanie plazmatických hladín draslíka.
Opatrnosť
potrebná pri súčasnom užívaní
Jednotlivá
 z
ložka Dafira HCT
z
ložka Dafira HCT Amlodipín
Známe interakcie snasledujúcimi látkamiInhibítory CYP3A4 (napr. ketokonazol, itrakonazol, ritonavir)
Účinok interakcie s inými liekmiKlinické skúšanie so staršími pacientmi ukázalo, že diltiazem inhibuje metabolizmus amlodipínu, pravdepodobne prostredníctvom CYP3A4 (plazmatická koncentrácia sa zvyšuje približne o 50% a účinok amlodipínu je zvýšený). Nedá sa vylúčiť možnosť, že účinnejšie inhibítory CYP3A4 (t.j. ketokonazol, itrakonazol, ritonavir) môžu zvýšiť plazmatickú
koncentráciu amlodipínu vo väčšej miere než diltiazem.

Valsartan a
HCT
Induktory CYP3A4 (antikonvulzíva [napr. karbamazepín, fenobarbital, fenytoín, fosfenytoín, primidón], rifampicín,
Hypericum perforatum [ľubovník bodkovaný])
Nesteroidné antiflogistiká (NSAID) vrátane selektívnych inhibítorov COX-2, acetylsalicylovej kyseliny (>3 g/deň) a neselektívnych NSAIDSúčasné podávanie môže viesť k zníženiu plazmatických koncentrácií amlodipínu. Vyžaduje sa klinické monitorovanie s možnou úpravou dávkovania amlodipínu počas liečby induktorom a po jeho vysadení.

NSAID môžu oslabiť antihypertenzívny účinok antagonistov angiotenzínu II aj hydrochlorotiazidu, keď sa podávajú súčasne. Okrem toho súbežné užívanie Dafira HCT a NSAID môže mať za následok zhoršenie funkcie obličiek a zvýšenie draslíka v sére. Preto sa odporúča monitorovanie funkcie obličiek na začiatku liečby, ako aj náležitá hydratácia pacienta.
HCT
Lieky ovplyvňované poruchami draslíka v séreAlkohol, anestetiká aPravidelné monitorovanie sérového draslíka a EKG sa odporúča pri súčasnom podávaní lieku obsahujúceho hydrochlorotiazid s látkami, ktoré sú ovplyvňované poruchami draslíka v sére (napr. digitálisové glykozidy, antiarytmiká) a s nasledujúcimi látkami, ktoré vyvolávajú torsades de pointes (patria k nim niektoré antiarytmiká), pričom hypokaliémia je predisponujúcim faktorom pre
torsades de pointes.- Antiarytmiká triedy Ia (napr. chinidín, hydrochinidín, dizopyramid)
- Antiarytmiká triedy III (napr. amiodarón, sotalol, dofetilid, ibutilid)
- Niektoré antipsychotiká (napr. tioridazín, chlórpromazín, levomepromazín, trifluoperazín, cyamemazín, sulpirid, sultoprid, amisulprid, tiaprid, pimozid, haloperidol, droperidol, metadón)

- Iné (napr. bepridil, cisaprid, difemanil, erytromycín i.v., halofantrín, ketanserín, mizolastín, pentamidín, moxifloxacín, terfenadín, vinkamín i.v.)
Môže sa vyskytnúť potenciovanie ortostatickej
sedatíva
hypotenzie.
Amantadín Tiazidy vrátane hydrochlorotiazidu môžu zvyšovať riziko
nežiaducich reakcií spôsobených amantadínom.
Anticholínergiká (napr. atropín, biperidén)
Biologická dostupnosť diuretík tiazidového typu sa môže zvýšiť anticholínergikami (napr. atropínom, biperidénom), zjavne pre zníženie gastrointestinálnej motility a rýchlosti
vyprázdňovania žalúdka.
Antidiabetiká (napr. inzulín a perorálne antidiabetiká)
Môže byť potrebné znovu upraviť dávkovanie inzulínu a perorálnych antidiabetík.
− Metformín Metformín sa má používať opatrne vzhľadom na riziko laktátovej acidózy vyvolanej možným funkčným zlyhaním
obličiek pripisovaným hydrochlorotiazidu.
Betablokátory a diazoxid
Súčasné užívanie tiazidových diuretík vrátane hydrochlorotiazidu s betablokátormi môže zvýšiť riziko hyperglykémie. Tiazidové diuretiká vrátane hydrochlorotiazidu môžu zosilniť hyperglykemizujúci
účinok diazoxidu.
Karbamazepín U pacientov, ktorí dostávajú hydrochlorotiazid súčasne
s karbamazepínom, môže vzniknúť hyponatriémia. Takých pacientov je preto potrebné informovať o možnosti hyponatriemických reakcií a je potrebné ich náležite
sledovať.
Cholestyramínové a kolestipolové živice
Absorpcia tiazidových diuretík vrátane hydrochlorotiazidu je znížená cholestyramínom a inými aniónovými
iónomeničovými živicami.
 Cyklosporín
Cyklosporín Súčasná liečba cyklosporínom môže zvýšiť riziko hyperurikémie a komplikácií typu dny.
Cytotoxické látky (napr.
cyklofosfamid, metotrexát)
Tiazidy vrátane hydrochlorotiazidu môžu znižovať
vylučovanie cytotoxických látok obličkami (napr. cyklofosfamidu, metotrexátu) a potenciovať ich
 myelosupresívne účinky.
myelosupresívne účinky.
 Digitálisové glykozidy
Digitálisové glykozidy Hypokaliémia alebo hypomagneziémia vyvolané tiazidmi sa môžu vyskytnúť ako neželané účinky napomáhajúce
vzniku srdcových arytmií vyvolaných digitálisom.
Kontrastné látky obsahujúce jód
V prípade dehydratácie vyvolanej diuretikami je zvýšené riziko akútneho zlyhania obličiek, najmä pri vysokých dávkach jódovaných látok. Pacienti majú byť pred
podaním rehydratovaní.
Liečivá ovplyvňujúce draslík (kaliuretické diuretiká, kortikosteroidy, laxatíva, ACTH, amfotericín, karbenoxolón, penicilín G, deriváty kyseliny
Hypokaliemický účinok hydrochlorotiazidu môžu zvýšiť kaliuretické diuretiká, kortikosteroidy, laxatíva, adrenokortikotropný hormón (ACTH), amfotericín, karbenoxolón, penicilín G a deriváty kyseliny salicylovej. Ak sa tieto lieky majú predpísať s kombináciou amlodipínu/valsartanu/hydrochlorotiazidu, odporúča sa sledovať hladinu draslíka v plazme.
salicylovej)
Lieky používané na liečbu dny (probenecid, sulfínpyrazón a alopurinol)
Môže byť potrebná úprava dávok urikosurík, pretože hydrochlorotiazid môže zvýšiť hladinu kyseliny močovej
v sére. Môže byť potrebné zvýšiť dávkovanie probenecidu alebo sulfínpyrazónu. Súčasné podávanie tiazidových diuretík vrátane hydrochlorotiazidu môže zvyšovať
incidenciu reakcií z precitlivenosti na alopurinol.
Metyldopa Vyskytli sa ojedinelé hlásenia hemolytickej anémie, ktorá vznikla pri súčasnom použití hydrochlorotiazidu a
metyldopy.

 Nedepolarizujúce relaxanciá kostrového svalstva
Nedepolarizujúce relaxanciá kostrového svalstva (napr. tubokurarín)
Presorické amíny (napr. noradrenalín, adrenalín)
Vitamín D a soli vápnikaTiazidy vrátane hydrochlorotiazidu potenciujú účinok derivátov kurare.
Účinok presorických amínov sa môže znížiť.

Podávanie tiazidových diuretík vrátane hydrochlorotiazidu s vitamínom D alebo soľami vápnika môže potenciovať zvýšenie vápnika v sére.
Žiadne interakcie
Jednotlivá
z
ložka
Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi


Valsartan
Iné(cimetidín, warfarín, furosemid, digoxín, atenolol, indometacín, hydrochlorotiazid, amlodipín, glibenklamid)
Pri monoterapii valsartanom sa nezistili žiadne klinicky významné interakcie s nasledujúcimi liečivami: cimetidín, warfarín, furosemid, digoxín, atenolol, indometacín, hydrochlorotiazid, amlodipín, glibenklamid.
Niektoré z týchto látok môžu interagovať s hydrochlorotiazidovou zložkou Dafira HCT (pozri interakcie súvisiace s HCT).
 4.6 Gravidita a laktácia
Gravidita
Amlodipín
4.6 Gravidita a laktácia
Gravidita
Amlodipín
Údaje o obmedzenom počte gravidít naznačujú, že amlodipín a iné antagonisty kalciových receptorov nemajú nežiaduce účinky na zdravie plodu. Môže však byť riziko predĺženia pôrodu.
ValsartanPoužitie antagonistov receptorov angiotenzínu II (AIIRA) sa neodporúča počas prvého trimestra gravidity (pozri časť 4.4). Použitie AIIRA je kontraindikované počas druhého a tretieho trimestra gravidity (pozri časti 4.3 a 4.4).
Epidemiologické dôkazy týkajúce sa rizika teratogenity po expozícii inhibítorom ACE počas prvého
trimestra gravidity neboli nezvratné; malé zvýšenie rizika však nemožno vylúčiť. Zatiaľ čo nie sú kontrolované epidemiologické údaje o riziku pri antagonistoch receptorov angiotenzínu II (AIIRA), podobné riziká môžu existovať pre túto skupinu liekov. Ak sa nepretržitá liečba AIIRA nepovažuje za nevyhnutnú, pacientky plánujúce graviditu je potrebné previesť na alternatívnu antihypertenzívnu liečbu, ktorá má potvrdený bezpečnostný profil pri použití počas gravidity. Keď sa potvrdí gravidita, liečba AIIRA sa má okamžite ukončiť a ak je to potrebné, má sa začať alternatívna liečba.
Je známe, že expozícia AIIRA pri liečbe počas druhého a tretieho trimestra gravidity vyvoláva u ľudí fetotoxické účinky (poškodenie funkcie obličiek, oligohydramnión, spomalenie osifikácie lebky) a toxické účinky u novorodencov (zlyhanie obličiek, hypotenzia, hyperkaliémia) (pozri časť 5.3).
Ak by došlo k expozícii AIIRA od druhého trimestra gravidity, odporúča sa ultrazvukové vyšetrenie funkcie obličiek a lebky.
Dojčatá, ktorých matky užívali AIIRA, je potrebné dôsledne sledovať pre hypotenziu (pozri časti 4.3
a 4.4).
HydrochlorotiazidS použitím hydrochlorotiazidu počas gravidity, najmä počas prvého trimestra, sú obmedzené skúsenosti. Štúdie na zvieratách sú nedostatočné.
Hydrochlorotiazid prechádza cez placentu. Na základe farmakologického mechanizmu účinku môže použitie hydrochlorotiazidu počas druhého a tretieho trimestra ohroziť fetoplacentárnu perfúziu a môže mať účinky na plod a novorodenca, ako sú žltačka, poruchy rovnováhy elektrolytov
a trombocytopénia a môže sa spájať s inými nežiaducimi reakciami, ktoré sa vyskytli u dospelých.
Amlodipín/valsartan/hydrochlorotiazidNie sú skúsenosti s používaním Dafira HCT u gravidných žien. Na základe existujúcich údajov o jeho zložkách sa použitie Dafira HCT neodporúča počas prvého trimestra a je kontraindikované počas druhého a tretieho trimestra gravidity (pozri časti 4.3 a 4.4).
DojčenieNie sú dostupné informácie o použití valsartanu a/alebo amlodipínu počas dojčenia. Hydrochlorotiazid sa vylučuje do materského mlieka. Preto sa neodporúča použitie Dafira HCT počas dojčenia. Vhodnejšie sú iné druhy liečby s lepšie preukázaným bezpečnostným profilom počas dojčenia, najmä pri dojčení novorodencov alebo predčasne narodených detí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Pri vedení vozidla alebo obsluhe strojov je potrebné vziať do úvahy, že občas sa môžu vyskytnúť závraty alebo únava.
4.8 Nežiaduce účinky
Bezpečnostný profil Dafira HCT uvedený nižšie je založený na klinických štúdiách vykonaných s Dafirom HCT a na známom bezpečnostnom profile jeho jednotlivých zložiek amlodipínu, valsartanu a hydrochlorotiazidu.
Informácie o Dafire HCT
Bezpečnosť Dafira HCT sa vyhodnotila pri jeho maximálnej dávke 10 mg/320 mg/25 mg v jednej kontrolovanej krátkodobej (8 týždňov) klinickej štúdii s 2 271 pacientmi, z ktorých 582 dostávalo valsartan v kombinácii s amlodipínom a hydrochlorotiazidom. Nežiaduce reakcie boli spravidla mierne a prechodné a len zriedkavo vyžadovali ukončenie liečby. V tomto klinickom skúšaní kontrolovanom účinným liekom boli najčastejšími dôvodmi na ukončenie liečby Dafirom HCT závraty a hypotenzia (0,7%).
V kontrolovanej klinickej štúdii trvajúcej 8 týždňov sa nepozorovali žiadne významné nové alebo neočakávané nežiaduce reakcie pri liečbe trojkombináciou v porovnaní so známymi účinkami zložiek v monoterapii alebo pri liečbe dvojkombináciou.
V kontrolovanej klinickej štúdii trvajúcej 8 týždňov boli pozorované zmeny laboratórnych parametrov pri kombinácii Dafira HCT len malé a v súlade s farmakologickým mechanizmom účinku látok použitých v monoterapii. Prítomnosť valsartanu v trojkombinácii oslabila hypokaliemický účinok hydrochlorotiazidu.
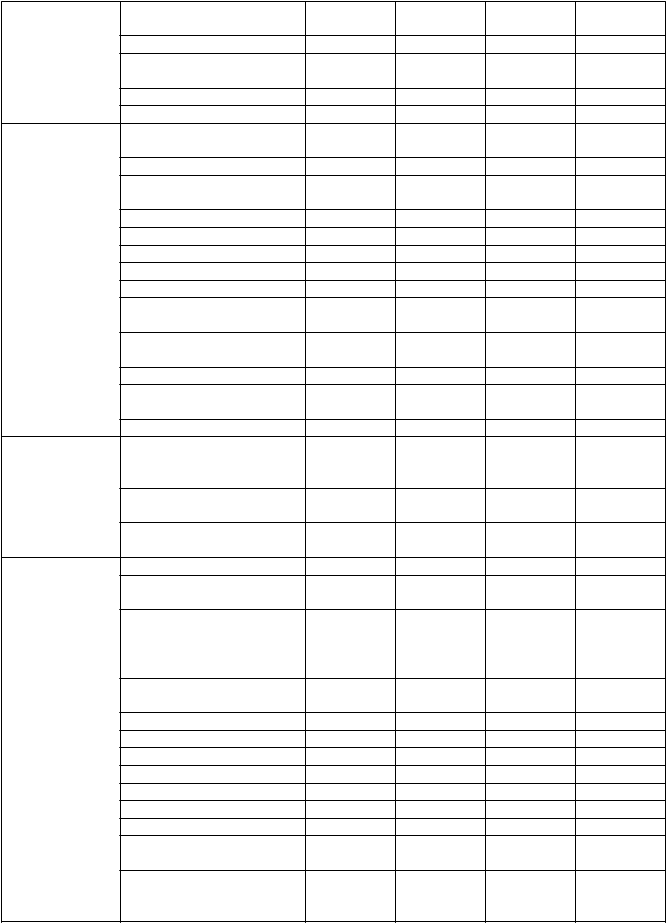
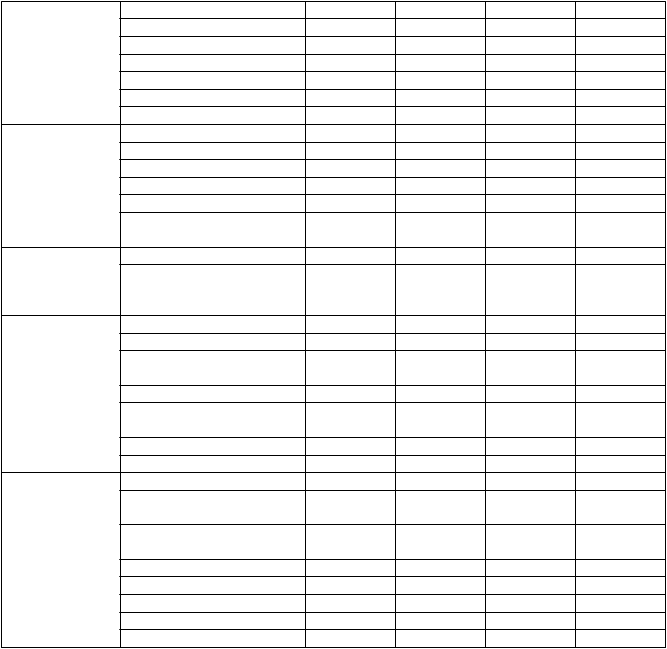
Nasledujúce nežiaduce reakcie, uvedené podľa triedy orgánových systémov MedDRA a frekvencie, sa týkajú Dafira HCT (amlodipín/valsartan/HCT) a samostatne amlodipínu, valsartanu a HCT.
Veľmi časté: ≥l/10; časté: ≥l/100 až <l/10; menej časté: ≥l/1 000 až <1/100; zriedkavé: ≥1/10 000 až
<1/1 000; veľmi zriedkavé <1/10 000), neznáme (z dostupných údajov).
Trieda
orgánového systému MedDRA
Nežiaduce reakcie
Frekvencia
Dafiro
HCT
Amlodipín Valsartan HCT
Poruchy krvi
a lymfatického systému
Agranulocytóza, útlm kostnej drene
Pokles hemoglobínu a hematokritu
-- -- Veľmi zriedkavé
-- -- Neznáme --
Hemolytická anémia -- -- -- Veľmi zriedkavé
Leukopénia -- Veľmi zriedkavé
-- Veľmi zriedkavé
Neutropénia -- -- Neznáme --

Poruchy imunitného systému
Trombocytopénia -- Veľmi zriedkavé
Precitlivenosť -- Veľmi zriedkavé
Neznáme Zriedkavé
Neznáme Veľmi zriedkavé
Poruchy metabolizmu a
Anorexia Menej časté -- -- -- Hyperkalciémia Menej časté -- -- Zriedkavé
výživy
Hyperglykémia -- Veľmi zriedkavé
-- Zriedkavé
Psychické poruchy
Poruchy nervového
Hyperlipidémia Menej časté -- -- -- Hyperurikémia Menej časté -- -- Menej časté Hypochloremická alkalóza -- -- -- Veľmi
zriedkavé
Hypokaliémia Časté -- -- Časté Hypomagneziémia -- -- -- Menej časté Hyponatriémia Menej časté -- -- Menej časté Depresia -- -- -- Zriedkavé Nespavosť/poruchy spánku Menej časté Menej časté -- Zriedkavé Kolísanie nálady -- Menej časté --
Abnormálna koordinácia Menej časté -- -- -- Závraty Časté Časté -- Zriedkavé
systému
Posturálne závraty, závraty pri námahe
Menej časté -- -- --
Dysgeúzia Menej časté Menej časté -- -- Extrapyramídový syndróm -- Neznáme -- -- Bolesť hlavy Časté Časté -- Zriedkavé
Hypertónia -- Veľmi zriedkavé
-- --
Letargia Menej časté -- -- -- Parestézia Menej časté Menej časté -- Zriedkavé
Periférna neuropatia, neuropatia
Menej časté Veľmi zriedkavé
-- --
Somnolencia Menej časté Časté -- -- Synkopa Menej časté Menej časté -- -- Tremor -- Menej časté -- --
Poruchy oka Porucha videnia Menej časté Menej časté -- Menej časté
Poruchy ucha a
Tinitus -- Menej časté -- --
labyrintu Vertigo Menej časté -- Menej časté --
Poruchy srdca a srdcovej činnosti
Palpitácie -- Časté -- -- Tachykardia Menej časté -- -- --
Arytmia (vrátane bradykardie, komorovej tachykardie a fibrilácie predsiení)
-- Veľmi zriedkavé
-- Zriedkavé
Infarkt myokardu -- Veľmi zriedkavé
-- --
Poruchy ciev
Sčervenanie -- Časté -- -- Hypotenzia Časté Menej časté -- -- Ortostatická hypotenzia Menej časté -- -- Menej časté Flebitída, tromboflebitída Menej časté -- -- --

Vaskulitída -- Veľmi zriedkavé
Neznáme --
Poruchy
dýchacej sústavy,
Kašeľ Menej časté Veľmi zriedkavé
Menej časté --
hrudníka a
Dyspnoe Menej časté Menej časté -- --
mediastína
Respiračná tieseň, pľúcny edém, pneumonitída
-- -- -- Veľmi zriedkavé
Rinitída -- Menej časté -- -- Podráždenie hrdla Menej časté -- -- --
Poruchy gastrointestinál-
Nepríjemné pocity v bruchu, bolesť v hornej časti brucha
Menej časté Časté Menej časté Zriedkavé
neho traktu
Zapáchajúci dych Menej časté -- -- --
Zmena vo vyprázdňovaní
čriev
-- Menej časté -- --
Zápcha -- -- -- Zriedkavé Znížená chuť do jedenia -- -- -- Menej časté Hnačka Menej časté Menej časté -- Zriedkavé Suchosť v ústach Menej časté Menej časté -- -- Dyspepsia Časté Menej časté -- --
Gastritída -- Veľmi zriedkavé
Hyperplázia ďasien -- Veľmi zriedkavé
-- --
-- --
Nauzea Menej časté Časté -- Menej časté
Pankreatitída -- Veľmi zriedkavé
-- Veľmi zriedkavé
Vracanie Menej časté Menej časté -- Menej časté
Poruchy pečene a žlčových ciest
Vzostup hepatálnych enzýmov vrátane zvýšenia bilirubínu v sére
-- Veľmi zriedkavé
Neznáme --
Hepatitída -- Veľmi zriedkavé
-- --
Intrahepatálna cholestáza, ikterus
-- Veľmi zriedkavé
-- Zriedkavé
Poruchy kože a
Alopécia -- Menej časté --
podkožného tkaniva
Angioedém -- Veľmi zriedkavé
Neznáme --
Reakcie podobné kožnému lupus erythematosus, reaktivácia kožného lupus erythematosus
-- -- -- Veľmi zriedkavé
Multiformný erytém -- Veľmi zriedkavé
-- --
Exantém -- Menej časté -- -- Hyperhidróza Menej časté Menej časté -- -- Reakcia z fotosenzitivity* -- -- -- Zriedkavé Pruritus Menej časté Menej časté Neznáme -- Purpura -- Menej časté -- Zriedkavé Exantém -- Menej časté Neznáme Menej časté Zmena farby kože -- Menej časté -- --
Urtikária -- Veľmi zriedkavé
-- Menej časté

Nekrotizujúca vaskulitída a toxická epidermálna nekrolýza
-- -- -- Veľmi zriedkavé
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Artralgia -- Menej časté -- -- Bolesť chrbta Menej časté Menej časté -- -- Opuch kĺbov Menej časté -- -- -- Svalové kŕče Menej časté Menej časté -- -- Svalová slabosť Menej časté -- -- -- Myalgia Menej časté Menej časté Neznáme -- Bolesť končatín Menej časté -- -- -- Zvýšenie kreatinínu v sére Menej časté -- Neznáme -- Porucha močenia Menej časté
Nyktúria -- Menej časté -- -- Polakizúria Časté Menej časté
Akútne zlyhanie obličiek Menej časté -- -- --
Zlyhanie a poškodenie funkcie obličiek
-- -- Neznáme Zriedkavé
Poruchy reprodukčného systému a prsníkov
Celkové poruchy a reakcie v
Erektilná dysfunkcia Menej časté Menej časté -- Menej časté
Gynekomastia Menej časté -- --
Abázia, porucha chôdze Menej časté -- -- -- Asténia Menej časté Menej časté -- --
mieste podania
Nepríjemné pocity, celková nevoľnosť
Menej časté Menej časté -- --
Únava Časté Časté Menej časté --
Nekardiálna bolesť v hrudníku
Menej časté Menej časté -- --
Laboratórne a
Edém Časté Časté -- -- Bolesť -- Menej časté -- -- Zvýšenie lipidov -- Časté
funkčné
vyšetrenia
Zvýšenie močovinového dusíka v krvi
Zvýšenie kyseliny močovej v krvi
Menej časté -- -- -- Menej časté -- --

Glykozúria Zriedkavé Zníženie draslíka v sére Menej časté -- -- -- Zvýšenie draslíka v sére -- -- Neznáme -- Zvýšenie telesnej hmotnosti Menej časté Menej časté -- -- Zníženie telesnej hmotnosti -- Menej časté -- --
* Pozri časť 4.4 Fotosenzitivita
4.9 PredávkovanieSymptómyS predávkovaním Dafira HCT nie sú skúsenosti. Hlavným príznakom predávkovania valsartanu je asi výrazná hypotenzia so závratmi. Predávkovanie amlodipínu môže mať za následok nadmernú periférnu vazodilatáciu a možno reflexnú tachykardiu. Pri amlodipíne bola hlásená výrazná a potenciálne dlhodobá systémová hypotenzia vrátane šoku končiaceho sa smrťou.
LiečbaAmlodipín/valsartan/hydrochlorotiazidKlinicky významná hypotenzia spôsobená predávkovaním Dafira HCT vyžaduje aktívnu kardiovaskulárnu podpornú liečbu, vrátane častého monitorovania funkcie srdca a dýchania, vyvýšenia končatín a sledovania objemu cirkulujúcich tekutín a vylučovania moču. Pri obnovení cievneho tonusu a krvného tlaku môže pomôcť vazokonstrikčná látka za predpokladu, že jej podanie
nie je kontraindikované. Intravenózne podanie kalciumglukonátu môže byť prospešné pri zvrátení účinkov blokády kalciových kanálov.
Amlodipín
Ak k požitiu lieku došlo nedávno, možno zvážiť vyvolanie vracania alebo výplach žalúdka. Ukázalo sa, že podanie aktívneho uhlia zdravým dobrovoľníkom ihneď alebo do dvoch hodín od požitia amlodipínu významne znížilo jeho absorpciu.
Odstránenie amlodipínu hemodialýzou nie je pravdepodobné.
Valsartan
Odstránenie valsartanu hemodialýzou nie je pravdepodobné.
Hydrochlorotiazid
Predávkovanie hydrochlorotiazidom sa spája s depléciou elektrolytov (hypokaliémia, hypochlorémia) a s hypovolémiou, ktoré sú dôsledkom nadmernej diurézy. Najčastejšími príznakmi a prejavmi predávkovania sú nauzea a somnolencia. Hypokaliémia môže mať za následok svalové kŕče a/alebo zvýraznenie arytmie spojenej so súbežným podávaním digitálisových glykozidov alebo niektorých antiarytmík.
Miera odstránenia hydrochlorotiazidu hemodialýzou sa nestanovila.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antagonisty angiotenzínu II, samotné (valsartan), kombinácie s derivátmi dihydropyridínu (amlodipín) a tiazidovými diuretikami (hydrochlorotiazid), ATC kód: C09DX01 valsartan, amlodipín a hydrochlorotiazid.
Dafiro HCT kombinuje tri antihypertenzívne zlúčeniny s komplementárnymi mechanizmami znižovania krvného tlaku u pacientov s esenciálnou hypertenziou: amlodipín patrí do liekovej triedy antagonistov kalcia a valsartan do triedy antagonistov angiotenzínu II a hydrochlorotiazid patrí do triedy tiazidových diuretík. Kombinácia týchto látok má aditívny antihypertenzívny účinok.
Amlodipín/valsartan/hydrochlorotiazid
Dafiro HCT sa skúmalo v dvojito slepej štúdii kontrolovanej účinným liekom u pacientov s hypertenziou. Celkovo 2 271 pacientov so stredne ťažkou až ťažkou hypertenziou (priemerná východisková hodnota systolického/diastolického krvného tlaku bola 170/107) dostávalo liečbu amplodipínom/valsartanom/hydrochlorotiazidom 10 mg/320 mg/25 mg, valsartanom/hydrochlorotiazidom 320 mg/25 mg, amlodipínom/valsartanom 10 mg/320 mg alebo hydrochlorotiazidom/amlodipínom 25 mg/10 mg. Na začiatku štúdie pacienti dostávali nižšie dávky ich liečebnej kombinácie a na plnú terapeutickú dávku boli titrovaní do 2. týždňa.
V 8. týždni bol priemerný pokles systolického/diastolického krvného tlaku 39,7/24,7 mmHg pri Dafire
HCT, 32,0/19,7 mmHg pri valsartane/hydrochlorotiazide, 33,5/21,5 mmHg pri amlodipíne/valsartane a 31,5/19,5 mmHg pri amlodipíne/hydrochlorotiazide. Liečba trojkombináciou bola štatisticky lepšia ako liečba ktoroukoľvek z troch dvojkombinácií vzhľadom na zníženie diastolického a systolického krvného tlaku. Pokles systolického/diastolického krvného tlaku pri Dafire HCT bol o 7,6/5,0 mmHg väčší ako pri valsartane/hydrochlorotiazide, o 6,2/3,3 mmHg väčší ako pri amlodipíne/valsartane a o
8,2/5,3 mmHg väčší ako pri amlodipíne/hydrochlorotiazide. Plný hypotenzívny účinok sa dosiahol po
2 týždňoch užívania ich maximálnej dávky Dafira HCT. U štatisticky vyššieho podielu pacientov sa
dosiahlo zníženie krvného tlaku (<140/90 mmHg) pri Dafire HCT (71%) v porovnaní s liečbou ktoroukoľvek z troch dvojkombinácií (45-54%) (p<0,0001).
V podskupine 283 pacientov zameranej na ambulantné monitorovanie krvného tlaku sa pozoroval klinicky a štatisticky lepší pokles 24-hodinového systolického a diastolického krvného tlaku pri trojkombinácii v porovnaní s valsartanom/hydrochlorotiazidom, valsartanom/amlodipínom a hydrochlorotiazidom/amlodipínom.
Amlodipín
Zložka amlodipínu v Dafire HCT inhibuje transmembránový vstup iónov vápnika do hladkého svalstva srdca a ciev. Mechanizmus antihypertenzívneho pôsobenia amlodipínu je podmienený priamym relaxačným účinkom na hladké svalstvo ciev, čo vyvoláva pokles odporu periférnych ciev a krvného tlaku. Experimentálne údaje naznačujú, že amlodipín sa viaže na dihydropyridínové aj na nedihydropyridínové väzbové miesta. Kontraktilné procesy srdcového svalstva a hladkého svalstva ciev závisia od pohybu extracelulárnych iónov vápnika do týchto buniek cez špecifické iónové kanály.
Po podaní terapeutických dávok pacientom s hypertenziou amlodipín vyvoláva vazodilatáciu, čo vedie k poklesu krvného tlaku u ležiaceho aj stojaceho pacienta. Tento pokles nesprevádza pri chronickom podávaní významná zmena srdcovej frekvencie ani plazmatických hladín katecholamínov.
Plazmatické koncentrácie korelujú s účinkom u mladých aj starších pacientov.
U pacientov s hypertenziou s normálnou funkciou obličiek terapeutické dávky amlodipínu vyvolali zníženie odporu obličkových ciev a zvýšenie rýchlosti glomerulárnej filtrácie a efektívneho prietoku plazmy obličkami, a to bezo zmeny filtrovanej frakcie alebo proteinúrie.
Valsartan
Valsartan je perorálne aktívny, účinný a špecifický antagonista receptorov angiotenzínu II. Účinkuje selektívne na receptor podtypu AT1, ktorý je zodpovedný za známe účinky angiotenzínu II.
Podávanie valsartanu pacientom s hypertenziou vyvoláva pokles krvného tlaku bez ovplyvnenia tepovej frekvencie.
U väčšiny pacientov po podaní jednorazovej perorálnej dávky nastupuje antihypertenzívny účinok
v priebehu 2 hodín a maximálny pokles krvného tlaku sa dosiahne počas 4-6 hodín. Antihypertenzívny účinok pretrváva 24 hodín po podaní. Pri opakovanom podávaní maximálne zníženie krvného tlaku pri akejkoľvek dávke sa spravidla dosiahne v priebehu 2-4 týždňov.
Hydrochlorotiazid
Miesto účinku tiazidových diuretík je primárne v distálnom stočenom tubule obličiek. Ukázalo sa, že v kôre obličiek sa vyskytuje vysokoafinitný receptor ako primárne väzbové miesto pre pôsobenie tiazidových diuretík a inhibíciu transportu NaCl v distálnom stočenom tubule. Tiazidy účinkujú prostredníctvom inhibície symportéra Na+Cl-, možno kompetíciou o miesto Cl-, čím ovplyvňujú mechanizmy reabsorpcie elektrolytov: priamo zvyšujú vylučovanie sodíka a chloridu v približne rovnakom rozsahu, a týmto diuretickým účinkom nepriamo znižujú objem plazmy s následným zvýšením plazmatickej aktivity renínu, sekrécie aldosterónu a strát draslíka močom, aj znížením draslíka v sére.
Európska lieková agentúra netrvá na povinnosti predložiť výsledky štúdií s Dafirom HCT u všetkých podsúborov pediatrickej populácie pri esenciálnej hypertenzii. Informácie o použití u detí pozri v časti
4.2.
5.2 Farmakokinetické vlastnosti
Linearita
Amlodipín, valsartan a hydrochlorotiazid majú lineárnu farmakokinetiku.
Amlodipín/valsartan/hydrochlorotiazid
Po perorálnom podaní Dafira HCT zdravým dospelým osobám sa dosiahnu maximálne plazmatické koncentrácie amlodipínu za 6-8 hodín, valsartanu za 3 hodiny a hydrochlorotiazidu za 2 hodiny.
Rýchlosť a rozsah absorpcie amlodipínu, valsartanu a hydrochlorotiazidu z Dafira HCT sú rovnaké ako pri podávaní v osobitných liekoch.
Amlodipín
Absorpcia: Po perorálnom podaní terapeutických dávok samotného amlodipínu sa jeho maximálne plazmatické koncentrácie dosiahnu v priebehu 6-12 hodín. Absolútna biologická dostupnosť sa vypočítala medzi 64% a 80%. Biologická dostupnosť amlodipínu nie je ovplyvnená požitím jedla.
Distribúcia: Distribučný objem je približne 21 l/kg. V štúdiách s amlodipínom in vitro sa ukázalo, že približne 97,5% cirkulujúceho liečiva sa viaže na bielkoviny plazmy.
Biotransformácia: Amlodipín sa extenzívne (približne 90%) metabolizuje v pečeni na neaktívne metabolity.
Eliminácia: Eliminácia amlodipínu z plazmy je bifázická s terminálnym polčasom eliminácie približne
30 až 50 hodín. Rovnovážne hladiny v plazme sa dosiahnu po kontinuálnom podávaní za 7-8 dní. Močom sa vylúči 10% pôvodného amlodipínu a 60% jeho metabolitov.
Valsartan
Absorpcia: Po perorálnom podaní samotného valsartanu sa jeho maximálne plazmatické koncentrácie dosiahnu za 2-4 hodiny. Priemerná absolútna biologická dostupnosť je 23%. Jedlo znižuje expozíciu valsartanu (stanovené ako AUC) asi o 40% a maximálnu plazmatickú koncentráciu (Cmax) asi o 50%, aj keď asi po 8 hodinách od podania sú koncentrácie valsartanu v plazme podobné v skupinách, ktoré ho užili buď s jedlom, alebo nalačno. Tento pokles AUC však nesprevádza klinicky významné zníženie terapeutického účinku, a preto sa valsartan môže užívať buď s jedlom, alebo bez jedla.
Distribúcia: Rovnovážny distribučný objem valsartanu po intravenóznom podaní je asi 17 litrov, čo naznačuje, že valsartan sa extenzívne nedistribuuje do tkanív. Valsartan sa vo vysokej miere viaže na bielkoviny séra (94-97%), prevažne na sérový albumín.
Biotransformácia: Valsartan sa netransformuje vo veľkom rozsahu, pretože iba asi 20% dávky sa nájde ako metabolity. V plazme bol v nízkych koncentráciách zistený hydroxymetabolit (menej ako
10% AUC valsartanu). Tento metabolit je farmakologicky neaktívny.
Eliminácia: Valsartan sa primárne eliminuje stolicou (asi 83% dávky) a močom (asi 13% dávky), prevažne ako nezmenené liečivo. Po intravenóznom podaní plazmatický klírens valsartanu je asi
2 l/hod a jeho renálny klírens 0,62 l/hod (asi 30% celkového klírensu). Polčas valsartanu je 6 hodín.
Hydrochlorotiazid
Absorpcia:Absorpcia hydrochlorotiazidu po perorálnom podaní je rýchla (tmax približne 2 hodiny). V terapeutickom rozmedzí je vzostup priemernej AUC lineárny a úmerný dávke. Po opakovanom podávaní hydrochlorotiazidu sa kinetika nemení a akumulácia je minimálna, keď sa podáva raz denne. Súčasné podávanie s jedlom podľa hlásení zvyšuje aj znižuje systémovú dostupnosť hydrochlorotiazidu v porovnaní s podávaním nalačno. Tieto účinky sú malé a majú minimálny
klinický význam. Absolútna biologická dostupnosť hydrochlorotiazidu po perorálnom podaní je
60-80%.
Distribúcia: Zdanlivý distribučný objem je 4-8 l/kg. Cirkulujúci hydrochlorotiazid sa viaže na sérové bielkoviny (40-70%), hlavne na sérový albumín. Hydrochlorotiazid sa tiež akumuluje v erytrocytoch v hladine približne 1,8-krát vyššej ako v plazme.
Biotransformácia: Hydrochlorotiazid sa eliminuje ako nezmenené liečivo.
Eliminácia: Viac ako 95% absorbovanej dávky sa vylúči ako nezmenená látka močom. Obličkový klírens sa skladá z pasívnej filtrácie a aktívnej sekrécie do renálneho tubulu. Terminálny polčas je
6-15 hodín.
Osobitné populácie
Pediatrickí pacienti (vo veku menej ako 18 rokov)
Nie sú dostupné farmakokinetické údaje u pediatrickej populácie.
Starší pacienti (vo veku 65 rokov alebo viac)
Čas do dosiahnutia maximálnych plazmatických koncentrácií amlodipínu je podobný u mladých a starších pacientov. U starších pacientov klírens amlodipínu má tendenciu klesať, čo spôsobuje zväčšenie plochy pod krivkou (AUC) a predĺženie polčasu eliminácie. Priemerná systémová AUC valsartanu je o 70% vyššia u starších ako u mladých ľudí, preto je pri zvyšovaní dávkovania potrebná opatrnosť.
Systémová expozícia valsartanu je mierne zvýšená u starších pacientov v porovnaní s mladšími, ale nepreukázalo sa, že by to bolo klinicky významné.
Obmedzené údaje naznačujú, že systémový klírens hydrochlorotiazidu je znížený u zdravých aj hypertenzných starších osôb v porovnaní s mladými zdravými dobrovoľníkmi.
Keďže tieto tri zložky tolerujú rovnako dobre mladší aj starší pacienti, odporúčajú sa normálne dávkovacie režimy (pozri časť 4.2).
Poškodenie funkcie obličiek
Farmakokinetiku amlodipínu poškodenie funkcie obličiek významne neovplyvňuje. Podľa očakávania pri zlúčenine, ktorej renálny klírens predstavuje iba 30% celkového plazmatického klírensu, sa nepozorovala žiadna korelácia medzi funkciou obličiek a systémovou expozíciou valsartanu.
Pacienti s ľahkým až stredne ťažkým poškodením funkcie obličiek môžu preto dostať obvyklú začiatočnú dávku (pozri časti 4.2 a 4.4).
Poškodenie funkcie pečene
Pacienti s insuficienciou pečene majú znížený klírens amlodipínu, čo má za následok zväčšenie AUC približne o 40-60%. V priemere je u pacientov s ľahkým až stredne ťažkým chronickým ochorením pečene expozícia (stanovená hodnotami AUC) valsartanu dvojnásobná v porovnaní so zdravými dobrovoľníkmi (so zodpovedajúcim vekom, pohlavím a telesnou hmotnosťou). U pacientov s ochorením pečene je potrebné postupovať opatrne (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
V rôznych predklinických štúdiách bezpečnosti amplodipínu, valsartanu, hydrochlorotiazidu, valsartanu/hydrochlorotiazidu, amlodipínu/valsartanu a amlodipínu/valsartanu/hydrochlorotiazidu (Dafiro HCT) vykonaných na viacerých živočíšnych druhoch sa nepreukázala systémová ani cieľová orgánová toxicita, ktorá by nepriaznivo ovplyvnila vývoj Dafira HCT pre klinické použitie u ľudí.
Predklinické štúdie bezpečnosti trvajúce do 13 týždňov sa vykonali s amlodipínom/valsartanom/hydrochlorotiazidom na potkanoch. Kombinácia viedla k očakávanému poklesu erytrocytovej masy (erytrocytov, hemoglobínu, hematokritu a retikulocytov), vzostupu močoviny v sére, vzostupu kreatinínu v sére, zvýšeniu draslíka v sére, k juxtaglomerulárnej (JG) hyperplázii v obličke a fokálnym eróziám v žľazovom žalúdku potkanov. Všetky tieto zmeny boli reverzibilné po 4-týždňovom období zotavenia a boli považované za vystupňované farmakologické účinky.
Kombinácia amlodipínu/valsartanu/hydrochlorotiazidu sa netestovala na genotoxicitu alebo karcinogenitu, pretože nebol žiaden dôkaz o akejkoľvek interakcii medzi týmito látkami, ktoré sú už dlhý čas na trhu. Amlodipín, valsartan a hydrochlorotiazid však boli samostatne testované na genotoxicitu a karcinogenitu s negatívnymi výsledkami.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety Mikrokryštalická celulóza Krospovidón
Koloidný bezvodý oxid kremičitý
Magnéziumstearát
Obal tablety Hypromelóza Makrogol 4000
Mastenec
Oxid titaničitý (E171) Žltý oxid železitý (E172) Červený oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30°C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC blistre. Jeden blister obsahuje 7, 10 alebo 14 filmom obalených tabliet. Veľkosti balenia: 14, 28, 30, 56, 90, 98 alebo 280 filmom obalených tabliet.
Spoločné balenia obsahujúce 280 tabliet, tvorené 20 škatuľkami, z ktorých každá obsahuje 14 tabliet.
PVC/PVDC perforované blistre s jednotlivými dávkami na použitie v nemocniciach: Veľkosti balenia: 56, 98 alebo 280 filmom obalených tabliet.
Spoločné balenia obsahujúce 280 tabliet, tvorené 4 škatuľkami, z ktorých každá obsahuje 70 tabliet. Nie všetky veľkosti balenia alebo liekové sily musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Novartis Europharm Limited
Wimblehurst Road
Horsham
West Sussex, RH12 5AB Veľká Británia
8. REGISTRAČNÉ ČÍSLA
9. DÁTUM PRVEJ REGISTRÁCIE / PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
1. NÁZOV LIEKU
Dafiro HCT 5 mg/160 mg/25 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá filmom obalená tableta obsahuje 5 mg amlodipínu (ako amlodipíniumbesilátu), 160 mg valsartanu a 25 mg hydrochlorotiazidu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta (tableta)
Žlté oválne bikonvexné tablety so skoseným okrajom, s vyrazeným označením „NVR” na jednej strane a „VEL” na druhej strane.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba esenciálnej hypertenzie, ako náhradná liečba u dospelých pacientov, ktorých krvný tlak je primerane znížený kombináciou amlodipínu, valsartanu a hydrochlorotiazidu (HCT), ktoré sa užívajú buď ako tri jednozložkové lieky, alebo ako dvojzložkový a jednozložkový liek.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Odporúčané dávkovanie lieku Dafiro HCT je jedna tableta denne, ktorá sa má užívať podľa možnosti ráno.
Skôr ako pacienti prejdú na liečbu Dafirom HCT, majú mať stav upravený stabilnými dávkami jednotlivých zložiek užívaných v rovnakom čase. Dávka Dafira HCT má byť založená na dávkach jednotlivých zložiek kombinácie v čase zmeny liečby.
Maximálna odporúčaná dávka Dafira HCT je 10 mg/320 mg/25 mg. Osobitné populácie
Poškodenie funkcie obličiek
Pre hydrochlorotiazidovú zložku je Dafiro HCT kontraindikované u pacientov s ťažkým poškodením funkcie obličiek (klírens kreatinínu <30 ml/min) (pozri časti 4.3 a 5.2). U pacientov s miernym až stredne ťažkým poškodením funkcie obličiek nie je potrebná úprava dávkovania. U pacientov so stredne ťažkým poškodením funkcie obličiek sa odporúča monitorovanie hladín draslíka a kreatinínu.
Poškodenie funkcie pečene
Pre hydrochlorotiazidovú a valsartanovú zložku je Dafiro HCT kontraindikované u pacientov so závažným poškodením funkcie pečene (pozri časť 4.3). U pacientov s miernym až stredne ťažkým poškodením funkcie pečene bez cholestázy je maximálna odporúčaná dávka valsartanu 80 mg, preto nie je Dafiro HCT vhodné pre túto skupinu pacientov (pozri časti 4.3, 4.4 a 5.2).
Srdcové zlyhávanie a ischemická choroba srdca
U pacientov so srdcovým zlyhávaním a ischemickou chorobou srdca sú obmedzené skúsenosti
s použitím Dafira HCT, najmä s maximálnou dávkou. Opatrnosť je potrebná u pacientov so srdcovým
zlyhávaním a ischemickou chorobou srdca, zvlášť pri maximálnej dávke Dafira HCT
10 mg/320 mg/25 mg.
Starší pacienti (vo veku 65 rokov alebo viac)
Opatrnosť vrátane častejšieho monitorovania krvného tlaku sa odporúča u starších pacientov, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
Pediatrická populácia
Použitie Dafira HCT u pediatrickej populácie (pacienti vo veku menej ako 18 rokov) v indikácii esenciálna hypertenzia nie je relevantné.
Spôsob podávania
Dafiro HCT možno užívať s jedlom alebo bez jedla. Tablety sa majú prehĺtať celé s trochou vody, v rovnakom dennom čase, podľa možnosti ráno.
4.3 Kontraindikácie
− Precitlivenosť na liečivá, na iné sulfonamidy, na dihydropyridínové deriváty alebo na ktorúkoľvek z pomocných látok.
− Druhý a tretí trimester gravidity (pozri časti 4.4 a 4.6).
− Poškodenie funkcie pečene, biliárna cirhóza alebo cholestáza.
− Ťažké zhoršenie funkcie obličiek (GFR <30 ml/min/1,73 m2), anúria a dialyzovaní pacienti.
− Refraktérna hypokaliémia, hyponatriémia, hyperkalciémia a symptomatická hyperurikémia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pacienti s depléciou sodíka a/alebo objemu
Výrazná hypotenzia vrátane ortostatickej hypotenzie sa pozorovala u 1,7% pacientov pri liečbe maximálnou dávkou Dafira HCT (10 mg/320 mg/25 mg) v porovnaní s 1,8% pacientov pri valsartane/hydrochlorotiazide (320 mg/25 mg), 0,4% pacientov pri amlodipíne/valsartane
(10 mg/320 mg) a 0,2% pacientov pri hydrochlorotiazide/amplodipíne (25 mg/10 mg)
v kontrolovanom klinickom skúšaní u pacientov so stredne ťažkou až ťažkou nekomplikovanou hypertenziou. U pacientov s aktivovaným systémom renín-angiotenzín (ako sú pacienti s depléciou objemu a/alebo soli liečení vysokými dávkami diuretík), ktorí dostávajú antagonisty receptorov angiotenzínu II (AIIRA), sa môže vyskytnúť symptomatická hypotenzia. Odporúča sa úprava tohto stavu pred podaním Dafira HCT alebo starostlivý lekársky dohľad na začiatku liečby.
Ak pri užívaní Dafira HCT vznikne výrazná hypotenzia, pacienta je potrebné uložiť na chrbát a v prípade potreby podať intravenóznu infúziu fyziologického roztoku. V liečbe možno pokračovať po stabilizovaní krvného tlaku.
Zmeny elektrolytov v sére
Amlodipín/valsartan/hydrochlorotiazid
V kontrolovanom klinickom skúšaní Dafira HCT sa protichodné účinky valsartanu 320 mg a hydrochlorotiazidu 25 mg na draslík v sére u mnohých pacientov približne vyvážili. U iných pacientov môže prevládať jeden alebo druhý účinok. Pravidelné stanovovanie elektrolytov v sére sa má vykonávať v primeraných intervaloch, aby sa zistila možná elektrolytová nerovnováha.
Pravidelné stanovovanie sérových elektrolytov a najmä draslíka sa má robiť vo vhodných intervaloch, aby sa zistila prípadná nerovnováha elektrolytov, zvlášť u pacientov s inými rizikovými faktormi, napr. pri poškodení funkcie obličiek, podávaní iných liekov alebo pri nerovnováhe elektrolytov
v anamnéze.
Valsartan
Súčasné použitie s doplnkami draslíka, diuretikami šetriacimi draslík, náhradami solí obsahujúcimi draslík alebo inými liekmi, ktoré môžu hladinu draslíka zvyšovať (heparín atď.), sa neodporúča. Podľa potreby sa má monitorovať hladina draslíka.
Hydrochlorotiazid
Pri liečbe tiazidovými diuretikami vrátane hydrochlorotiazidu sa zaznamenala hypokaliémia.
Liečba tiazidovými diuretikami vrátane hydrochlorotiazidu sa spája s hyponatriémiou a hypochloremickou alkalózou. Tiazidy vrátane hydrochlorotiazidu zvyšujú vylučovanie horčíka močom, čo môže spôsobiť hypomagneziémiu. Tiazidové diuretiká znižujú vylučovanie vápnika. Môže to spôsobiť hyperkalciémiu.
Poškodenie funkcie obličiek
U pacientov s miernym až stredne ťažkým poškodením funkcie obličiek (GFR >30 ml/min/1,73 m2) nie je potrebná úprava dávkovania Dafira HCT. Pri používaní Dafira HCT u pacientov s poškodením funkcie obličiek sa odporúča pravidelné monitorovanie draslíka, kreatinínu a kyseliny močovej v sére.
Stenóza renálnej artérie
Nie sú dostupné údaje o používaní Dafira HCT u pacientov s unilaterálnou alebo bilaterálnou stenózou renálnej artérie alebo stenózou artérie pri solitérnej obličke.
Transplantácia obličky
Zatiaľ nie sú skúsenosti s bezpečným použitím Dafira HCT u pacientov, ktorí sa nedávno podrobili transplantácii obličky.
Poškodenie funkcie pečene
Valsartan sa eliminuje prevažne nezmenený žlčou, zatiaľ čo amlodipín sa extenzívne metabolizuje v pečeni. U pacientov s ľahkým až stredne ťažkým poškodením funkcie pečene bez cholestázy je maximálna odporúčaná dávka valsartanu 80 mg, preto Dafiro HCT nie je vhodné pre túto skupinu pacientov (pozri časti 4.2, 4.3 a 5.2).
Zlyhávanie srdca a ischemická choroba srdca
U citlivých osôb možno v dôsledku inhibície systému renín-angiotenzín-aldosterón predpokladať zmeny funkcie obličiek. U pacientov s ťažkým zlyhávaním srdca, u ktorých funkcia obličiek môže závisieť od aktivity systému renín-angiotenzín-aldosterón, sa liečba inhibítormi enzýmu konvertujúceho angiotenzín (ACE) a antagonistami receptorov angiotenzínu spájala s oligúriou a/alebo progredujúcou azotémiou a (zriedka) s akútnym zlyhaním obličiek a/alebo úmrtím. Podobné následky boli hlásené pri valsartane.
V dlhodobom placebom kontrolovanom klinickom skúšaní (PRAISE-2) amlodipínu u pacientov so zlyhávaním srdca triedy III a IV podľa NYHA (New York Heart Association Classification) neischemickej etiológie sa amlodipín spájal so zvýšeným počtom hlásení pľúcneho edému napriek tomu, že v porovnaní s placebom nebol významný rozdiel v incidencii zhoršenia zlyhávania srdca.
Opatrnosť je potrebná u pacientov so srdcovým zlyhávaním a ischemickou chorobou srdca, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
Stenóza aortálnej a mitrálnej chlopne, obštrukčná hypertrofická kardiomyopatia
Tak ako pri všetkých ostatných vazodilatanciách, osobitná opatrnosť sa vyžaduje u pacientov s aortálnou alebo mitrálnou stenózou alebo obštrukčnou hypertrofickou kardiomyopatiou.
Gravidita
Liečba antagonistami receptorov angiotenzínu II (AIIRA) sa nemá začať počas gravidity. Ak sa nepretržitá liečba AIIRA nepovažuje za nevyhnutnú, pacientky plánujúce graviditu je potrebné previesť na alternatívnu antihypertenzívnu liečbu, ktorá má potvrdený bezpečnostný profil pri použití
počas gravidity. Keď sa potvrdí gravidita, liečba AIIRA sa má okamžite ukončiť a ak je to potrebné, má sa začať alternatívna liečba (pozri časti 4.3 a 4.6).
Primárny hyperaldosteronizmus
Pacienti s primárnym hyperaldosteronizmom nemajú byť liečení antagonistom angiotenzínu II valsartanom, pretože ich systém renín-angiotenzín nie je aktivovaný. Preto sa Dafiro HCT u tejto populácie neodporúča.
Systémový lupus erythematosus
Tiazidové diuretiká vrátane hydrochlorotiazidu spôsobujú podľa hlásení exacerbáciu alebo aktiváciu systémového lupus erythematosus.
Iné metabolické poruchy
Tiazidové diuretiká vrátane hydrochlorotiazidu môžu zmeniť glukózovú toleranciu a zvýšiť hladiny cholesterolu, triacylglycerolov a kyseliny močovej v sére. U pacientov s diabetes môže byť potrebné upraviť dávkovanie inzulínu alebo perorálnych antidiabetík.
Tiazidy môžu znižovať vylučovanie vápnika močom a spôsobovať prechodné a mierne zvýšenie hladín vápnika v sére, aj keď nie sú prítomné známe poruchy metabolizmu vápnika. Výrazná hyperkalciémia môže svedčiť o skrytom hyperparatyreoidizme. Tiazidy sa majú vysadiť ešte pred vykonaním testov funkcie prištítnych teliesok.
Fotosenzitivita
Pri tiazidových diuretikách boli hlásené prípady reakcií z fotosenzitivity (pozri časť 4.8). Ak sa počas liečby Dafirom HCT vyskytne reakcia z fotosenzitivity, odporúča sa liečbu ukončiť. Ak sa opätovné podanie diuretika považuje za potrebné, odporúča sa chrániť oblasti vystavené slnečnému žiareniu alebo umelému UVA.
Všeobecné upozornenia
Opatrnosť je potrebná u pacientov, u ktorých sa v minulosti preukázala precitlivenosť na iné antagonisty receptorov angiotenzínu II. Reakcie z precitlivenosti na hydrochlorotiazid sú pravdepodobnejšie u pacientov s alergiou a astmou.
Starší pacienti (vo veku 65 rokov alebo viac)
Opatrnosť vrátane častejšieho monitorovania krvného tlaku sa odporúča u starších pacientov, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
4.5 Liekové a iné interakcie
Formálne štúdie interakcií Dafira HCT s inými liekmi sa nevykonali. Preto sa v tejto časti uvádzajú len informácie o interakciách s inými liekmi, ktoré sú známe pre jednotlivé liečivá.
Je však dôležité vziať do úvahy, že Dafiro HCT môže zvyšovať hypotenzívny účinok iných antihypertenzív.
Súbežné používanie sa neodporúča
Jednotlivá
z
ložka
 Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi
Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi
Valsartan a
HCT
Lítium Počas súčasného podávania inhibítorov ACE a tiazidov, napr. hydrochlorotiazidu, sa zaznamenalo reverzibilné zvýšenie sérových koncentrácií a toxicity lítia. Napriek nedostatočným skúsenostiam so súčasným podávaním valsartanu a lítia sa táto kombinácia neodporúča. Ak sa ukáže, že je potrebná, odporúča sa starostlivo monitorovať
hladiny lítia v sére (pozri časť 4.4).
Valsartan Diuretiká šetriace kálium, doplnky draslíka, náhrady soli obsahujúce draslík

a iné látky, ktoré môžu zvyšovať hladiny draslíka
Ak sa za potrebnú považuje kombinácia valsartanu s liekom, ktorý ovplyvňuje hladiny draslíka, odporúča sa časté monitorovanie plazmatických hladín draslíka.
Opatrnosť
potrebná pri súčasnom užívaní
Jednotlivá
 z
ložka Dafira HCT
z
ložka Dafira HCT Amlodipín
Známe interakcie snasledujúcimi látkamiInhibítory CYP3A4 (napr. ketokonazol, itrakonazol, ritonavir)
Účinok interakcie s inými liekmiKlinické skúšanie so staršími pacientmi ukázalo, že diltiazem inhibuje metabolizmus amlodipínu, pravdepodobne prostredníctvom CYP3A4 (plazmatická koncentrácia sa zvyšuje približne o 50% a účinok amlodipínu je zvýšený). Nedá sa vylúčiť možnosť, že účinnejšie inhibítory CYP3A4 (t.j. ketokonazol, itrakonazol, ritonavir) môžu zvýšiť plazmatickú
koncentráciu amlodipínu vo väčšej miere než diltiazem.

Valsartan a
HCT
Induktory CYP3A4 (antikonvulzíva [napr. karbamazepín, fenobarbital, fenytoín, fosfenytoín, primidón], rifampicín,
Hypericum perforatum [ľubovník bodkovaný])
Nesteroidné antiflogistiká (NSAID) vrátane selektívnych inhibítorov COX-2, acetylsalicylovej kyseliny (>3 g/deň) a neselektívnych NSAIDSúčasné podávanie môže viesť k zníženiu plazmatických koncentrácií amlodipínu. Vyžaduje sa klinické monitorovanie s možnou úpravou dávkovania amlodipínu počas liečby induktorom a po jeho vysadení.

NSAID môžu oslabiť antihypertenzívny účinok antagonistov angiotenzínu II aj hydrochlorotiazidu, keď sa podávajú súčasne. Okrem toho súbežné užívanie Dafira HCT a NSAID môže mať za následok zhoršenie funkcie obličiek a zvýšenie draslíka v sére. Preto sa odporúča monitorovanie funkcie obličiek na začiatku liečby, ako aj náležitá hydratácia pacienta.
HCT
Lieky ovplyvňované poruchami draslíka v séreAlkohol, anestetiká aPravidelné monitorovanie sérového draslíka a EKG sa odporúča pri súčasnom podávaní lieku obsahujúceho hydrochlorotiazid s látkami, ktoré sú ovplyvňované poruchami draslíka v sére (napr. digitálisové glykozidy, antiarytmiká) a s nasledujúcimi látkami, ktoré vyvolávajú torsades de pointes (patria k nim niektoré antiarytmiká), pričom hypokaliémia je predisponujúcim faktorom pre
torsades de pointes.- Antiarytmiká triedy Ia (napr. chinidín, hydrochinidín, dizopyramid)
- Antiarytmiká triedy III (napr. amiodarón, sotalol, dofetilid, ibutilid)
- Niektoré antipsychotiká (napr. tioridazín, chlórpromazín, levomepromazín, trifluoperazín, cyamemazín, sulpirid, sultoprid, amisulprid, tiaprid, pimozid, haloperidol, droperidol, metadón)

- Iné (napr. bepridil, cisaprid, difemanil, erytromycín i.v., halofantrín, ketanserín, mizolastín, pentamidín, moxifloxacín, terfenadín, vinkamín i.v.)
Môže sa vyskytnúť potenciovanie ortostatickej
sedatíva
hypotenzie.
Amantadín Tiazidy vrátane hydrochlorotiazidu môžu zvyšovať riziko
nežiaducich reakcií spôsobených amantadínom.
Anticholínergiká (napr. atropín, biperidén)
Biologická dostupnosť diuretík tiazidového typu sa môže zvýšiť anticholínergikami (napr. atropínom, biperidénom), zjavne pre zníženie gastrointestinálnej motility a rýchlosti
vyprázdňovania žalúdka.
Antidiabetiká (napr. inzulín a perorálne antidiabetiká)
Môže byť potrebné znovu upraviť dávkovanie inzulínu a perorálnych antidiabetík.
− Metformín Metformín sa má používať opatrne vzhľadom na riziko laktátovej acidózy vyvolanej možným funkčným zlyhaním
obličiek pripisovaným hydrochlorotiazidu.
Betablokátory a diazoxid
Súčasné užívanie tiazidových diuretík vrátane hydrochlorotiazidu s betablokátormi môže zvýšiť riziko hyperglykémie. Tiazidové diuretiká vrátane hydrochlorotiazidu môžu zosilniť hyperglykemizujúci
účinok diazoxidu.
Karbamazepín U pacientov, ktorí dostávajú hydrochlorotiazid súčasne
s karbamazepínom, môže vzniknúť hyponatriémia. Takých pacientov je preto potrebné informovať o možnosti hyponatriemických reakcií a je potrebné ich náležite
sledovať.
Cholestyramínové a kolestipolové živice
Absorpcia tiazidových diuretík vrátane hydrochlorotiazidu je znížená cholestyramínom a inými aniónovými
iónomeničovými živicami.
 Cyklosporín
Cyklosporín Súčasná liečba cyklosporínom môže zvýšiť riziko hyperurikémie a komplikácií typu dny.
Cytotoxické látky (napr.
cyklofosfamid, metotrexát)
Tiazidy vrátane hydrochlorotiazidu môžu znižovať
vylučovanie cytotoxických látok obličkami (napr. cyklofosfamidu, metotrexátu) a potenciovať ich
 myelosupresívne účinky.
myelosupresívne účinky.
 Digitálisové glykozidy
Digitálisové glykozidy Hypokaliémia alebo hypomagneziémia vyvolané tiazidmi sa môžu vyskytnúť ako neželané účinky napomáhajúce
vzniku srdcových arytmií vyvolaných digitálisom.
Kontrastné látky obsahujúce jód
V prípade dehydratácie vyvolanej diuretikami je zvýšené riziko akútneho zlyhania obličiek, najmä pri vysokých dávkach jódovaných látok. Pacienti majú byť pred
podaním rehydratovaní.
Liečivá ovplyvňujúce draslík (kaliuretické diuretiká, kortikosteroidy, laxatíva, ACTH, amfotericín, karbenoxolón, penicilín G, deriváty kyseliny
Hypokaliemický účinok hydrochlorotiazidu môžu zvýšiť kaliuretické diuretiká, kortikosteroidy, laxatíva, adrenokortikotropný hormón (ACTH), amfotericín, karbenoxolón, penicilín G a deriváty kyseliny salicylovej. Ak sa tieto lieky majú predpísať s kombináciou amlodipínu/valsartanu/hydrochlorotiazidu, odporúča sa sledovať hladinu draslíka v plazme.
salicylovej)
Lieky používané na liečbu dny (probenecid, sulfínpyrazón a alopurinol)
Môže byť potrebná úprava dávok urikosurík, pretože hydrochlorotiazid môže zvýšiť hladinu kyseliny močovej
v sére. Môže byť potrebné zvýšiť dávkovanie probenecidu alebo sulfínpyrazónu. Súčasné podávanie tiazidových diuretík vrátane hydrochlorotiazidu môže zvyšovať
incidenciu reakcií z precitlivenosti na alopurinol.
Metyldopa Vyskytli sa ojedinelé hlásenia hemolytickej anémie, ktorá vznikla pri súčasnom použití hydrochlorotiazidu a
metyldopy.

 Nedepolarizujúce relaxanciá kostrového svalstva
Nedepolarizujúce relaxanciá kostrového svalstva (napr. tubokurarín)
Presorické amíny (napr. noradrenalín, adrenalín)
Vitamín D a soli vápnikaTiazidy vrátane hydrochlorotiazidu potenciujú účinok derivátov kurare.
Účinok presorických amínov sa môže znížiť.

Podávanie tiazidových diuretík vrátane hydrochlorotiazidu s vitamínom D alebo soľami vápnika môže potenciovať zvýšenie vápnika v sére.
Žiadne interakcie
Jednotlivá
z
ložka
Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi


Valsartan
Iné(cimetidín, warfarín, furosemid, digoxín, atenolol, indometacín, hydrochlorotiazid, amlodipín, glibenklamid)
Pri monoterapii valsartanom sa nezistili žiadne klinicky významné interakcie s nasledujúcimi liečivami: cimetidín, warfarín, furosemid, digoxín, atenolol, indometacín, hydrochlorotiazid, amlodipín, glibenklamid.
Niektoré z týchto látok môžu interagovať s hydrochlorotiazidovou zložkou Dafira HCT (pozri interakcie súvisiace s HCT).
 4.6 Gravidita a laktácia
Gravidita
Amlodipín
4.6 Gravidita a laktácia
Gravidita
Amlodipín
Údaje o obmedzenom počte gravidít naznačujú, že amlodipín a iné antagonisty kalciových receptorov nemajú nežiaduce účinky na zdravie plodu. Môže však byť riziko predĺženia pôrodu.
ValsartanPoužitie antagonistov receptorov angiotenzínu II (AIIRA) sa neodporúča počas prvého trimestra gravidity (pozri časť 4.4). Použitie AIIRA je kontraindikované počas druhého a tretieho trimestra gravidity (pozri časti 4.3 a 4.4).
Epidemiologické dôkazy týkajúce sa rizika teratogenity po expozícii inhibítorom ACE počas prvého
trimestra gravidity neboli nezvratné; malé zvýšenie rizika však nemožno vylúčiť. Zatiaľ čo nie sú kontrolované epidemiologické údaje o riziku pri antagonistoch receptorov angiotenzínu II (AIIRA), podobné riziká môžu existovať pre túto skupinu liekov. Ak sa nepretržitá liečba AIIRA nepovažuje za nevyhnutnú, pacientky plánujúce graviditu je potrebné previesť na alternatívnu antihypertenzívnu liečbu, ktorá má potvrdený bezpečnostný profil pri použití počas gravidity. Keď sa potvrdí gravidita, liečba AIIRA sa má okamžite ukončiť a ak je to potrebné, má sa začať alternatívna liečba.
Je známe, že expozícia AIIRA pri liečbe počas druhého a tretieho trimestra gravidity vyvoláva u ľudí fetotoxické účinky (poškodenie funkcie obličiek, oligohydramnión, spomalenie osifikácie lebky) a toxické účinky u novorodencov (zlyhanie obličiek, hypotenzia, hyperkaliémia) (pozri časť 5.3).
Ak by došlo k expozícii AIIRA od druhého trimestra gravidity, odporúča sa ultrazvukové vyšetrenie funkcie obličiek a lebky.
Dojčatá, ktorých matky užívali AIIRA, je potrebné dôsledne sledovať pre hypotenziu (pozri časti 4.3
a 4.4).
HydrochlorotiazidS použitím hydrochlorotiazidu počas gravidity, najmä počas prvého trimestra, sú obmedzené skúsenosti. Štúdie na zvieratách sú nedostatočné.
Hydrochlorotiazid prechádza cez placentu. Na základe farmakologického mechanizmu účinku môže použitie hydrochlorotiazidu počas druhého a tretieho trimestra ohroziť fetoplacentárnu perfúziu a môže mať účinky na plod a novorodenca, ako sú žltačka, poruchy rovnováhy elektrolytov
a trombocytopénia a môže sa spájať s inými nežiaducimi reakciami, ktoré sa vyskytli u dospelých.
Amlodipín/valsartan/hydrochlorotiazidNie sú skúsenosti s používaním Dafira HCT u gravidných žien. Na základe existujúcich údajov o jeho zložkách sa použitie Dafira HCT neodporúča počas prvého trimestra a je kontraindikované počas druhého a tretieho trimestra gravidity (pozri časti 4.3 a 4.4).
DojčenieNie sú dostupné informácie o použití valsartanu a/alebo amlodipínu počas dojčenia. Hydrochlorotiazid sa vylučuje do materského mlieka. Preto sa neodporúča použitie Dafira HCT počas dojčenia. Vhodnejšie sú iné druhy liečby s lepšie preukázaným bezpečnostným profilom počas dojčenia, najmä pri dojčení novorodencov alebo predčasne narodených detí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Pri vedení vozidla alebo obsluhe strojov je potrebné vziať do úvahy, že občas sa môžu vyskytnúť závraty alebo únava.
4.8 Nežiaduce účinky
Bezpečnostný profil Dafira HCT uvedený nižšie je založený na klinických štúdiách vykonaných s Dafirom HCT a na známom bezpečnostnom profile jeho jednotlivých zložiek amlodipínu, valsartanu a hydrochlorotiazidu.
Informácie o Dafire HCT
Bezpečnosť Dafira HCT sa vyhodnotila pri jeho maximálnej dávke 10 mg/320 mg/25 mg v jednej kontrolovanej krátkodobej (8 týždňov) klinickej štúdii s 2 271 pacientmi, z ktorých 582 dostávalo valsartan v kombinácii s amlodipínom a hydrochlorotiazidom. Nežiaduce reakcie boli spravidla mierne a prechodné a len zriedkavo vyžadovali ukončenie liečby. V tomto klinickom skúšaní kontrolovanom účinným liekom boli najčastejšími dôvodmi na ukončenie liečby Dafirom HCT závraty a hypotenzia (0,7%).
V kontrolovanej klinickej štúdii trvajúcej 8 týždňov sa nepozorovali žiadne významné nové alebo neočakávané nežiaduce reakcie pri liečbe trojkombináciou v porovnaní so známymi účinkami zložiek v monoterapii alebo pri liečbe dvojkombináciou.
V kontrolovanej klinickej štúdii trvajúcej 8 týždňov boli pozorované zmeny laboratórnych parametrov pri kombinácii Dafira HCT len malé a v súlade s farmakologickým mechanizmom účinku látok použitých v monoterapii. Prítomnosť valsartanu v trojkombinácii oslabila hypokaliemický účinok hydrochlorotiazidu.
Nasledujúce nežiaduce reakcie, uvedené podľa triedy orgánových systémov MedDRA a frekvencie, sa týkajú Dafira HCT (amlodipín/valsartan/HCT) a samostatne amlodipínu, valsartanu a HCT.
Veľmi časté: ≥l/10; časté: ≥l/100 až <l/10; menej časté: ≥l/1 000 až <1/100; zriedkavé: ≥1/10 000 až
<1/1 000; veľmi zriedkavé <1/10 000), neznáme (z dostupných údajov).
Trieda
orgánového systému MedDRA
Nežiaduce reakcie
Frekvencia
Dafiro
HCT
Amlodipín Valsartan HCT
Poruchy krvi
a lymfatického systému
Agranulocytóza, útlm kostnej drene
Pokles hemoglobínu a hematokritu
-- -- Veľmi zriedkavé
-- -- Neznáme --
Hemolytická anémia -- -- -- Veľmi zriedkavé
Leukopénia -- Veľmi zriedkavé
-- Veľmi zriedkavé
Neutropénia -- -- Neznáme --

Poruchy imunitného systému
Trombocytopénia -- Veľmi zriedkavé
Precitlivenosť -- Veľmi zriedkavé
Neznáme Zriedkavé
Neznáme Veľmi zriedkavé
Poruchy metabolizmu a
Anorexia Menej časté -- -- -- Hyperkalciémia Menej časté -- -- Zriedkavé
výživy
Hyperglykémia -- Veľmi zriedkavé
-- Zriedkavé
Psychické poruchy
Poruchy nervového
Hyperlipidémia Menej časté -- -- -- Hyperurikémia Menej časté -- -- Menej časté Hypochloremická alkalóza -- -- -- Veľmi
zriedkavé
Hypokaliémia Časté -- -- Časté Hypomagneziémia -- -- -- Menej časté Hyponatriémia Menej časté -- -- Menej časté Depresia -- -- -- Zriedkavé Nespavosť/poruchy spánku Menej časté Menej časté -- Zriedkavé Kolísanie nálady -- Menej časté --
Abnormálna koordinácia Menej časté -- -- -- Závraty Časté Časté -- Zriedkavé
systému
Posturálne závraty, závraty pri námahe
Menej časté -- -- --
Dysgeúzia Menej časté Menej časté -- -- Extrapyramídový syndróm -- Neznáme -- -- Bolesť hlavy Časté Časté -- Zriedkavé
Hypertónia -- Veľmi zriedkavé
-- --
Letargia Menej časté -- -- -- Parestézia Menej časté Menej časté -- Zriedkavé
Periférna neuropatia, neuropatia
Menej časté Veľmi zriedkavé
-- --
Somnolencia Menej časté Časté -- -- Synkopa Menej časté Menej časté -- -- Tremor -- Menej časté -- --
Poruchy oka Porucha videnia Menej časté Menej časté -- Menej časté
Poruchy ucha a
Tinitus -- Menej časté -- --
labyrintu Vertigo Menej časté -- Menej časté --
Poruchy srdca a srdcovej činnosti
Palpitácie -- Časté -- -- Tachykardia Menej časté -- -- --
Arytmia (vrátane bradykardie, komorovej tachykardie a fibrilácie predsiení)
-- Veľmi zriedkavé
-- Zriedkavé
Infarkt myokardu -- Veľmi zriedkavé
-- --
Poruchy ciev
Sčervenanie -- Časté -- -- Hypotenzia Časté Menej časté -- -- Ortostatická hypotenzia Menej časté -- -- Menej časté Flebitída, tromboflebitída Menej časté -- -- --

Vaskulitída -- Veľmi zriedkavé
Neznáme --
Poruchy
dýchacej sústavy,
Kašeľ Menej časté Veľmi zriedkavé
Menej časté --
hrudníka a
Dyspnoe Menej časté Menej časté -- --
mediastína
Respiračná tieseň, pľúcny edém, pneumonitída
-- -- -- Veľmi zriedkavé
Rinitída -- Menej časté -- -- Podráždenie hrdla Menej časté -- -- --
Poruchy gastrointestinál-
Nepríjemné pocity v bruchu, bolesť v hornej časti brucha
Menej časté Časté Menej časté Zriedkavé
neho traktu
Zapáchajúci dych Menej časté -- -- --
Zmena vo vyprázdňovaní
čriev
-- Menej časté -- --
Zápcha -- -- -- Zriedkavé Znížená chuť do jedenia -- -- -- Menej časté Hnačka Menej časté Menej časté -- Zriedkavé Suchosť v ústach Menej časté Menej časté -- -- Dyspepsia Časté Menej časté -- --
Gastritída -- Veľmi zriedkavé
Hyperplázia ďasien -- Veľmi zriedkavé
-- --
-- --
Nauzea Menej časté Časté -- Menej časté
Pankreatitída -- Veľmi zriedkavé
-- Veľmi zriedkavé
Vracanie Menej časté Menej časté -- Menej časté
Poruchy pečene a žlčových ciest
Vzostup hepatálnych enzýmov vrátane zvýšenia bilirubínu v sére
-- Veľmi zriedkavé
Neznáme --
Hepatitída -- Veľmi zriedkavé
-- --
Intrahepatálna cholestáza, ikterus
-- Veľmi zriedkavé
-- Zriedkavé
Poruchy kože a
Alopécia -- Menej časté --
podkožného tkaniva
Angioedém -- Veľmi zriedkavé
Neznáme --
Reakcie podobné kožnému lupus erythematosus, reaktivácia kožného lupus erythematosus
-- -- -- Veľmi zriedkavé
Multiformný erytém -- Veľmi zriedkavé
-- --
Exantém -- Menej časté -- -- Hyperhidróza Menej časté Menej časté -- -- Reakcia z fotosenzitivity* -- -- -- Zriedkavé Pruritus Menej časté Menej časté Neznáme -- Purpura -- Menej časté -- Zriedkavé Exantém -- Menej časté Neznáme Menej časté Zmena farby kože -- Menej časté -- --
Urtikária -- Veľmi zriedkavé
-- Menej časté

Nekrotizujúca vaskulitída a toxická epidermálna nekrolýza
-- -- -- Veľmi zriedkavé
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Artralgia -- Menej časté -- -- Bolesť chrbta Menej časté Menej časté -- -- Opuch kĺbov Menej časté -- -- -- Svalové kŕče Menej časté Menej časté -- -- Svalová slabosť Menej časté -- -- -- Myalgia Menej časté Menej časté Neznáme -- Bolesť končatín Menej časté -- -- -- Zvýšenie kreatinínu v sére Menej časté -- Neznáme -- Porucha močenia Menej časté
Nyktúria -- Menej časté -- -- Polakizúria Časté Menej časté
Akútne zlyhanie obličiek Menej časté -- -- --
Zlyhanie a poškodenie funkcie obličiek
-- -- Neznáme Zriedkavé
Poruchy reprodukčného systému a prsníkov
Celkové poruchy a reakcie v
Erektilná dysfunkcia Menej časté Menej časté -- Menej časté
Gynekomastia Menej časté -- --
Abázia, porucha chôdze Menej časté -- -- -- Asténia Menej časté Menej časté -- --
mieste podania
Nepríjemné pocity, celková nevoľnosť
Menej časté Menej časté -- --
Únava Časté Časté Menej časté --
Nekardiálna bolesť v hrudníku
Menej časté Menej časté -- --
Laboratórne a
Edém Časté Časté -- -- Bolesť -- Menej časté -- -- Zvýšenie lipidov -- Časté
funkčné
vyšetrenia
Zvýšenie močovinového dusíka v krvi
Zvýšenie kyseliny močovej v krvi
Menej časté -- -- -- Menej časté -- --

Glykozúria Zriedkavé Zníženie draslíka v sére Menej časté -- -- -- Zvýšenie draslíka v sére -- -- Neznáme -- Zvýšenie telesnej hmotnosti Menej časté Menej časté -- -- Zníženie telesnej hmotnosti -- Menej časté -- --
* Pozri časť 4.4 Fotosenzitivita
4.9 PredávkovanieSymptómyS predávkovaním Dafira HCT nie sú skúsenosti. Hlavným príznakom predávkovania valsartanu je asi výrazná hypotenzia so závratmi. Predávkovanie amlodipínu môže mať za následok nadmernú periférnu vazodilatáciu a možno reflexnú tachykardiu. Pri amlodipíne bola hlásená výrazná a potenciálne dlhodobá systémová hypotenzia vrátane šoku končiaceho sa smrťou.
LiečbaAmlodipín/valsartan/hydrochlorotiazidKlinicky významná hypotenzia spôsobená predávkovaním Dafira HCT vyžaduje aktívnu kardiovaskulárnu podpornú liečbu, vrátane častého monitorovania funkcie srdca a dýchania, vyvýšenia končatín a sledovania objemu cirkulujúcich tekutín a vylučovania moču. Pri obnovení cievneho tonusu a krvného tlaku môže pomôcť vazokonstrikčná látka za predpokladu, že jej podanie
nie je kontraindikované. Intravenózne podanie kalciumglukonátu môže byť prospešné pri zvrátení účinkov blokády kalciových kanálov.
Amlodipín
Ak k požitiu lieku došlo nedávno, možno zvážiť vyvolanie vracania alebo výplach žalúdka. Ukázalo sa, že podanie aktívneho uhlia zdravým dobrovoľníkom ihneď alebo do dvoch hodín od požitia amlodipínu významne znížilo jeho absorpciu.
Odstránenie amlodipínu hemodialýzou nie je pravdepodobné.
Valsartan
Odstránenie valsartanu hemodialýzou nie je pravdepodobné.
Hydrochlorotiazid
Predávkovanie hydrochlorotiazidom sa spája s depléciou elektrolytov (hypokaliémia, hypochlorémia) a s hypovolémiou, ktoré sú dôsledkom nadmernej diurézy. Najčastejšími príznakmi a prejavmi predávkovania sú nauzea a somnolencia. Hypokaliémia môže mať za následok svalové kŕče a/alebo zvýraznenie arytmie spojenej so súbežným podávaním digitálisových glykozidov alebo niektorých antiarytmík.
Miera odstránenia hydrochlorotiazidu hemodialýzou sa nestanovila.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antagonisty angiotenzínu II, samotné (valsartan), kombinácie s derivátmi dihydropyridínu (amlodipín) a tiazidovými diuretikami (hydrochlorotiazid), ATC kód: C09DX01 valsartan, amlodipín a hydrochlorotiazid.
Dafiro HCT kombinuje tri antihypertenzívne zlúčeniny s komplementárnymi mechanizmami znižovania krvného tlaku u pacientov s esenciálnou hypertenziou: amlodipín patrí do liekovej triedy antagonistov kalcia a valsartan do triedy antagonistov angiotenzínu II a hydrochlorotiazid patrí do triedy tiazidových diuretík. Kombinácia týchto látok má aditívny antihypertenzívny účinok.
Amlodipín/valsartan/hydrochlorotiazid
Dafiro HCT sa skúmalo v dvojito slepej štúdii kontrolovanej účinným liekom u pacientov s hypertenziou. Celkovo 2 271 pacientov so stredne ťažkou až ťažkou hypertenziou (priemerná východisková hodnota systolického/diastolického krvného tlaku bola 170/107) dostávalo liečbu amplodipínom/valsartanom/hydrochlorotiazidom 10 mg/320 mg/25 mg, valsartanom/hydrochlorotiazidom 320 mg/25 mg, amlodipínom/valsartanom 10 mg/320 mg alebo hydrochlorotiazidom/amlodipínom 25 mg/10 mg. Na začiatku štúdie pacienti dostávali nižšie dávky ich liečebnej kombinácie a na plnú terapeutickú dávku boli titrovaní do 2. týždňa.
V 8. týždni bol priemerný pokles systolického/diastolického krvného tlaku 39,7/24,7 mmHg pri Dafire
HCT, 32,0/19,7 mmHg pri valsartane/hydrochlorotiazide, 33,5/21,5 mmHg pri amlodipíne/valsartane a 31,5/19,5 mmHg pri amlodipíne/hydrochlorotiazide. Liečba trojkombináciou bola štatisticky lepšia ako liečba ktoroukoľvek z troch dvojkombinácií vzhľadom na zníženie diastolického a systolického krvného tlaku. Pokles systolického/diastolického krvného tlaku pri Dafire HCT bol o 7,6/5,0 mmHg väčší ako pri valsartane/hydrochlorotiazide, o 6,2/3,3 mmHg väčší ako pri amlodipíne/valsartane a o
8,2/5,3 mmHg väčší ako pri amlodipíne/hydrochlorotiazide. Plný hypotenzívny účinok sa dosiahol po
2 týždňoch užívania ich maximálnej dávky Dafira HCT. U štatisticky vyššieho podielu pacientov sa
dosiahlo zníženie krvného tlaku (<140/90 mmHg) pri Dafire HCT (71%) v porovnaní s liečbou ktoroukoľvek z troch dvojkombinácií (45-54%) (p<0,0001).
V podskupine 283 pacientov zameranej na ambulantné monitorovanie krvného tlaku sa pozoroval klinicky a štatisticky lepší pokles 24-hodinového systolického a diastolického krvného tlaku pri trojkombinácii v porovnaní s valsartanom/hydrochlorotiazidom, valsartanom/amlodipínom a hydrochlorotiazidom/amlodipínom.
Amlodipín
Zložka amlodipínu v Dafire HCT inhibuje transmembránový vstup iónov vápnika do hladkého svalstva srdca a ciev. Mechanizmus antihypertenzívneho pôsobenia amlodipínu je podmienený priamym relaxačným účinkom na hladké svalstvo ciev, čo vyvoláva pokles odporu periférnych ciev a krvného tlaku. Experimentálne údaje naznačujú, že amlodipín sa viaže na dihydropyridínové aj na nedihydropyridínové väzbové miesta. Kontraktilné procesy srdcového svalstva a hladkého svalstva ciev závisia od pohybu extracelulárnych iónov vápnika do týchto buniek cez špecifické iónové kanály.
Po podaní terapeutických dávok pacientom s hypertenziou amlodipín vyvoláva vazodilatáciu, čo vedie k poklesu krvného tlaku u ležiaceho aj stojaceho pacienta. Tento pokles nesprevádza pri chronickom podávaní významná zmena srdcovej frekvencie ani plazmatických hladín katecholamínov.
Plazmatické koncentrácie korelujú s účinkom u mladých aj starších pacientov.
U pacientov s hypertenziou s normálnou funkciou obličiek terapeutické dávky amlodipínu vyvolali zníženie odporu obličkových ciev a zvýšenie rýchlosti glomerulárnej filtrácie a efektívneho prietoku plazmy obličkami, a to bezo zmeny filtrovanej frakcie alebo proteinúrie.
Valsartan
Valsartan je perorálne aktívny, účinný a špecifický antagonista receptorov angiotenzínu II. Účinkuje selektívne na receptor podtypu AT1, ktorý je zodpovedný za známe účinky angiotenzínu II.
Podávanie valsartanu pacientom s hypertenziou vyvoláva pokles krvného tlaku bez ovplyvnenia tepovej frekvencie.
U väčšiny pacientov po podaní jednorazovej perorálnej dávky nastupuje antihypertenzívny účinok
v priebehu 2 hodín a maximálny pokles krvného tlaku sa dosiahne počas 4-6 hodín. Antihypertenzívny účinok pretrváva 24 hodín po podaní. Pri opakovanom podávaní maximálne zníženie krvného tlaku pri akejkoľvek dávke sa spravidla dosiahne v priebehu 2-4 týždňov.
Hydrochlorotiazid
Miesto účinku tiazidových diuretík je primárne v distálnom stočenom tubule obličiek. Ukázalo sa, že v kôre obličiek sa vyskytuje vysokoafinitný receptor ako primárne väzbové miesto pre pôsobenie tiazidových diuretík a inhibíciu transportu NaCl v distálnom stočenom tubule. Tiazidy účinkujú prostredníctvom inhibície symportéra Na+Cl-, možno kompetíciou o miesto Cl-, čím ovplyvňujú mechanizmy reabsorpcie elektrolytov: priamo zvyšujú vylučovanie sodíka a chloridu v približne rovnakom rozsahu, a týmto diuretickým účinkom nepriamo znižujú objem plazmy s následným zvýšením plazmatickej aktivity renínu, sekrécie aldosterónu a strát draslíka močom, aj znížením draslíka v sére.
Európska lieková agentúra netrvá na povinnosti predložiť výsledky štúdií s Dafirom HCT u všetkých podsúborov pediatrickej populácie pri esenciálnej hypertenzii. Informácie o použití u detí pozri v časti
4.2.
5.2 Farmakokinetické vlastnosti
Linearita
Amlodipín, valsartan a hydrochlorotiazid majú lineárnu farmakokinetiku.
Amlodipín/valsartan/hydrochlorotiazid
Po perorálnom podaní Dafira HCT zdravým dospelým osobám sa dosiahnu maximálne plazmatické koncentrácie amlodipínu za 6-8 hodín, valsartanu za 3 hodiny a hydrochlorotiazidu za 2 hodiny.
Rýchlosť a rozsah absorpcie amlodipínu, valsartanu a hydrochlorotiazidu z Dafira HCT sú rovnaké ako pri podávaní v osobitných liekoch.
Amlodipín
Absorpcia: Po perorálnom podaní terapeutických dávok samotného amlodipínu sa jeho maximálne plazmatické koncentrácie dosiahnu v priebehu 6-12 hodín. Absolútna biologická dostupnosť sa vypočítala medzi 64% a 80%. Biologická dostupnosť amlodipínu nie je ovplyvnená požitím jedla.
Distribúcia: Distribučný objem je približne 21 l/kg. V štúdiách s amlodipínom in vitro sa ukázalo, že približne 97,5% cirkulujúceho liečiva sa viaže na bielkoviny plazmy.
Biotransformácia: Amlodipín sa extenzívne (približne 90%) metabolizuje v pečeni na neaktívne metabolity.
Eliminácia: Eliminácia amlodipínu z plazmy je bifázická s terminálnym polčasom eliminácie približne
30 až 50 hodín. Rovnovážne hladiny v plazme sa dosiahnu po kontinuálnom podávaní za 7-8 dní. Močom sa vylúči 10% pôvodného amlodipínu a 60% jeho metabolitov.
Valsartan
Absorpcia: Po perorálnom podaní samotného valsartanu sa jeho maximálne plazmatické koncentrácie dosiahnu za 2-4 hodiny. Priemerná absolútna biologická dostupnosť je 23%. Jedlo znižuje expozíciu valsartanu (stanovené ako AUC) asi o 40% a maximálnu plazmatickú koncentráciu (Cmax) asi o 50%, aj keď asi po 8 hodinách od podania sú koncentrácie valsartanu v plazme podobné v skupinách, ktoré ho užili buď s jedlom, alebo nalačno. Tento pokles AUC však nesprevádza klinicky významné zníženie terapeutického účinku, a preto sa valsartan môže užívať buď s jedlom, alebo bez jedla.
Distribúcia: Rovnovážny distribučný objem valsartanu po intravenóznom podaní je asi 17 litrov, čo naznačuje, že valsartan sa extenzívne nedistribuuje do tkanív. Valsartan sa vo vysokej miere viaže na bielkoviny séra (94-97%), prevažne na sérový albumín.
Biotransformácia: Valsartan sa netransformuje vo veľkom rozsahu, pretože iba asi 20% dávky sa nájde ako metabolity. V plazme bol v nízkych koncentráciách zistený hydroxymetabolit (menej ako
10% AUC valsartanu). Tento metabolit je farmakologicky neaktívny.
Eliminácia: Valsartan sa primárne eliminuje stolicou (asi 83% dávky) a močom (asi 13% dávky), prevažne ako nezmenené liečivo. Po intravenóznom podaní plazmatický klírens valsartanu je asi
2 l/hod a jeho renálny klírens 0,62 l/hod (asi 30% celkového klírensu). Polčas valsartanu je 6 hodín.
Hydrochlorotiazid
Absorpcia:Absorpcia hydrochlorotiazidu po perorálnom podaní je rýchla (tmax približne 2 hodiny). V terapeutickom rozmedzí je vzostup priemernej AUC lineárny a úmerný dávke. Po opakovanom podávaní hydrochlorotiazidu sa kinetika nemení a akumulácia je minimálna, keď sa podáva raz denne. Súčasné podávanie s jedlom podľa hlásení zvyšuje aj znižuje systémovú dostupnosť hydrochlorotiazidu v porovnaní s podávaním nalačno. Tieto účinky sú malé a majú minimálny
klinický význam. Absolútna biologická dostupnosť hydrochlorotiazidu po perorálnom podaní je
60-80%.
Distribúcia: Zdanlivý distribučný objem je 4-8 l/kg. Cirkulujúci hydrochlorotiazid sa viaže na sérové bielkoviny (40-70%), hlavne na sérový albumín. Hydrochlorotiazid sa tiež akumuluje v erytrocytoch v hladine približne 1,8-krát vyššej ako v plazme.
Biotransformácia: Hydrochlorotiazid sa eliminuje ako nezmenené liečivo.
Eliminácia: Viac ako 95% absorbovanej dávky sa vylúči ako nezmenená látka močom. Obličkový klírens sa skladá z pasívnej filtrácie a aktívnej sekrécie do renálneho tubulu. Terminálny polčas je
6-15 hodín.
Osobitné populácie
Pediatrickí pacienti (vo veku menej ako 18 rokov)
Nie sú dostupné farmakokinetické údaje u pediatrickej populácie.
Starší pacienti (vo veku 65 rokov alebo viac)
Čas do dosiahnutia maximálnych plazmatických koncentrácií amlodipínu je podobný u mladých a starších pacientov. U starších pacientov klírens amlodipínu má tendenciu klesať, čo spôsobuje zväčšenie plochy pod krivkou (AUC) a predĺženie polčasu eliminácie. Priemerná systémová AUC valsartanu je o 70% vyššia u starších ako u mladých ľudí, preto je pri zvyšovaní dávkovania potrebná opatrnosť.
Systémová expozícia valsartanu je mierne zvýšená u starších pacientov v porovnaní s mladšími, ale nepreukázalo sa, že by to bolo klinicky významné.
Obmedzené údaje naznačujú, že systémový klírens hydrochlorotiazidu je znížený u zdravých aj hypertenzných starších osôb v porovnaní s mladými zdravými dobrovoľníkmi.
Keďže tieto tri zložky tolerujú rovnako dobre mladší aj starší pacienti, odporúčajú sa normálne dávkovacie režimy (pozri časť 4.2).
Poškodenie funkcie obličiek
Farmakokinetiku amlodipínu poškodenie funkcie obličiek významne neovplyvňuje. Podľa očakávania pri zlúčenine, ktorej renálny klírens predstavuje iba 30% celkového plazmatického klírensu, sa nepozorovala žiadna korelácia medzi funkciou obličiek a systémovou expozíciou valsartanu.
Pacienti s ľahkým až stredne ťažkým poškodením funkcie obličiek môžu preto dostať obvyklú začiatočnú dávku (pozri časti 4.2 a 4.4).
Poškodenie funkcie pečene
Pacienti s insuficienciou pečene majú znížený klírens amlodipínu, čo má za následok zväčšenie AUC približne o 40-60%. V priemere je u pacientov s ľahkým až stredne ťažkým chronickým ochorením pečene expozícia (stanovená hodnotami AUC) valsartanu dvojnásobná v porovnaní so zdravými dobrovoľníkmi (so zodpovedajúcim vekom, pohlavím a telesnou hmotnosťou). U pacientov s ochorením pečene je potrebné postupovať opatrne (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
V rôznych predklinických štúdiách bezpečnosti amplodipínu, valsartanu, hydrochlorotiazidu, valsartanu/hydrochlorotiazidu, amlodipínu/valsartanu a amlodipínu/valsartanu/hydrochlorotiazidu (Dafiro HCT) vykonaných na viacerých živočíšnych druhoch sa nepreukázala systémová ani cieľová orgánová toxicita, ktorá by nepriaznivo ovplyvnila vývoj Dafira HCT pre klinické použitie u ľudí.
Predklinické štúdie bezpečnosti trvajúce do 13 týždňov sa vykonali s amlodipínom/valsartanom/hydrochlorotiazidom na potkanoch. Kombinácia viedla k očakávanému poklesu erytrocytovej masy (erytrocytov, hemoglobínu, hematokritu a retikulocytov), vzostupu močoviny v sére, vzostupu kreatinínu v sére, zvýšeniu draslíka v sére, k juxtaglomerulárnej (JG) hyperplázii v obličke a fokálnym eróziám v žľazovom žalúdku potkanov. Všetky tieto zmeny boli reverzibilné po 4-týždňovom období zotavenia a boli považované za vystupňované farmakologické účinky.
Kombinácia amlodipínu/valsartanu/hydrochlorotiazidu sa netestovala na genotoxicitu alebo karcinogenitu, pretože nebol žiaden dôkaz o akejkoľvek interakcii medzi týmito látkami, ktoré sú už dlhý čas na trhu. Amlodipín, valsartan a hydrochlorotiazid však boli samostatne testované na genotoxicitu a karcinogenitu s negatívnymi výsledkami.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety Mikrokryštalická celulóza Krospovidón
Koloidný bezvodý oxid kremičitý
Magnéziumstearát
Obal tablety Hypromelóza Makrogol 4000
Mastenec
Oxid titaničitý (E171) Žltý oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30°C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC blistre. Jeden blister obsahuje 7, 10 alebo 14 filmom obalených tabliet. Veľkosti balenia: 14, 28, 30, 56, 90, 98 alebo 280 filmom obalených tabliet.
Spoločné balenia obsahujúce 280 tabliet, tvorené 20 škatuľkami, z ktorých každá obsahuje 14 tabliet.
PVC/PVDC perforované blistre s jednotlivými dávkami na použitie v nemocniciach: Veľkosti balenia: 56, 98 alebo 280 filmom obalených tabliet.
Spoločné balenia obsahujúce 280 tabliet, tvorené 4 škatuľkami, z ktorých každá obsahuje 70 tabliet. Nie všetky veľkosti balenia alebo liekové sily musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Novartis Europharm Limited
Wimblehurst Road
Horsham
West Sussex, RH12 5AB Veľká Británia
8. REGISTRAČNÉ ČÍSLA
9. DÁTUM PRVEJ REGISTRÁCIE / PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
1. NÁZOV LIEKU
Dafiro HCT 10 mg/160 mg/25 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá filmom obalená tableta obsahuje 10 mg amlodipínu (ako amlodipíniumbesilátu), 160 mg valsartanu a 25 mg hydrochlorotiazidu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta (tableta)
Hnedožlté oválne bikonvexné tablety so skoseným okrajom, s vyrazeným označením „NVR” na jednej strane a „VHL” na druhej strane.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba esenciálnej hypertenzie, ako náhradná liečba u dospelých pacientov, ktorých krvný tlak je primerane znížený kombináciou amlodipínu, valsartanu a hydrochlorotiazidu (HCT), ktoré sa užívajú buď ako tri jednozložkové lieky, alebo ako dvojzložkový a jednozložkový liek.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Odporúčané dávkovanie lieku Dafiro HCT je jedna tableta denne, ktorá sa má užívať podľa možnosti ráno.
Skôr ako pacienti prejdú na liečbu Dafirom HCT, majú mať stav upravený stabilnými dávkami jednotlivých zložiek užívaných v rovnakom čase. Dávka Dafira HCT má byť založená na dávkach jednotlivých zložiek kombinácie v čase zmeny liečby.
Maximálna odporúčaná dávka Dafira HCT je 10 mg/320 mg/25 mg. Osobitné populácie
Poškodenie funkcie obličiek
Pre hydrochlorotiazidovú zložku je Dafiro HCT kontraindikované u pacientov s ťažkým poškodením funkcie obličiek (klírens kreatinínu <30 ml/min) (pozri časti 4.3 a 5.2). U pacientov s miernym až stredne ťažkým poškodením funkcie obličiek nie je potrebná úprava dávkovania. U pacientov so stredne ťažkým poškodením funkcie obličiek sa odporúča monitorovanie hladín draslíka a kreatinínu.
Poškodenie funkcie pečene
Pre hydrochlorotiazidovú a valsartanovú zložku je Dafiro HCT kontraindikované u pacientov so závažným poškodením funkcie pečene (pozri časť 4.3). U pacientov s miernym až stredne ťažkým poškodením funkcie pečene bez cholestázy je maximálna odporúčaná dávka valsartanu 80 mg, preto nie je Dafiro HCT vhodné pre túto skupinu pacientov (pozri časti 4.3, 4.4 a 5.2).
Srdcové zlyhávanie a ischemická choroba srdca
U pacientov so srdcovým zlyhávaním a ischemickou chorobou srdca sú obmedzené skúsenosti
s použitím Dafira HCT, najmä s maximálnou dávkou. Opatrnosť je potrebná u pacientov so srdcovým
zlyhávaním a ischemickou chorobou srdca, zvlášť pri maximálnej dávke Dafira HCT
10 mg/320 mg/25 mg.
Starší pacienti (vo veku 65 rokov alebo viac)
Opatrnosť vrátane častejšieho monitorovania krvného tlaku sa odporúča u starších pacientov, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
Pediatrická populácia
Použitie Dafira HCT u pediatrickej populácie (pacienti vo veku menej ako 18 rokov) v indikácii esenciálna hypertenzia nie je relevantné.
Spôsob podávania
Dafiro HCT možno užívať s jedlom alebo bez jedla. Tablety sa majú prehĺtať celé s trochou vody, v rovnakom dennom čase, podľa možnosti ráno.
4.3 Kontraindikácie
− Precitlivenosť na liečivá, na iné sulfonamidy, na dihydropyridínové deriváty alebo na ktorúkoľvek z pomocných látok.
− Druhý a tretí trimester gravidity (pozri časti 4.4 a 4.6).
− Poškodenie funkcie pečene, biliárna cirhóza alebo cholestáza.
− Ťažké zhoršenie funkcie obličiek (GFR <30 ml/min/1,73 m2), anúria a dialyzovaní pacienti.
− Refraktérna hypokaliémia, hyponatriémia, hyperkalciémia a symptomatická hyperurikémia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pacienti s depléciou sodíka a/alebo objemu
Výrazná hypotenzia vrátane ortostatickej hypotenzie sa pozorovala u 1,7% pacientov pri liečbe maximálnou dávkou Dafira HCT (10 mg/320 mg/25 mg) v porovnaní s 1,8% pacientov pri valsartane/hydrochlorotiazide (320 mg/25 mg), 0,4% pacientov pri amlodipíne/valsartane
(10 mg/320 mg) a 0,2% pacientov pri hydrochlorotiazide/amplodipíne (25 mg/10 mg)
v kontrolovanom klinickom skúšaní u pacientov so stredne ťažkou až ťažkou nekomplikovanou hypertenziou. U pacientov s aktivovaným systémom renín-angiotenzín (ako sú pacienti s depléciou objemu a/alebo soli liečení vysokými dávkami diuretík), ktorí dostávajú antagonisty receptorov angiotenzínu II (AIIRA), sa môže vyskytnúť symptomatická hypotenzia. Odporúča sa úprava tohto stavu pred podaním Dafira HCT alebo starostlivý lekársky dohľad na začiatku liečby.
Ak pri užívaní Dafira HCT vznikne výrazná hypotenzia, pacienta je potrebné uložiť na chrbát a v prípade potreby podať intravenóznu infúziu fyziologického roztoku. V liečbe možno pokračovať po stabilizovaní krvného tlaku.
Zmeny elektrolytov v sére
Amlodipín/valsartan/hydrochlorotiazid
V kontrolovanom klinickom skúšaní Dafira HCT sa protichodné účinky valsartanu 320 mg a hydrochlorotiazidu 25 mg na draslík v sére u mnohých pacientov približne vyvážili. U iných pacientov môže prevládať jeden alebo druhý účinok. Pravidelné stanovovanie elektrolytov v sére sa má vykonávať v primeraných intervaloch, aby sa zistila možná elektrolytová nerovnováha.
Pravidelné stanovovanie sérových elektrolytov a najmä draslíka sa má robiť vo vhodných intervaloch, aby sa zistila prípadná nerovnováha elektrolytov, zvlášť u pacientov s inými rizikovými faktormi, napr. pri poškodení funkcie obličiek, podávaní iných liekov alebo pri nerovnováhe elektrolytov
v anamnéze.
Valsartan
Súčasné použitie s doplnkami draslíka, diuretikami šetriacimi draslík, náhradami solí obsahujúcimi draslík alebo inými liekmi, ktoré môžu hladinu draslíka zvyšovať (heparín atď.), sa neodporúča. Podľa potreby sa má monitorovať hladina draslíka.
Hydrochlorotiazid
Pri liečbe tiazidovými diuretikami vrátane hydrochlorotiazidu sa zaznamenala hypokaliémia.
Liečba tiazidovými diuretikami vrátane hydrochlorotiazidu sa spája s hyponatriémiou a hypochloremickou alkalózou. Tiazidy vrátane hydrochlorotiazidu zvyšujú vylučovanie horčíka močom, čo môže spôsobiť hypomagneziémiu. Tiazidové diuretiká znižujú vylučovanie vápnika. Môže to spôsobiť hyperkalciémiu.
Poškodenie funkcie obličiek
U pacientov s miernym až stredne ťažkým poškodením funkcie obličiek (GFR >30 ml/min/1,73 m2) nie je potrebná úprava dávkovania Dafira HCT. Pri používaní Dafira HCT u pacientov s poškodením funkcie obličiek sa odporúča pravidelné monitorovanie draslíka, kreatinínu a kyseliny močovej v sére.
Stenóza renálnej artérie
Nie sú dostupné údaje o používaní Dafira HCT u pacientov s unilaterálnou alebo bilaterálnou stenózou renálnej artérie alebo stenózou artérie pri solitérnej obličke.
Transplantácia obličky
Zatiaľ nie sú skúsenosti s bezpečným použitím Dafira HCT u pacientov, ktorí sa nedávno podrobili transplantácii obličky.
Poškodenie funkcie pečene
Valsartan sa eliminuje prevažne nezmenený žlčou, zatiaľ čo amlodipín sa extenzívne metabolizuje v pečeni. U pacientov s ľahkým až stredne ťažkým poškodením funkcie pečene bez cholestázy je maximálna odporúčaná dávka valsartanu 80 mg, preto Dafiro HCT nie je vhodné pre túto skupinu pacientov (pozri časti 4.2, 4.3 a 5.2).
Zlyhávanie srdca a ischemická choroba srdca
U citlivých osôb možno v dôsledku inhibície systému renín-angiotenzín-aldosterón predpokladať zmeny funkcie obličiek. U pacientov s ťažkým zlyhávaním srdca, u ktorých funkcia obličiek môže závisieť od aktivity systému renín-angiotenzín-aldosterón, sa liečba inhibítormi enzýmu konvertujúceho angiotenzín (ACE) a antagonistami receptorov angiotenzínu spájala s oligúriou a/alebo progredujúcou azotémiou a (zriedka) s akútnym zlyhaním obličiek a/alebo úmrtím. Podobné následky boli hlásené pri valsartane.
V dlhodobom placebom kontrolovanom klinickom skúšaní (PRAISE-2) amlodipínu u pacientov so zlyhávaním srdca triedy III a IV podľa NYHA (New York Heart Association Classification) neischemickej etiológie sa amlodipín spájal so zvýšeným počtom hlásení pľúcneho edému napriek tomu, že v porovnaní s placebom nebol významný rozdiel v incidencii zhoršenia zlyhávania srdca.
Opatrnosť je potrebná u pacientov so srdcovým zlyhávaním a ischemickou chorobou srdca, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
Stenóza aortálnej a mitrálnej chlopne, obštrukčná hypertrofická kardiomyopatia
Tak ako pri všetkých ostatných vazodilatanciách, osobitná opatrnosť sa vyžaduje u pacientov s aortálnou alebo mitrálnou stenózou alebo obštrukčnou hypertrofickou kardiomyopatiou.
Gravidita
Liečba antagonistami receptorov angiotenzínu II (AIIRA) sa nemá začať počas gravidity. Ak sa nepretržitá liečba AIIRA nepovažuje za nevyhnutnú, pacientky plánujúce graviditu je potrebné previesť na alternatívnu antihypertenzívnu liečbu, ktorá má potvrdený bezpečnostný profil pri použití
počas gravidity. Keď sa potvrdí gravidita, liečba AIIRA sa má okamžite ukončiť a ak je to potrebné, má sa začať alternatívna liečba (pozri časti 4.3 a 4.6).
Primárny hyperaldosteronizmus
Pacienti s primárnym hyperaldosteronizmom nemajú byť liečení antagonistom angiotenzínu II valsartanom, pretože ich systém renín-angiotenzín nie je aktivovaný. Preto sa Dafiro HCT u tejto populácie neodporúča.
Systémový lupus erythematosus
Tiazidové diuretiká vrátane hydrochlorotiazidu spôsobujú podľa hlásení exacerbáciu alebo aktiváciu systémového lupus erythematosus.
Iné metabolické poruchy
Tiazidové diuretiká vrátane hydrochlorotiazidu môžu zmeniť glukózovú toleranciu a zvýšiť hladiny cholesterolu, triacylglycerolov a kyseliny močovej v sére. U pacientov s diabetes môže byť potrebné upraviť dávkovanie inzulínu alebo perorálnych antidiabetík.
Tiazidy môžu znižovať vylučovanie vápnika močom a spôsobovať prechodné a mierne zvýšenie hladín vápnika v sére, aj keď nie sú prítomné známe poruchy metabolizmu vápnika. Výrazná hyperkalciémia môže svedčiť o skrytom hyperparatyreoidizme. Tiazidy sa majú vysadiť ešte pred vykonaním testov funkcie prištítnych teliesok.
Fotosenzitivita
Pri tiazidových diuretikách boli hlásené prípady reakcií z fotosenzitivity (pozri časť 4.8). Ak sa počas liečby Dafirom HCT vyskytne reakcia z fotosenzitivity, odporúča sa liečbu ukončiť. Ak sa opätovné podanie diuretika považuje za potrebné, odporúča sa chrániť oblasti vystavené slnečnému žiareniu alebo umelému UVA.
Všeobecné upozornenia
Opatrnosť je potrebná u pacientov, u ktorých sa v minulosti preukázala precitlivenosť na iné antagonisty receptorov angiotenzínu II. Reakcie z precitlivenosti na hydrochlorotiazid sú pravdepodobnejšie u pacientov s alergiou a astmou.
Starší pacienti (vo veku 65 rokov alebo viac)
Opatrnosť vrátane častejšieho monitorovania krvného tlaku sa odporúča u starších pacientov, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
4.5 Liekové a iné interakcie
Formálne štúdie interakcií Dafira HCT s inými liekmi sa nevykonali. Preto sa v tejto časti uvádzajú len informácie o interakciách s inými liekmi, ktoré sú známe pre jednotlivé liečivá.
Je však dôležité vziať do úvahy, že Dafiro HCT môže zvyšovať hypotenzívny účinok iných antihypertenzív.
Súbežné používanie sa neodporúča
Jednotlivá
z
ložka
 Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi
Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi
Valsartan a
HCT
Lítium Počas súčasného podávania inhibítorov ACE a tiazidov, napr. hydrochlorotiazidu, sa zaznamenalo reverzibilné zvýšenie sérových koncentrácií a toxicity lítia. Napriek nedostatočným skúsenostiam so súčasným podávaním valsartanu a lítia sa táto kombinácia neodporúča. Ak sa ukáže, že je potrebná, odporúča sa starostlivo monitorovať
hladiny lítia v sére (pozri časť 4.4).
Valsartan Diuretiká šetriace kálium, doplnky draslíka, náhrady soli obsahujúce draslík

a iné látky, ktoré môžu zvyšovať hladiny draslíka
Ak sa za potrebnú považuje kombinácia valsartanu s liekom, ktorý ovplyvňuje hladiny draslíka, odporúča sa časté monitorovanie plazmatických hladín draslíka.
Opatrnosť
potrebná pri súčasnom užívaní
Jednotlivá
 z
ložka Dafira HCT
z
ložka Dafira HCT Amlodipín
Známe interakcie snasledujúcimi látkamiInhibítory CYP3A4 (napr. ketokonazol, itrakonazol, ritonavir)
Účinok interakcie s inými liekmiKlinické skúšanie so staršími pacientmi ukázalo, že diltiazem inhibuje metabolizmus amlodipínu, pravdepodobne prostredníctvom CYP3A4 (plazmatická koncentrácia sa zvyšuje približne o 50% a účinok amlodipínu je zvýšený). Nedá sa vylúčiť možnosť, že účinnejšie inhibítory CYP3A4 (t.j. ketokonazol, itrakonazol, ritonavir) môžu zvýšiť plazmatickú
koncentráciu amlodipínu vo väčšej miere než diltiazem.

Valsartan a
HCT
Induktory CYP3A4 (antikonvulzíva [napr. karbamazepín, fenobarbital, fenytoín, fosfenytoín, primidón], rifampicín,
Hypericum perforatum [ľubovník bodkovaný])
Nesteroidné antiflogistiká (NSAID) vrátane selektívnych inhibítorov COX-2, acetylsalicylovej kyseliny (>3 g/deň) a neselektívnych NSAIDSúčasné podávanie môže viesť k zníženiu plazmatických koncentrácií amlodipínu. Vyžaduje sa klinické monitorovanie s možnou úpravou dávkovania amlodipínu počas liečby induktorom a po jeho vysadení.

NSAID môžu oslabiť antihypertenzívny účinok antagonistov angiotenzínu II aj hydrochlorotiazidu, keď sa podávajú súčasne. Okrem toho súbežné užívanie Dafira HCT a NSAID môže mať za následok zhoršenie funkcie obličiek a zvýšenie draslíka v sére. Preto sa odporúča monitorovanie funkcie obličiek na začiatku liečby, ako aj náležitá hydratácia pacienta.
HCT
Lieky ovplyvňované poruchami draslíka v séreAlkohol, anestetiká aPravidelné monitorovanie sérového draslíka a EKG sa odporúča pri súčasnom podávaní lieku obsahujúceho hydrochlorotiazid s látkami, ktoré sú ovplyvňované poruchami draslíka v sére (napr. digitálisové glykozidy, antiarytmiká) a s nasledujúcimi látkami, ktoré vyvolávajú torsades de pointes (patria k nim niektoré antiarytmiká), pričom hypokaliémia je predisponujúcim faktorom pre
torsades de pointes.- Antiarytmiká triedy Ia (napr. chinidín, hydrochinidín, dizopyramid)
- Antiarytmiká triedy III (napr. amiodarón, sotalol, dofetilid, ibutilid)
- Niektoré antipsychotiká (napr. tioridazín, chlórpromazín, levomepromazín, trifluoperazín, cyamemazín, sulpirid, sultoprid, amisulprid, tiaprid, pimozid, haloperidol, droperidol, metadón)

- Iné (napr. bepridil, cisaprid, difemanil, erytromycín i.v., halofantrín, ketanserín, mizolastín, pentamidín, moxifloxacín, terfenadín, vinkamín i.v.)
Môže sa vyskytnúť potenciovanie ortostatickej
sedatíva
hypotenzie.
Amantadín Tiazidy vrátane hydrochlorotiazidu môžu zvyšovať riziko
nežiaducich reakcií spôsobených amantadínom.
Anticholínergiká (napr. atropín, biperidén)
Biologická dostupnosť diuretík tiazidového typu sa môže zvýšiť anticholínergikami (napr. atropínom, biperidénom), zjavne pre zníženie gastrointestinálnej motility a rýchlosti
vyprázdňovania žalúdka.
Antidiabetiká (napr. inzulín a perorálne antidiabetiká)
Môže byť potrebné znovu upraviť dávkovanie inzulínu a perorálnych antidiabetík.
− Metformín Metformín sa má používať opatrne vzhľadom na riziko laktátovej acidózy vyvolanej možným funkčným zlyhaním
obličiek pripisovaným hydrochlorotiazidu.
Betablokátory a diazoxid
Súčasné užívanie tiazidových diuretík vrátane hydrochlorotiazidu s betablokátormi môže zvýšiť riziko hyperglykémie. Tiazidové diuretiká vrátane hydrochlorotiazidu môžu zosilniť hyperglykemizujúci
účinok diazoxidu.
Karbamazepín U pacientov, ktorí dostávajú hydrochlorotiazid súčasne
s karbamazepínom, môže vzniknúť hyponatriémia. Takých pacientov je preto potrebné informovať o možnosti hyponatriemických reakcií a je potrebné ich náležite
sledovať.
Cholestyramínové a kolestipolové živice
Absorpcia tiazidových diuretík vrátane hydrochlorotiazidu je znížená cholestyramínom a inými aniónovými
iónomeničovými živicami.
 Cyklosporín
Cyklosporín Súčasná liečba cyklosporínom môže zvýšiť riziko hyperurikémie a komplikácií typu dny.
Cytotoxické látky (napr.
cyklofosfamid, metotrexát)
Tiazidy vrátane hydrochlorotiazidu môžu znižovať
vylučovanie cytotoxických látok obličkami (napr. cyklofosfamidu, metotrexátu) a potenciovať ich
 myelosupresívne účinky.
myelosupresívne účinky.
 Digitálisové glykozidy
Digitálisové glykozidy Hypokaliémia alebo hypomagneziémia vyvolané tiazidmi sa môžu vyskytnúť ako neželané účinky napomáhajúce
vzniku srdcových arytmií vyvolaných digitálisom.
Kontrastné látky obsahujúce jód
V prípade dehydratácie vyvolanej diuretikami je zvýšené riziko akútneho zlyhania obličiek, najmä pri vysokých dávkach jódovaných látok. Pacienti majú byť pred
podaním rehydratovaní.
Liečivá ovplyvňujúce draslík (kaliuretické diuretiká, kortikosteroidy, laxatíva, ACTH, amfotericín, karbenoxolón, penicilín G, deriváty kyseliny
Hypokaliemický účinok hydrochlorotiazidu môžu zvýšiť kaliuretické diuretiká, kortikosteroidy, laxatíva, adrenokortikotropný hormón (ACTH), amfotericín, karbenoxolón, penicilín G a deriváty kyseliny salicylovej. Ak sa tieto lieky majú predpísať s kombináciou amlodipínu/valsartanu/hydrochlorotiazidu, odporúča sa sledovať hladinu draslíka v plazme.
salicylovej)
Lieky používané na liečbu dny (probenecid, sulfínpyrazón a alopurinol)
Môže byť potrebná úprava dávok urikosurík, pretože hydrochlorotiazid môže zvýšiť hladinu kyseliny močovej
v sére. Môže byť potrebné zvýšiť dávkovanie probenecidu alebo sulfínpyrazónu. Súčasné podávanie tiazidových diuretík vrátane hydrochlorotiazidu môže zvyšovať
incidenciu reakcií z precitlivenosti na alopurinol.
Metyldopa Vyskytli sa ojedinelé hlásenia hemolytickej anémie, ktorá vznikla pri súčasnom použití hydrochlorotiazidu a
metyldopy.

 Nedepolarizujúce relaxanciá kostrového svalstva
Nedepolarizujúce relaxanciá kostrového svalstva (napr. tubokurarín)
Presorické amíny (napr. noradrenalín, adrenalín)
Vitamín D a soli vápnikaTiazidy vrátane hydrochlorotiazidu potenciujú účinok derivátov kurare.
Účinok presorických amínov sa môže znížiť.

Podávanie tiazidových diuretík vrátane hydrochlorotiazidu s vitamínom D alebo soľami vápnika môže potenciovať zvýšenie vápnika v sére.
Žiadne interakcie
Jednotlivá
z
ložka
Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi


Valsartan
Iné(cimetidín, warfarín, furosemid, digoxín, atenolol, indometacín, hydrochlorotiazid, amlodipín, glibenklamid)
Pri monoterapii valsartanom sa nezistili žiadne klinicky významné interakcie s nasledujúcimi liečivami: cimetidín, warfarín, furosemid, digoxín, atenolol, indometacín, hydrochlorotiazid, amlodipín, glibenklamid.
Niektoré z týchto látok môžu interagovať s hydrochlorotiazidovou zložkou Dafira HCT (pozri interakcie súvisiace s HCT).
 4.6 Gravidita a laktácia
Gravidita
Amlodipín
4.6 Gravidita a laktácia
Gravidita
Amlodipín
Údaje o obmedzenom počte gravidít naznačujú, že amlodipín a iné antagonisty kalciových receptorov nemajú nežiaduce účinky na zdravie plodu. Môže však byť riziko predĺženia pôrodu.
ValsartanPoužitie antagonistov receptorov angiotenzínu II (AIIRA) sa neodporúča počas prvého trimestra gravidity (pozri časť 4.4). Použitie AIIRA je kontraindikované počas druhého a tretieho trimestra gravidity (pozri časti 4.3 a 4.4).
Epidemiologické dôkazy týkajúce sa rizika teratogenity po expozícii inhibítorom ACE počas prvého
trimestra gravidity neboli nezvratné; malé zvýšenie rizika však nemožno vylúčiť. Zatiaľ čo nie sú kontrolované epidemiologické údaje o riziku pri antagonistoch receptorov angiotenzínu II (AIIRA), podobné riziká môžu existovať pre túto skupinu liekov. Ak sa nepretržitá liečba AIIRA nepovažuje za nevyhnutnú, pacientky plánujúce graviditu je potrebné previesť na alternatívnu antihypertenzívnu liečbu, ktorá má potvrdený bezpečnostný profil pri použití počas gravidity. Keď sa potvrdí gravidita, liečba AIIRA sa má okamžite ukončiť a ak je to potrebné, má sa začať alternatívna liečba.
Je známe, že expozícia AIIRA pri liečbe počas druhého a tretieho trimestra gravidity vyvoláva u ľudí fetotoxické účinky (poškodenie funkcie obličiek, oligohydramnión, spomalenie osifikácie lebky) a toxické účinky u novorodencov (zlyhanie obličiek, hypotenzia, hyperkaliémia) (pozri časť 5.3).
Ak by došlo k expozícii AIIRA od druhého trimestra gravidity, odporúča sa ultrazvukové vyšetrenie funkcie obličiek a lebky.
Dojčatá, ktorých matky užívali AIIRA, je potrebné dôsledne sledovať pre hypotenziu (pozri časti 4.3
a 4.4).
HydrochlorotiazidS použitím hydrochlorotiazidu počas gravidity, najmä počas prvého trimestra, sú obmedzené skúsenosti. Štúdie na zvieratách sú nedostatočné.
Hydrochlorotiazid prechádza cez placentu. Na základe farmakologického mechanizmu účinku môže použitie hydrochlorotiazidu počas druhého a tretieho trimestra ohroziť fetoplacentárnu perfúziu a môže mať účinky na plod a novorodenca, ako sú žltačka, poruchy rovnováhy elektrolytov
a trombocytopénia a môže sa spájať s inými nežiaducimi reakciami, ktoré sa vyskytli u dospelých.
Amlodipín/valsartan/hydrochlorotiazidNie sú skúsenosti s používaním Dafira HCT u gravidných žien. Na základe existujúcich údajov o jeho zložkách sa použitie Dafira HCT neodporúča počas prvého trimestra a je kontraindikované počas druhého a tretieho trimestra gravidity (pozri časti 4.3 a 4.4).
DojčenieNie sú dostupné informácie o použití valsartanu a/alebo amlodipínu počas dojčenia. Hydrochlorotiazid sa vylučuje do materského mlieka. Preto sa neodporúča použitie Dafira HCT počas dojčenia. Vhodnejšie sú iné druhy liečby s lepšie preukázaným bezpečnostným profilom počas dojčenia, najmä pri dojčení novorodencov alebo predčasne narodených detí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Pri vedení vozidla alebo obsluhe strojov je potrebné vziať do úvahy, že občas sa môžu vyskytnúť závraty alebo únava.
4.8 Nežiaduce účinky
'
Bezpečnostný profil Dafira HCT uvedený nižšie je založený na klinických štúdiách vykonaných s Dafirom HCT a na známom bezpečnostnom profile jeho jednotlivých zložiek amlodipínu, valsartanu a hydrochlorotiazidu.
Informácie o Dafire HCT
Bezpečnosť Dafira HCT sa vyhodnotila pri jeho maximálnej dávke 10 mg/320 mg/25 mg v jednej kontrolovanej krátkodobej (8 týždňov) klinickej štúdii s 2 271 pacientmi, z ktorých 582 dostávalo valsartan v kombinácii s amlodipínom a hydrochlorotiazidom. Nežiaduce reakcie boli spravidla mierne a prechodné a len zriedkavo vyžadovali ukončenie liečby. V tomto klinickom skúšaní kontrolovanom účinným liekom boli najčastejšími dôvodmi na ukončenie liečby Dafirom HCT závraty a hypotenzia (0,7%).
V kontrolovanej klinickej štúdii trvajúcej 8 týždňov sa nepozorovali žiadne významné nové alebo neočakávané nežiaduce reakcie pri liečbe trojkombináciou v porovnaní so známymi účinkami zložiek v monoterapii alebo pri liečbe dvojkombináciou.
V kontrolovanej klinickej štúdii trvajúcej 8 týždňov boli pozorované zmeny laboratórnych parametrov pri kombinácii Dafira HCT len malé a v súlade s farmakologickým mechanizmom účinku látok použitých v monoterapii. Prítomnosť valsartanu v trojkombinácii oslabila hypokaliemický účinok hydrochlorotiazidu.
Nasledujúce nežiaduce reakcie, uvedené podľa triedy orgánových systémov MedDRA a frekvencie, sa týkajú Dafira HCT (amlodipín/valsartan/HCT) a samostatne amlodipínu, valsartanu a HCT.
Veľmi časté: ≥l/10; časté: ≥l/100 až <l/10; menej časté: ≥l/1 000 až <1/100; zriedkavé: ≥1/10 000 až
<1/1 000; veľmi zriedkavé <1/10 000), neznáme (z dostupných údajov).
Trieda
orgánového systému MedDRA
Nežiaduce reakcie
Frekvencia
Dafiro
HCT
Amlodipín Valsartan HCT
Poruchy krvi
a lymfatického systému
Agranulocytóza, útlm kostnej drene
Pokles hemoglobínu a hematokritu
-- -- Veľmi zriedkavé
-- -- Neznáme --
Hemolytická anémia -- -- -- Veľmi zriedkavé
Leukopénia -- Veľmi zriedkavé
-- Veľmi zriedkavé
Neutropénia -- -- Neznáme --

Poruchy imunitného systému
Trombocytopénia -- Veľmi zriedkavé
Precitlivenosť -- Veľmi zriedkavé
Neznáme Zriedkavé
Neznáme Veľmi zriedkavé
Poruchy metabolizmu a
Anorexia Menej časté -- -- -- Hyperkalciémia Menej časté -- -- Zriedkavé
výživy
Hyperglykémia -- Veľmi zriedkavé
-- Zriedkavé
Psychické poruchy
Poruchy nervového
Hyperlipidémia Menej časté -- -- -- Hyperurikémia Menej časté -- -- Menej časté Hypochloremická alkalóza -- -- -- Veľmi
zriedkavé
Hypokaliémia Časté -- -- Časté Hypomagneziémia -- -- -- Menej časté Hyponatriémia Menej časté -- -- Menej časté Depresia -- -- -- Zriedkavé Nespavosť/poruchy spánku Menej časté Menej časté -- Zriedkavé Kolísanie nálady -- Menej časté --
Abnormálna koordinácia Menej časté -- -- -- Závraty Časté Časté -- Zriedkavé
systému
Posturálne závraty, závraty pri námahe
Menej časté -- -- --
Dysgeúzia Menej časté Menej časté -- -- Extrapyramídový syndróm -- Neznáme -- -- Bolesť hlavy Časté Časté -- Zriedkavé
Hypertónia -- Veľmi zriedkavé
-- --
Letargia Menej časté -- -- -- Parestézia Menej časté Menej časté -- Zriedkavé
Periférna neuropatia, neuropatia
Menej časté Veľmi zriedkavé
-- --
Somnolencia Menej časté Časté -- -- Synkopa Menej časté Menej časté -- -- Tremor -- Menej časté -- --
Poruchy oka Porucha videnia Menej časté Menej časté -- Menej časté
Poruchy ucha a
Tinitus -- Menej časté -- --
labyrintu Vertigo Menej časté -- Menej časté --
Poruchy srdca a srdcovej činnosti
Palpitácie -- Časté -- -- Tachykardia Menej časté -- -- --
Arytmia (vrátane bradykardie, komorovej tachykardie a fibrilácie predsiení)
-- Veľmi zriedkavé
-- Zriedkavé
Infarkt myokardu -- Veľmi zriedkavé
-- --
Poruchy ciev
Sčervenanie -- Časté -- -- Hypotenzia Časté Menej časté -- -- Ortostatická hypotenzia Menej časté -- -- Menej časté Flebitída, tromboflebitída Menej časté -- -- --

Vaskulitída -- Veľmi zriedkavé
Neznáme --
Poruchy
dýchacej sústavy,
Kašeľ Menej časté Veľmi zriedkavé
Menej časté --
hrudníka a
Dyspnoe Menej časté Menej časté -- --
mediastína
Respiračná tieseň, pľúcny edém, pneumonitída
-- -- -- Veľmi zriedkavé
Rinitída -- Menej časté -- -- Podráždenie hrdla Menej časté -- -- --
Poruchy gastrointestinál-
Nepríjemné pocity v bruchu, bolesť v hornej časti brucha
Menej časté Časté Menej časté Zriedkavé
neho traktu
Zapáchajúci dych Menej časté -- -- --
Zmena vo vyprázdňovaní
čriev
-- Menej časté -- --
Zápcha -- -- -- Zriedkavé Znížená chuť do jedenia -- -- -- Menej časté Hnačka Menej časté Menej časté -- Zriedkavé Suchosť v ústach Menej časté Menej časté -- -- Dyspepsia Časté Menej časté -- --
Gastritída -- Veľmi zriedkavé
Hyperplázia ďasien -- Veľmi zriedkavé
-- --
-- --
Nauzea Menej časté Časté -- Menej časté
Pankreatitída -- Veľmi zriedkavé
-- Veľmi zriedkavé
Vracanie Menej časté Menej časté -- Menej časté
Poruchy pečene a žlčových ciest
Vzostup hepatálnych enzýmov vrátane zvýšenia bilirubínu v sére
-- Veľmi zriedkavé
Neznáme --
Hepatitída -- Veľmi zriedkavé
-- --
Intrahepatálna cholestáza, ikterus
-- Veľmi zriedkavé
-- Zriedkavé
Poruchy kože a
Alopécia -- Menej časté --
podkožného tkaniva
Angioedém -- Veľmi zriedkavé
Neznáme --
Reakcie podobné kožnému lupus erythematosus, reaktivácia kožného lupus erythematosus
-- -- -- Veľmi zriedkavé
Multiformný erytém -- Veľmi zriedkavé
-- --
Exantém -- Menej časté -- -- Hyperhidróza Menej časté Menej časté -- -- Reakcia z fotosenzitivity* -- -- -- Zriedkavé Pruritus Menej časté Menej časté Neznáme -- Purpura -- Menej časté -- Zriedkavé Exantém -- Menej časté Neznáme Menej časté Zmena farby kože -- Menej časté -- --
Urtikária -- Veľmi zriedkavé
-- Menej časté

Nekrotizujúca vaskulitída a toxická epidermálna nekrolýza
-- -- -- Veľmi zriedkavé
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Artralgia -- Menej časté -- -- Bolesť chrbta Menej časté Menej časté -- -- Opuch kĺbov Menej časté -- -- -- Svalové kŕče Menej časté Menej časté -- -- Svalová slabosť Menej časté -- -- -- Myalgia Menej časté Menej časté Neznáme -- Bolesť končatín Menej časté -- -- -- Zvýšenie kreatinínu v sére Menej časté -- Neznáme -- Porucha močenia Menej časté
Nyktúria -- Menej časté -- -- Polakizúria Časté Menej časté
Akútne zlyhanie obličiek Menej časté -- -- --
Zlyhanie a poškodenie funkcie obličiek
-- -- Neznáme Zriedkavé
Poruchy reprodukčného systému a prsníkov
Celkové poruchy a reakcie v
Erektilná dysfunkcia Menej časté Menej časté -- Menej časté
Gynekomastia Menej časté -- --
Abázia, porucha chôdze Menej časté -- -- -- Asténia Menej časté Menej časté -- --
mieste podania
Nepríjemné pocity, celková nevoľnosť
Menej časté Menej časté -- --
Únava Časté Časté Menej časté --
Nekardiálna bolesť v hrudníku
Menej časté Menej časté -- --
Laboratórne a
Edém Časté Časté -- -- Bolesť -- Menej časté -- -- Zvýšenie lipidov -- Časté
funkčné
vyšetrenia
Zvýšenie močovinového dusíka v krvi
Zvýšenie kyseliny močovej v krvi
Menej časté -- -- -- Menej časté -- --

Glykozúria Zriedkavé Zníženie draslíka v sére Menej časté -- -- -- Zvýšenie draslíka v sére -- -- Neznáme -- Zvýšenie telesnej hmotnosti Menej časté Menej časté -- -- Zníženie telesnej hmotnosti -- Menej časté -- --
* Pozri časť 4.4 Fotosenzitivita
4.9 PredávkovanieSymptómyS predávkovaním Dafira HCT nie sú skúsenosti. Hlavným príznakom predávkovania valsartanu je asi výrazná hypotenzia so závratmi. Predávkovanie amlodipínu môže mať za následok nadmernú periférnu vazodilatáciu a možno reflexnú tachykardiu. Pri amlodipíne bola hlásená výrazná a potenciálne dlhodobá systémová hypotenzia vrátane šoku končiaceho sa smrťou.
LiečbaAmlodipín/valsartan/hydrochlorotiazidKlinicky významná hypotenzia spôsobená predávkovaním Dafira HCT vyžaduje aktívnu kardiovaskulárnu podpornú liečbu, vrátane častého monitorovania funkcie srdca a dýchania, vyvýšenia končatín a sledovania objemu cirkulujúcich tekutín a vylučovania moču. Pri obnovení cievneho tonusu a krvného tlaku môže pomôcť vazokonstrikčná látka za predpokladu, že jej podanie
nie je kontraindikované. Intravenózne podanie kalciumglukonátu môže byť prospešné pri zvrátení účinkov blokády kalciových kanálov.
Amlodipín
Ak k požitiu lieku došlo nedávno, možno zvážiť vyvolanie vracania alebo výplach žalúdka. Ukázalo sa, že podanie aktívneho uhlia zdravým dobrovoľníkom ihneď alebo do dvoch hodín od požitia amlodipínu významne znížilo jeho absorpciu.
Odstránenie amlodipínu hemodialýzou nie je pravdepodobné.
Valsartan
Odstránenie valsartanu hemodialýzou nie je pravdepodobné.
Hydrochlorotiazid
Predávkovanie hydrochlorotiazidom sa spája s depléciou elektrolytov (hypokaliémia, hypochlorémia) a s hypovolémiou, ktoré sú dôsledkom nadmernej diurézy. Najčastejšími príznakmi a prejavmi predávkovania sú nauzea a somnolencia. Hypokaliémia môže mať za následok svalové kŕče a/alebo zvýraznenie arytmie spojenej so súbežným podávaním digitálisových glykozidov alebo niektorých antiarytmík.
Miera odstránenia hydrochlorotiazidu hemodialýzou sa nestanovila.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antagonisty angiotenzínu II, samotné (valsartan), kombinácie s derivátmi dihydropyridínu (amlodipín) a tiazidovými diuretikami (hydrochlorotiazid), ATC kód: C09DX01 valsartan, amlodipín a hydrochlorotiazid.
Dafiro HCT kombinuje tri antihypertenzívne zlúčeniny s komplementárnymi mechanizmami znižovania krvného tlaku u pacientov s esenciálnou hypertenziou: amlodipín patrí do liekovej triedy antagonistov kalcia a valsartan do triedy antagonistov angiotenzínu II a hydrochlorotiazid patrí do triedy tiazidových diuretík. Kombinácia týchto látok má aditívny antihypertenzívny účinok.
Amlodipín/valsartan/hydrochlorotiazid
Dafiro HCT sa skúmalo v dvojito slepej štúdii kontrolovanej účinným liekom u pacientov s hypertenziou. Celkovo 2 271 pacientov so stredne ťažkou až ťažkou hypertenziou (priemerná východisková hodnota systolického/diastolického krvného tlaku bola 170/107) dostávalo liečbu amplodipínom/valsartanom/hydrochlorotiazidom 10 mg/320 mg/25 mg, valsartanom/hydrochlorotiazidom 320 mg/25 mg, amlodipínom/valsartanom 10 mg/320 mg alebo hydrochlorotiazidom/amlodipínom 25 mg/10 mg. Na začiatku štúdie pacienti dostávali nižšie dávky ich liečebnej kombinácie a na plnú terapeutickú dávku boli titrovaní do 2. týždňa.
V 8. týždni bol priemerný pokles systolického/diastolického krvného tlaku 39,7/24,7 mmHg pri Dafire
HCT, 32,0/19,7 mmHg pri valsartane/hydrochlorotiazide, 33,5/21,5 mmHg pri amlodipíne/valsartane a 31,5/19,5 mmHg pri amlodipíne/hydrochlorotiazide. Liečba trojkombináciou bola štatisticky lepšia ako liečba ktoroukoľvek z troch dvojkombinácií vzhľadom na zníženie diastolického a systolického krvného tlaku. Pokles systolického/diastolického krvného tlaku pri Dafire HCT bol o 7,6/5,0 mmHg väčší ako pri valsartane/hydrochlorotiazide, o 6,2/3,3 mmHg väčší ako pri amlodipíne/valsartane a o
8,2/5,3 mmHg väčší ako pri amlodipíne/hydrochlorotiazide. Plný hypotenzívny účinok sa dosiahol po
2 týždňoch užívania ich maximálnej dávky Dafira HCT. U štatisticky vyššieho podielu pacientov sa
dosiahlo zníženie krvného tlaku (<140/90 mmHg) pri Dafire HCT (71%) v porovnaní s liečbou ktoroukoľvek z troch dvojkombinácií (45-54%) (p<0,0001).
V podskupine 283 pacientov zameranej na ambulantné monitorovanie krvného tlaku sa pozoroval klinicky a štatisticky lepší pokles 24-hodinového systolického a diastolického krvného tlaku pri trojkombinácii v porovnaní s valsartanom/hydrochlorotiazidom, valsartanom/amlodipínom a hydrochlorotiazidom/amlodipínom.
Amlodipín
Zložka amlodipínu v Dafire HCT inhibuje transmembránový vstup iónov vápnika do hladkého svalstva srdca a ciev. Mechanizmus antihypertenzívneho pôsobenia amlodipínu je podmienený priamym relaxačným účinkom na hladké svalstvo ciev, čo vyvoláva pokles odporu periférnych ciev a krvného tlaku. Experimentálne údaje naznačujú, že amlodipín sa viaže na dihydropyridínové aj na nedihydropyridínové väzbové miesta. Kontraktilné procesy srdcového svalstva a hladkého svalstva ciev závisia od pohybu extracelulárnych iónov vápnika do týchto buniek cez špecifické iónové kanály.
Po podaní terapeutických dávok pacientom s hypertenziou amlodipín vyvoláva vazodilatáciu, čo vedie k poklesu krvného tlaku u ležiaceho aj stojaceho pacienta. Tento pokles nesprevádza pri chronickom podávaní významná zmena srdcovej frekvencie ani plazmatických hladín katecholamínov.
Plazmatické koncentrácie korelujú s účinkom u mladých aj starších pacientov.
U pacientov s hypertenziou s normálnou funkciou obličiek terapeutické dávky amlodipínu vyvolali zníženie odporu obličkových ciev a zvýšenie rýchlosti glomerulárnej filtrácie a efektívneho prietoku plazmy obličkami, a to bezo zmeny filtrovanej frakcie alebo proteinúrie.
Valsartan
Valsartan je perorálne aktívny, účinný a špecifický antagonista receptorov angiotenzínu II. Účinkuje selektívne na receptor podtypu AT1, ktorý je zodpovedný za známe účinky angiotenzínu II.
Podávanie valsartanu pacientom s hypertenziou vyvoláva pokles krvného tlaku bez ovplyvnenia tepovej frekvencie.
U väčšiny pacientov po podaní jednorazovej perorálnej dávky nastupuje antihypertenzívny účinok
v priebehu 2 hodín a maximálny pokles krvného tlaku sa dosiahne počas 4-6 hodín. Antihypertenzívny účinok pretrváva 24 hodín po podaní. Pri opakovanom podávaní maximálne zníženie krvného tlaku pri akejkoľvek dávke sa spravidla dosiahne v priebehu 2-4 týždňov.
Hydrochlorotiazid
Miesto účinku tiazidových diuretík je primárne v distálnom stočenom tubule obličiek. Ukázalo sa, že v kôre obličiek sa vyskytuje vysokoafinitný receptor ako primárne väzbové miesto pre pôsobenie tiazidových diuretík a inhibíciu transportu NaCl v distálnom stočenom tubule. Tiazidy účinkujú prostredníctvom inhibície symportéra Na+Cl-, možno kompetíciou o miesto Cl-, čím ovplyvňujú mechanizmy reabsorpcie elektrolytov: priamo zvyšujú vylučovanie sodíka a chloridu v približne rovnakom rozsahu, a týmto diuretickým účinkom nepriamo znižujú objem plazmy s následným zvýšením plazmatickej aktivity renínu, sekrécie aldosterónu a strát draslíka močom, aj znížením draslíka v sére.
Európska lieková agentúra netrvá na povinnosti predložiť výsledky štúdií s Dafirom HCT u všetkých podsúborov pediatrickej populácie pri esenciálnej hypertenzii. Informácie o použití u detí pozri v časti
4.2.
5.2 Farmakokinetické vlastnosti
Linearita
Amlodipín, valsartan a hydrochlorotiazid majú lineárnu farmakokinetiku.
Amlodipín/valsartan/hydrochlorotiazid
Po perorálnom podaní Dafira HCT zdravým dospelým osobám sa dosiahnu maximálne plazmatické koncentrácie amlodipínu za 6-8 hodín, valsartanu za 3 hodiny a hydrochlorotiazidu za 2 hodiny.
Rýchlosť a rozsah absorpcie amlodipínu, valsartanu a hydrochlorotiazidu z Dafira HCT sú rovnaké ako pri podávaní v osobitných liekoch.
Amlodipín
Absorpcia: Po perorálnom podaní terapeutických dávok samotného amlodipínu sa jeho maximálne plazmatické koncentrácie dosiahnu v priebehu 6-12 hodín. Absolútna biologická dostupnosť sa vypočítala medzi 64% a 80%. Biologická dostupnosť amlodipínu nie je ovplyvnená požitím jedla.
Distribúcia: Distribučný objem je približne 21 l/kg. V štúdiách s amlodipínom in vitro sa ukázalo, že približne 97,5% cirkulujúceho liečiva sa viaže na bielkoviny plazmy.
Biotransformácia: Amlodipín sa extenzívne (približne 90%) metabolizuje v pečeni na neaktívne metabolity.
Eliminácia: Eliminácia amlodipínu z plazmy je bifázická s terminálnym polčasom eliminácie približne
30 až 50 hodín. Rovnovážne hladiny v plazme sa dosiahnu po kontinuálnom podávaní za 7-8 dní. Močom sa vylúči 10% pôvodného amlodipínu a 60% jeho metabolitov.
Valsartan
Absorpcia: Po perorálnom podaní samotného valsartanu sa jeho maximálne plazmatické koncentrácie dosiahnu za 2-4 hodiny. Priemerná absolútna biologická dostupnosť je 23%. Jedlo znižuje expozíciu valsartanu (stanovené ako AUC) asi o 40% a maximálnu plazmatickú koncentráciu (Cmax) asi o 50%, aj keď asi po 8 hodinách od podania sú koncentrácie valsartanu v plazme podobné v skupinách, ktoré ho užili buď s jedlom, alebo nalačno. Tento pokles AUC však nesprevádza klinicky významné zníženie terapeutického účinku, a preto sa valsartan môže užívať buď s jedlom, alebo bez jedla.
Distribúcia: Rovnovážny distribučný objem valsartanu po intravenóznom podaní je asi 17 litrov, čo naznačuje, že valsartan sa extenzívne nedistribuuje do tkanív. Valsartan sa vo vysokej miere viaže na bielkoviny séra (94-97%), prevažne na sérový albumín.
Biotransformácia: Valsartan sa netransformuje vo veľkom rozsahu, pretože iba asi 20% dávky sa nájde ako metabolity. V plazme bol v nízkych koncentráciách zistený hydroxymetabolit (menej ako
10% AUC valsartanu). Tento metabolit je farmakologicky neaktívny.
Eliminácia: Valsartan sa primárne eliminuje stolicou (asi 83% dávky) a močom (asi 13% dávky), prevažne ako nezmenené liečivo. Po intravenóznom podaní plazmatický klírens valsartanu je asi
2 l/hod a jeho renálny klírens 0,62 l/hod (asi 30% celkového klírensu). Polčas valsartanu je 6 hodín.
Hydrochlorotiazid
Absorpcia:Absorpcia hydrochlorotiazidu po perorálnom podaní je rýchla (tmax približne 2 hodiny). V terapeutickom rozmedzí je vzostup priemernej AUC lineárny a úmerný dávke. Po opakovanom podávaní hydrochlorotiazidu sa kinetika nemení a akumulácia je minimálna, keď sa podáva raz denne. Súčasné podávanie s jedlom podľa hlásení zvyšuje aj znižuje systémovú dostupnosť hydrochlorotiazidu v porovnaní s podávaním nalačno. Tieto účinky sú malé a majú minimálny
klinický význam. Absolútna biologická dostupnosť hydrochlorotiazidu po perorálnom podaní je
60-80%.
Distribúcia: Zdanlivý distribučný objem je 4-8 l/kg. Cirkulujúci hydrochlorotiazid sa viaže na sérové bielkoviny (40-70%), hlavne na sérový albumín. Hydrochlorotiazid sa tiež akumuluje v erytrocytoch v hladine približne 1,8-krát vyššej ako v plazme.
Biotransformácia: Hydrochlorotiazid sa eliminuje ako nezmenené liečivo.
Eliminácia: Viac ako 95% absorbovanej dávky sa vylúči ako nezmenená látka močom. Obličkový klírens sa skladá z pasívnej filtrácie a aktívnej sekrécie do renálneho tubulu. Terminálny polčas je
6-15 hodín.
Osobitné populácie
Pediatrickí pacienti (vo veku menej ako 18 rokov)
Nie sú dostupné farmakokinetické údaje u pediatrickej populácie.
Starší pacienti (vo veku 65 rokov alebo viac)
Čas do dosiahnutia maximálnych plazmatických koncentrácií amlodipínu je podobný u mladých a starších pacientov. U starších pacientov klírens amlodipínu má tendenciu klesať, čo spôsobuje zväčšenie plochy pod krivkou (AUC) a predĺženie polčasu eliminácie. Priemerná systémová AUC valsartanu je o 70% vyššia u starších ako u mladých ľudí, preto je pri zvyšovaní dávkovania potrebná opatrnosť.
Systémová expozícia valsartanu je mierne zvýšená u starších pacientov v porovnaní s mladšími, ale nepreukázalo sa, že by to bolo klinicky významné.
Obmedzené údaje naznačujú, že systémový klírens hydrochlorotiazidu je znížený u zdravých aj hypertenzných starších osôb v porovnaní s mladými zdravými dobrovoľníkmi.
Keďže tieto tri zložky tolerujú rovnako dobre mladší aj starší pacienti, odporúčajú sa normálne dávkovacie režimy (pozri časť 4.2).
Poškodenie funkcie obličiek
Farmakokinetiku amlodipínu poškodenie funkcie obličiek významne neovplyvňuje. Podľa očakávania pri zlúčenine, ktorej renálny klírens predstavuje iba 30% celkového plazmatického klírensu, sa nepozorovala žiadna korelácia medzi funkciou obličiek a systémovou expozíciou valsartanu.
Pacienti s ľahkým až stredne ťažkým poškodením funkcie obličiek môžu preto dostať obvyklú začiatočnú dávku (pozri časti 4.2 a 4.4).
Poškodenie funkcie pečene
Pacienti s insuficienciou pečene majú znížený klírens amlodipínu, čo má za následok zväčšenie AUC približne o 40-60%. V priemere je u pacientov s ľahkým až stredne ťažkým chronickým ochorením pečene expozícia (stanovená hodnotami AUC) valsartanu dvojnásobná v porovnaní so zdravými dobrovoľníkmi (so zodpovedajúcim vekom, pohlavím a telesnou hmotnosťou). U pacientov s ochorením pečene je potrebné postupovať opatrne (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
V rôznych predklinických štúdiách bezpečnosti amplodipínu, valsartanu, hydrochlorotiazidu, valsartanu/hydrochlorotiazidu, amlodipínu/valsartanu a amlodipínu/valsartanu/hydrochlorotiazidu (Dafiro HCT) vykonaných na viacerých živočíšnych druhoch sa nepreukázala systémová ani cieľová orgánová toxicita, ktorá by nepriaznivo ovplyvnila vývoj Dafira HCT pre klinické použitie u ľudí.
Predklinické štúdie bezpečnosti trvajúce do 13 týždňov sa vykonali s amlodipínom/valsartanom/hydrochlorotiazidom na potkanoch. Kombinácia viedla k očakávanému poklesu erytrocytovej masy (erytrocytov, hemoglobínu, hematokritu a retikulocytov), vzostupu močoviny v sére, vzostupu kreatinínu v sére, zvýšeniu draslíka v sére, k juxtaglomerulárnej (JG) hyperplázii v obličke a fokálnym eróziám v žľazovom žalúdku potkanov. Všetky tieto zmeny boli reverzibilné po 4-týždňovom období zotavenia a boli považované za vystupňované farmakologické účinky.
Kombinácia amlodipínu/valsartanu/hydrochlorotiazidu sa netestovala na genotoxicitu alebo karcinogenitu, pretože nebol žiaden dôkaz o akejkoľvek interakcii medzi týmito látkami, ktoré sú už dlhý čas na trhu. Amlodipín, valsartan a hydrochlorotiazid však boli samostatne testované na genotoxicitu a karcinogenitu s negatívnymi výsledkami.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety Mikrokryštalická celulóza Krospovidón
Koloidný bezvodý oxid kremičitý
Magnéziumstearát
Obal tablety Hypromelóza Makrogol 4000
Mastenec
Žltý oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30°C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC blistre. Jeden blister obsahuje 7, 10 alebo 14 filmom obalených tabliet. Veľkosti balenia: 14, 28, 30, 56, 90, 98 alebo 280 filmom obalených tabliet.
Spoločné balenia obsahujúce 280 tabliet, tvorené 20 škatuľkami, z ktorých každá obsahuje 14 tabliet.
PVC/PVDC perforované blistre s jednotlivými dávkami na použitie v nemocniciach: Veľkosti balenia: 56, 98 alebo 280 filmom obalených tabliet.
Spoločné balenia obsahujúce 280 tabliet, tvorené 4 škatuľkami, z ktorých každá obsahuje 70 tabliet. Nie všetky veľkosti balenia alebo liekové sily musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Novartis Europharm Limited
Wimblehurst Road
Horsham
West Sussex, RH12 5AB Veľká Británia
8. REGISTRAČNÉ ČÍSLA
9. DÁTUM PRVEJ REGISTRÁCIE / PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
1. NÁZOV LIEKU
Dafiro HCT 10 mg/320 mg/25 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá filmom obalená tableta obsahuje 10 mg amlodipínu (ako amlodipíniumbesilátu), 320 mg valsartanu a 25 mg hydrochlorotiazidu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta (tableta)
Hnedožlté oválne bikonvexné tablety so skoseným okrajom, s vyrazeným označením „NVR” na jednej strane a „VFL” na druhej strane.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba esenciálnej hypertenzie, ako náhradná liečba u dospelých pacientov, ktorých krvný tlak je primerane znížený kombináciou amlodipínu, valsartanu a hydrochlorotiazidu (HCT), ktoré sa užívajú buď ako tri jednozložkové lieky, alebo ako dvojzložkový a jednozložkový liek.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Odporúčané dávkovanie lieku Dafiro HCT je jedna tableta denne, ktorá sa má užívať podľa možnosti ráno.
Skôr ako pacienti prejdú na liečbu Dafirom HCT, majú mať stav upravený stabilnými dávkami jednotlivých zložiek užívaných v rovnakom čase. Dávka Dafira HCT má byť založená na dávkach jednotlivých zložiek kombinácie v čase zmeny liečby.
Maximálna odporúčaná dávka Dafira HCT je 10 mg/320 mg/25 mg. Osobitné populácie
Poškodenie funkcie obličiek
Pre hydrochlorotiazidovú zložku je Dafiro HCT kontraindikované u pacientov s ťažkým poškodením funkcie obličiek (klírens kreatinínu <30 ml/min) (pozri časti 4.3 a 5.2). U pacientov s miernym až stredne ťažkým poškodením funkcie obličiek nie je potrebná úprava dávkovania. U pacientov so stredne ťažkým poškodením funkcie obličiek sa odporúča monitorovanie hladín draslíka a kreatinínu.
Poškodenie funkcie pečene
Pre hydrochlorotiazidovú a valsartanovú zložku je Dafiro HCT kontraindikované u pacientov so závažným poškodením funkcie pečene (pozri časť 4.3). U pacientov s miernym až stredne ťažkým poškodením funkcie pečene bez cholestázy je maximálna odporúčaná dávka valsartanu 80 mg, preto nie je Dafiro HCT vhodné pre túto skupinu pacientov (pozri časti 4.3, 4.4 a 5.2).
Srdcové zlyhávanie a ischemická choroba srdca
U pacientov so srdcovým zlyhávaním a ischemickou chorobou srdca sú obmedzené skúsenosti
s použitím Dafira HCT, najmä s maximálnou dávkou. Opatrnosť je potrebná u pacientov so srdcovým
zlyhávaním a ischemickou chorobou srdca, zvlášť pri maximálnej dávke Dafira HCT
10 mg/320 mg/25 mg.
Starší pacienti (vo veku 65 rokov alebo viac)
Opatrnosť vrátane častejšieho monitorovania krvného tlaku sa odporúča u starších pacientov, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
Pediatrická populácia
Použitie Dafira HCT u pediatrickej populácie (pacienti vo veku menej ako 18 rokov) v indikácii esenciálna hypertenzia nie je relevantné.
Spôsob podávania
Dafiro HCT možno užívať s jedlom alebo bez jedla. Tablety sa majú prehĺtať celé s trochou vody, v rovnakom dennom čase, podľa možnosti ráno.
4.3 Kontraindikácie
− Precitlivenosť na liečivá, na iné sulfonamidy, na dihydropyridínové deriváty alebo na ktorúkoľvek z pomocných látok.
− Druhý a tretí trimester gravidity (pozri časti 4.4 a 4.6).
− Poškodenie funkcie pečene, biliárna cirhóza alebo cholestáza.
− Ťažké zhoršenie funkcie obličiek (GFR <30 ml/min/1,73 m2), anúria a dialyzovaní pacienti.
− Refraktérna hypokaliémia, hyponatriémia, hyperkalciémia a symptomatická hyperurikémia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Pacienti s depléciou sodíka a/alebo objemu
Výrazná hypotenzia vrátane ortostatickej hypotenzie sa pozorovala u 1,7% pacientov pri liečbe maximálnou dávkou Dafira HCT (10 mg/320 mg/25 mg) v porovnaní s 1,8% pacientov pri valsartane/hydrochlorotiazide (320 mg/25 mg), 0,4% pacientov pri amlodipíne/valsartane
(10 mg/320 mg) a 0,2% pacientov pri hydrochlorotiazide/amplodipíne (25 mg/10 mg)
v kontrolovanom klinickom skúšaní u pacientov so stredne ťažkou až ťažkou nekomplikovanou hypertenziou. U pacientov s aktivovaným systémom renín-angiotenzín (ako sú pacienti s depléciou objemu a/alebo soli liečení vysokými dávkami diuretík), ktorí dostávajú antagonisty receptorov angiotenzínu II (AIIRA), sa môže vyskytnúť symptomatická hypotenzia. Odporúča sa úprava tohto stavu pred podaním Dafira HCT alebo starostlivý lekársky dohľad na začiatku liečby.
Ak pri užívaní Dafira HCT vznikne výrazná hypotenzia, pacienta je potrebné uložiť na chrbát a v prípade potreby podať intravenóznu infúziu fyziologického roztoku. V liečbe možno pokračovať po stabilizovaní krvného tlaku.
Zmeny elektrolytov v sére
Amlodipín/valsartan/hydrochlorotiazid
V kontrolovanom klinickom skúšaní Dafira HCT sa protichodné účinky valsartanu 320 mg a hydrochlorotiazidu 25 mg na draslík v sére u mnohých pacientov približne vyvážili. U iných pacientov môže prevládať jeden alebo druhý účinok. Pravidelné stanovovanie elektrolytov v sére sa má vykonávať v primeraných intervaloch, aby sa zistila možná elektrolytová nerovnováha.
Pravidelné stanovovanie sérových elektrolytov a najmä draslíka sa má robiť vo vhodných intervaloch, aby sa zistila prípadná nerovnováha elektrolytov, zvlášť u pacientov s inými rizikovými faktormi, napr. pri poškodení funkcie obličiek, podávaní iných liekov alebo pri nerovnováhe elektrolytov
v anamnéze.
Valsartan
Súčasné použitie s doplnkami draslíka, diuretikami šetriacimi draslík, náhradami solí obsahujúcimi draslík alebo inými liekmi, ktoré môžu hladinu draslíka zvyšovať (heparín atď.), sa neodporúča. Podľa potreby sa má monitorovať hladina draslíka.
Hydrochlorotiazid
Pri liečbe tiazidovými diuretikami vrátane hydrochlorotiazidu sa zaznamenala hypokaliémia.
Liečba tiazidovými diuretikami vrátane hydrochlorotiazidu sa spája s hyponatriémiou a hypochloremickou alkalózou. Tiazidy vrátane hydrochlorotiazidu zvyšujú vylučovanie horčíka močom, čo môže spôsobiť hypomagneziémiu. Tiazidové diuretiká znižujú vylučovanie vápnika. Môže to spôsobiť hyperkalciémiu.
Poškodenie funkcie obličiek
U pacientov s miernym až stredne ťažkým poškodením funkcie obličiek (GFR >30 ml/min/1,73 m2) nie je potrebná úprava dávkovania Dafira HCT. Pri používaní Dafira HCT u pacientov s poškodením funkcie obličiek sa odporúča pravidelné monitorovanie draslíka, kreatinínu a kyseliny močovej v sére.
Stenóza renálnej artérie
Nie sú dostupné údaje o používaní Dafira HCT u pacientov s unilaterálnou alebo bilaterálnou stenózou renálnej artérie alebo stenózou artérie pri solitérnej obličke.
Transplantácia obličky
Zatiaľ nie sú skúsenosti s bezpečným použitím Dafira HCT u pacientov, ktorí sa nedávno podrobili transplantácii obličky.
Poškodenie funkcie pečene
Valsartan sa eliminuje prevažne nezmenený žlčou, zatiaľ čo amlodipín sa extenzívne metabolizuje v pečeni. U pacientov s ľahkým až stredne ťažkým poškodením funkcie pečene bez cholestázy je maximálna odporúčaná dávka valsartanu 80 mg, preto Dafiro HCT nie je vhodné pre túto skupinu pacientov (pozri časti 4.2, 4.3 a 5.2).
Zlyhávanie srdca a ischemická choroba srdca
U citlivých osôb možno v dôsledku inhibície systému renín-angiotenzín-aldosterón predpokladať zmeny funkcie obličiek. U pacientov s ťažkým zlyhávaním srdca, u ktorých funkcia obličiek môže závisieť od aktivity systému renín-angiotenzín-aldosterón, sa liečba inhibítormi enzýmu konvertujúceho angiotenzín (ACE) a antagonistami receptorov angiotenzínu spájala s oligúriou a/alebo progredujúcou azotémiou a (zriedka) s akútnym zlyhaním obličiek a/alebo úmrtím. Podobné následky boli hlásené pri valsartane.
V dlhodobom placebom kontrolovanom klinickom skúšaní (PRAISE-2) amlodipínu u pacientov so zlyhávaním srdca triedy III a IV podľa NYHA (New York Heart Association Classification) neischemickej etiológie sa amlodipín spájal so zvýšeným počtom hlásení pľúcneho edému napriek tomu, že v porovnaní s placebom nebol významný rozdiel v incidencii zhoršenia zlyhávania srdca.
Opatrnosť je potrebná u pacientov so srdcovým zlyhávaním a ischemickou chorobou srdca, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
Stenóza aortálnej a mitrálnej chlopne, obštrukčná hypertrofická kardiomyopatia
Tak ako pri všetkých ostatných vazodilatanciách, osobitná opatrnosť sa vyžaduje u pacientov s aortálnou alebo mitrálnou stenózou alebo obštrukčnou hypertrofickou kardiomyopatiou.
Gravidita
Liečba antagonistami receptorov angiotenzínu II (AIIRA) sa nemá začať počas gravidity. Ak sa nepretržitá liečba AIIRA nepovažuje za nevyhnutnú, pacientky plánujúce graviditu je potrebné previesť na alternatívnu antihypertenzívnu liečbu, ktorá má potvrdený bezpečnostný profil pri použití
počas gravidity. Keď sa potvrdí gravidita, liečba AIIRA sa má okamžite ukončiť a ak je to potrebné, má sa začať alternatívna liečba (pozri časti 4.3 a 4.6).
Primárny hyperaldosteronizmus
Pacienti s primárnym hyperaldosteronizmom nemajú byť liečení antagonistom angiotenzínu II valsartanom, pretože ich systém renín-angiotenzín nie je aktivovaný. Preto sa Dafiro HCT u tejto populácie neodporúča.
Systémový lupus erythematosus
Tiazidové diuretiká vrátane hydrochlorotiazidu spôsobujú podľa hlásení exacerbáciu alebo aktiváciu systémového lupus erythematosus.
Iné metabolické poruchy
Tiazidové diuretiká vrátane hydrochlorotiazidu môžu zmeniť glukózovú toleranciu a zvýšiť hladiny cholesterolu, triacylglycerolov a kyseliny močovej v sére. U pacientov s diabetes môže byť potrebné upraviť dávkovanie inzulínu alebo perorálnych antidiabetík.
Tiazidy môžu znižovať vylučovanie vápnika močom a spôsobovať prechodné a mierne zvýšenie hladín vápnika v sére, aj keď nie sú prítomné známe poruchy metabolizmu vápnika. Výrazná hyperkalciémia môže svedčiť o skrytom hyperparatyreoidizme. Tiazidy sa majú vysadiť ešte pred vykonaním testov funkcie prištítnych teliesok.
Fotosenzitivita
Pri tiazidových diuretikách boli hlásené prípady reakcií z fotosenzitivity (pozri časť 4.8). Ak sa počas liečby Dafirom HCT vyskytne reakcia z fotosenzitivity, odporúča sa liečbu ukončiť. Ak sa opätovné podanie diuretika považuje za potrebné, odporúča sa chrániť oblasti vystavené slnečnému žiareniu alebo umelému UVA.
Všeobecné upozornenia
Opatrnosť je potrebná u pacientov, u ktorých sa v minulosti preukázala precitlivenosť na iné antagonisty receptorov angiotenzínu II. Reakcie z precitlivenosti na hydrochlorotiazid sú pravdepodobnejšie u pacientov s alergiou a astmou.
Starší pacienti (vo veku 65 rokov alebo viac)
Opatrnosť vrátane častejšieho monitorovania krvného tlaku sa odporúča u starších pacientov, zvlášť pri maximálnej dávke Dafira HCT 10 mg/320 mg/25 mg, pretože dostupné údaje u tejto populácie pacientov sú obmedzené.
4.5 Liekové a iné interakcie
Formálne štúdie interakcií Dafira HCT s inými liekmi sa nevykonali. Preto sa v tejto časti uvádzajú len informácie o interakciách s inými liekmi, ktoré sú známe pre jednotlivé liečivá.
Je však dôležité vziať do úvahy, že Dafira HCT môže zvyšovať hypotenzívny účinok iných antihypertenzív.
Súbežné používanie sa neodporúča
Jednotlivá
z
ložka
 Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi
Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi
Valsartan a
HCT
Lítium Počas súčasného podávania inhibítorov ACE a tiazidov, napr. hydrochlorotiazidu, sa zaznamenalo reverzibilné zvýšenie sérových koncentrácií a toxicity lítia. Napriek nedostatočným skúsenostiam so súčasným podávaním valsartanu a lítia sa táto kombinácia neodporúča. Ak sa ukáže, že je potrebná, odporúča sa starostlivo monitorovať
hladiny lítia v sére (pozri časť 4.4).
Valsartan Diuretiká šetriace kálium, doplnky draslíka, náhrady soli obsahujúce draslík

a iné látky, ktoré môžu zvyšovať hladiny draslíka
Ak sa za potrebnú považuje kombinácia valsartanu s liekom, ktorý ovplyvňuje hladiny draslíka, odporúča sa časté monitorovanie plazmatických hladín draslíka.
Opatrnosť
potrebná pri súčasnom užívaní
Jednotlivá
 z
ložka Dafira HCT
z
ložka Dafira HCT Amlodipín
Známe interakcie snasledujúcimi látkamiInhibítory CYP3A4 (napr. ketokonazol, itrakonazol, ritonavir)
Účinok interakcie s inými liekmiKlinické skúšanie so staršími pacientmi ukázalo, že diltiazem inhibuje metabolizmus amlodipínu, pravdepodobne prostredníctvom CYP3A4 (plazmatická koncentrácia sa zvyšuje približne o 50% a účinok amlodipínu je zvýšený). Nedá sa vylúčiť možnosť, že účinnejšie inhibítory CYP3A4 (t.j. ketokonazol, itrakonazol, ritonavir) môžu zvýšiť plazmatickú
koncentráciu amlodipínu vo väčšej miere než diltiazem.

Valsartan a
HCT
Induktory CYP3A4 (antikonvulzíva [napr. karbamazepín, fenobarbital, fenytoín, fosfenytoín, primidón], rifampicín,
Hypericum perforatum [ľubovník bodkovaný])
Nesteroidné antiflogistiká (NSAID) vrátane selektívnych inhibítorov COX-2, acetylsalicylovej kyseliny (>3 g/deň) a neselektívnych NSAIDSúčasné podávanie môže viesť k zníženiu plazmatických koncentrácií amlodipínu. Vyžaduje sa klinické monitorovanie s možnou úpravou dávkovania amlodipínu počas liečby induktorom a po jeho vysadení.

NSAID môžu oslabiť antihypertenzívny účinok antagonistov angiotenzínu II aj hydrochlorotiazidu, keď sa podávajú súčasne. Okrem toho súbežné užívanie Dafira HCT a NSAID môže mať za následok zhoršenie funkcie obličiek a zvýšenie draslíka v sére. Preto sa odporúča monitorovanie funkcie obličiek na začiatku liečby, ako aj náležitá hydratácia pacienta.
HCT
Lieky ovplyvňované poruchami draslíka v séreAlkohol, anestetiká aPravidelné monitorovanie sérového draslíka a EKG sa odporúča pri súčasnom podávaní lieku obsahujúceho hydrochlorotiazid s látkami, ktoré sú ovplyvňované poruchami draslíka v sére (napr. digitálisové glykozidy, antiarytmiká) a s nasledujúcimi látkami, ktoré vyvolávajú torsades de pointes (patria k nim niektoré antiarytmiká), pričom hypokaliémia je predisponujúcim faktorom pre
torsades de pointes.- Antiarytmiká triedy Ia (napr. chinidín, hydrochinidín, dizopyramid)
- Antiarytmiká triedy III (napr. amiodarón, sotalol, dofetilid, ibutilid)
- Niektoré antipsychotiká (napr. tioridazín, chlórpromazín, levomepromazín, trifluoperazín, cyamemazín, sulpirid, sultoprid, amisulprid, tiaprid, pimozid, haloperidol, droperidol, metadón)

- Iné (napr. bepridil, cisaprid, difemanil, erytromycín i.v., halofantrín, ketanserín, mizolastín, pentamidín, moxifloxacín, terfenadín, vinkamín i.v.)
Môže sa vyskytnúť potenciovanie ortostatickej
sedatíva
hypotenzie.
Amantadín Tiazidy vrátane hydrochlorotiazidu môžu zvyšovať riziko
nežiaducich reakcií spôsobených amantadínom.
Anticholínergiká (napr. atropín, biperidén)
Biologická dostupnosť diuretík tiazidového typu sa môže zvýšiť anticholínergikami (napr. atropínom, biperidénom), zjavne pre zníženie gastrointestinálnej motility a rýchlosti
vyprázdňovania žalúdka.
Antidiabetiká (napr. inzulín a perorálne antidiabetiká)
Môže byť potrebné znovu upraviť dávkovanie inzulínu a perorálnych antidiabetík.
− Metformín Metformín sa má používať opatrne vzhľadom na riziko laktátovej acidózy vyvolanej možným funkčným zlyhaním
obličiek pripisovaným hydrochlorotiazidu.
Betablokátory a diazoxid
Súčasné užívanie tiazidových diuretík vrátane hydrochlorotiazidu s betablokátormi môže zvýšiť riziko hyperglykémie. Tiazidové diuretiká vrátane hydrochlorotiazidu môžu zosilniť hyperglykemizujúci
účinok diazoxidu.
Karbamazepín U pacientov, ktorí dostávajú hydrochlorotiazid súčasne
s karbamazepínom, môže vzniknúť hyponatriémia. Takých pacientov je preto potrebné informovať o možnosti hyponatriemických reakcií a je potrebné ich náležite
sledovať.
Cholestyramínové a kolestipolové živice
Absorpcia tiazidových diuretík vrátane hydrochlorotiazidu je znížená cholestyramínom a inými aniónovými
iónomeničovými živicami.
 Cyklosporín
Cyklosporín Súčasná liečba cyklosporínom môže zvýšiť riziko hyperurikémie a komplikácií typu dny.
Cytotoxické látky (napr.
cyklofosfamid, metotrexát)
Tiazidy vrátane hydrochlorotiazidu môžu znižovať
vylučovanie cytotoxických látok obličkami (napr. cyklofosfamidu, metotrexátu) a potenciovať ich
 myelosupresívne účinky.
myelosupresívne účinky.
 Digitálisové glykozidy
Digitálisové glykozidy Hypokaliémia alebo hypomagneziémia vyvolané tiazidmi sa môžu vyskytnúť ako neželané účinky napomáhajúce
vzniku srdcových arytmií vyvolaných digitálisom.
Kontrastné látky obsahujúce jód
V prípade dehydratácie vyvolanej diuretikami je zvýšené riziko akútneho zlyhania obličiek, najmä pri vysokých dávkach jódovaných látok. Pacienti majú byť pred
podaním rehydratovaní.
Liečivá ovplyvňujúce draslík (kaliuretické diuretiká, kortikosteroidy, laxatíva, ACTH, amfotericín, karbenoxolón, penicilín G, deriváty kyseliny
Hypokaliemický účinok hydrochlorotiazidu môžu zvýšiť kaliuretické diuretiká, kortikosteroidy, laxatíva, adrenokortikotropný hormón (ACTH), amfotericín, karbenoxolón, penicilín G a deriváty kyseliny salicylovej. Ak sa tieto lieky majú predpísať s kombináciou amlodipínu/valsartanu/hydrochlorotiazidu, odporúča sa sledovať hladinu draslíka v plazme.
salicylovej)
Lieky používané na liečbu dny (probenecid, sulfínpyrazón a alopurinol)
Môže byť potrebná úprava dávok urikosurík, pretože hydrochlorotiazid môže zvýšiť hladinu kyseliny močovej
v sére. Môže byť potrebné zvýšiť dávkovanie probenecidu alebo sulfínpyrazónu. Súčasné podávanie tiazidových diuretík vrátane hydrochlorotiazidu môže zvyšovať
incidenciu reakcií z precitlivenosti na alopurinol.
Metyldopa Vyskytli sa ojedinelé hlásenia hemolytickej anémie, ktorá vznikla pri súčasnom použití hydrochlorotiazidu a
metyldopy.

 Nedepolarizujúce relaxanciá kostrového svalstva
Nedepolarizujúce relaxanciá kostrového svalstva (napr. tubokurarín)
Presorické amíny (napr. noradrenalín, adrenalín)
Vitamín D a soli vápnikaTiazidy vrátane hydrochlorotiazidu potenciujú účinok derivátov kurare.
Účinok presorických amínov sa môže znížiť.

Podávanie tiazidových diuretík vrátane hydrochlorotiazidu s vitamínom D alebo soľami vápnika môže potenciovať zvýšenie vápnika v sére.
Žiadne interakcie
Jednotlivá
z
ložka
Dafira HCT
Z
náme interakcie s
nasledujúcimi látkami
Účinok interakcie s inými liekmi


Valsartan
Iné(cimetidín, warfarín, furosemid, digoxín, atenolol, indometacín, hydrochlorotiazid, amlodipín, glibenklamid)
Pri monoterapii valsartanom sa nezistili žiadne klinicky významné interakcie s nasledujúcimi liečivami: cimetidín, warfarín, furosemid, digoxín, atenolol, indometacín, hydrochlorotiazid, amlodipín, glibenklamid.
Niektoré z týchto látok môžu interagovať s hydrochlorotiazidovou zložkou Dafira HCT (pozri interakcie súvisiace s HCT).
 4.6 Gravidita a laktácia
Gravidita
Amlodipín
4.6 Gravidita a laktácia
Gravidita
Amlodipín
Údaje o obmedzenom počte gravidít naznačujú, že amlodipín a iné antagonisty kalciových receptorov nemajú nežiaduce účinky na zdravie plodu. Môže však byť riziko predĺženia pôrodu.
ValsartanPoužitie antagonistov receptorov angiotenzínu II (AIIRA) sa neodporúča počas prvého trimestra gravidity (pozri časť 4.4). Použitie AIIRA je kontraindikované počas druhého a tretieho trimestra gravidity (pozri časti 4.3 a 4.4).
Epidemiologické dôkazy týkajúce sa rizika teratogenity po expozícii inhibítorom ACE počas prvého
trimestra gravidity neboli nezvratné; malé zvýšenie rizika však nemožno vylúčiť. Zatiaľ čo nie sú kontrolované epidemiologické údaje o riziku pri antagonistoch receptorov angiotenzínu II (AIIRA), podobné riziká môžu existovať pre túto skupinu liekov. Ak sa nepretržitá liečba AIIRA nepovažuje za nevyhnutnú, pacientky plánujúce graviditu je potrebné previesť na alternatívnu antihypertenzívnu liečbu, ktorá má potvrdený bezpečnostný profil pri použití počas gravidity. Keď sa potvrdí gravidita, liečba AIIRA sa má okamžite ukončiť a ak je to potrebné, má sa začať alternatívna liečba.
Je známe, že expozícia AIIRA pri liečbe počas druhého a tretieho trimestra gravidity vyvoláva u ľudí fetotoxické účinky (poškodenie funkcie obličiek, oligohydramnión, spomalenie osifikácie lebky) a toxické účinky u novorodencov (zlyhanie obličiek, hypotenzia, hyperkaliémia) (pozri časť 5.3).
Ak by došlo k expozícii AIIRA od druhého trimestra gravidity, odporúča sa ultrazvukové vyšetrenie funkcie obličiek a lebky.
Dojčatá, ktorých matky užívali AIIRA, je potrebné dôsledne sledovať pre hypotenziu (pozri časti 4.3
a 4.4).
HydrochlorotiazidS použitím hydrochlorotiazidu počas gravidity, najmä počas prvého trimestra, sú obmedzené skúsenosti. Štúdie na zvieratách sú nedostatočné.
Hydrochlorotiazid prechádza cez placentu. Na základe farmakologického mechanizmu účinku môže použitie hydrochlorotiazidu počas druhého a tretieho trimestra ohroziť fetoplacentárnu perfúziu a môže mať účinky na plod a novorodenca, ako sú žltačka, poruchy rovnováhy elektrolytov
a trombocytopénia a môže sa spájať s inými nežiaducimi reakciami, ktoré sa vyskytli u dospelých.
Amlodipín/valsartan/hydrochlorotiazidNie sú skúsenosti s používaním Dafira HCT u gravidných žien. Na základe existujúcich údajov o jeho zložkách sa použitie Dafira HCT neodporúča počas prvého trimestra a je kontraindikované počas druhého a tretieho trimestra gravidity (pozri časti 4.3 a 4.4).
DojčenieNie sú dostupné informácie o použití valsartanu a/alebo amlodipínu počas dojčenia. Hydrochlorotiazid sa vylučuje do materského mlieka. Preto sa neodporúča použitie Dafira HCT počas dojčenia. Vhodnejšie sú iné druhy liečby s lepšie preukázaným bezpečnostným profilom počas dojčenia, najmä pri dojčení novorodencov alebo predčasne narodených detí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Pri vedení vozidla alebo obsluhe strojov je potrebné vziať do úvahy, že občas sa môžu vyskytnúť závraty alebo únava.
4.8 Nežiaduce účinky
Bezpečnostný profil Dafira HCT uvedený nižšie je založený na klinických štúdiách vykonaných s Dafirom HCT a na známom bezpečnostnom profile jeho jednotlivých zložiek amlodipínu, valsartanu a hydrochlorotiazidu.
Informácie o Dafire HCT
Bezpečnosť Dafira HCT sa vyhodnotila pri jeho maximálnej dávke 10 mg/320 mg/25 mg v jednej kontrolovanej krátkodobej (8 týždňov) klinickej štúdii s 2 271 pacientmi, z ktorých 582 dostávalo valsartan v kombinácii s amlodipínom a hydrochlorotiazidom. Nežiaduce reakcie boli spravidla mierne a prechodné a len zriedkavo vyžadovali ukončenie liečby. V tomto klinickom skúšaní kontrolovanom účinným liekom boli najčastejšími dôvodmi na ukončenie liečby Dafirom HCT závraty a hypotenzia (0,7%).
V kontrolovanej klinickej štúdii trvajúcej 8 týždňov sa nepozorovali žiadne významné nové alebo neočakávané nežiaduce reakcie pri liečbe trojkombináciou v porovnaní so známymi účinkami zložiek v monoterapii alebo pri liečbe dvojkombináciou.
V kontrolovanej klinickej štúdii trvajúcej 8 týždňov boli pozorované zmeny laboratórnych parametrov pri kombinácii Dafira HCT len malé a v súlade s farmakologickým mechanizmom účinku látok použitých v monoterapii. Prítomnosť valsartanu v trojkombinácii oslabila hypokaliemický účinok hydrochlorotiazidu.
Nasledujúce nežiaduce reakcie, uvedené podľa triedy orgánových systémov MedDRA a frekvencie, sa týkajú Dafira HCT (amlodipín/valsartan/HCT) a samostatne amlodipínu, valsartanu a HCT.
Veľmi časté: ≥l/10; časté: ≥l/100 až <l/10; menej časté: ≥l/1 000 až <1/100; zriedkavé: ≥1/10 000 až
<1/1 000; veľmi zriedkavé <1/10 000), neznáme (z dostupných údajov).
Trieda
orgánového systému MedDRA
Nežiaduce reakcie
Frekvencia
Dafiro
HCT
Amlodipín Valsartan HCT
Poruchy krvi
a lymfatického systému
Agranulocytóza, útlm kostnej drene
Pokles hemoglobínu a hematokritu
-- -- Veľmi zriedkavé
-- -- Neznáme --
Hemolytická anémia -- -- -- Veľmi zriedkavé
Leukopénia -- Veľmi zriedkavé
-- Veľmi zriedkavé
Neutropénia -- -- Neznáme --

Poruchy imunitného systému
Trombocytopénia -- Veľmi zriedkavé
Precitlivenosť -- Veľmi zriedkavé
Neznáme Zriedkavé
Neznáme Veľmi zriedkavé
Poruchy metabolizmu a
Anorexia Menej časté -- -- -- Hyperkalciémia Menej časté -- -- Zriedkavé
výživy
Hyperglykémia -- Veľmi zriedkavé
-- Zriedkavé
Psychické poruchy
Poruchy nervového
Hyperlipidémia Menej časté -- -- -- Hyperurikémia Menej časté -- -- Menej časté Hypochloremická alkalóza -- -- -- Veľmi
zriedkavé
Hypokaliémia Časté -- -- Časté Hypomagneziémia -- -- -- Menej časté Hyponatriémia Menej časté -- -- Menej časté Depresia -- -- -- Zriedkavé Nespavosť/poruchy spánku Menej časté Menej časté -- Zriedkavé Kolísanie nálady -- Menej časté --
Abnormálna koordinácia Menej časté -- -- -- Závraty Časté Časté -- Zriedkavé
systému
Posturálne závraty, závraty pri námahe
Menej časté -- -- --
Dysgeúzia Menej časté Menej časté -- -- Extrapyramídový syndróm -- Neznáme -- -- Bolesť hlavy Časté Časté -- Zriedkavé
Hypertónia -- Veľmi zriedkavé
-- --
Letargia Menej časté -- -- -- Parestézia Menej časté Menej časté -- Zriedkavé
Periférna neuropatia, neuropatia
Menej časté Veľmi zriedkavé
-- --
Somnolencia Menej časté Časté -- -- Synkopa Menej časté Menej časté -- -- Tremor -- Menej časté -- --
Poruchy oka Porucha videnia Menej časté Menej časté -- Menej časté
Poruchy ucha a
Tinitus -- Menej časté -- --
labyrintu Vertigo Menej časté -- Menej časté --
Poruchy srdca a srdcovej činnosti
Palpitácie -- Časté -- -- Tachykardia Menej časté -- -- --
Arytmia (vrátane bradykardie, komorovej tachykardie a fibrilácie predsiení)
-- Veľmi zriedkavé
-- Zriedkavé
Infarkt myokardu -- Veľmi zriedkavé
-- --
Poruchy ciev
Sčervenanie -- Časté -- -- Hypotenzia Časté Menej časté -- -- Ortostatická hypotenzia Menej časté -- -- Menej časté Flebitída, tromboflebitída Menej časté -- -- --

Vaskulitída -- Veľmi zriedkavé
Neznáme --
Poruchy
dýchacej sústavy,
Kašeľ Menej časté Veľmi zriedkavé
Menej časté --
hrudníka a
Dyspnoe Menej časté Menej časté -- --
mediastína
Respiračná tieseň, pľúcny edém, pneumonitída
-- -- -- Veľmi zriedkavé
Rinitída -- Menej časté -- -- Podráždenie hrdla Menej časté -- -- --
Poruchy gastrointestinál-
Nepríjemné pocity v bruchu, bolesť v hornej časti brucha
Menej časté Časté Menej časté Zriedkavé
neho traktu
Zapáchajúci dych Menej časté -- -- --
Zmena vo vyprázdňovaní
čriev
-- Menej časté -- --
Zápcha -- -- -- Zriedkavé Znížená chuť do jedenia -- -- -- Menej časté Hnačka Menej časté Menej časté -- Zriedkavé Suchosť v ústach Menej časté Menej časté -- -- Dyspepsia Časté Menej časté -- --
Gastritída -- Veľmi zriedkavé
Hyperplázia ďasien -- Veľmi zriedkavé
-- --
-- --
Nauzea Menej časté Časté -- Menej časté
Pankreatitída -- Veľmi zriedkavé
-- Veľmi zriedkavé
Vracanie Menej časté Menej časté -- Menej časté
Poruchy pečene a žlčových ciest
Vzostup hepatálnych enzýmov vrátane zvýšenia bilirubínu v sére
-- Veľmi zriedkavé
Neznáme --
Hepatitída -- Veľmi zriedkavé
-- --
Intrahepatálna cholestáza, ikterus
-- Veľmi zriedkavé
-- Zriedkavé
Poruchy kože a
Alopécia -- Menej časté --
podkožného tkaniva
Angioedém -- Veľmi zriedkavé
Neznáme --
Reakcie podobné kožnému lupus erythematosus, reaktivácia kožného lupus erythematosus
-- -- -- Veľmi zriedkavé
Multiformný erytém -- Veľmi zriedkavé
-- --
Exantém -- Menej časté -- -- Hyperhidróza Menej časté Menej časté -- -- Reakcia z fotosenzitivity* -- -- -- Zriedkavé Pruritus Menej časté Menej časté Neznáme -- Purpura -- Menej časté -- Zriedkavé Exantém -- Menej časté Neznáme Menej časté Zmena farby kože -- Menej časté -- --
Urtikária -- Veľmi zriedkavé
-- Menej časté

Nekrotizujúca vaskulitída a toxická epidermálna nekrolýza
-- -- -- Veľmi zriedkavé
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Artralgia -- Menej časté -- -- Bolesť chrbta Menej časté Menej časté -- -- Opuch kĺbov Menej časté -- -- -- Svalové kŕče Menej časté Menej časté -- -- Svalová slabosť Menej časté -- -- -- Myalgia Menej časté Menej časté Neznáme -- Bolesť končatín Menej časté -- -- -- Zvýšenie kreatinínu v sére Menej časté -- Neznáme -- Porucha močenia Menej časté
Nyktúria -- Menej časté -- -- Polakizúria Časté Menej časté
Akútne zlyhanie obličiek Menej časté -- -- --
Zlyhanie a poškodenie funkcie obličiek
-- -- Neznáme Zriedkavé
Poruchy reprodukčného systému a prsníkov
Celkové poruchy a reakcie v
Erektilná dysfunkcia Menej časté Menej časté -- Menej časté
Gynekomastia Menej časté -- --
Abázia, porucha chôdze Menej časté -- -- -- Asténia Menej časté Menej časté -- --
mieste podania
Nepríjemné pocity, celková nevoľnosť
Menej časté Menej časté -- --
Únava Časté Časté Menej časté --
Nekardiálna bolesť v hrudníku
Menej časté Menej časté -- --
Laboratórne a
Edém Časté Časté -- -- Bolesť -- Menej časté -- -- Zvýšenie lipidov -- Časté
funkčné
vyšetrenia
Zvýšenie močovinového dusíka v krvi
Zvýšenie kyseliny močovej v krvi
Menej časté -- -- -- Menej časté -- --

Glykozúria Zriedkavé Zníženie draslíka v sére Menej časté -- -- -- Zvýšenie draslíka v sére -- -- Neznáme -- Zvýšenie telesnej hmotnosti Menej časté Menej časté -- -- Zníženie telesnej hmotnosti -- Menej časté -- --
* Pozri časť 4.4 Fotosenzitivita
4.9 PredávkovanieSymptómyS predávkovaním Dafira HCT nie sú skúsenosti. Hlavným príznakom predávkovania valsartanu je asi výrazná hypotenzia so závratmi. Predávkovanie amlodipínu môže mať za následok nadmernú periférnu vazodilatáciu a možno reflexnú tachykardiu. Pri amlodipíne bola hlásená výrazná a potenciálne dlhodobá systémová hypotenzia vrátane šoku končiaceho sa smrťou.
LiečbaAmlodipín/valsartan/hydrochlorotiazidKlinicky významná hypotenzia spôsobená predávkovaním Dafira HCT vyžaduje aktívnu kardiovaskulárnu podpornú liečbu, vrátane častého monitorovania funkcie srdca a dýchania, vyvýšenia končatín a sledovania objemu cirkulujúcich tekutín a vylučovania moču. Pri obnovení cievneho tonusu a krvného tlaku môže pomôcť vazokonstrikčná látka za predpokladu, že jej podanie
nie je kontraindikované. Intravenózne podanie kalciumglukonátu môže byť prospešné pri zvrátení účinkov blokády kalciových kanálov.
Amlodipín
Ak k požitiu lieku došlo nedávno, možno zvážiť vyvolanie vracania alebo výplach žalúdka. Ukázalo sa, že podanie aktívneho uhlia zdravým dobrovoľníkom ihneď alebo do dvoch hodín od požitia amlodipínu významne znížilo jeho absorpciu.
Odstránenie amlodipínu hemodialýzou nie je pravdepodobné.
Valsartan
Odstránenie valsartanu hemodialýzou nie je pravdepodobné.
Hydrochlorotiazid
Predávkovanie hydrochlorotiazidom sa spája s depléciou elektrolytov (hypokaliémia, hypochlorémia) a s hypovolémiou, ktoré sú dôsledkom nadmernej diurézy. Najčastejšími príznakmi a prejavmi predávkovania sú nauzea a somnolencia. Hypokaliémia môže mať za následok svalové kŕče a/alebo zvýraznenie arytmie spojenej so súbežným podávaním digitálisových glykozidov alebo niektorých antiarytmík.
Miera odstránenia hydrochlorotiazidu hemodialýzou sa nestanovila.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antagonisty angiotenzínu II, samotné (valsartan), kombinácie s derivátmi dihydropyridínu (amlodipín) a tiazidovými diuretikami (hydrochlorotiazid), ATC kód: C09DX01 valsartan, amlodipín a hydrochlorotiazid.
Dafiro HCT kombinuje tri antihypertenzívne zlúčeniny s komplementárnymi mechanizmami znižovania krvného tlaku u pacientov s esenciálnou hypertenziou: amlodipín patrí do liekovej triedy antagonistov kalcia a valsartan do triedy antagonistov angiotenzínu II a hydrochlorotiazid patrí do triedy tiazidových diuretík. Kombinácia týchto látok má aditívny antihypertenzívny účinok.
Amlodipín/valsartan/hydrochlorotiazid
Dafiro HCT sa skúmalo v dvojito slepej štúdii kontrolovanej účinným liekom u pacientov s hypertenziou. Celkovo 2 271 pacientov so stredne ťažkou až ťažkou hypertenziou (priemerná východisková hodnota systolického/diastolického krvného tlaku bola 170/107) dostávalo liečbu amplodipínom/valsartanom/hydrochlorotiazidom 10 mg/320 mg/25 mg, valsartanom/hydrochlorotiazidom 320 mg/25 mg, amlodipínom/valsartanom 10 mg/320 mg alebo hydrochlorotiazidom/amlodipínom 25 mg/10 mg. Na začiatku štúdie pacienti dostávali nižšie dávky ich liečebnej kombinácie a na plnú terapeutickú dávku boli titrovaní do 2. týždňa.
V 8. týždni bol priemerný pokles systolického/diastolického krvného tlaku 39,7/24,7 mmHg pri Dafire
HCT, 32,0/19,7 mmHg pri valsartane/hydrochlorotiazide, 33,5/21,5 mmHg pri amlodipíne/valsartane a 31,5/19,5 mmHg pri amlodipíne/hydrochlorotiazide. Liečba trojkombináciou bola štatisticky lepšia ako liečba ktoroukoľvek z troch dvojkombinácií vzhľadom na zníženie diastolického a systolického krvného tlaku. Pokles systolického/diastolického krvného tlaku pri Dafire HCT bol o 7,6/5,0 mmHg väčší ako pri valsartane/hydrochlorotiazide, o 6,2/3,3 mmHg väčší ako pri amlodipíne/valsartane a o
8,2/5,3 mmHg väčší ako pri amlodipíne/hydrochlorotiazide. Plný hypotenzívny účinok sa dosiahol po
2 týždňoch užívania ich maximálnej dávky Dafira HCT. U štatisticky vyššieho podielu pacientov sa
dosiahlo zníženie krvného tlaku (<140/90 mmHg) pri Dafire HCT (71%) v porovnaní s liečbou ktoroukoľvek z troch dvojkombinácií (45-54%) (p<0,0001).
V podskupine 283 pacientov zameranej na ambulantné monitorovanie krvného tlaku sa pozoroval klinicky a štatisticky lepší pokles 24-hodinového systolického a diastolického krvného tlaku pri trojkombinácii v porovnaní s valsartanom/hydrochlorotiazidom, valsartanom/amlodipínom a hydrochlorotiazidom/amlodipínom.
Amlodipín
Zložka amlodipínu v Dafire HCT inhibuje transmembránový vstup iónov vápnika do hladkého svalstva srdca a ciev. Mechanizmus antihypertenzívneho pôsobenia amlodipínu je podmienený priamym relaxačným účinkom na hladké svalstvo ciev, čo vyvoláva pokles odporu periférnych ciev a krvného tlaku. Experimentálne údaje naznačujú, že amlodipín sa viaže na dihydropyridínové aj na nedihydropyridínové väzbové miesta. Kontraktilné procesy srdcového svalstva a hladkého svalstva ciev závisia od pohybu extracelulárnych iónov vápnika do týchto buniek cez špecifické iónové kanály.
Po podaní terapeutických dávok pacientom s hypertenziou amlodipín vyvoláva vazodilatáciu, čo vedie k poklesu krvného tlaku u ležiaceho aj stojaceho pacienta. Tento pokles nesprevádza pri chronickom podávaní významná zmena srdcovej frekvencie ani plazmatických hladín katecholamínov.
Plazmatické koncentrácie korelujú s účinkom u mladých aj starších pacientov.
U pacientov s hypertenziou s normálnou funkciou obličiek terapeutické dávky amlodipínu vyvolali zníženie odporu obličkových ciev a zvýšenie rýchlosti glomerulárnej filtrácie a efektívneho prietoku plazmy obličkami, a to bezo zmeny filtrovanej frakcie alebo proteinúrie.
Valsartan
Valsartan je perorálne aktívny, účinný a špecifický antagonista receptorov angiotenzínu II. Účinkuje selektívne na receptor podtypu AT1, ktorý je zodpovedný za známe účinky angiotenzínu II.
Podávanie valsartanu pacientom s hypertenziou vyvoláva pokles krvného tlaku bez ovplyvnenia tepovej frekvencie.
U väčšiny pacientov po podaní jednorazovej perorálnej dávky nastupuje antihypertenzívny účinok
v priebehu 2 hodín a maximálny pokles krvného tlaku sa dosiahne počas 4-6 hodín. Antihypertenzívny účinok pretrváva 24 hodín po podaní. Pri opakovanom podávaní maximálne zníženie krvného tlaku pri akejkoľvek dávke sa spravidla dosiahne v priebehu 2-4 týždňov.
Hydrochlorotiazid
Miesto účinku tiazidových diuretík je primárne v distálnom stočenom tubule obličiek. Ukázalo sa, že v kôre obličiek sa vyskytuje vysokoafinitný receptor ako primárne väzbové miesto pre pôsobenie tiazidových diuretík a inhibíciu transportu NaCl v distálnom stočenom tubule. Tiazidy účinkujú prostredníctvom inhibície symportéra Na+Cl-, možno kompetíciou o miesto Cl-, čím ovplyvňujú mechanizmy reabsorpcie elektrolytov: priamo zvyšujú vylučovanie sodíka a chloridu v približne rovnakom rozsahu, a týmto diuretickým účinkom nepriamo znižujú objem plazmy s následným zvýšením plazmatickej aktivity renínu, sekrécie aldosterónu a strát draslíka močom, aj znížením draslíka v sére.
Európska lieková agentúra netrvá na povinnosti predložiť výsledky štúdií s Dafirom HCT u všetkých podsúborov pediatrickej populácie pri esenciálnej hypertenzii. Informácie o použití u detí pozri v časti
4.2.
5.2 Farmakokinetické vlastnosti
Linearita
Amlodipín, valsartan a hydrochlorotiazid majú lineárnu farmakokinetiku.
Amlodipín/valsartan/hydrochlorotiazid
Po perorálnom podaní Dafira HCT zdravým dospelým osobám sa dosiahnu maximálne plazmatické koncentrácie amlodipínu za 6-8 hodín, valsartanu za 3 hodiny a hydrochlorotiazidu za 2 hodiny.
Rýchlosť a rozsah absorpcie amlodipínu, valsartanu a hydrochlorotiazidu z Dafira HCT sú rovnaké ako pri podávaní v osobitných liekoch.
Amlodipín
Absorpcia: Po perorálnom podaní terapeutických dávok samotného amlodipínu sa jeho maximálne plazmatické koncentrácie dosiahnu v priebehu 6-12 hodín. Absolútna biologická dostupnosť sa vypočítala medzi 64% a 80%. Biologická dostupnosť amlodipínu nie je ovplyvnená požitím jedla.
Distribúcia: Distribučný objem je približne 21 l/kg. V štúdiách s amlodipínom in vitro sa ukázalo, že približne 97,5% cirkulujúceho liečiva sa viaže na bielkoviny plazmy.
Biotransformácia: Amlodipín sa extenzívne (približne 90%) metabolizuje v pečeni na neaktívne metabolity.
Eliminácia: Eliminácia amlodipínu z plazmy je bifázická s terminálnym polčasom eliminácie približne
30 až 50 hodín. Rovnovážne hladiny v plazme sa dosiahnu po kontinuálnom podávaní za 7-8 dní. Močom sa vylúči 10% pôvodného amlodipínu a 60% jeho metabolitov.
Valsartan
Absorpcia: Po perorálnom podaní samotného valsartanu sa jeho maximálne plazmatické koncentrácie dosiahnu za 2-4 hodiny. Priemerná absolútna biologická dostupnosť je 23%. Jedlo znižuje expozíciu valsartanu (stanovené ako AUC) asi o 40% a maximálnu plazmatickú koncentráciu (Cmax) asi o 50%, aj keď asi po 8 hodinách od podania sú koncentrácie valsartanu v plazme podobné v skupinách, ktoré ho užili buď s jedlom, alebo nalačno. Tento pokles AUC však nesprevádza klinicky významné zníženie terapeutického účinku, a preto sa valsartan môže užívať buď s jedlom, alebo bez jedla.
Distribúcia: Rovnovážny distribučný objem valsartanu po intravenóznom podaní je asi 17 litrov, čo naznačuje, že valsartan sa extenzívne nedistribuuje do tkanív. Valsartan sa vo vysokej miere viaže na bielkoviny séra (94-97%), prevažne na sérový albumín.
Biotransformácia: Valsartan sa netransformuje vo veľkom rozsahu, pretože iba asi 20% dávky sa nájde ako metabolity. V plazme bol v nízkych koncentráciách zistený hydroxymetabolit (menej ako
10% AUC valsartanu). Tento metabolit je farmakologicky neaktívny.
Eliminácia: Valsartan sa primárne eliminuje stolicou (asi 83% dávky) a močom (asi 13% dávky), prevažne ako nezmenené liečivo. Po intravenóznom podaní plazmatický klírens valsartanu je asi
2 l/hod a jeho renálny klírens 0,62 l/hod (asi 30% celkového klírensu). Polčas valsartanu je 6 hodín.
Hydrochlorotiazid
Absorpcia:Absorpcia hydrochlorotiazidu po perorálnom podaní je rýchla (tmax približne 2 hodiny). V terapeutickom rozmedzí je vzostup priemernej AUC lineárny a úmerný dávke. Po opakovanom podávaní hydrochlorotiazidu sa kinetika nemení a akumulácia je minimálna, keď sa podáva raz denne. Súčasné podávanie s jedlom podľa hlásení zvyšuje aj znižuje systémovú dostupnosť hydrochlorotiazidu v porovnaní s podávaním nalačno. Tieto účinky sú malé a majú minimálny
klinický význam. Absolútna biologická dostupnosť hydrochlorotiazidu po perorálnom podaní je
60-80%.
Distribúcia: Zdanlivý distribučný objem je 4-8 l/kg. Cirkulujúci hydrochlorotiazid sa viaže na sérové bielkoviny (40-70%), hlavne na sérový albumín. Hydrochlorotiazid sa tiež akumuluje v erytrocytoch v hladine približne 1,8-krát vyššej ako v plazme.
Biotransformácia: Hydrochlorotiazid sa eliminuje ako nezmenené liečivo.
Eliminácia: Viac ako 95% absorbovanej dávky sa vylúči ako nezmenená látka močom. Obličkový klírens sa skladá z pasívnej filtrácie a aktívnej sekrécie do renálneho tubulu. Terminálny polčas je
6-15 hodín.
Osobitné populácie
Pediatrickí pacienti (vo veku menej ako 18 rokov)
Nie sú dostupné farmakokinetické údaje u pediatrickej populácie.
Starší pacienti (vo veku 65 rokov alebo viac)
Čas do dosiahnutia maximálnych plazmatických koncentrácií amlodipínu je podobný u mladých a starších pacientov. U starších pacientov klírens amlodipínu má tendenciu klesať, čo spôsobuje zväčšenie plochy pod krivkou (AUC) a predĺženie polčasu eliminácie. Priemerná systémová AUC valsartanu je o 70% vyššia u starších ako u mladých ľudí, preto je pri zvyšovaní dávkovania potrebná opatrnosť.
Systémová expozícia valsartanu je mierne zvýšená u starších pacientov v porovnaní s mladšími, ale nepreukázalo sa, že by to bolo klinicky významné.
Obmedzené údaje naznačujú, že systémový klírens hydrochlorotiazidu je znížený u zdravých aj hypertenzných starších osôb v porovnaní s mladými zdravými dobrovoľníkmi.
Keďže tieto tri zložky tolerujú rovnako dobre mladší aj starší pacienti, odporúčajú sa normálne dávkovacie režimy (pozri časť 4.2).
Poškodenie funkcie obličiek
Farmakokinetiku amlodipínu poškodenie funkcie obličiek významne neovplyvňuje. Podľa očakávania pri zlúčenine, ktorej renálny klírens predstavuje iba 30% celkového plazmatického klírensu, sa nepozorovala žiadna korelácia medzi funkciou obličiek a systémovou expozíciou valsartanu.
Pacienti s ľahkým až stredne ťažkým poškodením funkcie obličiek môžu preto dostať obvyklú začiatočnú dávku (pozri časti 4.2 a 4.4).
Poškodenie funkcie pečene
Pacienti s insuficienciou pečene majú znížený klírens amlodipínu, čo má za následok zväčšenie AUC približne o 40-60%. V priemere je u pacientov s ľahkým až stredne ťažkým chronickým ochorením pečene expozícia (stanovená hodnotami AUC) valsartanu dvojnásobná v porovnaní so zdravými dobrovoľníkmi (so zodpovedajúcim vekom, pohlavím a telesnou hmotnosťou). U pacientov s ochorením pečene je potrebné postupovať opatrne (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
V rôznych predklinických štúdiách bezpečnosti amplodipínu, valsartanu, hydrochlorotiazidu, valsartanu/hydrochlorotiazidu, amlodipínu/valsartanu a amlodipínu/valsartanu/hydrochlorotiazidu (Dafiro HCT) vykonaných na viacerých živočíšnych druhoch sa nepreukázala systémová ani cieľová orgánová toxicita, ktorá by nepriaznivo ovplyvnila vývoj Dafira HCT pre klinické použitie u ľudí.
Predklinické štúdie bezpečnosti trvajúce do 13 týždňov sa vykonali s amlodipínom/valsartanom/hydrochlorotiazidom na potkanoch. Kombinácia viedla k očakávanému poklesu erytrocytovej masy (erytrocytov, hemoglobínu, hematokritu a retikulocytov), vzostupu močoviny v sére, vzostupu kreatinínu v sére, zvýšeniu draslíka v sére, k juxtaglomerulárnej (JG) hyperplázii v obličke a fokálnym eróziám v žľazovom žalúdku potkanov. Všetky tieto zmeny boli reverzibilné po 4-týždňovom období zotavenia a boli považované za vystupňované farmakologické účinky.
Kombinácia amlodipínu/valsartanu/hydrochlorotiazidu sa netestovala na genotoxicitu alebo karcinogenitu, pretože nebol žiaden dôkaz o akejkoľvek interakcii medzi týmito látkami, ktoré sú už dlhý čas na trhu. Amlodipín, valsartan a hydrochlorotiazid však boli samostatne testované na genotoxicitu a karcinogenitu s negatívnymi výsledkami.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety Mikrokryštalická celulóza Krospovidón
Koloidný bezvodý oxid kremičitý
Magnéziumstearát
Obal tablety Hypromelóza Makrogol 4000
Mastenec
Žltý oxid železitý (E172)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
18 mesiacov
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30°C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC blistre. Jeden blister obsahuje 7, 10 alebo 14 filmom obalených tabliet. Veľkosti balenia: 14, 28, 30, 56, 90, 98 alebo 280 filmom obalených tabliet.
Spoločné balenia obsahujúce 280 tabliet, tvorené 20 škatuľkami, z ktorých každá obsahuje 14 tabliet.
PVC/PVDC perforované blistre s jednotlivými dávkami na použitie v nemocniciach: Veľkosti balenia: 56, 98 alebo 280 filmom obalených tabliet.
Spoločné balenia obsahujúce 280 tabliet, tvorené 4 škatuľkami, z ktorých každá obsahuje 70 tabliet. Nie všetky veľkosti balenia alebo liekové sily musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Novartis Europharm Limited
Wimblehurst Road
Horsham
West Sussex, RH12 5AB Veľká Británia
8. REGISTRAČNÉ ČÍSLA
9. DÁTUM PRVEJ REGISTRÁCIE / PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU