
mnú skríženú reaktivitu s podobnými endogénnymi peptidmi (glukagón alebo GLP-1).
Rýchly úbytok hmotnosti
Počas 30-týždňovej štúdie, približne u 3% (n = 4/148) pacientov liečených exenatidom s predĺženým uvoľňovaním, došlo minimálne v jednom časovom období k rýchlemu úbytku hmotnosti (zaznamenané zníženie hmotnosti medzi dvoma za sebou nasledujúcimi študijnými návštevami bolo väčšie ako 1,5 kg/týždeň).
Zvýšenie srdcovej frekvencie
V súhrnných klinických štúdiách exenatidu s predĺženým uvoľňovaním sa pozorovalo priemerné zvýšenie srdcovej frekvencie (HR) o 2,6 tepov za minútu (bpm) oproti východiskovej hodnote (74 bpm). Pätnásť percent pacientov liečených exenatidom s predĺženým uvoľňovaním malo
priemerné zvýšenie HR ≥10 bpm, približne 5% až 10% jedincov v rámci iných liečebných skupín mali priemerné zvýšenie HR ≥10 bpm.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 Predávkovanie
Príznaky predávkovania exenatidom (vychádzajúce z klinických skúšaní exenatidu s okamžitým uvoľňovaním) zahŕňajú závažnú nevoľnosť, prudké vracanie a rýchly pokles koncentrácie glukózy v krvi. V prípade predávkovania je potrebné začať s vhodnou podpornou liečbou podľa klinických prejavov a príznakov pacienta.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antidiabetiká, analógy GLP (glukagónu podobný peptid)-1-receptora, ATC kód: A10BJ01.
Mechanizmusúčinku
Exenatid je agonista receptorov glukagónu podobného peptidu 1 (GLP-1), ktorý vykazuje viaceré antihyperglykemické účinky glukagónu podobného peptidu 1 (GLP-1). Sekvencia aminokyselín sa prekrýva so sekvenciou ľudského GLP-1. U exenatidu sa dokázala väzba a aktivácia známych
ľudských GLP-1 receptorov in vitro, mechanizmus účinku je sprostredkovaný cyklickým AMP a/alebo ďalšími vnútrobunkovými signálnymi dráhami.
Exenatid zvyšuje sekréciu inzulínu z pankreatických beta-buniek v závislosti od hladiny glukózy. So znižovaním koncentrácie krvnej glukózy klesá i sekrécia inzulínu. Pri podávaní exenatidu
v kombinácii so samotným metformínom a/alebo tiazolidíndiónom sa nepozorovalo žiadne zvýšenie výskytu hypoglykémie v porovnaní s placebom v kombinácii s metformínom a/alebo
tiazolidíndiónom, čo môže byť spôsobené glukózo-dependentným inzulínotropným mechanizmom účinku (pozri časť 4.4).
Exenatid potláča sekréciu glukagónu, o ktorom je známe, že jeho hladina je neprimerane zvýšená
u pacientov s diabetom 2. typu. Nižšie hladiny glukagónu vedú k zníženiu produkcie glukózy v pečeni. Exenatid však neovplyvňuje normálnu reakciu glukagónu ani iné hormonálne reakcie na
hypoglykémiu.
Exenatid spomaľuje vyprázdňovanie žalúdka, čím spomaľuje rýchlosť prechodu glukózy z potravy do krvného obehu.
Dokázalo sa, že podávanie exenatidu znižuje príjem potravy následkom zníženej chuti do jedla a zvýšeného pocitu sýtosti.
Farmakodynamické účinky
Exenatid zlepšuje glykemickú kontrolu prostredníctvom trvalého pôsobenia na zníženie postprandiálnych a hladových koncentrácií glukózy u pacientov s diabetom 2. typu. Na rozdiel od prirodzeného GLP-1, farmakokinetický a farmakodynamický profil exenatidu s predĺženým uvoľňovaním u ľudí je vhodný na podávanie raz týždenne.
Farmakodynamická štúdia u pacientov s diabetom 2. typu (n = 13) dokázala obnovenie prvej fázy sekrécie inzulínu a zlepšenie druhej fázy sekrécie inzulínu ako odpoveď na intravenózny bolus glukózy.
Klinická účinnosť a bezpečnosť
Výsledky dlhodobých klinických štúdií s exenatidom s predĺženým uvoľňovaním sú uvedené nižšie, tieto štúdie zahŕňali 1 356 pacientov liečených exenatidom s predĺženým uvoľňovaním, 52% mužov a 48% žien; 230 pacientov (17%) bolo vo veku ≥65 rokov.
Okrem toho dvojito-zaslepená, placebom kontrolovaná štúdia (EXSCEL) sledujúca kardiovaskulárne výsledky zahŕňala 14 752 jedincov s diabetom 2. typu a akoukoľvek mierou kardiovaskulárneho rizika, keď bol pridaný k bežnej zvyčajnej liečbe.
Glykemickákontrola
V dvoch štúdiách bol exenatid 2 mg s predĺženým uvoľňovaním podávaný raz týždenne porovnávaný s exenatidom 5 µg s okamžitým uvoľňovaním podávaným dvakrát denne počas 4 týždňov
a pokračovalo sa exenatidom 10 µg s okamžitým uvoľňovaním podávaným dvakrát denne. Jedna
štúdia trvala 24 týždňov (n = 252) a druhá 30 týždňov (n = 295) s následným otvoreným predĺženým sledovaním, v ktorom boli všetci pacienti ďalších 7 rokov liečení exenatidom 2 mg s predĺženým uvoľňovaním podávaným raz týždenne (n = 258). V oboch štúdiách došlo v oboch liečebných skupinách k viditeľnému poklesu HbA1c už pri prvom meraní HbA1c od začatia liečby (4. alebo 6. týždeň).
Exenatid s predĺženým uvoľňovaním viedol k štatisticky významnému zníženiu HbA1c v porovnaní s pacientmi, ktorí dostávali exenatid s okamžitým uvoľňovaním (tabuľka 2).
Klinicky významný účinok exenatidu s predĺženým uvoľňovaním a exenatidu s okamžitým uvoľňovaním na HbA1c bol pozorovaný v oboch štúdiách, bez ohľadu na druh základnej antidiabetickej liečby.
Klinicky a štatisticky významne viac pacientov užívajúcich exenatid s predĺženým uvoľňovaním
v porovnaní s exenatidom s okamžitým uvoľňovaním dosiahlo v týchto dvoch štúdiách zníženie HbA1c
≤7% alebo <7% (p <0,05, resp. p ≤0,0001).
Pacienti liečení exenatidom s predĺženým uvoľňovaním aj exenatidom s okamžitým uvoľňovaním dosiahli zníženie hmotnosti v porovnaní s východiskovými hodnotami, hoci rozdiel medzi týmito dvomi liečebnými skupinami nebol významný.
V nekontrolovanom predĺžení štúdie vyhodnocovaní pacienti, ktorí v 30. týždni prešli z exenatidu
s okamžitým uvoľňovaním na exenatid s predĺženým uvoľňovaním (n = 121), dosiahli v 52. týždni
rovnaké zlepšenie HbA1c o -2,0% v porovnaní s východiskovými hodnotami, ako pacienti liečení exenatidom s predĺženým uvoľňovaním.
U všetkých pacientov, ktorí dokončili nekontrolované predĺženie štúdie trvajúce 7 rokov (n = 122
z 258 pacientov zaradených do predĺženej fázy), sa HbA1c postupne od 52. týždňa zvyšovalo, avšak stále bolo nižšie ako východisková hodnota po 7 rokoch (-1,5%). Úbytok na hmotnosti u týchto pacientov pretrvával počas 7 rokov.
Tabuľka 2: Výsledky z dvoch klinických štúdií s exenatidom s predĺženým uvoľňovaním
v porovnaní s exenatidom s okamžitým uvoľňovaním v kombinácii iba s diétou a cvičením, metformínom a/alebo sulfonylmočovinou a metformínom a/alebo tiazolidíndiónom (ITT- pacienti; ITT = intent to treat)
24-týždňová štúdia
Exenatid
s predĺženým uvoľňovaním 2 mg
Exena
t
id
s okamžitým uvoľňovaním
10 µg 2 x denne

n 129 123
Priemerná hodnota HbA1c (%)Východisková hodnota 8,5 8,4
Zmena oproti východiskovej hodnote (± SE) -1,6 (± 0,1)** -0,9 (± 0,1)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,67 (-0,94; -0,39)**
Pacienti (%) dosahujúci hodnotu HbA1c <
7% 58 30
Zmena plazmatickej glukózy nalačno (mmol/l)(± SE) -1,4 (± 0,2) -0,3 (± 0,2)
Priemerná telesná hmotnosť (kg)Východisková hodnota 97 94
Zmena oproti východiskovej hodnote (± SE) -2,3 (± 0,4) -1,4 (± 0,4)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,95 (-1,91; 0,01)
30-týždňová štúdiaN 148 147
Priemerná hodnota HbA1c (%)Východisková hodnota 8,3 8,3
Zmena oproti východiskovej hodnote (± SE) -1,9 (± 0,1)* -1,5 (± 0,1)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,33 (-0,54; -0,12)*
Pacienti (%) dosahujúci hodnotu HbA1c ≤
7% 73 57
Zmena plazmatickej glukózy nalačno (mmol/l)(± SE) -2,3 (± 0,2) -1,4 (± 0,2)
Priemerná telesná hmotnosť (kg)Východisková hodnota 102 102
Zmena oproti východiskovej hodnote (± SE) -3,7 (± 0,5) -3,6 (± 0,5)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,08 (-1,29; 1,12)
SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval), *p <0,05;
**p <0,0001
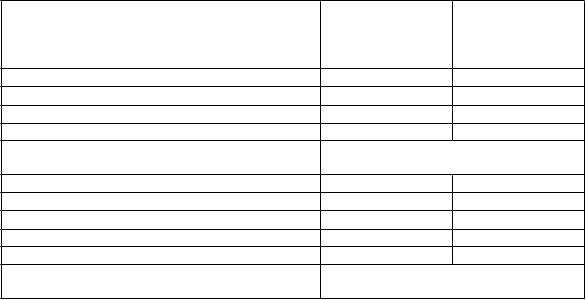
V 26-týždňovej štúdii bol exenatid s predĺženým uvoľňovaním 2 mg porovnávaný s inzulínom-glargín podávaným raz denne. V porovnaní s liečbou inzulínom-glargín, exenatid s predĺženým uvoľňovaním preukázal významnejšiu zmenu v hodnote HbA1c, signifikantne zníženú priemernú telesnú hmotnosť
a spájal sa s menším počtom hypoglykemických príhod (tabuľka 3).
Tabuľk
a 3: Výsledky 26-týždňovéj klinickej štúdie s exenatidom s predĺženým uvoľňovaním
v porovnaní s inzulínom-glargín v kombinácii s metformínom samostatne alebo s metformínom a sulfonylmočovinou (ITT-pacienti)
Exenatid
s predĺženým uvoľňovaním
2 mg
Inzulín-glargín1
n 233 223
Priemerná hodnota HbA1c (%)Východisková hodnota 8,3 8,3
Zmena oproti východiskovej hodnote (± SE) -1,5 (± 0,1)* -1,3 (± 0,1)*
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,16 (-0,29; -0,03)*
Pacienti (%) dosahujúci hodnotu HbA1c ≤
7% 62 54
Zmena glukózy v sére nalačno (mmol/l) (± SE) -2,1 (± 0,2) -2,8 (± 0,2)
Priemerná telesná hmotnosť (kg)Východisková hodnota 91 91
Zmena oproti východiskovej hodnote (± SE) -2,6 (± 0,2) +1,4 (± 0,2)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -4,05 (-4,57; -3,52)*
SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval), *p <0,05
1 Inzulín-glargín bol dávkovaný tak, aby sa dosiahla cieľová koncentrácia glukózy v rozmedzí 4,0 až
5,5 mmol/l (72 až 100 mg/dl).
Priemerná dávka inzulínu-glargín na začiatku liečby bola 10,1 IU/deň a zvýšila sa na 31,1 IU/deň pre pacientov liečených inzulínom-glargín.
Výsledky za 156 týždňov boli konzistentné s tými, ktoré už boli predtým hlásené v 26-týždňovej predbežnej správe. Liečba exenatidom s predĺženým uvoľňovaním trvale významne zlepšovala kontrolu glykémie a kontrolu hmotnosti v porovnaní s liečbou inzulínom-glargín. Údaje týkajúce sa bezpečnosti v 156. týždni sa zhodovali s tými, ktoré sa hlásili v 26. týždni.
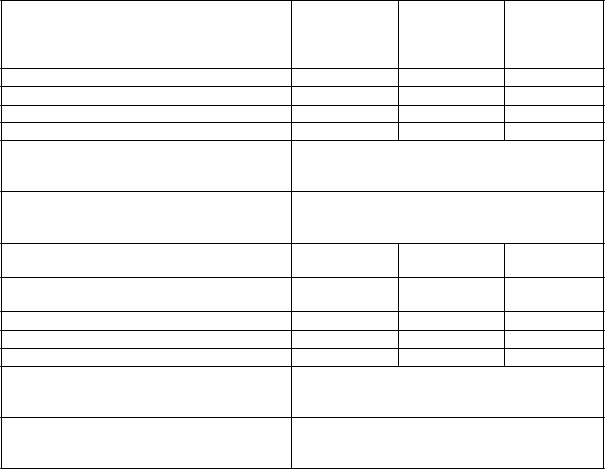
V 26-týždňovej dvojito zaslepenej štúdii sa exenatid s predĺženým uvoľňovaním porovnával
s maximálnymi dennými dávkami sitagliptínu a pioglitazónu u pacientov, ktorí užívali aj metformín. Vo všetkých liečebných skupinách došlo k významnému zníženiu hodnoty HbA1c oproti východiskovej hodnote. Exenatid s predĺženým uvoľňovaním prevažoval sitagliptín a pioglitazón
v účinku na zmenu hodnoty HbA1c vzhľadom na východiskovú hodnotu.
Exenatid s predĺženým uvoľňovaním v porovnaní so sitagliptínom preukázal významne väčšie zníženie hmotnosti. Hmotnosť pacientov liečených pioglitazónom sa zvýšila (tabuľka 4).
Tabuľk
a 4: Výsledky 26-týždňovej štúdie s exenatidom s predĺženým uvoľňovaním v porovnaní so sitagliptínom a pioglitazónom v kombinácii s metformínom (ITT-pacienti)
Exenatid
s predĺženým uvoľňovaním
2 mg
Sitagliptín
100 mg
Pioglitazón
45 mg
n 160 166 165
Priemerná hodnota HbA1c (%)
Východiskové hodnoty 8,6 8,5 8,5
Zmena oproti východiskovej hodnote (± SE) -1,6 (± 0,1)* -0,9 (± 0,1)* -1,2 (± 0,1)*
Priemerný rozdiel oproti východiskovej
h
o
dnote medzi liečbami (95% CI) oproti sitagliptínu
Pri
e
mern
ý rozdiel oproti východiskovej hodnote medzi liečbami (95% CI) oproti pioglitazónu
Pacient
i (%) dosahujúci hodnotu
HbA
1
c
≤
7%
Z
men
a glukózy v sére nalačno (mmol/l) (± SE)
Priemerná telesná hmotnosť (kg)
-0,63 (-0,89; -0,37)**
-0,32 (-0,57; -0,06)*
62 36 49
-1,8 (± 0,2) -0,9 (± 0,2) -1,5 (± 0,2)
Východisková hodnota 89 87 88
Zmena oproti východiskovej hodnote(± SE) -2,3 (± 0,3) -0,8 (± 0,3) +2,8 (± 0,3)
Priemerný rozdiel oproti východiskovej
h
o
dnote medzi liečbami (95% CI) oproti sitagliptínu
Pri
e
mern
ý rozdiel oproti východiskovej hodnote medzi liečbami (95% CI) oproti pioglitazónu
-1,54 (-2,35; -0,72)*
-5,10 (-5,91; -4,28)**
SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval), *p <0,05;
**p <0,0001
V 28-týždňovej dvojito zaslepenej štúdii sa porovnával exenatid s predĺženým uvoľňovaním
v kombinácii s dapagliflozínom so samotným exenatidom s predĺženým uvoľňovaním a samotným dapagliflozínom u pacientov, ktorí užívali aj metformín. Vo všetkých liečebných skupinách došlo
k zníženiu hodnoty HbA1c oproti východiskovej hodnote. V liečebnej skupine s exenatidom
s predĺženým uvoľňovaním a dapagliflozínom sa preukázali významnejšie zníženia hodnôt HbA1c oproti východiskovej hodnote v porovnaní so skupinami s exenatidom s predĺženým uvoľňovaním samotným a samotným dapagliflozínom (tabuľka 5).
Kombinácia exenatidu s predĺženým uvoľňovaním a dapagliflozínu v porovnaní s liečivami samotnými preukázala významne väčšie zníženia hmotnosti (tabuľka 5).
Tabuľka 5: Výsledky jednej 28-týždňovej štúdie s exenatidom s predĺženým uvoľňovaním v kombinácii s dapagliflozínom v porovnaní so samotným exenatidom s predĺženým uvoľňovaním a samotným dapagliflozínom v kombinácii s metformínom (ITT-pacienti)
Exenatid s predĺženým
uvoľňovaní
m 2 mg QW
+
Dapaglifloz
í
n 10 mg QD
Exenatid
s predĺženým uvoľňovaním 2 mg QW
+ Placebo QD
Dapagliflozín
10 mg QD
+
Placebo QW
n 228 227 230
Pri
e
mern
á hodnota HbA
1c
(
%
)
Východisková hodnota 9,3 9,3 9,3
Zmena oproti východiskovej
hodnote (±SE)a -2,0 (± 0,1) -1,6 (± 0,1) -1,4 (± 0,1)
Priemerný rozdiel oproti
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
Pacienti (%) dosahujúci
-0,38*
(-0,63; -0,13)
-0,59**
(-0,84; -0,34)
h
o
dnot
u HbA
1
c <7% 45 27 19
Priemerná zmena oproti východiskovej hodnote
plazmaticke
j glukózy nalačno (mmol/l) (±SE)a
Priemerný rozdiel oproti
-3,7 (± 0,2) -2,5 (± 0,2) -2,7 (± 0,2)
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
Priemerná zmena oproti východiskovej hodnote
-1,12**
(-1,55; -0,68)
-0,92**
(-1,36; -0,49)
plazmaticke
j glukózy 2 hodiny po jedle (mmol/l) (±SE) a
Priemerný rozdiel oproti
-4,9 (± 0,2) -3,3 (± 0,2) -3,4 (± 0,2)
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
Priemerná telesná hmotnosť
(kg)
-1,54**
(-2,10; -0,98)
-1.49**
(-2,04; -0,93)
Východisková hodnota 92 89 91
Zmena oproti východiskovej
hodnote (±SE)a -3,6 (± 0,3) -1,6 (± 0,3) -2,2 (± 0,3)
Priemerný rozdiel oproti
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
-2,00**
(-2,79; -1,20)
-1,33**
(-2,12; -0,55)
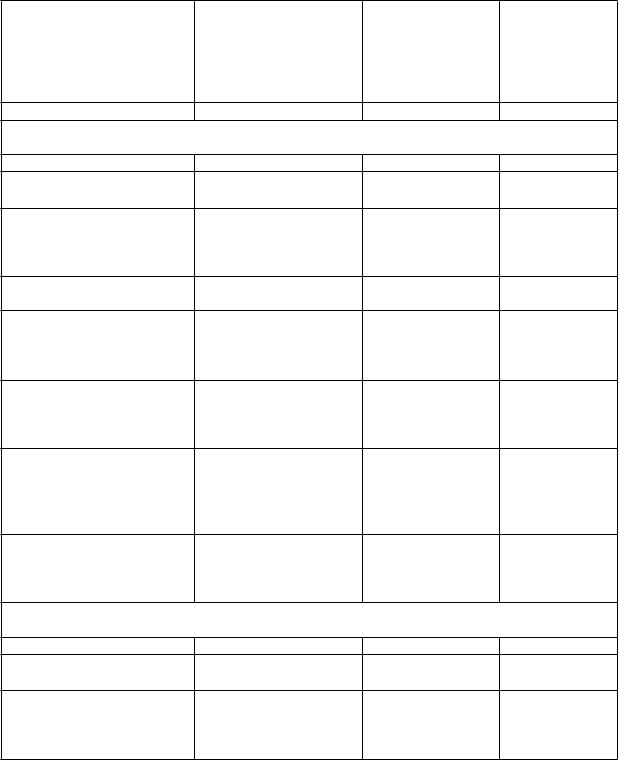
QW = jedenkrát týždenne (once weekly), QD = jedenkrát denne (once daily), SE = štandardná odchýlka (standard error), CI =interval spoľahlivosti (confidence interval), n = počet pacientov (number of patients).
a Upravené priemery najmenších štvorcov (least squares means, LS priemery) a rozdiel(y) liečebnej
skupiny v zmene oproti východiskovým hodnotám v 28. týždni sú modelované použitím zmiešaného modelu s opakovanými meraniami (mixed model with repeated measures, MMRM), ktorý zahŕňa liečbu, región, stratifikáciu podľa východiskovej hladiny HbA1c (<9,0% alebo ≥9,0%), týždeň
a týždeň liečby s interakciami ako fixné faktory a východiskovú hodnotu ako kovariát.
*p <0,01, **p <0,001.
p-hodnoty sú všetky p-hodnoty upravené na multiplicitu.
Analýzy nezahŕňajú merania po podaní záchrannej liečby a po predčasnom prerušení podávania
skúšaného lieku.
V 28-týždňovej dvojito zaslepenej štúdii sa porovnával exenatid s predĺženým uvoľňovaním pridaný buď k samotnému inzulínu-glargín alebo ku kombinácii inzulínu-glargín s metformínom – s placebom pridaným buď k samotnému inzulínu-glargín alebo ku kombinácii inzulínu-glargín s metformínom. Inzulín-glargín bol dávkovaný s cieľom dosiahnuť hladinu plazmatickej glukózy nalačno 4,0 až
5,5 mmol/l (72 až 99 mg/dl). Exenatid s predĺženým uvoľňovaním preukázal superioritu oproti
placebu v znižovaní HbA1c z východiskovej hodnoty do 28. týždňa (tabuľka 6).
Exenatid s predĺženým uvoľňovaním preukázal superioritu oproti placebu v znižovaní telesnej hmotnosti v 28. týždni (tabuľka 6).
Tabuľka 6: Výsledky jednej 28-týždňovej štúdie s exenatidom s predĺženým uvoľňovaním
v porovnaní s placebom v kombinácii buď s inzulínom-glargín samotným alebo inzulínom-
glargín spolu s metformínom (ITT-pacienti)
E
xenati
d s predĺženým
uvoľňovaní
m 2 mg
+ inzulín-glargína
Placebo
+ inzulín-glargína
n 230 228
Priemer HbA1c (%)
Východisková hodnota 8,5 8,5
Zmena oproti východiskovej hodnote (± SE)b -1,0 (±0,1) -0,2 (±0,1)
Priemerný rozdiel medzi liečbami v zmene z východiskovej hodnoty (95% CI)
-0,74*
(-0,94; -0,54)
Pacienti (%), ktorí dosiahli HbA
1
c ≤7%c 33* 7
Priemerná telesná hmotnosť (kg)
Východisková hodnota 94 94
Zmena oproti východiskovej hodnote (± SE)b -1,0 (±0,3) 0,5 (±0,3)
Priemerný rozdiel medzi liečbami v zmene z východiskovej hodnoty (95% CI)
Zmena z východiskovej hodnoty plazmatickej glukózy 2 hodiny po jedle (mmol/l) (± SE)b,d Priemerný rozdiel medzi liečbami v zmene
z východiskovej hodnoty (95% CI)
-1,52*
(-2,19; -0,85)
-1,6 (±0,3) -0,1 (±0,3)
-1,54*
(-2,17; -0,91)
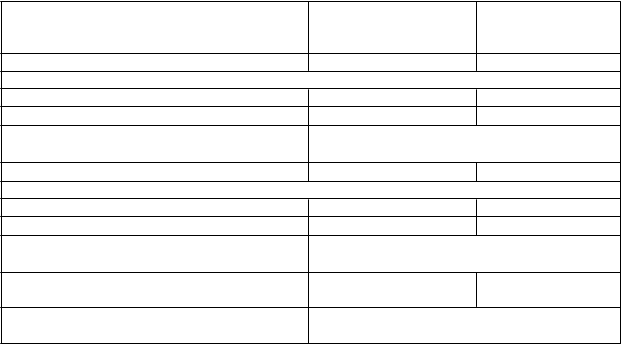
n = počet pacientov v každej liečenej skupine, SE = štandardná odchýlka (standard error),
CI = interval spoľahlivosti (confidence interval), *p-hodnota <0,001 (upravená na multiplicitu).
a. Zmena priemerov najmenších štvorcov (least squares means, LS-priemery) priemernej dennej dávky inzulínu bola 1,6 jednotiek pre skupinu s exenatidom s predĺženým uvoľňovaním a 3,5 jednotiek pre skupinu s placebom.
b. Upravené priemery najmenších štvorcov (least squares means, LS-priemery) a rozdiel(y) liečebnej skupiny v zmene oproti východiskovým hodnotám v 28. týždni sú modelované použitím zmiešaného modelu s opakovanými meraniami (mixed model with repeated measures, MMRM), ktorý zahŕňa liečbu, región, stratifikáciu podľa východiskovej hladiny HbA1c (<9,0% alebo ≥9,0%), stratifikáciu podľa východiskového použitia sulfonylmočoviny (SU) (áno alebo nie), týždeň a týždeň liečby
s interakciami ako fixné faktory a východiskovú hodnotu ako kovariát. Absolútna zmena plazmatickej glukózy 2 hodiny po jedle v 28. týždni je modelovaná podobne použitím ANCOVA.
c. Všetci pacienti s chýbajúcimi údajmi koncových parametrov sú považovaní za nereagujúcich na liečbu.
d. Po štandardnom teste tolerancie jedla.
Analýzy nezahŕňajú merania po podaní záchrannej liečby a po predčasnom prerušení podávania skúšaného lieku.
Kardiovaskulárne hodnotenie
EXSCEL bola pragmatická štúdia sledujúca kardiovaskulárne (KV) výsledky u pacientov s diabetom
2. typu a akoukoľvek mierou KV rizika. Celkovo 14 752 pacientov bolo randomizovaných 1:1 na
2 mg exenatidu s predĺženým uvoľňovaním raz týždenne alebo placebo, pridané k bežnej zvyčajnej liečbe, ktorá môže zahŕňať inhibítory SGLT2. Pacienti boli sledovaní ako v bežnej klinickej praxi po dobu 38,7 mesiacov (medián) s mediánom trvania liečby 27,8 mesiacov. Vitálny status bol známy na konci štúdie u 98,9% pacientov s exenatidom s predĺženým uvoľňovaním a 98,8% pacientov s placebom. Priemerný vek pri vstupe do štúdie bol 62 rokov (8,5% pacientov vo veku ≥75 rokov). Približne 62% pacientov boli muži. Priemerný BMI bol 32,7 kg/m2 a priemerné trvanie diabetu bolo
13,1 rokov. Priemerné HbA1c bolo 8,1%. Približne 49,3% malo miernu poruchu funkcie obličiek (odhadovaná rýchlosť glomerulárnej filtrácie [eGFR] ≥60 až ≤89 ml/min/1,73 m2) a 21,6% malo stredne závažnú poruchu funkcie obličiek (eGFR ≥30 až ≤59 ml/min/1,73 m2). Celkovo 26,9% pacientov nemalo predtým KV príhodu, 73,1% malo predtým minimálne jednu KV príhodu.
Primárny ukazovateľ bezpečnosti (non-inferiorita) a účinnosti (superiorita) v štúdii EXSCEL bol čas do prvej potvrdenej závažnej nežiaducej kardiálnej príhody (MACE, Major Adverse Cardiac Event): úmrtie súvisiace s kardiovaskulárnym ochorením, nefatálny infarkt myokardu (IM) alebo nefatálna mozgová príhoda. Mortalita z akejkoľvek príčiny bola iniciálnym sekundárnym hodnoteným ukazovateľom.
Exenatid s predĺženým uvoľňovaním nezvyšoval kardiovaskulárne riziko u pacientov s diabetes mellitus 2. typu v porovnaní s placebom, keď bol pridaný k bežnej zvyčajnej liečbe (HR: 0,91; 95%
CI: 0,832, 1,004; P<0,001 pre non-inferioritu), pozri obrázok 1. Výsledky primárneho kombinovaného
a sekundárneho kardiovaskulárneho ukazovateľa sú uvedené na obrázku 2.
Obrázok 1: Čas do prvej posudzovanej MACE (pacienti so zámerom liečiť)Exenatid
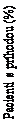
Placebo
Exenatid vs placebo:
HR (95% CI) 0,91 (0,832; 1,004)
Exenatid
Počet pacientov s rizikom
Mesiace od randomizácie
Placebo
HR=pomer rizika, CI=interval spoľahlivosti
Obrázo
k 2: Blobbogram (Forest Plot): Analýza primárneho a sekundárneho ukazovateľa
(pacienti so zámerom liečiť)
AKS=akútny koronárny syndróm, CI=interval spoľahlivosti, KV=kardiovaskulárny, HF=zlyhanie srdca; HR=pomer rizika; MACE=závažná nežiaduca kardiálna príhoda; IM=infarkt myokardu; n=počet pacientov s príhodou; N=počet pacientov v liečenej skupine.
1 HR (aktívny/placebo) a CI na základe Coxovho regresného modelu proporčných rizík, stratifikované podľa KV príhody len s liečebnou skupinou ako vysvetľujúcou premennou.
Potreba ďalšej antihyperglykemickej liečby sa znížila o 33% v skupine s exenatidom s predĺženým uvoľňovaním (incidencia upravená na expozíciu 10,5 na 100 pacientorokov) v porovnaní s placebovou skupinou (incidencia upravená na expozíciu 15,7 na 100 pacientorokov). Zníženie HbA1c sa
pozorovalo počas trvania štúdie s celkovým rozdielom liečby -0,53% (exenatid s predĺženým uvoľňovaním oproti placebu).
TelesnáhmotnosťVo všetkých štúdiách s exenatidom s predĺženým uvoľňovaním bol pozorovaný úbytok telesnej
hmotnosti v porovnaní s východiskovými hodnotami. V 4 komparátorom kontrolovaných štúdiách sa tento úbytok telesnej hmotnosti prejavil u pacientov liečených exenatidom s predĺženým uvoľňovaním bez ohľadu na výskyt nevoľnosti, hoci v skupine s nevoľnosťou bol tento úbytok väčší (priemerný úbytok –2,9 kg až –5,2 kg s nevoľnosťou verzus –2,2 kg až –2,9 kg bez nevoľnosti).
V 4 komparátorom kontrolovaných štúdiách sa podiel pacientov, u ktorých sa prejavilo aj zníženie hmotnosti aj HbA1c, pohyboval medzi 70 až 79% (podiel pacientov, u ktorých sa prejavilo zníženie HbA1c, sa pohyboval medzi 88 až 96%).
Plazmatická/sérováglukózaLiečba exenatidom s predĺženým uvoľňovaním mala za následok významné zníženie koncentrácií
plazmatickej/sérovej glukózy nalačno (hladovej), pričom toto zníženie bolo pozorované už vo 4. týždni. V placebom kontrolovanej štúdii s inzulínom-glargín bola zmena plazmatickej glukózy nalačno z východiskovej hodnoty do 28. týždňa -0,7 mmol/l pre skupinu s exenatidom s predĺženým uvoľňovaním a -0,1 mmol/l pre skupinu s placebom.
Bolo tiež pozorované ďalšie zníženie postprandiálnych koncentrácií. Zlepšenie koncentrácií hladovej plazmatickej/sérovej glukózy vydržalo 52 týždňov.
Funkciabeta-buniekKlinické štúdie s exenatidom s predĺženým uvoľňovaním preukázali zlepšenie funkcie beta-buniek pri použití homeostatického modelu (HOMA-B). Tento účinok na funkciu beta-buniek pretrvával 52 týždňov.
Krvný
tlak
V 4 komparátorom kontrolovaných štúdiách s exenatidom s predĺženým uvoľňovaním bolo
pozorované zníženie systolického krvného tlaku (2,9 mmHg až 4,7 mmHg). V 30-týždňovej porovnávacej štúdii s exenatidom s okamžitým uvoľňovaním obidva lieky, exenatid s predĺženým uvoľňovaním aj exenatid s okamžitým uvoľňovaním, signifikantne znížili systolický krvný tlak
v porovnaní s východiskovou hodnotou (4,7 ± 1,1 mmHg a 3,4 ± 1,1 mmHg v danom poradí); rozdiel medzi týmito dvoma liečebnými postupmi nebol signifikantný. Zlepšenie krvného tlaku sa udržalo počas 52 týždňov.
V placebom kontrolovanej štúdii s inzulínom-glargín bola zmena systolického krvného tlaku z východiskovej hodnoty do 28. týždňa -2,6 mmHg pre skupinu s exenatidom s predĺženým uvoľňovaním a -0,7 mmHg pre skupinu s placebom.
Liečba exenatidom s predĺženým uvoľňovaním v kombinácii s dapagliflozínom v 28. týždni viedla
k významnej priemernej zmene zníženia systolického krvného tlaku o 4,3 ± 0,8 mmHg v porovnaní so samotným exenatidom s predĺženým uvoľňovaním o -1,2 ± 0,8 mmHg (p <0,01) alebo samotným dapagliflozínom o -1,8 ± 0,8 mmHg (p <0,05).
Hladiny lipidov nalačno
Exenatid s predĺženým uvoľňovaním nevykazuje žiadne negatívne účinky na parametre lipidov.
Pediatrickápopulácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s exenatidom s predĺženým uvoľňovaním v jednej alebo vo viacerých podskupinách pediatrickej populácie
s diabetes mellitus 2. typu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpčné vlastnosti exenatidu odzrkadľujú vlastnosti predĺženého uvoľňovania exenatidu
s predĺženým uvoľňovaním. Potom, čo sa absorbuje v krvnom obehu, exenatid sa distribuuje
a vylučuje podľa známych systémových farmakokinetických vlastností (ako je to popísané v tejto časti).
Absorpcia
Po týždennom podávaní 2 mg exenatidu s predĺženým uvoľňovaním prekračovali priemerné koncentrácie exenatidu v priebehu 2 týždňov minimálne účinné koncentrácie (~ 50 pg/ml) a priemerné plazmatické koncentrácie exenatidu sa postupne zvyšovali v priebehu 6 až 7 týždňov. Následne sa dosiahli koncentrácie exenatidu približne 151 - 265 pg/ml, čo naznačuje, že bol dosiahnutý
rovnovážny stav. Počas jednotýždňového intervalu medzi dávkami sa udržiavajú stabilné koncentrácie
exenatidu, s minimálnymi výkyvmi nahor alebo nadol od priemernej terapeutickej koncentrácie.
Distribúcia
Priemerný zdanlivý distribučný objem exenatidu po subkutánnej aplikácii jednotlivej dávky exenatidu
je 28 litrov.
Biotransformácia a eliminácia
Predklinické štúdie ukázali, že exenatid je prednostne vylučovaný glomerulárnou filtráciou
s následnou proteolytickou degradáciou. Priemerný zdanlivý klírens exenatidu je 9 l/h. Tieto farmakokinetické vlastnosti exenatidu nie sú závislé na dávke. Stredné plazmatické koncentrácie exenatidu klesnú pod detekovateľnú hranicu približne 10 týždňov po ukončení liečby exenatidom s predĺženým uvoľňovaním.
Osobitné skupiny pacientov
Porucha funkcie obličiek
Farmakokinetické populačné analýzy pacientov s poruchou funkcie obličiek, ktorí boli liečení 2 mg exenatidu s predĺženým uvoľňovaním, naznačili zvýšenie systémovej expozície približne o 74%
a 23% (odhad strednej hodnoty v každej skupine) u pacientov so stredne závažnou (N=10) a miernou (N=56) poruchou funkcie obličiek, v porovnaní s pacientmi s normálnymi renálnymi funkciami (N=84).
Insuficiencia pečene
Neuskutočnila sa žiadna farmakokinetická štúdia u pacientov s insuficienciou pečene. Exenatid je
eliminovaný predovšetkým obličkami, preto by dysfunkcia pečene nemala ovplyvňovať koncentrácie exenatidu v krvi.
Pohlavie, rasa a telesná hmotnosť
Pohlavie, rasa a telesná hmotnosť nemajú klinicky relevantný vplyv na farmakokinetiku exenatidu.
Starší pacienti
Údaje o starších pacientoch sú obmedzené, ale nenaznačujú žiadne výrazné zmeny v expozícii exenatidu s narastajúcim vekom až do veku okolo 75 rokov.
Vo farmakokinetickej štúdii s exenatidom s okamžitým uvoľňovaním u pacientov s diabetom 2. typu podanie exenatidu (10 µg) viedlo k priemernému zvýšeniu AUC exenatidu o 36% u 15 starších pacientov vo veku 75 až 85 rokov v porovnaní s 15 pacientmi vo veku 45 až 65 rokov, čo pravdepodobne súvisí so zníženou renálnou funkciou u vekovo staršej skupiny (pozri časť 4.2).
Pediatrická populácia
Vo farmakokinetickej štúdii s podaním jednotlivej dávky exenatidu s okamžitým uvoľňovaním u 13
pacientov s diabetom 2. typu vo veku 12 až 16 rokov malo podanie exenatidu (5 mg) za následok mierne zníženie priemernej hodnoty AUC (nižšia o 16%) a Cmax (nižšia o 25%) v porovnaní
s hodnotami pozorovanými u dospelých. V pediatrickej populácii sa doteraz neuskutočnila žiadna farmakokinetická štúdia s exenatidom s predĺženým uvoľňovaním.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní a genotoxicity, uskutočnených s exenatidom s okamžitým uvoľňovaním alebo s exenatidom s predĺženým uvoľňovaním, neodhalili žiadne osobitné riziko pre ľudí.
U potkanov a myší sa pri dlhodobo účinkujúcich agonistoch GLP-1 receptorov pozorovali nádory štítnej žľazy. V 2-ročnej štúdii karcinogenity u potkanov sa pri exenatide s predĺženým uvoľňovaním pozoroval zvýšený výskyt adenómov C-buniek a karcinómov C-buniek pri dávkach ≥2-násobok systémovej expozície u ľudí na základe AUC. Klinický význam týchto zistení nie je v súčasnosti známy.
Štúdie s exenatidom na zvieratách nepreukázali škodlivé účinky na fertilitu; vysoké dávky exenatidu spôsobovali poruchy vývoja kostry a spomalenie fetálneho a neonatálneho rastu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
poly(D,L-laktid-ko-glykolid)
sacharóza
Disperzné prostredie sodná soľ karmelózy chlorid sodný polysorbát 20
monohydrát dihydrogenfosforečnanu sodného
heptahydrát fosforečnanu disodného voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
3 roky
Popríprave suspenzie
Suspenzia sa musí injikovať bezprostredne po zmiešaní prášku a disperzného prostredia.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Súprava sa pred použitím môže uchovávať 4 týždne pri teplote do 30 ºC. Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie po zmiešaní lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Prášok je balený v 3 ml sklenenej injekčnej liekovke typu I uzavretej chlórbutylovou gumovou zátkou a hliníkovou plombou s plastovým vyklápacím viečkom.
Disperzné prostredie je balené v 1,5 ml sklenenej naplnenej injekčnej striekačke typu I uzavretej viečkom z brómbutylovej gumy a gumovým piestom.
Každá súprava na jednu dávku obsahuje jednu liekovku s 2 mg exenatidu, jednu naplnenú injekčnú striekačku s 0,65 ml disperzného prostredia, jeden liekovkový konektor a dve injekčné ihly (jednu rezervnú).
Veľkosť balenia: 4 jednodávkové súpravy a viacnásobné balenie obsahujúce 12 (3 balenia po 4)
jednodávkových súprav. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pacienta je potrebné poučiť, aby injekčnú striekačku spolu s nasadenou ihlou po každej injekcii bezpečne zlikvidoval. Pacient si nemusí uchovať žiadnu časť jednorazovej súpravy.
Disperzné prostredie treba pred použitím vizuálne skontrolovať. Disperzné prostredie sa môže použiť iba vtedy, ak je číre a neobsahuje žiadne častice. Po príprave suspenzie zmes sa môže použiť iba vtedy, ak je biela až sivobiela a zakalená.
Exenatid s predĺženým uvoľňovaním sa musí aplikovať hneď po zmiešaní prášku s disperzným prostredím.
Exenatid s predĺženým uvoľňovaním, ktorý bol zmrazený, sa nesmie používať.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
AstraZeneca AB
SE-151 85 Södertälje
Švédsko
8. REGISTRAČNÉ ČÍSLAEU/1/11/696/001-002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 17. júna 2011
Dátum posledného predĺženia registrácie: 18. februára 2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
1. NÁZOV LIEKUBydureon 2 mg prášok a disperzné prostredie na injekčnú suspenziu s predĺženým uvoľňovaním v naplnenom pere
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždé naplnené pero obsahuje 2 mg exenatidu. Po príprave suspenzie každé pero dodá dávku 2 mg v 0,65 ml.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAPrášok a disperzné prostredie na injekčnú suspenziu s predĺženým uvoľňovaním. Prášok: biely až sivobiely prášok.
Disperzné prostredie: priezračný, bezfarebný až bledožltý alebo bledohnedý roztok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieBydureon je indikovaný dospelým vo veku 18 rokov a starším s diabetes mellitus 2. typu na zlepšenie kontroly glykémie v kombinácii s inými liekmi znižujúcimi hladinu glukózy vrátane bazálneho inzulínu, keď súčasná liečba spolu s diétou a pohybovou aktivitou neposkytujú dostatočnú kontrolu glykémie.
Výsledky štúdie pokiaľ ide o kombinácie, vplyv na glykemickú kontrolu a kardiovaskulárne účinky a skúmané populácie, pozri časť 4.4, 4.5 a 5.1.
4.2 Dávkovanie a spôsob podávaniaDávkovanieOdporúčaná dávka je 2 mg exenatidu raz týždenne.
Pacienti, ktorí prechádzajú z exenatidu s okamžitým uvoľňovaním (Byetta) na exenatid s predĺženým uvoľňovaním (Bydureon alebo Bydureon BCise), môžu pozorovať prechodné zvýšenie hodnôt koncentrácie krvnej glukózy, čo sa obvykle upraví v prvých dvoch týždňoch po začiatku liečby. Pacienti, ktorí prechádzajú z jedného exenatidu s predĺženým uvoľňovaním na iný exenatid
s predĺženým uvoľňovaním (Bydureon alebo Bydureon BCise), tak môžu urobiť bez akéhokoľvek
očakávaného významného účinku na koncentrácie glukózy v krvi.
Ak sa exenatid s predĺženým uvoľňovaním pridáva k existujúcej liečbe metformínom a/alebo tiazolidíndiónom, je možné pokračovať v doterajšom dávkovaní metformínu a/alebo tiazolidíndiónu. Ak sa pridáva k liečbe sulfonylmočovinou, je potrebné zvážiť zníženie dávky sulfonylmočoviny, aby sa znížilo riziko hypoglykémie (pozri časť 4.4).
Exenatid s predĺženým uvoľňovaním sa má podávať raz týždenne, v rovnaký deň. Deň podávania
lieku možno v prípade potreby zmeniť, pokiaľ bola posledná dávka podaná minimálne tri dni predtým. Exenatid s predĺženým uvoľňovaním sa môže podať kedykoľvek počas dňa, s jedlom alebo bez jedla.
V prípade vynechania dávky je potrebné vynechanú dávku podať ihneď ako je to možné, za predpokladu, že ďalšia pravidelná plánovaná dávka sa má podať o 3 alebo viac dní. Potom sa môžu pacienti vrátiť k ich zvyčajnému dávkovaciemu režimu jedenkrát týždenne.
Ak sa dávka vynechá a ďalšia pravidelná plánovaná dávka sa má podať o 1 alebo 2 dni neskôr, pacient si vynechanú dávku nemá podať, ale namiesto toho má pokračovať v liečbe exenatidom s predĺženým uvoľňovaním v deň ďalšej pravidelnej plánovanej dávky.
Používanie exenatidu s predĺženým uvoľňovaním nevyžaduje ďalšiu samokontrolu. Samokontrola hladiny glukózy v krvi je potrebná kvôli úprave dávky sulfonylmočoviny a inzulínu, najmä ak sa začína liečba exenatidom s predĺženým uvoľňovaním a dávka inzulínu sa znižuje. Odporúča sa postupné znižovanie dávky inzulínu.
Ak sa po prerušení liečby exenatidom s predĺženým uvoľňovaním začne liečba iným liekom znižujúcim hladinu glukózy, treba mať na zreteli predĺžené uvoľňovanie lieku (pozri časť 5.2).
Osobitné skupiny pacientovStarší pacientiNie je potrebná žiadna úprava dávky v závislosti od veku. Avšak vo všeobecnosti sa so zvyšujúcim vekom funkcia obličiek znižuje, preto treba brať do úvahy renálne funkcie pacienta (pozri časť
Porucha funkcie obličiek) (pozri časť 5.2).
Porucha funkcie obličiekNie je potrebná žiadna úprava dávky u pacientov s miernou poruchou funkcie obličiek (klírens kreatinínu 50 – 80 ml/min). Klinické skúsenosti u pacientov so stredne závažnou poruchou funkcie obličiek (klírens kreatinínu 30 – 50 ml/min) sú obmedzené (pozri časť 5.2). Týmto pacientom sa neodporúča používať exenatid s predĺženým uvoľňovaním.
Podávanie exenatidu s predĺženým uvoľňovaním sa neodporúča u pacientov v terminálnom štádiu renálneho ochorenia alebo so závažnou poruchou funkcie obličiek (klírens kreatinínu <30 ml/min) (pozri časť 4.4).
Porucha funkcie pečeneNie je potrebná žiadna úprava dávky u pacientov s poruchou funkcie pečene (pozri časť 5.2).
Pediatrická populáciaBezpečnosť a účinnosť exenatidu s predĺženým uvoľňovaním u detí a dospievajúcich vo veku do 18
rokov neboli doteraz stanovené. V súčasnosti dostupné údaje sú opísané v časti 5.2, ale neumožňujú uviesť odporúčania na dávkovanie.
SpôsobpodávaniaSubkutánne použitie
Exenatid s predĺženým uvoľňovaním si pacient podáva sám. Každé pero je určené len pre jedného pacienta a na jedno použitie.
Pred začatím podávania exenatidu s predĺženým uvoľňovaním sa dôrazne odporúča, aby lekár nacvičil podávanie s pacientmi a ich ošetrovateľmi. Je potrebné postupovať opatrne podľa „Návodu na použitie“, ktorý je súčasťou balenia.
Každá dávka lieku sa podáva ako subkutánna injekcia do brucha, stehna alebo zadnej časti ramena ihneď po nariedení suspenzie.
V prípade podávania s inzulínom sa exenatid s predĺženým uvoľňovaním a inzulín musia podávať vo forme dvoch samostatných injekcií.
Pokyny na nariedenie suspenzie lieku pred podaním, pozri časť 6.6 a „Návod na použitie“.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníExenatid s predĺženým uvoľňovaním sa nemá používať u pacientov s diabetes mellitus 1. typu alebo na liečbu diabetickej ketoacidózy.
Exenatid s predĺženým uvoľňovaním nie je náhrada za inzulín. U pacientov závislých od inzulínu bola po náhlom prerušení podávania alebo znížení dávky inzulínu hlásená diabetická ketoacidóza (pozri časť 4.2).
Exenatid s predĺženým uvoľňovaním sa nesmie podávať intravenózne alebo intramuskulárne.
Porucha funkcie obličiekU pacientov v terminálnom štádiu renálneho ochorenia, ktorí sú liečení dialýzou, jednotlivé dávky
exenatidu s okamžitým uvoľňovaním zvyšovali frekvenciu a závažnosť nežiaducich
gastrointestinálnych účinkov; preto sa použitie exenatidu s predĺženým uvoľňovaním neodporúča
u pacientov v terminálnom štádiu renálneho ochorenia alebo so závažnou poruchou funkcie obličiek (klírens kreatinínu <30 ml/min). Klinické skúsenosti u pacientov so stredne závažnou poruchou funkcie obličiek sú obmedzené, preto sa im podávanie exenatidu s predĺženým uvoľňovaním neodporúča.
U exenatidu boli menej často hlásené prípady zmenenej renálnej funkcie, vrátane zvýšeného sérového kreatinínu, poruchy funkcie obličiek, zhoršenia chronického renálneho zlyhania a akútneho renálneho zlyhania, niekedy vyžadujúceho hemodialýzu. Niektoré z týchto prípadov sa objavili u pacientov,
u ktorých sa vyskytli stavy, ktoré môžu ovplyvniť hydratáciu, vrátane nevoľnosti, vracania, a/alebo
hnačky a/alebo u pacientov užívajúcich lieky ovplyvňujúce funkciu obličiek/stav hydratácie. Súbežne podávané lieky zahŕňali inhibítory angiotenzín-konvertujúceho enzýmu, antagonistov angiotenzínu II, nesteroidové protizápalové lieky a diuretiká. Reverzibilita zmenenej funkcie obličiek sa pozorovala pri podpornej liečbe a pri vysadení potenciálne príčinných liečiv, vrátane exenatidu.
Závažné gastrointestinálne ochorenieExenatid s predĺženým uvoľňovaním sa doteraz neskúmal u pacientov so závažným gastrointestinálnym ochorením, vrátane gastroparézy. Podávanie tohto lieku je obyčajne spojené s nežiaducimi gastrointestinálnymi účinkami, vrátane nevoľnosti, vracania a hnačky. Preto sa podávanie exenatidu s predĺženým uvoľňovaním neodporúča u pacientov so závažným gastrointestinálnym ochorením.
AkútnapankreatitídaPoužitie agonistov GLP-1 receptorov je spojené s rizikom vzniku akútnej pankreatitídy. V klinických štúdiách s exenatidom s predĺženým uvoľňovaním sa akútna pankreatitída vyskytla u 0,3% pacientov. Spontánne boli hlásené prípady akútnej pankreatitídy s exenatidom s predĺženým uvoľňovaním. Vyliečenie pankreatitídy sa pozorovalo po podpornej liečbe, veľmi zriedkavo však boli hlásené prípady nekrotizujúcej alebo hemoragickej pankreatitídy a/alebo úmrtie. Pacienti majú byť informovaní o charakteristických príznakoch akútnej pankreatitídy: pretrvávajúcej, závažnej bolesti brucha. Pri podozrení na pankreatitídu sa má exenatid s predĺženým uvoľňovaním vysadiť; v prípade, že je akútna pankreatitída potvrdená s exenatidom s predĺženým uvoľňovaním sa nesmie pokračovať. U pacientov s anamnézou pankreatitídy sa odporúča postupovať opatrne.
Súbežnépoužitie iných liekovSúbežné použitie exenatidu s predĺženým uvoľňovaním s derivátmi D-fenylalanínu (meglitinidmi), alfa-glukozidázovými inhibítormi, inhibítormi dipeptidyl peptidázy-4 alebo inými agonistami GLP-1 receptora sa doteraz neskúmalo. Súbežné použitie exenatidu s predĺženým uvoľňovaním a exenatidu
s okamžitým uvoľňovaním sa doteraz neskúmalo, a preto sa neodporúča.
Interakcia s warfarínomPri súbežnom užívaní warfarínu a exenatidu boli spontánne hlásené prípady zvýšeného INR (International Normalized Ratio - Medzinárodný normalizovaný pomer), niekedy spojeného s krvácaním (pozri časť 4.5).
HypoglykémiaRiziko hypoglykémie bolo v klinických štúdiách vyššie pri použití exenatidu s predĺženým uvoľňovaním v kombinácii so sulfonylmočovinou. V klinických štúdiách pacienti s miernou poruchou funkcie obličiek užívajúci sulfonylmočovinu v kombinácii mali zvýšený výskyt hypoglykémie
v porovnaní s pacientmi s normálnou funkciou obličiek. Aby sa znížilo riziko hypoglykémie
v súvislosti s užívaním sulfonylmočoviny, je potrebné zvážiť redukciu dávky sulfonylmočoviny.
Rýchly úbytok hmotnostiU pacientov liečených exenatidom sa zaznamenal rýchly úbytok hmotnosti v priemere >1,5 kg za týždeň. Takýto úbytok hmotnosti môže mať škodlivé dôsledky. U pacientov s prudkým znížením hmotnosti sa majú sledovať príznaky a prejavy cholelitiázy.
Prerušenie liečbyPo prerušení liečby môže pretrvať účinok exenatidu s predĺženým uvoľňovaním, pretože plazmatická hladina exenatidu klesá počas 10 týždňov. Pri výbere iného lieku a nastavení jeho dávky treba mať tento fakt na zreteli, keďže nežiaduce účinky môžu pretrvávať a účinnosť môže, hoci iba čiastočne, pokračovať až do úplného zníženia hladín exenatidu.
Pomocné látkyObsah sodíka: Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej dávke, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcieSulfonylmočovinaMôže byť potrebné upraviť dávku sulfonylmočoviny, pretože pri liečbe sulfonylmočovinou sa zvyšuje riziko hypoglykémie (pozri časti 4.2 a 4.4).
VyprázdňovaniežalúdkaVýsledky štúdie využívajúcej paracetamol ako marker vyprázdňovania žalúdka naznačujú, že vplyv exenatidu s predĺženým uvoľňovaním na spomalenie vyprázdňovania žalúdka je mierny
a nepredpokladá sa, že by mohol spôsobovať klinicky významné zníženie rýchlosti ani rozsahu
absorpcie súbežne užívaných perorálnych liekov. Preto nie sú potrebné žiadne úpravy dávkovania perorálnych liekov citlivých na spomalené vyprázdňovanie žalúdka.
Pri podaní 1 000 mg paracetamolu vo forme tabliet, s jedlom alebo bez jedla, po 14 týždňoch liečby exenatidom s predĺženým uvoľňovaním, neboli v AUC paracetamolu v porovnaní s kontrolným obdobím pozorované žiadne významné zmeny. Cmax paracetamolu bola znížená o 16% (nalačno)
a o 5% (s jedlom) a tmax bola zvýšená z približne 1 hodiny v kontrolnej perióde na 1,4 hodiny
(nalačno) a 1,3 hodiny (s jedlom).
Nasledujúce štúdie interakcií sa uskutočnili s použitím 10 μg exenatidu s okamžitým uvoľňovaním, ale nie exenatidu s predĺženým uvoľňovaním.
WarfarínPri podaní warfarínu 35 minút po podaní exenatidu s okamžitým uvoľňovaním sa tmax predĺžila asi o 2 hodiny. Neboli pozorované žiadne klinicky významné účinky na Cmax alebo AUC. Zvýšený INR bol spontánne hlásený pri súbežnom užívaní warfarínu a exenatidu s predĺženým uvoľňovaním. INR sa má monitorovať na začiatku liečby exenatidom s predĺženým uvoľňovaním u pacientov liečených warfarínom a/alebo derivátmi kumarolu (pozri časti 4.4 a 4.8).
Inhibítory HMG CoA reduktázyHodnoty AUC a Cmax lovastatínu boli znížené približne o 40% resp. 28%, a tmax bola predĺžená približne o 4 hodiny pri podaní exenatidu s okamžitým uvoľňovaním súbežne s jednou dávkou lovastatínu (40 mg) v porovnaní s podaním lovastatínu samostatne. V 30-týždňových placebom kontrolovaných klinických štúdiách s exenatidom s okamžitým uvoľňovaním nebolo súbežné podávanie exenatidu a inhibítorov HMG CoA reduktázy spojené so stabilnými zmenami v lipidovom profile (pozri časť 5.1). Nie je potrebná žiadna vopred stanovená úprava dávkovania; ale lipidový profil sa má pravidelne monitorovať.
Digoxína lizinoprilV štúdiách interakcií účinku exenatidu s okamžitým uvoľňovaním na digoxín a lizinopril neboli pozorované žiadne klinicky relevantné účinky na Cmax alebo AUC, ale pozorovalo sa posunutie tmax približne o 2 hodiny.
Etinylestradiol a levonorgestrelPodanie kombinovaných perorálnych kontraceptív (30 µg etinylestradiolu a 150 µg levonorgestrelu) hodinu pred podaním exenatidu s okamžitým uvoľňovaním neovplyvnilo AUC, Cmax alebo Cmin etinylestradiolu ani levonorgestrelu. Podanie perorálnych kontraceptív 35 minút po podaní exenatidu neovplyvnilo AUC, ale malo za následok zníženie Cmax etinylestradiolu o 45% a Cmax levonorgestrelu o 27-41% a predĺžilo tmax o 2-4 hod. v dôsledku spomaleného vyprázdňovania žalúdka. Zníženie Cmax má obmedzený klinický význam a úprava dávky perorálnych kontraceptív nie je potrebná.
PediatrickápopuláciaInterakčné štúdie s exenatidom sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktáciaŽeny v reprodukčnom vekuŽeny v reprodukčnom veku by mali počas liečby exenatidom s predĺženým uvoľňovaním užívať kontraceptíva kvôli dlhému polčasu eliminácie exenatidu s predĺženým uvoľňovaním. Tento liek sa má vysadiť aspoň 3 mesiace pred plánovanou graviditou.
GraviditaNie sú k dispozícii dostatočné údaje o použití exenatidu s predĺženým uvoľňovaním u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Exenatid s predĺženým uvoľňovaním nesmie byť podávaný počas gravidity a odporúča sa podávanie inzulínu.
DojčenieNie je známe, či sa exenatid vylučuje do materského mlieka u ľudí. Exenatid s predĺženým
uvoľňovaním sa nemá užívať počas dojčenia.
FertilitaNeuskutočnili sa žiadne štúdie fertility u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeExenatid s predĺženým uvoľňovaním má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pri podávaní exenatidu s predĺženým uvoľňovaním v kombinácii so sulfonylmočovinou je potrebné upozorniť pacientov, aby podnikli opatrenia na zabránenie vzniku hypoglykémie počas riadenia vozidiel a obsluhy strojov.
4.8 Nežiaduce účinkySúhrnbezpečnostnéhoprofiluNajčastejšie nežiaduce reakcie boli hlavne gastrointestinálneho charakteru (nevoľnosť, ktorá bola najčastejšou reakciou a objavovala sa na začiatku liečby a časom slabla a hnačka). Okrem toho sa
objavili reakcie v mieste vpichu injekcie (pruritus, nodulus, erytém), hypoglykémia (so sulfonylmočovinou) a bolesť hlavy. Väčšina nežiaducich reakcií súvisiacich s exenatidom s predĺženým uvoľňovaním bola slabej až miernej intenzity.
Tabuľkový zoznam nežiaducich reakciíV tabuľke 1 sú zhrnuté frekvencie nežiaducich reakcií exenatidu s predĺženým uvoľňovaním
identifikovaných z klinických štúdií a zo spontánnych hlásení (nepozorované v klinických štúdiách, frekvencia neznáma).
Základná liečba v klinických štúdiách s exenatidom s predĺženým uvoľňovaním zahŕňala diétu
a cvičenie, metformín, sulfonylmočovinu, tiazolidíndión, kombináciu perorálnych liekov znižujúcich hladinu glukózy alebo bazálny inzulín.
Reakcie sú uvedené nižšie podľa uprednostňovaných názvov MedDRA a zoradené podľa tried orgánových systémov a podľa absolútnej frekvencie. Frekvencie výskytu sú definované nasledovne: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (z dostupných údajov).
Tabuľka 1: Nežiaduce reakcie exenatidu s predĺženým uvoľňovaním zistené v klinických štúdiách a zo spontánnych hlásení
Tried
y orgánových
systémov / názvy nežiaducich reakcií
Veľmi časté
Frekvencia výskytu
Časté Menej časté Zriedkavé Veľmi zriedkavé
Neznáme
Poruch
y imunitného systému
Anafylaktické reakcie X1
Poruchy metabolizmu a výživy
Hypoglykémia (so sulfonylmočovinou) Hypoglykémia
(s inzulínom)
X1
X2,3
Znížená chuť do jedla X1
Dehydratácia X1
Poruchy nervového systému
Bolesť hlavy X1
Závraty X1
Dysgeúzia X1
Somnolencia X1
Poruchy gastrointestinálneho traktu
Intestinálna obštrukcia X1
Akútna pankreatitída X1
(pozri časť 4.4)
Nevoľnosť X1
Vracanie X1
Hnačka X1
Dyspepsia X1
Abdominálna bolesť X1
Gastroezofageálny X1
reflux
Abdominálna distenzia X1
Eruktácia X1
Zápcha X1
Plynatosť X1
Poruchy kože a podkožného tkaniva
Makulárna alebo X4
papulárna vyrážka
Pruritus a/alebo X1
urtikária
Angioneurotický edém X4
Abscesy v mieste X4
vpichu a celulitída
Hyperhidróza X1
Alopécia X1
Poruchy obličiek a močových ciestAlterovaná funkcia X1
obličiek, vrátane
akútneho zlyhania obličiek, zhoršenie chronického zlyhania obličiek, poškodenie obličiek, zvýšenie sérového kreatinínu (pozri časť 4.4).
Celkové poruchy a reakcie v mieste podaniaPruritus v mieste X1
podania injekcie
Únava X1
Začervenanie v mieste X1
podania injekcie
Vyrážka v mieste X1
podania injekcie
Asténia X1
Pocit nepokoja X1
Laboratórne a funkčné vyšetreniaZvýšený X4
medzinárodný normalizovaný pomer (pozri časť 4.4)
1 Výskyt na základe dvanástich ukončených dlhodobých štúdií účinnosti a bezpečnosti exenatidu s predĺženým uvoľňovaním s celkovým n = 2 868, (pacienti so sulfonylmočovinou n = 1 002).
2 Na základe hypoglykemických udalostí, ktoré: 1. mali za následok stratu vedomia, záchvat alebo kómu, ktorá ustúpila po podaní glukagónu alebo glukózy ALEBO 2. vyžadovali pomoc tretej strany
z dôvodu poruchy vedomia alebo správania a bola pri nich hodnota glukózy <54 mg/dl (3 mmol/l) ALEBO 3. mali za následok príznaky zhodujúce sa s hypoglykémiou pri hladine glukózy <54 mg/dl (3 mmol/l) pred liečbou.
3 Frekvencia hlásená z obdobia 28-týždňovej kontrolovanej liečby exenatidom s predĺženým
uvoľňovaním ako prídavnej liečby v rámci štúdie s inzulínom-glargín (n = 231).
4 Výskyt na základe údajov zo spontánnych hlásení s exenatidom s predĺženým uvoľňovaním
(neznáma frekvencia výskytu).
Popis vybraných nežiaducich reakciíHypoglykémiaIncidencia hypoglykémie sa zvýšila pri užívaní exenatidu s predĺženým uvoľňovaním v kombinácii so
sulfonylmočovinou (24,0% verzus 5,4%) (pozri časť 4.4). Pre zníženie rizika hypoglykémie súvisiacej s užívaním sulfonylmočoviny by sa malo zvážiť zníženie dávky sulfonylmočoviny (pozri časti 4.2
a 4.4).
Exenatid s predĺženým uvoľňovaním sa spája s podstatne nižšou incidenciou epizód hypoglykémie než bazálny inzulín u pacientov, ktorí sú liečení súbežne metformínom (3% oproti 19%) a u pacientov, ktorí sú liečení súbežne metformínom spolu so sulfonylmočovinou (20% oproti 42%).
V 12 štúdiách s exenatidom s predĺženým uvoľňovaním väčšina epizód (99,9% n = 649) hypoglykémie bola mierna a podarilo sa ju prekonať perorálnym podaním sacharidov. Hlásený bol jeden prípad závažnej hypoglykémie s nízkou hladinou glukózy v krvi (2,2 mmol/l), ktorá bola zvládnutá perorálnym podaním sacharidov.
Po pridaní exenatidu s predĺženým uvoľňovaním k bazálnemu inzulínu nebola potrebná žiadna úprava úvodnej dávky. Exenatid s predĺženým uvoľňovaním v kombinácii s bazálnym inzulínom nepreukázal v porovnaní s inzulínom žiadne klinicky významné rozdiely v incidencii hypoglykemických epizód.
V skupine s exenatidom s predĺženým uvoľňovaním v kombinácii s inzulínom sa nezaznamenali
žiadne epizódy závažnej hypoglykémie.
Nevoľnosť
Najčastejšie zaznamenaným nežiaducim účinkom bola nevoľnosť. Celkovo u 20% pacientov liečených exenatidom s predĺženým uvoľňovaním sa zaznamenala minimálne jedna epizóda nevoľnosti, v porovnaní s 34% pacientov liečených exenatidom s okamžitým uvoľňovaním. Väčšina epizód nevoľnosti bola mierna až stredne závažná. U väčšiny pacientov, ktorí na začiatku pociťovali nevoľnosť, jej frekvencia pri pokračujúcej liečbe klesala.
V 30 týždňových kontrolovaných klinických štúdiách došlo k ukončeniu liečby z dôvodu nežiaducich účinkov u 6% pacientov liečených exenatidom s predĺženým uvoľňovaním a u 5% pacientov liečených exenatidom s okamžitým uvoľňovaním. Najčastejšími nežiaducimi účinkami, ktoré viedli k prerušeniu liečby v oboch liečebných skupinách, boli nevoľnosť a vracanie. Spomedzi pacientov liečených exenatidom s predĺženým uvoľňovaním menej ako 1% predčasne ukončilo liečbu kvôli nevoľnosti alebo vracaniu a spomedzi pacientov liečených exenatidom s okamžitým uvoľňovaním to bolo 1% pacientov.
Reakcie v mieste podania injekcie
Reakcie v mieste podania injekcie boli zaznamenané častejšie u pacientov liečených exenatidom
s predĺženým uvoľňovaním než u pacientov liečených komparátorom (16% oproti rozpätiu 2-7%)
počas 6-mesačnej kontrolnej fázy klinickej štúdie. Tieto reakcie v mieste podania injekcie boli obvykle mierne a väčšinou neviedli k ukončeniu účasti v klinickej štúdii. Pacienti môžu byť ošetrení za účelom zmiernenia príznakov, zatiaľ čo sa pokračuje v liečbe. Nasledujúce injekcie sa majú potom podávať každý týždeň do iného miesta. V postmarketingových sledovaniach sa zaznamenali prípady abscesov v mieste vpichu a celulitída.
Malé podkožné uzlíky v mieste podania boli v klinických štúdiách pozorované veľmi často a súviseli
so známymi vlastnosťami poly(D,L-laktid-ko-glykolid) mikrosférických formulácií polyméru. Väčšina jednotlivých uzlíkov bola asymptomatická, nemala vplyv na účasť v štúdii a vymizla v priebehu 4 až 8 týždňov.
Imunogenita
V súlade s potenciálne imunogénnymi vlastnosťami liekov na báze proteínov a peptidov sa
u pacientov po liečbe exenatidom s predĺženým uvoľňovaním môžu vyvinúť protilátky proti
exenatidu. U väčšiny pacientov, u ktorých k tvorbe protilátok došlo, sa titer protilátok postupne znižoval.
Prítomnosť protilátok (vo vysokých alebo nízkych titroch) nie je prediktívna pre kontrolu glykémie u jednotlivých pacientov.
V klinických štúdiách s exenatidom s predĺženým uvoľňovaním približne 45% pacientov malo nízke titre protilátok proti exenatidu v študovanom ukazovateli. Celkovo bolo percento pacientov
s prítomnosťou protilátok počas klinických štúdií nemenné. Vo všeobecnosti bola úroveň glykemickej kontroly (HbA1c) u týchto pacientov porovnateľná s úrovňou pozorovanou u pacientov bez zvýšenej koncentrácie protilátok. V štúdiách 3. fázy malo priemerne 12% pacientov zvýšený titer protilátok. Úmerne k tomu v závere kontrolovanej fázy štúdií chýbala glykemická odpoveď na exenatid
s predĺženým uvoľňovaním; glykemická odpoveď sa neprejavila u 2,6% pacientov s vyššou
koncentráciou protilátok, zatiaľ čo u 1,6% pacientov s neprítomnosťou protilátok sa odpoveď neprejavila.
Pacienti, u ktorých sa vytvoria protilátky proti exenatidu, majú sklon k početnejším reakciám v mieste podania injekcie (napríklad: začervenanie kože a svrbenie), ale inak majú podobnú frekvenciu a typ nežiaducich účinkov ako pacienti bez protilátok proti exenatidu.
Potenciálne imunogénne reakcie v mieste podania injekcie (najčastejšie pruritus s alebo bez erytému) sa vyskytli u 9% pacientov liečených exenatidom s predĺženým uvoľňovaním v priebehu jednej 30- týždňovej a dvoch 26-týždňových štúdií. Tieto reakcie sa menej často pozorovali u pacientov
s neprítomnosťou protilátok (4%) v porovnaní s pacientmi s pozitivitou protilátok (13%), pričom vyšší výskyt bol u pacientov s vyššou koncentráciou protilátok.
Vyšetrenie vzoriek s pozitívnym nálezom protilátok neodhalilo žiadnu významnú skríženú reaktivitu s podobnými endogénnymi peptidmi (glukagón alebo GLP-1).
Rýchly úbytok hmotnosti
Počas 30-týždňovej štúdie, približne u 3% (n = 4/148) pacientov liečených exenatidom s predĺženým uvoľňovaním, došlo minimálne v jednom časovom období k rýchlemu úbytku hmotnosti (zaznamenané zníženie hmotnosti medzi dvoma za sebou nasledujúcimi študijnými návštevami bolo väčšie ako 1,5 kg/týždeň).
Zvýšenie srdcovej frekvencie
V súhrnných klinických štúdiách exenatidu s predĺženým uvoľňovaním sa pozorovalo priemerné zvýšenie srdcovej frekvencie (HR) o 2,6 tepov za minútu (bpm) oproti východiskovej hodnote (74 bpm). Pätnásť percent pacientov liečených exenatidom s predĺženým uvoľňovaním malo
priemerné zvýšenie HR ≥10 bpm, približne 5% až 10% jedincov v rámci iných liečebných skupín mali
priemerné zvýšenie HR ≥10 bpm.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 Predávkovanie
Príznaky predávkovania exenatidom (vychádzajúce z klinických skúšaní exenatidu s okamžitým uvoľňovaním) zahŕňajú závažnú nevoľnosť, prudké vracanie a rýchly pokles koncentrácie glukózy v krvi. V prípade predávkovania je potrebné začať s vhodnou podpornou liečbou podľa klinických prejavov a príznakov pacienta.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antidiabetiká, analógy GLP (glukagónu podobný peptid)-1-receptora, ATC kód: A10BJ01.
Mechanizmusúčinku
Exenatid je agonista receptorov glukagónu podobného peptidu 1 (GLP-1), ktorý vykazuje viaceré antihyperglykemické účinky glukagónu podobného peptidu 1 (GLP-1). Sekvencia aminokyselín sa prekrýva so sekvenciou ľudského GLP-1. U exenatidu sa dokázala väzba a aktivácia známych
ľudských GLP-1 receptorov in vitro, mechanizmus účinku je sprostredkovaný cyklickým AMP a/alebo
ďalšími vnútrobunkovými signálnymi dráhami.
Exenatid zvyšuje sekréciu inzulínu z pankreatických beta-buniek v závislosti od hladiny glukózy. So znižovaním koncentrácie krvnej glukózy klesá i sekrécia inzulínu. Pri podávaní exenatidu
v kombinácii so samotným metformínom a/alebo tiazolidíndiónom sa nepozorovalo žiadne zvýšenie
výskytu hypoglykémie v porovnaní s placebom v kombinácii s metformínom a/alebo tiazolidíndiónom, čo môže byť spôsobené glukózo-dependentným inzulínotropným mechanizmom účinku (pozri časť 4.4).
Exenatid potláča sekréciu glukagónu, o ktorom je známe, že jeho hladina je neprimerane zvýšená
u pacientov s diabetom 2. typu. Nižšie hladiny glukagónu vedú k zníženiu produkcie glukózy v pečeni. Exenatid však neovplyvňuje normálnu reakciu glukagónu ani iné hormonálne reakcie na
hypoglykémiu.
Exenatid spomaľuje vyprázdňovanie žalúdka, čím spomaľuje rýchlosť prechodu glukózy z potravy do krvného obehu.
Dokázalo sa, že podávanie exenatidu znižuje príjem potravy následkom zníženej chuti do jedla a zvýšeného pocitu sýtosti.
Farmakodynamické účinky
Exenatid zlepšuje glykemickú kontrolu prostredníctvom trvalého pôsobenia na zníženie
postprandiálnych a hladových koncentrácií glukózy u pacientov s diabetom 2. typu. Na rozdiel od prirodzeného GLP-1, farmakokinetický a farmakodynamický profil exenatidu s predĺženým uvoľňovaním u ľudí je vhodný na podávanie raz týždenne.
Farmakodynamická štúdia u pacientov s diabetom 2. typu (n = 13) dokázala obnovenie prvej fázy sekrécie inzulínu a zlepšenie druhej fázy sekrécie inzulínu ako odpoveď na intravenózny bolus glukózy.
Klinická účinnosť a bezpečnosť
Výsledky dlhodobých klinických štúdií s exenatidom s predĺženým uvoľňovaním sú uvedené nižšie,
tieto štúdie zahŕňali 1 356 pacientov liečených exenatidom s predĺženým uvoľňovaním, 52% mužov a 48% žien; 230 pacientov (17%) bolo vo veku ≥65 rokov.
Okrem toho dvojito-zaslepená, placebom kontrolovaná štúdia (EXSCEL) sledujúca kardiovaskulárne výsledky zahŕňala 14 752 jedincov s diabetom 2. typu a akoukoľvek mierou kardiovaskulárneho rizika, keď bol pridaný k bežnej zvyčajnej liečbe.
Glykemickákontrola
V dvoch štúdiách bol exenatid 2 mg s predĺženým uvoľňovaním podávaný raz týždenne porovnávaný s exenatidom 5 µg s okamžitým uvoľňovaním podávaným dvakrát denne počas 4 týždňov
a pokračovalo sa exenatidom 10 µg s okamžitým uvoľňovaním podávaným dvakrát denne. Jedna štúdia trvala 24 týždňov (n = 252) a druhá 30 týždňov (n = 295) s následným otvoreným predĺženým sledovaním, v ktorom boli všetci pacienti ďalších 7 rokov liečení exenatidom 2 mg s predĺženým
uvoľňovaním podávaným raz týždenne (n = 258). V oboch štúdiách došlo v oboch liečebných
skupinách k viditeľnému poklesu HbA1c už pri prvom meraní HbA1c od začatia liečby (4. alebo 6. týždeň).
Exenatid s predĺženým uvoľňovaním viedol k štatisticky významnému zníženiu HbA1c v porovnaní s pacientmi, ktorí dostávali exenatid s okamžitým uvoľňovaním (tabuľka 2).
Klinicky významný účinok exenatidu s predĺženým uvoľňovaním a exenatidu s okamžitým uvoľňovaním na HbA1c bol pozorovaný v oboch štúdiách, bez ohľadu na druh základnej antidiabetickej liečby.
Klinicky a štatisticky významne viac pacientov užívajúcich exenatid s predĺženým uvoľňovaním
v porovnaní s exenatidom s okamžitým uvoľňovaním dosiahlo v týchto dvoch štúdiách zníženie HbA1c
≤7% alebo <7% (p <0,05, resp. p ≤0,0001).
Pacienti liečení exenatidom s predĺženým uvoľňovaním aj exenatidom s okamžitým uvoľňovaním dosiahli zníženie hmotnosti v porovnaní s východiskovými hodnotami, hoci rozdiel medzi týmito dvomi liečebnými skupinami nebol významný.
V nekontrolovanom predĺžení štúdie vyhodnocovaní pacienti, ktorí v 30. týždni prešli z exenatidu
s okamžitým uvoľňovaním na exenatid s predĺženým uvoľňovaním (n = 121), dosiahli v 52. týždni rovnaké zlepšenie HbA1c o -2,0% v porovnaní s východiskovými hodnotami, ako pacienti liečení exenatidom s predĺženým uvoľňovaním.
U všetkých pacientov, ktorí dokončili nekontrolované predĺženie štúdie trvajúce 7 rokov (n = 122
z 258 pacientov zaradených do predĺženej fázy), sa HbA1c postupne od 52. týždňa zvyšovalo, avšak stále bolo nižšie ako východisková hodnota po 7 rokoch (-1,5%). Úbytok na hmotnosti u týchto pacientov pretrvával počas 7 rokov.
Tabuľka 2: Výsledky z dvoch klinických štúdií s exenatidom s predĺženým uvoľňovaním
v porovnaní s exenatidom s okamžitým uvoľňovaním v kombinácii iba s diétou a cvičením, metformínom a/alebo sulfonylmočovinou a metformínom a/alebo tiazolidíndiónom
(ITT-pacienti; ITT = intent to treat)
24-týždňová štúdia
Exenatid
s predĺženým uvoľňovaním 2 mg
Exenatid
s okamžitým
uvoľňo
v
an
í
m
10 µg 2 x denne

n 129 123
Priemerná hodnota HbA1c (%)Východisková hodnota 8,5 8,4
Zmena oproti východiskovej hodnote (± SE) -1,6 (± 0,1)** -0,9 (± 0,1)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,67 (-0,94; -0,39)**
Pacienti (%) dosahujúci hodnotu HbA1c <
7% 58 30
Zmena plazmatickej glukózy nalačno (mmol/l)(± SE) -1,4 (± 0,2) -0,3 (± 0,2)
Priemerná telesná hmotnosť (kg)Východisková hodnota 97 94
Zmena oproti východiskovej hodnote (± SE) -2,3 (± 0,4) -1,4 (± 0,4)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,95 (-1,91; 0,01)
30-týždňová štúdiaN 148 147
Priemerná hodnota HbA1c (%)Východisková hodnota 8,3 8,3
Zmena oproti východiskovej hodnote (± SE) -1,9 (± 0,1)* -1,5 (± 0,1)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,33 (-0,54; -0,12)*
Pacienti (%) dosahujúci hodnotu HbA1c ≤
7% 73 57
Zmena plazmatickej glukózy nalačno (mmol/l)(± SE) -2,3 (± 0,2) -1,4 (± 0,2)
Priemerná telesná hmotnosť (kg)Východisková hodnota 102 102
Zmena oproti východiskovej hodnote (± SE) -3,7 (± 0,5) -3,6 (± 0,5)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,08 (-1,29; 1,12)
SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval), *p <0,05;
**p <0,0001
V 26-týždňovej štúdii bol exenatid s predĺženým uvoľňovaním 2 mg porovnávaný s inzulínom-glargín podávaným raz denne. V porovnaní s liečbou inzulínom-glargín, exenatid s predĺženým uvoľňovaním
preukázal významnejšiu zmenu v hodnote HbA1c, signifikantne zníženú priemernú telesnú hmotnosť a spájal sa s menším počtom hypoglykemických príhod (tabuľka 3).
Tabuľka 3: Výsledky 26-týždňovéj klinickej štúdie s exenatidom s predĺženým uvoľňovaním
v porovnaní s inzulínom-glargín v kombinácii s metformínom samostatne alebo s metformínom a sulfonylmočovinou (ITT-pacienti)
Exenatid
s predĺženým uvoľňovaním
2 mg
Inzulín-glargín1
n 233 223
Priemerná hodnota HbA1c (%)Východisková hodnota 8,3 8,3
Zmena oproti východiskovej hodnote (± SE) -1,5 (± 0,1)* -1,3 (± 0,1)*
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,16 (-0,29; -0,03)*
Pacienti (%) dosahujúci hodnotu HbA1c ≤
7% 62 54
Zmena glukózy v sére nalačno (mmol/l) (± SE) -2,1 (± 0,2) -2,8 (± 0,2)
Priemerná telesná hmotnosť (kg)Východisková hodnota 91 91
Zmena oproti východiskovej hodnote (± SE) -2,6 (± 0,2) +1,4 (± 0,2)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -4,05 (-4,57; -3,52)*
SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval), *p <0,05
1 Inzulín-glargín bol dávkovaný tak, aby sa dosiahla cieľová koncentrácia glukózy v rozmedzí 4,0 až
5,5 mmol/l (72 až 100 mg/dl).
Priemerná dávka inzulínu-glargín na začiatku liečby bola 10,1 IU/deň a zvýšila sa na 31,1 IU/deň pre pacientov liečených inzulínom-glargín.
Výsledky za 156 týždňov boli konzistentné s tými, ktoré už boli predtým hlásené v 26-týždňovej predbežnej správe. Liečba exenatidom s predĺženým uvoľňovaním trvale významne zlepšovala kontrolu glykémie a kontrolu hmotnosti v porovnaní s liečbou inzulínom-glargín. Údaje týkajúce sa bezpečnosti v 156. týždni sa zhodovali s tými, ktoré sa hlásili v 26. týždni.
V 26-týždňovej dvojito zaslepenej štúdii sa exenatid s predĺženým uvoľňovaním porovnával
s maximálnymi dennými dávkami sitagliptínu a pioglitazónu u pacientov, ktorí užívali aj metformín.
Vo všetkých liečebných skupinách došlo k významnému zníženiu hodnoty HbA1c oproti východiskovej hodnote. Exenatid s predĺženým uvoľňovaním prevažoval sitagliptín a pioglitazón v účinku na zmenu hodnoty HbA1c vzhľadom na východiskovú hodnotu.
Exenatid s predĺženým uvoľňovaním v porovnaní so sitagliptínom preukázal významne väčšie zníženie hmotnosti. Hmotnosť pacientov liečených pioglitazónom sa zvýšila (tabuľka 4).
Tabuľk
a 4: Výsledky 26-týždňovej štúdie s exenatidom s predĺženým uvoľňovaním v porovnaní so sitagliptínom a pioglitazónom v kombinácii s metformínom (ITT-pacienti)
Exenatid
s predĺženým uvoľňovaním
2 mg
Sitagliptín
100 mg
Pioglitazón
45 mg
n 160 166 165
Priemerná hodnota HbA1c (%)
Východiskové hodnoty 8,6 8,5 8,5
Zmena oproti východiskovej hodnote (± SE) -1,6 (± 0,1)* -0,9 (± 0,1)* -1,2 (± 0,1)*
Priemerný rozdiel oproti východiskovej
h
o
dnote medzi liečbami (95% CI) oproti sitagliptínu
Pri
e
mern
ý rozdiel oproti východiskovej hodnote medzi liečbami (95% CI) oproti pioglitazónu
Pacient
i (%) dosahujúci hodnotu
HbA
1
c
≤
7%
Zmena glukózy v sére nalačno (mmol/l) (± SE)
Priemerná telesná hmotnosť (kg)
-0,63 (-0,89; -0,37)**
-0,32 (-0,57; -0,06)*
62 36 49
-1,8 (± 0,2) -0,9 (± 0,2) -1,5 (± 0,2)
Východisková hodnota 89 87 88
Zmena oproti východiskovej hodnote(± SE) -2,3 (± 0,3) -0,8 (± 0,3) +2,8 (± 0,3)
Priemerný rozdiel oproti východiskovej
h
o
dnot
e medzi liečbami (95% CI) oproti sitagliptínu
Pri
e
mern
ý rozdiel oproti východiskovej hodnote medzi liečbami (95% CI) oproti pioglitazónu
-1,54 (-2,35; -0,72)*
-5,10 (-5,91; -4,28)**

SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval), *p <0,05;
**p <0,0001
V 28-týždňovej dvojito zaslepenej štúdii sa porovnával exenatid s predĺženým uvoľňovaním
v kombinácii s dapagliflozínom so samotným exenatidom s predĺženým uvoľňovaním a samotným dapagliflozínom u pacientov, ktorí užívali aj metformín. Vo všetkých liečebných skupinách došlo
k zníženiu hodnoty HbA1c oproti východiskovej hodnote. V liečebnej skupine s exenatidom
s predĺženým uvoľňovaním a dapagliflozínom sa preukázali významnejšie zníženia hodnôt HbA1c oproti východiskovej hodnote v porovnaní so skupinami s exenatidom s predĺženým uvoľňovaním samotným a samotným dapagliflozínom (tabuľka 5).
Kombinácia exenatidu s predĺženým uvoľňovaním a dapagliflozínu v porovnaní s liečivami samotnými preukázala významne väčšie zníženia hmotnosti (tabuľka 5).
Tabuľka 5: Výsledky jednej 28-týždňovej štúdie s exenatidom s predĺženým uvoľňovaním v kombinácii s dapagliflozínom v porovnaní so samotným exenatidom s predĺženým uvoľňovaním a samotným dapagliflozínom v kombinácii s metformínom (ITT-pacienti)
Exenatid s predĺženým
uvoľňovaní
m 2 mg QW
+
Dapagliflozí
n 10 mg QD
Exenatid
s predĺženým uvoľňovaním 2 mg QW
+ Placebo QD
Dapagliflozín
10 mg QD
+
Placebo QW
n 228 227 230
Pri
e
mern
á hodnota HbA
1c
(
%
)
Východisková hodnota 9,3 9,3 9,3
Zmena oproti východiskovej
hodnote (±SE)a -2,0 (± 0,1) -1,6 (± 0,1) -1,4 (± 0,1)
Priemerný rozdiel oproti
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
Pacienti (%) dosahujúci
-0,38*
(-0,63; -0,13)
-0,59**
(-0,84; -0,34)
h
o
d
n
ot
u HbA
1
c <7% 45 27 19
Priemerná zmena oproti východiskovej hodnote
plazmaticke
j glukózy nalačno (mmol/l) (±SE)a
Priemerný rozdiel oproti
-3,7 (± 0,2) -2,5 (± 0,2) -2,7 (± 0,2)
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
Priemerná zmena oproti východiskovej hodnote
-1,12**
(-1,55; -0,68)
-0,92**
(-1,36; -0,49)
plazmaticke
j glukózy 2 hodiny po jedle (mmol/l) (±SE) a
Priemerný rozdiel oproti
-4,9 (± 0,2) -3,3 (± 0,2) -3,4 (± 0,2)
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
Priemerná telesná hmotnosť
(kg)
-1,54**
(-2,10; -0,98)
-1.49**
(-2,04; -0,93)
Východisková hodnota 92 89 91
Zmena oproti východiskovej
hodnote (±SE)a -3,6 (± 0,3) -1,6 (± 0,3) -2,2 (± 0,3)
Priemerný rozdiel oproti
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
-2,00**
(-2,79; -1,20)
-1,33**
(-2,12; -0,55)

QW = jedenkrát týždenne (once weekly), QD = jedenkrát denne (once daily), SE = štandardná odchýlka (standard error), CI =interval spoľahlivosti (confidence interval), n = počet pacientov (number of patients).
a Upravené priemery najmenších štvorcov (least squares means, LS-priemery) a rozdiel(y) liečebnej
skupiny v zmene oproti východiskovým hodnotám v 28. týždni sú modelované použitím zmiešaného modelu s opakovanými meraniami (mixed model with repeated measures, MMRM), ktorý zahŕňa liečbu, región, stratifikáciu podľa východiskovej hladiny HbA1c (<9,0% alebo ≥9,0%), týždeň
a týždeň liečby s interakciami ako fixné faktory a východiskovú hodnotu ako kovariát.
*p <0,01, **p <0,001.
p-hodnoty sú všetky p-hodnoty upravené na multiplicitu.
Analýzy nezahŕňajú merania po podaní záchrannej liečby a po predčasnom prerušení podávania
skúšaného lieku.
V 28-týždňovej dvojito zaslepenej štúdii sa porovnával exenatid s predĺženým uvoľňovaním pridaný buď k samotnému inzulínu-glargín alebo ku kombinácii inzulínu-glargín s metformínom – s placebom pridaným buď k samotnému inzulínu-glargín alebo ku kombinácii inzulínu-glargín s metformínom. Inzulín-glargín bol dávkovaný s cieľom dosiahnuť hladinu plazmatickej glukózy nalačno 4,0 až
5,5 mmol/l (72 až 99 mg/dl). Exenatid s predĺženým uvoľňovaním preukázal superioritu oproti
placebu v znižovaní HbA1c z východiskovej hodnoty do 28. týždňa (tabuľka 6).
Exenatid s predĺženým uvoľňovaním preukázal superioritu oproti placebu v znižovaní telesnej hmotnosti v 28. týždni (tabuľka 6).
Tabuľka 6: Výsledky jednej 28-týždňovej štúdie s exenatidom s predĺženým uvoľňovaním v porovnaní s placebom v kombinácii buď s inzulínom-glargín samotným alebo
inzulínom-glargín spolu s metformínom (ITT-pacienti)
Exenatid s predĺženým
uvoľňovaní
m 2 mg
+ inzulín-glargína
Placebo
+ inzulín-glargína
n 230 228
Priemer HbA1c (%)
Východisková hodnota 8,5 8,5
Zmena oproti východiskovej hodnote (± SE)b -1,0 (±0,1) -0,2 (±0,1)
Priemerný rozdiel medzi liečbami v zmene z východiskovej hodnoty (95% CI)
-0,74*
(-0,94; -0,54)
Pacient
i (%), ktorí dosiahli HbA
1
c ≤7%c 33* 7
Priemerná telesná hmotnosť (kg)
Východisková hodnota 94 94
Zmena oproti východiskovej hodnote (± SE)b -1,0 (±0,3) 0,5 (±0,3)
Priemerný rozdiel medzi liečbami v zmene z východiskovej hodnoty (95% CI)
Zmena z východiskovej hodnoty plazmatickej glukózy 2 hodiny po jedle (mmol/l) (± SE)b,d Priemerný rozdiel medzi liečbami v zmene z východiskovej hodnoty (95% CI)
-1,52*
(-2,19; -0,85)
-1,6 (±0,3) -0,1 (±0,3)
-1,54*
(-2,17; -0,91)

n = počet pacientov v každej liečenej skupine, SE = štandardná odchýlka (standard error),
CI = interval spoľahlivosti (confidence interval), *p-hodnota <0,001 (upravená na multiplicitu).
a. Zmena priemerov najmenších štvorcov (least squares means, LS-priemery) priemernej dennej dávky inzulínu bola 1,6 jednotiek pre skupinu s exenatidom s predĺženým uvoľňovaním a 3,5 jednotiek pre skupinu s placebom.
b. Upravené priemery najmenších štvorcov (least squares means, LS-priemery) a rozdiel(y) liečebnej skupiny v zmene oproti východiskovým hodnotám v 28. týždni sú modelované použitím zmiešaného modelu s opakovanými meraniami (mixed model with repeated measures, MMRM), ktorý zahŕňa liečbu, región, stratifikáciu podľa východiskovej hladiny HbA1c (<9,0% alebo ≥9,0%), stratifikáciu podľa východiskového použitia sulfonylmočoviny (SU) (áno alebo nie), týždeň a týždeň liečby
s interakciami ako fixné faktory a východiskovú hodnotu ako kovariát. Absolútna zmena plazmatickej glukózy 2 hodiny po jedle v 28. týždni je modelovaná podobne použitím ANCOVA.
c. Všetci pacienti s chýbajúcimi údajmi koncových parametrov sú považovaní za nereagujúcich na liečbu.
d. Po štandardnom teste tolerancie jedla.
Analýzy nezahŕňajú merania po podaní záchrannej liečby a po predčasnom prerušení podávania skúšaného lieku.
Kardiovaskulárne hodnotenie
EXSCEL bola pragmatická štúdia sledujúca kardiovaskulárne (KV) výsledky u pacientov s diabetom
2. typu a akoukoľvek mierou KV rizika. Celkovo 14 752 pacientov bolo randomizovaných 1:1 na
2 mg exenatidu s predĺženým uvoľňovaním raz týždenne alebo placebo, pridané k bežnej zvyčajnej liečbe, ktorá môže zahŕňať inhibítory SGLT2. Pacienti boli sledovaní ako v bežnej klinickej praxi po dobu 38,7 mesiacov (medián) s mediánom trvania liečby 27,8 mesiacov. Vitálny status bol známy na konci štúdie u 98,9% pacientov s exenatidom s predĺženým uvoľňovaním a 98,8% pacientov s placebom. Priemerný vek pri vstupe do štúdie bol 62 rokov (8,5% pacientov vo veku ≥75 rokov). Približne 62% pacientov boli muži. Priemerný BMI bol 32,7 kg/m2 a priemerné trvanie diabetu bolo
13,1 rokov. Priemerné HbA1c bolo 8,1%. Približne 49,3% malo miernu poruchu funkcie obličiek (odhadovaná rýchlosť glomerulárnej filtrácie [eGFR] ≥60 až ≤89 ml/min/1,73 m2) a 21,6% malo stredne závažnú poruchu funkcie obličiek (eGFR ≥30 až ≤59 ml/min/1,73 m2). Celkovo 26,9% pacientov nemalo predtým KV príhodu, 73,1% malo predtým minimálne jednu KV príhodu.
Primárny ukazovateľ bezpečnosti (non-inferiorita) a účinnosti (superiorita) v štúdii EXSCEL bol čas do prvej potvrdenej závažnej nežiaducej kardiálnej príhody (MACE, Major Adverse Cardiac Event): úmrtie súvisiace s kardiovaskulárnym ochorením, nefatálny infarkt myokardu (IM) alebo nefatálna mozgová príhoda. Mortalita z akejkoľvek príčiny bola iniciálnym sekundárnym hodnoteným ukazovateľom.
Exenatid s predĺženým uvoľňovaním nezvyšoval kardiovaskulárne riziko u pacientov s diabetes mellitus 2. typu v porovnaní s placebom, keď bol pridaný k bežnej zvyčajnej liečbe (HR: 0,91; 95%
CI: 0,832, 1,004; P<0,001 pre non-inferioritu), pozri obrázok 1. Výsledky primárneho kombinovaného
a sekundárneho kardiovaskulárneho ukazovateľa sú uvedené na obrázku 2.
Obrázok 1: Čas do prvej posudzovanej MACE (pacienti so zámerom liečiť)Exenatid

Placebo

Exenatid vs placebo:
HR (95% CI) 0,91 (0,832; 1,004)
Exenatid
Počet pacientov s rizikom
Mesiace od randomizácie
Placebo
HR=pomer rizika, CI=interval spoľahlivosti
Obrázo
k 2: Blobbogram (Forest Plot): Analýza primárneho a sekundárneho ukazovateľa
(pacienti so zámerom liečiť)
AKS=akútny koronárny syndróm, CI=interval spoľahlivosti, KV=kardiovaskulárny, HF=zlyhanie srdca; HR=pomer rizika; MACE=závažná nežiaduca kardiálna príhoda; IM=infarkt myokardu; n=počet pacientov s príhodou; N=počet pacientov v liečenej skupine.
1 HR (aktívny/placebo) a CI na základe Coxovho regresného modelu proporčných rizík, stratifikované podľa KV príhody len s liečebnou skupinou ako vysvetľujúcou premennou.
Potreba ďalšej antihyperglykemickej liečby sa znížila o 33% v skupine s exenatidom s predĺženým uvoľňovaním (incidencia upravená na expozíciu 10,5 na 100 pacientorokov) v porovnaní s placebovou skupinou (incidencia upravená na expozíciu 15,7 na 100 pacientorokov). Zníženie HbA1c sa
pozorovalo počas trvania štúdie s celkovým rozdielom liečby -0,53% (exenatid s predĺženým uvoľňovaním oproti placebu).
Telesná hmotnosťVo všetkých štúdiách s exenatidom s predĺženým uvoľňovaním bol pozorovaný úbytok telesnej
hmotnosti v porovnaní s východiskovými hodnotami. V 4 komparátorom kontrolovaných štúdiách sa tento úbytok telesnej hmotnosti prejavil u pacientov liečených exenatidom s predĺženým uvoľňovaním bez ohľadu na výskyt nevoľnosti, hoci v skupine s nevoľnosťou bol tento úbytok väčší (priemerný úbytok –2,9 kg až –5,2 kg s nevoľnosťou verzus –2,2 kg až –2,9 kg bez nevoľnosti).
V 4 komparátorom kontrolovaných štúdiách sa podiel pacientov, u ktorých sa prejavilo aj zníženie hmotnosti aj HbA1c, pohyboval medzi 70 až 79% (podiel pacientov, u ktorých sa prejavilo zníženie HbA1c, sa pohyboval medzi 88 až 96%).
Plazmatická/sérováglukózaLiečba exenatidom s predĺženým uvoľňovaním mala za následok významné zníženie koncentrácií
plazmatickej/sérovej glukózy nalačno (hladovej), pričom toto zníženie bolo pozorované už vo 4. týždni. V placebom kontrolovanej štúdii s inzulínom-glargín bola zmena plazmatickej glukózy nalačno z východiskovej hodnoty do 28. týždňa -0,7 mmol/l pre skupinu s exenatidom s predĺženým uvoľňovaním a -0,1 mmol/l pre skupinu s placebom.
Bolo tiež pozorované ďalšie zníženie postprandiálnych koncentrácií. Zlepšenie koncentrácií hladovej plazmatickej/sérovej glukózy vydržalo 52 týždňov.
Funkciabeta-buniekKlinické štúdie s exenatidom s predĺženým uvoľňovaním preukázali zlepšenie funkcie beta-buniek pri použití homeostatického modelu (HOMA-B). Tento účinok na funkciu beta-buniek pretrvával 52 týždňov.
Krvný
tlak
V 4 komparátorom kontrolovaných štúdiách s exenatidom s predĺženým uvoľňovaním bolo
pozorované zníženie systolického krvného tlaku (2,9 mmHg až 4,7 mmHg). V 30-týždňovej porovnávacej štúdii s exenatidom s okamžitým uvoľňovaním obidva lieky, exenatid s predĺženým uvoľňovaním aj exenatid s okamžitým uvoľňovaním, signifikantne znížili systolický krvný tlak
v porovnaní s východiskovou hodnotou (4,7 ± 1,1 mmHg a 3,4 ± 1,1 mmHg v danom poradí); rozdiel medzi týmito dvoma liečebnými postupmi nebol signifikantný. Zlepšenie krvného tlaku sa udržalo počas 52 týždňov.
V placebom kontrolovanej štúdii s inzulínom-glargín bola zmena systolického krvného tlaku z východiskovej hodnoty do 28. týždňa -2,6 mmHg pre skupinu s exenatidom s predĺženým uvoľňovaním a -0,7 mmHg pre skupinu s placebom.
Liečba exenatidom s predĺženým uvoľňovaním v kombinácii s dapagliflozínom v 28. týždni viedla
k významnej priemernej zmene zníženia systolického krvného tlaku o 4,3 ± 0,8 mmHg v porovnaní so samotným exenatidom s predĺženým uvoľňovaním o -1,2 ± 0,8 mmHg (p <0,01) alebo samotným dapagliflozínom o -1,8 ± 0,8 mmHg (p <0,05).
Hladiny lipidov nalačno
Exenatid s predĺženým uvoľňovaním nevykazuje žiadne negatívne účinky na parametre lipidov.
Pediatrickápopulácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s exenatidom s predĺženým uvoľňovaním v jednej alebo vo viacerých podskupinách pediatrickej populácie
s diabetes mellitus 2. typu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpčné vlastnosti exenatidu odzrkadľujú vlastnosti predĺženého uvoľňovania exenatidu
s predĺženým uvoľňovaním. Potom, čo sa absorbuje v krvnom obehu, exenatid sa distribuuje
a vylučuje podľa známych systémových farmakokinetických vlastností (ako je to popísané v tejto časti).
Absorpcia
Po týždennom podávaní 2 mg exenatidu s predĺženým uvoľňovaním prekračovali priemerné koncentrácie exenatidu v priebehu 2 týždňov minimálne účinné koncentrácie (~ 50 pg/ml) a priemerné plazmatické koncentrácie exenatidu sa postupne zvyšovali v priebehu 6 až 7 týždňov. Následne sa dosiahli koncentrácie exenatidu približne 151 - 265 pg/ml, čo naznačuje, že bol dosiahnutý
rovnovážny stav. Počas jednotýždňového intervalu medzi dávkami sa udržiavajú stabilné koncentrácie
exenatidu, s minimálnymi výkyvmi nahor alebo nadol od priemernej terapeutickej koncentrácie.
Distribúcia
Priemerný zdanlivý distribučný objem exenatidu po subkutánnej aplikácii jednotlivej dávky exenatidu
je 28 litrov.
Biotransformácia a eliminácia
Predklinické štúdie ukázali, že exenatid je prednostne vylučovaný glomerulárnou filtráciou
s následnou proteolytickou degradáciou. Priemerný zdanlivý klírens exenatidu je 9 l/h. Tieto farmakokinetické vlastnosti exenatidu nie sú závislé na dávke. Stredné plazmatické koncentrácie exenatidu klesnú pod detekovateľnú hranicu približne 10 týždňov po ukončení liečby exenatidom s predĺženým uvoľňovaním.
Osobitné skupiny pacientov
Porucha funkcie obličiek
Farmakokinetické populačné analýzy pacientov s poruchou funkcie obličiek, ktorí boli liečení 2 mg exenatidu s predĺženým uvoľňovaním, naznačili zvýšenie systémovej expozície približne o 74%
a 23% (odhad strednej hodnoty v každej skupine) u pacientov so stredne závažnou (N=10) a miernou (N=56) poruchou funkcie obličiek, v porovnaní s pacientmi s normálnymi renálnymi funkciami (N=84).
Insuficiencia pečene
Neuskutočnila sa žiadna farmakokinetická štúdia u pacientov s insuficienciou pečene. Exenatid je
eliminovaný predovšetkým obličkami, preto by dysfunkcia pečene nemala ovplyvňovať koncentrácie exenatidu v krvi.
Pohlavie, rasa a telesná hmotnosť
Pohlavie, rasa a telesná hmotnosť nemajú klinicky relevantný vplyv na farmakokinetiku exenatidu.
Starší pacienti
Údaje o starších pacientoch sú obmedzené, ale nenaznačujú žiadne výrazné zmeny v expozícii exenatidu s narastajúcim vekom až do veku okolo 75 rokov.
Vo farmakokinetickej štúdii s exenatidom s okamžitým uvoľňovaním u pacientov s diabetom 2. typu podanie exenatidu (10 µg) viedlo k priemernému zvýšeniu AUC exenatidu o 36% u 15 starších pacientov vo veku 75 až 85 rokov v porovnaní s 15 pacientmi vo veku 45 až 65 rokov, čo pravdepodobne súvisí so zníženou renálnou funkciou u vekovo staršej skupiny (pozri časť 4.2).
Pediatrická populácia
Vo farmakokinetickej štúdii s podaním jednotlivej dávky exenatidu s okamžitým uvoľňovaním u 13
pacientov s diabetom 2. typu vo veku 12 až 16 rokov malo podanie exenatidu (5 mg) za následok mierne zníženie priemernej hodnoty AUC (nižšia o 16%) a Cmax (nižšia o 25%) v porovnaní
s hodnotami pozorovanými u dospelých. V pediatrickej populácii sa doteraz neuskutočnila žiadna farmakokinetická štúdia s exenatidom s predĺženým uvoľňovaním.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní a genotoxicity, uskutočnených s exenatidom s okamžitým uvoľňovaním alebo s exenatidom s predĺženým uvoľňovaním, neodhalili žiadne osobitné riziko pre ľudí.
U potkanov a myší sa pri dlhodobo účinkujúcich agonistoch GLP-1 receptorov pozorovali nádory štítnej žľazy. V 2-ročnej štúdii karcinogenity u potkanov sa pri exenatide s predĺženým uvoľňovaním pozoroval zvýšený výskyt adenómov C-buniek a karcinómov C-buniek pri dávkach ≥2-násobok systémovej expozície u ľudí na základe AUC. Klinický význam týchto zistení nie je v súčasnosti známy.
Štúdie s exenatidom na zvieratách nepreukázali škodlivé účinky na fertilitu; vysoké dávky exenatidu spôsobovali poruchy vývoja kostry a spomalenie fetálneho a neonatálneho rastu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
poly(D,L-laktid-ko-glykolid)
sacharóza
Disperzné prostredie sodná soľ karmelózy chlorid sodný polysorbát 20
monohydrát dihydrogenfosforečnanu sodného
heptahydrát fosforečnanu disodného voda na injekcie
hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
3 roky
Po príprave suspenzie
Suspenzia sa musí injikovať bezprostredne po zmiešaní prášku a disperzného prostredia.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C) Neuchovávajte v mrazničke.
Perá sa pred použitím môžu uchovávať 4 týždne pri teplote do 30 ºC. Na konci tohto obdobia sa musí pero použiť alebo zlikvidovať.
Uchovávajte v pôvodnom obale na ochranu pred svetlom. Podmienky na uchovávanie po zmiešaní lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Každé dvojkomorové pero obsahuje prášok exenatidu a disperzné prostredie v sklenenej náplni typu 1 uzatvorenej na jednom konci chlórobutylovou gumovou zátkou a hliníkovým uzáverom a na druhom konci chlórobutylokaučukovým piestom. Dve komory sú od seba oddelené druhým chlórobutylokaučukovým piestom. K peru je priložená jedna ihla. Každá škatuľka obsahuje jednu náhradnú ihlu. Používajte s perom len priložené ihly.
Veľkosť balenia: 4 jednodávkové naplnené perá a viacnásobné balenie obsahujúce 12 (3 balenia po 4)
jednodávkové naplnené perá.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Naplnené pero je určené len na jednorazové použitie.
Pero sa musí vybrať z chladničky minimálne 15 minút pred aplikáciou. Prášok v jednej komore sa musí zmiešať s disperznými prostredím v druhej komore naplneného pera. Disperzné prostredie treba pred použitím vizuálne skontrolovať. Disperzné prostredie sa môže použiť iba vtedy, ak je číre
a neobsahuje žiadne častice. Po príprave suspenzie sa má zmes použiť iba vtedy, ak je zmes biela až sivobiela a zakalená. Ďalšie informácie o suspenzii a podaní nájdete v písomnej informácii pre používateľa a v Návode na použitie.
Používajte len ihly priložené k peru.
Exenatid s predĺženým uvoľňovaním sa musí aplikovať subkutánne hneď po zmiešaní prášku a disperzného prostredia.
Exenatid s predĺženým uvoľňovaním, ktorý bol zmrazený, sa nesmie používať.
Pacient má byť poučený, ako po každej aplikácii bezpečne zlikvidovať pero s pripojenou ihlou.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAstraZeneca AB
SE-151 85 Södertälje
Švédsko
8. REGISTRAČNÉ ČÍSLAEU/1/11/696/003-004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 17. júna 2011
Dátum posledného predĺženia registrácie: 18. februára 2016
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
1. NÁZOV LIEKU
Bydureon 2 mg injekčná suspenzia s predĺženým uvoľňovaním v naplnenom pere
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každé naplnené pero dodá dávku 2 mg exenatidu v 0,85 ml. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčná suspenzia s predĺženým uvoľňovaním v naplnenom pere (BCise). Biela až sivobiela nepriehľadná suspenzia.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Bydureon je indikovaný dospelým vo veku 18 rokov a starším s diabetes mellitus 2. typu na zlepšenie kontroly glykémie v kombinácii s inými liekmi znižujúcimi hladinu glukózy vrátane bazálneho inzulínu, keď súčasná liečba spolu s diétou a pohybovou aktivitou neposkytujú dostatočnú kontrolu glykémie.
Výsledky štúdie pokiaľ ide o kombinácie, vplyv na glykemickú kontrolu a kardiovaskulárne účinky a skúmané populácie, pozri časť 4.4, 4.5 a 5.1.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Odporúčaná dávka je 2 mg exenatidu raz týždenne.
Pacienti, ktorí prechádzajú z exenatidu s okamžitým uvoľňovaním (Byetta) na exenatid s predĺženým uvoľňovaním (Bydureon alebo Bydureon BCise), môžu pozorovať prechodné zvýšenie hodnôt koncentrácie krvnej glukózy, čo sa obvykle upraví v prvých štyroch týždňoch po začiatku liečby. Pacienti, ktorí prechádzajú z jedného exenatidu s predĺženým uvoľňovaním na iný exenatid
s predĺženým uvoľňovaním (Bydureon alebo Bydureon BCise), tak môžu urobiť bez akéhokoľvek očakávaného významného účinku na koncentrácie glukózy v krvi.
Ak sa exenatid s predĺženým uvoľňovaním pridáva k existujúcej liečbe metformínom a/alebo tiazolidíndiónom, je možné pokračovať v doterajšom dávkovaní metformínu a/alebo tiazolidíndiónu. Ak sa pridáva k liečbe sulfonylmočovinou, je potrebné zvážiť zníženie dávky sulfonylmočoviny, aby sa znížilo riziko hypoglykémie (pozri časť 4.4).
Exenatid s predĺženým uvoľňovaním sa má podávať raz týždenne, v rovnaký deň. Deň podávania
lieku možno v prípade potreby zmeniť, pokiaľ bola posledná dávka podaná minimálne tri dni predtým.
Exenatid s predĺženým uvoľňovaním sa môže podať kedykoľvek počas dňa, s jedlom alebo bez jedla.
V prípade vynechania dávky je potrebné vynechanú dávku podať ihneď ako je to možné, za predpokladu, že ďalšia pravidelná plánovaná dávka sa má podať o 3 alebo viac dní. Potom sa môžu pacienti vrátiť k ich zvyčajnému dávkovaciemu režimu jedenkrát týždenne.
Ak sa dávka vynechá a ďalšia pravidelná plánovaná dávka sa má podať o 1 alebo 2 dni neskôr, pacient si vynechanú dávku nemá podať, ale namiesto toho má pokračovať v liečbe exenatidom s predĺženým uvoľňovaním v deň ďalšej pravidelnej plánovanej dávky.
Používanie tohto lieku nevyžaduje ďalšiu samokontrolu. Samokontrola hladiny glukózy v krvi je potrebná kvôli úprave dávky sulfonylmočoviny a inzulínu, najmä ak sa začína liečba exenatidom s predĺženým uvoľňovaním a dávka inzulínu sa znižuje. Odporúča sa postupné znižovanie dávky inzulínu.
Ak sa po prerušení liečby exenatidom s predĺženým uvoľňovaním začne liečba iným liekom znižujúcim hladinu glukózy, treba mať na zreteli predĺžené uvoľňovanie lieku (pozri časť 5.2).
Osobitné skupiny pacientov
Starší pacienti
Nie je potrebná žiadna úprava dávky v závislosti od veku. Avšak vo všeobecnosti sa so zvyšujúcim vekom funkcia obličiek znižuje, preto treba brať do úvahy renálne funkcie pacienta (pozri časť Porucha funkcie obličiek) (pozri časť 5.2).
Porucha funkcie obličiek
Nie je potrebná žiadna úprava dávky u pacientov s miernou poruchou funkcie obličiek (klírens
kreatinínu 50 – 80 ml/min). Klinické skúsenosti u pacientov so stredne závažnou poruchou funkcie obličiek (klírens kreatinínu 30 – 50 ml/min) sú obmedzené. Týmto pacientom sa neodporúča používať exenatid s predĺženým uvoľňovaním.
Podávanie exenatidu s predĺženým uvoľňovaním sa neodporúča u pacientov v terminálnom štádiu renálneho ochorenia alebo so závažnou poruchou funkcie obličiek (klírens kreatinínu <30 ml/min) (pozri časť 4.4).
Porucha funkcie pečene
Nie je potrebná žiadna úprava dávky u pacientov s poruchou funkcie pečene (pozri časť 5.2).
Pediatrická populácia
Bezpečnosť a účinnosť exenatidu s predĺženým uvoľňovaním u detí a dospievajúcich vo veku do 18
rokov neboli doteraz stanovené. V súčasnosti dostupné údaje sú opísané v časti 5.2, ale neumožňujú uviesť odporúčania na dávkovanie.
Spôsobpodávania
Subkutánne použitie
Exenatid s predĺženým uvoľňovaním si pacient podáva sám. Každé pero je určené len pre jedného pacienta a na jedno použitie.
Pred začatím podávania exenatidu s predĺženým uvoľňovaním sa dôrazne odporúča, aby lekár nacvičil podávanie s pacientmi a ich ošetrovateľmi. Je potrebné postupovať opatrne podľa „Návodu na použitie“, ktorý je súčasťou balenia.
Každá dávka lieku sa podáva ako subkutánna injekcia do brucha, stehna alebo zadnej časti ramena ihneď po úplnom zmiešaní lieku.
V prípade podávania s inzulínom sa exenatid s predĺženým uvoľňovaním a inzulín musia podávať vo forme dvoch samostatných injekcií.
Pokyny na prípravu lieku pred podaním, pozri časť 6.6 a „Návod na použitie“.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.
4 Osobitné upozornenia a opatrenia pri používaní
Exenatid s predĺženým uvoľňovaním sa nemá používať u pacientov s diabetes mellitus 1. typu alebo na liečbu diabetickej ketoacidózy.
Exenatid s predĺženým uvoľňovaním nie je náhrada za inzulín. U pacientov závislých od inzulínu bola po náhlom prerušení podávania alebo znížení dávky inzulínu hlásená diabetická ketoacidóza (pozri časť 4.2).
Exenatid s predĺženým uvoľňovaním sa nesmie podávať intravenózne alebo intramuskulárne. Porucha funkcie obličiek
U pacientov v terminálnom štádiu renálneho ochorenia, ktorí sú liečení dialýzou, jednotlivé dávky exenatidu s okamžitým uvoľňovaním zvyšovali frekvenciu a závažnosť nežiaducich gastrointestinálnych účinkov; preto sa použitie liekových foriem exenatidu s predĺženým uvoľňovaním neodporúča u pacientov v terminálnom štádiu renálneho ochorenia alebo so závažnou poruchou
funkcie obličiek (klírens kreatinínu <30 ml/min). Klinické skúsenosti u pacientov so stredne závažnou poruchou funkcie obličiek sú obmedzené, preto sa im podávanie exenatidu s predĺženým uvoľňovaním neodporúča.
U exenatidu boli menej často hlásené prípady zmenenej renálnej funkcie, vrátane zvýšeného sérového kreatinínu, poruchy funkcie obličiek, zhoršenia chronického renálneho zlyhania a akútneho renálneho zlyhania, niekedy vyžadujúceho hemodialýzu. Niektoré z týchto prípadov sa objavili u pacientov,
u ktorých sa vyskytli stavy, ktoré môžu ovplyvniť hydratáciu, vrátane nevoľnosti, vracania, a/alebo
hnačky a/alebo u pacientov užívajúcich lieky ovplyvňujúce funkciu obličiek/stav hydratácie. Súbežne podávané lieky zahŕňali inhibítory angiotenzín-konvertujúceho enzýmu, antagonistov angiotenzínu II, nesteroidové protizápalové lieky a diuretiká. Reverzibilita zmenenej funkcie obličiek sa pozorovala pri podpornej liečbe a pri vysadení potenciálne príčinných liečiv, vrátane exenatidu.
Závažné gastrointestinálne ochorenie
Exenatid s predĺženým uvoľňovaním sa doteraz neskúmal u pacientov so závažným
gastrointestinálnym ochorením, vrátane gastroparézy. Podávanie tohto lieku je obyčajne spojené s nežiaducimi gastrointestinálnymi účinkami, vrátane nevoľnosti, vracania a hnačky. Preto sa podávanie tohto lieku neodporúča u pacientov so závažným gastrointestinálnym ochorením.
Akútnapankreatitída
Použitie agonistov GLP-1 receptorov je spojené s rizikom vzniku akútnej pankreatitídy. V klinických štúdiách s Bydureonom BCise sa akútna pankreatitída vyskytla u 0,4% pacientov. Spontánne boli hlásené prípady akútnej pankreatitídy s exenatidom s predĺženým uvoľňovaním. Vyliečenie pankreatitídy sa pozorovalo po podpornej liečbe, veľmi zriedkavo však boli hlásené prípady nekrotizujúcej alebo hemoragickej pankreatitídy a/alebo úmrtie. Pacienti majú byť informovaní
o charakteristických príznakoch akútnej pankreatitídy: pretrvávajúcej, závažnej bolesti brucha. Pri podozrení na pankreatitídu sa má tento liek vysadiť; v prípade, že je akútna pankreatitída potvrdená v liečbe sa nesmie pokračovať. U pacientov s anamnézou pankreatitídy sa odporúča postupovať opatrne.
Súbežné použitie iných liekov
Súbežné použitie liekových foriem exenatidu s predĺženým uvoľňovaním s derivátmi D-fenylalanínu
(meglitinidmi), alfa-glukozidázovými inhibítormi, inhibítormi dipeptidyl peptidázy-4 alebo inými agonistami GLP-1 receptora sa doteraz neskúmalo. Súbežné použitie liekovej formy exenatidu
s predĺženým uvoľňovaním a exenatidu s okamžitým uvoľňovaním sa doteraz neskúmalo, a preto sa
neodporúča.
Interakcia s warfarínom
Pri súbežnom užívaní warfarínu a exenatidu boli spontánne hlásené prípady zvýšeného INR
(International Normalized Ratio - Medzinárodný normalizovaný pomer), niekedy spojeného s krvácaním (pozri časť 4.5).
Hypoglykémia
Riziko hypoglykémie bolo v klinických štúdiách vyššie pri použití exenatidu s predĺženým uvoľňovaním v kombinácii so sulfonylmočovinou. V klinických štúdiách pacienti s miernou poruchou funkcie obličiek užívajúci sulfonylmočovinu v kombinácii mali zvýšený výskyt hypoglykémie
v porovnaní s pacientmi s normálnou funkciou obličiek. Aby sa znížilo riziko hypoglykémie
v súvislosti s užívaním sulfonylmočoviny, je potrebné zvážiť redukciu dávky sulfonylmočoviny.
Rýchly úbytok hmotnosti
U pacientov liečených exenatidom sa zaznamenal rýchly úbytok hmotnosti v priemere >1,5 kg za týždeň. Takýto úbytok hmotnosti môže mať škodlivé dôsledky. U pacientov s prudkým znížením hmotnosti sa majú sledovať príznaky a prejavy cholelitiázy.
Prerušenie liečby
Po prerušení liečby môže pretrvať účinok exenatidu s predĺženým uvoľňovaním, pretože plazmatická hladina exenatidu klesá počas 10 týždňov. Pri výbere iného lieku a nastavení jeho dávky treba mať tento fakt na zreteli, keďže nežiaduce účinky môžu pretrvávať a účinnosť môže, hoci iba čiastočne, pokračovať až do úplného zníženia hladín exenatidu.
4.5 Liekové a iné interakcie
Sulfonylmočovina
Môže byť potrebné upraviť dávku sulfonylmočoviny, pretože pri liečbe sulfonylmočovinou sa zvyšuje riziko hypoglykémie (pozri časti 4.2 a 4.4).
Vyprázdňovaniežalúdka
Výsledky štúdie využívajúcej paracetamol ako marker vyprázdňovania žalúdka naznačujú, že vplyv exenatidu s predĺženým uvoľňovaním na spomalenie vyprázdňovania žalúdka je mierny
a nepredpokladá sa, že by mohol spôsobovať klinicky významné zníženie rýchlosti ani rozsahu absorpcie súbežne užívaných perorálnych liekov. Preto nie sú potrebné žiadne úpravy dávkovania perorálnych liekov citlivých na spomalené vyprázdňovanie žalúdka.
Pri podaní 1 000 mg paracetamolu vo forme tabliet, s jedlom alebo bez jedla, po 14 týždňoch liečby exenatidom s predĺženým uvoľňovaním, neboli v AUC paracetamolu v porovnaní s kontrolným obdobím pozorované žiadne významné zmeny. Cmax paracetamolu bola znížená o 16% (nalačno)
a o 5% (s jedlom) a tmax bola zvýšená z približne 1 hodiny v kontrolnej perióde na 1,4 hodiny
(nalačno) a 1,3 hodiny (s jedlom).
Nasledujúce štúdie interakcií sa uskutočnili s použitím 10 μg exenatidu s okamžitým uvoľňovaním, ale nie s liekovými formami exenatidu s predĺženým uvoľňovaním.
Warfarín
Pri podaní warfarínu 35 minút po podaní exenatidu s okamžitým uvoľňovaním sa tmax predĺžila asi o 2 hodiny. Neboli pozorované žiadne klinicky významné účinky na Cmax alebo AUC. Zvýšený INR bol spontánne hlásený pri súbežnom užívaní warfarínu a exenatidu s predĺženým uvoľňovaním. INR sa má monitorovať na začiatku liečby exenatidom s predĺženým uvoľňovaním u pacientov liečených warfarínom a/alebo derivátmi kumarolu (pozri časti 4.4 a 4.8).
Inhibítory HMG CoA reduktázy
Hodnoty AUC a Cmax lovastatínu boli znížené približne o 40% resp. 28%, a tmax bola predĺžená približne o 4 hodiny pri podaní exenatidu s okamžitým uvoľňovaním súbežne s jednou dávkou lovastatínu (40 mg) v porovnaní s podaním lovastatínu samostatne. V 30-týždňových placebom kontrolovaných klinických štúdiách s exenatidom s okamžitým uvoľňovaním nebolo súbežné podávanie exenatidu a inhibítorov HMG CoA reduktázy spojené so stabilnými zmenami v lipidovom profile (pozri časť 5.1). Nie je potrebná žiadna vopred stanovená úprava dávkovania; ale lipidový profil sa má pravidelne monitorovať.
Digoxín
a lizinopril
V štúdiách interakcií účinku exenatidu s okamžitým uvoľňovaním na digoxín a lizinopril neboli pozorované žiadne klinicky relevantné účinky na Cmax alebo AUC, ale pozorovalo sa posunutie tmax približne o 2 hodiny.
Etinylestradiol a levonorgestrel
Podanie kombinovaných perorálnych kontraceptív (30 µg etinylestradiolu a 150 µg levonorgestrelu) hodinu pred podaním exenatidu s okamžitým uvoľňovaním neovplyvnilo AUC, Cmax alebo Cmin etinylestradiolu ani levonorgestrelu. Podanie perorálnych kontraceptív 35 minút po podaní exenatidu neovplyvnilo AUC, ale malo za následok zníženie Cmax etinylestradiolu o 45% a Cmax levonorgestrelu o 27-41% a predĺžilo tmax o 2-4 hod. v dôsledku spomaleného vyprázdňovania žalúdka. Zníženie Cmax má obmedzený klinický význam a úprava dávky perorálnych kontraceptív nie je potrebná.
Pediatrickápopulácia
Interakčné štúdie s exenatidom sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy v reprodukčnom veku
Ženy v reprodukčnom veku by mali počas liečby exenatidom s predĺženým uvoľňovaním užívať
kontraceptíva kvôli dlhému polčasu eliminácie exenatidu s predĺženým uvoľňovaním. Tento liek sa má vysadiť aspoň 3 mesiace pred plánovanou graviditou.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití exenatidu s predĺženým uvoľňovaním u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko u ľudí. Exenatid s predĺženým uvoľňovaním nesmie byť podávaný počas gravidity a odporúča sa podávanie inzulínu.
Dojčenie
Nie je známe, či sa exenatid vylučuje do materského mlieka u ľudí. Exenatid s predĺženým uvoľňovaním sa nemá užívať počas dojčenia.
Fertilita
Neuskutočnili sa žiadne štúdie fertility u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Exenatid s predĺženým uvoľňovaním má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pri podávaní v kombinácii so sulfonylmočovinou je potrebné upozorniť pacientov, aby podnikli opatrenia na zabránenie vzniku hypoglykémie počas riadenia vozidiel a obsluhy strojov.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Najčastejšie nežiaduce reakcie počas klinických štúdií boli gastrointestinálneho charakteru (najmä nevoľnosť (8%), ktorá pri pokračovaní liečby zvyčajne vymizla), bolesť hlavy (4%) a reakcie v mieste vpichu injekcie, ako napríklad pruritus v mieste vpichu injekcie (3%) a erytém v mieste vpichu
injekcie (2%). Okrem toho sa veľmi často objavila hypoglykémia so sulfonylmočovinou (pozri nižšie, Popis vybraných nežiaducich reakcií). Väčšina nežiaducich reakcií bola slabej až miernej intenzity.
Tabuľkový zoznam nežiaducich reakcií
V tabuľke 1 sú zhrnuté frekvencie nežiaducich reakcií Bydureonu BCise identifikovaných z klinických štúdií.
Súbor údajov zo združených klinických štúdií s Bydureonom BCise zahŕňa dve komparátorom kontrolované štúdie fázy 3 s trvaním 6 až 12 mesiacov. V súbore sú zahrnuté fázy sledovania
a rozšírenia štúdií. Základná liečba zahŕňala diétu a cvičenie samostatne alebo s metformínom, sulfonylmočovinu, tiazolidíndión alebo kombináciu perorálnych liekov znižujúcich hladinu glukózy. Nežiaduce reakcie, ktoré sa pozorovali pri exenatide s predĺženým uvoľňovaním, ale nepozorovali sa v klinických štúdiách s Bydureonom BCise, sú tiež zahrnuté v tabuľke 1.
Základná liečba v klinických štúdiách s exenatidom s predĺženým uvoľňovaním zahŕňala diétu
a cvičenie, metformín, sulfonylmočovinu, tiazolidíndión, kombináciu perorálnych liekov znižujúcich hladinu glukózy alebo bazálny inzulín.
Reakcie sú uvedené nižšie podľa uprednostňovaných názvov MedDRA a zoradené podľa tried orgánových systémov a podľa absolútnej frekvencie. Frekvencie výskytu sú definované nasledovne: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (z dostupných údajov).
Tabuľka 1: Nežiaduce reakcie Bydureonu BCise zistené v klinických štúdiách
Tried
y orgánových systémov / názvy nežiaducich reakcií
Veľmi časté
Frekvencia výskytu1
Časté Menej časté Zriedkavé Veľmi zriedkavé
Neznáme
Poruch
y imunitného systému
Anafylaktická reakcia2 X
Poruchy metabolizmu a výživyHypoglykémia (so X
sulfonylmočovinou)5,6,
7
Hypoglykémia (bez X
sulfonylmočoviny)5,6,7
Hypoglykémia X (s inzulínom)3,4,5
Znížená chuť do jedla X Dehydratácia X
Poruchy nervového systémuBolesť hlavy X

Závraty X
Dysgeúzia X Somnolencia2 X
Poruchy gastrointestinálneho traktuNevoľnosť5 X
Hnačka X Vracanie X Zápcha X Dyspepsia X
Gastroezofageálny X
reflux
Abdominálna distenzia X Abdominálna bolesť X
Plynatosť X
Akútna pankreatitída X (pozri časť 4.4)
Eruktácia2 X
Intestinálna X
obštrukcia2
Poruchy kože a podkožného tkanivaUrtikária X

Hyperhidróza X
Makulárna alebo X
papulárna vyrážka
Pruritus X Alopécia2 X
Angioedém9 X
Abscesy v mieste X
vpichu a celulitída9
Poruchy obličiek a močových ciestAlterovaná funkcia X
obličiek8
Celkové poruchy a reakcie v mieste podaniaPruritus v mieste X
podania injekcie5
Erytém v mieste X
podania injekcie5
Únava X
Reakcia v mieste X
podania injekcie5
Asténia X
Vyrážka v mieste X
podania injekcie5
Pocit nepokoja2 X
Laboratórne a funkčné vyšetreniaZvýšený X
medzinárodný normalizovaný pomer9 (pozri časť 4.4)
1 Výskyt na základe ukončených dlhodobých štúdií účinnosti a bezpečnosti (n = 526), pokiaľ nie je uvedené inak. Zahŕňa sledovanie v priebehu sedemdesiatich dní po podaní poslednej dávky a obdobie rozšírenia.
2 Výskyt na základe dvanástich ukončených dlhodobých štúdií účinnosti a bezpečnosti exenatidu
s predĺženým uvoľňovaním s celkovým n = 2 868.
3 Na základe hypoglykemických udalostí, ktoré: 1. mali za následok stratu vedomia, záchvat alebo kómu, ktorá ustúpila po podaní glukagónu alebo glukózy ALEBO 2. vyžadovali pomoc tretej strany
z dôvodu poruchy vedomia alebo správania a bola pri nich hodnota glukózy <54 mg/dl (3 mmol/l) ALEBO 3. mali za následok príznaky zhodujúce sa s hypoglykémiou pri hladine glukózy <54 mg/dl (3 mmol/l) pred liečbou.
4 Frekvencia hlásená z obdobia 28-týždňovej kontrolovanej liečby exenatidom s predĺženým
uvoľňovaním ako prídavnej liečby v rámci štúdie s inzulínom-glargín (n = 231).
5 Pozri nižšie, Popis vybraných nežiaducich reakcií.
6 Frekvencie hlásené v združených údajoch z kontrolných období dvoch klinických skúšaní fázy 3
(n = 410).
7 Na základe hypoglykemických udalostí, ktoré majú príznaky zhodujúce sa s hypoglykémiou pri hladine glukózy <54 mg/dl (3 mmol/l) pred liečbou.
8 Zahŕňa akútne zlyhanie obličiek, zhoršené chronické zlyhávanie obličiek, poruchu funkcie obličiek,
zvýšenie kreatinínu v sére. Pozri časť 4.4.
9 Výskyt na základe údajov zo spontánnych hlásení s exenatidom s predĺženým uvoľňovaním
(neznáma frekvencia výskytu).
Popis vybraných nežiaducich reakciíHypoglykémiaPri Bydureone BCise sa nevyskytli žiadne udalosti závažnej hypoglykémie. Celková incidencia miernej hypoglykémie bola 6,3%. Táto incidencia sa zvýšila pri jeho používaní v kombinácii so sulfonylmočovinou (26,1%) v porovnaní bez sulfonylmočoviny (0,9%) (pozri časť 4.4). Pre zníženie
rizika hypoglykémie súvisiacej s užívaním sulfonylmočoviny by sa malo zvážiť zníženie dávky sulfonylmočoviny (pozri časti 4.2 a 4.4).
Po pridaní exenatidu s predĺženým uvoľňovaním k bazálnemu inzulínu nebola potrebná žiadna úprava úvodnej dávky inzulínu. Exenatid s predĺženým uvoľňovaním v kombinácii s bazálnym inzulínom nepreukázal v porovnaní s inzulínom žiadne klinicky významné rozdiely v incidencii hypoglykemických epizód. V skupine s exenatidom s predĺženým uvoľňovaním v kombinácii
s inzulínom sa nezaznamenali žiadne epizódy závažnej hypoglykémie.
Nevoľnosť
Najčastejšie zaznamenanou nežiaducou gastrointestinálnou reakciou bola nevoľnosť. Počas kontrolného obdobia klinickej štúdie porovnávajúcej Bydureon BCise s exenatidom s okamžitým uvoľňovaním sa nevoľnosť hlásila u 9,6% a 20,5% pacientov v jednotlivých skupinách. Celkovo
u 9,3% pacientov liečených Bydureonom BCise sa zaznamenala nevoľnosť počas kontrolného obdobia oboch klinických štúdií. Väčšina epizód nevoľnosti bola mierna až stredne závažná, spájala sa so začatím liečby a jej frekvencia postupne klesala.
Reakcie v mieste podania injekcie
Počas kontrolného obdobia klinických štúdií sa reakcie v mieste podania injekcie zaznamenali častejšie u pacientov liečených Bydureonom BCise než u pacientov liečených komparátorom (24% oproti 4% pri exenatide s okamžitým uvoľňovaním). Tieto reakcie v mieste podania injekcie boli obvykle mierne a väčšinou neviedli k ukončeniu skúšanej liečby. Pacienti môžu byť ošetrení za účelom zmiernenia príznakov, zatiaľ čo sa pokračuje v liečbe. Nasledujúce injekcie sa majú potom podávať každý týždeň do iného miesta. V rámci skúseností po uvedení exenatidu s predĺženým uvoľňovaním na trh sa zaznamenali prípady abscesov v mieste vpichu a celulitída.
Podkožné uzlíky v mieste podania boli v klinických štúdiách pozorované často a súviseli so známymi vlastnosťami mikrosférických liekových foriem polyméru poly(D,L-laktid-ko-glykolid). Väčšina jednotlivých uzlíkov nemala vplyv na účasť v štúdii a vymizla v priebehu času.
Imunogenita
V súlade s potenciálne imunogénnymi vlastnosťami liekov na báze proteínov a peptidov sa
u pacientov po liečbe exenatidom s predĺženým uvoľňovaním môžu vyvinúť protilátky proti
exenatidu.
U približne 42% pacientov sa vyvinuli nízke titre protilátok proti exenatidu a u 32% pacientov sa vyvinuli vysoké titre protilátok kedykoľvek v priebehu štúdií. Percento týchto osôb s pozitívnymi titrami protilátok, obzvlášť vysokými titrami, dosiahlo maximum približne v 8. až 16. týždni dávkovania a následne sa v priebehu času znížilo. Pri dosiahnutí cieľového ukazovateľa štúdie približne 43% pacientov malo nízke titre protilátok proti exenatidu a 14% pacientov malo vysoké titre protilátok. Vo všeobecnosti bola úroveň glykemickej kontroly (HbA1c) u pacientov liečených Bydureonom BCise s nízkymi titrami protilátok pri poslednej návšteve (-1,1% až -1,5%) porovnateľná s úrovňou pozorovanou u pacientov bez titrov protilátok (-1,1% až -1,4%). Zatiaľ čo pacienti
s vysokými titrami protilátok pri poslednej návšteve mali oslabenú HbA1c odpoveď, zníženia HbA1c
u týchto pacientov boli klinicky významné (-0,6% až -0,7%).
U pacientov liečených Bydureonom BCise hodnotiteľných na prítomnosť protilátok (n = 393) bola incidencia poteciálne imunogénnych reakcií v mieste podania injekcie (najčastejšie uzlík v mieste podania injekcie) v rámci oboch štúdií približne 20%. Tieto reakcie sa menej často pozorovali
u pacientov s neprítomnosťou protilátok (16%) a pacientov s nízkymi titrami protilátok (16%)
v porovnaní s pacientmi s vysokými titrami protilátok (27%).
Rýchly úbytok hmotnosti
Počas 30-týždňovej štúdie približne u 3% (n = 4/148) pacientov liečených exenatidom s predĺženým
uvoľňovaním, došlo minimálne v jednom časovom období k rýchlemu úbytku hmotnosti (zaznamenané zníženie hmotnosti medzi dvoma za sebou nasledujúcimi návštevami v štúdii bolo väčšie ako 1,5 kg/týždeň).
Zvýšenie srdcovej frekvencie
V kontrolnom období klinických štúdií Bydureonu BCise sa pozorovalo priemerné zvýšenie srdcovej
frekvencie (HR) o 2,4 tepov za minútu (bpm) oproti východiskovej hodnote (74 bpm). Pätnásť percent pacientov liečených exenatidom s predĺženým uvoľňovaním malo priemerné zvýšenie HR ≥10 bpm; približne 5% až 10% osôb v rámci iných liečebných skupín malo priemerné zvýšenie HR ≥10 bpm.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 Predávkovanie
Účinky predávkovania exenatidom (vychádzajúce z klinických štúdií exenatidu s okamžitým uvoľňovaním) zahŕňajú závažnú nevoľnosť, prudké vracanie a rýchly pokles koncentrácie glukózy v krvi. V prípade predávkovania je potrebné začať s vhodnou podpornou liečbou podľa klinických prejavov a príznakov pacienta.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antidiabetiká, analógy GLP (glukagónu podobný peptid)-1-receptora, ATC kód: A10BJ01.
Mechanizmusúčinku
Exenatid je agonista receptorov glukagónu podobného peptidu 1 (GLP-1), ktorý vykazuje viaceré antihyperglykemické účinky glukagónu podobného peptidu 1 (GLP-1). Sekvencia aminokyselín exenatidu sa prekrýva so sekvenciou ľudského GLP-1. U exenatidu sa dokázala väzba a aktivácia známych ľudských GLP-1 receptorov in vitro, mechanizmus účinku je sprostredkovaný cyklickým AMP a/alebo ďalšími vnútrobunkovými signálnymi dráhami.
Exenatid zvyšuje sekréciu inzulínu z pankreatických beta-buniek v závislosti od hladiny glukózy. So znižovaním koncentrácie krvnej glukózy klesá i sekrécia inzulínu. Pri podávaní exenatidu
v kombinácii so samotným metformínom a/alebo tiazolidíndiónom sa nepozorovalo žiadne zvýšenie
výskytu hypoglykémie v porovnaní s placebom v kombinácii s metformínom a/alebo tiazolidíndiónom, čo môže byť spôsobené glukózo-dependentným inzulínotropným mechanizmom účinku (pozri časť 4.4).
Exenatid potláča sekréciu glukagónu, o ktorom je známe, že jeho hladina je neprimerane zvýšená
u pacientov s diabetom 2. typu. Nižšie hladiny glukagónu vedú k zníženiu produkcie glukózy v pečeni. Exenatid však neovplyvňuje normálnu reakciu glukagónu ani iné hormonálne reakcie na
hypoglykémiu.
Exenatid spomaľuje vyprázdňovanie žalúdka, čím spomaľuje rýchlosť prechodu glukózy z potravy do krvného obehu.
Dokázalo sa, že podávanie exenatidu znižuje príjem potravy následkom zníženej chuti do jedla a zvýšeného pocitu sýtosti.
Farmakodynamické účinky
Exenatid zlepšuje glykemickú kontrolu prostredníctvom trvalého pôsobenia na zníženie
postprandiálnych a hladových koncentrácií glukózy u pacientov s diabetom 2. typu. Na rozdiel od prirodzeného GLP-1, farmakokinetický a farmakodynamický profil exenatidu s predĺženým uvoľňovaním u ľudí je vhodný na podávanie raz týždenne.
Farmakodynamická štúdia s exenatidom u pacientov s diabetom 2. typu (n = 13) dokázala obnovenie prvej fázy sekrécie inzulínu a zlepšenie druhej fázy sekrécie inzulínu ako odpoveď na intravenózny bolus glukózy.
Klinická účinnosť a bezpečnosť
Výsledky dvoch štúdií s Bydureonom BCise a šiestich dlhodobých klinických štúdií s exenatidom s predĺženým uvoľňovaním sú uvedené nižšie, tieto štúdie zahŕňali 1 766 osôb (556 liečených Bydureonom BCise), 53% mužov a 47% žien; 304 osôb (17%) bolo vo veku ≥65 rokov.
Okrem toho dvojito-zaslepená, placebom kontrolovaná štúdia (EXSCEL) sledujúca kardiovaskulárne výsledky zahŕňala 14 752 jedincov s diabetom 2. typu a akoukoľvek mierou kardiovaskulárneho rizika, keď bol pridaný k bežnej zvyčajnej liečbe.
Glykemickákontrola
Bydureon BCise
V 28-týždňovej otvorenej štúdii sa Bydureon BCise porovnával s exenatidom s okamžitým uvoľňovaním u osôb podstupujúcich diétu a cvičebný program samostatne alebo spolu so stabilným režimom perorálnych liekov znižujúcich hladinu glukózy. Obe liečebné skupiny dosiahli oproti východiskovej hodnote zníženie HbA1c. Pri Bydureone BCise oproti exenatidu s okamžitým uvoľňovaním sa preukázala superiorita týkajúca sa zníženia HbA1c v 28. týždni oproti východiskovej hodnote (tabuľka 2). Po 28-týždňovom komparátorom kontrolovanom období štúdie nasledovalo 24- týždňové obdobie rozšírenia, počas ktorého všetky zaradené osoby dostávali liečbu týmto liekom. Klinicky významný účinok na HbA1c pretrvával počas 52 týždňov, v skupine, ktorá na začiatku dostávala Bydureon BCise, však v priebehu času čiastočne vymizol.
Pacienti s Bydureonom BCise aj pacienti s exenatidom s okamžitým uvoľňovaním dosiahli v 28.
týždni oproti východiskovej hodnote zníženie hmotnosti (tabuľka 2). Rozdiel medzi oboma liečebnými skupinami nebol významný. Zníženia telesnej hmotnosti sa zachovali aj v 52. týždni.
Tabuľka 2: Výsledky 28-týždňovej štúdie Bydureonu BCise oproti exenatidu s okamžitým uvoľňovaním s diétou a cvičením samostatne alebo so stabilným režimom perorálnych liekov znižujúcich hladinu glukózy (pacienti z modifikovanej populácie podľa liečebného zámeru1)
Bydureon BCise 2 mg
QW
Exenatid
s okamžitým uvoľňovaním 10 µg BID
N 229 146
Priemerný HbA1c (%)
Východisková hodnota 8,5 8,5
Zmena oproti východiskovej hodnote (± SE)2 -1,4 (± 0,1) -1,0 (± 0,1)
Pri
e
mern
ý rozdiel zmeny oproti východiskovej hodnote v porovnaní s exenatidom
s okamžitým uvoľňovaním (95% CI)2
-0,37*
(-0,63; -0,10)
Pacient
i (%), ktorí dosiahli HbA
1
c <7%3 49 43
Priemerná telesná hmotnosť (kg)
Východisková hodnota 97 97
Zmena oproti východiskovej hodnote (± SE)2 -1,5 (± 0,3) -1,9 (± 0,4)
 Pri
e
mern
ý rozdiel zmeny oproti východiskovej hodnote v porovnaní s exenatidom
s okamžitým uvoľňovaním (95% CI)
Pri
e
mern
ý rozdiel zmeny oproti východiskovej hodnote v porovnaní s exenatidom
s okamžitým uvoľňovaním (95% CI)2
Priemerná zmena oproti východiskovej hodnote plazmatickej hladiny glukózy nalačno (mmol/l) (± SE)2
Priemerný rozdiel zmeny oproti východiskovej hodnote v porovnaní s exenatidom+0,40
(-0,48; 1,28)
-1,8 (± 0,2) -1,3 (± 0,3)
-0,56
(-1,20; 0,08)
s okamžitým uvoľňovaním (95% CI)2
Bydureon BCise 2 mg
QW
Exenatid
s okamžitým uvoľňovaním 10 µg BID
QW = raz týždenne, BID = dvakrát denne, N = počet pacientov v liečebnej skupine, SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval).
*p-hodnota <0,01.
1 Všetci randomizovaní pacienti, ktorí dostali aspoň jednu dávku skúšaného lieku.
2 Priemery najmenších štvorcov.
3 Prenesená posledná pozorovaná hodnota (Last Observation Carried Forward, LOCF).
V 28-týždňovej otvorenej (zaslepenej perorálnou liečbou) štúdii sa Bydureon BCise porovnával so sitagliptínom a placebom u osôb, ktoré užívali aj metformín ≥1 500 mg denne. Bydureon BCise preukázal superioritu oproti sitagliptínu a placebu týkajúcu sa zníženia HbA1c v 28. týždni oproti východiskovej hodnote (tabuľka 3).
Pacienti s Bydureonom BCise aj pacienti so sitagliptínom dosiahli v 28. týždni oproti východiskovej hodnote zníženie hmotnosti (tabuľka 3). Rozdiel medzi oboma liečebnými skupinami nebol významný.
Tabuľka 3: Výsledky 28-týždňovej štúdie Bydureonu BCise oproti sitagliptínu a placebu
v kombinácii s metformínom (pacienti z modifikovanej populácie podľa liečebného zámeru1)
Bydureon BCise
2 mg QW
Sitagliptín
100 mg QD
Placebo QD
N 181 122 61
Priemerný HbA1c (%)
Východisková hodnota 8,4 8,5 8,5
Zmena oproti východiskovej hodnote (± SE)2
Priemerný rozdiel zmeny oproti východiskovej hodnote v porovnaní so sitagliptínom (95% CI)2
Priemerný rozdiel zmeny oproti východiskovej hodnote v porovnaní s placebom (95% CI)2
Pacienti (%), ktorí dosiahli
HbA1c <7%3
Priemerná telesná hmotnosť (kg)
-1,1 (± 0,1) -0,8 (± 0,1) -0,4 (± 0,2)
-0,38*
(-0,70; -0,06)
-0,72**
(-1,15; -0,30)
43* 32 25
Východisková hodnota 89 88 89
Zmena oproti východiskovej hodnote (± SE)2
Priemerný rozdiel zmeny oproti východiskovej hodnote v porovnaní so sitagliptínom (95% CI)2
Priemerný rozdiel zmeny oproti východiskovej hodnote v porovnaní s placebom (95% CI)2
Priemerná zmena oproti východiskovej hodnote plazmatickej hladiny glukózy nalačno (mmol/l)
(± SE)2
Priemerný rozdiel zmeny oproti východiskovej hodnote v porovnaní so sitagliptínom (95% CI)2
-1,1 (± 0,3) -1,2 (± 0,3) +0,2 (± 0,5)
+0,07
(-0,73; 0,87)
-1,27#
(-2,34; -0,20)
-1,2 (± 0,2) -0,6 (± 0,3) +0,5 (± 0,4)
-0,56
(-1,21; 0,09)

 Pri
e
mern
ý rozdiel zmeny oproti
Pri
e
mern
ý rozdiel zmeny oproti -1,71§
východiskovej hodnote v porovnaní s placebom (95% IS)2
Bydureon BCise
2 mg QW
(-2,59; -0,83)
Sitagliptín
100 mg QD
Placebo QD

QW = raz týždenne, QD = raz denne, N = počet pacientov v liečebnej skupine, SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval).
*p-hodnota <0,05; **p-hodnota <0,01; #nominálna p-hodnota <0,05; §nominálna p-hodnota <0,001.
1 Všetci randomizovaní pacienti, ktorí dostali aspoň jednu dávku skúšaného lieku.
2 Priemery najmenších štvorcov.
3 Prenesená posledná pozorovaná hodnota (Last Observation Carried Forward, LOCF).
Exenatid s predĺženým uvoľňovanímV dvoch štúdiách bol exenatid 2 mg s predĺženým uvoľňovaním podávaný raz týždenne porovnávaný s exenatidom 5 µg s okamžitým uvoľňovaním podávaným dvakrát denne počas 4 týždňov
a pokračovalo sa exenatidom 10 µg s okamžitým uvoľňovaním podávaným dvakrát denne. Jedna štúdia trvala 24 týždňov (n = 252) a druhá 30 týždňov (n = 295) s následným otvoreným predĺženým sledovaním, v ktorom boli všetci pacienti ďalších 7 rokov liečení exenatidom 2 mg s predĺženým
uvoľňovaním podávaným raz týždenne (n = 258). V oboch štúdiách došlo v oboch liečebných skupinách k viditeľnému poklesu HbA1c už pri prvom meraní HbA1c od začatia liečby (4. alebo 6. týždeň).
Exenatid s predĺženým uvoľňovaním viedol k štatisticky významnému zníženiu HbA1c v porovnaní s pacientmi, ktorí dostávali exenatid s okamžitým uvoľňovaním (tabuľka 4).
Klinicky významný účinok exenatidu s predĺženým uvoľňovaním a exenatidu s okamžitým uvoľňovaním na HbA1c bol pozorovaný v oboch štúdiách, bez ohľadu na druh základnej antidiabetickej liečby.
Klinicky a štatisticky významne viac pacientov užívajúcich exenatid s predĺženým uvoľňovaním
v porovnaní s exenatidom s okamžitým uvoľňovaním dosiahlo v týchto dvoch štúdiách zníženie HbA1c
≤7% alebo <7% (p <0,05, resp. p ≤0,0001).
Pacienti liečení exenatidom s predĺženým uvoľňovaním aj exenatidom s okamžitým uvoľňovaním dosiahli zníženie hmotnosti v porovnaní s východiskovými hodnotami, hoci rozdiel medzi týmito dvomi liečebnými skupinami nebol významný.
V nekontrolovanom predĺžení štúdie vyhodnocovaní pacienti, ktorí v 30. týždni prešli z exenatidu
s okamžitým uvoľňovaním na exenatid s predĺženým uvoľňovaním (n = 121), dosiahli v 52. týždni
rovnaké zlepšenie HbA1c o -2,0% v porovnaní s východiskovými hodnotami, ako pacienti liečení exenatidom s predĺženým uvoľňovaním.
U všetkých pacientov, ktorí dokončili nekontrolované predĺženie štúdie trvajúce 7 rokov (n = 122
z 258 pacientov zaradených do predĺženej fázy), sa HbA1c postupne od 52. týždňa zvyšovalo, avšak stále bolo nižšie ako východisková hodnota po 7 rokoch (-1,5%). Úbytok na hmotnosti u týchto pacientov pretrvával počas 7 rokov.
Tabuľk
a 4: Výsledky z dvoch štúdií s exenatidom s predĺženým uvoľňovaním v porovnaní
s exenatidom s okamžitým uvoľňovaním v kombinácii iba s diétou a cvičením, metformínom a/alebo sulfonylmočovinou a metformínom a/alebo tiazolidíndiónom (ITT-pacienti; ITT = intent to treat)
24-týždňová štúdia
Exenatid
s predĺženým uvoľňovaním 2 mg
Exenatid
s okamžitým uvoľňovaním
10 µg 2 x denne

n 129 123
Priemerná hodnota HbA1c (%)Východisková hodnota 8,5 8,4
Zmena oproti východiskovej hodnote (± SE) -1,6 (± 0,1)** -0,9 (± 0,1)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,67 (-0,94; -0,39)**
Pacienti (%) dosahujúci hodnotu HbA1c <
7% 58 30
Zmena plazmatickej glukózy nalačno (mmol/l)(± SE) -1,4 (± 0,2) -0,3 (± 0,2)
Priemerná telesná hmotnosť (kg)Východisková hodnota 97 94
Zmena oproti východiskovej hodnote (± SE) -2,3 (± 0,4) -1,4 (± 0,4)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,95 (-1,91; 0,01)
30-týždňová štúdiaN 148 147
Priemerná hodnota HbA1c (%)Východisková hodnota 8,3 8,3
Zmena oproti východiskovej hodnote (± SE) -1,9 (± 0,1)* -1,5 (± 0,1)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,33 (-0,54; -0,12)*
Pacienti (%) dosahujúci hodnotu HbA1c ≤
7% 73 57
Zmena plazmatickej glukózy nalačno (mmol/l)(± SE) -2,3 (± 0,2) -1,4 (± 0,2)
Priemerná telesná hmotnosť (kg)Východisková hodnota 102 102
Zmena oproti východiskovej hodnote (± SE) -3,7 (± 0,5) -3,6 (± 0,5)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,08 (-1,29; 1,12)
SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval), *p <0,05;
**p <0,0001
V 26-týždňovej štúdii bol exenatid s predĺženým uvoľňovaním 2 mg porovnávaný s inzulínom-glargín podávaným raz denne. V porovnaní s liečbou inzulínom-glargín, exenatid s predĺženým uvoľňovaním preukázal významnejšiu zmenu v hodnote HbA1c, signifikantne zníženú priemernú telesnú hmotnosť
a spájal sa s menším počtom hypoglykemických príhod (tabuľka 5).
Tabuľk
a 5: Výsledky 26-týždňovéj štúdie s exenatidom s predĺženým uvoľňovaním v porovnaní s inzulínom-glargín v kombinácii s metformínom samostatne alebo s metformínom
a sulfonylmočovinou (ITT-pacienti)
Exenatid
s predĺženým uvoľňovaním
2 mg
Inzulín-glargín1

n 233 223
Priemerná hodnota HbA1c (%)Východisková hodnota 8,3 8,3
Zmena oproti východiskovej hodnote (± SE) -1,5 (± 0,1)* -1,3 (± 0,1)*
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -0,16 (-0,29; -0,03)*
Pacienti (%) dosahujúci hodnotu HbA1c ≤
7% 62 54
Zmena glukózy v sére nalačno (mmol/l) (± SE) -2,1 (± 0,2) -2,8 (± 0,2)
Priemerná telesná hmotnosť (kg)Východisková hodnota 91 91
Zmena oproti východiskovej hodnote (± SE) -2,6 (± 0,2) +1,4 (± 0,2)
Priemerný rozdiel oproti východiskovej hodnotemedzi liečbami (95% CI) -4,05 (-4,57; -3,52)*
SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval), *p <0,05
1 Inzulín-glargín bol dávkovaný tak, aby sa dosiahla cieľová koncentrácia glukózy v rozmedzí 4,0 až
5,5 mmol/l (72 až 100 mg/dl).
Priemerná dávka inzulínu-glargín na začiatku liečby bola 10,1 IU/deň a zvýšila sa na 31,1 IU/deň pre pacientov liečených inzulínom-glargín.
Výsledky za 156 týždňov boli konzistentné s tými, ktoré už boli predtým hlásené v 26-týždňovej predbežnej správe. Liečba exenatidom s predĺženým uvoľňovaním trvale významne zlepšovala kontrolu glykémie a kontrolu hmotnosti v porovnaní s liečbou inzulínom-glargín. Údaje týkajúce sa bezpečnosti v 156. týždni sa zhodovali s tými, ktoré sa hlásili v 26. týždni.
V 26-týždňovej dvojito zaslepenej štúdii sa exenatid s predĺženým uvoľňovaním porovnával
s maximálnymi dennými dávkami sitagliptínu a pioglitazónu u pacientov, ktorí užívali aj metformín. Vo všetkých liečebných skupinách došlo k významnému zníženiu hodnoty HbA1c oproti východiskovej hodnote. Exenatid s predĺženým uvoľňovaním prevažoval sitagliptín a pioglitazón
v účinku na zmenu hodnoty HbA1c vzhľadom na východiskovú hodnotu.
Exenatid s predĺženým uvoľňovaním v porovnaní so sitagliptínom preukázal významne väčšie zníženie hmotnosti. Hmotnosť pacientov liečených pioglitazónom sa zvýšila (tabuľka 6).
Tabuľk
a 6: Výsledky 26-týždňovej štúdie s exenatidom s predĺženým uvoľňovaním v porovnaní so sitagliptínom a pioglitazónom v kombinácii s metformínom (ITT-pacienti)
Exenatid
s predĺženým uvoľňovaním
2 mg
Sitagliptín
100 mg
Pioglitazón
45 mg
n 160 166 165
Priemerná hodnota HbA1c (%)
Východiskové hodnoty 8,6 8,5 8,5
Zmena oproti východiskovej hodnote (± SE) -1,6 (± 0,1)* -0,9 (± 0,1)* -1,2 (± 0,1)*
Priemerný rozdiel oproti východiskovej
h
o
dnote medzi liečbami (95% CI) oproti sitagliptínu
Pri
e
mern
ý rozdiel oproti východiskovej hodnote medzi liečbami (95% CI) oproti pioglitazónu
Pacient
i (%) dosahujúci hodnotu
HbA
1
c
≤
7%
Zmena glukózy v sére nalačno (mmol/l) (± SE)
Priemerná telesná hmotnosť (kg)
-0,63 (-0,89; -0,37)**
-0,32 (-0,57; -0,06)*
62 36 49
-1,8 (± 0,2) -0,9 (± 0,2) -1,5 (± 0,2)
Východisková hodnota 89 87 88
Zmena oproti východiskovej hodnote(± SE) -2,3 (± 0,3) -0,8 (± 0,3) +2,8 (± 0,3)
Priemerný rozdiel oproti východiskovej
h
o
dnote medzi liečbami (95% CI) oproti sitagliptínu
Pri
e
mern
ý rozdiel oproti východiskovej hodnote medzi liečbami (95% CI) oproti pioglitazónu
-1,54 (-2,35; -0,72)*
-5,10 (-5,91; -4,28)**

SE = štandardná odchýlka (standard error), CI = interval spoľahlivosti (confidence interval), *p <0,05;
**p <0,0001
V 28-týždňovej dvojito zaslepenej štúdii sa porovnával exenatid s predĺženým uvoľňovaním
v kombinácii s dapagliflozínom so samotným exenatidom s predĺženým uvoľňovaním a samotným dapagliflozínom u pacientov, ktorí užívali aj metformín. Vo všetkých liečebných skupinách došlo
k zníženiu hodnoty HbA1c oproti východiskovej hodnote. V liečebnej skupine s exenatidom
s predĺženým uvoľňovaním a dapagliflozínom sa preukázali významnejšie zníženia hodnôt HbA1c oproti východiskovej hodnote v porovnaní so skupinami s exenatidom s predĺženým uvoľňovaním samotným a samotným dapagliflozínom (tabuľka 7).
Kombinácia exenatidu s predĺženým uvoľňovaním a dapagliflozínu v porovnaní s liečivami samotnými preukázala významne väčšie zníženia hmotnosti (tabuľka 7).
Tabuľk
a 7: Výsledky jednej 28-týždňovej štúdie s exenatidom s predĺženým uvoľňovaním v kombinácii s dapagliflozínom v porovnaní so samotným exenatidom s predĺženým uvoľňovaním a samotným dapagliflozínom v kombinácii s metformínom (ITT-pacienti)
Exenatid s predĺženým
uvoľňovaní
m 2 mg QW
+
Dapagliflozí
n 10 mg QD
Exenatid
s predĺženým uvoľňovaním 2 mg QW
+ Placebo QD
Dapagliflozín
10 mg QD
+
Placebo QW
n 228 227 230
Pri
e
mern
á hodnota HbA
1c
(
%
)
Východisková hodnota 9,3 9,3 9,3
Zmena oproti východiskovej
hodnote (±SE)a -2,0 (± 0,1) -1,6 (± 0,1) -1,4 (± 0,1)
Priemerný rozdiel oproti
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
Pacienti (%) dosahujúci
-0,38*
(-0,63; -0,13)
-0,59**
(-0,84; -0,34)
h
o
dnot
u HbA
1
c <7% 45 27 19
Priemerná zmena oproti východiskovej hodnote
plazmatickej glukózy nalačno (mmol/l) (±SE)a
Priemerný rozdiel oproti
-3,7 (± 0,2) -2,5 (± 0,2) -2,7 (± 0,2)
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
Priemerná zmena oproti východiskovej hodnote
-1,12**
(-1,55; -0,68)
-0,92**
(-1,36; -0,49)
pl
azmatickej glukózy 2 hodiny po jedle (mmol/l) (±SE) a
Priemerný rozdiel oproti
-4,9 (± 0,2) -3,3 (± 0,2) -3,4 (± 0,2)
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
Priemerná telesná hmotnosť
(kg)
-1,54**
(-2,10; -0,98)
-1.49**
(-2,04; -0,93)
Východisková hodnota 92 89 91
Zmena oproti východiskovej
hodnote (±SE)a -3,6 (± 0,3) -1,6 (± 0,3) -2,2 (± 0,3)
Priemerný rozdiel oproti
východiskovej hodnote medzi kombináciou a samotným liečivom (95% CI)
-2,00**
(-2,79; -1,20)
-1,33**
(-2,12; -0,55)

QW = jedenkrát týždenne (once weekly), QD = jedenkrát denne (once daily), SE = štandardná odchýlka (standard error), CI =interval spoľahlivosti (confidence interval), n = počet pacientov (number of patients).
a Upravené priemery najmenších štvorcov (least squares means, LS-priemery) a rozdiel(y) liečebnej
skupiny v zmene oproti východiskovým hodnotám v 28. týždni sú modelované použitím zmiešaného modelu s opakovanými meraniami (mixed model with repeated measures, MMRM), ktorý zahŕňa liečbu, región, stratifikáciu podľa východiskovej hladiny HbA1c (<9,0% alebo ≥9,0%), týždeň
a týždeň liečby s interakciami ako fixné faktory a východiskovú hodnotu ako kovariát.
*p <0,01, **p <0,001.
p-hodnoty sú všetky p-hodnoty upravené na multiplicitu.
Analýzy nezahŕňajú merania po podaní záchrannej liečby a po predčasnom prerušení podávania
skúšaného lieku.
V 28-týždňovej dvojito zaslepenej štúdii sa porovnával exenatid s predĺženým uvoľňovaním pridaný buď k samotnému inzulínu-glargín alebo ku kombinácii inzulínu-glargín s metformínom – s placebom pridaným buď k samotnému inzulínu-glargín alebo ku kombinácii inzulínu-glargín s metformínom. Inzulín-glargín bol dávkovaný s cieľom dosiahnuť hladinu plazmatickej glukózy nalačno 4,0 až
5,5 mmol/l (72 až 99 mg/dl). Exenatid s predĺženým uvoľňovaním preukázal superioritu oproti
placebu v znižovaní HbA1c z východiskovej hodnoty do 28. týždňa (tabuľka 8).
Exenatid s predĺženým uvoľňovaním preukázal superioritu oproti placebu v znižovaní telesnej hmotnosti v 28. týždni (tabuľka 8).
Tabuľka 8: Výsledky jednej 28-týždňovej štúdie s exenatidom s predĺženým uvoľňovaním v porovnaní s placebom v kombinácii buď s inzulínom-glargín samotným alebo
inzulínom-glargín spolu s metformínom (ITT-pacienti)
Exenatid s predĺženým
uvoľňovaním 2 mg
+ inzulín-glargína
Placebo
+ inzulín-glargína
n 230 228
Priemer HbA1c (%)
Východisková hodnota 8,5 8,5'
Zmena oproti východiskovej hodnote (± SE)b -1,0 (±0,1) -0,2 (±0,1)
Priemerný rozdiel medzi liečbami v zmene z východiskovej hodnoty (95% CI)
-0,74*
(-0,94; -0,54)
Pacient
i (%), ktorí dosiahli HbA
1
c ≤7%c 33* 7
Priemerná telesná hmotnosť (kg)
Východisková hodnota 94 94
Zmena oproti východiskovej hodnote (± SE)b -1,0 (±0,3) 0,5 (±0,3)
Priemerný rozdiel medzi liečbami v zmene z východiskovej hodnoty (95% CI)
Zmena z východiskovej hodnoty plazmatickej glukózy 2 hodiny po jedle (mmol/l) (± SE)b,d Priemerný rozdiel medzi liečbami v zmene
z východiskovej hodnoty (95% CI)
-1,52*
(-2,19; -0,85)
-1,6 (±0,3) -0,1 (±0,3)
-1,54*
(-2,17; -0,91)

n = počet pacientov v každej liečenej skupine, SE = štandardná odchýlka (standard error),
CI = interval spoľahlivosti (confidence interval), *p-hodnota <0,001 (upravená na multiplicitu).
a. Zmena priemerov najmenších štvorcov (least squares means, LS-priemery) priemernej dennej dávky inzulínu bola 1,6 jednotiek pre skupinu s exenatidom s predĺženým uvoľňovaním a 3,5 jednotiek pre skupinu s placebom.
b. Upravené priemery najmenších štvorcov (least squares means, LS-priemery) a rozdiel(y) liečebnej skupiny v zmene oproti východiskovým hodnotám v 28. týždni sú modelované použitím zmiešaného modelu s opakovanými meraniami (mixed model with repeated measures, MMRM), ktorý zahŕňa liečbu, región, stratifikáciu podľa východiskovej hladiny HbA1c (<9,0% alebo ≥9,0%), stratifikáciu podľa východiskového použitia sulfonylmočoviny (SU) (áno alebo nie), týždeň a týždeň liečby
s interakciami ako fixné faktory a východiskovú hodnotu ako kovariát. Absolútna zmena plazmatickej glukózy 2 hodiny po jedle v 28. týždni je modelovaná podobne použitím ANCOVA.
c. Všetci pacienti s chýbajúcimi údajmi koncových parametrov sú považovaní za nereagujúcich na liečbu.
d. Po štandardnom teste tolerancie jedla.
Analýzy nezahŕňajú merania po podaní záchrannej liečby a po predčasnom prerušení podávania skúšaného lieku.
Kardiovaskulárne hodnotenie
EXSCEL bola pragmatická štúdia sledujúca kardiovaskulárne (KV) výsledky u pacientov s diabetom
2. typu a akoukoľvek mierou KV rizika. Celkovo 14 752 pacientov bolo randomizovaných 1:1 na
2 mg exenatidu s predĺženým uvoľňovaním raz týždenne alebo placebo, pridané k bežnej zvyčajnej liečbe, ktorá môže zahŕňať inhibítory SGLT2. Pacienti boli sledovaní ako v bežnej klinickej praxi po dobu 38,7 mesiacov (medián) s mediánom trvania liečby 27,8 mesiacov. Vitálny status bol známy na konci štúdie u 98,9% pacientov s exenatidom s predĺženým uvoľňovaním a 98,8% pacientov s placebom. Priemerný vek pri vstupe do štúdie bol 62 rokov (8,5% pacientov vo veku ≥75 rokov). Približne 62% pacientov boli muži. Priemerný BMI bol 32,7 kg/m2 a priemerné trvanie diabetu bolo
13,1 rokov. Priemerné HbA1c bolo 8,1%. Približne 49,3% malo miernu poruchu funkcie obličiek (odhadovaná rýchlosť glomerulárnej filtrácie [eGFR] ≥60 až ≤89 ml/min/1,73 m2) a 21,6% malo stredne závažnú poruchu funkcie obličiek (eGFR ≥30 až ≤59 ml/min/1,73 m2). Celkovo 26,9% pacientov nemalo predtým KV príhodu, 73,1% malo predtým minimálne jednu KV príhodu.
Primárny ukazovateľ bezpečnosti (non-inferiorita) a účinnosti (superiorita) v štúdii EXSCEL bol čas do prvej potvrdenej závažnej nežiaducej kardiálnej príhody (MACE, Major Adverse Cardiac Event): úmrtie súvisiace s kardiovaskulárnym ochorením, nefatálny infarkt myokardu (IM) alebo nefatálna mozgová príhoda. Mortalita z akejkoľvek príčiny bola iniciálnym sekundárnym hodnoteným ukazovateľom.
Exenatid s predĺženým uvoľňovaním nezvyšoval kardiovaskulárne riziko u pacientov s diabetes mellitus 2. typu v porovnaní s placebom, keď bol pridaný k bežnej zvyčajnej liečbe (HR: 0,91; 95%
CI: 0,832, 1,004; P<0,001 pre non-inferioritu), pozri obrázok 1. Výsledky primárneho kombinovaného
a sekundárneho kardiovaskulárneho ukazovateľa sú uvedené na obrázku 2.
Obrázok 1: Čas do prvej posudzovanej MACE (pacienti so zámerom liečiť)Exenatid

Placebo

Exenatid vs placebo:
HR (95% CI) 0,91 (0,832; 1,004)
Exenatid
Počet pacientov s rizikom
Mesiace od randomizácie
Placebo
HR=pomer rizika, CI=interval spoľahlivosti
O
b
rázo
k 2: Blobbogram (Forest Plot): Analýza primárneho a sekundárneho ukazovateľa
(pacienti so zámerom liečiť)
AKS=akútny koronárny syndróm, CI=interval spoľahlivosti, KV=kardiovaskulárny, HF=zlyhanie srdca; HR=pomer rizika; MACE=závažná nežiaduca kardiálna príhoda; IM=infarkt myokardu; n=počet pacientov s príhodou; N=počet pacientov v liečenej skupine.
1 HR (aktívny/placebo) a CI na základe Coxovho regresného modelu proporčných rizík, stratifikované podľa KV príhody len s liečebnou skupinou ako vysvetľujúcou premennou.
Potreba ďalšej antihyperglykemickej liečby sa znížila o 33% v skupine s exenatidom s predĺženým uvoľňovaním (incidencia upravená na expozíciu 10,5 na 100 pacientorokov) v porovnaní s placebovou skupinou (incidencia upravená na expozíciu 15,7 na 100 pacientorokov). Zníženie HbA1c sa
pozorovalo počas trvania štúdie s celkovým rozdielom liečby -0,53% (exenatid s predĺženým uvoľňovaním oproti placebu).
TelesnáhmotnosťV štúdiách s liekovými formami exenatidu s predĺženým uvoľňovaním bol pozorovaný úbytok telesnej
hmotnosti v porovnaní s východiskovými hodnotami. Tento úbytok telesnej hmotnosti prejavil bez ohľadu na výskyt nevoľnosti, hoci v skupine s nevoľnosťou bol tento úbytok väčší (priemerný úbytok
–1,9 kg až –5,2 kg s nevoľnosťou verzus –1,0 kg až –2,9 kg bez nevoľnosti).
Plazmatická/sérováglukózaLiečba exenatidom s predĺženým uvoľňovaním mala za následok významné zníženie koncentrácií plazmatickej/sérovej glukózy nalačno (hladovej), pričom toto zníženie bolo pozorované už vo 4. týždni. V placebom kontrolovanej štúdii s inzulínom-glargín bola zmena plazmatickej glukózy nalačno z východiskovej hodnoty do 28. týždňa -0,7 mmol/l pre skupinu s exenatidom s predĺženým uvoľňovaním a -0,1 mmol/l pre skupinu s placebom. Bolo tiež pozorované ďalšie zníženie postprandiálnych koncentrácií.
Pre obe liekové formy exenatidu s predĺženým uvoľňovaním zlepšenie koncentrácií hladovej plazmatickej glukózy pretrvávalo aj v 52. týždni.
Funkciabeta-buniekKlinické štúdie s liekovými formami exenatidu s predĺženým uvoľňovaním preukázali zlepšenie funkcie beta-buniek pri použití homeostatického modelu (HOMA-B). Tento účinok na funkciu beta- buniek pretrvával aj v 52. týždni.
KrvnýtlakV štúdiách s liekovými formami exenatidu s predĺženým uvoľňovaním bolo pozorované zníženie
systolického krvného tlaku (0,8 mmHg až 4,7 mmHg). V 30-týždňovej porovnávacej štúdii
s exenatidom s okamžitým uvoľňovaním obidva lieky, exenatid s predĺženým uvoľňovaním aj exenatid s okamžitým uvoľňovaním, signifikantne znížili systolický krvný tlak v porovnaní
s východiskovou hodnotou (4,7 ± 1,1 mmHg a 3,4 ± 1,1 mmHg v danom poradí), rozdiel medzi týmito
dvoma liečebnými postupmi nebol signifikantný. Zlepšenie krvného tlaku sa udržalo počas 52
týždňov.
V placebom kontrolovanej štúdii s inzulínom-glargín bola zmena systolického krvného tlaku z východiskovej hodnoty do 28. týždňa -2,6 mmHg pre skupinu s exenatidom s predĺženým uvoľňovaním a -0,7 mmHg pre skupinu s placebom.
Liečba exenatidom s predĺženým uvoľňovaním v kombinácii s dapagliflozínom v 28. týždni viedla
k významnej priemernej zmene zníženia systolického krvného tlaku o 4,3 ± 0,8 mmHg v porovnaní so samotným exenatidom s predĺženým uvoľňovaním o -1,2 ± 0,8 mmHg (p <0,01) alebo samotným dapagliflozínom o -1,8 ± 0,8 mmHg (p <0,05).
Hladiny lipidov nalačno
Liekové formy exenatidu s predĺženým uvoľňovaním nevykazujú žiadne negatívne účinky na
parametre lipidov.
Pediatrickápopulácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekovými
formami exenatidu s predĺženým uvoľňovaním v jednej alebo vo viacerých podskupinách pediatrickej populácie s diabetes mellitus 2. typu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpčné vlastnosti exenatidu odzrkadľujú vlastnosti predĺženého uvoľňovania exenatidu
s predĺženým uvoľňovaním. Potom, čo sa absorbuje v krvnom obehu, exenatid sa distribuuje
a vylučuje podľa známych systémových farmakokinetických vlastností (ako je to popísané v tejto časti).
Absorpcia
Po týždennom podávaní 2 mg Bydureonu BCise prekračovali priemerné koncentrácie exenatidu
v priebehu 2 týždňov minimálne účinné koncentrácie (~ 50 pg/ml) a priemerné plazmatické koncentrácie exenatidu sa postupne zvyšovali až do 8. týždňa. Následne sa dosiahli koncentrácie exenatidu približne 153 - 208 pg/ml, čo naznačuje, že bol dosiahnutý rovnovážny stav. Počas jednotýždňového intervalu medzi dávkami sa udržiavajú stabilné koncentrácie exenatidu,
s minimálnymi výkyvmi nahor alebo nadol od priemernej terapeutickej koncentrácie.
Distribúcia
Priemerný zdanlivý distribučný objem exenatidu po subkutánnej aplikácii jednotlivej dávky exenatidu je 28 litrov.
Biotransformácia a eliminácia
Predklinické štúdie ukázali, že exenatid je prednostne vylučovaný glomerulárnou filtráciou
s následnou proteolytickou degradáciou. Priemerný zdanlivý klírens exenatidu je 9 l/h. Tieto farmakokinetické vlastnosti exenatidu nie sú závislé na dávke. Stredné plazmatické koncentrácie exenatidu klesnú pod detekovateľnú hranicu približne 10 týždňov po ukončení liečby exenatidom s predĺženým uvoľňovaním.
Osobitné skupiny pacientov
Porucha funkcie obličiek
U pacientov s miernou až stredne závažnou poruchou funkcie obličiek (eGFR 30 až
89 ml/min/1,73 m2), ktorí boli liečení Bydureonom BCise, sa v porovnaní s pacientmi s normálnou
funkciou obličiek nepozorovali žiadne klinicky významné rozdiely rovnovážnych koncentrácií exenatidu alebo znášanlivosti.
Insuficiencia pečene
Neuskutočnila sa žiadna farmakokinetická štúdia u pacientov s insuficienciou pečene. Exenatid je eliminovaný predovšetkým obličkami; preto by dysfunkcia pečene nemala ovplyvňovať koncentrácie exenatidu v krvi.
Pohlavie, rasa a telesná hmotnosť
Pohlavie, rasa a telesná hmotnosť nemajú klinicky relevantný vplyv na farmakokinetiku exenatidu.
Starší pacienti
Údaje o starších pacientoch sú obmedzené, ale nenaznačujú žiadne výrazné zmeny v expozícii
exenatidu s narastajúcim vekom až do veku okolo 75 rokov.
Vo farmakokinetickej štúdii s exenatidom s okamžitým uvoľňovaním u pacientov s diabetom 2. typu podanie exenatidu (10 µg) viedlo k priemernému zvýšeniu AUC exenatidu o 36% u 15 starších pacientov vo veku 75 až 85 rokov v porovnaní s 15 pacientmi vo veku 45 až 65 rokov, čo pravdepodobne súvisí so zníženou renálnou funkciou u vekovo staršej skupiny (pozri časť 4.2).
Pediatrická populácia
Vo farmakokinetickej štúdii s podaním jednotlivej dávky exenatidu s okamžitým uvoľňovaním u 13 pacientov s diabetom 2. typu vo veku 12 až 16 rokov malo podanie exenatidu (5 mg) za následok mierne zníženie priemernej hodnoty AUC (nižšia o 16%) a Cmax (nižšia o 25%) v porovnaní
s hodnotami pozorovanými u dospelých. V pediatrickej populácii sa doteraz neuskutočnila žiadna farmakokinetická štúdia s exenatidom s predĺženým uvoľňovaním.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní a genotoxicity, uskutočnených s exenatidom s okamžitým uvoľňovaním alebo
s liekovými formami exenatidu s predĺženým uvoľňovaním, neodhalili žiadne osobitné riziko pre ľudí.
U potkanov a myší sa pri dlhodobo účinkujúcich agonistoch GLP-1 receptorov pozorovali nádory štítnej žľazy. V 2-ročnej štúdii karcinogenity u potkanov sa pri exenatide s predĺženým uvoľňovaním pozoroval zvýšený výskyt adenómov C-buniek a karcinómov C-buniek pri dávkach ≥2-násobok systémovej expozície u ľudí na základe AUC. Klinický význam týchto zistení nie je v súčasnosti známy.
Štúdie s exenatidom na zvieratách nepreukázali škodlivé účinky na fertilitu; vysoké dávky exenatidu spôsobovali poruchy vývoja kostry a spomalenie fetálneho a neonatálneho rastu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok
poly(D,L-laktid-ko-glykolid)
sacharóza
Vehikulum
triacylglyceroly so stredne dlhým reťazcom
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.
3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C)
Pero sa pred použitím môže uchovávať 4 týždne pri teplote do 30 ºC. Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Pero sa musí uchovávať vo vodorovnej polohe.
6.5 Druh obalu a obsah balenia
Suspenzia je obsiahnutá v 2 ml sklenenej náplni typu 1 uzatvorenej na jednom konci kombináciou (brómbutylovej) gumenej zátky/viečka (combiseal) a na druhom konci (brómbutylovým) gumeným piestom. Liek sa skladá z náplne obsahujúcej suspenziu, ktorá je zabudovaná v pere. Pero obsahuje zabudovanú ihlu.
Veľkosť balenia: 4 jednodávkové naplnené perá (BCise) a viacnásobné balenie obsahujúce 12 (3
balenia po 4) jednodávkových naplnených pier (BCise).
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Naplnené pero je určené len na jednorazové použitie.
Lekár má nacvičiť podávanie lieku s pacientmi a ich ošetrovateľmi.
Pero BCise sa pred aplikáciou musí vybrať z chladničky a nechať ležať vo vodorovnej polohe aspoň
15 minút. Suspenzia sa musí premiešať silným pretrepávaním aspoň po dobu 15 sekúnd. Suspenzia sa pred použitím musí vizuálne skontrolovať. Suspenzia sa môže použiť iba vtedy, ak je rovnomerne premiešaná, biela až sivobiela a zakalená, bez akýchkoľvek bielych stôp lieku po stranách, na dne alebo vrchnej strane okienka pera. Po úplnom premiešaní suspenzie je nutné okamžite nasledovať kroky na prípravu a suspenzia sa má podať subkutánnou injekciou. Ďalšie informácie o suspenzii
a podaní nájdete v písomnej informácii pre používateľa a v „Návode na použitie“. Pacient má byť poučený, ako po každej aplikácii pero bezpečne zlikvidoval.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
AstraZeneca AB
SE-151 85 Södertälje
Švédsko
8. REGISTRAČNÉ ČÍSLO
EU/1/11/696/005-006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 17. júna 2011
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
NÁVOD NA POUŽITIE Postup krok za krokomBydureon 2 mg prášok a disperzné prostredie na injekčnú suspenziu s predĺženým uvoľňovanímAk máte akékoľvek otázky týkajúce sa užívania Bydureonu· Pozrite si
Časté otázky a odpovedeUžitočné rady· Neponáhľajte sa.
· Postupujte presne podľa pokynov, krok za krokom.
· Budete potrebovať dostatok času na vykonanie všetkých krokov bez prestávky.
· Menej času budete potrebovať, keď sa sami dôkladne naučíte podávať si injekciu.
DÔLEŽITÉ:Pri každom podávaní svojej dávky Bydureonu si pozorne prečítajte tieto pokyny a dodržiavajte ich. Nevynechávajte žiadne kroky. Prečítajte si aj Písomnú informáciu pre používateľa, ktorá je súčasťou balenia.Návod na použitie jednotlivých častí súpravyJednodávková súprava Tu nadvihnite a pozrite si súčasti súpravy zblízkaNechajte rožtek otvorený, aby ste sa k nemu mohli pri prechádzaní jednotlivými krokmi vrátiť
Tu nadvihnite a pozrite si súčasti súpravy zblízkaNechajte rožtek otvorený, aby ste sa k nemu mohli pri prechádzaní jednotlivými krokmi vrátiťTekutina
Striekačka
Piest
(rozpúšťadlo) vnútri Biely uzáver
Liekovka
Konektor liekovky
Čiara dávky
Zelený uzáver
Prášok vnútri je váš liek
Papierový uzáver
Balenie
s konektorom
liekovky
Ihla (monoject)
Oranžový konektor
Modrý uzáver
Ihla Kryt na ihlu
Jednodávková súprava obsahuje
náhradnú ihlu (nezobrazená) pre prípad
potreby.
Váš návod na použitie jednotlivých častí súpravy
Jednodávková súprava
Striekačka Ihly (2)
Liekovka
Konektor liekovky
Čo je vo vnútri
Na podanie správnej dávky si prečítajte každú časť, aby ste každý krok urobili správne.
Tento návod sa delí na nasledovné časti:
1 Začíname
2 Spájanie jednotlivých častí
3 Zmiešanie lieku a naplnenie injekčnej striekačky
4 Injekčné podanie lieku
Najčastejšie otázky a odpovede.
1. Začíname1a Vyberte jednodávkovú súpravu z chladničky.Pripravte sa na bezpečnú likvidáciu použitých ihiel a striekačiek. Pripravte sa, aby ste mali všetko, čo potrebujete na bezpečnú likvidáciu použitých ihiel a striekačiek, poruke.
1b Umyte si ruky.1c Odstráňte vrchnák a otvorte škatuľku.
Odstráňte vrchnák a otvorte škatuľku.Vyberte injekčnú striekačku. Tekutina v striekačke musí byť číra a bez častíc. Vzduchové bublinky v striekačke sú normálny jav.
Položte ihlu, balenie s konektorom liekovky, liekovku a injekčnú striekačku na čistú a rovnú plochu.
1d
Vezmite ihlu a odskrutkujte modrý kryt.
Odložte uzavretú ihlu bokom. Ihla je teraz pripravená. Budete ju potrebovať neskôr.
Pre prípad potreby máte aj náhradnú ihlu.
1eŤuk!Uchopte liekovku.Poklopkajte liekovkou niekoľkokrát o nejakú tvrdú plochu, aby sa prášok uvoľnil.1fPomocou palca odstráňte zelený uzáver.Odložte liekovku bokom.
2. Spájanie jednotlivých častí
2a
Vezmite obal s konektorom liekovky a odstráňte papierový kryt. Nedotýkajte sa oranžového
konektora vo vnútri.
2bUchopte obal s konektorom.Do druhej ruky uchopte liekovku.2cZatlačte silno vrchnú časť liekovky do oranžového konektora.
2d
Vybert
e liekovku s nasadeným oranžovým konektorom von z obalu.
2e
Takto má teraz liekovka vyzerať.
Odložte ju nabok na neskoršie použitie.
2fUchopte injekčnú striekačku.
Druho
u rukou pevne stisnite 2 sivé štvorce na bielom uzávere.
2g

Prask!
Odlomte uzáver.Buďte opatrní, aby ste nestisli piest.Rovnako, ako by ste odlomili paličku, tak odlomíte aj uzáver.2hTakto vyzerá odlomený uzáver.Uzáver už nebudete potrebovať a môžete ho zahodiť.
2iTakto by teraz mala vyzerať injekčná striekačka.
2j
Tera
z uchopte liekovku s nasadeným oranžovým konektorom.
Naskrutkujt
e
oranžový
konektor na hornú časť injekčnej striekačky, až kým nebude tesne priliehať. Pri skrutkovaní sa uistite, že držíte oranžový konektor. Neutiahnite príliš tesne. Buďte opatrní, aby ste nestisli piest.
 2kTakto by mali tieto časti vyzerať po spojení.3. Zmiešanie lieku a naplnenie injekčnej striekačkyDÔLEŽITÉ:Počas týchto nasledujúcich krokov zmiešate liek a naplníte striekačku. Keď bude liek zmiešaný, musíte ihneď injekciu podať. Zmiešanýlieknesmieteuchovávaťnaneskoršiepoužitie.3aPalcom potlačte piest nadol, až kým sa nezastaví a podržte palec v tejto polohe.
2kTakto by mali tieto časti vyzerať po spojení.3. Zmiešanie lieku a naplnenie injekčnej striekačkyDÔLEŽITÉ:Počas týchto nasledujúcich krokov zmiešate liek a naplníte striekačku. Keď bude liek zmiešaný, musíte ihneď injekciu podať. Zmiešanýlieknesmieteuchovávaťnaneskoršiepoužitie.3aPalcom potlačte piest nadol, až kým sa nezastaví a podržte palec v tejto polohe.
Možno budete mať pocit, akoby piest trochu vyskočil nahor.
 3bStále tlačte piest palcom nadol a silnopotraste. Traste, až kým sa tekutina a prášok riadnenepremiešajú.
3bStále tlačte piest palcom nadol a silnopotraste. Traste, až kým sa tekutina a prášok riadnenepremiešajú.Nemusíte sa obávať, že sa liekovka oddelí. Oranžový konektor ju bude držať spojenú so striekačkou.
Traste silno, ako keby ste triasli fľašou šalátového dresingu z oleja a octu.3cKeď je liek správne zmiešaný, má byť zakalený.
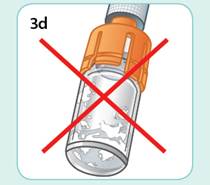 A
k na bokoch alebo dne liekovky uvidíte zhluky suchého prášku, liek NIE JE dobre zmiešaný.
Znov
u silno potraste, až kým sa dobre nezmieša.
A
k na bokoch alebo dne liekovky uvidíte zhluky suchého prášku, liek NIE JE dobre zmiešaný.
Znov
u silno potraste, až kým sa dobre nezmieša.
Pri trasení stále tlačte piest palcom nadol.
3eTeraz uchopte liekovku tak, aby injekčná striekačka mierila nahor. Palcom stále tlačte na piest,až kým sa nezastaví a podržte ho tak.3fDruhou rukou jemne poklopkajte po liekovke. Palcom stále tlačte na piest, aby ostal v tej istejpolohe.Poklopkaním sa zabezpečí, aby liek stiekol nadol. Ak sa objavia vzduchové bublinky, je to normálny jav.
3g
Natiahnit
e piest smerom nadol ažza čiernu prerušovanú čiaru označujúcu dávku lieku.
Takto natiahnete liek z liekovky do injekčnej striekačky. Môžu sa objaviť vzduchové bublinky. Je to
normálny jav.
Na stenách liekovky môže ostať malé množstvo tekutiny. To je tiež normálny jav.
3hJednou rukou držte piest na mieste tak, aby sa nehýbal.3iDruhou rukou úplne odskrutkujteoranžovýkonektor, aby sa dal odstrániť.
Buďte opatrní, aby ste po odstránení konektora nezatlačili piest dovnútra.
3jTakto by mala teraz vyzerať injekčná striekačka.4. Injekčné podanie liekuDÔLEŽITÉ:Pozorne si prečítajte ďalšie kroky a podrobne si prezrite obrázky. Pomôže vám to podať si správnu dávku lieku.4aNaskrutkujteihlu na injekčnú striekačku, až kým sa tesne nespoja. Zatiaľ neodstraňujte kryt ihly.
Buďte opatrní, aby ste nestlačili piest.
4b
Pomaly
stlačte
Vrch
piestu
P
o
mal
y
stlačte piest, aby bola vrchná časť piestu zarovno s prerušovanou čiernou čiarou
označujúco
u dávku lieku.
Potom dajte palec dolu z piestu.
V tomto okamihu je dôležité prestať stláčať piest, lebo by ste mohli prísť o svoj liek a nedostali by stepotrebnúdávku.4cPočas ďalších krokov musí vrchná časť piestu ostať v jednej rovine s prerušovanou čiernoučiarou označujúcou dávku lieku. Takto sa vám podarí podať si správnu dávku lieku.
DÔLEŽITÉ:Ak spozorujete v zmesi niekoľko vzduchových bubliniek, je to normálny jav. Vzduchové bublinky vám neuškodia ani neovplyvnia dávku vášho lieku.
4d
Zadná časť ramena
Brucho
Stehno
Spredu Zozadu
Časti tela na podanie injekcieInjekciu si môžete podať do oblasti žalúdka (brucha), stehna alebo do zadnej časti ramena.Každý týždeň môžete použiť tú istú časť svojho tela. Ale určite si vyberte iné miesto podania injekcie na tejto časti tela.
4eUchopte injekčnú striekačku vedľa prerušovanej čiernej čiary označujúcej dávku lieku.4f Stiahnuť
Stiahnitekrytzihly.Neotáčajte ním.Dávajte pozor, aby ste netlačili na piest.
Môže sa stať, že po odstránení krytu uvidíte 1 alebo 2 kvapky tekutiny. Je to normálny jav.
4g
Uistite sa, že používate injekčnú techniku, ktorú vám odporučil lekár alebo diabetologická sestra.
Pamätajte si: injekciu Bydureonu si musíte podať ihneď po jej zmiešaní.
Vpichnite si ihlu do kože (pod kožu). Aby ste si podali celú dávku, palcom potlačte piest nadol, až kým to už ďalej nepôjde.Vytiahnite ihlu.
Ak si nie ste istí, či ste si podali celú dávku, pozrite si Písomnú informáciu pre používateľa (časť 3).
4h. Zlikvidujte striekačku s nasadenou ihlou podľa pokynov lekára alebo diabetologickej sestry. NEPOKÚŠAJTE sa znovu nasadiť kryt na ihlu alebo ihlu znovu použiť.Nemusíte si uchovávať žiadne časti súpravy. Každá jednodávková súprava obsahuje všetko, čo potrebujete na podanie vašej týždennej dávky Bydureonu.
Nelikvidujte lieky odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
Ak prišiel čas na vašu ďalšiu týždennú dávku, začnite opäť krokom 1. Časté otázky a odpovedeAk sa vaša otázka týka: vyhľadajte otázku číslo:
Ako skoro podať injekciu po zmiešaní 1Zmiešanie lieku 2Vzduchové bublinky v injekčnej striekačke 3Nasadenie ihly 4Odstránenie krytu ihly 5Piest nie je zarovno s čiernou prerušovanou čiarou 6označujúcou dávku liekuPri podávaní injekcie sa vám nedarí stlačiť piest nadol 7Časté otázky a odpovede1. Ako dlho mám od zmiešania lieku čakať do podania injekcie?Injekciu Bydureonu si musíte podať ihneď po jej zmiešaní. Ak si Bydureon nepodáte ihneď, liek začne v injekčnej striekačke vytvárať malé zhluky. Tieto zhluky by mohli upchať ihlu pri podávaní injekcie (pozri otázku 7).
2. Ako mám vedieť, že liek je správne zmiešaný?Ak je liek správne zmiešaný, má byť zakalený. Na bokoch a na dne liekovky nesmie byť žiadny nerozpustený prášok.
Ak predsa len vidíte nerozpustený prášok, silno liekovkou zatraste a pritom stálepalcom tlačte piest nadol. (Táto otázka súvisí s krokmi v častiach 3a až 3d).
3. Som pripravený/á podať si injekciu. Čo mám robiť, keď zbadám v injekčnej striekačke vzduchové bublinky?
Prítomnosť vzduchových bubliniek v injekčnej striekačke je normálny jav. Vzduchové bublinky vám neublížia ani nijako neovplyvnia dávku lieku. Bydureon sa injekčne podáva do kože (pod kožu). Pri tomto type podania injekcie vzduchové bublinky nie sú problém.
4. Čo mám robiť, ak sa mi nedarí nasadiť ihlu?
Najprv sa uistite, či ste odstránili modrý kryt. Potom naskrutkujte ihlu na injekčnú striekačku tak, aby tesne priliehala. Aby ste neprišli o liek, pri nasadzovaní ihly netlačte na piest. Ak potrebujete viac informácií o injekčných technikách, obráťte sa na zdravotníckych pracovníkov.
(Táto otázka súvisí s krokom 4a).
5. Čo mám robiť, ak sa mi nedarí odstrániť kryt ihly?
Jednou rukou uchopte injekčnú striekačku vedľa prerušovanej čiernej čiary označujúcej dávku lieku. Druhou rukou uchopte kryt ihly. Stiahnite kryt ihly priamo dolu. Neotáčajte ním. (Táto otázka sa týka kroku 4f).
6. Som pri kroku 4c. Čo mám robiť, ak sa vrchná časť piestu dostala za prerušovanú čiernu čiaru označujúcu dávku lieku?
Prerušovaná čierna čiara označujúca dávku lieku ukazuje, aká má byť správna dávka. Ak ste stlačili vrchnú časť piestu tak, že sa dostala za túto čiaru, pokračujte od kroku 4d a podajte si injekciu.
O týždeň, pred podaním ďalšej injekcie, si pozorne preštudujte inštrukcie pri krokoch 3a až 4h.
7. Čo mám robiť, keď pri podávaní injekcie nedokážem stlačiť piest celkom dolu?
Znamená to, že sa ihla upchala. Odstráňte ihlu a nahraďte ju náhradnou ihlou zo súpravy. Potom si vyberte iné miesto podania injekcie a dokončite podanie injekcie.
Na zopakovanie postupu ako:
· odstrániť modrý kryt z ihly, pozri krok 1d
· nasadiť ihlu, pozri krok 4a
· odstrániť kryt ihly a podať injekciu, pozri kroky 4e až 4g
Ak sa vám stále nedarí stlačiť piest celkom dolu, vytiahnite ihlu. Ak si nie ste istí, či ste si podali celú dávku, pozrite si Písomnú informáciu pre používateľa (časť 3) a zistite, čo treba urobiť.
Aby sa vám neupchala ihla, vždy poriadne zmiešajte liek a injekciu podajte hneď po zmiešaní.
Bydureon treba užívať len raz týždenne.
Zapíšte si, že ste si Bydureon už dnes podali a zaznačte si v kalendári, kedy máte dostať ďalšiu injekciu.
Kde sa dozviem viac o Bydureone?
· Obráťte sa na svojho lekára, lekárnika alebo diabetologickú sestru
· Prečítajte si podrobne Písomnú informáciu pre používateľa
NÁVOD NA POUŽITIE
Pred použitím si dôkladne prečítajte tieto pokyny.
Bydureo
n 2 mg prášok a disperzné prostredie na injekčnú suspenziu s predĺženým uvoľňovaním v naplnenom pere
A
k
o používať Bydureon naplnené pero
Pre
m iešav ac ie ok no
P
r
u
h označenia
Tlačidlo
K
r
yt
I
h
l
a
Horná časť pera
kontroln
é oki enko
Zelený zn ak
O
r
a
nžový znak
Pred použitím pera sa odporúča, aby vás lekár alebo diabetologická sestra vyškolili v správnom používaní.
Pokiaľ školená osoba nemôže pomôcť s aplikáciou tohto lieku, neodporúča sa pre osoby, ktoré sú slepé alebo slabozraké.
1. krok: Príprava pera
A
. Nechajte pero zohriať.
Vyberte jedno pero z chladničky a nechajte ho
dosiahnuť izbovú teplotu počas minimálne 15 minút.
NEPOUŽÍVAJTE pero po uplynutí dátumu exspirácie.
Umyte si ruky, kým sa pero zohrieva.B. Otvorte zásobníkodlúpnutím rohu fólie. Potom vyberte pero
a ihlu.
NEPOUŽÍVAJTE pero ani ihlu, ak je niektorá časť zlomená alebo chýba.
C. Skontrolujte tekutinuvo vnútri kontrolného okienka. Má byť číra
a nemá obsahovať častice. Je normálne, ak uvidíte v tekutine vzduchové bubliny.
15 Minút
Minút
D
. Odtrhnite papierový štítok
z krytu ihly.
E. Nasaďte ihlu na pero
stlačením a otočením na hrot pera, až kým
nebude pevne nasadená. Zatiaľ
NEODSTRAŇUJTE kryt ihly.
S
T
OP
NEPOKRAČUJTE
, pokiaľ nie je nasadená ihla.
2
. krok: Zmiešajte dávku
A
. Liek zmiešajte.
Držte pero kolmo vo zvislej polohe s krytom
ihly smerujúcim čo najvyššie,
pomaly otáčajte kolieskom proti smeru hodinových ručičiek. Ak budete počuť kliknutie a zmizne zelený štítok,
PRESTAŇTE otáčať.
Držte vzpriamene KLIK!
B
. Silno pretrepávajte perom, aby sa liek
zmiešal.
· Držte pero za koniec s oranžovým štítkom a
pero silno pretrepávajte oproti dlani.·
OTÁČAJTE pero po pár úderoch
BEZ TOHO, aby ste otočili kolieskom.
· Naplnené pero silno pretrepávajte, kým nezískate rovnomerne zakalenú suspenziu bez zhlukov.
· Možno budete musieť pretrepávať 80-krát alebo aj viac.
80 krát alebo aj viac
C
. Skontrolujte suspenziu.
Držt
e pero oproti svetlu a prezrite obe strany zmiešavacieho okienka. Roztok nemá obsahovať
ZHLUKY a má byť rovnomerne zakalený.
Nezmiešaný dobre
Zhluk
y
Nerovnomerne zakalené
Zmiešaný dobre
Žiadn
e zhluky
,
rovnomern
e zakalené
S
T
OP
Lie
k sa musí dôkladne premiešať, aby ste získali kompletnú dávku.
A
k sa nezmieša dôkladne, pretrepávajte ho dlhšie a silnejšie. NEPOKRAČUJTE, pokiaľ váš liek nie je dôkladne premiešaný.
Liek sa musí dôkladne premiešať, aby ste získali kompletnú dávku. Ak sa nezmieša dôkladne,
pretrepávajte ho dlhšie a silnejšie. Je normálne, ak v tekutine spozorujete vzduchové bubliny a tieto bubliny nespôsobia žiadne poškodenie.
D
. Porovnajte obe strany zmiešavacieho okienka s nižšie uvedenými fotkami,
pričom pero držíte oproti papieru. Venujte pozornosť povrchu dna. Ak nespozorujete zhluky, ste pripravení na aplikáciu.
Pozrite sa na pero
Poklepte
Pripraven
é na podanie
3. krok: Aplikujte dávku
DÔLEŽITÉ: Keď je liek dôkladne zmiešaný, ihneď musíte aplikovať dávku. Nemôžete si ju odložiť na neskoršie použitie.
A. Vyberte miesto vpichuv oblasti brucha, stehna alebo zadnej časti ramena. Každý týždeň môžete použiť tú istú
časť tela, ale vyberte si odlišné miesto vpichu v tejto oblasti.
Jemne očistite oblasť mydlom a vodou alebo liehovým tampónom.
B. Otáčajte kolieskom, aby ste uvoľnili injekčné tlačidlo.Držte
pero kolmo vo zvislej polohe s krytom ihly smerujúcim čo najvyššie
, otáčajte
kolieskom proti smeru hodinových ručičiek, až kým nezmizne oranžový štítok a kým sa neuvoľní injekčné tlačidlo. Zatiaľ
NESTLÁČAJTE injekčné tlačidlo.
C. Odstráňte kryt ihlypriamym vytiahnutím.
NEOTÁČAJTE.
Môžete spozorovať niekoľko kvapiek tekutiny na ihle alebo kryte.
Držte vzpriameneODSTRÁŇTEInjekčné tlačidlo
D
. Liek aplikujte.
Vpichnite ihlu do kože (subkutánne). Palcom
stláčajte injekčné tlačidlo, až kým nebudete počuť kliknutie.
Podržte 10 sekúnd, aby ste sa uistili, že ste podali úplnú dávku.
E. Pero s nasadenou ihlou vhodným spôsobom zlikvidujtedo kontajnera odolného voči prepichnutiu.
NEPOKÚŠAJTE SA opätovne nasadiť kryt
ihly alebo opätovne používať ihlu.
STLAČIŤ A PODRŽAŤ10Sekúnd
Často kladené otázky a odpovede
1. Ako mám vedieť, že je liek dôkladne premiešaný?
Liek je dôkladne premiešaný, keď je tekutina zakalená z oboch strán okienka. Nemali by ste vidieť zhluky v tekutine. Môže pomôcť, keď budete pero držať hore oproti svetlu a pozerať do
okienka. Keď uvidíte zhluky akejkoľvek veľkosti, ďalej silno pretrepávajte perom oproti dlani, až kým sa nepremieša.
2. Mám problémy so zmiešaním svojej dávky. Čo mám robiť?
Nezabudnite pred prípravou svojej dávky ponechať pero vybraté z chladničky aspoň počas 15 minút. To umožní, že pero dosiahne izbovú teplotu. Bude ľahšie liek zmiešať, keď pero dosiahne izbovú teplotu.
Uistite sa, že držíte pero za koniec s kolieskom a oranžovým štítkom. To vám pomôže lepšie uchopiť pero a silnejšie preklepávať oproti dlani.
Môže tiež pomôcť, keď budete pretrepávať zmiešavacie okienko oproti dlani. Ak spozorujete
zhluky, pokračujte v pretrepávaní.
3. Ako dlho môžem čakať s podaním injekcie po zmiešaní lieku?
Dávku si musíte podať ihneď po zmiešaní. Ak si dávku neaplikujete hneď, v pere sa môžu tvoriť zhluky lieku a nemusíte si podať úplnú dávku.
4. Som pripravený aplikovať si dávku. Čo mám robiť, ak spozorujem vzduchové bubliny v pere?
Je normálne, že v pere sú vzduchové bubliny. Liek sa aplikuje do kože (pod kožu). Vzduchové
bubliny vám neuškodia ani neovplyvnia vašu dávku pri tomto type injekcie.
5. Čo mám robiť, ak nemôžem úplne stlačiť injekčné tlačidlo pri aplikácii svojej dávky?
Uistite sa, či ste pevne nasadili ihlu na pero. Tiež sa uistite, či ste koliesko otočili nadoraz, či oranžový štítok zmizol a či sa objavilo injekčné tlačidlo.
Ak stále nemôžete zatlačiť tlačidlo, môže to znamenať, že je ihla upchatá. Vytiahnite ihlu z kože a nahraďte je náhradnou ihlou pribalenou v škatuli. Pozrite si, ako nasadiť ihlu. Potom vyberte odlišné miesto vpichu a dokončite aplikáciu injekcie.
Ak stále nemôžete úplne zatlačiť tlačidlo, vytiahnite ihlu z kože. Na likvidáciu pera s nasadenou ihlou použite kontajner odolný voči prepichnutiu.
6. Ako môžem vedieť, či som si aplikoval úplnú dávku?
Na uistenie sa, či ste si aplikovali úplnú dávku, palcom zatlačte injekčné tlačidlo, až kým
nebudete počuť kliknutie. Po kliknutí ďalej držte ihlu v koži počas 10 sekúnd. To predstavuje dostatok času na to, aby mohlo celé množstvo lieku prejsť do kože.
7. Ako mám zlikvidovať svoje pero Bydureon?
Budete potrebovať kontajner odolný voči prepichnutiu, ktorý je dostatočne veľký na to, aby sa
do neho zmestilo pero s nasadenou ihlou. Uistite sa, že kontajner má vrchnák. Môžete použiť kontajner na biologicky nebezpečný odpad, iný obal z tvrdého plastu alebo kovový kontajner. Kontajner nie je pribalený v škatuli.
Spýtajte sa svojho lekárnika, ako bezpečne zlikvidovať kontajner s použitými perami a ihlami. Neodhadzujte kontajner do vášho domového odpadu.
NÁVOD NA POUŽITIE
Pred použitím si dôkladne prečítajte tieto pokyny.
Prečítajt
e si aj písomnú informáciu pre používateľa, ktorá je v škatuľke vášho lieku.
Bydureo
n 2 mg injekčná suspenzia s predĺženým uvoľňovaním v naplnenom pere exenatid
Ra
z týždenne
Le
n na podkožné použitie
Jednodávko
vé naplnené pero
BCise je názov naplneného pera používaného na injekčnú aplikáciu Bydureonu.

Predtým, ako začnete
Pero Bydureon BCise:
− Je pero na jednorazové použitie s fixnou dávkou, ktoré automaticky podáva injekciu vášho lieku.
− Predtým, ako ho použijete, sa dodáva sa v uzamknutej polohe. Pero neodomkýnajte pokiaľ nie ste pripravený na podanie injekcie.
− Ihla je skrytá. Pred použitím, počas používania ani po použití pera ju neuvidíte.
• Pero
nepoužívajte, ak sa vám zdá, že ktorákoľvek súčasť je pokazená alebo poškodená.
• Uchovávajte vo vodorovnej polohe v chladničke pri teplote 2 °C až 8 °C.
• Ľudia trpiaci slepotou alebo ľudia s obmedzenou zrakovou schopnosťou
nemajú používať pero
Bydureon BCise bez pomoci inej osoby, ktorá bola vyškolená ako používať túto pomôcku.
• Pero a všetky lieky uchovávajte mimo dosahu detí.
Pred použitímPredtým, ako tento liek použijete prvýkrát, by vás mal váš lekár alebo diabetologická sestra vyškoliť ako injekčne podať tento liek
 LiekObrázok APomôcky potrebné na podanie injekcie:•
LiekObrázok APomôcky potrebné na podanie injekcie:• Pero Bydureon BCise • alkoholový tampón • čistý, vodorovný povrch • nádoba na ostré predmety
(pozri pokyny na „likvidáciu“ na konci tohto návodu)
KROK 1: Príprava na podanie injekcie
A
. Nechajte pero dosiahnuť izbovú teplotu.
Vyberte 1 pero z chladničky a nechajte ho ležať vo vodorovnej polohe 15 minút. Pero Bydureon BCise sa môže uchovávať pri izbovej teplote až 4 týždne.
POČKAJTE Minút
Minút
Obrázok B
B
. Skontrolujte dátum použiteľnosti (označený EXP), ktorý je vytlačený na štítku pera. Pero nepoužívajte po uplynutí dátumu použiteľnosti.
 Obrázok C
Obrázok C
C
. Umyte si ruky.
D
. Vyberte si miesto podania injekcie.
Buď do brucha, stehna alebo zadnej časti ramena, pozri obrázok D.
Každý týždeň môžte použit rovnakú časť tela, vyberte si však odlišné miesto podania injekcie v tejto časti vášho tela.
Toto miesto očistite alkoholovým tampónom.

 Predná strana Zadná stranaObrázok D
Predná strana Zadná stranaObrázok D
KROK 2: Premiešajte liek
A
. Skontrolujte okienko.
Po stranách, na dne alebo vrchnej strane okienka
môžete pozorovať biele stopy lieku. Znamená to,
že liek nie je rovnomerne premiešaný.
 Skontrolujte
Skontrolujte
B
. Pero silno pretrepte,
kmitavým pohybom, až kým liek nie je rovnomerne premiešaný a nie je možné pozorovať akékoľvek biele stopy lieku po stranách, na dne alebo vrchnej strane okienka. Pretrepávajte aspoň
15 sekúnd.
Silno pretrepte
Obrázok E
 Obrázok F
C
. Skontrolujte suspenziu.
Obrázok F
C
. Skontrolujte suspenziu.
Pero držte oproti svetlu a skontrolujte obe strany a dno okienka. Ak liek nie je dostatočne premiešaný, opakujte krok 2 a opäť skontrolujte.
NEDOSTATOČNE premiešanýNerovnomerne premiešaný

Biele stopy lieku na
dne, vrchnej strane alebo po stranách
Obrázok GDostatočne premiešanýRovnomerne premiešaný

Zakalený
Prítomnosť bublín je v poriadku
Obrázok H
 Nepokračujt
e
Nepokračujt
e v ďalšom kroku pokiaľ váš liek nie je dostatočne premiešaný. Aby ste dostali úplnú dávku,
liek musí byť dostatočne premiešaný a zakalený.
Ak nie je dostatočne premiešaný, pokračujte v silnom pretrepávaní.
KROK 3: Pripravte peroDôležité: Po úplnom premiešaní lieku musíte
okamžite nasledovať kroky na prípravu a liek si injekčne podať, aby ste dostali úplnú dávku. Neodkladajte ho na neskoršie použitie.
Pero odomknite iba vtedy, ak ste pripravený na injekčné podanie.
A. Odomknite pero.Pero držte v zvislej polohe s oranžovým krytom smerom nahor. Otočte otočným gombíkom z uzamknutej polohy do odomknutej polohy až kým nezačujete kliknutie.
Uzamknuté KlikObrázok I
KlikObrázok I OdomknutéObrázok JB. Počas toho, ako stále držíte pero vo zvislej polohe, opatrne odskrutkujte oranžový kryt.•
OdomknutéObrázok JB. Počas toho, ako stále držíte pero vo zvislej polohe, opatrne odskrutkujte oranžový kryt.• Môže byť potrebné otočiť krytom niekoľkokrát predtým, ako povolí (ak počas otáčania začujete kliknutie, otáčate nesprávnym smerom).
• Pero stále držte vo zvislej polohe, aby ste zabránili náhodnému vytečeniu lieku.
• Po odstránení krytu sa objaví zelený chránič ihly. Zelený chránič ihly ukrýva ihlu.
Je v poriadku, ak spozorujete niekoľko kvapiek tekutiny vo vnútri krytu. Kryt opätovne
nenasadzujtena pero.
Kryt odhoďte.

Držte vo
zvislej polohe a
opatrne odskrutkujte kryt
 Obrázok K Obrázok L
Obrázok K Obrázok L
Obrázok M Obrázok N
KROK 4: Injekčne si podajte dávku
A
. Injekčne podajte a podržte:
• Pero pritlačte oproti koži. Keď sa začne injekčné podanie, začujete „klik“.
• Pero držte priložené oproti koži 15 sekúnd. Zabezpečí to podanie úplnej dávky.
PRITLAČTE A DRŽTE
 Klik
Sekúnd
Klik
Sekúnd
Obrázok O
B
. Uistite sa, že ste dostali vašu úplnú dávku.
Po tom, ako si podáte injekciu, v okienku uvidíte oranžový piest. Po uvoľnení pera od kože sa zelený chránič ihly opäť vysunie a uzamkne ihlu. Ak po podaní injekcie v okienku nevidíte oranžový piest, pozrite si Často kladené otázky a odpovede, aby ste zistili čo robiť.
Oranžový piestObrázok PC. Likvidácia.
piestObrázok PC. Likvidácia.
Ihne
ď po použití pero zlikvidujte správnym
spôsobom, ako vás poučil váš lekár, lekárnik
alebo diabetologická sestra.
Budete potrebovať nádobu na ostré predmety, ktorá:
· je dostatočne veľká na to, aby sa do nej
zmestilo celé pero,
· má príklop,
· nie je deravá,
· je náležite označená varovaním o obsahu nebezpečného odpadu vo vnútri nádoby.
Môžete použiť nádobu na biologicky nebezpečný odpad, inú nádobu z tvrdého plastu alebo kovu.
Obrázok Q
Často kladené otázky a odpovede
1. Kde sa nachádza ihla?
Ihla je zabudovaná v pere a je zakrytá oranžovým krytom.
Keď odskrutkujete oranžový kryt, zelený chránič ihly prekrýva ihlu predtým, ako si podáte injekciu.
Pre viac informácií si pozrite obrázok N v kroku 3B v Návode na použitie.
2. Ako mám vedieť, že je liek dôkladne premiešaný?
Po pretrepaní pera skontrolujte okienko z oboch strán. Po stranách, na dne ani na vrchnej strane
nesmiete spozorovať žiadne biele stopy lieku. Ak spozorujete biele stopy lieku, znamená to, že nie je dostatočne premiešaný. Pero silno pretrepte, aby ste liek premiešali, až kým biele stopy lieku po stranách, na dne alebo na vrchnej strane okienka zmiznú. Liek by mal byť v celom objeme rovnomerne premiešaný (pozri obrázok G a obrázok H v kroku 2C).
3. Prečo mám počas odstraňovania krytu držať pero vo zvislej polohe?
Držanie pera vo zvislej polohe s oranžovým krytom smerujúcim nahor môže zabrániť vytečeniu lieku.
Je normálne, ak po odskrutkovaní spozorujete v oranžovom kryte niekoľko kvapiek lieku.
4. Prečo si mám liek inječne podať okamžite po premiešaní?
Ak si liek injekčne nepodáte okamžite po premiešaní, liek sa môže usadiť a vy nedostanete úplnú
dávku. Váš liek môžte opätovne premiešať pokiaľ je pero v uzamknutej polohe. Ak ste ho však už odomkli, musíte okamžite nasledovať kroky na prípravu a liek si injekčne podať, aby ste dostali úplnú dávku. Nesmiete ho odložiť na neskoršie použitie.
5. Ako môžem vedieť, či som si podal úplnú dávku lieku?
Aby ste sa uistili, že si podáte úplnú dávku, pritlačte pero oproti koži a držte.
Zacítite, že ihla prenikla do vašej kože. Ihlu držte oproti koži 15 sekúnd. Zabezpečí sa tým dostatočný čas na podkožné podanie všetkého lieku z pera. Po vytiahnutí ihly skontrolujte prítomnosť oranžového piestu v okienku, ktorý naznačuje, že dávka bola podaná. Ak sa oranžový piest v okienku neobjaví, kontaktujte miestneho zástupcu držiteľa rozhodnutia o registrácii lieku (zoznam kontaktov pre jednotlivé krajiny nájdete v časti 6 písomnej informácie pre používateľa).
6. Prečo mám pero uchovávať vo vodorovnej polohe v chladničke?
Liek v perách uchovávaných vo zvislej polohe (ihlou smerom nahor alebo nadol) je ťažšie premiešateľný. Takýto liek je stále možné dôkladne premiešať, bude potrebné ho však dlhšie
pretrepávať a zaberie to viac času.
7. Ako mám pero Bydureon BCise zlikvidovať?
Pero nelikvidujte domovým odpadom. Budete potrebovať nádobu na ostré predmety, ktorá je dostatočne veľká na to, aby sa do nej zmestilo celé pero. Uistite sa, že nádoba má príklop. Môžete použiť nádobu na biologicky nebezpečný odpad, inú nádobu z tvrdého plastu alebo kovu. Nádoba nie je súčasťou balenia lieku.
Nádobu s použitými perami opätovne nepoužívajte. Opýtajte sa lekárnika, ako ju bezpečne zlikvidovať. Nádobu nevyhadzujte do domového odpadu.
8. Čo mám robiť, ak pomôcka nefunguje a nedá sa odomknúť?
Preštudujte si krok 3 Návodu na použitie, aby ste skontrolovali následnosť krokov, potom kontaktujte
miestneho zástupcu držiteľa rozhodnutia o registrácii lieku (zoznam kontaktov pre jednotlivé krajiny nájdete v časti 6 písomnej informácie pre používateľa). Nesnažte sa ho odomknúť násilne alebo pomocou nástrojov.
9. Čo mám robiť, ak pomôcka nefunguje a nedá sa odskrutkovať oranžový kryt?
Preštudujte si krok 3 Návodu na použitie, aby ste skontrolovali následnosť krokov, skontrolujte tiež, či
je otočný gombík v odomknutej polohe, potom kontaktujte miestneho zástupcu držiteľa rozhodnutia
o registrácii lieku (zoznam kontaktov pre jednotlivé krajiny nájdete v časti 6 písomnej informácie pre
používateľa). Nesnažte sa kryt odskrutkovať pomocou nástrojov alebo násilne.
10
. Kde nájdem viac informácií o pere Bydureon BCise?
· Porozprávajte sa so svojím lekárom, lekárnikom alebo diabetologickou sestrou.
· Pozorne si prečítajte písomnú informáciu pre používateľa.
Ako uchovávať pero Bydureon BCise
• Uchovávajte ho vo vodorovnej polohe v chladničke pri teplote 2 °C až 8 °C.
• Každé pero sa podľa potreby môže uchovávať pri teplote neprevyšujúcej 30 °C počas maximálne
4 týždňov.
• Uchovávajte ho v obale, v ktorom sa dodáva, na ochranu pred svetlom, až kým nie ste pripravený na prípavu a podanie vašej dávky.
• Nepoužívajte ho po uplynutí dátumu použiteľnosti. Dátum použiteľnosti je vyznačený pri skratke
„EXP“.
• Pero udržiavajte čisté a chráňte ho pred v