
úce dávky)
6,7 (prvé 4 dávky)
10 (nasledujúce dávky)

2 roky a starší 300 10
Spôsob podávaniaIntracerebroventrikulárne použitie.
Opatrenia pred zaobchádzaním alebo podaním liekuPri príprave a podávaní je nutné prísne dodržiavať aseptické postupy.
Brineura a preplachovací roztok sa smú podávať len intracerebroventrikulárnou cestou. Každá injekčná
liekovka Brineury a preplachovacieho roztoku sú určené len na jednorazové použitie.
Brineura sa podáva do mozgovomiechového moku (Cerebrospinal fluid -CSF) infúziou cez chirurgicky implantovaný zásobník a katéter (zariadenie na intracerebroventrikulárny prístup). Zariadenie na intracerebroventrikulárny prístup sa musí implantovať pred prvou infúziou. Implantované zariadenie na intracerebroventrikulárny prístup má byť vhodné na vytvorenie prístupu do mozgových komôr na účely terapeutického podávania.
Po infúzii Brineury sa musia infúzne komponenty vrátane zariadenia na intracerebroventrikulárny prístup prepláchnuť vypočítaným množstvom preplachovacieho roztoku, aby sa zaistilo podanie celej dávky Brineury a aby sa zachovala priechodnosť zariadenia na intracerebroventrikulárny prístup (pozri časť 6.6). Injekčné liekovky Brineury a preplachovacieho roztoku sa pred podaním majú rozmraziť. Rýchlosť podávania infúzie Brineury a preplachovacieho roztoku je 2,5 ml/hodinu. Celkové trvanie infúzie zahŕňajúce podanie Brineury a požadovaného preplachovacieho roztoku je približne 2 až 4,5 hodiny v závislosti od podávanej dávky a objemu.
Intracerebroventrikulárna infúzia Brineury
Brineuru podajte pred preplachovacím roztokom.
1. Infúznu hadičku označte nápisom „Len na intracerebroventrikulárnu infúziu“.
2. Ak používate predlžovaciu hadičku, pripojte k nej injekčnú striekačku obsahujúcu Brineuru, inak pripojte injekčnú striekačku k infúznej súprave. Infúzna súprava musí byť vybavená 0,2 µm líniovým filtrom. Pozri obrázok 1.
3. Naplňte infúzne komponenty Brineurou.
4. Skontrolujte, či sa na skalpe nenachádzajú známky unikania tekutiny alebo poruchy zariadenia na intracerebroventrikulárny prístup alebo prejavy možných infekcií (opuch, erytém skalpu, extravazácia tekutiny alebo vydutie skalpu okolo zariadenia na intracerebroventrikulárny prístup alebo nad ním). Nepodávajte Brineuru, ak sa objavia prejavy a príznaky akútneho unikania tekutiny zo zariadenia na intracerebroventrikulárny prístup, zlyhania zariadenia alebo infekcie súvisiacej so zariadením (pozri časti 4.3 a 4.4).
5. Pripravte skalp na intracerebroventrikulárnu infúziu s použitím aseptického postupu podľa
štandardov starostlivosti v danom zdravotníckom zariadení.
6. Zaveďte vstupnú ihlu do zariadenia na intracerebroventrikulárny prístup.
7. K vstupnej ihle pripojte samostatnú prázdnu sterilnú injekčnú striekačku (nie väčšiu ako 3 ml).
Naberte 0,5 ml až 1 ml CSF na kontrolu priechodnosti zariadenia na intracerebroventrikulárny prístup.
· Nevracajte CSF do zariadenia na intracerebroventrikulárny prístup. Vzorky CSF sa majú
štandardne poslať na monitorovanie infekcie (pozri časť 4.4).
8. Pripojte infúznu súpravu k vstupnej ihle (pozri obrázok 1).
· Zaistite komponenty podľa štandardov starostlivosti v danom zdravotníckom zariadení.
9. Vložte injekčnú striekačku obsahujúcu Brineuru do lineárneho dávkovača a naprogramujte ho na
rýchlosť podávania infúzie 2,5 ml za hodinu.
· Alarmy dávkovača naprogramujte tak, aby sa spustili pri najcitlivejších medzných hodnotách tlaku, rýchlosti a objemu. Podrobné informácie sú uvedené v návode na použitie od výrobcu
lineárneho dávkovača.
· Nepodávajte ako bolus ani ručne.
10. Infúziu Brineury začnite rýchlosťou 2,5 ml za hodinu.
11. Počas infúzie pravidelne kontrolujte, či infúzny systém nevykazuje známky unikania tekutiny alebo
zlyhania podávania.
12. Po skončení infúzie sa presvedčte, či je injekčná striekačka označená ako „Brineura“ v lineárnom dávkovači prázdna. Odpojte a vyberte prázdnu injekčnú striekačku z dávkovača a odpojte ju od hadičky. Prázdnu injekčnú striekačku zlikvidujte v súlade s národnými požiadavkami.
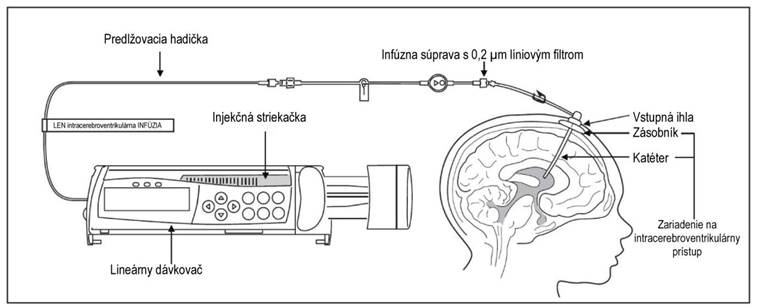 O
brázok 1: Zostavenie infúzneho systému
I
ntracerebroventrikulárna infúzia preplachovacieho roztoku
O
brázok 1: Zostavenie infúzneho systému
I
ntracerebroventrikulárna infúzia preplachovacieho roztoku
Dodaný preplachovací roztok podajte
po skončení infúzie Brineury.
1. Pripojte injekčnú striekačku obsahujúcu vypočítaný objem preplachovacieho roztoku k infúznym
komponentom (pozri časť 6.6).
2. Vložte injekčnú striekačku obsahujúcu preplachovací roztok do lineárneho dávkovača
a naprogramujte ho na rýchlosť podávania infúzie 2,5 ml za hodinu.
· Alarmy dávkovača naprogramujte tak, aby sa spustili pri najcitlivejších medzných hodnotách tlaku, rýchlosti a objemu. Podrobné informácie sú uvedené v návode na použitie od výrobcu lineárneho dávkovača.
·
Nepodávajte ako bolus ani ručne.3. Infúziu preplachovacieho roztoku začnite rýchlosťou 2,5 ml za hodinu.
4. Počas infúzie pravidelne kontrolujte, či infúzne komponenty nevykazujú známky unikania tekutiny
alebo zlyhania podávania.
5. Po skončení infúzie sa presvedčte, či je injekčná striekačka označená ako „preplachovací roztok“
v lineárnom dávkovači prázdna. Odpojte a vyberte prázdnu injekčnú striekačku z dávkovača
a odpojte ju od infúznej hadičky.
6. Odstráňte vstupnú ihlu. Jemne stlačte a obviažte miesto podania infúzie podľa štandardov
starostlivosti v danom zdravotníckom zariadení.
7. Infúzne komponenty, ihly, nepoužité roztoky a iné odpadové materiály zlikvidujte v súlade s národnými požiadavkami.
Pokyny na prípravu Brineury a preplachovacieho roztoku pred podaním sú uvedené v časti 6.6.
4.3 KontraindikácieŽivot ohrozujúca anafylaktická reakcia na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1, keď pokusy o opätovné nasadenie boli neúspešné (pozri časť 4.4).
Pacienti s CLN2 s ventrikuloperitoneálnymi skratmi.
Brineura sa nesmie podávať v prípade známok akútneho unikania tekutiny zo zariadenia na intracerebroventrikulárny prístup, poruchy zariadenia alebo infekcie súvisiacej so zariadením (pozri časti 4.2 a 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
K
omplikácie súvisiace so zariadením
Brineura sa musí podávať aseptickým postupom, aby sa znížilo riziko infekcie. V klinických štúdiách sa
pozorovali prípady infekcií súvisiacich so zariadením na intracerebroventrikulárny prístup. V týchto prípadoch sa podali antibiotiká, zariadenie na intracerebroventrikulárny prístup sa vymenilo a pokračovalo sa v liečbe Brineurou.
Zdravotnícki pracovníci majú pred každou infúziou skontrolovať celistvosť kože skalpu, aby sa uistili, že zariadenie na intracerebroventrikulárny prístup je neporušené. Pred začatím infúzie Brineury sa musí vykonať kontrola miesta podania infúzie a kontrola priechodnosti, aby sa zistilo prípadné unikanie tekutiny zo zariadenia na intracerebroventrikulárny prístup a/alebo jeho porucha (pozri časti 4.2 a 4.3). Na potvrdenie neporušenosti zariadenia môže byť potrebná konzultácia s neurochirurgom. Liečba Brineurou sa má
v prípade poruchy zariadenia prerušiť a pred ďalšími infúziami bude možno potrebné zariadenie na prístup
vymeniť.
V prípade komplikácií súvisiacich so zariadením na intracerebroventrikulárny prístup nájdete ďalšie pokyny na označení obalu zariadenia od výrobcu.
Opatrnosť je potrebná u pacientov náchylných na komplikácie v dôsledku podávania intracerebroventrikulárneho lieku vrátane pacientov s obštrukčným hydrocefalom.
Klinické a laboratórne monitorovanie
Pred začiatkom podávania infúzie v zdravotníckom zariadení, pravidelne počas nej i po nej sa majú
monitorovať životné funkcie. Po skončení infúzie sa má klinicky vyhodnotiť stav pacienta, pričom ak je to klinicky indikované, môže byť potrebné dlhodobejšie sledovanie, najmä u pacientov mladších ako 3 roky.
U pacientov s bradykardiou, poruchou vedenia srdcových vzruchov alebo so štrukturálnym ochorením srdca
v anamnéze sa má počas infúzie monitorovať elektrokardiogram (EKG), lebo u niektorých pacientov s CLN2
sa môžu rozvinúť poruchy vedenia srdcových vzruchov alebo ochorenie srdca. U pacientov s normálnou
funkciou srdca sa má každých 6 mesiacov vykonať vyšetrenie pomocou 12-zvodového EKG.
Vzorky CSF sa majú pravidelne posielať na testovanie výskytu subklinických infekcií súvisiacich so zariadením (pozri časť 4.2).
Pediatrická populácia
Do klinických skúšaní neboli zaradení žiadni pacienti s pokročilou progresiou ochorenia na začiatku liečby
a nie sú k dispozícii žiadne klinické údaje o deťoch vo veku < 2 roky. Pacienti s pokročilým ochorením
CLN2 a novorodenci môžu mať zníženú celistvosť hematoencefalickej bariéry. Účinky potenciálne zvýšenej
expozície lieku na periférny systém nie sú známe.
Anafylaxia
Počas klinických skúšaní s Brineurou nebola hlásená anafylaxia, riziko anafylaxie však nemožno vylúčiť.
Zdravotnícki pracovníci by mali poznať možné príznaky anafylaxie, ako je celková žihľavka, pruritus alebo
návaly horúčavy, opuch pier, jazyka a/alebo uvuly, dyspnoe, bronchospazmus, stridor, hypoxémia, hypotónia, synkopa alebo inkontinencia. Pri podávaní Brineury má byť ako bezpečnostné opatrenie rýchlo dostupná vhodná medicínska podpora. V prípade výskytu anafylaxie sa má pri opätovnom podávaní postupovať opatrne.
Obsah sodíka
Tento liek obsahuje 44 mg sodíka na injekčnú liekovku Brineury a preplachovacieho roztoku. To treba vziať
do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie. Cerliponáza alfa je rekombinantný ľudský proteín a systémová expozícia je obmedzená vzhľadom na intracerebroventrikulárne podávanie, preto je nepravdepodobné, že by sa vyskytli interakcie medzi cerliponázou alfa a liekmi metabolizovanými enzýmami cytochrómu P450.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii údaje o použití Brineury u gravidných žien. Neuskutočnili sa reprodukčné štúdie na
zvieratách s Brineurou. Nie je známe, či Brineura môže pri podaní gravidnej žene spôsobiť poškodenie plodu alebo či môže mať vplyv na reprodukčnú schopnosť. Brineura sa má podávať gravidným ženám len vtedy,
keď je to jednoznačne nutné.
Dojčenie
Nie sú k dispozícii údaje o prítomnosti cerliponázy alfa v ľudskom mlieku, účinkoch cerliponázy alfa na
dojčené dieťa ani o účinkoch cerliponázy alfa na tvorbu mlieka. Dojčenie sa má počas liečby Brineurou prerušiť.
Fertilita
Neuskutočnili sa žiadne štúdie fertility na zvieratách ani na ľuďoch s cerliponázou alfa.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o vplyve Brineury na schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Nežiaduce reakcie opísané v tejto časti sa vyhodnocovali u 24 pacientov s ochorením CLN2, ktorí dostali
v klinických štúdiách trvajúcich až 141 týždňov aspoň jednu dávku Brineury. Najčastejšie (> 20 %)
nežiaduce účinky pozorované v klinických skúšaniach s Brineurou zahŕňajú pyrexiu, nízku hladinu proteínu
v CSF, abnormality v EKG, vracanie, infekcie horných dýchacích ciest a precitlivenosť. U žiadneho pacienta
nebolo potrebné prerušiť liečbu v dôsledku nežiaducich udalostí.
Tabuľkový zoznamnežiaducichreakcií
Ďalej sú uvedené nežiaduce reakcie zoradené podľa triedy orgánových systémov a frekvencie na základe
definície frekvencií podľa databázy MedDRA: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté
(≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme
(z dostupných údajov). Nežiaduce reakcie sú usporiadané v poradí klesajúcej závažnosti.
T
abuľka 2: Frekvencia nežiaducich reakcií pri podaní Brineury
T
rieda orgánových systémov
podľa databázy MedDRA
P
re
f
e
rovaný termín
podľa databázy MedDRA
F
r
ekvencia
Infekcie a nákazy Infekcia horných dýchacích ciest
Konjunktivitída
Infekcia súvisiaca so zariadeníma
Veľmi časté
Časté
Časté
Poruchy imunitného systému Precitlivenosť Veľmi časté Psychické poruchy Podráždenosť Veľmi časté Poruchy srdca a srdcovej činnosti Bradykardia Časté
Poruchy nervového systému Príhody kŕčovb Bolesť hlavy Pleocytóza CSF
Syndróm poklesnutej hlavy (Dropped head syndrome )
Poruchy gastrointestinálneho traktu Vracanie
Bolesť brucha
Pľuzgiere na ústnej sliznici
Pľuzgiere na jazyku
Porucha gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva Vyrážka
Urtikária
Celkové poruchy a reakcie v mieste podania Pyrexiac
Pocit napätia (nervozita)
Bolesť
Laboratórne a funkčné vyšetrenia Zvýšená hladina proteínu v CSF Abnormality v EKG
Znížená hladina proteínu v CSF
Problémy s produktom Problémy so zariadením: Unikanie tekutiny zo zariadenia Upchatie zariadeniad
Dislokácia zariadeniae
Problém s ihlouf
Veľmi časté Veľmi časté Veľmi časté Časté
Veľmi časté
Časté
Časté Časté Časté Časté Časté
Veľmi časté
Časté
Časté
Veľmi časté Veľmi časté Veľmi časté
Časté Časté Neznáme Veľmi časté
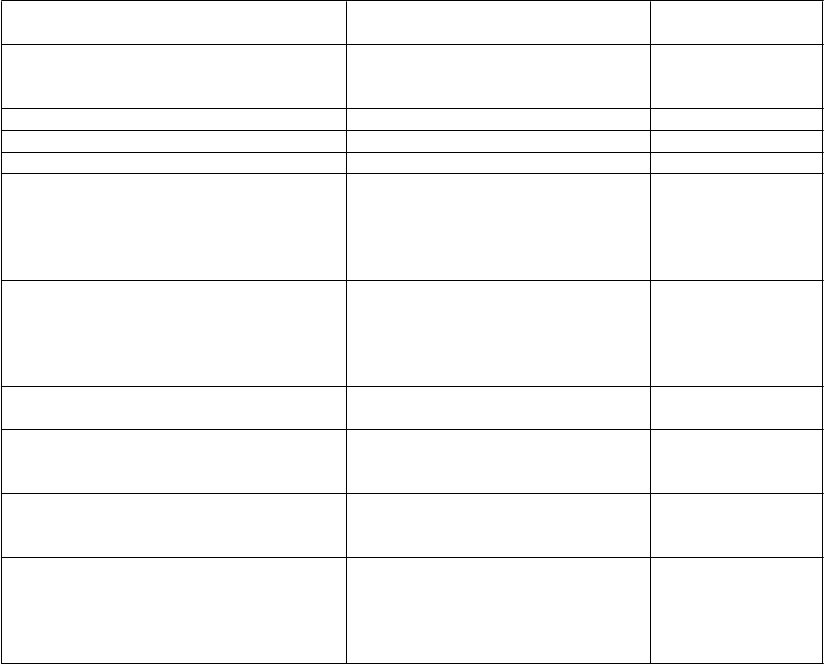
a
Propionibacterium acnes, Staphylococcus epidermisb Atonické záchvaty, klonické kŕče, záchvaty s náhlou stratou svalového tonusu („drop attacks“) , epilepsia, celkový tonicko-klonický záchvat, myoklonická epilepsia, parciálne záchvaty, absencia, záchvat, séria záchvatov a status epilepticus
c Pyrexia zahŕňa kombinované preferované termíny „pyrexia“ a „zvýšená telesná teplota“
d Upchatie prietoku v katétri
e Posunutie zariadenia sa v klinických skúšaniach nevyskytlo
f Vypudenie infúznej ihly
Opis vybranýchnežiaducichreakciíKŕčeKŕče sú častým prejavom ochorenia CLN2 a ich výskyt v tejto populácii sa očakáva. Celkovo sa udalosť, ktorá zodpovedala štandardizovanému záznamu „kŕče“ v databáze MedDRA, vyskytla
u 23 (96 %) účastníkov, ktorí dostali cerliponázu alfa. Medzi najčastejšie hlásené udalosti kŕčov patrí
záchvat, epilepsia a celkový tonicko-klonický záchvat. Celkový výskyt udalostí kŕčov s časovým vzťahom
k podaniu cerliponázy alfa bol 17 %, pričom udalosti boli mierne až stredne závažné so stupňom závažnosti
1 alebo 2. Spolu 6 % všetkých udalostí kŕčov sa považovalo za súvisiace s cerliponázou alfa, pričom boli mierne až závažné so stupňom CTCAE 1 – 4. Kŕče ustúpili po podaní štandardných antikonvulzív a neviedli k prerušeniu liečby Brineurou.
PrecitlivenosťReakcie z precitlivenosti boli hlásené u 14 z 24 pacientov (58 %) liečených Brineurou. Závažné (stupeň 3
podľa spoločných terminologických kritérií pre nežiaduce udalosti (CTCAE)) reakcie z precitlivenosti sa
vyskytli u troch pacientov, pričom u žiadneho pacienta sa liečba neprerušila. Najčastejšie prejavy zahŕňali pyrexiu s vracaním, pleocytózu alebo podráždenosť, čo nezodpovedá klasickej precitlivenosti vyvolanej imunitným systémom. Tieto nežiaduce reakcie sa pozorovali počas infúzie Brineury alebo do 24 hodín od jej skončenia a nenarušili liečbu. Príznaky ustúpili časom alebo po podaní antipyretík, antihistaminík a/alebo glukokortikosteroidov.
ImunogenicitaProtilátky proti lieku sa zistili v sére u 79 % pacientov a v CSF u 21 % pacientov liečených cerliponázou alfa
počas až 107 týždňov. V CSF sa nezistili liekovo špecifické neutralizačné protilátky, ktoré by boli schopné
inhibovať bunkový príjem cerliponázy alfa prostredníctvom receptorov. Nezistila sa žiadna súvislosť medzi titrami protilátok proti lieku v sére alebo CSF a výskytom alebo závažnosťou precitlivenosti. Pacienti,
u ktorých sa vyskytli stredne závažné nežiaduce udalosti precitlivenosti, sa testovali na výskyt liekovo
špecifickej protilátky IgE s negatívnym výsledkom. Nezistili sa žiadne korelácie medzi vyššími titrami protilátok proti lieku a nižšími hodnotami meraní účinnosti. Neprejavil sa žiadny zjavný účinok protilátok proti lieku v sére alebo CSF na farmakokinetiku plazmy alebo CSF.
Pediatrická populáciaPrebiehajúca štúdia prináša skúsenosti s dvoma pacientmi vo veku 2 roky liečenými Brineurou v dávke
300 mg jedenkrát za dva týždne (pozri časť 5.1). Obaja pacienti dostali 8 infúzií a zdá sa, že celkový bezpečnostný profil Brineury u týchto mladších pacientov zodpovedá bezpečnostnému profilu pozorovanému u starších detí. V súčasnosti nie sú k dispozícii žiadne klinické skúsenosti s Brineurou u detí mladších ako 2 roky.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie
pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNie sú k dispozícii žiadne informácie.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné liečivá pre tráviaci trakt a metabolizmus, enzýmy, ATC kód: A16AB17.
Mechanizmus účinkuCerliponáza alfa je rekombinantná forma ľudskej tripeptidylpeptidázy 1 (rhTPP1). Cerliponáza alfa je
proteolytický neaktívny proenzým (zymogén), ktorý sa aktivuje v lyzozóme. Cerliponáza alfa vstupuje do cieľových buniek a presúva sa do lyzozómov prostredníctvom manóza-6-fosfátového receptora nezávislého na katiónoch (CI-MPR, známy aj ako receptor M6P/IGF2). Profil glykozylácie cerliponázy alfa má za následok jej stabilný bunkový príjem a nasmerovanie do lyzozómov na účely aktivácie.
Aktivovaný proteolytický enzým (rhTPP1) štiepi tripeptidy z N-konca cieľového proteínu bez známej substrátovej špecifickosti. Nedostatočná hladina TPP1 spôsobuje ochorenie CLN2, ktoré má za následok neurodegeneráciu, stratu neurologickej funkcie a úmrtie v detstve.
K
l
i
n
i
cká účinnosť abezpečnosť
Bezpečnosť a účinnosť Brineury sa vyhodnocovali v otvorenej klinickej štúdii so stupňovaním dávky
(190-201) a v prebiehajúcej dlhodobej rozšírenej štúdii (190-202) u pacientov s ochorením CLN2
v porovnaní s neliečeným pacientmi s ochorením CLN2 z databázy prirodzeného vývoja (kontrolná skupina s prirodzeným vývojom ochorenia). V týchto štúdiách sa na vyhodnotenie progresie ochorenia použila
kombinácia motorickej a jazykovej domény klinickej hodnotiacej stupnice špecifickej pre toto ochorenie
(pozri tabuľku 3). Každá doména zahŕňa skóre 3 (zhruba normálne) až 0 (mimoriadne narušené) s celkovým
možným skóre 6, pričom jednotkové zníženia skóre predstavovali významné udalosti straty predtým
dosiahnutej úrovne funkcií chôdze a reči.
Tabuľka 3: Klinická hodnotiaca stupnica CLN2
Doména Skóre Hodnotenie
Motorická
3 Zhruba normálna chôdza. Žiadna výrazná ataxia, žiadne patologické pády.
2 Samostatná chôdza definovaná schopnosťou prejsť bez opory 10 krokov.
Zreteľná nestabilita, možné občasné pády.
1 Nutnosť vonkajšej pomoci pri chôdzi alebo len schopnosť liezť.
Jazyková
0 Neschopnosť chodiť ani liezť.
3 Zjavne normálny jazykový prejav. Zrozumiteľný a zhruba primeraný veku. Zatiaľ žiadne zaznamenané zníženie.
Jazykový prejav sa stal rozoznateľne abnormálny: niektoré zrozumiteľné
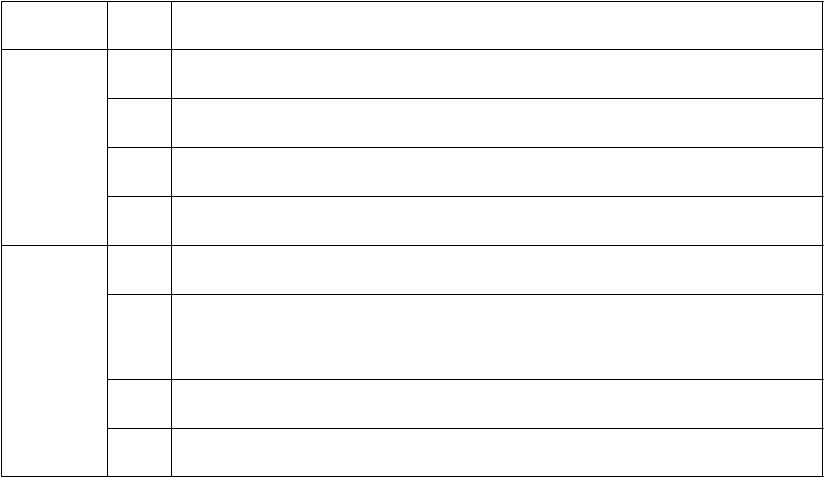
2 slová, môže tvoriť krátke vety vyjadrujúce myšlienky, požiadavky alebo
potreby. Toto skóre znamená zníženie predchádzajúcej úrovne schopností
(z individuálneho maxima dosiahnutého dieťaťom).
1 Ťažko zrozumiteľné. Niekoľko zrozumiteľných slov.
0 Žiadne zrozumiteľné slová ani slovný prejav.
Spolu 24 pacientov vo veku od 3 do 8 rokov bolo liečených Brineurou 300 mg jedenkrát za dva týždne.
V štúdii 190-201 bolo 23 pacientov liečených 48 týždňov (1 pacient ukončil liečbu po 1. týždni pre neschopnosť pokračovať v postupoch štúdie). Priemerné začiatočné skóre CLN2 bolo 3,5 (štandardná
odchýlka (SD) 1,20) s rozsahom od 1 do 6. Neskúmali sa žiadni pacienti s pokročilou progresiou ochorenia
(kritériá zaradenia: mierna až stredná progresia ochorenia CLN2). Všetkých 23 pacientov dokončilo štúdiu
190-201 a pokračovalo v prebiehajúcej rozšírenej štúdii 190-202, kde sa liečia Brineurou v dávke 300 mg
jedenkrát za dva týždne počas maximálne 124 týždňov.
Zistenia zo štúdií 190-201 a 190-202 sa porovnali s kontrolnou skupinou s prirodzeným vývojom, ktorá obsahovala pacientov vyhovujúcich kritériám zaradenia do štúdií 190-201 a 190-202. Výsledky kontrolnej skupiny s prirodzeným vývojom preukázali, že ochorenie CLN2 je rýchlo postupujúce neurodegeneratívne ochorenie s predpovedateľným znížením motorickej a jazykovej funkcie, pričom odhadovaná priemerná miera zníženia skóre CLN2 je 2 body za 48 týždňov.
Liečebný účinok u pacientov dostávajúcich Brineuru sa vyhodnocoval pomocou klinickej hodnotiacej stupnice CLN2 a výsledky sa porovnali s predpovedaným znížením skóre o 2 body za 48 týždňov
v kontrolnej skupine s prirodzeným vývojom. V štúdii 190-201 sa u 20 z 23 (87 %) pacientov dostávajúcich
Brineuru počas 48 týždňov nevyskytlo neodvrátené zníženie o 2 body v neliečenej populácii pacientov
(p = 0,0002, binomický test s p0= 0,50). Spolu u 15 pacientov z 23 (65 %) nedošlo k celkovému zníženiu
skóre CLN2 bez ohľadu na začiatočné skóre a u 2 z týchto 15 pacientov došlo počas obdobia liečby

k zlepšeniu skóre o jeden bod. U piatich pacientov došlo k zníženiu o jeden bod a u 3 pacientov k zníženiu o 2 body.
V štúdii 190-201 bola priemerná miera zníženia u pacientov liečených Brineurou v dávke 300 mg jedenkrát za dva týždne 0,40 bodu za 48 týždňov. V porovnaní s očakávanou mierou zníženia na základe prirodzeného vývoja sú výsledky štúdie štatisticky významné (p < 0,0001) (pozri tabuľku 4). Pozorovaný liečebný účinok sa vzhľadom na prirodzený vývoj neliečeného ochorenia CLN2 považoval za klinicky významný.
Tabuľka 4: 0 až 6-bodová motoricko-jazyková klinická hodnotiaca stupnica CLN2: Miera zníženiapočas 48 týždňov (populácia s úmyslom liečiť)Miera zníženia (body/48 týždňov)a Spolu (n = 23) hodnota pb
Priemer (SD) 0,40 (0,809)c < 0,0001
Medián 0,00
Min., max. –0,88, 2,02
95 % limity IS 0,05, 0,75
a Miera zníženia u pacientov počas 48 týždňov: (začiatočné skóre CLN2 – posledné skóre CLN2)/(uplynulý čas v jednotkách 48
týždňov)
b Hodnota p založená na 1-vzorkovom t-teste porovnávajúcom mieru zníženia s hodnotou 2
c Kladné odhady znamenajú klinické zníženie, záporné odhady znamenajú klinické zlepšenie
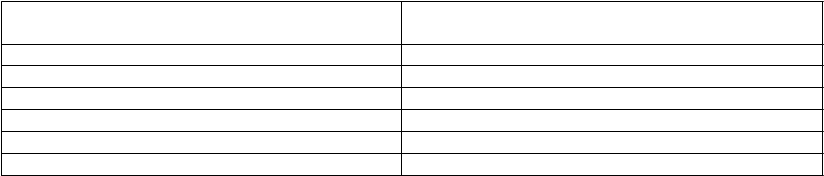
V prebiehajúcej štúdii 190-202 (k 3. júnu 2016) miera zníženia u pacientov liečených Brineurou v porovnaní s kontrolnou skupinou s prirodzeným vývojom (n = 42 pacientov) aj naďalej poukazuje na trvácnosť liečebného účinku (pozri obrázok 2).
Obrázok 2: Priemerná zmena skóre CLN2 oproti začiatočnému skóre(kontrolná skupina s prirodzeným vývojom/pacienti liečení Brineurou, 300 mg jedenkrát za dvatýždne) Zvislé čiary predstavujú štandardnú chybu priemeru
Plná čiara: klinické štúdie 190-201 a 190-202
Prerušovaná čiara: kontrolná skupina s prirodzeným vývojom 190-901
Skóre videnia a záchvatov v kombinácii so skóre CLN2 (motorická a jazyková doména) zostali stabilné. Volumetrické merania s použitím magnetickej rezonancie ukázali zníženú mieru straty.
 Pediatrická populácia
Pediatrická populácia
'
Dôležité je začať liečbu u detí v čo najmladšom veku, hoci pacienti mladší ako 3 roky neboli zaradení do
pivotnej štúdie.
Štúdia 190-203 je prebiehajúca otvorená klinická štúdia, v ktorej sa hodnotí bezpečnosť a účinnosť
u pacientov od narodenia do veku 18 rokov. Dávkovanie bolo založené na analýze rozdielov v hodnotách hmotnosti mozgu u detí vo veku menej ako 3 roky. Doterajšie výsledky týkajúce sa bezpečnosti u mladších pacientov sa zdajú byť v súlade s bezpečnostným profilom pozorovaným u starších detí. V súčasnosti nie sú k dispozícii žiadne klinické skúsenosti s Brineurou u detí mladších ako 2 roky (pozri časť 4.8).
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Brineurou v jednej alebo vo viacerých podskupinách pediatrickej populácie s CLN2 (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Tento liek bol registrovaný za tzv. „mimoriadnych okolností“. To znamená, že pre zriedkavosť výskytu ochorenia nebolo možné získať všetky informácie o tomto lieku.
Európska agentúra pre lieky každý rok posúdi nové dostupné informácie o tomto lieku a tento súhrn
charakteristických vlastností lieku bude podľa potreby aktualizovať.
5.2 Farmakokinetické vlastnostiFarmakokinetika cerliponázy alfa sa vyhodnocovala u pacientov s ochorením CLN2, ktorí dostávali intracerebroventrikulárne infúzie 300 mg v trvaní približne 4,5 hodiny jedenkrát za dva týždne.
Všetky farmakokinetické parametre boli podobné po začiatočnej infúzii v 1. deň i po nasledujúcich infúziách v 5. týždni a 13. týždni, čo naznačuje, že pri podávaní v dávke 300 mg jedenkrát za dva týždňe nedochádza k zjavnej akumulácii alebo časovo závislej farmakokinetike cerliponázy alfa v CSF alebo plazme. Farmakokinetické parametre v CSF sa vyhodnocovali u 17 pacientov a sú zhrnuté v tabuľke 5. Farmakokinetika cerliponázy alfa v plazme sa vyhodnocovala u 13 pacientov, pričom sa zistila hodnota mediánu Tmax 12,0 hodín (od začiatku infúzie), priemerná hodnota Cmax 1,39 µg/ml a priemerná hodnota AUC0-t 24,1 µg-hod./ml. Neprejavil sa žiadny zjavný účinok protilátok proti lieku v sére alebo CSF na farmakokinetiku plazmy alebo CSF.
Tabuľka 5: Farmakokinetické vlastnosti po prvej intracerebroventrikulárnej infúzii (v trvanípribližne 4 hodiny) 300 mg cerliponázy alfa do CSFParameter CSF (n = 17) Priemer (SD)
Tmax*, hod. 4,50 [4,25, 5,75] Cmax, µg/ml 1 490 (942) AUC0-t, µg-hod./ml 9 510 (4 130) Vz, ml 435 (412)
CL, ml/hod. 38,7 (19,8)
t1/2, hod. 7,35 (2,90)
* Hodnota Tmax vyjadrená ako čas od začiatku ~4-hodinovej infúzie vyjadrená ako medián [min., max.], nameraná v prvom časovom
bode odberu vzoriek po infúzii.
DistribúciaOdhadovaný distribučný objem cerliponázy alfa po intracerebroventrikulárnej infúzii 300 mg (Vz = 435 ml)
prekračuje typický objem CSF (100 ml), čo nasvedčuje distribúcii do tkanív mimo CSF. Vysoké pomery
CSF k plazme pre hodnoty Cmax (približne 1 000) a AUC0-t (približne 400) poukazujú na to, že väčšina podanej cerliponázy alfa zostáva lokalizovaná v CNS. Neočakáva sa, že by intracerebroventrikulárne podávanie cerliponázy alfa viedlo k terapeutickým koncentráciám v oku, a to vzhľadom na obmedzený prístup z CSF do postihnutých buniek sietnice a prítomnosť hematoretinálnej bariéry.
Eliminácia
Cerliponáza alfa je bielkovina a očakáva sa, že sa metabolicky degraduje peptidovou hydrolýzou. Preto sa
neočakáva, že by porucha funkcie pečene mala vplyv na farmakokinetiku cerliponázy alfa.
Vylučovanie
Eliminácia cerliponázy alfa obličkami sa považuje za menej významnú cestu pre klírens.
5.3 Predklinické údaje o bezpečnosti
Obmedzené predklinické údaje o bezpečnosti cerliponázy alfa sa získali zo štúdií toxicity po jednom podaní u opíc a zo štúdií po opakovanom podávaní v modeli s jazvečíkmi pre klasickú neskorú dojčenskú neuronálnu ceroidnú lipofuscinózu typu 2. Tento model ochorenia slúžil predovšetkým na preskúmanie farmakodynamických a farmakokinetických vlastností cerliponázy alfa, ale aj na vyhodnotenie toxicity tejto látky. Výsledky týchto štúdií na jazvečíkoch však nemôžu spoľahlivo predpovedať bezpečnosť u človeka, lebo režim infúzií cerliponázy alfa bol rozdielny a mimoriadne variabilný dokonca aj v rámci rovnakej štúdie, a to z dôvodu ťažkostí so systémom zavedeného katétra a výrazných reakcií z precitlivenosti. Tieto vyšetrenia navyše zahŕňali veľmi malé počty zvierat, ktoré sa väčšinou testovali v skupinách s jednou dávkou bez primeraných kontrolných skupín. Neklinické výsledky sú teda nejednoznačné, pokiaľ ide
o klinickú bezpečnosť cerliponázy alfa. Vyšetrenia genotoxicity, karcinogenity a reprodukčnej toxicity sa neuskutočnili.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Brineura a preplachovací roztok
heptahydrát hydrogenfosforečnanu sodného monohydrát dihydrogenfosforečnanu sodného chlorid sodný
chlorid draselný
hexahydrát chloridu horečnatého
dihydrát chloridu vápenatého voda na injekciu
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
Rozmrazená Brineura a preplachovací roztok sa majú ihneď použiť. Liek sa má odobrať z neotvorených injekčných liekoviek až bezprostredne pred použitím. Ak okamžité použitie nie je možné, neotvorené injekčné liekovky Brineury alebo preplachovacieho roztoku sa majú uchovávať pri teplote 2 – 8 °C a použiť do 24 hodín.
Chemická a fyzikálna stabilita počas používania je preukázaná počas maximálne 12 hodín pri izbovej teplote
(19 – 25 °C). Z mikrobiologického hľadiska sa majú otvorené injekčné liekovky alebo liek držaný
v injekčných striekačkách použiť ihneď. Ak sa nepoužijú ihneď, za podmienky a čas uchovávania pred použitím je zodpovedný užívateľ.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte vo zvislej polohe v mrazničke (–25 °C až –15 °C). Prepravujte a distribuujte v mraze (–85 °C až –15 °C). Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Injekčná liekovka (zo skla typu I) so zátkou (z butylkaučuku), viečkom (z polypropylénu) a krimpovacím uzáverom (z hliníka). Brineura má zelené snímateľné viečko a preplachovací roztok má žlté snímateľné viečko.
Veľkosť balenia je tri injekčné liekovky: dve 10 ml injekčné liekovky, každá s obsahom 150 mg cerliponázy alfa v 5 ml roztoku, a jedna 10 ml injekčná liekovka s obsahom 5 ml preplachovacieho roztoku.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Brineura sa má podávať pomocou infúznych komponentov, v prípade ktorých sa preukázalo, že sú chemicky a fyzikálne kompatibilné s podávaním Brineury a preplachovacieho roztoku. Na podanie Brineury sa majú použiť zariadenia na intracerebroventrikulárny prístup s označením CE a jednorazové komponenty uvedené ďalej alebo rovnocenné.
Medzi zariadenia na intracerebroventrikulárny prístup, v prípade ktorých sa preukázalo, že sú kompatibilné s Brineurou a preplachovacím roztokom, a ktoré sa použili v klinických štúdiách s Brineurou, patria zásobníky Codman HOLTER RICKHAM a HOLTER SALMON-RICKHAM, ventrikulárny katéter Codman a CSF-ventrikulárny zásobník Medtronic (s katétrom).
Brineura je kompatibilná s jednorazovými infúznymi komponentmi vyrobenými z PVC, PVC (bez DEHP), polyetylénu, polyétersulfónu (PES), polypropylénu (PP) a PTFE. V klinických skúšaniach s Brineurou sa použili tieto jednorazové infúzne komponenty s označením CE:
· injekčná striekačka: Braun a BD Luer-Lok,
· predlžovacia súprava: hadička Fresenius Injectomat®, predlžovacia súprava Alaris CC, predlžovacia hadička Vygon Lectro-Cath,
· predlžovacia súprava s 0,2-mikrónovým filtrom: Impromediform GmbH,
· vstupná ihla: ihly Deltec GRIPPER.
Príprava na podanie Brineury a preplachovacieho roztoku
Na správne podanie Brineury a preplachovacieho roztoku sú potrebné nasledujúce komponenty (nedodávajú
sa) (pozri obrázok 1 v časti 4.2). Všetky infúzne komponenty musia byť sterilné. Brineura a preplachovací roztok sa dodávajú a uchovávajú zmrazené (pozri časť 6.4).
· Programovateľný lineárny dávkovač s príslušným rozsahom podávania, presnosťou rýchlosti podávania a alarmami pri nesprávnom podávaní alebo upchatí. Dávkovač musí byť možné naprogramovať tak, aby podával liek konštantnou rýchlosťou 2,5 ml/hod.
· Dve jednorazové injekčné striekačky kompatibilné s vybavením dávkovača. Odporúčajú sa striekačky
s objemom 10 až 20 ml.
· Dve jednorazové hypodermické injekčné ihly (21 G, 25,4 mm).
· Jedna jednorazová infúzna súprava. V prípade potreby možno pridať predlžovaciu hadičku. Odporúča sa dĺžka 150 až 206 cm (nie viac ako 400 cm) a vnútorný priemer 0,1 cm.
· Vyžaduje sa 0,2 µm líniový filter. Líniový filter môže byť zabudovaný v infúznej súprave. Líniový
filter sa má umiestniť čo najbližšie k vstupnej ihle.
· Neprerezávajúca vstupná ihla veľkosti 22 G alebo menšia s odporúčanou dĺžkou 16 mm. Riaďte sa odporúčaním výrobcu zariadenia na intracerebroventrikulárny prístup v súvislosti so vstupnou ihlou.
· Jedna prázdna sterilná jednorazová injekčná striekačka (na odber CSF na kontrolu priechodnosti).
R
ozmrazenie Brineury a preplachovacieho roztoku
Rozmrazte injekčné liekovky Brineury a injekčnú liekovku preplachovacieho roztoku pri izbovej teplote
počas približne 60 minút. Injekčné liekovky nerozmrazujte ani neohrievajte žiadnym iným spôsobom. Injekčnými liekovkami netraste. Počas rozmrazovania sa objaví kondenzácia. Odporúča sa rozmrazovať
injekčné liekovky mimo škatule.
Brineura a preplachovací roztok sa musia úplne rozmraziť a ihneď použiť (pozri časť 6.3).
Opakovane nezmrazujte injekčné liekovky ani nezmrazujte injekčné striekačky obsahujúce Brineuru
alebo preplachovací roztok.
Kontrola injekčných liekovieks rozmrazenou Brineurou a preplachovacím roztokom
Skontrolujte injekčné liekovky, či sú úplne rozmrazené. Brineura a preplachovací roztok majú byť číre až
mierne opalizujúce, bezfarebné až svetložlté. Injekčné liekovky Brineury môžu niekedy obsahovať tenké priesvitné vlákna alebo nepriehľadné častice. Tieto prirodzene sa vyskytujúce častice sú cerliponáza alfa.
Tieto častice sa odstránia pomocou 0,2 μm líniového filtra bez toho, aby to malo zistiteľný vplyv na čistotu
alebo silu Brineury.
Preplachovací roztok môže obsahovať častice, ktoré sa po úplnom rozmrazení injekčnej liekovky rozpustia. Nepoužívajte roztoky ak zmenili zafarbenie alebo ak sa v nich nachádzajú iné cudzorodé tuhé častice. Odobratie Brineury
Označte jednu nepoužitú sterilnú injekčnú striekačku nápisom „Brineura“ a pripojte injekčnú ihlu. Snímte
zelené snímateľné viečka z oboch injekčných liekoviek Brineury. S použitím aseptického postupu odoberte objem roztoku Brineury zodpovedajúci požadovanej dávke (pozri tabuľku 1 v časti 4.2) do sterilnej injekčnej
striekačky označenej nápisom „Brineura“. Brineuru nerieďte. Brineuru nemiešajte so žiadnym iným
liekom. Ihlu a prázdne injekčné liekovky zlikvidujte v súlade s národnými požiadavkami.
Odobratie preplachovacieho roztoku
Stanovte objem preplachovacieho roztoku potrebného na zabezpečenie podania celého množstva Brineury do
mozgových komôr. Preplachovací objem vypočítate tak, že pripočítate plniaci objem všetkých infúznych
komponentov vrátane zariadenia na intracerebroventrikulárny prístup.
Označte jednu nepoužitú sterilnú injekčnú striekačku nápisom „preplachovací roztok“ a pripojte injekčnú ihlu. Snímte žlté snímateľné viečko z injekčnej liekovky preplachovacieho roztoku. S použitím aseptického postupu odoberte príslušné množstvo preplachovacieho roztoku z injekčnej liekovky do novej sterilnej injekčnej striekačky označenej nápisom „preplachovací roztok“. Ihlu a injekčnú liekovku zlikvidujte v súlade s národnými požiadavkami.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
BioMarin International Limited
Shanbally, Ringaskiddy
County Cork
Írsko
8. REGISTRAČNÉ ČÍSLO
EU/1/17/1192/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.