musí vždy smerovať k dosiahnutiu klinického účinku u každého liečeného pacienta.
V prípade nasledujúcich hemoragických príhod počas zodpovedajúceho obdobia hladina faktora VIII nesmie klesnúť pod danú aktivitu v plazme (v % alebo IU/dl). Ako návod pre dávkovanie pri krvácaní a operáciách sa môže použiť nasledujúca tabuľka:
Stupeň krvácania/ Typ chirurgického výkonu
| Požadovaná hladina faktora VIII (% alebo IU/dl)
| Frekvencia dávkovania (hod.) / Dĺžka liečby (dni)
|
Krvácanie
|
|
|
Začínajúca hemartróza, krvácanie do svalov alebo do ústnej dutiny
| 20 - 40
| Infúziu opakujte každých 12 až 24 hodín najmenej 1 deň, pokiaľ epizóda krvácania indikovaná bolesťou neustúpi alebo nedôjde k zahojeniu.
|
Rozsiahlejšia hemartróza, krvácanie do svalov alebo hematóm
| 30 - 60
| Infúziu opakujte každých
12-24 hodín, počas 3 – 4 dní alebo viac dní, pokiaľ nedôjde k ústupu bolesti a neobnoví sa funkčnosť.
|
Život ohrozujúce krvácanie
| 60 - 100
| Infúziu opakujte každých
8 až 24 hodín, pokiaľ nepominie ohrozenie života.
|
Chirurgické výkony
|
|
|
Menšie zákroky
vrátane extrakcie zubov
| 30 - 60
| Každých 24 hodín, najmenej
1 deň, do uspokojivého zahojenia.
|
Veľké zákroky
| 80 - 100
(pred a po operácii)
| Infúziu opakujte každých
8 – 24 hodín pokiaľ nedôjde k uspokojivému zahojeniu rany, potom najmenej 7 dní udržiavať aktivitu faktora VIII na
30 – 60 % (IU/dl).
|
ProfylaxiaNa dlhodobú profylaxiu proti krvácaniu zvyčajne pacientom so závažnou hemofíliou typu A postačia dávky 20 až 40 IU faktora VIII na kg telesnej hmotnosti podávané v intervaloch 2 až 3 dní. V niektorých prípadoch, najmä u mladších pacientov, je nutné zvoliť kratšie intervaly dávkovania alebo vyššie dávky.
Počas liečby sa odporúča vhodným spôsobom stanovovať hladiny faktora VIII, čo pomôže určiť podávanú dávku a frekvenciu infúzií. Obzvlášť v prípadoch veľkých chirurgických výkonov je nevyhnutné presne sledovať substitučnú liečbu pomocou koagulačnej analýzy (aktivita faktora VIII v plazme). U jednotlivých pacientov sa môže reakcia na podávanie faktora VIII líšiť tým, že sú dosahované rôzne hladiny
in vivo a rôzne biologické polčasy.
Pacientov treba sledovať na vývin protilátok proti faktoru VIII v ich organizme. Pozri tiež časť 4.4.
Pacienti predtým neliečení Bezpečnosť a účinnosť Beriate u predtým neliečených pacientov neboli doteraz stanovené.
Pediatrická populáciaDávkovanie u detí závisí na telesnej hmotnosti, a preto platia rovnaké zásady ako pri liečbe dospelých. Frekvencia dávkovania v individuálnych prípadoch má byť zameraná na klinickú účinnosť. S liečbou detí do 6 rokov sú už určité skúsenosti (pozri časť 5.1).
Spôsob podávaniaNa intravenózne použitie.
Liek rekonštituujte spôsobom uvedeným v časti 6.6.
Pred podaním má byť liek vytemperovaný na teplotu miestnosti alebo telesnú teplotu. Podáva sa injekčne alebo pomalou intravenóznou infúziou s rýchlosťou, ktorá vyhovuje pacientovi. Rýchlosť injekcie alebo infúzie nemá byť vyššia ako 2 ml/min.
Pozorujte pacienta, či podávanie nespôsobuje okamžitú reakciu. Ak sa vyskytnú akékoľvek reakcie, ktoré môžu mať súvislosť s podávaním Beriate, spomaľte rýchlosť infúzie alebo ju podľa klinického stavu pacienta úplne zastavte (pozri časť 4.4).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
PrecitlivenosťReakcie z precitlivenosti alergického typu sú možné.
Ak sa vyskytnú príznaky precitlivenosti, pacienti majú byť poučení, že sa podávanie lieku musí okamžite prerušiť a musia sa skontaktovať so svojím lekárom. Pacienti majú byť informovaní o prvotných príznakoch reakcií z precitlivenosti, ako je žihľavka, generalizovaná urtikária, pocit tiesne na hrudníku, dýchavičnosť (sipot), hypotenzia a anafylaxia.
V prípade šoku sa treba riadiť štandardnými lekárskymi postupmi pre liečbu šoku.
InhibítoryVznik neutralizačných protilátok (inhibítorov) proti FVIII je známou komplikáciou pri liečbe jedincov s hemofíliou A. Tieto inhibítory predstavujú zvyčajne IgG imunoglobulíny, ktoré pôsobia proti koagulačnej aktivite faktora VIII a sú kvantifikované v Bethesdových jednotkách (BU) na 1 ml plazmy a zisťované použitím modifikovanej metódy. Riziko vzniku inhibítorov koreluje s expozíciou organizmu FVIII, pričom riziko je najvyššie v prvých 20 dňoch expozície. Zriedkavo sa inhibítory môžu vytvoriť až po prvých 100 dňoch expozície.
Po zmene z jedného lieku FVIII na iný sa pozorovali prípady rekurentného inhibítora (nízky titer) u predtým liečených pacientov s viac než 100 dňami expozície, ktorí majú v anamnéze vznik inhibítorov. Preto sa odporúča dôkladne sledovať u pacientov výskyt inhibítorov po každej zmene lieku.
Všeobecne platí, že u pacientov liečených ľudským koagulačným faktorom VIII treba sledovať vývin protilátok vhodnými klinickými vyšetreniami a laboratórnymi testami. Ak sa nedosiahnu očakávané hladiny aktivity faktora VIII v plazme, alebo sa príslušnou dávkou nedarí udržať krvácanie pod kontrolou, má sa spraviť vyšetrenie na prítomnosť inhibítora FVIII. U pacientov s vysokými hladinami inhibítora, nemusí byť liečba faktorom VIII účinná a je potrebné zvážiť iné terapeutické možnosti. Liečba týchto pacientov má byť vedená pod dohľadom lekárov, ktorí majú skúsenosti s liečbou pacientov s hemofíliou A a s inhibítormi faktora VIII. Pozri tiež časť 4.8.
Beriate obsahuje až 28 mg sodíka na 1000 IU. Musí sa to zohľadniť, ak sú pacienti na diéte so zníženým obsahom sodíka.
Vírusová bezpečnosťMedzi štandardné opatrenia na predchádzanie infekciám, ktoré sú následkom podávania liekov pripravených z ľudskej krvi alebo plazmy zahŕňajú výber darcov, kontrolu jednotlivých odberov zameranú na špecifické infekčné markery a zaradenie účinných výrobných krokov na inaktiváciu alebo odstránenie vírusov. Napriek týmto opatreniam pri podávaní liekov pripravených z ľudskej krvi alebo plazmy nie je možné úplne vylúčiť možnosť prenosu infekcie. Platí to aj pre akékoľvek neznáme alebo práve objavené vírusy alebo iné patogény.
Vykonané opatrenia sa považujú za účinné pre obalené vírusy, ako je vírus ľudskej imunodeficiencie (HIV), vírus hepatitídy B (HBV) a vírus hepatitídy C (HCV) a pre neobalený vírus hepatitídy A (HAV) a parvovírus B19.
U pacientov s pravidelným alebo opakovaným príjmom liekov obsahujúcich faktor VIII, ktorý sa získava z ľudskej plazmy, sa musí zvážiť vhodné očkovanie (proti hepatitíde typu A a B).
Je nevyhnutné, aby sa pri každom podaní Beriate pacientovi zaznamenal názov a číslo šarže, aby sa udržiavali záznamy o prepojení medzi pacientom a šaržou lieku.
Pediatrická populáciaUvedené upozornenia a opatrenia platia pre dospelých aj deti.
4.5 Liekové a iné interakcie
Nie sú známe žiadne interakcie liekov s ľudským koagulačným faktorom VIII s inými liekmi.
4.6 Fertilita, gravidita a laktácia
S faktorom VIII sa doteraz neuskutočnili žiadne reprodukčné štúdie na zvieratách.
Gravidita a laktáciaVzhľadom k zriedkavému výskytu hemofílie A u žien, nie sú dostupné skúsenosti týkajúce sa použitia faktora VIII počas gravidity a dojčenia.
Z uvedených dôvodov sa môže faktor VIII podávať počas gravidity a dojčenia iba v takom prípade, ak je to jednoznačne indikované.
FertilitaNezaznamenali sa žiadne údaje o fertilite.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Beriate nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Nasledujúce nežiaduce reakcie sú založené na postmarketingových skúsenostiach a vedeckej literatúre.
Súhrn bezpečnostného profiluU dospelých a dospievajúcich sa môžu počas liečby s Beriate vyskytnúť nasledujúce nežiaduce reakcie:
Precitlivenosť alebo alergické reakcie a horúčka. Okrem toho môžu vzniknúť inhibítory FVIII.
Tabuľkový prehľad nežiaducich reakciíTabuľka uvedená nižšie je podľa triedy orgánových systémov databázy MedDRA.
Frekvencie boli vyhodnotené podľa nasledujúcich konvencií: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1000 až <1/100), zriedkavé (≥1/10 000 až <1/1000), veľmi zriedkavé (<1/10 000) a neznáme (z dostupných údajov).
Trieda orgánových systémov podľa databázy MedDRA
| Nežiaduca reakcia
| Frekvencia
|
Poruchy krvi a lymfatického systému
| FVIII inhibícia
| Veľmi zriedkavé
|
Celkové poruchy a reakcie v mieste podania
| Horúčka
| Veľmi zriedkavé
|
Poruchy imunitného systému
| Precitlivenosť
(alergické reakcie)
| Veľmi zriedkavé
|
Popis vybraných nežiaducich reakciíPoruchy imunitného systémuPrecitlivenosť a alergické reakcie (medzi ktoré patrí angioedém, pálenie a štípanie v mieste vpichu, triaška, návaly horúčavy, začervenanie, generalizovaná urtikária, bolesť hlavy, žihľavka, hypotenzia, letargia, nevoľnosť, nepokoj, tachykardia, pocit tiesne na hrudníku, mravenčenie, dávenie, dýchavičnosť (sipot)) boli pozorované veľmi zriedkavo a môžu sa v niektorých prípadoch rozvinúť do závažnej anafylaxie (vrátane šoku).
Poruchy krvi a lymfatického systémuU pacientov s hemofíliou A sa môžu tvoriť neutralizačné protilátky (inhibítory) proti faktoru VIII. Prítomnosť týchto inhibítorov má za dôsledok nedostatočnú klinickú odpoveď na liečbu. V týchto prípadoch sa odporúča kontaktovať špecializované centrum pre liečbu hemofílie.
Celkové poruchy a reakcie v mieste podaniaV zriedkavých prípadoch sa môže vyskytnúť horúčka.
Informácie o bezpečnosti z hľadiska vírusov sú uvedené v časti 4.4.
Pediatrická populáciaU detí sa očakáva rovnaká frekvencia, typ a závažnosť nežiaducich reakcií ako u dospelých.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 Predávkovanie
Žiadne príznaky predávkovania ľudským koagulačným faktorom VIII nie sú doteraz známe.
5. farmakologické vlastnosti
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antihemoragiká: koagulačný faktor VIII
ATC kód: B02BD02
Komplex faktor VIII/von Willebrandov faktor je tvorený z dvoch molekúl (faktor VIII a von Willebrandov faktor) s odlišnými fyziologickými funkciami.
Po infúzii hemofilickému pacientovi sa v jeho krvnom obehu faktor VIII viaže na von Willebrandov faktor.
Aktivovaný faktor VIII pôsobí ako kofaktor aktivovaného faktora IX, ktorý urýchľuje konverziu faktora X na aktivovaný faktor X. Aktivovaný faktor X katalyzuje premenu protrombínu na trombín. Trombín katalyzuje premenu fibrinogénu na fibrín a môže vzniknúť krvná zrazenina.
Hemofília A je dedičná porucha koagulácie krvi viazaná na pohlavie spôsobená zníženou hladinou faktora VIII:C, ktorá vyvoláva ťažké krvácanie do kĺbov, svalov alebo vnútorných orgánov a buď spontánne alebo v dôsledku traumy po úraze alebo chirurgickom výkone. Plazmatické hladiny faktora VIII sa pri substitučnej terapii zvyšujú a týmto spôsobom umožňujú prechodnú úpravu nedostatku faktora VIII a sklonu ku krvácaniu.
Okrem jeho úlohy ako ochranného proteínu faktora VIII, von Willebrandov faktor sprostredkováva adhéziu doštičiek k miestam cievnych poranení a hrá úlohu v agregácii krvných doštičiek.
K dispozícii sú údaje o liečbe 16 detí mladších ako 6 rokov a výsledky klinickej účinnosti a bezpečnosti sú podobné ako u starších pacientov.
5.2 Farmakokinetické vlastnosti
Po intravenóznom podaní sa hladina faktora VIII znižuje mono- až biexponenciálne. Konečný biologický polčas je v rozmedzí 5 a 22 hodín so strednou hodnotou asi 12 hodín. Zvýšenie aktivity faktora VIII po podaní jednej IU faktora VIII/kg telesnej hmotnosti (incremental recovery) predstavovalo približne 2 % s variabilitou medzi jednotlivými pacientmi (1,5 až 3 %). Stredný čas predĺženia (MRT- the mean residence time) bol 17 hodín (smerodajná odchýlka 5,5 hodiny), stredná hodnota plochy pod krivkou plazmatických koncentrácií (AUC) bola 0,4 h × kg/ml (smerodajná odchýlka 0,2), priemerný klírens 3 ml/h/kg (smerodajná odchýlka 1,5 ml/h/kg).
Pediatrická populáciaPre detskú populáciu sú dostupné obmedzené farmakokinetické údaje.
5.3 Predklinické údaje o bezpečnosti
Všeobecná toxicita:Toxikologické štúdie pri opakovanej dávke sa nerobili z dôvodu tvorby protilátok proti heterológnej bielkovine.
Toxický účinok na laboratórne zvieratá nemali ani dávky niekoľkonásobne vyššie ako je odporúčaná dávka pre človeka.
Skúšky s tepelne ošetreným faktorom VIII s polyklonálnymi precipitujúcimi králičími protilátkami Ouchterlonyho metódou a test na pasívnu kožnú anafylaxiu skúšaný na morčatách nedokázali zmenenú imunologickú reakciu v porovnaní s natívnym proteínom.
Mutagenicita:Pretože klinické skúsenosti nezaznamenali žiadne tumorogénne a mutagénne účinky ľudského koagulačného faktora VIII, nepovažujú sa experimentálne štúdie, najmä na heterológnych druhoch, za významné.
6. farmaceutické údaje
6.1 Zoznam pomocných látok
Glycín
Chlorid vápenatý
Hydroxid sodný (v malých množstvách) na úpravu pH
Sacharóza
Chlorid sodný
Rozpúšťadlo: Voda na injekciu 2,5 ml, 5 ml a 10 ml.
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi, rozpúšťadlami a riedidlami okrem tých, ktoré sú uvedené v časti 6.1.
6.3 Čas použiteľnosti
3 roky.'
Zistilo sa, že po rekonštitúcii je liek fyzikálne a chemicky stabilný počas 8 hodín pri 25 °C. Z mikrobiologického hľadiska sa má pripravený roztok použiť okamžite. Ak sa nepoužije okamžite, možno ho skladovať max. 8 hodín pri izbovej teplote.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Injekčnú liekovku uchovávajte v škatuľke, aby bol liek chránený pred svetlom.
V rámci času použiteľnosti, môže byť Beriate uchovávaný až do 25 ° C, nesmie sa prekročiť kumulatívne uchovávanie po dobu 1 mesiaca. Jednotlivé obdobia uchovávania lieku pri izbovej teplote by mali byť dokumentované v súlade s celkovou dobou 1 mesiaca.
NEVYSTAVUJTE injekčné liekovky priamemu zdroju tepla! Injekčné liekovky nesmú byť zohriate na teplotu vyššiu ako je telesná teplota (37 °C).
6.5 Druh obalu a obsah balenia
Vnútorný obal:Injekčná liekovka z bezfarebného skla (250 IU a 500 IU: typ I, 1000 IU a 2000 IU: typ II), uzatvorená gumovou zátkou pod vákuom, hliníkovým lemovacím uzáverom a plastickým diskom.
Balenia:Jedno balenie s 250 IU obsahuje:
1 injekčná liekovka s práškom
1 injekčná liekovka s 2,5 ml vody na injekciu
Jedna aplikačná súprava obsahuje:
1 filtračná prenosová súprava 20/20
1 jednorazová 5 ml injekčná striekačka
1 súprava na podanie do žily
2 alkoholové tampóny
1 nesterilná náplasť
Jedno balenie s 500 IU obsahuje:
1 injekčná liekovka s práškom
1 injekčná liekovka s 5 ml vody na injekciu
Jedna aplikačná súprava obsahuje:
1 filtračná prenosová súprava 20/20
1 jednorazová 5 ml injekčná striekačka
1 súprava na podanie do žily
2 alkoholové tampóny
1 nesterilná náplasť
Jedno balenie s 1000 IU obsahuje:
1 injekčná liekovka s práškom
1 injekčná liekovka s 10 ml vody na injekciu
Jedna aplikačná súprava obsahuje:
1 filtračná prenosová súprava 20/20
1 jednorazová 10 ml injekčná striekačka
1 súprava na podanie do žily
2 alkoholové tampóny
1 nesterilná náplasť
Jedno balenie s 2000 IU obsahuje:
1 injekčná liekovka s práškom
1 injekčná liekovka s 10 ml vody na injekciu
Jedna aplikačná súprava obsahuje:
1 filtračná prenosová súprava 20/20
1 jednorazová 10 ml injekčná striekačka
1 súprava na podanie do žily
2 alkoholové tampóny
1 nesterilná náplasť
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
SpôsobpodávaniaVšeobecné pokyny- Roztok má byť číry alebo mierne opalescentný. Po filtrácii alebo natiahnutí z liekovky (pozri nižšie) pred podaním roztok skontrolujte, či neobsahuje malé častice alebo nezmenil farbu. Nepoužívajte roztoky, ktoré sú zakalené alebo obsahujú častice.
- Rekonštitúcia a vyprázdnenie injekčnej liekovky sa musí robiť v aseptických podmienkach.
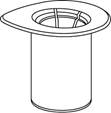
RekonštitúciaZohrejte rozpúšťadlo na izbovú teplotu. Pred otvorením Mix2Vial balenia z liekovky so substanciou odstráňte ochranné viečka a zátky očistite dezinfekčným roztokom a vysušte.
 1 1
| 1. Otvorte Mix2Vial balenie vyklopením viečka.
Nevyberajte Mix2Vial z blistra!
|
 2 2
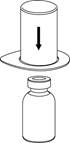
| 2. Postavte injekčnú liekovku s rozpúšťadlom na rovný a čistý povrch a pevne ju držte. Uchopte Mix2Vial spoločne s blistrom a zatlačte hrot konca modrého adaptéru priamo dole cez zátku liekovky s rozpúšťadlom.
|
 3 3
| 3. Opatrne odstráňte blister zo súpravy Mix2Vial tak, že ho držíte za okraj a ťaháte zvislo hore. Presvedčte sa, že ste vytiahli iba blistrový obal a nie Mix2Vial súpravu.
|
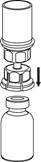 4 4
| 4. Postavte injekčnú liekovku s liekom na rovný a tvrdý povrch. Obráťte liekovku s rozpúšťadlom a pripojeným setom Mix2Vial a zatlačte hrot priehľadného konca adaptéra rovno dole cez zátku injekčnej liekovky s liekom. Rozpúšťadlo sa automaticky nasaje do liekovky s liekom.
|
 5 5
| 5. Uchopte jednou rukou časť setu Mix2Vial uchytenú na liekovke s liekom a druhou rukou časť setu Mix2Vial uchytenú na liekovke s rozpúšťadlom a proti smeru hodinových ručičiek rozskrutkujte set opatrne na dve časti.
Zlikvidujte liekovku s rozpúšťadlom s pripojeným modrým Mix2Vial adaptérom.
|
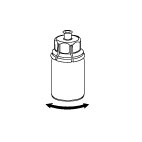 6 6
| 6. Jemným krúživým pohybom otáčajte injekčnú liekovku s liekom s pripojeným priehľadným adaptérom, kým látka nie je úplne rozpustená. Netrepte.
|
 7 7
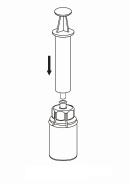
| 7. Nasajte vzduch do prázdnej, sterilnej injekčnej striekačky. Kým je injekčná liekovka s liekom v zvislej polohe, pripojte striekačku k Luer nástavcu Mix2Vial otáčaním v smere hodinových ručičiek. Vstreknite vzduch do injekčnej liekovky s liekom.
|
Natiahnutie a aplikácia: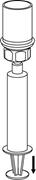 8 8
| 8. Obráťte systém hore dnom a súčasne držte piest striekačky stlačený. Natiahnite roztok pomaly do striekačky vyťahovaním piestu.
|
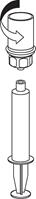 9 9
| 9. Teraz, keď bol roztok prevedený do injekčnej striekačky pevne držte hlavu striekačky (držiac piest striekačky smerom nadol) a odpojte transparentný adaptér Mix2Vial od injekčnej striekačky otáčaním proti smeru hodinových ručičiek.
|
Na injekciu Beriate je vhodné použiť jednorazové plastové injekčné striekačky, pretože roztoky tohto typu majú tendenciu priľnúť k zabrúsenému sklenenému povrchu, ktorý majú sklenené injekčné striekačky.
Roztok podávajte pomaly intravenózne (pozri časť 4.2)
. Ubezpečte sa, že do naplnenej injekčnej striekačky neprenikla krv. Na aplikáciu do žily použite aplikačnú súpravu, ktorá je dodávaná s liekom a vpichnite injekčnú ihlu do žily. Nechajte pretekať krv späť na koniec hadičky. Pripojte injekčnú striekačku so závitom k zámku na konci venepunkčnej sady.
Nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
7. DržiteĽ rozhodnutIA o registrÁcIi
CSL Behring GmbH
Emil-von-Behring-Straße 76
35041 Marburg
Nemecko
8. RegistračnÉ čísla
Beriate 250 IU: 16/0146/15-S
Beriate 500 IU: 16/0147/15-S
Beriate 1000 IU: 16/0148/15-S
Beriate 2000 IU: 16/0149/15-S
9. DÁtum prvEJ registrÁcIe/prEdĹženIA registrÁcIe
Dátum prvej registrácie:
10. DÁtum revÍzIe textu
04/2015