
Obrázok 2: Rýchlosť infúzie glukózy po subkutánnej injekcii 0,3 U/kg inzulínu glulizínu (GLULIZÍN)
alebo inzulínu lispro (LISPRO) alebo bežného ľudského inzulínu (BEŽNÝ) u obéznej populácie.
Ďalšia štúdia fázy I s inzulínom glulizínom a inzulínom lispro v populácii nediabetikov, v ktorej sa zúčastnilo 80 jedincov so širokým rozsahom body mass indexu (18-46 kg/m²), ukázala, že rýchly účinok je v širokom rozsahu body mass indexu vo všeobecnosti zachovaný, zatiaľ čo celkový účinok na zníženie hladiny glukózy v krvi klesá súčasne so stúpajúcou obezitou.
Priemerná celková AUC rýchlosti využitia glukózy v intervale 0–1 hodina bola v prípade inzulínu glulizínu 102±75 mg/kg pri dávke 0,2 U/kg a 158±100 mg/kg pri dávke 0,4 U/kg a v prípade inzulínu lispro 83,1±72,8 mg/kg pri dávke 0,2 U/kg a 112,3±70,8 mg/kg pri dávke 0,4 U/kg.
Štúdia fázy I u 18 obéznych pacientov s diabetom mellitus 2.typu (BMI medzi 35 a 40 kg/m2) s inzulínom glulizínom a inzulínom lispro [90% CI:0,81, 0,95 (p=<0,01)] ukázala, že inzulín glulizín efektívne kontroluje denné rozdiely postprandiálnej hladiny glukózy v krvi.
Klinické štúdie
Daibetes mellitus1.typu
V 26 týždňovej klinickej štúdii fázy III porovnávajúcej inzulín glulizín s inzulínom lispro, oba podávané subkutánne, krátko (0-15 minút) pred jedlom u pacientov s diabetes mellitus 1.typu za použitia inzulínu glulizínu ako bazálneho inzulínu, bol inzulín glulizín v glykemickej kontrole porovnateľný s inzulínom lispro, čo sa odrazilo v zmenách glykovaného hemoglobínu (vyjadreného ako HbA1c ekvivalent) z východiskových hodnôt po koncový bod. Boli pozorované porovnateľné hodnoty self-monitorovanej krvnej glukózy. V kontraste s inzulínom lispro nebolo pri inzulíne glulizíne potrebné zvýšenie dávky bazálneho inzulínu.
V 12 týždňovej klinickej štúdii fázy III, ktorá sa uskutočnila u pacientov s diabetes mellitus 1.typu dostávajúcich inzulín glargín ako bazálnu terapiu, ukázala, že účinnosť podania inzulínu glulizínu bezprostredne po jedle je porovnateľná s účinnosťou podania inzulínu glulizínu bezprostredne pred jedlom (0-15 minút) alebo bežného inzulínu (30-45 minút).
U zaprotokolovanej populácie bolo pozorované signifikatne vyššie zníženie glykovaného hemoglobínu v skupine s inzulínom glulizínom podaným pred jedlom v porovnaní so skupinou s bežným inzulínom.
Diabetes mellitus 2.typu
26-týždňová klinická štúdia fázy III, po ktorej nasledovala 26-týždňová štúdia rozšírenej bezpečnosti, sa uskutočnila pre porovnanie inzulínu glulizínu (0-15 minút pred jedlom) s bežným ľudským inzulínom (30-45 minút pred jedlom) oboma podanými subkutánne u pacientov s diabetes mellitus
2.typu, pričom niektorí užívali ešte ako bazálny inzulín NPH inzulín. Priemerný BMI index pacientov bol 34,55 kg/m2. Čo sa týka zmien glykovaného hemoglobínu (vyjadreného ako ekvivalent HbA1c)
z počiatočnej hodnoty k 6-mesačnej konečnej hodnote (-0,46% pre inzulín glulizín a –0,30% pre
bežný ľudský inzulín, p=0,0029) a počiatočnej hodnoty na 12-mesačnú konečnú hodnotu (-0,23% pre inzulín glulizín a –0,13% pre bežný ľudský inzulín, rozdiel nie je výrazný, sa inzulín glulizín ukázal ako porovnateľný s bežným ľudským inzulínom. V tejto štúdii si väčšina pacientov (79%) miešala tesne pred podaním injekcie krátko účinkujúci inzulín s inzulínom NPH a 58% pacientov užívalo perorálne antidiabetiká v čase randomizácie, pričom boli inštruovaní, aby v ich užívaní pokračovali
v rovnakom dávkovaní.
Rasa a pohlavie
V kontrolovaných klinických štúdiách u dospelých nevykazoval inzulín glulizín rozdiely v bezpečnosti a účinnosti v podskupinových analýzach založených na rase a pohlaví.
5.2 Farmakokinetické vlastnosti
Nahradenie aminokyseliny asparagínu v pozícii B3 lyzínom a lyzínu v pozícii B29 kyselinou glutámovou v ľudskom inzulíne určuje rýchlejšiu absorpciu inzulínu glulizínu.
V štúdii, v ktorej sa zúčastnilo 18 pacientov mužského pohlavia s diabetes mellitus typu 1 vo veku od
21 do 50 rokov, sa prejavil účinok inzulínu glulizínu ako úmerný dávke pri skorej, maximálnej a celkovej expozícii v rozsahu dávok 0,075 až 0,4 U/kg,
Absorpcia a biologická dostupnosťFarmakokinetické profily u zdravých dobrovoľníkov a diabetických pacientov (1. alebo 2.typu)
ukázali, že v porovnaní s bežným ľudským inzulínom je absorpcia inzulínu glulizínu asi dvakrát rýchlejšia a jeho vrcholová koncentrácia je približne dvakrát vyššia.
V štúdii u pacientov s diabetes mellitus 1.typu boli po subkutánnom podaní 0,15 U/kg hodnoty tmax
55 minút a Cmax 82 ±1,3 μU/ml pre inzulín glulizín a tmax 82 minút a Cmax 46 ±1,3 μU/ml pre bežný
ľudský inzulín. Priemerný reziduálny čas inzulínu glulizínu bol kratší (98 minút) ako u bežného
ľudského inzulínu (161 minút) (pozri obrázok 3).


GLULIZÍN







 80
80 BEŽNÝ

 60
60


 40
40 200
200 0 1 2 3 4 5 6ČAS - hodina
0 1 2 3 4 5 6ČAS - hodinaObrázok 3: Farmakokinetický profil inzulínu glulizínu a bežného ľudského inzulínu u pacientov s diabetes mellitus 1.typu po dávke 0,15 U/kg.
V štúdii s pacientmi s diabetes mellitus 2.typu po subkutánnom podaní 0,2 U/kg inzulínu glulizínu, Cmax bol 91 μU/ml s interkvartilným rozsahom od 78 do 104 μU/ml.
Keď bol inzulín glulizín injikovaný subkutánne do brucha, deltoidu a ramena, boli časovokoncentračné profily podobné s trošku rýchlejšou absorpciou pri podaní do brucha v porovnaní s ramenom. Absorpcia z miesta v deltoide bola medzi týmito hodnotami (pozri časť 4.2). Absolútna biologická dostupnosť (70%) inzulínu glulizínu bola podobná pre všetky injekčné oblasti s nízkou vnútornou internou variabilitou (11% CV).
Obezita
Ďalšia štúdia fázy I s inzulínom glulizínom a inzulínom lispro v populácii nediabetikov, v ktorej sa zúčastnilo 80 jedincov so širokým rozsahom body mass indexu (18-46 kg/m2) preukázala, že rýchla absorpcia a celková expozícia zostáva v širokom rozsahu body mass indexu vo všeobecnosti zachovaná.
S inzulínom glulizínom sa dosiahol čas do 10% celkovej INS expozície približne o 5-6 minút skôr.
Distribúcia a eliminácia
Distribúcia a eliminácia inzulínu glulizínu a bežného ľudského inzulínu je po intravenóznom podaní
podobná, distribučné objemy sú 13 l resp. 22 l a polčasy sú 13 resp. 18 minút.
Po subkutánnom podaní sa inzulín glulizín eliminuje rýchlejšie ako bežný ľudský inzulín, zdanlivý polčas je 42 minút v porovnaní s 86 minútami. V skríženej analytickej štúdii inzulínu glulizínu buď u zdravých dobrovoľníkov alebo jedincov s diabetes mellitus 1. alebo 2.typu bol zdanlivý polčas
v rozsahu 37 až 75 minút (interkvartilný rozsah).
Inzulín glulizín má podobne ako ľudský inzulín nízku väzbovosť na plazmové proteíny. Špeciálne skupiny pacientov
Zhoršená funkcia obličiek
V klinickej štúdii u nediabetických jedincov zahrňujúcich širokú škálu renálnej funkcie
(CrCl >80 ml/min, 30-50 ml/min, <30 ml/min), boli rýchlo pôsobiace vlastnosti inzulínu glulizínu vo všeobecnosti zachované. Avšak nároky na inzulín pri zhoršenej funkcii obličiek môžu byť znížené.
Zhoršená funkcia pečene
Farmakokinetické vlastnosti u pacientov so zhoršenou funkciou pečene sa neskúmali.
Starší pacienti
U starších pacientov s diabetes mellitus sú k dispozícii veľmi obmedzené farmakokinetické údaje.
Deti a dospievajúci
Farmakokinetické a farmakodynamické vlastnosti inzulínu glulizínu sa skúmali u detí (7-11 rokov)
a adolescentov (12-16 rokov) s diabetes mellitus 1.typu. Inzulín glulizín sa rýchlo absorboval
u obidvoch vekových skupín, s podobným tmax a Cmax ako u dospelých (pozri časť 4.2). Ak sa inzulín gulizín podal bezprostredne pred jedlom, ukázal lepšiu postprandiálnu kontrolu, ako bežný ľudský inzulín, ako u dospelých (pozri časť 5.1). Glukózový rozdiel (AUC0-6h) bol 641 mg.h.dl-1 pre inzulín glulizín a 801 mg.h.dl-1 pre bežný ľudský inzulín.
5.3 Predklinické údaje o bezpečnosti
Predklinické štúdie neodhalili iné toxické nálezy než tie, ktoré sa spájajú s farmakodynamickou aktivitou znižujúcou glukózu (hypoglykémia), ktoré by boli odlišné od bežného ľudského inzulínu alebo nálezy klinicky závažné pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
metakrezol chlorid sodný trometamol polysorbát 20
kyselina chlorovodíková, koncentrovaná hydroxid sodný
voda na injekciu
6.2 Inkompatibility
Pri absencii štúdií kompatibility sa inzulín glulizín nesmie miešať s inými liekmi okrem NPH
ľudského inzulínu.
Ak sa Apidra podáva v inzulínovej infúznej pumpe, nesmie sa miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky.
Čas použiteľnosti po prvom použití: liek sa môže uchovávať maximálne 4 týždne pri teplote neprevyšujúcej 25°C. Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Neotvorené
Uchovávajte v chladničke pri teplote (2°C - 8°C).
Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom. Neuchovávajte v mrazničke.
Zabezpečte, aby sa obal priamo nedotýkal výparníka alebo zmrazených balení.
Podmienky pri používaní
Upozornenia na uchovávanie pozri časť 6.3.
6.5 Druh obalu a obsah balenia
10 ml injekčného roztoku v injekčnej liekovke (bezfarebné sklo typu I) so zátkou (guma z elastoméru, so zapečatenou hliníkovou obrubou ) a odlamovacím viečkom. Sú dostupné balenia po 1, 2, 4 a 5 injekčných liekovkách.
Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Apidra injekčné liekovky sú určené na používanie s injekčnými striekačkami so zodpovedajúcou jednotkovou škálou a s inzulínovým pumpovým systémom (pozri časť 4.2).
Pred použitím si injekčnú liekovku prezrite. Použitá môže byť len vtedy, ak je roztok číry, bezfarebný
a neobsahuje viditeľné tuhé častice. Apidra je roztok, nemusí byť preto pred použitím resuspendovaný.
Miešanie s inzulínmi
Pri miešaní s NPH ľudským inzulínom, musí sa Apidra natiahnuť do injekčnej striekačky ako prvá. Injekcia sa musí podať okamžite po zmiešaní, keďže nie sú dostupné žiadne údaje o zmesiach urobených signifikantne skôr pred podaním injekcie.
Kontinuálna subkutánna infúzna pumpa
Apidra sa môže použiť na kontinuálnu subkutánnu inzulínovú infúziu (CSII) v pumpovom systéme vhodnom na infúziu inzulínu s vhodnými katétrami a rezervoármi.
Pacienti používajúci CSII majú dostať podrobné inštrukcie o používaní pumpového systému. Infúzna súprava a rezervoár sa musí meniť každých 48 hodín za použitia aseptickej techniky.
Pacienti, ktorí si podávajú Apidru používajúc CSII musia mať k dispozícii alternatívny inzulín pre prípad, že zlyhá pumpový systém.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Sanofi-Aventis Deutschland GmbH, Brueningstrasse 50, D-65926 Frankfurt am Main, Nemecko.
8. REGISTRAČNÉ ČÍSLO
EU/1/04/285/001-004
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 27. september 2004
10. DÁTUM REVÍZIE TEXTU
1. NÁZOV LIEKU
Apidra 100 jednotiek/ml, injekčný roztok v náplni
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml obsahuje 100 jednotiek inzulínu glulizínu (čo zodpovedá 3,49 mg). Každá náplň obsahuje 3 ml injekčného roztoku, čo zodpovedá 300 jednotiek.
Inzulín glulizín sa vyrába rekombinantnou DNA technológiou s použitím kmeňov Escherichia coli. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v náplni.
Číry, bezfarebný, vodný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba dospelých pacientov s diabetes mellitus.
4.2 Dávkovanie a spôsob podávania
Účinnosť tohto lieku je daná v jednotkách. Tieto jednotky sú špecifické len pre Apidru a nie sú rovnaké ako IU alebo jednotky, ktoré sa používajú na vyjadrenie účinnosti iných inzulínových analógov. Pozri časť 5.1 (Farmakodynamika).
Apidra sa má podávať krátko (0-15 min) pred alebo skoro po jedle.
Apidra sa má podávať v režimoch, ktoré obsahujú strednodobo alebo dlhodobo pôsobiaci inzulín alebo analóg bazálneho inzulínu a môže sa používať s perorálnymi hypoglykemizujúcimi liekmi.
Dávkovanie Apidry sa má upravovať individuálne. Podávanie
Apidra sa má podávať subkutánnou injekciou alebo kontinuálnou subkutánnou infúziou pomocou
pumpy.
Apidra sa má podávať subkutánne do abdominálnej steny, do stehna alebo do deltového svalu alebo kontinuálnou infúziou do abdominálnej steny. Miesta vpichu injekcie alebo infúzie v rámci danej oblasti (brucho, stehno alebo deltoid) sa majú obmieňať od jednej injekcie po ďalšiu. Rýchlosť absorpcie a potom nástup a trvanie účinku môžu byť ovplyvnené miestom vpichu injekcie, cvičením a ďalšími premennými. Subkutánna injekcia do abdominálnej steny zabezpečuje mierne rýchlejšiu absorpciu ako injekcia do iných miest vpichu (pozri časť 5.2).
Musí sa dávať pozor, aby nebola zasiahnutá krvná cieva. Po injekcii sa miesto vpichu nemá masírovať. Pacienti majú byť poučení o používaní vhodnej injekčnej techniky.
Miešanie s inzulínmi
Inzulín glulizín sa nesmie miešať s inými liekmi s výnimkou NPH ľudského inzulínu, keďže neexistujú štúdie inkompatibility.
Ďalšie podrobnosti o používaní, pozri časť 6.6. Špeciálne skupiny pacientov
Zhoršená funkcia obličiek
Vo všeobecnosti sa farmakokinetické vlastnosti inzulínu glulizínu u pacientov s poškodením funkcie obličiek zachovávajú. Avšak pri zhoršenej funkcii obličiek môžu byť nároky na inzulín znížené (pozri časť 5.2).
Zhoršená funkcia pečene
U pacientov so zníženou funkciou pečene sa farmakokinetické vlastnosti inzulínu glulizínu neskúmali. U pacientov s poškodením funkcie pečene môžu byť nároky na inzulín nižšie kvôli zníženej kapacite pre glukoneogenézu a zníženému inzulínovému metabolizmu.
Starší pacienti
U starších pacientov s diabetes mellitus sú k dispozícii obmedzené farmakokinetické údaje. Zhoršenie renálnej funkcie môže viesť k poklesu nárokov na inzulín.
Deti a adolescenti
O používaní Apidry u detí a adolescentov nie je dostatok klinických informácií.
4.3 Kontraindikácie
Precitlivenosť na inzulín glulizín alebo na niektorú z pomocných látok. Hypoglykémia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Prechod pacienta na nový typ alebo druh inzulínu sa má uskutočniť pod prísnym lekárskym dohľadom. Zmeny v sile, druhu (výrobca), type (bežný, NPH, lente, atď.), pôvode (zvierací) a/alebo spôsobe výroby môžu vyústiť do zmeny v dávkovaní. Súbežná liečba perorálnymi antidiabetikami si môže vyžiadať úpravu.
Použitie neprimeraného dávkovania alebo ukončenie liečby, najmä u pacientov závislých na inzulíne, môže viesť ku hyperglykémii a diabetickej ketoacidóze; k stavom potenciálne letálnym.
Prestavenie pacienta na iný typ alebo druh inzulínu sa musí robiť pod prísnym lekárskym dohľadom a môže si to vyžiadať zmenu dávky.
Hypoglykémia
Čas výskytu hypoglykémie závisí od akčného profilu podávaných inzulínov a môže sa preto pri zmene liečebného režimu meniť.
Stavy, ktoré môžu rôzne alebo málo zvýrazniť včasné varovné príznaky hypoglykémie, zahŕňajú dlho trvajúci diabetes, intenzifikovanú inzulínovú liečbu, diabetické nervové ochorenie, lieky ako sú betablokátory alebo po prechode z inzulínu zvieracieho pôvodu na ľudský inzulín.
Úprava dávkovania môže byť potrebná aj vtedy, ak pacienti majú zvýšenú fyzickú aktivitu alebo
menia svoj obvyklý plán jedál. Cvičenie vykonávané bezprostredne po jedle môže zvýšiť riziko hypoglykémie.
Pri porovnávaní s rozpustným ľudským inzulínom, ak sa hypoglykémia objaví po injekcii rýchlo pôsobiacich analógov, môže nastať rýchlejšie.
Neupravené hypoglykemické alebo hyperglykemické reakcie môžu spôsobiť stratu vedomia, kómu alebo smrť.
Nároky na inzulín sa môžu zmeniť počas choroby alebo pri emočných poruchách.
4.5 Liekové a iné interakcie
Štúdie farmakokinetických interakcií sa neuskutočnili. Na základe empirických poznatkov o podobných liekoch výskyt klinicky relevantných farmakokinetických interakcií nie je pravdepodobný.
Množstvo látok ovplyvňuje glukózový metabolizmus a môže si vyžiadať úpravu dávok inzulínu glulizínu a obzvlášť starostlivé monitorovanie.
Medzi látky, ktoré môžu zvýšiť účinok znižujúci hladinu cukru v krvi a zvýšiť tak pravdepodobnosť hypoglykémie patria perorálne antidiabetiká, inhibítory angiotenzín konvertujúceho enzýmu (ACE), disopyramid, fibráty, fluoxetín, inhibítory monoaminooxidázy (IMAO), pentoxifylín, propoxyfén, salicyláty a sulfónamidové antibiotiká.
Medzi látky, ktoré môžu redukovať účinok znižujúci hladinu cukru v krvi patria kortikoidy, danazol, diazoxid, diuretiká, glukagón, izoniazid, deriváty fenotiazínu, somatropín, sympatomimetiká (napr. epinefrín [adrenalín], salbutamol, terbutalín), hormóny štítnej žľazy, estrogény, progestíny (napr. perorálne kontraceptíva), inhibítory proteázy a atypické antipsychotické lieky (napr. olanzapín
a klozapín).
Betablokátory, klonidín, lítiové soli alebo alkohol môžu účinok inzulínu znižujúci hladinu cukru v krvi potencovať, alebo oslabovať. Pentamidín môže spôsobiť hypoglykémiu, ktorá je niekedy nasledovaná hyperglykémiou.
Okrem toho môžu byť pod vplyvom sympatolytických liekov, ako sú betablokátory, klonidín, guanetidín a rezerpín príznaky adrenergnej kontraregulácie redukované, alebo môžu chýbať.
4.6 Gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití inzulínu glulizínu u gravidných žien.
Reprodukčné štúdie na zvieratách neodhalili žiadne rozdiely medzi inzulínom glulizínom a ľudským inzulínom, čo sa týka gravidity, embryonálneho/fetálneho vývoja, pôrodu alebo postnatálneho vývoja (pozri časť 5.3)
Pri predpisovaní gravidným ženám sa má zvýšiť opatrnosť. Nevyhnutné je starostlivé monitorovanie glukózovej kontroly.
U pacientok s preexistujúcim alebo gestačným diabetom je nevyhnutné počas gravidity udržať dobrú metabolickú kontrolu. Nároky na inzulín môžu počas prvého trimestra klesnúť a celkovo stúpnuť počas druhého a tretieho trimestra. Okamžite po pôrode nároky na inzulín rapídne poklesnú.
Laktácia
Nie je známe, či sa inzulín glulizín vylučuje do materského mlieka, ale vo všeobecnosti inzulín
neprechádza do materského mlieka a po perorálnom podaní sa neabsorbuje. Dojčiace ženy môžu vyžadovať úpravu dávky inzulínu a úpravu diéty.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pacientova schopnosť koncentrovať sa a reagovať môže byť narušená následkom hypoglykémie alebo hyperglykémie alebo napr. následkom poškodenia zraku. Toto môže predstavovať riziko v situáciách, kedy sú tieto schopnosti zvlášť dôležité (napr. vedenie vozidla alebo obsluha strojov).
Pacienti majú byť poučení, aby sa vystríhali hypoglykémie počas vedenia vozidla. Zvlášť dôležité je to u pacientov, u ktorých je uvedomovanie si varovných príznakov hypoglykémie redukované alebo absentuje alebo u tých, ktorí mávajú časté epizódy hypoglykémie. Musí sa zvážiť, či je vedenie
vozidiel alebo obsluhovanie strojov za týchto okolností vhodné.
4.8 Nežiaduce účinky
Hypoglykémia, najčastejší nežiaduci účinok inzulínovej terapie, sa môže vyskytnúť, ak je inzulínová dávka vo vzťahu k potrebe inzulínu príliš vysoká.
Nasledujúce nežiaduce reakcie, ktoré vyplynuli z klinických štúcií, sú zoradené podľa tiredy orgánových sytémov a podľa klesajúceho výskytu (veľmi časté: ≥1/10; časté: ≥1/100 až <1/10; menej časté: ≥1/1000 až <1/100; zriedkavé: ≥1/10 000 až <1/1000; veľmi zriedkavé: <1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Poruchy metabolizmu a výživy
Veľmi časté: Hypoglykémia
Symptómy hypoglykémie sa obyčajne objavia náhle. Môžu zahŕňať studený pot, studená, bledá koža, únava, nervozita alebo triaška, úzkosť, neobvyklá únava alebo slabosť, zmätenosť, ťažkosti pri sústredení sa, ospalosť, pálčivý hlad, zmeny videnia, bolesť hlavy, nauzea a palpitácie.
Hypoglykémia sa môže stať závažnou a môže viesť k strate vedomia a/alebo kŕčom a môže vyústiť do
dočasného alebo trvalého poškodenia funkcie mozgu alebo dokonca smrti.
Poruchy kože a podkožného tkaniva
Časté: reakcie v mieste vpichu injekcie a lokálne hypersenzitívne reakcie.
Počas liečby inzulínom sa môžu vyskytnúť lokálne hypersenzitívne reakcie (sčervenenie, opuch
a svrbenie v mieste vpichu injekcie). Tieto reakcie bývajú obvykle prechodné a normálne vymiznú v priebehu ďalšej liečby.
Zriedkavé: Lipodystrofia
V mieste vpichu injekcie sa môže objaviť lipodystrofia ako dôsledok toho, že sa nestiredajú miesta vpichu injekcií v rámci danej oblasti.
Celkové poruchy
Menej časté: Systémové hypersenzitívne reakcie
Systémové hypersenzitívne reakcie môžu zahŕňať žihľavku, tlak na hrudníku, dyspnoe, alergickú dermatitídu a pruritus. Závažné prípady generalizovanej alergie, vrátane anafylaktickej reakcie, môžu ohrozovať život.
4.9 Predávkovanie
Hypoglykémia môže nastať následkom výrazného účinku inzulínu vo vzťahu k príjmu jedla a výdaju energie.
O predávkovaní inzulínom glulizínom nie sú k dispozícii žiadne špecifické údaje. Avšak v ďalších štádiách sa môže hypoglykémia rozvinúť:
Mierne príhody hypoglykémie sa môžu liečiť perorálnym podaním glukózy alebo výrobkov z cukru. Preto sa diabetickým pacientom odporúča neustále so sebou nosiť kockový cukor, sladkosti, sušienky alebo cukrom sladené džúsy.
Ťažké príhody hypoglykémie, kedy pacient stráca vedomie, možno liečiť glukagónom (0,5 až 1 mg) podaným intramuskulárne alebo subkutánne primerane vyškolenou osobou alebo glukózou podanou intravenózne odborníkom v medicíne. Glukóza sa musí podať intravenózne aj vtedy, ak pacient
v priebehu 10 až 15 minút neodpovedá na glukagón.
Po nadobudnutí vedomia sa pacientovi odporúča perorálne podávanie uhľovodíkov, ako prevencia relapsu.
Po injekcii glukagónu sa musí pacient monitorovať v nemocnici,aby sa zistila príčina tejto ťažkej hypoglykémie a aby sa predišlo ďalším podobným príhodám.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: inzulín a analógy, rýchlo pôsobiace. ATC kód: A10AB06
Inzulín glulizín je rekombinatný analóg ľudského inzulínu, ktorý je ekvipotentný bežnému ľudskému inzulínu. Inzulín glulizín má rýchlajší nástup účinku a kratšie trvanie účinku ako bežný ľudský inzulín.
Primárnym účinkom inzulínov a inzulínových analógov, vrátane inzulínu glulizínu, je regulácia metabolizmu glukózy. Inzulín znižuje hladiny glukózy v krvi stimuláciou periférnej absorpcie glukózy, najmä kostrovým svalstvom a tukovým tkanivom, a inhibíciou produkcie glukózy v pečeni. Inzulín inhibuje lipolýzu v adipocytoch, inhibuje proteolýzu a podporuje syntézu proteínov.
Štúdie u zdravých dobrovoľníkov a pacientov s diabetom ukázali, že inzulín glulizín má rýchlejší nástup účinku a kratšie trvanie účinku, ako bežný ľudský inulín podávaný subkutánne. Ak sa inzulín glulizín podáva subkutánne, začína sa jeho pôsobenie na zníženie hladiny glukózy v krvi v priebehu
10 – 20 minút. Ak sa inzulín glulizín a bežný ľudský inzulín podávajú intravenózne, ich účinok na
zníženie hladiny glukózy v krvi je ekvipotentný. Jedna jednotka inzulínu glulizínu má rovnaký účinok na zníženie hladiny glukózy v krvi ako jedna jednotka bežného ľudského inzulínu.
Úmernosť vo vzťahu k dávke
V štúdii, v ktorej sa zúčastnilo 18 pacientov mužského pohlavia s diabetes mellitus typu 1 vo veku od
21 do 50 rokov, sa prejavil účinok na zníženie hladiny glukózy v krvi úmerný dávke v terapeuticky relevantnom rozsahu dávok 0,075 až 0,15 U/kg, a menej ako úmerné zvýšenie účinku na zníženie hladiny glukózy v krvi pri dávke 0,3 U/kg alebo väčšej, podobne ako u ľudského inzulínu.
Inzulín glulizín účinkuje približne dvakrát tak rýchlo ako bežný ľudský inzulín a dosahuje účinok na zníženie hladiny glukózy v krvi približne o 2 hodiny skôr ako bežný ľudský inzulín.
Štúdia fázy I u pacientov s diabetes mellitus typu 1 hodnotila účinok na zníženie hladiny glukózy u inzulínu glulizínu a bežného ľudského inzulínu podávaných subkutánne v dávke 0,15 U/kg
v rozličnom časovom vzťahu ku štandardnému 15-minútovému jedlu. Údaje ukazujú, že inzulín glulizín podávaný 2 minúty pred jedlom poskytuje podobnú postprandiálnu glykemickú kontrolou ako bežný ľudský inzulín podávaný 30 minút pred jedlom. Ak sa podáva inzulín glulizín 2 minúty pred jedlom, poskytuje lepšiu postprandiálnu kontrolu ako bežný ľudský inzulín podávaný 2 minúty pred jedlom. Inzulín glulizín podaný 15 minút po začiatku jedla poskytuje podobnú glykemickú kontrolu ako bežný ľudský inzulín podávaný 2 minúty pred jedlom (pozri obrázok 1).
Obrázok 2: Rýchlosť infúzie glukózy po subkutánnej injekcii 0,3 U/kg inzulínu glulizínu (GLULIZÍN)
alebo inzulínu lispro (LISPRO) alebo bežného ľudského inzulínu (BEŽNÝ) u obéznej populácie.
Ďalšia štúdia fázy I s inzulínom glulizínom a inzulínom lispro v populácii nediabetikov, v ktorej sa zúčastnilo 80 jedincov so širokým rozsahom body mass indexu (18-46 kg/m²) ukázala, že rýchly účinok je v širokom rozsahu body mass indexu vo všeobecnosti zachovaný, zatiaľ čo celkový účinok na zníženie hladiny glukózy v krvi klesá súčasne so stúpajúcou obezitou.
Priemerná celková AUC rýchlosti využitia glukózy v intervale 0–1 hodina bola v prípade inzulínu glulizínu 102±75 mg/kg pri dávke 0,2 U/kg a 158±100 mg/kg pri dávke 0,4 U/kg a v prípade inzulínu lispro 83,1±72,8 mg/kg pri dávke 0,2 U/kg a 112,3±70,8 mg/kg pri dávke 0,4 U/kg.
Štúdia fázy I u 18 obéznych pacientov s diabetom mellitus 2.typu (BMI medzi 35 a 40 kg/m2) s inzulínom glulizínom a inzulínom lispro [90% CI:0,81, 0,95 (p=<0,01)] ukázala, že inzulín glulizín efektívne kontroluje denné rozdiely postprandiálnej hladiny glukózy v krvi.
Klinické štúdie
Daibetes mellitus1.typu
V 26 týždňovej klinickej štúdii fázy III porovnávajúcej inzulín glulizín s inzulínom lispro, oba podávané subkutánne, krátko (0-15 minút) pred jedlom u pacientov s diabetes mellitus 1.typu za použitia inzulínu glargínu ako bazálneho inzulínu, bol inzulín glulizín v glykemickej kontrole porovnateľný s inzulínom lispro, čo sa odrazilo v zmenách glykovaného hemoglobínu (vyjadreného ako HbA1c ekvivalent) z východiskových hodnôt po koncový bod. Boli pozorované porovnateľné hodnoty self-monitorovanej krvnej glukózy. V kontraste s inzulínom lispro nebolo pri inzulíne glulizíne potrebné zvýšenie dávky bazálneho inzulínu.
V 12 týždňovej klinickej štúdii fázy III, ktorá sa uskutočnila u pacientov s diabetes mellitus 1.typu dostávajúcich inzulín glargín ako bazálnu terapiu, ukázala, že účinnosť podania inzulínu glulizínu bezprostredne po jedle je porovnateľná s účinnosťou podania inzulínu glulizínu bezprostredne pred jedlom (0-15 minút) alebo bežného inzulínu (30-45 minút).
U zaprotokolovanej populácie bolo pozorované signifikatne vyššie zníženie glykovaného hemoglobínu v skupine s inzulínom glulizínom podaným pred jedlom v porovnaní so skupinou s bežným inzulínom.
Diabetes mellitus 2.typu
26-týždňová klinická štúdia fázy III, po ktorej nasledovala 26-týždňová štúdia rozšírenej bezpečnosti, sa uskutočnila pre porovnanie inzulínu glulizínu (0-15 minút pred jedlom) s bežným ľudským inzulínom (30-45 minút pred jedlom) oboma podanými subkutánne u pacientov s diabetes mellitus
2.typu, pričom niektorí užívali ešte ako bazálny inzulín NPH inzulín. Priemerný BMI index pacientov bol 34,55 kg/m2. Čo sa týka zmien glykovaného hemoglobínu (vyjadreného ako ekvivalent HbA1c)
z počiatočnej hodnoty k 6-mesačnej konečnej hodnote (-0,46% pre inzulín glulizín a –0,30% pre
bežný ľudský inzulín, p=0,0029) a počiatočnej hodnoty na 12-mesačnú konečnú hodnotu (-0,23% pre inzulín glulizín a –0,13% pre bežný ľudský inzulín, rozdiel nie je výrazný, sa inzulín glulizín ukázal ako porovnateľný s bežným ľudským inzulínom. V tejto štúdii si väčšina pacientov (79%) miešala tesne pred podaním injekcie krátko účinkujúci inzulín s inzulínom NPH a 58% pacientov užívalo perorálne antidiabetiká v čase randomizácie, pričom boli inštruovaní, aby v ich užívaní pokračovali
v rovnakom dávkovaní.
Rasa a pohlavie
V kontrolovaných klinických štúdiách u dospelých nevykazoval inzulín glulizín rozdiely v bezpečnosti a účinnosti v podskupinových analýzach založených na rase a pohlaví.
5.2 Farmakokinetické vlastnosti
Nahradenie aminokyseliny asparagínu v pozícii B3 lyzínom a lyzínu v pozícii B29 kyselinou glutámovou v ľudskom inzulíne určuje rýchlejšiu absorpciu inzulínu glulizínu.
V štúdii, v ktorej sa zúčastnilo 18 pacientov mužského pohlavia s diabetes mellitus typu 1 vo veku od
21 do 50 rokov, sa prejavil účinok inzulínu glulizínu ako úmerný dávke pri skorej, maximálnej a celkovej expozícii v rozsahu dávok 0,075 až 0,4 U/kg,
Absorpcia a biologická dostupnosťFarmakokinetické profily u zdravých dobrovoľníkov a diabetických pacientov (1. alebo 2.typu)
ukázali, že v porovnaní s bežným ľudským inzulínom je absorpcia inzulínu glulizínu asi dvakrát rýchlejšia a jeho vrcholová koncentrácia je približne dvakrát vyššia.
V štúdii u pacientov s diabetes mellitus 1.typu boli po subkutánnom podaní 0,15 U/kg hodnoty tmax
55 minút a Cmax 82 ±1,3 μU/ml pre inzulín glulizín a tmax 82 minút a Cmax 46 ±1,3 μU/ml pre bežný
ľudský inzulín. Priemerný reziduálny čas inzulínu glulizínu bol kratší (98 minút) ako u bežného
ľudského inzulínu (161 minút) (pozri obrázok 3).


GLULIZÍN








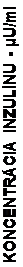 80
80 BEŽNÝ

 60
60

 40
40 200
200 0 1 2 3 4 5 6ČAS - hodina
0 1 2 3 4 5 6ČAS - hodinaObrázok 3: Farmakokinetický profil inzulínu glulizínu a bežného ľudského inzulínu u pacientov s diabetes mellitus 1.typu po dávke 0,15 U/kg.
V štúdii s pacientmi s diabetes mellitus 2.typu po subkutánnom podaní 0,2 U/kg inzulínu glulizínu, Cmax bol 91 μU/ml s interkvartilným rozsahom od 78 do 104 μU/ml.
Keď bol inzulín glulizín injikovaný subkutánne do brucha, deltoidu a ramena, boli časovokoncentračné profily podobné s trošku rýchlejšou absorpciou pri podaní do brucha v porovnaní s ramenom. Absorpcia z miesta v deltoide bola medzi týmito hodnotami (pozri časť 4.2). Absolútna biologická dostupnosť (70%) inzulínu glulizínu bola podobná pre všetky injekčné oblasti s nízkou vnútornou internou variabilitou (11% CV).
Obezita
Ďalšia štúdia fázy I s inzulínom glulizínom a inzulínom lispro v populácii nediabetikov, v ktorej sa zúčastnilo 80 jedincov so širokým rozsahom body mass indexu (18-46 kg/m2) preukázala, že rýchla absorpcia a celková expozícia zostáva v širokom rozsahu body mass indexu vo všeobecnosti zachovaná.
S inzulínom glulizínom sa dosiahol čas do 10% celkovej INS expozície približne o 5-6 minút skôr.
Distribúcia a eliminácia
Distribúcia a eliminácia inzulínu glulizínu a bežného ľudského inzulínu je po intravenóznom podaní
podobná, distribučné objemy sú 13 l resp. 22 l a polčasy sú 13 resp. 18 minút.
Po subkutánnom podaní sa inzulín glulizín eliminuje rýchlejšie ako bežný ľudský inzulín, zdanlivý polčas je 42 minút v porovnaní s 86 minútami. V skríženej analytickej štúdii inzulínu glulizínu buď u zdravých dobrovoľníkov alebo jedincov s diabetes mellitus 1. alebo 2.typu bol zdanlivý polčas
v rozsahu 37 až 75 minút (interkvartilný rozsah).
Inzulín glulizín má podobne ako ľudský inzulín nízku väzbovosť na plazmové proteíny. Špeciálne skupiny pacientov
Zhoršená funkcia obličiek
V klinickej štúdii u nediabetických jedincov zahrňujúcich širokú škálu renálnej funkcie
(CrCl >80 ml/min, 30-50 ml/min, <30 ml/min), boli rýchlo pôsobiace vlastnosti inzulínu glulizínu vo všeobecnosti zachované. Avšak nároky na inzulín pri zhoršenej funkcii obličiek môžu byť znížené.
Zhoršená funkcia pečene
Farmakokinetické vlastnosti u pacientov so zhoršenou funkciou pečene sa neskúmali.
Starší pacienti
U starších pacientov s diabetes mellitus sú k dispozícii veľmi obmedzené farmakokinetické údaje.
Deti a dospievajúci
Farmakokinetické a farmakodynamické vlastnosti inzulínu glulizínu sa skúmali u detí (7-11 rokov)
a adolescentov (12-16 rokov) s diabetes mellitus 1.typu. Inzulín glulizín sa rýchlo absorboval
u obidvoch vekových skupín, s podobným tmax a Cmax ako u dospelých (pozri časť 4.2). Ak sa inzulín gulizín podal bezprostredne pred jedlom, ukázal lepšiu postprandiálnu kontrolu, ako bežný ľudský inzulín, ako u dospelých (pozri časť 5.1). Glukózový rozdiel (AUC0-6h) bol 641 mg.h.dl-1 pre inzulín glulizín a 801 mg.h.dl-1 pre bežný ľudský inzulín.
5.3 Predklinické údaje o bezpečnosti
Predklinické štúdie neodhalili iné toxické nálezy než tie, ktoré sa spájajú s farmakodynamickou aktivitou znižujúcou glukózu (hypoglykémia), ktoré by boli odlišné od bežného ľudského inzulínu alebo nálezy klinicky závažné pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
metakrezol chlorid sodný trometamol polysorbát 20
kyselina chlorovodíková, koncentrovaná hydroxid sodný
voda na injekciu
6.2 Inkompatibility
Pri absencii štúdií kompatibility sa inzulín glulizín nesmie miešať s inými liekmi s výnimkou NPH
ľudského inzulínu.
6.3 Čas použiteľnosti
2 roky.
Čas použiteľnosti po prvom použití: liek sa môže uchovávať maximálne 4 týždne pri teplote neprevyšujúcej 25°C. Neuchovávajte v chladničke. Uchovávajte náplň vloženú v pere na ochranu pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Neotvorené
Uchovávajte v chladničke (2°C - 8°C).
Uchovávajte náplň vo vonkajšom obale na ochranu pred svetlom. Neuchovávajte v mrazničke.
Zabezpečte, aby sa obal priamo nedotýkal výparníka alebo zmrazených balení.
Podmienky pri používaní
Upozornenia na uchovávanie pozri časť 6.3.
6.5 Druh obalu a obsah balenia
3 ml injekčného roztoku v náplni (bezfarebné sklo typu I) s piestom (guma z elastoméru) a obrubou (zapečatenou hliníkom) so zátkou (guma z elastoméru). Sú dostupné balenia po 1, 3, 4, 5, 6, 8, 9 a 10 náplní.
Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Náplne sú určené na používanie v inzulínovom pere ako je OptiPen a podľa odporúčania v návode, ktorý poskytuje výrobca pomôcky.
Návod výrobcu na používanie pera, čo sa týka zaobchádzania s náplňou, upevňovania ihly a podávania inzulínovej injekcie, sa musí dôkladne dodržiavať. Pred použitím si náplň prezrite. Použitá môže byť len vtedy, ak je roztok číry, bezfarebný a neobsahuje viditeľné tuhé častice. Pred vložením náplne do opakovane použiteľného pera sa náplň musí uchovávať pri izbovej teplote 1 až 2 hodiny. Pred
injekciou sa musia z náplne odstrániť vzduchové bubliny (pozri návod na používanie pera). Prázdne náplne sa nesmú opätovne napĺňať.
Ak je OptiPen poškodený, nemá sa používať.
Ak je pero chybné, injekčný roztok možno natiahnuť z náplne do injekčnej striekačky (vhodnej pre inzulín s koncentráciou 100 jednotiek/ml) a podať.
Na zabránenie akejkoľvek kontaminácii musí používať opakovane použiteľné pero vždy len jeden pacient.
Miešanie s inzulínmi
Pri miešaní s NPH ľudským inzulínom, musí sa Apidra natiahnuť do injekčnej striekačky ako prvá. Injekcia sa musí podať okamžite po zmiešaní, keďže nie sú dostupné žiadne údaje o zmesiach urobených signifikantne skôr pred podaním injekcie.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Sanofi-Aventis Deutschland GmbH, Brueningstrasse 50, D-65926 Frankfurt am Main, Nemecko.
8. REGISTRAČNÉ ČÍSLO
EU/1/04/285/005-012
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 27. september 2004
10. DÁTUM REVÍZIE TEXTU
1. NÁZOV LIEKU
Apidra 100 jednotiek/ml, injekčný roztok v náplni.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml obsahuje 100 jednotiek inzulínu glulizínu (čo zodpovedá 3,49 mg). Každá náplň obsahuje 3 ml injekčného roztoku, čo zodpovedá 300 jednotiek.
Inzulín glulizín sa vyrába rekombinantnou DNA technológiou s použitím kmeňov Escherichia coli. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok v náplni pre OptiClik.
Číry, bezfarebný, vodný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba dospelých pacientov s diabetes mellitus.
4.2 Dávkovanie a spôsob podávania
Účinnosť tohto lieku je daná v jednotkách. Tieto jednotky sú špecifické len pre Apidru a nie sú rovnaké ako IU alebo jednotky, ktoré sa používajú na vyjadrenie účinnosti iných inzulínových analógov. Pozri časť 5.1 (Farmakodynamika).
Apidra sa má podávať krátko (0-15 min) pred alebo skoro po jedle.
Apidra sa má podávať v režimoch, ktoré obsahujú strednodobo alebo dlhodobo pôsobiaci inzulín alebo analóg bazálneho inzulínu a môže sa používať s perorálnymi hypoglykemizujúcimi liekmi.
Dávkovanie Apidry sa má upravovať individuálne. Podávanie
Apidra sa má podávať subkutánnou injekciou alebo kontinuálnou subkutánnou infúziou pomocou
pumpy.
Apidra sa má podávať subkutánne do abdominálnej steny, do stehna alebo do deltového svalu alebo kontinuálnou infúziou do abdominálnej steny. Miesta vpichu injekcie alebo infúzie v rámci danej oblasti (brucho, stehno alebo deltoid) sa majú obmieňať od jednej injekcie po ďalšiu. Rýchlosť absorpcie a potom nástup a trvanie účinku môžu byť ovplyvnené miestom vpichu injekcie, cvičením a ďalšími premennými. Subkutánna injekcia do abdominálnej steny zabezpečuje mierne rýchlejšiu absorpciu ako injekcia do iných miest vpichu (pozri časť 5.2).
Musí sa dávať pozor, aby nebola zasiahnutá krvná cieva. Po injekcii sa miesto vpichu nemá masírovať. Pacienti majú byť poučení o používaní vhodnej injekčnej techniky.
Miešanie s inzulínmi
Inzulín glulizín sa nesmie miešať s inými liekmi s výnimkou NPH ľudského inzulínu, keďže neexistujú štúdie inkompatibility.
Ďalšie podrobnosti o používaní, pozri časť 6.6. Špeciálne skupiny pacientov
Zhoršená funkcia obličiek
Vo všeobecnosti sa farmakokinetické vlastnosti inzulínu glulizínu u pacientov s poškodením funkcie obličiek zachovávajú. Avšak pri zhoršenej funkcii obličiek môžu byť nároky na inzulín znížené (pozri časť 5.2).
Zhoršená funkcia pečene
U pacientov so zníženou funkciou pečene sa farmakokinetické vlastnosti inzulínu glulizínu neskúmali. U pacientov s poškodením funkcie pečene môžu byť nároky na inzulín nižšie kvôli zníženej kapacite pre glukoneogenézu a zníženému inzulínovému metabolizmu.
Starší pacienti
U starších pacientov s diabetes mellitus sú k dispozícii obmedzené farmakokinetické údaje. Zhoršenie renálnej funkcie môže viesť k poklesu nárokov na inzulín.
Deti a adolescenti
O používaní Apidry u detí a adolescentov nie je dostatok klinických informácií.
4.3 Kontraindikácie
Precitlivenosť na inzulín glulizín alebo na niektorú z pomocných látok. Hypoglykémia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Prechod pacienta na nový typ alebo druh inzulínu sa má uskutočniť pod prísnym lekárskym dohľadom. Zmeny v sile, druhu (výrobca), type (bežný, NPH, lente, atď.), pôvode (zvierací) a/alebo spôsobe výroby môžu vyústiť do zmeny v dávkovaní. Súbežná liečba perorálnymi antidiabetikami si môže vyžiadať úpravu.
Použitie neprimeraného dávkovania alebo ukončenie liečby, najmä u pacientov závislých na inzulíne, môže viesť ku hyperglykémii a diabetickej ketoacidóze; k stavom potenciálne letálnym.
Prestavenie pacienta na iný typ alebo druh inzulínu sa musí robiť pod prísnym lekárskym dohľadom a môže si to vyžiadať zmenu dávky.
Hypoglykémia
Čas výskytu hypoglykémie závisí od akčného profilu podávaných inzulínov a môže sa preto pri zmene liečebného režimu meniť.
Stavy, ktoré môžu rôzne alebo málo zvýrazniť včasné varovné príznaky hypoglykémie, zahŕňajú dlho trvajúci diabetes, intenzifikovanú inzulínovú liečbu, diabetické nervové ochorenie, lieky ako sú betablokátory alebo po prechode z inzulínu zvieracieho pôvodu na ľudský inzulín.
Úprava dávkovania môže byť potrebná aj vtedy, ak pacienti majú zvýšenú fyzickú aktivitu alebo menia svoj obvyklý plán jedál. Cvičenie vykonávané bezprostredne po jedle môže zvýšiť riziko hypoglykémie.
Pri porovnávaní s rozpustným ľudským inzulínom, ak sa hypoglykémia objaví po injekcii rýchlo pôsobiacich analógov, môže nastať rýchlejšie.
Neupravené hypoglykemické alebo hyperglykemické reakcie môžu spôsobiť stratu vedomia, kómu alebo smrť.
Nároky na inzulín sa môžu zmeniť počas choroby alebo pri emočných poruchách.
4.5 Liekové a iné interakcie
Štúdie farmakokinetických interakcií sa neuskutočnili. Na základe empirických poznatkov o podobných liekoch výskyt klinicky relevantných farmakokinetických interakcií nie je pravdepodobný.
Množstvo látok ovplyvňuje glukózový metabolizmus a môže si vyžiadať úpravu dávok inzulínu glulizínu a obzvlášť starostlivé monitorovanie.
Medzi látky, ktoré môžu zvýšiť účinok znižujúci hladinu cukru v krvi a zvýšiť tak pravdepodobnosť hypoglykémie patria perorálne antidiabetiká, inhibítory angiotenzín konvertujúceho enzýmu (ACE), disopyramid, fibráty, fluoxetín, inhibítory monoaminooxidázy (IMAO), pentoxifylín, propoxyfén, salicyláty a sulfónamidové antibiotiká.
Medzi látky, ktoré môžu redukovať účinok znižujúci hladinu cukru v krvi patria kortikoidy, danazol, diazoxid, diuretiká, glukagón, izoniazid, deriváty fenotiazínu, somatropín, sympatomimetiká (napr. epinefrín [adrenalín], salbutamol, terbutalín), hormóny štítnej žľazy, estrogény, progestíny (napr. perorálne kontraceptíva), inhibítory proteázy a atypické antipsychotické lieky (napr. olanzapín
a klozapín).
Betablokátory, klonidín, lítiové soli alebo alkohol môžu účinok inzulínu znižujúci hladinu cukru v krvi potencovať, alebo oslabovať. Pentamidín môže spôsobiť hypoglykémiu, ktorá je niekedy nasledovaná hyperglykémiou.
Okrem toho môžu byť pod vplyvom sympatolytických liekov, ako sú betablokátory, klonidín, guanetidín a rezerpín príznaky adrenergnej kontraregulácie redukované, alebo môžu chýbať.
4.6 Gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití inzulínu glulizínu u gravidných žien.
Reprodukčné štúdie na zvieratách neodhalili žiadne rozdiely medzi inzulínom glulizínom a ľudským inzulínom, čo sa týka gravidity, embryonálneho/fetálneho vývoja, pôrodu alebo postnatálneho vývoja (pozri časť 5.3)
Pri predpisovaní gravidným ženám sa má zvýšiť opatrnosť. Nevyhnutné je starostlivé monitorovanie glukózovej kontroly.
U pacientok s preexistujúcim alebo gestačným diabetom je nevyhnutné počas gravidity udržať dobrú metabolickú kontrolu. Nároky na inzulín môžu počas prvého trimestra klesnúť a celkovo stúpnuť počas druhého a tretieho trimestra. Okamžite po pôrode nároky na inzulín rapídne poklesnú.
Laktácia
Nie je známe, či sa inzulín glulizín vylučuje do materského mlieka, ale vo všeobecnosti inzulín
neprechádza do materského mlieka a po perorálnom podaní sa neabsorbuje. Dojčiace ženy môžu vyžadovať úpravu dávky inzulínu a úpravu diéty.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pacientova schopnosť koncentrovať sa a reagovať môže byť narušená následkom hypoglykémie alebo hyperglykémie alebo napr. následkom poškodenia zraku. Toto môže predstavovať riziko v situáciách, kedy sú tieto schopnosti zvlášť dôležité (napr. vedenie vozidla alebo obsluha strojov).
Pacienti majú byť poučení, aby sa vystríhali hypoglykémie počas vedenia vozidla. Zvlášť dôležité je to u pacientov, u ktorých je uvedomovanie si varovných príznakov hypoglykémie redukované alebo absentuje alebo u tých, ktorí mávajú časté epizódy hypoglykémie. Musí sa zvážiť, či je vedenie
vozidiel alebo obsluhovanie strojov za týchto okolností vhodné.
4.8 Nežiaduce účinky
Hypoglykémia, najčastejší nežiaduci účinok inzulínovej terapie, sa môže vyskytnúť, ak je inzulínová dávka vo vzťahu k potrebe inzulínu príliš vysoká.
Nasledujúce nežiaduce reakcie, ktoré vyplynuli z klinických štúcií, sú zoradené podľa triedy orgánových sytémov a podľa klesajúceho výskytu (veľmi časté: ≥1/10; časté: ≥1/100 až <1/10; menej časté: ≥1/1000 až <1/100; zriedkavé: ≥1/10 000 až <1/1000; veľmi zriedkavé: <1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Poruchy metabolizmu a výživy
Veľmi časté: Hypoglykémia
Symptómy hypoglykémie sa obyčajne objavia náhle. Môžu zahŕňať studený pot, studená, bledá koža, únava, nervozita alebo triaška, úzkosť, neobvyklá únava alebo slabosť, zmätenosť, ťažkosti pri sústredení sa, ospalosť, pálčivý hlad, zmeny videnia, bolesť hlavy, nauzea a palpitácie.
Hypoglykémia sa môže stať závažnou a môže viesť k strate vedomia a/alebo kŕčom a môže vyústiť do
dočasného alebo trvalého poškodenia funkcie mozgu alebo dokonca smrti.
Poruchy kože a podkožného tkaniva
Časté: reakcie v mieste vpichu injekcie a lokálne hypersenzitívne reakcie.
Počas liečby inzulínom sa môžu vyskytnúť lokálne hypersenzitívne reakcie (sčervenenie, opuch
a svrbenie v mieste vpichu injekcie). Tieto reakcie bývajú obvykle prechodné a normálne vymiznú v priebehu ďalšej liečby.
Zriedkavé: Lipodystrofia
V mieste vpichu injekcie sa môže objaviť lipodystrofia ako dôsledok toho, že sa nestiredajú miesta vpichu injekcií v rámci danej oblasti.
Celkové poruchy
Menej časté: Systémové hypersenzitívne reakcie
Systémové hypersenzitívne reakcie môžu zahŕňať žihľavku, tlak na hrudníku, dyspnoe, alergickú dermatitídu a pruritus. Závažné prípady generalizovanej alergie, vrátane anafylaktickej reakcie, môžu ohrozovať život.
4.9 Predávkovanie
Hypoglykémia môže nastať následkom výrazného účinku inzulínu vo vzťahu k príjmu jedla a výdaju energie.
O predávkovaní inzulínom glulizínom nie sú k dispozícii žiadne špecifické údaje. Avšak v ďalších štádiách sa môže hypoglykémia rozvinúť:
Mierne príhody hypoglykémie sa môžu liečiť perorálnym podaním glukózy alebo výrobkov z cukru. Preto sa diabetickým pacientom odporúča neustále so sebou nosiť kockový cukor, sladkosti, sušienky alebo cukrom sladené džúsy.
Ťažké príhody hypoglykémie, kedy pacient stráca vedomie, možno liečiť glukagónom (0,5 až 1 mg) podaným intramuskulárne alebo subkutánne primerane vyškolenou osobou alebo glukózou podanou intravenózne odborníkom v medicíne. Glukóza sa musí podať intravenózne aj vtedy, ak pacient
v priebehu 10 až 15 minút neodpovedá na glukagón.
Po nadobudnutí vedomia sa pacientovi odporúča perorálne podávanie uhľovodíkov, ako prevencia relapsu.
Po injekcii glukagónu sa musí pacient monitorovať v nemocnici,aby sa zistila príčina tejto ťažkej hypoglykémie a aby sa predišlo ďalším podobným príhodám.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: inzulín a analógy, rýchlo pôsobiace. ATC kód: A10AB06
Inzulín glulizín je rekombinatný analóg ľudského inzulínu, ktorý je ekvipotentný bežnému ľudskému inzulínu. Inzulín glulizín má rýchlejší nástup účinku a kratšie trvanie účinku ako bežný ľudský inzulín.
Primárnym účinkom inzulínov a inzulínových analógov, vrátane inzulínu glulizínu, je regulácia metabolizmu glukózy. Inzulín znižuje hladiny glukózy v krvi stimuláciou periférnej absorpcie glukózy, najmä kostrovým svalstvom a tukovým tkanivom, a inhibíciou produkcie glukózy v pečeni. Inzulín inhibuje lipolýzu v adipocytoch, inhibuje proteolýzu a podporuje syntézu proteínov.
Štúdie u zdravých dobrovoľníkov a pacientov s diabetom ukázali, že inzulín glulizín má rýchlejší nástup účinku a kratšie trvanie účinku, ako bežný ľudský inulín podávaný subkutánne. Ak sa inzulín glulizín podáva subkutánne, začína sa jeho pôsobenie na zníženie hladiny glukózy v krvi v priebehu
10 – 20 minút. Ak sa inzulín glulizín a bežný ľudský inzulín podávajú intravenózne, ich účinok na zníženie hladiny glukózy v krvi je ekvipotentný. Jedna jednotka inzulínu glulizínu má rovnaký účinok na zníženie hladiny glukózy v krvi ako jedna jednotka bežného ľudského inzulínu.
Úmernosť vo vzťahu k dávke
V štúdii, v ktorej sa zúčastnilo 18 pacientov mužského pohlavia s diabetes mellitus typu 1 vo veku od
21 do 50 rokov, sa prejavil účinok na zníženie hladiny glukózy v krvi úmerný dávke v terapeuticky relevantnom rozsahu dávok 0,075 až 0,15 U/kg, a menej ako úmerné zvýšenie účinku na zníženie hladiny glukózy v krvi pri dávke 0,3 U/kg alebo väčšej, podobne ako u ľudského inzulínu.
Inzulín glulizín účinkuje približne dvakrát tak rýchlo ako bežný ľudský inzulín a dosahuje účinok na zníženie hladiny glukózy v krvi približne o 2 hodiny skôr ako bežný ľudský inzulín.
Štúdia fázy I u pacientov s diabetes mellitus typu 1 hodnotila účinok na zníženie hladiny glukózy u inzulínu glulizínu a bežného ľudského inzulínu podávaných subkutánne v dávke 0,15 U/kg
v rozličnom časovom vzťahu ku štandardnému 15-minútovému jedlu. Údaje ukazujú, že inzulín glulizín podávaný 2 minúty pred jedlom poskytuje podobnú postprandiálnu glykemickú kontrolou ako bežný ľudský inzulín podávaný 30 minút pred jedlom. Ak sa podáva inzulín glulizín 2 minúty pred jedlom, poskytuje lepšiu postprandiálnu kontrolu ako bežný ľudský inzulín podávaný 2 minúty pred jedlom. Inzulín glulizín podaný 15 minút po začiatku jedla poskytuje podobnú glykemickú kontrolu ako bežný ľudský inzulín podávaný 2 minúty pred jedlom (pozri obrázok 1).
Obrázok 2: Rýchlosť infúzie glukózy po subkutánnej injekcii 0,3 U/kg inzulínu glulizínu (GLULIZÍN)
alebo inzulínu lispro (LISPRO) alebo bežného ľudského inzulínu (BEŽNÝ) u obéznej populácie.
Ďalšia štúdia fázy I s inzulínom glulizínom a inzulínom lispro v populácii nediabetikov, v ktorej sa zúčastnilo 80 jedincov so širokým rozsahom body mass indexu (18-46 kg/m²) ukázala, že rýchly účinok je v širokom rozsahu body mass indexu vo všeobecnosti zachovaný, zatiaľ čo celkový účinok na zníženie hladiny glukózy v krvi klesá súčasne so stúpajúcou obezitou.
Priemerná celková AUC rýchlosti využitia glukózy v intervale 0–1 hodina bola v prípade inzulínu glulizínu 102±75 mg/kg pri dávke 0,2 U/kg a 158±100 mg/kg pri dávke 0,4 U/kg a v prípade inzulínu lispro 83,1±72,8 mg/kg pri dávke 0,2 U/kg a 112,3±70,8 mg/kg pri dávke 0,4 U/kg.
Štúdia fázy I u 18 obéznych pacientov s diabetom mellitus 2.typu (BMI medzi 35 a 40 kg/m2) s inzulínom glulizínom a inzulínom lispro [90% CI:0,81, 0,95 (p=<0,01)] ukázala, že inzulín glulizín efektívne kontroluje denné rozdiely postprandiálnej hladiny glukózy v krvi.
Klinické štúdie
Daibetes mellitus1.typu
V 26 týždňovej klinickej štúdii fázy III porovnávajúcej inzulín glulizín s inzulínom lispro, oba podávané subkutánne, krátko (0-15 minút) pred jedlom u pacientov s diabetes mellitus 1.typu za použitia inzulínu glargínu ako bazálneho inzulínu, bol inzulín glulizín v glykemickej kontrole porovnateľný s inzulínom lispro, čo sa odrazilo v zmenách glykovaného hemoglobínu (vyjadreného ako HbA1c ekvivalent) z východiskových hodnôt po koncový bod. Boli pozorované porovnateľné hodnoty self-monitorovanej krvnej glukózy. V kontraste s inzulínom lispro nebolo pri inzulíne glulizíne potrebné zvýšenie dávky bazálneho inzulínu.
V 12 týždňovej klinickej štúdii fázy III, ktorá sa uskutočnila u pacientov s diabetes mellitus 1.typu dostávajúcich inzulín glargín ako bazálnu terapiu, ukázala, že účinnosť podania inzulínu glulizínu bezprostredne po jedle je porovnateľná s účinnosťou podania inzulínu glulizínu bezprostredne pred jedlom (0-15 minút) alebo bežného inzulínu (30-45 minút).
U zaprotokolovanej populácie bolo pozorované signifikatne vyššie zníženie glykovaného hemoglobínu v skupine s inzulínom glulizínom podaným pred jedlom v porovnaní so skupinou s bežným inzulínom.
Diabetes mellitus 2.typu
26-týždňová klinická štúdia fázy III, po ktorej nasledovala 26-týždňová štúdia rozšírenej bezpečnosti, sa uskutočnila pre porovnanie inzulínu glulizínu (0-15 minút pred jedlom) s bežným ľudským inzulínom (30-45 minút pred jedlom) oboma podanými subkutánne u pacientov s diabetes mellitus
2.typu, pričom niektorí užívali ešte ako bazálny inzulín NPH inzulín. Priemerný BMI index pacientov bol 34,55 kg/m2. Čo sa týka zmien glykovaného hemoglobínu (vyjadreného ako ekvivalent HbA1c)
z počiatočnej hodnoty k 6-mesačnej konečnej hodnote (-0,46% pre inzulín glulizín a -0,30% pre bežný
ľudský inzulín, p=0,0029) a počiatočnej hodnoty na 12-mesačnú konečnú hodnotu (-0,23% pre inzulín glulizín a -0,13% pre bežný ľudský inzulín, rozdiel nie je výrazný, sa inzulín glulizín ukázal ako porovnateľný s bežným ľudským inzulínom. V tejto štúdii si väčšina pacientov (79%) miešala tesne pred podaním injekcie krátko účinkujúci inzulín s inzulínom NPH a 58% pacientov užívalo perorálne antidiabetiká v čase randomizácie, pričom boli inštruovaní, aby v ich užívaní pokračovali v rovnakom dávkovaní.
Rasa a pohlavie
V kontrolovaných klinických štúdiách u dospelých nevykazoval inzulín glulizín rozdiely v bezpečnosti a účinnosti v podskupinových analýzach založených na rase a pohlaví.
5.2 Farmakokinetické vlastnosti
Nahradenie aminokyseliny asparagínu v pozícii B3 lyzínom a lyzínu v pozícii B29 kyselinou glutámovou v ľudskom inzulíne určuje rýchlejšiu absorpciu inzulínu glulizínu.
V štúdii, v ktorej sa zúčastnilo 18 pacientov mužského pohlavia s diabetes mellitus typu 1 vo veku od
21 do 50 rokov, sa prejavil účinok inzulínu glulizínu ako úmerný dávke pri skorej, maximálnej a celkovej expozícii v rozsahu dávok 0,075 až 0,4 U/kg,
Absorpcia a biologická dostupnosťFarmakokinetické profily u zdravých dobrovoľníkov a diabetických pacientov (1. alebo 2.typu)
ukázali, že v porovnaní s bežným ľudským inzulínom je absorpcia inzulínu glulizínu asi dvakrát rýchlejšia a jeho vrcholová koncentrácia je približne dvakrát vyššia.
V štúdii u pacientov s diabetes mellitus 1.typu boli po subkutánnom podaní 0,15 U/kg hodnoty tmax
55 minút a Cmax 82 ±1,3 μU/ml pre inzulín glulizín a tmax 82 minút a Cmax 46 ±1,3 μU/ml pre bežný
ľudský inzulín. Priemerný reziduálny čas inzulínu glulizínu bol kratší (98 minút) ako u bežného
ľudského inzulínu (161 minút) (pozri obrázok 3).


GLULIZÍN








 80
80 BEŽNÝ

 60
60

 40
40 200
200 0 1 2 3 4 5 6ČAS - hodina
0 1 2 3 4 5 6ČAS - hodinaObrázok 3: Farmakokinetický profil inzulínu glulizínu a bežného ľudského inzulínu u pacientov s diabetes mellitus 1.typu po dávke 0,15 U/kg.
V štúdii s pacientmi s diabetes mellitus 2.typu po subkutánnom podaní 0,2 U/kg inzulínu glulizínu, Cmax bol 91 μU/ml s interkvartilným rozsahom od 78 do 104 μU/ml.
Keď bol inzulín glulizín injikovaný subkutánne do brucha, deltoidu a stehna, boli časovokoncentračné profily podobné s mierne rýchlejšou absorpciou pri podaní do brucha v porovnaní s podaním do stehna. Absorpcia z miesta v deltoide bola medzi týmito hodnotami (pozri časť 4.2). Absolútna biologická dostupnosť (70%) inzulínu glulizínu bola podobná pre všetky injekčné oblasti a s nízkou vnútornou internou variabilitou (11% CV).
Obezita
Ďalšia štúdia fázy I s inzulínom glulizínom a inzulínom lispro v populácii nediabetikov, v ktorej sa zúčastnilo 80 jedincov so širokým rozsahom body mass indexu (18-46 kg/m2) preukázala, že rýchla absorpcia a celková expozícia zostáva v širokom rozsahu body mass indexu vo všeobecnosti zachovaná.
S inzulínom glulizínom sa dosiahol čas do 10% celkovej INS expozície približne o 5-6 minút skôr.
Distribúcia a eliminácia
Distribúcia a eliminácia inzulínu glulizínu a bežného ľudského inzulínu je po intravenóznom podaní
podobná, distribučné objemy sú 13 l resp. 22 l a polčasy sú 13 resp. 18 minút.
Po subkutánnom podaní sa inzulín glulizín eliminuje rýchlejšie ako bežný ľudský inzulín, zdanlivý polčas je 42 minút v porovnaní s 86 minútami. V skríženej analytickej štúdii inzulínu glulizínu buď u zdravých dobrovoľníkov alebo jedincov s diabetes mellitus 1. alebo 2.typu bol zdanlivý polčas
v rozsahu 37 až 75 minút (interkvartilný rozsah).
Inzulín glulizín má podobne ako ľudský inzulín nízku väzbovosť na plazmové proteíny. Špeciálne skupiny pacientov
Zhoršená funkcia obličiek
V klinickej štúdii u nediabetických jedincov zahrňujúcich širokú škálu renálnej funkcie
(CrCl >80 ml/min, 30-50 ml/min, <30 ml/min), boli rýchlo pôsobiace vlastnosti inzulínu glulizínu vo všeobecnosti zachované. Avšak nároky na inzulín pri zhoršenej funkcii obličiek môžu byť znížené.
Zhoršená funkcia pečene
Farmakokinetické vlastnosti u pacientov so zhoršenou funkciou pečene sa neskúmali.
Starší pacienti
U starších pacientov s diabetes mellitus sú k dispozícii veľmi obmedzené farmakokinetické údaje.
Deti a dospievajúci
Farmakokinetické a farmakodynamické vlastnosti inzulínu glulizínu sa skúmali u detí (7-11 rokov)
a adolescentov (12-16 rokov) s diabetes mellitus 1.typu. Inzulín glulizín sa rýchlo absorboval
u obidvoch vekových skupín, s podobným tmax a Cmax ako u dospelých (pozri časť 4.2). Ak sa inzulín gulizín podal bezprostredne pred jedlom, ukázal lepšiu postprandiálnu kontrolu, ako bežný ľudský inzulín, ako u dospelých (pozri časť 5.1). Glukózový rozdiel (AUC0-6h) bol 641 mg.h.dl-1 pre inzulín glulizín a 801 mg.h.dl-1 pre bežný ľudský inzulín.
5.3 Predklinické údaje o bezpečnosti
Predklinické štúdie neodhalili iné toxické nálezy než tie, ktoré sa spájajú s farmakodynamickou aktivitou znižujúcou glukózu (hypoglykémia), ktoré by boli odlišné od bežného ľudského inzulínu alebo nálezy klinicky závažné pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
metakrezol chlorid sodný trometamol polysorbát 20
kyselina chlorovodíková, koncentrovaná hydroxid sodný
voda na injekciu
6.2 Inkompatibility
Pri absencii štúdií kompatibility sa inzulín glulizín nesmie miešať s inými liekmi s výnimkou NPH
ľudského inzulínu.
6.3 Čas použiteľnosti
2 roky.
Čas použiteľnosti po prvom použití: liek sa môže uchovávať maximálne 4 týždne pri teplote neprevyšujúcej 25°C. Neuchovávajte v chladničke. Uchovávajte náplň vloženú v pere na ochranu pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Neotvorené
Uchovávajte v chladničke (2°C - 8°C).
Uchovávajte náplň vo vonkajšom obale na ochranu pred svetlom. Neuchovávajte v mrazničke.
Zabezpečte, aby sa obal priamo nedotýkal výparníka alebo zmrazených balení.
Podmienky pri používaní
Upozornenia na uchovávanie pozri časť 6.3.
6.5 Druh obalu a obsah balenia
3 ml injekčného roztoku v náplni (bezfarebné sklo typu I) s piestom (guma z elastoméru) a obrubou
(zapečatenou hliníkom) so zátkou (guma z elastoméru).
Sklenená náplň je nezvratne integrovaná v priehľadnom púzdre a na jednom konci primontovaná k plastovému mechanizmu závitovým jadrom.
Sú dostupné balenia po 1, 3, 4, 5, 6, 8, 9 a 10 náplní pre OptiClik. Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Náplne pre OptiClik sa majú používať len spolu s OptiClikom a podľa odporúčaní v informácii poskytovanej výrobcom pomôcky.
Návod výrobcu na používanie pera, čo sa týka zaobchádzania s náplňou, upevňovania ihly a podávania inzulínovej injekcie, sa musí dôkladne dodržiavať.
Ak sa OptiClik poškodí, alebo nefunguje správne (pre mechanické závady), musí sa zlikvidovať
a použiť nový OptiClik.
Náplň sa pred vložením do opakovane použiteľného pera musí uchovávať pri izbovej teplote 1 až 2 hodiny.Pred použitím si náplň prezrite. Použitá môže byť len vtedy, ak je náplň nedotknutá a roztok je číry, bezfarebný a neobsahuje viditeľné tuhé častice.
Pred injekciou sa musia z náplne odstrániť vzduchové bubliny (pozri návod na používanie pera). Prázdne náplne sa nesmú opätovne napĺňať.
Ak je pero chybné (pozri návod na používanie pera), injekčný roztok možno natiahnuť z náplne do injekčnej striekačky (vhodnej pre inzulín s koncentráciou 100 jednotiek/ml) a podať.
Na zabránenie akejkoľvek kontaminácie musí používať opakovane použiteľné pero vždy len jeden pacient.
Miešanie s inzulínmi
Pri miešaní s NPH ľudským inzulínom, musí sa Apidra natiahnuť do injekčnej striekačky ako prvá. Injekcia sa musí podať okamžite po zmiešaní, keďže nie sú dostupné žiadne údaje o zmesiach urobených signifikantne skôr pred podaním injekcie.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Sanofi-Aventis Deutschland GmbH, Brueningstrasse 50, D-65926 Frankfurt am Main, Nemecko.
8. REGISTRAČNÉ ČÍSLO
EU/1/04/285/021-028
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 27. september 2004
10. DÁTUM REVÍZIE TEXTU
1. NÁZOV LIEKU
Apidra 100 jednotiek/ml, injekčný roztok naplnený v pere
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml obsahuje 100 jednotiek inzulínu glulizínu (čo zodpovedá 3,49 mg). Každé pero obsahuje 3 ml injekčného roztoku, čo zodpovedá 300 jednotiek.
Inzulín glulizín sa vyrába rekombinantnou DNA technológiou s použitím kmeňov Escherichia coli. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok naplnený v pere. OptiSet.
Číry, bezfarebný, vodný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba dospelých pacientov s diabetes mellitus.
4.2 Dávkovanie a spôsob podávania
Účinnosť tohto lieku je daná v jednotkách. Tieto jednotky sú špecifické len pre Apidru a nie sú rovnaké ako IU alebo jednotky, ktoré sa používajú na vyjadrenie účinnosti iných inzulínových analógov. Pozri časť 5.1 (Farmakodynamika).
Apidra sa má podávať krátko (0-15 min) pred alebo skoro po jedle.
Apidra sa má podávať v režimoch, ktoré obsahujú strednodobo alebo dlhodobo pôsobiaci inzulín alebo analóg bazálneho inzulínu a môže sa používať s perorálnymi hypoglykemizujúcimi liekmi.
Dávkovanie Apidry sa má upravovať individuálne. Podávanie
Apidra sa má podávať subkutánnou injekciou alebo kontinuálnou subkutánnou infúziou pomocou
pumpy.
Apidra sa má podávať subkutánne do abdominálnej steny, do stehna alebo do deltového svalu alebo kontinuálnou infúziou do abdominálnej steny. Miesta vpichu injekcie alebo infúzie v rámci danej oblasti (brucho, stehno alebo deltoid) sa majú obmieňať od jednej injekcie po ďalšiu. Rýchlosť absorpcie a potom nástup a trvanie účinku môžu byť ovplyvnené miestom vpichu injekcie, cvičením a ďalšími premennými. Subkutánna injekcia do abdominálnej steny zabezpečuje mierne rýchlejšiu absorpciu ako injekcia do iných miest vpichu (pozri časť 5.2).
Musí sa dávať pozor, aby nebola zasiahnutá krvná cieva. Po injekcii sa miesto vpichu nemá masírovať. Pacienti majú byť poučení o používaní vhodnej injekčnej techniky.
Miešanie s inzulínmi
Inzulín glulizín sa nesmie miešať s inými liekmi s výnimkou NPH ľudského inzulínu, keďže neexistujú štúdie inkompatibility.
Pred použitím OptiSetu si musí pacient dôkladne prečítať návod na používanie v písomnej informácii pre používateľov (pozri časť 6.6).
Špeciálne skupiny pacientov
Zhoršená funkcia obličiek
Vo všeobecnosti sa farmakokinetické vlastnosti inzulínu glulizínu u pacientov s poškodením funkcie obličiek zachovávajú. Avšak pri zhoršenej funkcii obličiek môžu byť nároky na inzulín znížené (pozri časť 5.2).
Zhoršená funkcia pečene
U pacientov so zníženou funkciou pečene sa farmakokinetické vlastnosti inzulínu glulizínu neskúmali. U pacientov s poškodením funkcie pečene môžu byť nároky na inzulín nižšie kvôli zníženej kapacite pre glukoneogenézu a zníženému inzulínovému metabolizmu.
Starší pacienti
U starších pacientov s diabetes mellitus sú k dispozícii obmedzené farmakokinetické údaje.Zhoršenie renálnej funkcie môže viesť k poklesu nárokov na inzulín.
Deti a adolescenti
O používaní Apidry u detí a adolescentov nie je dostatok klinických informácií.
4.3 Kontraindikácie
Precitlivenosť na inzulín glulizín alebo na niektorú z pomocných látok. Hypoglykémia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Prechod pacienta na nový typ alebo druh inzulínu sa má uskutočniť pod prísnym lekárskym dohľadom. Zmeny v sile, druhu (výrobca), type (bežný, NPH, lente, atď.), pôvode (zvierací) a/alebo spôsobe výroby môžu vyústiť do zmeny v dávkovaní. Súbežná liečba perorálnymi antidiabetikami si môže vyžiadať úpravu.
Použitie neprimeraného dávkovania alebo ukončenie liečby, najmä u pacientov závislých na inzulíne, môže viesť ku hyperglykémii a diabetickej ketoacidóze; k stavom potenciálne letálnym.
Prestavenie pacienta na iný typ alebo druh inzulínu sa musí robiť pod prísnym lekárskym dohľadom a môže si to vyžiadať zmenu dávky.
Hypoglykémia
Čas výskytu hypoglykémie závisí od akčného profilu podávaných inzulínov a môže sa preto pri zmene liečebného režimu meniť.
Stavy, ktoré môžu rôzne alebo málo zvýrazniť včasné varovné príznaky hypoglykémie, zahŕňajú dlho trvajúci diabetes, intenzifikovanú inzulínovú liečbu, diabetické nervové ochorenie, lieky ako sú betablokátory alebo po prechode z inzulínu zvieracieho pôvodu na ľudský inzulín.
Úprava dávkovania môže byť potrebná aj vtedy, ak pacienti majú zvýšenú fyzickú aktivitu alebo menia svoj obvyklý plán jedál. Cvičenie vykonávané bezprostredne po jedle môže zvýšiť riziko hypoglykémie.
Pri porovnávaní s rozpustným ľudským inzulínom, ak sa hypoglykémia objaví po injekcii rýchlo pôsobiacich analógov, môže nastať rýchlejšie.
Neupravené hypoglykemické alebo hyperglykemické reakcie môžu spôsobiť stratu vedomia, kómu alebo smrť.
Nároky na inzulín sa môžu zmeniť počas choroby alebo pri emočných poruchách.
Zaobchádzanie s perom
Pred použitím OptiSetu si musí pacient dôkladne prečítať návod na používanie v písomnej informácii pre používateľov. OptiSet sa musí používať tak, ako sa odporúča v tomto návode na používanie (pozri časť 6.6).
4.5 Liekové a iné interakcie
Štúdie farmakokinetických interakcií sa neuskutočnili. Na základe empirických poznatkov o podobných liekoch výskyt klinicky relevantných interakcií nie je pravdepodobný.
Množstvo látok ovplyvňuje glukózový metabolizmus a môže si vyžiadať úpravu dávok inzulínu glulizínu a obzvlášť starostlivé monitorovanie.
Medzi látky, ktoré môžu zvýšiť účinok znižujúci hladinu cukru v krvi a zvýšiť tak pravdepodobnosť hypoglykémie patria perorálne antidiabetiká, inhibítory angiotenzín konvertujúceho enzýmu (ACE), disopyramid, fibráty, fluoxetín, inhibítory monoaminooxidázy (IMAO), pentoxifylín, propoxyfén, salicyláty a sulfónamidové antibiotiká.
Medzi látky, ktoré môžu redukovať účinok znižujúci hladinu cukru v krvi patria kortikoidy, danazol, diazoxid, diuretiká, glukagón, izoniazid, deriváty fenotiazínu, somatropín, sympatomimetiká (napr. epinefrín [adrenalín], salbutamol, terbutalín), hormóny štítnej žľazy, estrogény, progestíny (napr. perorálne kontraceptíva), inhibítory proteázy a atypické antipsychotické lieky (napr. olanzapín
a klozapín).
Betablokátory, klonidín, lítiové soli alebo alkohol môžu účinok inzulínu znižujúci hladinu cukru v krvi potencovať, alebo oslabovať. Pentamidín môže spôsobiť hypoglykémiu, ktorá je niekedy nasledovaná hyperglykémiou.
Okrem toho môžu byť pod vplyvom sympatolytických liekov, ako sú betablokátory, klonidín, guanetidín a rezerpín príznaky adrenergnej kontraregulácie redukované, alebo môžu chýbať.
4.6 Gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití inzulínu glulizínu u gravidných žien.
Reprodukčné štúdie na zvieratách neodhalili žiadne rozdiely medzi inzulínom glulizínom a ľudským inzulínom, čo sa týka gravidity, embryonálneho/fetálneho vývoja, pôrodu alebo postnatálneho vývoja (pozri časť 5.3)
Pri predpisovaní gravidným ženám sa má zvýšiť opatrnosť. Nevyhnutné je starostlivé monitorovanie glukózovej kontroly.
U pacientok s preexistujúcim alebo gestačným diabetom je nevyhnutné počas gravidity udržať dobrú metabolickú kontrolu. Nároky na inzulín môžu počas prvého trimestra klesnúť a celkovo stúpnuť počas druhého a tretieho trimestra. Okamžite po pôrode nároky na inzulín rapídne poklesnú.
L
aktácia
Nie je známe, či sa inzulín glulizín vylučuje do materského mlieka, ale vo všeobecnosti inzulín
neprechádza do materského mlieka a po perorálnom podaní sa neabsorbuje. Dojčiace ženy môžu vyžadovať úpravu dávky inzulínu a úpravu diéty.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pacientova schopnosť koncentrovať sa a reagovať môže byť narušená následkom hypoglykémie alebo hyperglykémie alebo napr. následkom poškodenia zraku. Toto môže predstavovať riziko v situáciách, kedy sú tieto schopnosti zvlášť dôležité (napr. vedenie vozidla alebo obsluha strojov).
Pacienti majú byť poučení, aby sa vystríhali hypoglykémie počas vedenia vozidla. Zvlášť dôležité je to u pacientov, u ktorých je uvedomovanie si varovných príznakov hypoglykémie redukované alebo absentuje alebo u tých, ktorí mávajú časté epizódy hypoglykémie. Musí sa zvážiť, či je vedenie
vozidiel alebo obsluhovanie strojov za týchto okolností vhodné.
4.8 Nežiaduce účinky
Hypoglykémia, najčastejší nežiaduci účinok inzulínovej terapie, sa môže vyskytnúť, ak je inzulínová dávka vo vzťahu k potrebe inzulínu príliš vysoká.
Nasledujúce nežiaduce reakcie, ktoré vyplynuli z klinických štúcií, sú zoradené podľa tiredy orgánových sytémov a podľa klesajúceho výskytu (veľmi časté: ≥1/10; časté: ≥1/100 až <1/10; menej časté: ≥1/1000 až <1/100; zriedkavé: ≥1/10 000 až <1/1000; veľmi zriedkavé: <1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Poruchy metabolizmu a výživy
Veľmi časté: Hypoglykémia
Symptómy hypoglykémie sa obyčajne objavia náhle. Môžu zahŕňať studený pot, studená, bledá koža, únava, nervozita alebo triaška, úzkosť, neobvyklá únava alebo slabosť, zmätenosť, ťažkosti pri sústredení sa, ospalosť, pálčivý hlad, zmeny videnia, bolesť hlavy, nauzea a palpitácie.
Hypoglykémia sa môže stať závažnou a môže viesť k strate vedomia a/alebo kŕčom a môže vyústiť do
dočasného alebo trvalého poškodenia funkcie mozgu alebo dokonca smrti.
Poruchy kože a podkožného tkaniva
Časté: reakcie v mieste vpichu injekcie a lokálne hypersenzitívne reakcie.
Počas liečby inzulínom sa môžu vyskytnúť lokálne hypersenzitívne reakcie (sčervenenie, opuch
a svrbenie v mieste vpichu injekcie). Tieto reakcie bývajú obvykle prechodné a normálne vymiznú v priebehu ďalšej liečby.
Zriedkavé: Lipodystrofia
V mieste vpichu injekcie sa môže objaviť lipodystrofia ako dôsledok toho, že sa nestiredajú miesta vpichu injekcií v rámci danej oblasti.
Celkové poruchy
Menej časté: Systémové hypersenzitívne reakcie
Systémové hypersenzitívne reakcie môžu zahŕňať žihľavku, tlak na hrudníku, dyspnoe, alergickú dermatitídu a pruritus. Závažné prípady generalizovanej alergie, vrátane anafylaktickej reakcie, môžu ohrozovať život.
4.9 Predávkovanie
Hypoglykémia môže nastať následkom výrazného účinku inzulínu vo vzťahu k príjmu jedla a výdaju energie.
O predávkovaní inzulínom glulizínom nie sú k dispozícii žiadne špecifické údaje. Avšak v ďalších štádiách sa môže hypoglykémia rozvinúť:
Mierne príhody hypoglykémie sa môžu liečiť perorálnym podaním glukózy alebo výrobkov z cukru. Preto sa diabetickým pacientom odporúča neustále so sebou nosiť kockový cukor, sladkosti, sušienky alebo cukrom sladené džúsy.
Ťažké príhody hypoglykémie, kedy pacient stráca vedomie, možno liečiť glukagónom (0,5 až 1 mg) podaným intramuskulárne alebo subkutánne primerane vyškolenou osobou alebo glukózou podanou intravenózne odborníkom v medicíne. Glukóza sa musí podať intravenózne aj vtedy, ak pacient
v priebehu 10 až 15 minút neodpovedá na glukagón.
Po nadobudnutí vedomia sa pacientovi odporúča perorálne podávanie uhľovodíkov, ako prevencia relapsu.
Po injekcii glukagónu sa musí pacient monitorovať v nemocnici,aby sa zistila príčina tejto ťažkej hypoglykémie a aby sa predišlo ďalším podobným príhodám.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: inzulín a analógy, rýchlo pôsobiace. ATC kód: A10AB06
Inzulín glulizín je rekombinatný analóg ľudského inzulínu, ktorý je ekvipotentný bežnému ľudskému inzulínu. Inzulín glulizín má rýchlajší nástup účinku a kratšie trvanie účinku ako bežný ľudský inzulín.
Primárnym účinkom inzulínov a inzulínových analógov, vrátane inzulínu glulizínu, je regulácia metabolizmu glukózy. Inzulín znižuje hladiny glukózy v krvi stimuláciou periférnej absorpcie glukózy, najmä kostrovým svalstvom a tukovým tkanivom, a inhibíciou produkcie glukózy v pečeni. Inzulín inhibuje lipolýzu v adipocytoch, inhibuje proteolýzu a podporuje syntézu proteínov.
Štúdie u zdravých dobrovoľníkov a pacientov s diabetom ukázali, že inzulín glulizín má rýchlejší nástup účinku a kratšie trvanie účinku, ako bežný ľudský inulín podávaný subkutánne. Ak sa inzulín glulizín podáva subkutánne, začína sa jeho pôsobenie na zníženie hladiny glukózy v krvi v priebehu
10 – 20 minút. Ak sa inzulín glulizín a bežný ľudský inzulín podávajú intravenózne, ich účinok na zníženie hladiny glukózy v krvi je ekvipotentný. Jedna jednotka inzulínu glulizínu má rovnaký účinok na zníženie hladiny glukózy v krvi ako jedna jednotka bežného ľudského inzulínu.
Úmernosť vo vzťahu k dávke
V štúdii, v ktorej sa zúčastnilo 18 pacientov mužského pohlavia s diabetes mellitus typu 1 vo veku od
21 do 50 rokov, sa prejavil účinok na zníženie hladiny glukózy v krvi úmerný dávke v terapeuticky relevantnom rozsahu dávok 0,075 až 0,15 U/kg, a menej ako úmerné zvýšenie účinku na zníženie hladiny glukózy v krvi pri dávke 0,3 U/kg alebo väčšej, podobne ako u ľudského inzulínu.
Inzulín glulizín účinkuje približne dvakrát tak rýchlo ako bežný ľudský inzulín a dosahuje účinok na zníženie hladiny glukózy v krvi približne o 2 hodiny skôr ako bežný ľudský inzulín.
Štúdia fázy I u pacientov s diabetes mellitus typu 1 hodnotila účinok na zníženie hladiny glukózy u inzulínu glulizínu a bežného ľudského inzulínu podávaných subkutánne v dávke 0,15 U/kg
v rozličnom časovom vzťahu ku štandardnému 15-minútovému jedlu. Údaje ukazujú, že inzulín
glulizín podávaný 2 minúty pred jedlom poskytuje podobnú postprandiálnu glykemickú kontrolou ako
Obrázok 2: Rýchlosť infúzie glukózy po subkutánnej injekcii 0,3 U/kg inzulínu glulizínu (GLULIZÍN)
alebo inzulínu lispro (LISPRO) alebo bežného ľudského inzulínu (BEŽNÝ) u obéznej populácie.
Ďalšia štúdia fázy I s inzulínom glulizínom a inzulínom lispro v populácii nediabetikov, v ktorej sa zúčastnilo 80 jedincov so širokým rozsahom body mass indexu (18-46 kg/m²) ukázala, že rýchly účinok je v širokom rozsahu body mass indexu vo všeobecnosti zachovaný, zatiaľ čo celkový účinok na zníženie hladiny glukózy v krvi klesá súčasne so stúpajúcou obezitou.
Priemerná celková AUC rýchlosti využitia glukózy v intervale 0–1 hodina bola v prípade inzulínu glulizínu 102±75 mg/kg pri dávke 0,2 U/kg a 158±100 mg/kg pri dávke 0,4 U/kg a v prípade inzulínu lispro 83,1±72,8 mg/kg pri dávke 0,2 U/kg a 112,3±70,8 mg/kg pri dávke 0,4 U/kg.
Štúdia fázy I u 18 obéznych pacientov s diabetom mellitus 2.typu (BMI medzi 35 a 40 kg/m2) s inzulínom glulizínom a inzulínom lispro [90% CI:0,81, 0,95 (p=<0,01)] ukázala, že inzulín glulizín efektívne kontroluje denné rozdiely postprandiálnej hladiny glukózy v krvi.
Klinické štúdie
Daibetes mellitus1.typu
V 26 týždňovej klinickej štúdii fázy III porovnávajúcej inzulín glulizín s inzulínom lispro, oba podávané subkutánne, krátko (0-15 minút) pred jedlom u pacientov s diabetes mellitus 1.typu za použitia inzulínu glargínu ako bazálneho inzulínu, bol inzulín glulizín v glykemickej kontrole porovnateľný s inzulínom lispro, čo sa odrazilo v zmenách glykovaného hemoglobínu (vyjadreného ako HbA1c ekvivalent) z východiskových hodnôt po koncový bod. Boli pozorované porovnateľné hodnoty self-monitorovanej krvnej glukózy. V kontraste s inzulínom lispro nebolo pri inzulíne glulizíne potrebné zvýšenie dávky bazálneho inzulínu.
V 12 týždňovej klinickej štúdii fázy III, ktorá sa uskutočnila u pacientov s diabetes mellitus 1.typu dostávajúcich inzulín glargín ako bazálnu terapiu, ukázala, že účinnosť podania inzulínu glulizínu bezprostredne po jedle je porovnateľná s účinnosťou podania inzulínu glulizínu bezprostredne pred jedlom (0-15 minút) alebo bežného inzulínu (30-45 minút).
U zaprotokolovanej populácie bolo pozorované signifikatne vyššie zníženie glykovaného hemoglobínu v skupine s inzulínom glulizínom podaným pred jedlom v porovnaní so skupinou s bežným inzulínom.
Diabetes mellitus 2.typu
26-týždňová klinická štúdia fázy III, po ktorej nasledovala 26-týždňová štúdia rozšírenej bezpečnosti,sa uskutočnila pre porovnanie inzulínu glulizínu (0-15 minút pred jedlom) s bežným ľudským inzulínom (30-45 minút pred jedlom) oboma podanými subkutánne u pacientov s diabetes mellitus 2.typu, pričom niektorí užívali ešte ako bazálny inzulín NPH inzulín. Priemerný BMI index pacientov bol 34,55 kg/m2. Čo sa týka zmien glykovaného hemoglobínu (vyjadreného ako ekvivalent HbA1c) z počiatočnej hodnoty k 6-mesačnej konečnej hodnote (-0,46% pre inzulín glulizín a –0,30% pre bežný ľudský inzulín, p=0,0029) a počiatočnej hodnoty na 12-mesačnú konečnú hodnotu (-0,23% pre inzulín glulizín a –0,13% pre bežný ľudský inzulín, rozdiel nie je výrazný, sa inzulín glulizín ukázal ako porovnateľný s bežným ľudským inzulínom.. V tejto štúdii si väčšina pacientov (79%) miešala tesne pred podaním injekcie krátko účinkujúci inzulín s inzulínom NPH a 58% pacientov užívalo perorálne antidiabetiká v čase randomizácie, pričom boli inštruovaní, aby v ich užívaní pokračovali v rovnakom dávkovaní.
Rasa a pohlavie
V kontrolovaných klinických štúdiách u dospelých nevykazoval inzulín glulizín rozdiely v bezpečnosti a účinnosti v podskupinových analýzach založených na rase a pohlaví.
5.2 Farmakokinetické vlastnosti
Nahradenie aminokyseliny asparagínu v pozícii B3 lyzínom a lyzínu v pozícii B29 kyselinou glutámovou v ľudskom inzulíne určuje rýchlejšiu absorpciu inzulínu glulizínu.
V štúdii, v ktorej sa zúčastnilo 18 pacientov mužského pohlavia s diabetes mellitus typu 1 vo veku od
21 do 50 rokov, sa prejavil účinok inzulínu glulizínu ako úmerný dávke pri skorej, maximálnej a celkovej expozícii v rozsahu dávok 0,075 až 0,4 U/kg,
Absorpcia a biologická dostupnosťFarmakokinetické profily u zdravých dobrovoľníkov a diabetických pacientov (1. alebo 2.typu)
ukázali, že v porovnaní s bežným ľudským inzulínom je absorpcia inzulínu glulizínu asi dvakrát rýchlejšia a jeho vrcholová koncentrácia je približne dvakrát vyššia.
V štúdii u pacientov s diabetes mellitus 1.typu boli po subkutánnom podaní 0,15 U/kg hodnoty tmax
55 minút a Cmax 82 ±1,3 μU/ml pre inzulín glulizín a tmax 82 minút a Cmax 46 ±1,3 μU/ml pre bežný
ľudský inzulín. Priemerný reziduálny čas inzulínu glulizínu bol kratší (98 minút) ako u bežného
ľudského inzulínu (161 minút) (pozri obrázok 3).


GLULIZÍN










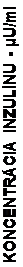 80
80 BEŽNÝ
 60
60

 40
40 200
200 0 1 2 3 4 5 6ČAS - hodina
0 1 2 3 4 5 6ČAS - hodinaObrázok 3: Farmakokinetický profil inzulínu glulizínu a bežného ľudského inzulínu u pacientov s diabetes mellitus 1.typu po dávke 0,15 U/kg.
V štúdii s pacientmi s diabetes mellitus 2.typu po subkutánnom podaní 0,2 U/kg inzulínu glulizínu, Cmax bol 91 μU/ml s interkvartilným rozsahom od 78 do 104 μU/ml.
Keď bol inzulín glulizín injikovaný subkutánne do brucha, deltoidu a ramena, boli časovokoncentračné profily podobné s trošku rýchlejšou absorpciou pri podaní do brucha v porovnaní s ramenom. Absorpcia z miesta v deltoide bola medzi týmito hodnotami (pozri časť 4.2). Absolútna biologická dostupnosť (70%) inzulínu glulizínu bola podobná pre všetky injekčné oblasti s nízkou vnútornou internou variabilitou (11% CV).
Obezita
Ďalšia štúdia fázy I s inzulínom glulizínom a inzulínom lispro v populácii nediabetikov, v ktorej sa zúčastnilo 80 jedincov so širokým rozsahom body mass indexu (18-46 kg/m2) preukázala, že rýchla absorpcia a celková expozícia zostáva v širokom rozsahu body mass indexu vo všeobecnosti zachovaná.
S inzulínom glulizínom sa dosiahol čas do 10% celkovej INS expozície približne o 5-6 minút skôr.
Distribúcia a eliminácia
Distribúcia a eliminácia inzulínu glulizínu a bežného ľudského inzulínu je po intravenóznom podaní
podobná, distribučné objemy sú 13 l resp. 22 l a polčasy sú 13 resp. 18 minút.
Po subkutánnom podaní sa inzulín glulizín eliminuje rýchlejšie ako bežný ľudský inzulín, zdanlivý polčas je 42 minút v porovnaní s 86 minútami. V skríženej analytickej štúdii inzulínu glulizínu buď u zdravých dobrovoľníkov alebo jedincov s diabetes mellitus 1. alebo 2.typu bol zdanlivý polčas
v rozsahu 37 až 75 minút (interkvartilný rozsah).
Inzulín glulizín má podobne ako ľudský inzulín nízku väzbovosť na plazmové proteíny. Špeciálne skupiny pacientov
Zhoršená funkcia obličiek
V klinickej štúdii u nediabetických jedincov zahrňujúcich širokú škálu renálnej funkcie
(CrCl >80 ml/min, 30-50 ml/min, <30 ml/min), boli rýchlo pôsobiace vlastnosti inzulínu glulizínu vo všeobecnosti zachované. Avšak nároky na inzulín pri zhoršenej funkcii obličiek môžu byť znížené.
Zhoršená funkcia pečene
Farmakokinetické vlastnosti u pacientov so zhoršenou funkciou pečene sa neskúmali.
Starší pacienti
U starších pacientov s diabetes mellitus sú k dispozícii veľmi obmedzené farmakokinetické údaje..
Deti a dospievajúci
Farmakokinetické a farmakodynamické vlastnosti inzulínu glulizínu sa skúmali u detí (7-11 rokov)
a adolescentov (12-16 rokov) s diabetes mellitus 1.typu. Inzulín glulizín sa rýchlo absorboval
u obidvoch vekových skupín, s podobným tmax a Cmax ako u dospelých (pozri časť 4.2). Ak sa inzulín gulizín podal bezprostredne pred jedlom, ukázal lepšiu postprandiálnu kontrolu, ako bežný ľudský inzulín, ako u dospelých (pozri časť 5.1). Glukózový rozdiel (AUC0-6h) bol 641 mg.h.dl-1 pre inzulín glulizín a 801 mg.h.dl-1 pre bežný ľudský inzulín.
5.3 Predklinické údaje o bezpečnosti
Predklinické štúdie neodhalili iné toxické nálezy než tie, ktoré sa spájajú s farmakodynamickou aktivitou znižujúcou glukózu (hypoglykémia), ktoré by boli odlišné od bežného ľudského inzulínu alebo nálezy klinicky závažné pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
metakrezol chlorid sodný trometamol polysorbát 20
kyselina chlorovodíková, koncentrovaná hydroxid sodný
voda na injekciu
6.2 Inkompatibility
Pri absencii štúdií kompatibility sa inzulín glulizín nesmie miešať s inými liekmi s výnimkou NPH
ľudského inzulínu.
6.3 Čas použiteľnosti
2 roky.
Čas použiteľnosti po prvom použití: liek sa môže uchovávať maximálne 4 týždne pri teplote neprevyšujúcej 25°C. Uchovávajte naplnené pero vo vonkajšom obale na ochranu pred svetlom. Neuchovávajte v chladničke.
6.4 Špeciálne upozornenia na uchovávanie
Neotvorené
Uchovávajte v chladničke (2°C - 8°C).
Uchovávajte naplnené pero vo vonkajšom obale na ochranu pred svetlom. Neuchovávajte v mrazničke.
Zabezpečte, aby sa obal priamo nedotýkal výparníka alebo zmrazených balení.
Podmienky pri používaní
Upozornenia na uchovávanie pozri časť 6.3.
6.5 Druh obalu a obsah balenia
3 ml injekčného roztoku v náplni (bezfarebné sklo typu I) s piestom (guma z elastoméru) a obrubou (zapečatenou hliníkom) so zátkou (guma z elastoméru). Náplň je zaplombovaná v jednorazovom naplnenom pere. Sú dostupné balenia po 1, 3, 4, 5, 6, 8, 9 a 10 pier.
Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred použitím si náplň prezrite. Použitá môže byť len vtedy, ak je roztok číry, bezfarebný
a neobsahuje viditeľné tuhé častice a ak má konzistenciu podobnú ako voda. Keďže Apidra je roztok, nevyžaduje sa pred použitím resuspenzácia.
Prázdne perá sa nikdy nesmú používať a musia byť vhodným spôsobom zlikvidované.
Aby sa zabránilo akejkoľvek kontaminácii, musí sa prísne dodržiavať pravidlo, že to isté pero používa vždy len jeden pacient.
Zaobchádzanie s perom
Pred použitím OptiSetu si musí pacient dôkladne prečítať návod na používanie v písomnej informácii pre používateľov.
Uzáver pera Ihla pera (v pere nezahrnutá)
Ochranné tesnenie
Inzulínový zásobník
Čierny piest
Telo pera
Názov inzulínu a farebné označenie
Dávkovaci a šípka
Vonkajší
kryt ihly
Vnútorný
kryt ihly Ihla
Farebná
Gumené čiara
Ukazovateľ
zvyšného
Prepínač Injekčné
Schematický nákres pera
tesnenie
inzulínu
dávky
tlačidlo
Dôležité informácie pre používanie OptiSetu:
• Pred každým použitím sa musí upevniť nová ihla. Používajte ihly iba určené pre použitie s
OptiSetom.
• Pred každou injekciou vždy urobte skúšku bezpečnosti.
• V prípade použitia nového OptiSetu, počiatočná skúška bezpečnosti sa musí vykonať s dávkou
8 jednotiek, ktorá je už nastavenou výrobcom.
• Prepínač dávky sa môže otáčať iba smerom dopredu.
• Nikdy neotáčajte prepínač dávky (zmena dávky) po vytiahnutí injekčného tlačidla.
• Toto pero je určené iba pre Vás. Nezdieľajte ho s nikým iným.
• Ak vám podáva injekciu niekto iný, od tejto osoby sa vyžaduje špeciálna opatrnosť, aby sa predišlo náhodnému poraneniu ihlou a prenosu infekcie.
• Nikdy nepoužívajte OptiSet , ak je poškodený, alebo ak nie ste si istý, či funguje správne.
• Pre prípad straty alebo poškodenia, vždy musíte mať náhradný OptiSet.
Pokyny na uchovávanie
Pozrite si prosím časť 6.4, kde sú uvedené pokyny ako uchovávať OptiSet.
Ak sa OptiSet uchováva na chladnom mieste, musí sa odtiaľ vziať 1 až 2 hodiny pred podaním injekcie, aby sa oteplil. Podanie chladného unzulínu je bolestivejšie.
Použitý OptiSet sa musí zlikvidovať v súlade s požiadavkami lokálnych autorít.
Údržba
OptiSet je nutné chrániť pred prachom a nečistotami. Vonkajšiu stranu OptiSetu môžete očistiť vlhkou handričkou.
Pero nenamáčajte, neumývajte a nemastite, môže sa tým poškodiť.
OptiSet je navrhnutý tak, aby sa s ním pracovalo presne a bezpečne. Má sa s ním zaobchádzať starostlivo. Vyhnite sa situáciám, kde sa môže poškodiť. Ak máte obavy, že OptiSet môže byť poškodený, použite nový.
Krok 1 Skontrolujte inzulín
Po odstránení uzáveru pera sa musí skontrolovať štítok na pere a inzulínovom zásobníku, aby bolo isté, že obsahuje správny inzulín. Taktiež sa musí skontrolovať vzhľad inzulínu: roztok inzulínu musí byť číry, bezfarebný a nesmú byť vidno tuhé častice a musí mať konzistenciu podobnú ako voda. Nepoužívajte OptiSet, keď roztok inzulínu je zakalený, sfarbený alebo obsahuje častice.
Krok 2 Upevnite ihlu
Ihla sa musí dôkladne nasadiť priamo na pero.
Krok 3 Vykonajte skúšku bezpečnosti
Pred každou injekciou sa musí urobiť skúška bezpečnosti.
Pre nový a ešte nepoužitý OptiSet počiatočná skúška bezpečnosti sa musí vykonať s dávkou 8
jednotiek, ktorá je už nastavená výrobcom.
V prípade už používaného OptiSetu, nastavte dávku 2 jednotiek otáčaním prepínača dávky smerom dopredu, až kým dávkovacia šípka nebude ukazovať na číslo 2. Prepínač dávky môžete otáčať iba jedným smerom.
Aby ste nastavili dávku, úplne vytiahnite injekčné tlačidlo. Nikdy neotáčajte prepínač dávky po vytiahnutí injekčného tlačidla.
Vonkajší a vnútorný kryt ihly sa musí odstrániť. Vonkajší kryt ihly odložte na odstránenie použitej ihly.
Držte pero tak, aby ihla smerovala nahor, súčasne jemne poklepávajte prstom na inzulínový zásobník tak, aby sa všetky vzduchové bubliny dostali k ihle.
Potom sa musí úplne stlačiť injekčné tlačidlo.
Ak vystrekne inzulín cez hrot ihly, znamená to, že pero a ihla fungujú správne.
Ak sa na hrote ihly neobjaví žiadny inzulín, bod 3 sa musí o ešte dvakrát, až kým sa inzulín na hrote ihly neobjaví. Ak inzulín ešte stále nevystrekne, vymeňte ihlu, pretože môže byť upchatá a pokúste sa znovu. Ak inzulín ani po výmene ihly nevystrekne, OptiSet môže byť poškodený. Nepoužívajte už tento OptiSet.
Krok 4 Nastavte dávku
Dávku možno nastaviť v krokoch po 2 jednotkách, od minimálnej hodnoty 2 jednotky až po maximálnu hodnotu 40 jednotiek. Ak sa vyžaduje dávka vyššia ako 40 jednotiek, musí sa podať v dvoch alebo viacerých injekciách.
Skontrolujte, či máte dosť inzulínu na potrebnú dávku.
Ukazovateľ zvyšného inzulínu na priehľadnom inzulínovom zásobníku ukazuje približne zostávajúce množstvo inzulínu v OptiSete. Tento ukazovateľ sa nesmie použiť na nastavenie dávky inzulínu.
Ak čierny piest sa nachádza na začiatku farebnej čiary, potom je k dizpozícii približne 40 jednotiek inzulínu.
Ak čierny piest sa nachádza na konci farebnej čiary, potom je k dizpozícii približne 20 jednotiek inzulínu.
Dávkovačom sa musí otáčať smerom dopredu , kým dávkovacia šípka neukazuje na požadovanú dávku.
Krok 5 Natiahnite dávku
Injekčné tlačidlo sa musí vytiahnuť tak ďaleko ako sa dá, aby sa dávka mohla natiahnuť. Skontrolojte, či zvolená dávka je úplne natiahnutá. Všimnite si, že injekčné tlačidlo sa dá vytiahnuť
len tak ďaleko, aké je zostávajúce množstvo inzulínu v zásobníku.
Injekčné tlačidlo umožní kontrolu aktuálnej natiahnutej dávky. Injekčné tlačidlo počas tejto kontroly musí zostať vytiahnuté. Posledná hrubá viditeľná čiara na injekčnom tlačidle ukazuje množstvo natiahnutého inzulínu. Keď injekčné tlačidlo je vytiahnuté, vidieť iba vrchnú časť tejto hrubej čiary.
Krok 6 Podajte dávku
Pacient musí byť informovaný o injekčnej technike svojím odborníkom na liečbu cukrovky. Ihla sa musí vpichnúť do kože.
Injekčné tlačidlo sa musí úplne zatlačiť. Môžete počuť klikanie, ktoré prestane, keď sa injekčné
tlačidlo úplne zatlačí. Potom sa injekčné tlačidlo musí držať zatlačené 10 sekúnd pred vytiahnutím ihly z kože. Tým sa zabezpečí, že bude podaná celá dávka inzulínu.
Krok 7 Odstráňte ihlu
Po každej injekcii sa musí ihla odstrániť a zlikvidovať. Zabraňuje sa tým kontaminácii a/alebo infekcii ako aj prístupu vzduchu do inzulínového zásobníka a unikaniu inzulínu, čo by mohlo spôsobiť nepresné dávkovanie.. Ihly sa nesmú používať opakovane.
Na pero sa musí opäť nasadiť uzáver.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Sanofi-Aventis Deutschland GmbH, Brueningstrasse 50, D-65926 Frankfurt am Main, Nemecko.
8. REGISTRAČNÉ ČÍSLO
EU/1/04/285/013-020
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 27. september 2004
10. DÁTUM REVÍZIE TEXTU
1. NÁZOV LIEKU
Apidra 100 jednotiek/ml, injekčný roztok naplnený v pere
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml obsahuje 100 jednotiek inzulínu glulizínu (čo zodpovedá 3,49 mg). Každé pero obsahuje 3 ml injekčného roztoku, čo zodpovedá 300 jednotiek.
Inzulín glulizín sa vyrába rekombinantnou DNA technológiou s použitím kmeňov Escherichia coli. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok naplnený v pere. SoloStar.
Číry, bezfarebný, vodný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Liečba dospelých pacientov s diabetes mellitus.
4.2 Dávkovanie a spôsob podávania
Účinnosť tohto lieku je daná v jednotkách. Tieto jednotky sú špecifické len pre Apidru a nie sú rovnaké ako IU alebo jednotky, ktoré sa používajú na vyjadrenie účinnosti iných inzulínových analógov. Pozri časť 5.1 (Farmakodynamika).
Apidra sa má podávať krátko (0-15 min) pred alebo skoro po jedle.
Apidra sa má podávať v režimoch, ktoré obsahujú strednodobo alebo dlhodobo pôsobiaci inzulín alebo analóg bazálneho inzulínu a môže sa používať s perorálnymi hypoglykemizujúcimi liekmi.
Dávkovanie Apidry sa má upravovať individuálne. Podávanie
Apidra sa má podávať subkutánnou injekciou alebo kontinuálnou subkutánnou infúziou pomocou
pumpy.
Apidra sa má podávať subkutánne do abdominálnej steny, do stehna alebo do deltového svalu alebo kontinuálnou infúziou do abdominálnej steny. Miesta vpichu injekcie alebo infúzie v rámci danej oblasti (brucho, stehno alebo deltoid) sa majú obmieňať od jednej injekcie po ďalšiu. Rýchlosť absorpcie a potom nástup a trvanie účinku môžu byť ovplyvnené miestom vpichu injekcie, cvičením a ďalšími premennými. Subkutánna injekcia do abdominálnej steny zabezpečuje mierne rýchlejšiu absorpciu ako injekcia do iných miest vpichu (pozri časť 5.2).
Musí sa dávať pozor, aby nebola zasiahnutá krvná cieva. Po injekcii sa miesto vpichu nemá masírovať. Pacienti majú byť poučení o používaní vhodnej injekčnej techniky.
Miešanie s inzulínmi
Inzulín glulizín sa nesmie miešať s inými liekmi s výnimkou NPH ľudského inzulínu, keďže neexistujú štúdie inkompatibility.
Pred použitím SoloStaru si musí pacient dôkladne prečítať návod na používanie v písomnej informácii pre používateľov (pozri časť 6.6).
Špeciálne skupiny pacientov
Zhoršená funkcia obličiek
Vo všeobecnosti sa farmakokinetické vlastnosti inzulínu glulizínu u pacientov s poškodením funkcie obličiek zachovávajú. Avšak pri zhoršenej funkcii obličiek môžu byť nároky na inzulín znížené (pozri časť 5.2).
Zhoršená funkcia pečene
U pacientov so zníženou funkciou pečene sa farmakokinetické vlastnosti inzulínu glulizínu neskúmali. U pacientov s poškodením funkcie pečene môžu byť nároky na inzulín nižšie kvôli zníženej kapacite pre glukoneogenézu a zníženému inzulínovému metabolizmu.
Starší pacienti
U starších pacientov s diabetes mellitus sú k dispozícii obmedzené farmakokinetické údaje.Zhoršenie renálnej funkcie môže viesť k poklesu nárokov na inzulín.
Deti a adolescenti
O používaní Apidry u detí a adolescentov nie je dostatok klinických informácií.
4.3 Kontraindikácie
Precitlivenosť na inzulín glulizín alebo na niektorú z pomocných látok. Hypoglykémia.
4.4 Osobitné upozornenia a opatrenia pri používaní
Prechod pacienta na nový typ alebo druh inzulínu sa má uskutočniť pod prísnym lekárskym dohľadom. Zmeny v sile, druhu (výrobca), type (bežný, NPH, lente, atď.), pôvode (zvierací) a/alebo spôsobe výroby môžu vyústiť do zmeny v dávkovaní. Súbežná liečba perorálnymi antidiabetikami si môže vyžiadať úpravu.
Použitie neprimeraného dávkovania alebo ukončenie liečby, najmä u pacientov závislých na inzulíne, môže viesť ku hyperglykémii a diabetickej ketoacidóze; k stavom potenciálne letálnym.
Prestavenie pacienta na iný typ alebo druh inzulínu sa musí robiť pod prísnym lekárskym dohľadom a môže si to vyžiadať zmenu dávky.
Hypoglykémia
Čas výskytu hypoglykémie závisí od akčného profilu podávaných inzulínov a môže sa preto pri zmene liečebného režimu meniť.
Stavy, ktoré môžu rôzne alebo málo zvýrazniť včasné varovné príznaky hypoglykémie, zahŕňajú dlho trvajúci diabetes, intenzifikovanú inzulínovú liečbu, diabetické nervové ochorenie, lieky ako sú betablokátory alebo po prechode z inzulínu zvieracieho pôvodu na ľudský inzulín.
Úprava dávkovania môže byť potrebná aj vtedy, ak pacienti majú zvýšenú fyzickú aktivitu alebo menia svoj obvyklý plán jedál. Cvičenie vykonávané bezprostredne po jedle môže zvýšiť riziko hypoglykémie.
Pri porovnávaní s rozpustným ľudským inzulínom, ak sa hypoglykémia objaví po injekcii rýchlo pôsobiacich analógov, môže nastať rýchlejšie.
Neupravené hypoglykemické alebo hyperglykemické reakcie môžu spôsobiť stratu vedomia, kómu alebo smrť.
Nároky na inzulín sa môžu zmeniť počas choroby alebo pri emočných poruchách.
Zaobchádzanie s perom
Pred použitím SoloStaru si musí pacient dôkladne prečítať návod na používanie v písomnej informácii pre používateľov. SoloStar sa musí používať tak, ako sa odporúča v tomto návode na používanie
(pozri časť 6.6).
4.5 Liekové a iné interakcie
Štúdie farmakokinetických interakcií sa neuskutočnili. Na základe empirických poznatkov o podobných liekoch výskyt klinicky relevantných interakcií nie je pravdepodobný.
Množstvo látok ovplyvňuje glukózový metabolizmus a môže si vyžiadať úpravu dávok inzulínu glulizínu a obzvlášť starostlivé monitorovanie.
Medzi látky, ktoré môžu zvýšiť účinok znižujúci hladinu cukru v krvi a zvýšiť tak pravdepodobnosť hypoglykémie patria perorálne antidiabetiká, inhibítory angiotenzín konvertujúceho enzýmu (ACE), disopyramid, fibráty, fluoxetín, inhibítory monoaminooxidázy (IMAO), pentoxifylín, propoxyfén, salicyláty a sulfónamidové antibiotiká.
Medzi látky, ktoré môžu redukovať účinok znižujúci hladinu cukru v krvi patria kortikoidy, danazol, diazoxid, diuretiká, glukagón, izoniazid, deriváty fenotiazínu, somatropín, sympatomimetiká (napr. epinefrín [adrenalín], salbutamol, terbutalín), hormóny štítnej žľazy, estrogény, progestíny (napr. perorálne kontraceptíva), inhibítory proteázy a atypické antipsychotické lieky (napr. olanzapín
a klozapín).
Betablokátory, klonidín, lítiové soli alebo alkohol môžu účinok inzulínu znižujúci hladinu cukru v krvi potencovať, alebo oslabovať. Pentamidín môže spôsobiť hypoglykémiu, ktorá je niekedy nasledovaná hyperglykémiou.
Okrem toho môžu byť pod vplyvom sympatolytických liekov, ako sú betablokátory, klonidín, guanetidín a rezerpín príznaky adrenergnej kontraregulácie redukované, alebo môžu chýbať.
4.6 Gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití inzulínu glulizínu u gravidných žien.
Reprodukčné štúdie na zvieratách neodhalili žiadne rozdiely medzi inzulínom glulizínom a ľudským inzulínom, čo sa týka gravidity, embryonálneho/fetálneho vývoja, pôrodu alebo postnatálneho vývoja (pozri časť 5.3)
Pri predpisovaní gravidným ženám sa má zvýšiť opatrnosť. Nevyhnutné je starostlivé monitorovanie glukózovej kontroly.
U pacientok s preexistujúcim alebo gestačným diabetom je nevyhnutné počas gravidity udržať dobrú metabolickú kontrolu. Nároky na inzulín môžu počas prvého trimestra klesnúť a celkovo stúpnuť počas druhého a tretieho trimestra. Okamžite po pôrode nároky na inzulín rapídne poklesnú.
L
aktácia
Nie je známe, či sa inzulín glulizín vylučuje do materského mlieka, ale vo všeobecnosti inzulín
neprechádza do materského mlieka a po perorálnom podaní sa neabsorbuje. Dojčiace ženy môžu vyžadovať úpravu dávky inzulínu a úpravu diéty.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pacientova schopnosť koncentrovať sa a reagovať môže byť narušená následkom hypoglykémie alebo hyperglykémie alebo napr. následkom poškodenia zraku. Toto môže predstavovať riziko v situáciách, kedy sú tieto schopnosti zvlášť dôležité (napr. vedenie vozidla alebo obsluha strojov).
Pacienti majú byť poučení, aby sa vystríhali hypoglykémie počas vedenia vozidla. Zvlášť dôležité je to u pacientov, u ktorých je uvedomovanie si varovných príznakov hypoglykémie redukované alebo absentuje alebo u tých, ktorí mávajú časté epizódy hypoglykémie. Musí sa zvážiť, či je vedenie
vozidiel alebo obsluhovanie strojov za týchto okolností vhodné.
4.8 Nežiaduce účinky
Hypoglykémia, najčastejší nežiaduci účinok inzulínovej terapie, sa môže vyskytnúť, ak je inzulínová dávka vo vzťahu k potrebe inzulínu príliš vysoká.
Nasledujúce nežiaduce reakcie, ktoré vyplynuli z klinických štúcií, sú zoradené podľa tiredy orgánových sytémov a podľa klesajúceho výskytu (veľmi časté: ≥1/10; časté: ≥1/100 až <1/10; menej časté: ≥1/1000 až <1/100; zriedkavé: ≥1/10 000 až <1/1000; veľmi zriedkavé: <1/10 000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Poruchy metabolizmu a výživy
Veľmi časté: Hypoglykémia
Symptómy hypoglykémie sa obyčajne objavia náhle. Môžu zahŕňať studený pot, studená, bledá koža, únava, nervozita alebo triaška, úzkosť, neobvyklá únava alebo slabosť, zmätenosť, ťažkosti pri sústredení sa, ospalosť, pálčivý hlad, zmeny videnia, bolesť hlavy, nauzea a palpitácie.
Hypoglykémia sa môže stať závažnou a môže viesť k strate vedomia a/alebo kŕčom a môže vyústiť do
dočasného alebo trvalého poškodenia funkcie mozgu alebo dokonca smrti.
Poruchy kože a podkožného tkaniva
Časté: reakcie v mieste vpichu injekcie a lokálne hypersenzitívne reakcie.
Počas liečby inzulínom sa môžu vyskytnúť lokálne hypersenzitívne reakcie (sčervenenie, opuch
a svrbenie v mieste vpichu injekcie). Tieto reakcie bývajú obvykle prechodné a normálne vymiznú v priebehu ďalšej liečby.
Zriedkavé: Lipodystrofia
V mieste vpichu injekcie sa môže objaviť lipodystrofia ako dôsledok toho, že sa nestiredajú miesta vpichu injekcií v rámci danej oblasti.
Celkové poruchy
Menej časté: Systémové hypersenzitívne reakcie
Systémové hypersenzitívne reakcie môžu zahŕňať žihľavku, tlak na hrudníku, dyspnoe, alergickú dermatitídu a pruritus. Závažné prípady generalizovanej alergie, vrátane anafylaktickej reakcie, môžu ohrozovať život.
4.9 Predávkovanie
Hypoglykémia môže nastať následkom výrazného účinku inzulínu vo vzťahu k príjmu jedla a výdaju energie.
O predávkovaní inzulínom glulizínom nie sú k dispozícii žiadne špecifické údaje. Avšak v ďalších štádiách sa môže hypoglykémia rozvinúť:
Mierne príhody hypoglykémie sa môžu liečiť perorálnym podaním glukózy alebo výrobkov z cukru. Preto sa diabetickým pacientom odporúča neustále so sebou nosiť kockový cukor, sladkosti, sušienky alebo cukrom sladené džúsy.
Ťažké príhody hypoglykémie, kedy pacient stráca vedomie, možno liečiť glukagónom (0,5 až 1 mg) podaným intramuskulárne alebo subkutánne primerane vyškolenou osobou alebo glukózou podanou intravenózne odborníkom v medicíne. Glukóza sa musí podať intravenózne aj vtedy, ak pacient
v priebehu 10 až 15 minút neodpovedá na glukagón.
Po nadobudnutí vedomia sa pacientovi odporúča perorálne podávanie uhľovodíkov, ako prevencia relapsu.
Po injekcii glukagónu sa musí pacient monitorovať v nemocnici,aby sa zistila príčina tejto ťažkej hypoglykémie a aby sa predišlo ďalším podobným príhodám.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: inzulín a analógy, rýchlo pôsobiace. ATC kód: A10AB06
Inzulín glulizín je rekombinatný analóg ľudského inzulínu, ktorý je ekvipotentný bežnému ľudskému inzulínu. Inzulín glulizín má rýchlajší nástup účinku a kratšie trvanie účinku ako bežný ľudský inzulín.
Primárnym účinkom inzulínov a inzulínových analógov, vrátane inzulínu glulizínu, je regulácia metabolizmu glukózy. Inzulín znižuje hladiny glukózy v krvi stimuláciou periférnej absorpcie glukózy, najmä kostrovým svalstvom a tukovým tkanivom, a inhibíciou produkcie glukózy v pečeni. Inzulín inhibuje lipolýzu v adipocytoch, inhibuje proteolýzu a podporuje syntézu proteínov.
Štúdie u zdravých dobrovoľníkov a pacientov s diabetom ukázali, že inzulín glulizín má rýchlejší nástup účinku a kratšie trvanie účinku, ako bežný ľudský inulín podávaný subkutánne. Ak sa inzulín glulizín podáva subkutánne, začína sa jeho pôsobenie na zníženie hladiny glukózy v krvi v priebehu
10 – 20 minút. Ak sa inzulín glulizín a bežný ľudský inzulín podávajú intravenózne, ich účinok na zníženie hladiny glukózy v krvi je ekvipotentný. Jedna jednotka inzulínu glulizínu má rovnaký účinok na zníženie hladiny glukózy v krvi ako jedna jednotka bežného ľudského inzulínu.
Úmernosť vo vzťahu k dávke
V štúdii, v ktorej sa zúčastnilo 18 pacientov mužského pohlavia s diabetes mellitus typu 1 vo veku od
21 do 50 rokov, sa prejavil účinok na zníženie hladiny glukózy v krvi úmerný dávke v terapeuticky relevantnom rozsahu dávok 0,075 až 0,15 U/kg, a menej ako úmerné zvýšenie účinku na zníženie hladiny glukózy v krvi pri dávke 0,3 U/kg alebo väčšej, podobne ako u ľudského inzulínu.
Inzulín glulizín účinkuje približne dvakrát tak rýchlo ako bežný ľudský inzulín a dosahuje účinok na zníženie hladiny glukózy v krvi približne o 2 hodiny skôr ako bežný ľudský inzulín.
Štúdia fázy I u pacientov s diabetes mellitus typu 1 hodnotila účinok na zníženie hladiny glukózy u inzulínu glulizínu a bežného ľudského inzulínu podávaných subkutánne v dávke 0,15 U/kg
v rozličnom časovom vzťahu ku štandardnému 15-minútovému jedlu. Údaje ukazujú, že inzulín
glulizín podávaný 2 minúty pred jedlom poskytuje podobnú postprandiálnu glykemickú kontrolou ako
Obrázok 2: Rýchlosť infúzie glukózy po subkutánnej injekcii 0,3 U/kg inzulínu glulizínu (GLULIZÍN)
alebo inzulínu lispro (LISPRO) alebo bežného ľudského inzulínu (BEŽNÝ) u obéznej populácie.
Ďalšia štúdia fázy I s inzulínom glulizínom a inzulínom lispro v populácii nediabetikov, v ktorej sa zúčastnilo 80 jedincov so širokým rozsahom body mass indexu (18-46 kg/m²) ukázala, že rýchly účinok je v širokom rozsahu body mass indexu vo všeobecnosti zachovaný, zatiaľ čo celkový účinok na zníženie hladiny glukózy v krvi klesá súčasne so stúpajúcou obezitou.
Priemerná celková AUC rýchlosti využitia glukózy v intervale 0–1 hodina bola v prípade inzulínu glulizínu 102±75 mg/kg pri dávke 0,2 U/kg a 158±100 mg/kg pri dávke 0,4 U/kg a v prípade inzulínu lispro 83,1±72,8 mg/kg pri dávke 0,2 U/kg a 112,3±70,8 mg/kg pri dávke 0,4 U/kg.
Štúdia fázy I u 18 obéznych pacientov s diabetom mellitus 2.typu (BMI medzi 35 a 40 kg/m2) s inzulínom glulizínom a inzulínom lispro [90% CI:0,81, 0,95 (p=<0,01)] ukázala, že inzulín glulizín efektívne kontroluje denné rozdiely postprandiálnej hladiny glukózy v krvi.
Klinické štúdie
Daibetes mellitus1.typu
V 26 týždňovej klinickej štúdii fázy III porovnávajúcej inzulín glulizín s inzulínom lispro, oba podávané subkutánne, krátko (0-15 minút) pred jedlom u pacientov s diabetes mellitus 1.typu za použitia inzulínu glargínu ako bazálneho inzulínu, bol inzulín glulizín v glykemickej kontrole porovnateľný s inzulínom lispro, čo sa odrazilo v zmenách glykovaného hemoglobínu (vyjadreného ako HbA1c ekvivalent) z východiskových hodnôt po koncový bod. Boli pozorované porovnateľné hodnoty self-monitorovanej krvnej glukózy. V kontraste s inzulínom lispro nebolo pri inzulíne glulizíne potrebné zvýšenie dávky bazálneho inzulínu.
V 12 týždňovej klinickej štúdii fázy III, ktorá sa uskutočnila u pacientov s diabetes mellitus 1.typu dostávajúcich inzulín glargín ako bazálnu terapiu, ukázala, že účinnosť podania inzulínu glulizínu bezprostredne po jedle je porovnateľná s účinnosťou podania inzulínu glulizínu bezprostredne pred jedlom (0-15 minút) alebo bežného inzulínu (30-45 minút).
U zaprotokolovanej populácie bolo pozorované signifikatne vyššie zníženie glykovaného hemoglobínu v skupine s inzulínom glulizínom podaným pred jedlom v porovnaní so skupinou s bežným inzulínom.
Diabetes mellitus 2.typu
26-týždňová klinická štúdia fázy III, po ktorej nasledovala 26-týždňová štúdia rozšírenej bezpečnosti,sa uskutočnila pre porovnanie inzulínu glulizínu (0-15 minút pred jedlom) s bežným ľudským inzulínom (30-45 minút pred jedlom) oboma podanými subkutánne u pacientov s diabetes mellitus 2.typu, pričom niektorí užívali ešte ako bazálny inzulín NPH inzulín. Priemerný BMI index pacientov bol 34,55 kg/m2. Čo sa týka zmien glykovaného hemoglobínu (vyjadreného ako ekvivalent HbA1c) z počiatočnej hodnoty k 6-mesačnej konečnej hodnote (-0,46% pre inzulín glulizín a –0,30% pre bežný ľudský inzulín, p=0,0029) a počiatočnej hodnoty na 12-mesačnú konečnú hodnotu (-0,23% pre inzulín glulizín a –0,13% pre bežný ľudský inzulín, rozdiel nie je výrazný, sa inzulín glulizín ukázal ako porovnateľný s bežným ľudským inzulínom.. V tejto štúdii si väčšina pacientov (79%) miešala tesne pred podaním injekcie krátko účinkujúci inzulín s inzulínom NPH a 58% pacientov užívalo perorálne antidiabetiká v čase randomizácie, pričom boli inštruovaní, aby v ich užívaní pokračovali v rovnakom dávkovaní.
Rasa a pohlavie
V kontrolovaných klinických štúdiách u dospelých nevykazoval inzulín glulizín rozdiely v bezpečnosti a účinnosti v podskupinových analýzach založených na rase a pohlaví.
5.2 Farmakokinetické vlastnosti
Nahradenie aminokyseliny asparagínu v pozícii B3 lyzínom a lyzínu v pozícii B29 kyselinou glutámovou v ľudskom inzulíne určuje rýchlejšiu absorpciu inzulínu glulizínu.
V štúdii, v ktorej sa zúčastnilo 18 pacientov mužského pohlavia s diabetes mellitus typu 1 vo veku od
21 do 50 rokov, sa prejavil účinok inzulínu glulizínu ako úmerný dávke pri skorej, maximálnej a celkovej expozícii v rozsahu dávok 0,075 až 0,4 U/kg,
Absorpcia a biologická dostupnosťFarmakokinetické profily u zdravých dobrovoľníkov a diabetických pacientov (1. alebo 2.typu)
ukázali, že v porovnaní s bežným ľudským inzulínom je absorpcia inzulínu glulizínu asi dvakrát rýchlejšia a jeho vrcholová koncentrácia je približne dvakrát vyššia.
V štúdii u pacientov s diabetes mellitus 1.typu boli po subkutánnom podaní 0,15 U/kg hodnoty tmax
55 minút a Cmax 82 ±1,3 μU/ml pre inzulín glulizín a tmax 82 minút a Cmax 46 ±1,3 μU/ml pre bežný
ľudský inzulín. Priemerný reziduálny čas inzulínu glulizínu bol kratší (98 minút) ako u bežného
ľudského inzulínu (161 minút) (pozri obrázok 3).


GLULIZÍN










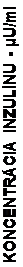 80
80 BEŽNÝ
 60
60

 40
40 200
200 0 1 2 3 4 5 6ČAS - hodina
0 1 2 3 4 5 6ČAS - hodinaObrázok 3: Farmakokinetický profil inzulínu glulizínu a bežného ľudského inzulínu u pacientov s diabetes mellitus 1.typu po dávke 0,15 U/kg.
V štúdii s pacientmi s diabetes mellitus 2.typu po subkutánnom podaní 0,2 U/kg inzulínu glulizínu, Cmax bol 91 μU/ml s interkvartilným rozsahom od 78 do 104 μU/ml.
Keď bol inzulín glulizín injikovaný subkutánne do brucha, deltoidu a ramena, boli časovokoncentračné profily podobné s trošku rýchlejšou absorpciou pri podaní do brucha v porovnaní s ramenom. Absorpcia z miesta v deltoide bola medzi týmito hodnotami (pozri časť 4.2). Absolútna biologická dostupnosť (70%) inzulínu glulizínu bola podobná pre všetky injekčné oblasti s nízkou vnútornou internou variabilitou (11% CV).
Obezita
Ďalšia štúdia fázy I s inzulínom glulizínom a inzulínom lispro v populácii nediabetikov, v ktorej sa zúčastnilo 80 jedincov so širokým rozsahom body mass indexu (18-46 kg/m2) preukázala, že rýchla absorpcia a celková expozícia zostáva v širokom rozsahu body mass indexu vo všeobecnosti zachovaná.
S inzulínom glulizínom sa dosiahol čas do 10% celkovej INS expozície približne o 5-6 minút skôr.
Distribúcia a eliminácia
Distribúcia a eliminácia inzulínu glulizínu a bežného ľudského inzulínu je po intravenóznom podaní
podobná, distribučné objemy sú 13 l resp. 22 l a polčasy sú 13 resp. 18 minút.
Po subkutánnom podaní sa inzulín glulizín eliminuje rýchlejšie ako bežný ľudský inzulín, zdanlivý polčas je 42 minút v porovnaní s 86 minútami. V skríženej analytickej štúdii inzulínu glulizínu buď u zdravých dobrovoľníkov alebo jedincov s diabetes mellitus 1. alebo 2.typu bol zdanlivý polčas
v rozsahu 37 až 75 minút (interkvartilný rozsah).
Inzulín glulizín má podobne ako ľudský inzulín nízku väzbovosť na plazmové proteíny. Špeciálne skupiny pacientov
Zhoršená funkcia obličiek
V klinickej štúdii u nediabetických jedincov zahrňujúcich širokú škálu renálnej funkcie
(CrCl >80 ml/min, 30-50 ml/min, <30 ml/min), boli rýchlo pôsobiace vlastnosti inzulínu glulizínu vo všeobecnosti zachované. Avšak nároky na inzulín pri zhoršenej funkcii obličiek môžu byť znížené.
Zhoršená funkcia pečene
Farmakokinetické vlastnosti u pacientov so zhoršenou funkciou pečene sa neskúmali.
Starší pacienti
U starších pacientov s diabetes mellitus sú k dispozícii veľmi obmedzené farmakokinetické údaje..
Deti a dospievajúci
Farmakokinetické a farmakodynamické vlastnosti inzulínu glulizínu sa skúmali u detí (7-11 rokov)
a adolescentov (12-16 rokov) s diabetes mellitus 1.typu. Inzulín glulizín sa rýchlo absorboval
u obidvoch vekových skupín, s podobným tmax a Cmax ako u dospelých (pozri časť 4.2). Ak sa inzulín gulizín podal bezprostredne pred jedlom, ukázal lepšiu postprandiálnu kontrolu, ako bežný ľudský inzulín, ako u dospelých (pozri časť 5.1). Glukózový rozdiel (AUC0-6h) bol 641 mg.h.dl-1 pre inzulín glulizín a 801 mg.h.dl-1 pre bežný ľudský inzulín.
5.3 Predklinické údaje o bezpečnosti
Predklinické štúdie neodhalili iné toxické nálezy než tie, ktoré sa spájajú s farmakodynamickou aktivitou znižujúcou glukózu (hypoglykémia), ktoré by boli odlišné od bežného ľudského inzulínu alebo nálezy klinicky závažné pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
metakrezol chlorid sodný trometamol polysorbát 20
kyselina chlorovodíková, koncentrovaná hydroxid sodný
voda na injekciu
6.2 Inkompatibility
Pri absencii štúdií kompatibility sa inzulín glulizín nesmie miešať s inými liekmi s výnimkou NPH
ľudského inzulínu.
6.3 Čas použiteľnosti
2 roky.
Čas použiteľnosti po prvom použití: liek sa môže uchovávať maximálne 4 týždne pri teplote neprevyšujúcej 25°C. Neuchovávajte v chladničke.
Uchovávajte pero tak, aby bolo chránené pred svetlom.
6.4 Špeciálne upozornenia na uchovávanie
Neotvorené
Uchovávajte v chladničke (2°C - 8°C). Uchovávajte naplnené pero vo vonkajšom obale na ochranu pred svetlom. Neuchovávajte v mrazničke. Zabezpečte, aby sa obal priamo nedotýkal výparníka alebo zmrazených balení.
Pred prvým použitím sa musí pero uchovávať 1 až 2 hodiny pri izbovej teplote. Podmienky pri používaní
Upozornenia na uchovávanie pozri časť 6.3.
6.5 Druh obalu a obsah balenia
3 ml injekčného roztoku v náplni (bezfarebné sklo) s piestom (guma z elastoméru) a obrubou (zapečatenou hliníkom) so zátkou (guma z elastoméru). Náplň je zaplombovaná v jednorazovom naplnenom pere. Sú dostupné balenia po 1, 3, 4, 5, 6, 8, 9 a 10 pier.
Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred použitím si náplň prezrite. Použitá môže byť len vtedy, ak je roztok číry, bezfarebný
a neobsahuje viditeľné tuhé častice a ak má konzistenciu podobnú ako voda. Keďže Apidra je roztok, nevyžaduje sa pred použitím resuspenzácia.
Prázdne perá sa nikdy nesmú používať a musia byť vhodným spôsobom zlikvidované.
Aby sa zabránilo akejkoľvek kontaminácii, musí sa prísne dodržiavať pravidlo, že to isté pero používa vždy len jeden pacient.
Zaobchádzanie s perom
Pred použitím SoloStaru si musí pacient dôkladne prečítať návod na používanie v písomnej informácii pre používateľov.
Uzáver pera Ihla pera (v pere nezahrnutá)
Ochranné tesnenie
Inzulínový zásobník
Telo pera
Ukazovateľ
dávky
Vonkajší
kryt ihly
Vnútorný
kryt hly

Ihla
Gumené tesnenie
Prepínač
dávky
Injekčné
tlačidlo
Schematický nákres pera
Dôležité informácie pre používanie SoloStaru:
Pred každým použitím sa musí dôkladne upevniť nová ihla a musí sa urobiť skúška bezpečnosti. Používajte len ihly, ktoré sú vhodné na používanie so SoloStarom.
Vyžaduje sa špeciálna opatrnosť, aby sa predišlo neočakávaným poraneniam ihlou a prenosu infekcie. Nikdy nepoužívajte SosloStar, ak je poškodený, alebo ak si nie ste istý, či funguje správne.
Vždy noste so sebou náhradný SoloStar pre prípad, že jeden stratíte alebo sa poškodí.
Pokyny pre uchovávanie
Pozrite si, prosím, časť 6.4, kde sú uvedené pokyny ako uchovávať SoloStar.
Ak sa SoloStar uchováva na chladnom mieste, musí sa odtiaľ vziať 1 až 2 hodiny pred podaním injekcie, aby sa oteplilo. Injikovanie chladného inzulínu je bolestivejšie.
Použitý SoloStar sa musí zlikvidovať v súlade s miestnymi požiadavkami.
Udržiavanie
SoloStar je nutné chrániť pred prachom a znečistením. Vonkajší povrch SoloStaru možno čistiť vlhkou handričkou.
Pero nenamáčajte, neumývajte ani nemastite, môže sa tým poškodiť.
SoloStar je navrhnutý tak, aby sa s ním pracovalo presne a bezpečne. Musí sa s ním zaobchádzať starostlivo.Je nutné zabrániť takým situáciám, kedy by sa mohlo poškodiť. Ak sa obávate, že pero môže byť poškodené, použite nové pero.
Krok 1 Skontrolujte inzulín
Musí sa skontrolovať štítok na pere, aby bolo isté, že obsahuje správny inzulín. Apidra SoloStar je modrej farby. Má tmavomodré injekčné tlačidlo so zvýrazneným kruhom na konci. Po odstránení uzáveru pera sa musí taktiež skontrolovať vzhľad inzulínu: roztok inzulínu musí byť číry, bezfarebný a nesmú v ňom byť viditeľné tuhé častice a musí mať konzistenciu podobnú ako voda.
Krok 2 Upevnenie ihly
Smú sa používať len ihly, ktoré sú vhodné na používanie so SoloStarom.
Na každú injekciu sa vždy musí použiť nová sterilná ihla. Po odstránení uzáveru pera sa musí ihla dôkladne nasadiť priamo na pero.
Krok 3 Skúška bezpečnosti
Pred každou injekciou sa musí urobiť skúška bezpečnosti. Nastavte dávku 2.
Vonkajší a vnútorný kryt ihly sa musí odstrániť.
Držte pero tak, aby ihla smerovala nahor, súčasne jemne poklepávajte prstom na inzulínový zásobník tak, aby sa všetky vzduchové bubliny dostali k ihle.
Potom sa musí úplne zatlačiť injekčné tlačidlo dovnútra.
Ak vystrekne inzulín cez hrot ihly, znamená to, že pero a ihla fungujú správne.
Ak sa na hrote ihly neobjaví žiadny inzulín, bod 3 sa musí opakovať dovtedy, kým sa inzulín na hrote ihly neobjaví.
Krok 4 Nastavenie dávky
Dávku možno nastaviť v krokoch po 1 jednotke, od minimálnej hodnoty 1 jednotka až po maximálnu hodnotu 80 jednotiek. Ak sa vyžaduje dávka vyššia ako 80 jednotiek, musí sa podať v dvoch alebo viacerých injekciách.
Ukazovateľ dávky musí po vykonaní skúšky bezpečnosti ukazovať „0“. Potom možno nastaviť dávku.
Krok 5 Podanie dávky
Pacient musí byť informovaný o injekčnej technike svojím odborníkom na liečbu cukrovky. Ihla sa musí vpichnúť do kože.
Injekčné tlačidlo sa musí úplne zatlačiť. Potom sa injekčné tlačidlo musí držať zatlačené 10 sekúnd
pred vytiahnutím ihly. Tým sa zabezpečí, že bude podaná celá dávka inzulínu.
Krok 6 Odstránenie a likvidácia ihly
Po každej injekcii sa musí ihla odstrániť a zlikvidovať. Pomáha to zabrániť kontaminácii a/alebo infekcii, nasatiu vzduchu do zásobníka inzulínu a úniku inzulínu. Ihly sa nesmú používať opakovane. Pri odstraňovaní a likvidácii ihly sa vyžaduje špeciálna opatrnosť. Dodržiavajte odporúčané bezpečnostné pokyny pre odstraňovanie a likvidáciu ihiel (napr. bezpečná uzatváracia technika
s použitím jednej ruky), aby sa znížilo riziko neočakávaných poranení ihlou a prenosu infekčných ochorení.
Na pero sa musí opäť nasadiť uzáver.
Miešanie s inzulínmi
Pri miešaní s NPH ľudským inzulínom sa musí Apidra natiahnuť do injekčnej striekačky ako prvá. Injekcia sa musí podať okamžite po zmiešaní, keďže nie sú dostupné žiadne údaje o zmesiach urobených signifikantne skôr pred podaním injekcie.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Sanofi-Aventis Deutschland GmbH, Brueningstrasse 50, D-65926 Frankfurt am Main, Nemecko.
8. REGISTRAČNÉ ČÍSLO
EU/1/04/285/029-036
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 27. september 2004
10. DÁTUM REVÍZIE TEXTU