
FSTYLA sa môže používať u pacientov všetkých vekových skupín.
2. Čo potrebujete vedieť predtým, ako použijete AFSTYLU Nepoužívajte AFSTYLU
• ak ste v minulosti mali alergickú reakciu na AFSTYLU, na ktorúkoľvek zo zložiek alebo
pomocných látok (uvedených v časti 6).
• ak ste alergický na bielkoviny škrečka.
U
pozornenia a opatrenia
Predtým, ako začnete používať AFSTYLU, obráťte sa na svojho lekára, lekárnika alebo zdravotnú
sestru.
• Môžu sa vyskytnúť alergické reakcie (precitlivenosť). Liek obsahuje bielkoviny škrečka (pozri tiež časť „Nepoužívajte AFSTYLU“). Ak sa vyskytnú príznaky alergických reakcií, ihneď prerušte používanie lieku a kontaktuje svojho lekára. Lekár vás má informovať o prvotných prejavoch alergických reakcií. Patrí medzi ne žihľavka, generalizovaná kožná vyrážka, pocit tiesne na hrudníku, sipot, nízky krvný tlak a anafylaxia (ťažká alergická reakcia, ktorá spôsobuje vážne problémy s dýchaním a závrat).
• Tvorba inhibítorov (neutralizačných protilátok) je známou komplikáciou, ktorá sa môže vyskytnúť počas liečby a zastaviť správny priebeh liečby. Ak krvácanie nie je AFSTYLOU regulované, ihneď to povedzte svojmu lekárovi. Musíte byť starostlivo sledovaný z dôvodu tvorby inhibítorov.
• Ak vás informovali, že máte ochorenie srdca alebo ste vystavený riziku ochorenia srdca, informujte o tom svojho lekára alebo lekárnika.
• Ak na podanie AFSTYLY budete potrebovať zariadenie na centrálny žilový prístup (CVAD),
váš lekár má zvážiť riziko komplikácií vrátane lokálnych infekcií, baktérií v krvi (bakteriémia) a vytvorenia krvnej zrazeniny v cieve (trombóza) v mieste zavedenia katétra.
Záznam o použití
Dôrazne sa odporúča, aby ste pri každom podaní AFSTYLY zaznamenali čas podania, číslo šarže
a podaný objem do denníka liečby.
Iné lieky a AFSTYLA
Ak teraz užívate, alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to
svojmu lekárovi alebo lekárnikovi.
Tehotenstvo a dojčenie
• Ak ste tehotná alebo dojčíte, ak si myslíte, že ste tehotná alebo ak plánujete otehotnieť, poraďte
sa so svojím lekárom alebo lekárnikom predtým, ako začnete užívať tento liek.
• Počas tehotenstva a dojčenia sa AFSTYLA môže podávať, len ak je to nevyhnutne potrebné.
Vedenie vozidiel a obsluha strojov
AFSTYLA nemá vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
AFSTYLA obsahuje sodík
AFSTYLA obsahuje až 7 mg (0,3 mmol) sodíka na ml po rekonštitúcii.
V závislosti od vašej telesnej hmotnosti a dávky AFSTYLY však môžete dostať viac ako jednu injekčnú liekovku. To sa má vziať do úvahy, ak ste na diéte s kontrolovaným príjmom sodíka.
3. Ako používať AFSTYLU
Vašu liečbu má viesť lekár, ktorý má skúsenosti s liečbou porúch krvnej zrážanlivosti.
Vždy užívajte tento liek presne tak, ako vám povedal váš lekár. Ak si nie ste niečím istý, overte si to
u svojho lekára.
Dávka
Množstvo AFSTYLY, ktoré potrebujete dostať, a dĺžka liečby závisia od:
• závažnosti vašej choroby
• miesta a intenzity krvácania
• vášho klinického stavu a odpovede
• vašej telesnej hmotnosti
Postupujte podľa pokynov, ktoré vám dal váš lekár.
Rekonštitúcia a podávanieVšeobecné pokyny• Prášok sa musí rozpustiť v rozpúšťadle (tekutine) a natiahnuť z injekčnej liekovky za
aseptických podmienok.
• AFSTYLA sa nesmie miešať s inými liekmi alebo rozpúšťadlami okrem tých, ktoré sú uvedené v časti 6.
• Roztok má byť číry alebo slabo opalescentný, žltý až bezfarebný, to znamená, že môže drobnými čiastočkami rozptýliť svetlo, ale nesmie obsahovať žiadne viditeľné častice. Po filtrácii alebo natiahnutí (pozri ďalej) sa má roztok pred použitím vizuálne skontrolovať. Nepoužívajte roztok, ak je viditeľne zakalený alebo obsahuje vločky alebo častice.
• Všetok nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými
požiadavkami.
Rekonštitúcia a podávanieZohrejte neotvorené injekčné liekovky s práškom AFSTYLY a tekutinou na izbovú teplotu alebo
teplotu tela. Toto môžete urobiť buď ponechaním injekčných liekoviek pri izbovej teplote približne
1 hodinu, alebo podržaním injekčných liekoviek v rukách na niekoľko minút.
Nevystavujte priamemu zdroju tepla. Injekčné liekovky sa nesmú zohriať na teplotu prevyšujúcu teplotu ľudského tela (37 °C).
Opatrne odstráňte ochranné viečka z injekčných liekoviek a očistite odkryté gumové zátky tampónom namočeným v alkohole. Pred otvorením Mix2Vial (balenie pomôcky) nechajte injekčné liekovky uschnúť, potom postupujte podľa pokynov nižšie.
1. Otvorte Mix2Vial odlepením viečka.
Nevyberajte súpravu Mix2Vial z blistra!
1
2. Umiestnite
injekčnú liekovku s rozpúšťadlom na rovný a čistý povrch a pevne ju držte. Uchopte Mix2Vial spolu s blistrom a zatlačte hrot na konci
modrého adaptéra
rovno nadol cez zátku injekčnej liekovky s rozpúšťadlom.
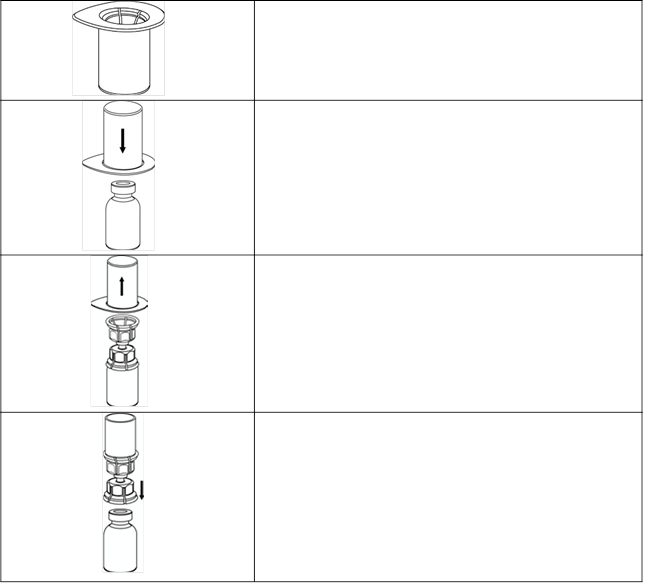
2
3. Opatrne odstráňte blister zo súpravy Mix2Vial podržaním za okraj a potiahnutím
zvislo nahor. Dbajte na to, aby ste vytiahli iba blistrový obal a nie súpravu Mix2Vial.
3
4. Umiestnite
injekčnú liekovku s práškom na rovný a pevný povrch. Injekčnú liekovku s rozpúšťadlom a pripojenou súpravou Mix2Vial otočte hore dnom a zatlačte hrot na konci
priesvitného adaptéra
rovno nadol cez zátku injekčnej liekovky s práškom. Rozpúšťadlo bude automaticky pretekať do injekčnej
4 liekovky s práškom.
5. Jednou rukou uchopte časť súpravy Mix2Vial s liekom. Druhou rukou uchopte časť súpravy s rozpúšťadlom a opatrne odskrutkujte súpravu proti smeru hodinových ručičiek na dve časti. Injekčnú liekovku s rozpúšťadlom a nasadeným modrým adaptérom Mix2Vial zlikvidujte.
5
6. Jemne premiešajte injekčnú liekovku s liekom s nasadeným priesvitným adaptérom, až kým sa prášok úplne nerozpustí. Nepretrepávajte.

6
7. Natiahnite vzduch do prázdnej sterilnej injekčnej striekačky. Injekčnú liekovku s liekom držte zvislo a ku konektoru Luer Lock súpravy Mix2Vial pripojte injekčnú striekačku otáčaním v smere hodinových ručičiek. Vstreknite vzduch do injekčnej liekovky s liekom.
7
Natiahnutie a podávanie8. Počas držania stlačeného piestu striekačky
prevráťte súpravu hore dnom a natiahnite roztok do injekčnej striekačky pomalým
spätným vyťahovaním piestu.

8
9. Teraz sa roztok premiestnil do injekčnej striekačky. Pevne uchopte telo injekčnej striekačky (piest smeruje smerom nadol) a odpojte priesvitný adaptér Mix2Vial od injekčnej striekačky odskrutkovaním proti smeru hodinových ručičiek.
9
Pomocou súpravy na venepunkciu dodávanej spolu s liekom zaveďte ihlu do žily. Nechajte pretekať
krv späť na koniec hadičky. Pripojte injekčnú striekačku so závitom na uzavretý koniec venepunkčnej súpravy.
Rekonštituovaný roztok podávajte pomaly (ako vám je pohodlné, maximálne 10 ml/min) do žily podľa pokynov, ktoré vám dal váš lekár. Dávajte pozor, aby sa do injekčnej striekačky obsahujúcej liek nedostala žiadna krv.
Pozorujte sa, či sa u vás nevyskytnú akékoľvek nežiaduce účinky, ktoré sa môžu objaviť hneď. Ak sa u vás vyskytnú akékoľvek vedľajšie účinky, ktoré môžu súvisieť s podaním AFSTYLY, injekciu musíte prerušiť (pozri tiež časť 2).
P
oužitie u detí a dospievajúcich
AFSTYLA sa môže používať u detí a dospievajúcich všetkých vekových kategórií. U detí mladších
ako 12 rokov sa môžu požadovať vyššie dávky alebo častejšie injekcie. Deti nad 12 rokov môžu
používať rovnaké dávky ako dospelí.
Ak použijete viac AFSTYLY, ako máte
Ak ste si podali viac AFSTYLY ako máte, informujte svojho lekára.
Ak zabudnete použiť AFSTYLU
Neužívajte dvojnásobnú dávku, aby ste nahradili vynechanú dávku. Pokračujte okamžite s ďalšou dávkou, a potom pokračujte podľa pokynov vášho lekára alebo lekárnika.
Ak prestanete používať AFSTYLU
Ak prestanete používať AFSTYLU, nemusíte byť chránený proti krvácaniu alebo aktuálne krvácanie
sa nemusí zastaviť. Neprestávajte používať AFSTYLU bez toho, aby ste sa o tom poradili so svojím lekárom.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára, lekárnika alebo zdravotnej sestry.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj AFSTYLA môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Prosím, ihneď zastavte podávanie lieku a kontaktujte svojho lekára ak:
• spozorujete príznaky alergických reakcií
Alergické reakcie môžu mať nasledujúce príznaky: žihľavka, generalizovaná žihľavka (svrbivá
vyrážka), pocit tlaku na hrudi, ťažkosti s dýchaním, sipot, nízky krvný tlak, závrat a anafylaxia.
Ak k tomu dôjde, ihneď zastavte podávanie lieku a kontaktujte svojho lekára.
• ak spozorujete, že liek prestane správne účinkovať (krvácanie sa nezastaví)
Môže sa u vás vytvoriť inhibítor (neutralizačná protilátka) proti faktoru VIII a v takomto prípade faktor VIII nebude viac správne fungovať. Ak k tomu dôjde, ihneď zastavte podávanie lieku a kontaktujte svojho lekára. Takéto reakcie sa v dokončených klinických skúšaniach
u predtým liečených pacientov s AFSTYLOU nepozorovali.
Časté vedľajšie účinky (môžu postihovať menej ako 1 z 10 používateľov)
• alergická reakcia
• závrat
• pocit mravčenia a zníženej citlivosti (parestézia)
• vyrážky
• horúčka
Menej časté vedľajšie účinky (môžu postihovať menej ako 1 zo 100 používateľov)
• svrbenie
• sčervenanie kože
• bolesť v mieste vpichu
• zimnica
• návaly tepla
Vedľajšie účinky u detí a dospievajúcich
Neboli pozorované žiadne rozdiely v nežiaducich účinkoch u detí, dospievajúcich a dospelých pacientov.
Hlásenie vedľajších účinkov

Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené
v
prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti
tohto lieku.
5. Ako uchovávať AFSTYLU• Tento liek uchovávajte mimo dohľadu a dosahu detí.
• Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a škatuľke.
• Uchovávajte v chladničke (2 °C – 8 °C).
• Pred rekonštitúciou prášku s AFSTYLOU sa liek môže uchovávať pri izbovej teplote do 25 °C počas obdobia nepresahujúceho 3 mesiace do dátumu exspirácie vyznačenom na škatuľkách a injekčných liekovkách. Na škatuľku lieku zaznamenajte dátum, kedy ste začali uchovávať AFSTYLU pri izbovej teplote.
• Ak liek vyberiete z chladničky, nesmiete ho vrátiť späť do chladničky.
• Neuchovávajte v mrazničke.
• Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
• Rekonštituovaný liek je najvhodnejšie použiť ihneď.
• Ak sa liek nepoužije ihneď, za čas a podmienky uchovávania pred použitím zodpovedá používateľ.
6. Obsah balenia a ďalšie informácieČo AFSTYLA obsahujeLiečivoje:250 IU na injekčnú liekovku; po rekonštitúcii s 2,5 ml vody na injekciu roztok obsahuje 100 IU/ml
lonoktokogu alfa.
500 IU na injekčnú liekovku; po rekonštitúcii s 2,5 ml vody na injekciu roztok obsahuje 200 IU/ml
lonoktokogu alfa.
1000 IU na injekčnú liekovku; po rekonštitúcii s 2,5 ml vody na injekciu roztok obsahuje 400 IU/ml
lonoktokogu alfa.
1500 IU na injekčnú liekovku; po rekonštitúcii s 5 ml vody na injekciu roztok obsahuje 300 IU/ml lonoktokogu alfa.
2000 IU na injekčnú liekovku; po rekonštitúcii s 5 ml vody na injekciu roztok obsahuje 400 IU/ml
lonoktokogu alfa.
2500 IU na injekčnú liekovku; po rekonštitúcii s 5 ml vody na injekciu roztok obsahuje 500 IU/ml lonoktokogu alfa.
3000 IU na injekčnú liekovku; po rekonštitúcii s 5 ml vody na injekciu roztok obsahuje 600 IU/ml lonoktokogu alfa.
Ďalšiezložkysú:L-histidín, polysorbát 80, dihydrát chloridu vápenatého, chlorid sodný (pozri posledný odsek časti
2.), sacharóza.
Rozpúšťadlo: Voda na injekciu.
Ako vyzerá AFSTYLA a obsah baleniaAFSTYLA sa dodáva ako biely až svetložltý prášok alebo drobivá hmota a číry a bezfarebný injekčný roztok.
Rekonštituovaný roztok má byť číry alebo slabo opalescentný, žltý až bezfarebný, to znamená, že
môže drobnými čiastočkami rozptýliť svetlo, ale nesmie obsahovať žiadne viditeľné častice.
V
eľkosť
balenia
Jedno balenie s 250, 500 alebo 1000 IU obsahuje:
1 injekčná liekovka s práškom
1 injekčná liekovka s 2,5 ml vody na injekciu
Jedna aplikačná súprava obsahuje:
1 filtračná prenosová súprava 20/20
1 jednorazová 5 ml injekčná striekačka
1 súprava na podanie do žily
2 alkoholové tampóny
1 nesterilná náplasť
Jedno balenie s 1500, 2000, 2500 alebo 3000 IU obsahuje:
1 injekčná liekovka s práškom
1 injekčná liekovka s 5 ml vody na injekciu
Jedna aplikačná súprava obsahuje:
1 filtračná prenosová súprava 20/20
1 jednorazová 10 ml injekčná striekačka
1 súprava na podanie do žily
2 alkoholové tampóny
1 nesterilná náplasť
Vnútorný obal
250 IU Sklenená injekčná liekovka s gumovou zátkou, oranžovým plastovým diskom a hliníkovým uzáverom so zelenými prúžkami.
500 IU Sklenená injekčná liekovka s gumovou zátkou, modrým plastovým diskom a hliníkovým uzáverom so zelenými prúžkami.
1000 IU Sklenená injekčná liekovka s gumovou zátkou, zeleným plastovým diskom a hliníkovým uzáverom so zelenými prúžkami.
1500 IU Sklenená injekčná liekovka s gumovou zátkou, tyrkysovým plastovým diskom a hliníkovým uzáverom so zelenými prúžkami.
2000 IU Sklenená injekčná liekovka s gumovou zátkou, purpurovým plastovým diskom a hliníkovým uzáverom so zelenými prúžkami.
2500 IU Sklenená injekčná liekovka s gumovou zátkou, svetlo šedým plastovým diskom a hliníkovým uzáverom so zelenými prúžkami.
3000 IU Sklenená injekčná liekovka s gumovou zátkou, žltým plastovým diskom a hliníkovým uzáverom so zelenými prúžkami.
Držiteľ rozhodnutia o registrácii a výrobca
CSL Behring GmbH Emil-von-Behring-Str.
35041 Marburg
Nemecko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte miestneho zástupcu držiteľa
rozhodnutia o registrácii:
B
e
l
gië/Belgique/Belgien
CSL Behring NV
Tél/Tel: +32 15 28 89 20
Lietuva
CSL Behring GmbH
Tel: +49 69 30584437
 Б
ъл
гария
Б
ъл
гария
Новимед EООД
Тел: +359 2 850 8617
Luxembourg/LuxemburgCSL Behring NV Tél/Tel: +32 15 28 89 20
Č
eská republika
CSL Behring s.r.o.
Tel: + 420 702 137 233
Magyarország CSL Behring Kft. Tel.: +36 1 213 4290
D
anmark
CSL Behring AB
Tel: +46 8 544 966 70
Malta
AM Mangion Ltd.
Tel: +356 2397 6333
D
eutschland
CSL Behring GmbH Tel: +49 69 30584437
Nederland
CSL Behring BV
Tel: + 31 85 111 96 00
E
esti
CSL Behring GmbH
Tel: +49 69 30584437
Norge
CSL Behring AB
Tlf: +46 8 544 966 70
'
Ε
λλάδα
CSL Behring ΕΠΕ
Τηλ: +30 210 7255 660
Österreich
CSL Behring GmbH Tel: +43 1 80101 2463
E
spaña
CSL Behring S.A.
Tel: +34 933 67 1870
Polska
CSL Behring Sp.z o.o.
Tel: +48 22 213 22 65
F
rance
CSL Behring S.A.
Tél: + 33 –(0)-1 53 58 54 00
Portugal
CSL Behring Lda
Tel: +351 21 782 62 30
H
rvatska
PharmaSwiss d.o.o.
Tel: +385 (1) 631-1833
România
Prisum International Trading srl
Tel: +40 21 322 0171
Ireland
CSL Behring UK Ltd.
Tel: +44 1444 447405
Slovenija
MediSanus d.o.o.
Tel: +386 1 25 71 496
Ísland
CSL Behring AB
Sími: +46 8 544 966 70
Slovenská republika
CSL Behring s.r.o.
Tel: +421 911 653 862
Italia
CSL Behring S.p.A. Tel: +39 02 34964 200
Suomi/Finland
CSL Behring AB
Puh/Tel: +46 8 544 966 70
Κύ
π
ρος
CSL Behring ΕΠΕ
Τηλ: +30 210 7255 660
Sverige
CSL Behring AB
Tel: +46 8 544 966 70
L
atvija
CSL Behring GmbH Tel: +49 69 30584437
United Kingdom
CSL Behring UK Ltd. Tel: +44 1444 447405
T
áto písomná informácia bola naposledy aktualizovaná v {MM/RRRR}.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu.----------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:Doteraz neliečení pacientiBezpečnosť a účinnosť AFSTYLY u doteraz neliečených pacientov ešte nebola stanovená.
Nie sú dostupné žiadne údaje.
MonitorovanieliečbyV priebehu liečby sa odporúča robiť príslušné stanovenie hladín faktora VIII, aby sa určila veľkosť dávky, ktorá sa má podať, a frekvencia podávania opakovaných injekcií. Odpoveď
jednotlivých pacientov na faktor VIII sa môže líšiť, čím sa prejavia rôzne biologické polčasy
a zlepšenia. Dávku odvodenú od telesnej hmotnosti môže byť potrebné upraviť u podvyživených pacientov alebo u pacientov s nadváhou. Predovšetkým v prípade veľkých chirurgických zákrokov je nevyhnutné starostlivo sledovať substitučnú liečbu pomocou koagulačnej analýzy (aktivita faktora VIII v plazme).
Pri použití jednostupňového testu zrážania založeného na tromboplastínovom čase (aPTT) in vitro na stanovenie aktivity faktora VIII z krvných vzoriek pacientov môžu byť výsledky aktivity faktora VIII v plazme významne ovplyvnené typom činidla aPTT aj referenčným štandardom použitým v teste. Okrem toho sa môžu vyskytnúť významné rozdiely medzi výsledkami
získanými pomocou jednostupňového testu zrážania (aPTT) a chromogénneho testu podľa
Európskeho liekopisu (European Pharmacopoeia , Ph. Eur). Táto skutočnosť je dôležitá najmä vtedy, ak sa zmení laboratórium, ktoré test vykonáva, alebo sa zmenia činidlá použité v teste.
Aktivita faktora VIII v plazme sa má sledovať u pacientov liečených AFSTYLOU pomocou chromogénneho testu alebo jednostupňového testu zrážania na určovanie podávaných dávok a frekvencie opakovaných injekcií. Výsledok chromogénneho testu najpresnejšie odráža klinický hemostatický potenciál AFSTYLY a je uprednostňovaný. Výsledok jednostupňového testu zrážania podhodnocuje hladinu aktivity faktora VIII v porovnaní s výsledkom chromogénneho testu o približne 45 %. Pri použití jednostupňového testu zrážania na určenie hladiny aktivity faktora VIII u pacienta vynásobte výsledok konverzným faktorom 2.
DávkovanieDávka a dĺžka substitučnej liečby závisí od závažnosti nedostatku faktora VIII, od miesta a
rozsahu krvácania a od klinického stavu pacienta.
Počet jednotiek podávaného faktora VIII sa vyjadruje v medzinárodných jednotkách (International Units, IU), ktoré zodpovedajú štandardom Svetovej zdravotníckej organizácie (World Health Organization, WHO) pre lieky s obsahom faktora VIII. Aktivita faktora VIII v plazme sa
vyjadruje v percentách (v pomere k normálnej ľudskej plazme) alebo prednostne
v medzinárodných jednotkách (v pomere k medzinárodným štandardom pre faktor VIII v plazme).
Jedna medzinárodná jednotka (IU) aktivity faktora VIII zodpovedá množstvu faktora VIII
v jednom ml normálnej ľudskej plazmy.
Účinnosť sa stanovuje chromogénnym substrátovým testom.
Hladiny faktora VIII v plazme možno sledovať pomocou chromogénneho substrátového testu alebo jednostupňového testu zrážania.
Liečba podľa potrebyVýpočet požadovanej dávky faktora VIII vychádza z empirického zistenia, že 1 medzinárodná jednotka (IU) faktora VIII na kg telesnej hmotnosti zvýši aktivitu faktora VIII v plazme o 2 IU/dl. Potrebná dávka sa stanoví použitím nasledovného vzorca:
Dávka (IU) = telesná hmotnosť (kg) x požadovaný vzostup faktora VIII (IU/dl alebo % normálu)
x 0,5 (IU/kg na IU/dl)
Množstvo lieku, ktoré sa má podať, a frekvencia podávania sa majú vždy riadiť podľa klinickej účinnosti v jednotlivých prípadoch.
V prípade nasledovných hemoragických príhod by aktivita faktora VIII nemala v danom období klesnúť pod určenú hladinu plazmatickej aktivity (v % normálu alebo IU/dl). Nasledujúcu tabuľku možno použiť ako návod na dávkovanie pri epizódach krvácania alebo pri chirurgickom zákroku:
Stupeň krvácania/typ
chirurgického zákroku
Kr
v
ácanie
P
ožadovaná hladina
f
aktora VIII (%) (IU/dl)
F
r
ekvencia dávok (hodiny)/
t
rvanie liečby (dni)
Začínajúca hemartróza, krvácanie do svalov alebo ústnej dutiny
Rozsiahlejšie hemartrózy, krvácanie do svalov alebo hematóm
Život ohrozujúce krvácanie
Chirurgický zákrokMenší chirurgický zákrok vrátane extrakcie zuba
20 – 40 Injekciu opakujte každých 12 až
24 hodín. Aspoň 1 deň, kým sa krvácanie indikované bolesťou nezastaví, alebo do zahojenia.
30 – 60 Injekciu opakujte každých 12 až
24 hodín počas 3 – 4 dní alebo dlhšie, kým bolesť a akútna slabosť nevymiznú.
60 – 100 Opakujte injekciu
každých 8 až 24 hodín, až kým
ohrozenie nevymizne.
30 – 60 Injekciu podávajte
každých 24 hodín, najmenej 1 deň
až do zahojenia.
V
eľký
chirurgický zákrok 80 – 100 (pred a
po operácii)
Opakujte injekciu
každých 8 až 24 hodín až do primeraného zahojenia rany, potom pokračujte v liečbe najmenej ďalších
7 dní na udržanie aktivity faktora
VIII na 30 % až 60 % (IU/dl).
Profylaxia
Odporúčaný počiatočný režim dávkovania je 20 až 50 IU/kg AFSTYLY podávanej dvakrát až trikrát týždenne. Dávkovanie sa môže upraviť na základe odpovede pacienta.
Pediatrická populácia
Odporúčaný počiatočný režim dávkovania u detí (vo veku 0 až < 12 rokov) je 30 až 50 IU na kg
AFSTYLY podávanej dvakrát až trikrát týždenne. U detí mladších ako 12 rokov sa môžu požadovať častejšie alebo vyššie dávky zohľadňujúce vyšší klírens v tejto vekovej skupine. Pre dospievajúcich vo veku 12 rokov a starších sú odporúčania dávkovania rovnaké ako pre dospelých.
Starší pacienti
Klinické skúšania AFSTYLY nezahŕňajú pacientov starších ako 65 rokov.